文章信息
基金项目
- 国家自然科学基金青年基金项目(31902348)
作者简介
- 王瑞睿(1996—),女,布依族,硕士,研究方向为虾蟹性别决定与性别分化机制,E-mail:rrww28@163.com.
通讯作者
- 马克异(1985—),男,博士,副研究员,研究方向为虾蟹遗传育种,E-mail:kyma1632022@163.com.
文章历史
- 收稿日期:2023-04-28
2. 上海海洋大学水产动物遗传育种中心上海市协同创新中心,上海 201306;
3. 中国水产科学研究院东海水产研究所,上海 200090
2. Aquatic Animal Genetic Breeding Center, Shanghai Collaborative Innovation Center, Shanghai Ocean University, Shanghai 201306, China;
3. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China
研究意义罗氏沼虾(Macrobrachium rosenbergii)为节肢动物门(Arthropoda)十足目(Decapoda)长臂虾科(Palaemonidae)沼虾属(Macrobrachium)重要的淡水养殖虾类,具有较高的经济价值[1]。罗氏沼虾雄性个体显著大于雌性个体,展现出典型的性别二态性。对其性别调控机制的研究将有利于促进甲壳动物性控机制的解析。同时,对罗氏沼虾的性控育种发展和产业价值的提升也具有深远的影响。前人研究进展在遗传性别决定(Genetic sex determination) 的过程中,性别决定与分化通常由多基因调控。在脊椎动物中发现了一系列参与性别决定与分化的关键基因[2-5]。与之类似,在无脊椎动物中,不同物种间性别决定与分化的调控关键基因也大不相同。例如,果蝇(Drosophila melanogaster) 中关键的性控基因有Sxl和Dsx [6],而线虫中(Caenorhabditis elegans)则是Xol-1和Her-1等基因[7]。目前,在罗氏沼虾中也发现了一些性别决定与分化相关基因[8-9],表明甲壳动物罗氏沼虾也存在类似的基因调控性别决定与分化机制。然而,甲壳动物促雄腺作为雄性个体特有的内分泌器官,也具有影响性别分化的功能。因此,甲壳动物的性别决定与分化机制可能更复杂[10-11]。Dmrt-like [9]和Dsx (Doublesex) [6]等基因均属于一个大基因家族,即Dmrt基因家族,该家族由果蝇Dsx同源基因和线虫Mab-3同源基因组成。作为转录因子,该基因家族的主要特征是其所编码的蛋白质均含有保守且富含半胱氨酸的Doublesex/Mab-3结构域(DM结构域)[12-13]。Dmrt基因家族在鱼类、昆虫类以及甲壳类等动物中均有发现[14-16],而其中Dsx被认为是Dmrt基因家族中作为性别决定级联通路中参与调控性别决定与分化的末端节点基因[17-18]。目前,虾蟹类已有转录因子Dsx的克隆和表达分析的报道[19-23],且中华绒螯蟹(Eriocheir sinensis)的IAG启动子区域存在转录因子Dsx结合的顺式作用元件,表明甲壳动物性别决定与分化相关基因IAG的表达可能受Dsx的调控⑵。本研究切入点目前,对罗氏沼虾性别决定与分化机制的研究,主要集中在IAG和Dmrt-like基因的功能方面,有关罗氏沼虾Dsx (命名为MrDsx)作用机制及调控网络的研究仍未见报道。除DM结构域外,不同物种的Dsx蛋白在其他区域的序列保守性较低。因此,有必要对MrDsx进行单独研究,以探明其是否影响罗氏沼虾IAG的表达从而发挥性别决定与分化的调控作用。大量研究表明,在大肠杆菌中诱导原核重组蛋白表达,是研究蛋白特征及功能的一种重要方法。拟解决的关键问题基于前期获得的罗氏沼虾转录组数据,通过特异性引物进行PCR扩增,克隆获得MrDsx的开放阅读框ORF序列。构建罗氏沼虾MrDsx基因的原核表达载体,为罗氏沼虾MrDsx后续的抗体制备、蛋白质功能研究和互作蛋白的筛选奠定基础,也为进一步研究MrDsx在罗氏沼虾性别决定与分化中的作用机制提供基础数据。
1 材料与方法 1.1 试验材料试验于2021年3—5月在上海海洋大学农业农村部淡水水产种质资源重点实验室进行,试验使用的菌种大肠杆菌DH 5α和BL 21(DE3)为本实验室保存。T4 DNA连接酶和pGEM-T载体购自Promega生物技术有限公司(北京);pET-32a(+)质粒保存于上海海洋大学农业农村部淡水水产种质资源重点实验室;质粒小提试剂盒购自Tiangen生化科技有限公司(北京);蛋白Marker购自南京海利克斯信息技术有限公司;Hind Ⅲ和Xho Ⅰ内切酶购自TaKaRa公司(大连);LB固体、液体培养基、IPTG和X-gal购自Sangon Biotech公司(上海);其他试剂均为国产分析纯。
1.2 试验方法1.2.1 引物设计与合成 通过本实验之前的转录组数据库(未发表)获得了罗氏沼虾MrDsx的ORF序列,利用Primer 3.0在线设计MrDsx的特异性引物组,包括Dsx-F:CCCAAGCTTGGA TGTATGAAGAGGGAGAATACG(下划线为Hind Ⅲ酶切位点,斜体为保护碱基)和Dsx-R:CCGCTCGAGAAGTTGATGTTTCATTGACTTC(下划线为Xho Ⅰ酶切位点,斜体为保护碱基)。
1.2.2 MrDsx原核表达载体的构建 以保存的罗氏沼虾性腺cDNA为模板,利用MrDsx基因特异性引物进行PCR扩增,并进行琼脂糖凝胶电泳检测; 回收PCR产物,连接pGEM-T载体并转化大肠杆菌DH 5α;将扩大培养的阳性克隆提取质粒后,送至上海Sangon Biotech公司测序鉴定。使用Hind Ⅲ和Xho Ⅰ内切酶对鉴定的阳性重组pGEM-T质粒和pET-32a(+)空质粒分别进行双酶切,并经电泳检测。胶回收上述目的基因及线性化载体pET-32a(+),4 ℃连接后转化感受态细胞DH 5α。经测序鉴定后命名为重组质粒pET-32a-MrDsx。
1.2.3 重组质粒pET-32a-MrDsx的原核表达 将提取的重组质粒pET-32a-MrDsx转化大肠杆菌BL 21(DE3)后,涂布于含氨苄青霉素的LB固体培养基上,37 ℃培养过夜。挑取阳性菌落于含有氨苄青霉素的LB液体培养基中扩大培养;之后,按1:200转接到LB液体培养基培养至对数期(OD≈0.7),分别加入不同浓度的IPTG进行诱导,37 ℃诱导6 h。诱导结束后将菌体进行超声破碎,分别收集裂解后的菌体上清液和菌体沉淀。同时,将部分菌体沉淀用8 mol/L尿素进行溶解,之后进行SDS-PAGE电泳和考马斯亮蓝染色,以确定蛋白表达量及纯度。
1.2.4 重组蛋白pET-32a-MrDsx的纯化及Western blot免疫印迹分析 使用蛋白纯化试剂盒(MagneHis™ Protein Purification System,Promega),具体纯化步骤如下:洗涤缓冲液和洗脱缓冲液分别加入8 mol/L尿素,混匀备用;向上述未纯化的粗蛋白溶液中加入500 mmol/L NaCl, 随后加入适量Ni混匀并静置30 min; 放入磁力吸附架使结合了重组蛋白的Ni被吸附在管壁,移除上清;加入洗涤缓冲液充分洗涤Ni,放入磁力吸附架,移除上清液, 重复3次;加入洗脱缓冲液,使洗脱缓冲液与Ni混匀,静置10 min后放入磁力吸附架,收集上清液, 即纯化后的重组蛋白溶液,吸取部分纯化后的蛋白溶液进行SDS-PAGE,检测pET-32a-MrDsx蛋白的纯化结果;将重组蛋白加入到透析袋中进行透析,透析结束后分装到2 mL的收集管中,超低温保存备用。Western blot免疫印迹方法参照之前的研究[24],用以鉴定重组蛋白pET-32a-MrDsx的表达特征。
1.2.5 重组蛋白pET-32a-MrDsx的质谱分析 将纯化后的重组蛋白pET-32a-MrDsx送至上海中科新生命生物科技有限公司,使用QE质谱仪进行质谱分析。利用胰蛋白酶对重组蛋白进行消化,然后使用LCMSMS和MASCOT等质谱相关软件对蛋白数据进行分析。
2 结果与分析 2.1 MrDsx基因PCR扩增结果PCR产物的电泳检测结果显示,在660 bp附近出现单一DNA的特异性条带(图 1)。该DNA条带大小与预期目的基因大小相符。PCR产物连接pGEM-T载体、转化大肠杆菌DH 5α、测序结果(图 2)经比对后与目的序列一致,表明以罗氏沼虾性腺cDNA为模板,已成功获得了罗氏沼虾MrDsx基因的ORF序列(GenBank登录号:OQ993218)。

|
| M:DNA分子量标准;1:MrDsx基因ORF扩增产物 M: DNA molecular weight standard; 1: Amplified product of ORF of MrDsx 图 1 MrDsx基因的PCR扩增 Fig. 1 PCR amplification of MrDsx gene |

|
| 图 2 MrDsx基因的ORF序列 Fig. 2 ORF sequences of MrDsx gene |
2.2 重组质粒pET-32a—MrDsx的双酶切鉴定结果
使用Hind Ⅲ和Xho Ⅰ内切酶双酶切pET-32a-MrDsx阳性重组质粒,经电泳后,可观察到与2.1中PCR鉴定结果一致的DNA条带以及约5 900 bp的载体条带。插入的片段测序比对后证实为罗氏沼虾MrDsx基因的ORF序列,表明重组质粒pET-32a-MrDsx构建正确(图 3)。
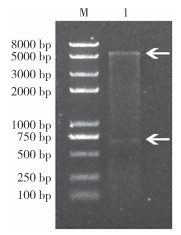
|
| M:DNA分子量标准;1:重组质粒pET-32a-MrDsx经Hind Ⅲ和Xho Ⅰ双酶切 M: DNA molecular weight standard; 1: pET-32a-MrDsx recombinant plasmid digested with Hind Ⅲ and Xho Ⅰ 图 3 重组质粒pET-32a-MrDsx的双酶切鉴定 Fig. 3 Double-enzyme digestion identification of pET-32a-MrDsx recombinant plasmid |
2.3 大肠杆菌的诱导表达效果
分别取超声裂解后的菌体上清和菌体沉淀进行SDS-PAGE,结果(图 4)显示,重组蛋白主要存在于超声裂解后的菌体沉淀中,即重组蛋白是以包涵体的形式存在于大肠杆菌感受态细胞中。而且,只有转化了重组质粒pET-32a-MDsx的大肠杆菌菌株在约55 kD的位置出现蛋白条带,而转化了空载体pET-32a的对照组菌株无此蛋白条带(图 4)。本试验所用的带His标签的pET-32a空载体表达的蛋白大小约为30 kD,预测的罗氏沼虾MrDsx基因编码的蛋白分子量约为25 kD,因此重组后的蛋白分子量大小约为55 kD,与SDS-PAGE实验结果一致,证明pET-32a-MrDsx融合蛋白表达成功。
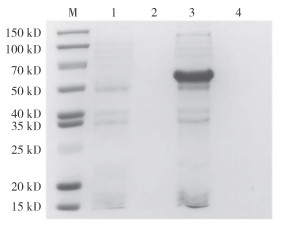
|
| M:蛋白分子标准;1:转化pET-32a的菌株裂解沉淀;2:转化pET-32a的菌株裂解上清液;3:转化pET-32a-MrDsx的菌株裂解沉淀;4:转化pET-32a-MrDsx的菌株裂解上清液 M: Protein molecular weight standard; 1: Lytic precipitate of strain transformed with pET-32a; 2: Lytic supernatant of strain transformed with pET-32a; 3: Lytic precipitate of strain transformed with pET-32a-MrDsx; 4: Lytic supernatant of strain transformed with pET-32a-MrDsx 图 4 pET-32a-MrDsx的原核表达 Fig. 4 Prokaryotic expression of pET-32a-MrDsx |
2.4 IPTG诱导浓度的确定
IPTG诱导6 h后,SDS-PAGE结果显示,在IPTG浓度为0.1~0.5 mmol/L时,重组蛋白pET-32a-MrDsx的表达量可达到峰值(图 5),此范围内的IPTG浓度变化并未显著改变重组蛋白pET-32a-MrDsx的表达量。因此,对于重组蛋白pET-32a-MrDsx而言,IPTG诱导浓度范围可设定为0.1~0.5 mmol/L,最佳诱导浓度为0.1 mmol/L。

|
| M:蛋白分子标准;1~5:IPTG诱导浓度分别为0、0.1、0.2、0.5、1 mmol/L M: Protein molecular weight standard; 1-5: IPTG concentration was 0, 0.1, 0.2, 0.5, 1 mmol/L, respectively 图 5 IPTG浓度对pET-32a-Dsx表达的影响 Fig. 5 Effects of IPTG concentration on pET-32a-Dsx expression |
2.5 重组蛋白pET-32a-MrDsx的纯化及复性效果
对纯化及复性后重组蛋白pET-32a-MrDsx进行SDS-PAGE电泳,结果(图 6A)显示,在蛋白相对分子量约55 kD处出现一条特异性蛋白条带,其大小与预期结果相符。相比蛋白纯化前,纯化后的SDS-PAGE蛋白条带单一,无其他杂质条带,表明重组蛋白pET-32a-MrDsx纯化成功。Western blot结果(图 6B)显示,重组蛋白pET-32a-MrDsx可与鼠抗His-tag单克隆抗体特异性结合,在蛋白相对分子量约55 kD的位置出现单一且清晰的特异性条带,说明纯化复性后获得了可溶性的罗氏沼虾pET-32a-MrDsx重组蛋白。
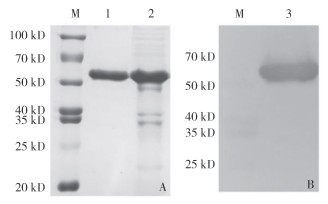
|
|
A: pET-32a-MrDsx蛋白纯化前后SDS-PAGE电泳;B:重组蛋白的Western blotting鉴定; M:蛋白分子标准;1:纯化后的pET-32a-Dsx; 2:纯化前的pET-32a-MrDsx;3:纯化后pET-32a-MrDsx的Western blot鉴定 A: SDS-PAGE electrophoresis before and after purification of pET-32a-MrDsx protein; B: Western blot identification of recombinant protein; M: Protein molecular weight standard; 1: Purified pET-32a-Dsx; 2: pET-32a-MrDsx before purification; 3: Identification of purified pET-32a-MrDsx by Western blot 图 6 重组蛋白pET-32a-MrDsx纯化后的Western blot鉴定 Fig. 6 Identification of purified recombinant protein pET-32a-MrDsx by Western blot |
2.6 重组蛋白pET-32a-MrDsx的质谱分析结果
质谱分析过程将重组蛋白pET-32a-MrDsx打成肽段,通过质谱分析获得重组蛋白pET-32a-MrDsx的部分肽段的质荷比(图 7)。质谱分析显示共有14个肽段与理论的氨基酸序列相符合,匹配度达到100%,并且这些肽段共覆盖理论序列的61.36%,再次证明罗氏沼虾pET-32a-MrDsx重组蛋白原核表达成功。
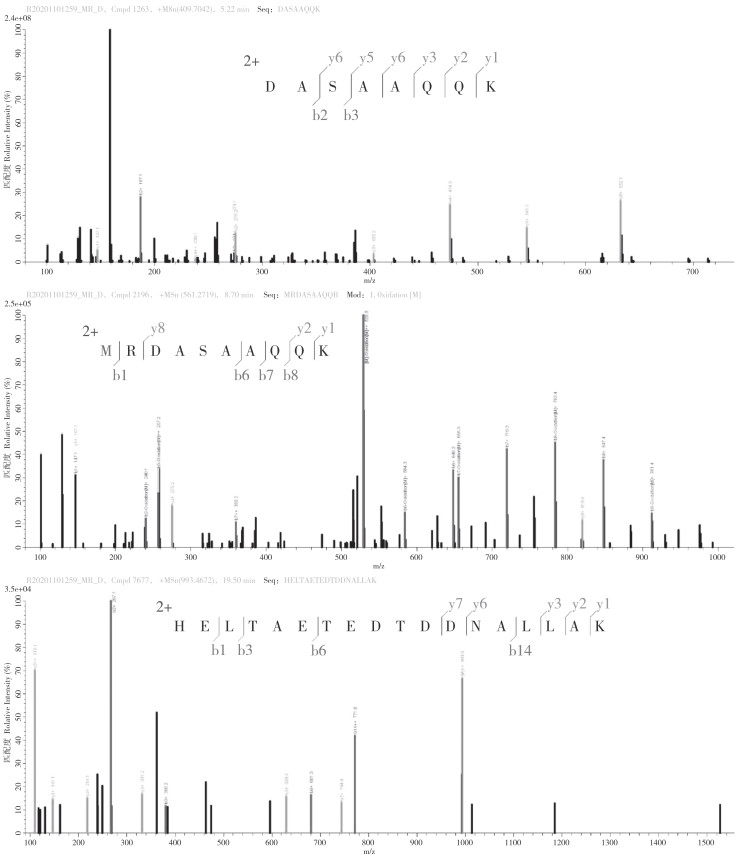
|
| 图 7 质谱分析重组蛋白pET-32a-MrDsx的部分肽段质荷比 Fig. 7 Mass-to-charge ratio of some peptides of recombinant protein pET-32a-MrDsx analyzed by mass spectrometry |
3 讨论
Doublesex(Dsx)是果蝇性别决定级联通路的关键终末转录因子,通过性别特异性选择性剪接调控下游基因的表达,进而调控性别分化方向[6]。在大型水蚤(Daphnia magna)中,Dsx基因在雄性特异性组织中表达,从而调控雄性性状发育[25]。红鳌螯虾(Cherax quadricarinatus)中分离鉴定出的Dsx基因在卵巢发育的早期阶段表现出较高的转录水平,该基因被沉默后可引起红鳌螯虾IAG基因表达上调,表明红鳌螯虾Dsx基因可能参与了其性腺分化过程[22]。类似地,在中国对虾(Fenneropenaeus chinensis)和中华绒螯蟹中也分离出了Dsx基因,敲降该基因后,两者的IAG基因的表达量均显著下降,也表明了Dsx基因可能参与虾蟹类的性别分化过程[20-21]。
本研究将罗氏沼虾MrDsx基因的开放阅读框(ORF)进行了完整克隆,成功构建pET-32a-MrDsx原核表达载体,并表达纯化了该重组蛋白。作为成熟的表达系统,原核生物大肠杆菌是目前用于异源表达重组蛋白的重要手段[26-30]。借助胞质,大肠杆菌表达系统可将外源蛋白以可溶性或非可溶性的形式表达[31]。因此,本研究使用了原核表达中普遍应用的、可被高效诱导表达的大肠杆菌BL21菌株。大量研究表明,原核表达蛋白内部信号肽结构有利于提高蛋白可溶性,一定程度降低原核表达重组蛋白的主要形式——包涵体。罗氏沼虾MrDsx基因所编码的蛋白并不具有信号肽结果。因此,不具有信号肽结构可能是导致罗氏沼虾MrDsx重组蛋白形成包涵体的因素之一。本研究使用高浓度尿素对包涵体进行溶解。该过程降低了蛋白结构柔韧性,增强了蛋白的溶解能力;接着采用Ni柱纯化,去除了杂质菌体蛋白;最后利用透析法去除变性剂,促进蛋白折叠,使重组蛋白复性。研究表明,原核表达的蛋白表达量与IPTG的诱导浓度息息相关。本研究中,在IPTG浓度为0.1~0.5 mmol/L时,重组蛋白表达量达到最大值;诱导浓度大于0.5 mmol/L时,蛋白表达量下降,说明IPTG浓度过高对大肠杆菌的生长存在抑制作用,不利于重组蛋白pET-32a-MrDsx的高效表达。因此,从节约试剂和降低对大肠杆菌生长的影响等方面考虑,诱导重组蛋白pET-32a-MrDsx的最佳IPTG浓度为0.1 mmol/L。因重组蛋白pET-32a-MrDsx可与带His标签的单克隆抗体特异结合,经Western blot检测后,在预测的蛋白分子量大小的位置出现了特征性的单一蛋白条带,进一步的质谱分析也显示该重组蛋白的氨基酸序列与预期相符合,证明该蛋白是罗氏沼虾MrDsx基因的开放阅读框与pET-32a原核表达载体的重组蛋白。His标签在蛋白互作研究中有着广泛的应用。本研究选择His标签,不仅方便了His标签的单抗特异结合,也为未来利用Pull down技术筛选与MrDsx相互作用的重要蛋白提供了实验基础。
4 结论本研究克隆了罗氏沼虾MrDsx基团的ORF序列, 与载体pET-32a (+)连接后,构建了罗氏沼虾MrDsx基因的原核表达载体。结果表明,利用IPTG对阳性转化细胞进行诱导表达,首次获得了相对分子量约为55 kD的罗氏沼虾MrDsx基因的重组蛋白,且在IPTG浓度为0.1~0.5 mmol/L时重组蛋白pET-32a-MrDsx的表达量达到峰值。可溶性分析显示该重组蛋白pET-32a-MrDsx以包涵体为主要表达形式,经高浓度尿素溶解、Ni柱纯化和透析复性后可实现活性pET-32a-MrDsx重组蛋白的大量回收,为该基因后续的蛋白功能研究、互作蛋白的筛选,以及进一步研究MrDsx在罗氏沼虾性别决定与分化中的作用机制奠定了基础。
| [1] |
杨国梁, 陈雪峰, 王军毅, 高强, 潘茜, 张宇飞. 罗氏沼虾产业在中国持续增长的经济与社会原因分析[J]. 浙江海洋学院学报(自然科学版), 2011, 30(5): 450-457. YANG G L, CHEN X F, WANG J Y, GAO Q, PAN Q, ZHANG Y F. Social and economical factors of sustained growth of Macrobrachium rosenbergii industry in mainland China[J]. Journal of Zhejiang Ocean University (Natural Science Edition), 2011, 30(5): 450-457. |
| [2] |
SINCLAIR A H, BERTA P, PALMER M S, HAWKINS J R, GRIFFITHS B L, SMITH M J, FOSTER J W, FRISCHAUF A M, LOVELL-BADGE R, GOODFELLOW P N. A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif[J]. Nature, 1990, 346(6281): 240-244. DOI:10.1038/346240a0 |
| [3] |
SMITH C A, ROESZLER K N, OHNESORG T, CUMMINS D M, FARLIE P G, DORAN T J, SINCLAIR A H. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken[J]. Nature, 2009, 461(7261): 267-271. DOI:10.1038/nature08298 |
| [4] |
YOSHIMOTO S, OKADA E, UMEMOTO H, TAMURA K, UNO Y, NISHIDA-UMEHARA C, MATSUDA Y, TAKAMATSU N, SHIBA T, ITO M. A W-linked DM-domain gene, DM-W, participates in primary ovary development in Xenopus laevis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(7): 2469-2474. DOI:10.1073/pnas.0712244105 |
| [5] |
MATSUDA M, NAGAHAMA Y, SHINOMIYA A, SATO T, MATSUDA C, KOBAYASHI T, MORREY C E, SHIBATA N, ASAKAWA S, SHIMIZU N, HORI H, HAMAGUCHI S, SAKAIZUMI M. DMY is a Y-specific DM-domain gene required for male development in the medaka fish[J]. Nature, 2002, 417(6888): 559-563. DOI:10.1038/nature751 |
| [6] |
BILLETER J C, RIDEOUT E J, DORNAN A J, GOODWIN S F. Control of male sexual behavior in Drosophila by the sex determination pathway[J]. Current Biology, 2006, 16(17): R766-R776. DOI:10.1016/j.cub.2006.08.025 |
| [7] |
HANSEN D, PILGRIM D. Sex and the single worm: sex determination in the nematode C. elegans[J]. Mechanisms of Development, 1999, 83(1-2): 3-15. DOI:10.1016/S0925-4773(99)00024-6 |
| [8] |
VENTURA T, MANOR R, AFLALO E D, WEIL S, ROSEN O, SAGI A. Timing sexual differentiation: full functional sex reversal achieved through silencing of a single insulin-like gene in the prawn, Macrobrachium rosenbergii[J]. Biology of Reproduction, 2012, 86(3): 1-6. DOI:10.1095/biolreprod.111.097261 |
| [9] |
XU H J, CHEN Y L, WANG Y M, LUO J Y, LI J W, SHEN S Q, YANG J S, MA W M. Full functional sex reversal achieved through silencing of MroDmrt11E gene in Macrobrachium rosenbergii: production of all-male monosex freshwater prawn[J]. Frontiers in Endocrinology, 2022, 12: 772498. DOI:10.3389/fendo.2021.772498 |
| [10] |
LIU Z Q, MA K Y, QIU G F. Identification of an insulin-like androgenic gland hormone transcript highly expressed in male precociousness of the Chinese mitten crab Eriocheir sinensis[J]. Aquaculture Research, 2019, 50(1): 304-311. DOI:10.1111/are.13899 |
| [11] |
VENTURA T, MANOR R, AFLALO ED, WEIL S, RAVIV S, GLAZER L, SAGI A. Temporal silencing of an androgenic gland-specific insulin-like gene affecting phenotypical gender differences and spermatogenesis[J]. Endocrinology, 2009, 150(3): 1278-1286. DOI:10.1210/en.2008-0906 |
| [12] |
KOPP A. Dmrt genes in the development and evolution of sexual dimorphism[J]. Trends in Genetics, 2012, 28(4): 175-184. DOI:10.1016/j.tig.2012.02.002 |
| [13] |
RAYMOND C S, KETTLEWELL J R, HIRSCH B, BARDWELL V J, ZARKOWER D. Expression of Dmrt1 in the genital ridge of mouse and chicken embryos suggests a role in vertebrate sexual development[J]. Developmental Biology, 1999, 215(2): 208-220. DOI:10.1006/dbio.1999.9461 |
| [14] |
FREITAS F C D, BUCHHOLZ J, NUNES F M F, CRISTINO A S, SIMOES Z L P. Characterization of sex-specific variants of doublesex and feminizer genes in stingless bee species[J]. Apidologie, 2020, 51(4): 469-480. DOI:10.1007/s13592-020-00735-8 |
| [15] |
ZAFAR I, RATHER M A, DHANDARE B C. Genome-wide identification of doublesex and mab-3-related transcription factor (DMRT) genes in nile tilapia (Oreochromis niloticus)[J]. Biotechnology Reports, 2019, 24: e00398. DOI:10.1016/j.btre.2019.e00398 |
| [16] |
ZHANG E F, QIU G F. A novel Dmrt gene is specifically expressed in the testis of Chinese mitten crab, Eriocheir sinensis[J]. Development Genes and Evolution, 2010, 220(5-6): 151-159. DOI:10.1007/s00427-010-0336-2 |
| [17] |
VIET D N, CHRISTIAENS O, DE VOS S, SMAGGHE G, BOSSIER P. The sex-specific splicing of doublesex in brine shrimp Artemia franciscana[J]. Genes, 2022, 13: 1997. DOI:10.3390/genes13111997 |
| [18] |
MAWARIBUCHI S, ITO Y, ITO M. Independent evolution for sex determination and differentiation in the DMRT family in animals[J]. Biology Open, 2019, 8: bio041962. DOI:10.1242/bio.041962 |
| [19] |
ZHONG P, ZHOU T, ZHANG Y, CHEN Y J, YI J Q, LIN W Y, GUO Z C, XU A X, YANG S P, CHAN S M, WANG W. Potential involvement of a DMRT family member (Mr-Dsx) in the regulation of sexual differentiation and moulting in the giant river prawn Macrobrachium rosenbergii[J]. Aquaculture Research, 2019, 50: 3037-3049. DOI:10.1111/are.14262 |
| [20] |
LI S, LI F, YU K, XIANG J H. Identification and characterization of a doublesex gene which regulates the expression of insulin-like androgenic gland hormone in Fenneropenaeus chinensis[J]. Gene, 2018, 649: 1-7. DOI:10.1016/j.gene.2018.01.043 |
| [21] |
WANG L, LIU Z Q, MA K Y, TAO J R, FANG X, QIU G F. A testis-specific gene doublesex is involved in spermatogenesis and early sex differentiation of the Chinese mitten crab Eriocheir sinensis[J]. Aquaculture, 2023, 569: 739401. DOI:10.1016/j.aquaculture.2023.739401 |
| [22] |
ZHENG J B, CAI L N, JIA Y Y, CHI M L, CHENG S, LIU S L, LI F, GU Z M. Identification and functional analysis of the doublesex gene in the redclaw crayfish, Cherax quadricarinatus[J]. Gene Expression Patterns, 2020, 37: 119129. DOI:10.1016/j.gep.2020.119129 |
| [23] |
WAN H F, ZHONG J Y, ZHANG Z P, SHENG Y Z, WANG Y L. Identification and functional analysis of the doublesex gene in the mud crab Scylla paramamosain[J]. Comparative Biochemistry and Physiology, Part A, 2022, 266: 111150. DOI:10.1016/j.cbpa.2022.111150 |
| [24] |
MA K Y, CHEN J, LIU Z Q, QIU G F. Inhibitory effects of RNAi-mediated knockdown of EsDmrt-like gene on testicular development in the Chinese mitten crab Eriocheir sinensis[J]. Aquaculture, 2016, 463: 217-223. DOI:10.1016/j.aquaculture.2016.06.003 |
| [25] |
KATO Y, KOBAYASHI K, WATANABE H, IGUCHI T. Environmental sex determination in the Branchiopod Crustacean Daphnia magna: Deep conservation of a doublesex gene in the sex-determining pathway[J]. PLoS Genetics, 2011, 7(3): e1001345. DOI:10.1371/journal.pgen.1001345 |
| [26] |
莫超迪, 覃呈欢, 戴龙喜, 韩鹏夫, 纪月鑫, 韦友传. 黄喉拟水龟肺炎克雷伯菌外膜蛋白A的原核表达与纯化[J]. 广东农业科学, 2023, 50(3): 137-143. DOI:10.16768/j.issn.1004-874X.2023.03.016 MO C D, QIN C H, DAI L X, HAN P F, JI Y X, WEI Y C. Prokaryotic expression and purification of OmpA of Klebsiella pneumoniae isolated from Mauremys mutica[J]. Guangdong Agricultural Sciences, 2023, 50(3): 137-143. DOI:10.16768/j.issn.1004-874X.2023.03.016 |
| [27] |
杨萌, 高爽爽, 谢业扬, 段家文, 陆专灵, 韦友传. 卵形鲳鲹JAK3蛋白的原核表达与纯化[J]. 广东农业科学, 2020, 47(1): 137-142. DOI:10.16768/j.issn.1004-874X.2020.01.019 YANG M, GAO S S, XIE Y Y, DUAN J W, LU Z L, WEI Y C. Prokaryotic expression and purification of JAK3 protein in golden pompano (Trachinotus ovatus)[J]. Guangdong Agricultural Sciences, 2020, 47(1): 137-142. DOI:10.16768/j.issn.1004-874X.2020.01.019 |
| [28] |
孙国荣, 马少鸿, 韦光本, 张依琳, 谭慧明, 蔡双虎. 哈维氏弧菌glyA基因的克隆及原核表达分析[J]. 广东农业科学, 2020, 47(6): 84-90. DOI:10.16768/j.issn.1004-874X.2020.06.012 SUN G R, MA S H, WEI G B, ZHANG Y L, TAN H M, CAI S H. Cloning and prokaryotic expression analysis of glyA gene of Vibrio harveyi[J]. Guangdong Agricultural Sciences, 2020, 47(6): 84-90. DOI:10.16768/j.issn.1004-874X.2020.06.012 |
| [29] |
余乃通, 李宾宾, 黎维丽, 杨毅, 刘志昕. 柑桔黄龙病菌亚洲种菌毛形成蛋白基因序列分析、原核表达及抗血清制备[J]. 广东农业科学, 2018, 45(11): 74-80. DOI:10.16768/j.issn.1004-874X.2018.11.012 YU N T, LI B B, LI W L, YANG Y, LIU Z X. Cloning and prokaryotic expression of pilus formation protein gene from Candidatus Liberibacter asiaticus and preparation of its antiserum[J]. Guangdong Agricultural Sciences, 2018, 45(11): 74-80. DOI:10.16768/j.issn.1004-874X.2018.11.012 |
| [30] |
唐伟, 张美, 王小兰. OsMT-1-4c基因原核表达载体的构建、表达及重金属抗性研究[J]. 广东农业科学, 2017, 44(1): 8-14. DOI:10.16768/j.issn.1004-874X.2017.01.002 TANG W, ZHANG M, WANG X L. Vector construction, prokaryotic expression and resistance to heavy metals of OsMT-1-4c[J]. Guangdong Agricultural Sciences, 2017, 44(1): 8-14. DOI:10.16768/j.issn.1004-874X.2017.01.002 |
| [31] |
张永德, 林勇, 冯鹏霏, 陈忠, 杜雪松, 黄姻, 潘传燕, 罗洪林. 尼罗罗非鱼Lck多克隆抗体的制备及鉴定[J]. 南方农业学报, 2018, 49(11): 2304-2310. DOI:10.3969/j.issn.2095-1191.2018.11.27 ZHANG Y D, LIN Y, FENG P F, CHEN Z, DU X S, HUANG Y, PAN C Y, LUO H L. Preparation and identification of Lck polyclonal antibody in Nile tilapia[J]. Journal of Southern Agriculture, 2018, 49(11): 2304-2310. DOI:10.3969/j.issn.2095-1191.2018.11.27 |
(责任编辑 邹移光)
 2023, Vol. 50
2023, Vol. 50




