文章信息
基金项目
- 黔科合平台人才项目(GCC〔2022〕027-1);国家重点研发计划项目(2021YFD1601002-03)
作者简介
- 王锋(1976—),男,硕士,副教授,研究方向为作物栽培,E-mail:wangfeng7620@163.com.
通讯作者
- 胡安龙(1977—),男,博士,教授,研究方向为有害生物绿色治理,E-mail:alhu@gzu.edu.cn.
文章历史
- 收稿日期:2023-07-04
2. 贵州大学农学院,贵州 贵阳 550025;
3. 贵州大学生命科学学院,贵州 贵阳 550025
2. College of Agriculture, Guizhou University, Guiyang 550025, China;
3. College of Life Sciences, Guizhou University, Guiyang 550025, China
【研究意义】黄精(Polygonatum sibiricum)是一种重要的中药材,为多年生百合科黄精属植物,其根茎和幼苗可食用[1]。黄精包含黄精皂苷、烟酸、糖类、醌类、氨基酸和微量元素等多种成分[2],可用于治疗疾病,如抗菌[3]、抗肿瘤和抗病毒。除此之外,黄精含有多种维生素和矿物质,营养价值高,有助于人体健康。随着黄精的需求量越来越大,其人工栽培面积也不断增大,但常年连作,再加上黄精的生产大多采用分根繁殖,使根腐病日趋加重,成为黄精生产最严重的病害之一。【前人研究进展】韩凤等[4]对重庆地区多花黄精根腐病病原菌的分离与鉴定,明确了重庆地区多花黄精根腐病的病原菌主要为尖孢镰刀菌(Fusarium oxysporum)和腐皮镰刀菌(F. solani),粱忠厚等[5]研究表明,湖南多花黄精根腐病病原为Fusarium foetens和Fusarium hostae,但都未对该病害进行防治研究。李静纳等[6]研究了多菌灵可湿性粉剂等5种杀菌剂对多花黄精根腐病的防效,发现5种药剂施用14 d后防治效果大于75%。吉林省黄精根腐病病原主要是腐皮镰刀菌(F. solani)和尖孢镰孢菌(F. oxysporum),针对该地区多花黄精根腐病的防治主要为化学防治[7]。关于用生防菌对多花黄精根腐病进行防治的研究较少。
【本研究切入点】多花黄精根腐病是一种毁灭性病害,严重影响多花黄精的品质和产量[8],该病发生严重时,可造成多花黄精绝收,因此对多花黄精根腐病害的治理已成为保障中草药质量安全的关键。化学防治是防治病害的重要手段,但因其带来的“3R(Residue残留,Resistance抗性,Resurgence再猖獗)”等问题,制约农业可持续发展[9]。因此,寻找作用效果明显、药效好的生物农药已成为当前研究的重点。【拟解决的关键问题】本研究对多花黄精根腐病进行病原菌鉴定,筛选出对病原菌具有较好抑制作用的菌株,利用平板对峙法测定4株生防菌株(WHD01~WHD04)对病原菌的抑制作用,然后对其进行鉴定,并测定4株生防菌株发酵液对病原菌的抑制效果。从而筛选出抑菌作用较好的生防菌株,以期为多花黄精根腐病的生物防治提供依据,开发出具有应用价值的生防菌剂。
1 材料与方法 1.1 试验材料1.1.1 供试病样 2022年夏季,在贵州省台江县采用随机取样法采集多花黄精感病样品,带回贵州大学农学院农产品质量安全实验室,置于4 ℃冰箱保存,并在24 h内对病原菌进行分离。
1.1.2 供试生防菌株 生防真菌(WHD01、WHD02)、生防细菌(WHD03、WHD04),分离自发病区土壤和植物组织。
1.1.3 主要培养基 马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂18 g、去离子水1 000 mL,置于高压灭菌锅121 ℃灭菌20 min,待冷却至室温后取出备用。马铃薯葡萄糖水(PDB)培养基:在PDA培养基配方基础上去掉琼脂,其他操作同PDA培养基。牛肉膏蛋白胨液体培养基: 称取牛肉膏3 g、NaCl 5 g、蛋白胨10 g,加1 000 mL去离子水煮沸,用无菌水定容至1 000 mL,放入压力蒸汽灭菌锅121 ℃高压灭菌20 min,待冷却至室温后取出备用。
1.2 病原菌分离纯化使用组织分离法分离多花黄精感病样品的潜在病原菌,在多花黄精根茎的病健交界处选取1 cm×1 cm的方块,依次将其放入75% 乙醇溶液中浸泡1 min、2% 的次氯酸钠溶液浸泡3 min,无菌水冲洗5次, 用无菌滤纸吸干水分后,置于PDA培养基中,28℃恒温培养。待其长出菌丝后,再挑取菌丝到新的PDA培养基中继续纯化培养,保存备用。
1.3 病原菌致病性测定根据科赫氏法则,将分离菌置于PDA培养基,28 ℃培养4 d,然后用打孔器打取菌饼于50 mL PDB培养基中,28℃、150 r/min振荡培养5 d,用无菌水配制成1×106 CFU/mL的孢子悬浮液。将2年生的多花黄精健康块茎置于上述孢子悬液中浸泡30 min,移入有湿润滤纸和棉花保湿的塑料盒中,以接种无菌水的多花黄精健康块茎为对照,置于28 ℃培养箱培养,每个处理3次重复。接种14 d后观察记录多花黄精发病情况,并在块茎病斑处再次分离纯化病原菌,与原接种的分离菌株进行比较。
1.4 病原菌鉴定1.4.1 形态学鉴定 用5 mm打孔器在分离纯化后的病原菌边缘打孔取样,用接种环挑取菌饼接种于直径为9 cm的PDA平板中心,设3次重复。28 ℃恒温培养4 d后观察其菌落形态、培养基颜色;利用光学显微镜观察菌丝、孢子形态及有无隔膜等情况。
1.4.2 分子鉴定 用Fungal DNA Kit D3390试剂盒(OMEGA生物试剂公司)提取菌株DNA,选用真菌通用引物ITS1和ITS4进行PCR扩增,引物序列为ITS1:5'-TCCGTAGGTGAACCTGCGG-3',ITS4:5'-TCCTCCGCTTATTGATATGC-3'[10],PCR产物送上海生工生物工程股份有限公司进行序列测定。将序列结果在Conting Express软件上拼接,然后上传至NCBI中的GenBank数据库进行比对分析,下载同源性较高的参考序列,使用MEGA7.0.14软件,设置Bootstrap值为1 000,以邻接法构建其系统发育树。
1.5 生防菌的筛选与鉴定1.5.1 生防菌的筛选 将供试病原菌接种于PDA培养基上,在28 ℃恒温培养4 d,用直径8 mm的无菌打孔器在菌落上打出直径一致的菌饼,备用。采用平板对峙法[11-12]对4株生防菌株进行抑菌活性评价。用直径5 mm的打孔器在已培养4 d的病菌菌落边缘打孔取菌饼,并接种在PDA平板中央,再分别接种生防菌株。接种后28 ℃倒置培养5~6 d后,观察4株生防菌的抑菌效果。
生防真菌接种法:将已分离纯化的生防真菌十字对称接种于距离病原菌中央25 mm处,对照仅接种病原菌,每个处理3次重复。
生防细菌接种法:将已分离纯化的生防细菌转移到牛肉膏蛋白胨液体培养基中,28 ℃、160 r/min振荡培养48 h,再将灭菌过的打孔滤纸圆片在菌悬液种浸泡15 min,用镊子将滤纸圆片十字对称接种于距离病原菌中央25 mm处。
利用ImageJ图形处理软件计算各处理和对照的病原菌菌落面积,操作步骤参照罗德义等[13]方法进行,计算抑制率:

|
式中SCK为对照菌落面积,ST为处理菌落面积。
1.5.2 生防菌形态学鉴定 将两株生防真菌在28 ℃恒温培养箱中培养7 d后,先通过肉眼观察培养基上菌落的形态特征,再在显微镜下观察其菌丝和孢子的形态。将两株生防细菌在28℃恒温培养箱中培养3 d后,通过肉眼观察培养基上菌落的形态特征。
1.5.3 生防菌分子生物学鉴定 生防真菌的分子生物学鉴定方法同1.2.4。生防细菌(WHD03、WHD04)采用北京索莱宝科技有限公司(Solarbio)细菌基因组DNA提取试剂盒提取DNA,参照黄婉媛等[14]方法进行,利用细菌通用引物进行PCR扩增。之后将PCR产物送至上海生物工程股份有限公司进行测序,测序成功后将所得测序获得的16S rRNA部分序列经BLAST同源比对后,从GenBank中获取同源性较高的种、属的16S rRNA序列,使用MEGA7软件构建系统发育树。
1.6 生防菌发酵液制备及抑菌能力测定生防真菌发酵液参照贺字典等[15]和王立祥等[16]方法,结合实验室条件,用5 mm打孔器打孔后,挑取3~5个生防真菌的菌饼接种于装有100 mL PDB培养基的250 mL锥形瓶(已灭菌)中,28 ℃、160 r/min摇床振荡培养120 h。生防真菌的发酵液经4 000 r/min离心50 min,收集上清液,用0.22 μm无菌过滤器过滤各生防菌的发酵液,得到无菌发酵液,置于4 ℃冰箱保存备用。
生防细菌发酵液参照安福涛等[17]方法,结合实验室条件,用接种环挑取菌体接种于装有100 mL营养肉汤的250 mL的锥形瓶(已灭菌)中,38 ℃、160 r/min摇床振荡培养120 h,得到生防细菌发酵液,再经4 000 r/min离心60 min,收集上清液,用0.22 μm无菌过滤器过滤各生防菌的发酵液,得到无菌发酵液,置于4 ℃冰箱保存备用。
采用菌丝生长速率法[18],分别取0.5、1、2 mL无菌发酵液与9.5、9、8 mL PDA培养基混匀,倒入无菌培养皿中制成带发酵液的平板,发酵液的浓度分别为50、100、200 mL/L。在含发酵液的平板中央接种尖孢镰刀菌菌饼1个,28℃恒温培养5~6 d后,按照以下公式计算其菌丝生长抑制率,各处理和对照均3次重复。
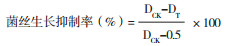
|
式中,DCK为对照菌落直径,DT为处理菌落直径。
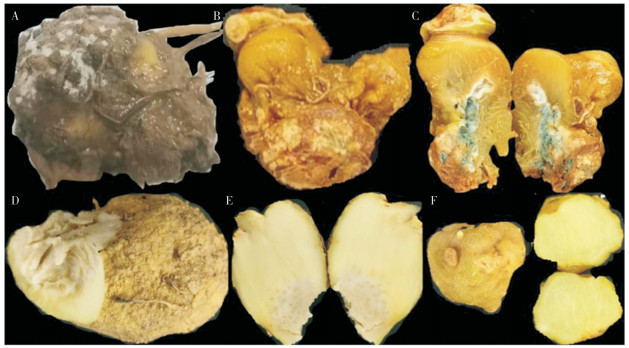
2 结果与分析 2.1 病原菌致病性测定通过组织分离法共分离得到28株分离株,通过科赫氏法则验证,其中12株分离株回接后可导致明显的多花黄精根腐病,表明其为多花黄精根腐病的病原菌,分别命名为2GF1、2GF52、2GF15-1、2GF28-1、2GF11-3、2GF8、2GF24、3GF1、3GF1-2、3GF5-2、3GF5-3、3GF8,对照发生明显病变(图 1)。菌株2GF1导致的根腐病最为严重,从发病组织分离得到相同菌株。
|
| A~C: 田间多花黄精块茎发病症状;D、E:接种分离株后发病症状;F:对照 A~C: Diseased symptoms of P. cyrtonema Hua tubers in the field; D、E: Symptoms of disease after inoculation with isolates; F: Control group (CK) 图 1 多花黄精根腐病田间症状及分离株致病性验证 Fig. 1 Field symptoms of Polygonatum cyrtonema Hua root rot and pathogenicity verification of isolates |
2.2 病原菌的鉴定
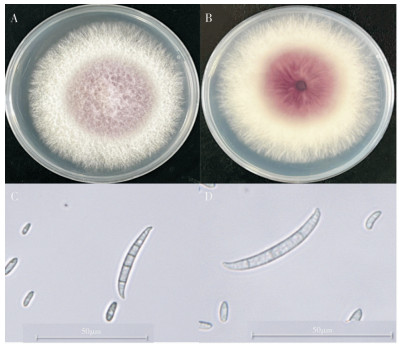
2.2.1 病原菌的形态学鉴定 12株病原菌在28 ℃培养箱中培养6 d后的形态基本一致(图 2),病原菌整个群落呈圆形,边缘为乳白色,中间稍凸起,底部呈淡紫色;菌丝体生长旺盛且不透明。显微观察结果表明,其分生孢子为椭圆型或镰刀形,分生小孢子较多且无分隔,两端钝圆;大孢子具有3~4个分隔,两端梭形,根据形态学特征,将12株病原菌初步鉴定为镰刀菌。
|
| A、B:菌落的正、反面;C、D:孢子形态 A, B: Front and back of the fungal colony; C, D: Spore morphology 图 2 病原菌形态学特征 Fig. 2 Morphological traits of the pathogens |
2.2.2 病原菌的分子生物学鉴定 以通用引物ITS对12株病原菌的DNA进行PCR扩增,扩增产物送至上海生工进行测序,在NCBI BLAST对测序结果进行比对,发现12株病原菌的ITS序列与菌株MNFo15(登录号:OP456684)、菌株FOFB62(登录号:HQ651161)、菌株B2(登录号:MZ060273)在序列上相似性为100%。系统发育树(图 3)显示,12株病原菌与尖孢镰刀菌(Fusarium oxysporum)(HQ905450、KX463005)等菌聚为一支,同源性为94%。因此,根据12株菌株的形态学特征以及分子生物学鉴定结果,将贵州多花黄精根腐病病原菌鉴定为尖孢镰刀菌。

|
| 图 3 基于ITS序列构建的系统发育树 Fig. 3 Phylogenetic tree constructed based on ITS sequences |
2.3 生防菌对尖孢镰刀菌的生防效果
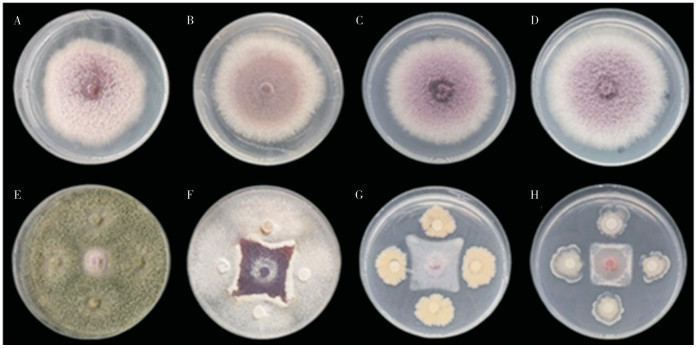
为获得对尖孢镰刀菌具有抑制活性的生防菌株,采用平板对峙法进行初步筛选。结果(图 4)表明,4株生防菌株对尖孢镰刀菌均有较好抑制作用,生防效果良好。其中,菌株WHD01的抑菌效果最好、抑菌率为95.21%;菌株WHD04次之、抑菌率为78.99%;菌株WHD3的抑菌率为77.96%;菌株WHD2的抑菌效果最差,但抑菌率也达67.95%。
|
| A~D:生防菌WHD01~WHD04的对照;E~H:生防菌WHD01~WHD04 A~D: Control group of biocontrol bacterias WHD01~WHD04; E~H: Biocontrol bacterias WHD01~WHD04 图 4 4株生防菌与尖孢镰刀菌的平板对峙试验结果 Fig. 4 Results of dual-culture tests between 4 biocontrol bacterias and Fusarium oxysporum |
2.4 生防菌的鉴定
2.4.1 形态学鉴定 纯化的生防真菌WHD01在PDA培养基上的菌落呈圆形,培养5 d后,菌落长满平板,前期有少量的白色气生菌丝,后期气生菌丝逐渐长满平板,质地絮状,产生大量淡绿色分生孢子,形成分生孢子堆,分生孢子堆围绕中心菌饼成空心圆状,菌落逐渐转变为淡黄色。显微镜下观察,菌丝光滑有分枝、具隔膜、无色纤维状、侧枝末端产生分生孢子梗、具2~3轮生分枝、单生或对生、簇生状排列。分生孢子外壁光滑,为亚球形或卵圆形(图 5)。
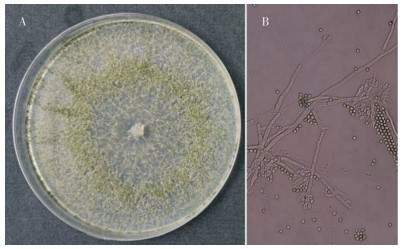
|
| 图 5 菌株WHD01菌落(A)、菌丝和分生孢子(B)的形态特征 Fig. 5 Morphological traits of colony (A), mycelium and conidial spores (B) of strain WHD01 |
纯化的生防真菌WHD02在PDA培养基上的菌落呈圆形。该真菌生长较慢,在PDA培养基上培养10 d后,菌落长满平板,菌丝较薄,在平板上平伏贴生,围绕中心菌饼呈同心圆轮纹、疏松棉絮网状,后期产生大量白色孢子,靠近中心菌饼的圆纹的菌落产淡黄色素。显微镜下观察,菌丝多分枝、光滑、较厚、有隔膜。具有担子和担孢子,担子呈棍棒状,担孢子则呈椭圆状,壁薄光滑(图 6)。
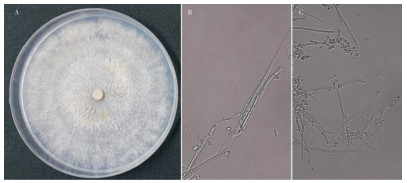
|
| 图 6 菌株WHD02菌落(A)、菌丝(B)和担孢子(C)的形态特征 Fig. 6 Morphological traits of colony (A), mycelium (B) and sporidium (C) of strain WHD02 |
菌株WHD03在PDA培养基划线培养结果如图 7A所示,其菌落呈浅黄色或者乳白色,菌落边缘不规则,表面不湿润、无光泽且不透明。菌株WHD04在PDA培养基划线培养结果如图 7B所示,其菌落呈乳白色,菌落边缘不整齐,呈椭圆形,且表面干燥、不光滑呈褶皱状。
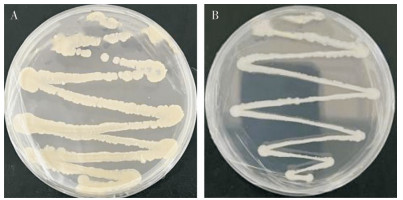
|
| 图 7 菌株WHD03(A)和WHD04(B)的菌落 Fig. 7 Colonies of strain WHD03 (A) and WHD04 (B) |
2.4.2 分子生物学鉴定 以菌株WHD01的基因组DNA为模板,用ITS引物扩增出一条长度约为594 bp的序列,将所得DNA序列在NCBI进行BLAST比对发现,该序列与绿木霉菌Trichoderma virens X2-70的同源性高达100%。对系统发育树(图 8)进行分析发现,菌株WHD01与T. virens聚于同一分支,同源性为73%,结合形态学鉴定结果,初步鉴定菌株WHD01为绿木霉菌。
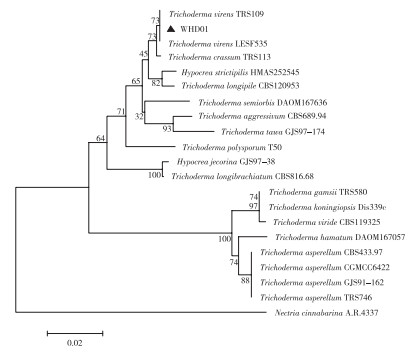
|
| 图 8 生防菌株WHD01的ITS基因序列系统发育树 Fig. 8 Phylogenetic tree of biocontrol bacteria WHD01 based on ITS sequences |
以菌株WHD02的基因组DNA为模板, 用ITS引物扩增出一条长度约为612 bp的序列,将所得DNA序列在NCBI官网进行BLAST比对,该序列与大伏革菌Phlebiopsis gigantea VA-APP_ VA的同源性高达100%。对系统发育树(图 9)进行分析发现,菌株WHD02与P. gigantea聚于同一分支,同源性为99%,结合形态学鉴定结果,初步鉴定菌株WHD02为大伏革菌。
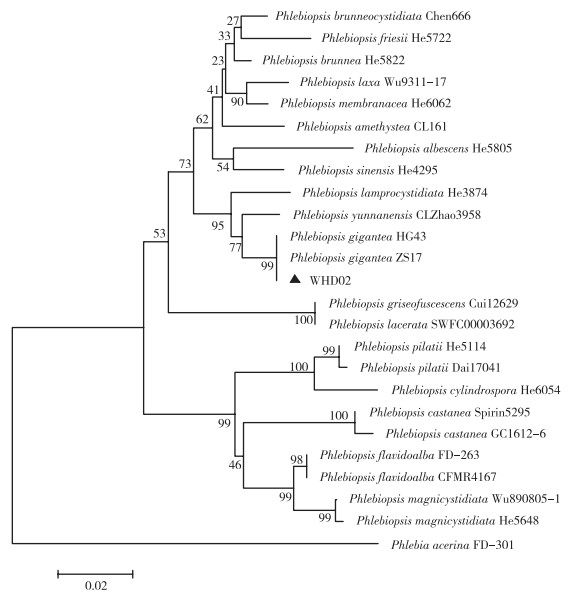
|
| 图 9 生防菌株WHD02的ITS基因序列系统发育树 Fig. 9 Phylogenetic tree of biocontrol bacteria WHD02 based on ITS sequences |
以菌株WHD03的基因组DNA为模板,用16S rRNA引物扩增出一条长度约为1 457 bp的序列,将所得DNA序列在NCBI官网进行BLAST比对,该序列与Bacillus amyloliquefaciens PP19的同源性高达99%。对系统发育树(图 10)进行分析,菌株WHD03与B. amyloliquefaciens聚于同一分支,同源性为90%,将菌株WHD03鉴定为解淀粉芽孢杆菌(B. amyloliquefaciens)。

|
| 图 10 生防菌株WHD03的16S rRNA基因序列系统发育树 Fig. 10 Phylogenetic tree of biocontrol bacteria WHD03 based on 16S rRNA sequences |
以菌株WHD04的基因组DNA为模板, 用16S rRNA引物扩增出一条长度约为1 460 bp的序列,将所得DNA序列在NCBI官网上进行BLAST比对,该序列与Bacillus velezensis A28的同源性高达99%。对系统发育树(图 11)进行分析发现,菌株WHD04与B. velezensis聚于同一分支,同源性为72%,初步将菌株WHD04鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。

|
| 图 11 生防菌株WHD04的16S rRNA基因序列系统发育树 Fig. 11 Phylogenetic tree of biocontrol bacteria WHD04 based on 16S rRNA sequences |
2.5 生防菌株发酵液的抑菌效果
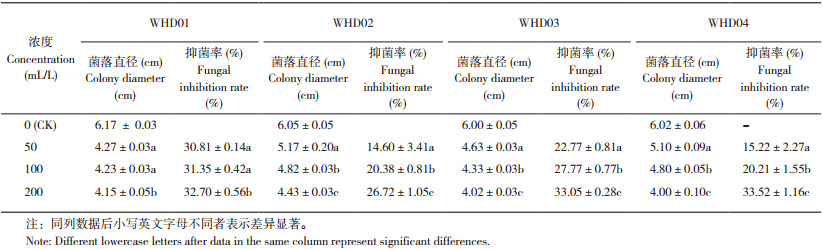
通过平板对峙法筛选出对尖孢镰刀菌具有生防作用的菌株共4株,采用菌丝生长速率法对4株生防菌的发酵液的抑菌活性进行测定。如图 12所示,4株生防菌株不同浓度的无菌发酵液对尖孢镰刀菌均有不同程度的抑制作用,尖孢镰刀菌在4种含无菌发酵液的平板上均被不同程度地抑制,但发酵液的抑菌效果却与平板对峙的结果差异显著,其抑菌效果与生防菌发酵液的浓度呈正相关。如表 1所示,当生防菌株WHD01(T. virens)、WHD02(P. gigantea)、WHD03(B. amyloliquefaciens)、WHD04(B. velezensis)无菌发酵液制成的平板发酵液浓度为50 mL/L时,对尖孢镰刀菌的抑制率分别为30.81%、14.60%、22.77%、15.22%;当平板发酵液浓度为100 mL/L时,抑制率分别为31.35%、20.38%、27.77%、20.21%;当平板发酵液浓度为200 mL/L时,抑制率分别为32.70%、26.72%、33.05%、33.52%。其中,解淀粉芽孢杆菌无菌发酵液对尖孢镰刀菌的最高抑制率为33.05%。总的来说,T. virens菌株3个浓度发酵液的抑菌能力高于其他生防菌株,(均高于30%),但差异不显著,可能与浓度梯度有关,平板对峙试验结果表明绿木霉菌具有一定的生防潜力。P. gigantea菌株3个浓度发酵液的抑菌能力最差,均低于30%。

|
| 图 12 4株生防菌株不同浓度的发酵液对尖孢镰刀菌菌丝生长的抑制效果 Fig. 12 Inhibition effects of different concentrations of fermentation broth from four biocontrol bacterias on mycelial growth of Fusarium oxysporum |
|
3 讨论
粱忠厚等[5]对湖南多花黄精根腐病病原进行分离鉴定,确定F. foetens和F. hostae是引起湖南多花黄精根腐病的致病菌。韩凤等[4]为明确重庆地区多花黄精根腐病的病原菌,对渝产多花黄精根腐病病原菌进行分离与鉴定,确定尖孢镰刀菌和腐皮镰刀菌是引起多花黄精根腐病的病原菌。本研究发现,从贵州省台江县采集的多花黄精根腐病上分离得到的12株病原菌均为尖孢镰刀菌,表明尖孢镰刀菌为贵州台江多花黄精根腐病的主要病原,不同地区多花黄精根腐病的病原有所差异,可能是由于地理差异造成的。
本研究筛选出4株能显著抑制多花黄精根腐病的生防菌,即绿木霉(Trichoderma virens)、大伏革菌(Phlebiopsis gigantea)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和贝莱斯芽孢杆菌(Bacillus velezensis)。这4种菌株分离于多花黄精及多花黄精种植的根际土壤,无致病性,同时还能抑制多花黄精根腐病病原菌的生长。木霉菌、木霉菌发酵液和挥发性物质均可有效抑制病原菌的生长,如棘孢木霉代谢液对16种真菌病原菌的生长抑制率达56.65%~87.62%,对小麦全蚀病菌病原菌抑制明显[19]。李春霞等[20]研究表明,哈茨木霉菌对甜瓜枯萎病病原菌具有明显的抑制作用,对病原菌菌丝生长抑制率最高可达77.18%,其挥发性物质抑制率最高为18.73%,发酵液对病原菌的抑制率最高为22.79%。短密木霉发酵液能在24 h内完全抑制香蕉枯萎病病原菌孢子的萌发[21]。芽孢杆菌属对多种造成植物病害的病原真菌具有较好的生防作用,因此常被作为生防制剂进行研究。陈爽[22]发现贝莱斯芽孢杆菌(Bacillus velezensis)对大豆根腐病病原菌尖孢镰刀菌的抑菌率可达64.6%,可以提高大豆株高、鲜质量、干质量、茎粗及叶绿素含量,具有较明显的促生作用。枯草芽孢杆菌(Bacillus subtilis)发酵液对紫花苜蓿根腐病病原菌的抑制率为44.9%~77.4%[23]。李超楠等[24]研究表明,枯草芽孢杆菌和贝莱斯芽孢杆菌对北苍术根腐病具有防治作用。本研究筛选出的4株多花黄精根腐病的生防菌具有较好的抑制作用,可为多花黄精根腐病的生物防治提供理论基础。多花黄精作为台江县的中药材,本研究明确了该地区多花黄精根腐病的致病菌为尖孢镰刀菌(Fusarium oxysporum),并筛选出对该病原菌有效的生防菌,可为构建安全有效的生物防治技术体系、规范中药材种植技术提供一定的理论依据。
4 结论本研究从多花黄精根腐病病株上分离得到12株多花黄精根腐病病原菌,并鉴定其均为尖孢镰刀菌(Fusarium oxysporum)。通过平板对峙试验对4株生防菌株(WHD01~WHD04)的抑菌能力进行评价,并通过系统发育树分析鉴定其分别为绿木霉、大伏革菌、解淀粉芽孢杆菌和贝莱斯芽孢杆菌。4株生防菌对尖孢镰刀菌的抑制效果分别为95.21%、67.95%、77.96% 和78.99%,其中WHD01的抑菌作用最强。当菌株发酵液浓度为200 mL/L时,4株生防菌株对尖孢镰刀菌抑制率分别为32.70%、26.72%、33.05%、33.52%。4株生防菌株对尖孢镰刀菌有良好的抑制作用,具有一定的生防潜力,可为下一步开发生防菌剂奠定基础。
| [1] |
王硕. 黄精的研究现状[J]. 农业科技通讯, 2020, 577(1): 46-47. WANG S. Research status of Polygonatum[J]. Agricultural Science and Technology Communications, 2020, 577(1): 46-47. |
| [2] |
中国科学院植物研究所. 中国植物志(第15卷)[M]. 北京: 科学出版社, 1978. Institute of Botany, Chinese Academy of Sciences. Flora of China (volume 15)[M]. Beijing: Science Press, 1978. |
| [3] |
庞欢瑛, 黄芝凤, 黄洋, 黄郁葱, 鲁义善, 简纪常. 五味子和黄精对副溶血弧菌及其生物膜的体外抑制作用[J]. 广东农业科学, 2016, 43(9): 119-123. DOI:10.16768/j.issn.1004-874X.2016.09.018 PANG H Y, HUANG Z F, HUANG Y, HUANG Y C, LU Y S, JIAN J C. The in vitro inhibitory effect of Schisandra and Polygonatum on Vibrio parahaemolyticus and its biofilm[J]. Guangdong Agricultural Sciences, 2016, 43(9): 119-123. DOI:10.16768/j.issn.1004-874X.2016.09.018 |
| [4] |
韩凤, 李巧玲, 韩如刚, 章文伟, 余中莲, 林茂祥, 杨娟. 渝产多花黄精根腐病病原菌的分离与鉴定[J]. 分子植物育种, 2020, 18(11): 3693-3698. DOI:10.13271/j.mpb.018.003693 HAN F, LI Q L, HAN R G, ZHANG W W, YU Z L, LIN M X, YANG J. Isolation and identification of pathogenic bacteria of Polygonatum polyfl ora root rot in Chongqing[J]. Molecular Plant Breeding, 2020, 18(11): 3693-3698. DOI:10.13271/j.mpb.018.003693 |
| [5] |
梁忠厚, 李静纳. 湖南多花黄精根腐病病原菌的分离与鉴定[J]. 南方农业学报, 2021, 52(7): 1923-1930. DOI:10.3969/j.issn.2095-1191.2021.07.022 LIANG Z H, LI J N. Isolation and identification of pathogenic bacteria of Rhizoma Polygonatum root rot in Hunan[J]. Journal of Southern Agriculture, 2021, 52(7): 1923-1930. DOI:10.3969/j.issn.2095-1191.2021.07.022 |
| [6] |
李静纳, 梁忠厚. 5种杀菌剂对多花黄精根腐病的室内毒力和田间药效[J]. 经济林研究, 2022, 40(1): 241-248. DOI:10.14067/j.cnki.1003-8981.2022.01.026 LI J N, LIANG Z H. Indoor toxicity and field efficacy of five fungicides against Rhizoma Polygonatum root rot[J]. Economic Forest Research, 2022, 40(1): 241-248. DOI:10.14067/j.cnki.1003-8981.2022.01.026 |
| [7] |
冯时, 耿庆茹, 高宇, 杨丽娜, 宫赫阳, 高洁, 卢宝慧. 吉林省黄精根腐病病原学研究及高效低毒配方筛选[J/OL]. 吉林农业大学学报, 2023(7): 1-7. DOI: 10.13327/j.jjlau.2021.1739. FENG S, GENG Q R, GAO Y, YANG L N, GONG H Y, GAO J, LU B H. Research on the etiology of Polygonatum root rot in Jilin Province and screening of high-efficiency and low-toxic formula[J/OL]. Journal of Jilin Agricultural University, 2023(7): 1-7. DOI: 10.13327/j.jjlau.2021.1739. |
| [8] |
李剑. 辣椒根腐病综合防治技术要点[J]. 现代农村科技, 2022(11): 36-37. LI J. Key points of comprehensive control technology for pepper root rot[J]. Modern Rural Science and Technology, 2022(11): 36-37. |
| [9] |
陈忠男, 王志刚, 徐伟慧. 生防菌在农业中的应用及其机制研究进展[J]. 高师理科学刊, 2022, 42(6): 89-94, 110. CHEN Z N, WANG Z G, XU W H. The application and mechanism research progress of biocontrol bacteria in agriculture[J]. Normal University Science Journal, 2022, 42(6): 89-94, 110. |
| [10] |
何凌冰, 吴惠萍, 游春平, 陈炳旭, 韩正洲, 徐冰, 兰金旭, 邢建永. 岗梅枝枯病病原鉴定[J]. 广东农业科学, 2017, 44(1): 111-114, 3. DOI:10.16768/j.issn.1004-874X.2017.01.017 HE L B, WU H P, YOU C P, CHEN B X, HAN Z Z, XU B, LAN J X, XING J Y. Pathogen identification of Gangmei branch blight[J]. Guangdong Agricultural Sciences, 2017, 44(1): 111-114, 3. DOI:10.16768/j.issn.1004-874X.2017.01.017 |
| [11] |
陈红彩, 游杏, 丁当, 赵春, 游春平. 白掌根腐病生防菌的筛选与鉴定[J]. 广东农业科学, 2016, 43(1): 89-92. DOI:10.16768/j.issn.1004-874X.2016.01.017 CHEN H C, YOU X, DING D, ZHAO C, YOU C P. Screening and identification of biocontrol bacteria for root rot of Alpinia offi cinalis[J]. Guangdong Agricultural Sciences, 2016, 43(1): 89-92. DOI:10.16768/j.issn.1004-874X.2016.01.017 |
| [12] |
谢宗华, 高健, 王金宇, 彭喜旭, 唐新科, 王海华. 一株水稻纹枯菌拮抗细菌的分离与鉴定[J]. 微生物学通报, 2012, 39(4): 477-485. XIE Z H, GAO J, WANG J Y, PENG X X, TANG X K, WANG H H. Isolation and identification of an antagonistic bacterium against Rhizoctonia solani[J]. Microbiology Bulletin, 2012, 39(4): 477-485. |
| [13] |
罗德义, 陈春旭, 赵敬钊, 余波, 田茂会. 基于ImageJ软件计算植物病情指数的方法探讨[J]. 农村经济与科技, 2022, 33(23): 65-68. LUO D Y, CHEN C X, ZHAO J Z, YU B, TIAN M H. Discussion on the method of calculating plant disease index based on ImageJ software[J]. Rural Economy and Technology, 2022, 33(23): 65-68. |
| [14] |
黄婉媛, 李彩斌, 彭宇, 李章海, 黄衍章, 丁婷. 烟草根黑腐病拮抗菌的分离鉴定和生防作用特性研究[J]. 浙江农业学报, 2023, 35(4): 873-883. DOI:10.3969/j.issn.1004-1524.2023.04.14 HUANG W Y, LI C B, PENG Y, LI Z H, HUANG Y Z, DING T. Isolation and identification of antagonistic bacteria against tobacco root black rot and their biocontrol properties[J]. Acta Agriculturae zhejiangensis, 2023, 35(4): 873-883. DOI:10.3969/j.issn.1004-1524.2023.04.14 |
| [15] |
贺字典, 吉志新, 高玉峰, 胡铁锋, 武会清. 灰色关联分析筛选抗逆生防木霉发酵条件的研究[J]. 西北农业学报, 2015, 24(3): 163-169. DOI:10.7606/j.issn.1004-1389.2015.03.025 HE Z D, JI Z X, GAO Y F, HU T F, WU H Q. Gray correlation analysis to screen the fermentation conditions for resistance to stress and antiTrichoderma[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2015, 24(3): 163-169. DOI:10.7606/j.issn.1004-1389.2015.03.025 |
| [16] |
王立祥, 崔树鹏, 孔露露, 王萱, 杨宗基, 任利利, 骆有庆. 内生真菌对新渡户树蜂共生真菌的抑制作用[J]. 林业科学, 2022, 58(5): 113-120. WANG L X, CUI S P, KONG L L, WANG X, YANG Z J, REN L L, LUO Y Q. Inhibitory effect of endophytic fungi on symbiotic fungi of the hornets of Nitohu[J]. Forestry Science, 2022, 58(5): 113-120. |
| [17] |
安福涛, 刘欣宇, 孙富余. 3种芽孢杆菌在番茄生产过程中的应用效果研究[J]. 山西农业大学学报(自然科学版), 2023, 43(1): 82-88. DOI:10.13842/j.cnki.issn1671-8151.202211019 AN F T, LIU X Y, SUN F Y. Study on the application effect of three species of Bacillus in tomato production[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2023, 43(1): 82-88. DOI:10.13842/j.cnki.issn1671-8151.202211019 |
| [18] |
王群利, 师宝君, 卞小莹, 姬志勤. 土壤拮抗放线菌的分离及其抗菌活性筛选[J]. 植物保护, 2008(3): 41-46. DOI:10.3969/j.issn.0529-1542.2008.03.010 WANG Q L, SHI B J, BIAN X Y, JI Z Q. Isolation of soil antagonistic actinomycetes and screening of their antibacterial activity[J]. Plant Protection, 2008(3): 41-46. DOI:10.3969/j.issn.0529-1542.2008.03.010 |
| [19] |
郑柯斌, 林海, 周沙, 袁静, 陈杰. 海洋生境棘孢木霉TCS007菌株的鉴定及抑菌活性[J]. 农药学学报, 2020, 22(5): 801-807. DOI:10.16801/j.issn.1008-7303.2020.0075 ZHENG K B, LIN H, ZHOU S, YUAN J, CHEN J. Identification and antibacterial activity of Trichoderma aculeatus TCS007 strain in marine habitat[J]. Journal of Pesticide Science, 2020, 22(5): 801-807. DOI:10.16801/j.issn.1008-7303.2020.0075 |
| [20] |
李春霞, 聂佳慧, 张飞龙, 柳传志, 王治浩, 靳亚忠. 哈茨木霉对甜瓜枯萎病病原菌的生防效果[J]. 黑龙江农业科学, 2023(3): 50-55. DOI:10.11942/j.issn10002-2767.2023.03.0050 LI C X, NIE J H, ZHANG F L, LIU C Z, WANG Z H, JIN Y Z. Biocontrol effect of Trichoderma harzianum on the pathogen of melon wilt[J]. Heilongjiang Agricultural Sciences, 2023(3): 50-55. DOI:10.11942/j.issn10002-2767.2023.03.0050 |
| [21] |
姚遐俊, 谢津, 祁艳华, 汪斌, 房文霞, 陶刚, 蒋细良. 一株防治香蕉枯萎病的短密木霉筛选及代谢物木霉素作用评价[J]. 生物工程学报, 2023(6): 1-22. DOI:10.13345/j.cjb.230170 YAO X J, XIE J, QI Y H, WANG B, FANG W X, TAO G, JIANG X L. Screening of Trichoderma brevis for controlling banana wilt and evaluation of metabolite Trichoderma[J]. Bioengineering Journal, 2023(6): 1-22. DOI:10.13345/j.cjb.230170 |
| [22] |
陈爽. 大豆根腐病生防菌的筛选鉴定及机制研究[D]. 哈尔滨: 哈尔滨师范大学, 2021. CHEN S. Screening, identification and mechanism research on biocontrol bacteria of soybean root rot[D]. Haerbin: Harbin Normal University, 2021. |
| [23] |
刘博, 蒲乐莹, 陶科, 金洪, 候太平. 紫花苜蓿根腐病生防菌的筛选、鉴定及发酵条件优化[J]. 南方农业学报, 2022, 53(8): 2142-2152. DOI:10.3969/j.issn.2095-1191.2022.08.007 LIU B, PU L Y, TAO K, JIN T P, HOU T P. Screening, identification and optimization of fermentation conditions for biocontrol of alfalfa root rot[J]. Journal of Southern Agriculture, 2022, 53(8): 2142-2152. DOI:10.3969/j.issn.2095-1191.2022.08.007 |
| [24] |
李超楠, 李洪涛, 李运朝, 李俊花, 及华, 章丽, 王琳. 北苍术根腐病病原菌分离鉴定及其生防菌筛选[J]. 农业环境科学学报, 2022, 41(12): 2824-2830. LI C N, LI H T, LI Y C, LI J H, JI H, ZHANG L, WANG L. Isolation and identification of pathogenic bacteria of Atractylodes atractylodes root rot and screening of biocontrol bacteria[J]. Journal of Agricultural Environmental Science, 2022, 41(12): 2824-2830. |
(责任编辑 陈丽娥)
 2023, Vol. 50
2023, Vol. 50




