文章信息
基金项目
- 广东省科技专项资金(“大专项+ 任务清单”)项目(花卉优质高效繁育技术服务团队);湛江市农业科学研究院博士工作站项目(非洲菊种质资源收集与创新利用);广东省农业科学院协同创新中心项目(XT202212);广东省农业科学院学科团队建设项目(202128TD)
作者简介
- 刘小飞,博士,助理研究员,广东省农业科学院环境园艺研究所科研人员,主要从事园艺植物发育调控机理及品种选育研究。近5年主持和参与广东省自然科学基金、广东省重点领域研发计划项目子课题等项目15项。以第一或通信作者在国内外期刊发表学术论文20篇,参编专著1部;获广东省农业技术推广奖二等奖1项(第5);育成白掌新品种4个、鸡冠花新品种1个;授权专利2件;参与制定广东省地方标准2部;现为朱顶红专家委员会委员。刘小飞(1984—),男,博士,助理研究员,研究方向为花卉分子育种,E-mail:liuxiaofei6996@126.com; 冯恩友,硕士,正高级农艺师,湛江市农业科学研究院蔬菜所所长,主要从事园艺作物栽培育种研究与推广。承担省、市级科技项目20余项,发表论文30余篇;获省、市级奖励10余项;授权专利14件。担任广东省设施园艺产业技术创新联盟理事会理事、广东省农村科技特派员,湛江市政府决策咨询专家,广东省12316三农信息服务平台、广东省科技厅、湛江市科技局、湛江市农业农村局专家库专家,平安产险理赔、农险专家。多次参与湛江市农作物、种子纯度、药害等突发性事件应急处理工作;台风灾害后,协助农业部门和保险公司做好政策性农作物保险测产定损工作.
通讯作者
- 冯恩友(1983—),男,硕士,高级农艺师,研究方向为园艺作物栽培技术及育种,E-mail:enyou2008@163.com.
文章历史
- 收稿日期:2023-07-31
2. 湛江市农业科学研究院 / 广东省农业科学院湛江分院,广东 湛江 524003;
3. 云南大学生命科学学院,云南 昆明 650500;
4. 广东省农业科学院蔬菜研究所 / 广东省蔬菜新技术研究重点实验室,广东 广州 510640;
5. 广东省农业科学院农业资源与环境研究所,广东 广州 510640
2. Zhanjiang Academy of Agricultural Sciences / Zhanjiang Branch of Guangdong Academy of Agricultural Sciences, Zhanjiang 524003, China;
3. School of Life Sciences, Yunnan University, Kunming 650500, China;
4. Vegetable Research Institute, Guangdong Academy of Agricultural Sciences / Guangdong Key Laboratory for New Technology Research of Vegetables, Guangzhou 510640, China;
5. Institute of Agricultural Resources and Environment, Guang dong Academy of Agricultural Sciences, Guangzhou 510640, China
【研究意义】非洲菊(Gerbera hybrida)是菊科扶郎花属多年生常绿草本植物,别名扶郎花、舞娘花、灯盏花[1],原产于南非,在温度适宜的条件下可周年开花,具有很高的观赏价值,是世界十大切花之一[2-3],园艺品种繁多,商品名称易混淆,不利于种质资源的收集与鉴评。因此,开发适用于非洲菊种质资源鉴评的分子标记,可实现对非洲菊种质资源的快速鉴评,为非洲菊新品种选育奠定基础。【前人研究进展】目前,在三色堇[4]、桂花[5]、牡丹[6]、山茶[7]和三角梅[8]等花卉中均已开发出相应的SSR标记,但有关非洲菊SSR标记开发的报道尚较少[9-10]。林发壮等[9]对非洲菊‘云南红’转录组序列的SSR位点进行挖掘,发现其SSR位点丰富,分布密度大,具有较高的多态性潜能,可作为开发SSR标记的有效来源。在菊属种质资源遗传多样性研究中,SSR分子标记技术应用广泛。肖雨沙等[11]对南美蟛蜞菊转录组测序得到的23 338个SSR位点设计引物,随机选择200对引物进行扩增实验验证,有效扩增55对,其中6对引物特异性高,重复性好。宋江琴等[12]基于表型性状和SSR标记的9份万寿菊种质遗传多样性分析发现9个材料具有较高的遗传多样性,且两种聚类结果总体上较为一致。丁红旭[13]对菊花全长转录组测序结果开发的SSR标记进行综合研究,发现这些标记在菊花全长转录组5 ' UTR区扩增多态性最高,且部分SSR与对应性状相关联,菊花插穗再生植株和组培苗中SSR标记的多态性受5- 氮杂胞苷(5-Azacytidine,5-azaC)或甲基磺酸乙酯(Ethyl methane sulfonate,EMS)处理影响。Yuan等[14]基于SSR标记多态性对中国菊花品种进行鉴定和分类,为菊花种质资源鉴评奠定了良好基础。【本研究切入点】目前非洲菊SSR标记的开发和应用尚不多见,有关SSR标记在非洲菊种质资源鉴评和杂交后代快速鉴定中的应用研究仍较少。【拟解决的关键问题】综上,本研究采用18对SSR标记对12份非洲菊种质进行亲缘关系分析,构建其指纹图谱,并对部分品种的杂交后代的真假杂种进行鉴定,筛选出可用于非洲菊分子育种的SSR荧光标记引物,以期为非洲菊种质资源鉴评及创新利用提供参考。
1 材料与方法 1.1 试验材料2021年12月25日,于湛江市农业科学研究院从云南宽霆生物科技有限公司购买11份非洲菊种质(表 1)的种苗,7 d后移栽至直径5 cm的黑色种植袋,放于大棚苗床上培养,培养温度为25~30 ℃,45 d后移栽至广东省农业科学院环境园艺研究所上盆培养;同时从华南师范大学引种‘深圳5号’(第12份种质),培养温度同上。2022年2月14日,取2月苗龄的非洲菊幼嫩叶片为材料,-80℃保存备用。受检的杂交后代以紫水晶(Gerbera hybrida‘Zishuijing’)为母本,以粉佳人(Gerbera hybrida‘Fenjiaren’)为父本,获得杂交F1代2个单株(Gh-1和Gh-4);以粉佳人为母本,以紫水晶为父本,获得杂交F1代1个单株(Gh-5),2023年7月13日,取播种后6月苗龄杂交苗幼嫩叶片为材料,-80 ℃保存备用。
试验用试剂:Taq Plus DNA聚合酶(B600090,生工生物工程股份有限公司),POP-7TM Polymer 〔4363785,ThermoFisher(Applied BiosystemsTM)〕,HiDiFormamide〔4311320,ThermoFisher(Applied BiosystemsTM)〕;其他常用试剂均由生工生物工程股份有限公司提供。
主要仪器:PCR仪(VeritiTM 96well,美国ABI),凝胶成像仪(FR-980A,上海复日科技有限公司),测序仪(3730XL,美国ABI),台式高速离心机(TD5A-WS,湖南湘仪实验仪器开发有限公司),电泳仪(DYY-6C,北京六一仪器厂),电泳槽(DYCP-32B,北京六一仪器厂),UV-Vis Spectrophotometer(SMA4000,Merinton)。
1.2 DNA提取使用Ezup柱式植物组织基因组DNA抽屉试剂盒(生工生物工程股份有限公司,B518261),参考刘小飞等[15]方法进行提取,提取DNA后电泳检测DNA质量,并保存于-20 ℃备用。
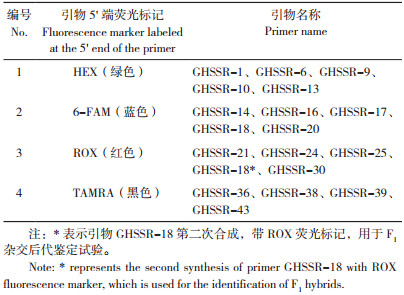
1.3 引物合成从非洲菊‘香槟’(Gerbera hybrida ‘Champagne’)转录组(SRA accession:PRJNA378315)测序得到的SSR标记中随机挑选出2碱基和3碱基重复类型的SSR标记,设计引物(表 2),初筛后,选择条带清晰且多态性好的引物合成带M13标记(正向引物,序列为:5 ' - TGTAAAACGACGGCCAGT-3')的荧光引物,荧光标记6-FAM(蓝色)、HEX(绿色)、TAMRA(黑色)和ROX(红色)均由生工生物工程(上海)股份有限公司合成。
1.4 PCR反应体系及程序
PCR反应体系:10×Taq Buffer(含Mg2+)2.5 μL,20~50 ng/μL模板DNA 1 μL,10 μmol/L正向引物0.5 μL,10 μmol/L反向引物0.5 μL,10 μmol/L dNTP(mix)0.5 μL,5 U/μL Taq酶0.2 μL,以ddH 2O补足25 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,2~4个循环;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,30个循环;72 ℃ 10 min。
1.5 毛细管电泳检测SSR标记荧光引物的多态性参考白松等[16]方法,使用ABI测序仪(3730 xl)对扩增结果进行检测。
1.6 数据分析使用Genemapper软件分析SSR数据,使用Excel进行常规分析。指纹图谱编码方法参见文献[17],UPGMA聚类分析方法参见文献[18]。
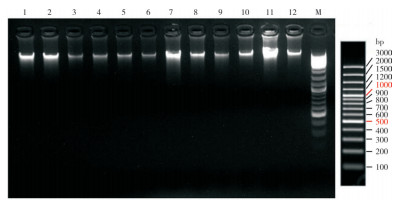
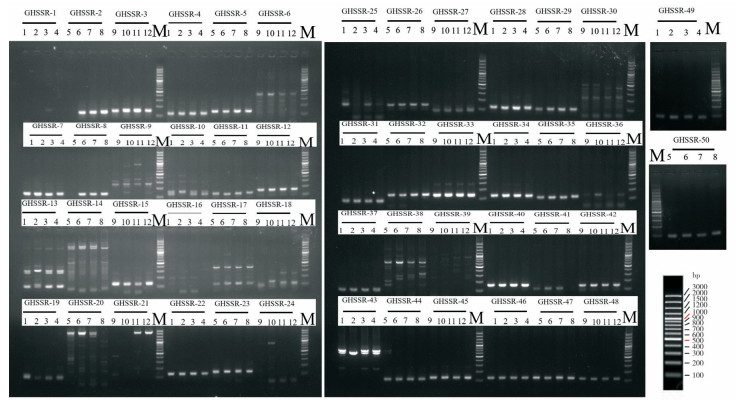
2 结果与分析 2.1 SSR引物筛选结果提取12份非洲菊种质的基因组DNA(图 1)后,基于非洲菊‘香槟’转录组中筛选出50对SSR标记(表 2),以每对引物PCR扩增4个样品进行初筛。电泳结果(图 2)显示,GHSSR-1/6/9/10/13/14/16/17/18/20/21/24/25/30/36/38/39/43共计18对引物的扩增条带清晰,多态性较好,合成带M13标记(正向引物)的荧光引物(表 3)用于后续试验。
|
| 1~12:品种编号,M:DNA marker 1-12: Variety number. M: DNA marker 图 1 12份非洲菊种质基因组DNA提取电泳检测结果 Fig. 1 Genomic DNA extraction and electrophoresis detection results of 12 varieties of Gerbera hybrida |
|
| GHSSR-1~50:引物名称,1~12:品种编号,M:DNA marker GHSSR-1-50: Primer name, 1-12: Variety No., M: DNA marker 图 2 基于50个SSR标记设计引物的PCR扩增电泳结果 Fig. 2 Result of PCR amplification electrophoresis based on 50 SSR markers designed primers |
|
2.2 18对引物在12份非洲菊种质扩增后的毛细管电泳结果
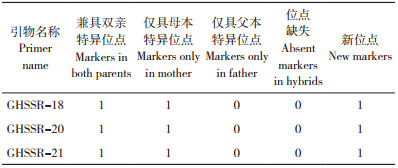
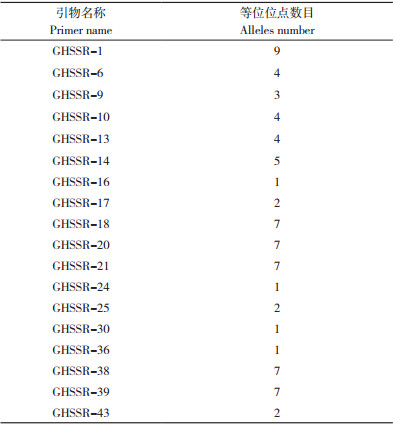
使用Genemapper软件分析毛细管电泳结果发现,18对引物共扩增出74个等位位点,平均每对引物扩增4.1个(表 4)。其中,GHSSR-1、GHSSR-18、GHSSR-20和GHSSR-21多态性较好,分别扩增出9、7、7和7个等位位点,这4对引物分别带有HEX(绿色)、6-FAM(蓝色)、6-FAM(蓝色)和ROX(红色)标记,SSR标记类型均分别为AG(2*8)、TCT(3*5)、CA(2*6)和GT(2*6)。综上,该4个SSR标记设计的引物可作为核心引物用于指纹图谱构建。
|
2.3 12份非洲菊种质指纹图谱构建
将4对核心引物(GHSSR-1、GHSSR-18、GHSSR-20和GHSSR-21)在12个非洲菊品种中扩增的等位位点进行串联排列,得出对应的指纹图谱编码。结果表明,12个非洲菊品种的编码均不相同,可有效对不同非洲菊品种进行区分(表 5)。
2.4 12份非洲菊种质聚类分析
依据18对引物在12份非洲菊种质中的毛细管电泳结果进行UPGMA聚类,结果显示,在遗传系数为0.75时,可将12个非洲菊品种分为5组:Ⅰ组包含3个品种,分别是‘云南红’‘大088’和‘情人’;Ⅱ组包含4个品种,分别是‘粉佳人’‘粉球’‘真爱’和‘福娃’;Ⅲ组包含3个品种,分别是‘绣色’‘淑女’和‘黄球’;Ⅳ组包含1个品种‘紫水晶’;Ⅴ组包含1个品种‘深圳5号’(图 3)。

|
| 图 3 12份非洲菊种质UPGMA聚类分析 Fig. 3 UPGMA cluster analysis of 12 varieties of Gerbera hybrida |
2.5 部分非洲菊品种真假杂种鉴定
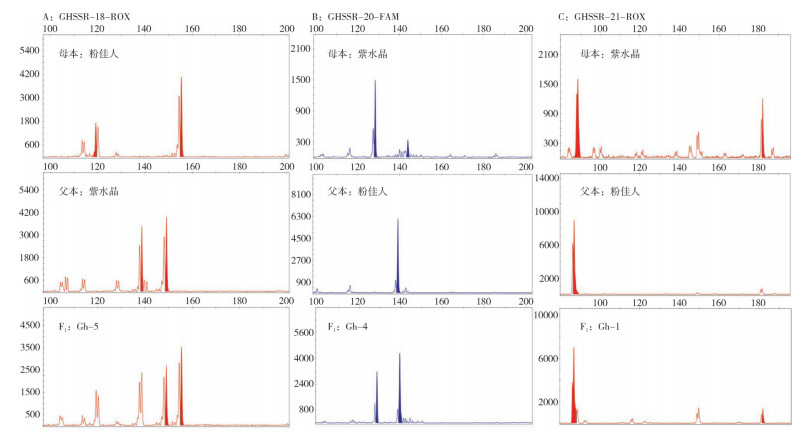
使用GHSSR-18、GHSSR-20和GHSSR-21 3对引物对‘紫水晶’和‘粉佳人’的杂交F1后代进行PCR扩增,毛细管电泳检测结果显示,上述3对引物鉴定出兼具双亲特异位点的单株分别是Gh-5、Gh-4和Gh-1(表 6、图 4),单独1对引物的鉴定率为33%。综合3对引物的鉴定结果,发现受检的3个单株均为真杂种,真杂种率为100%。
|
| 图 4 株杂交F1实生苗的扩增图谱 Fig. 4 Amplification maps of three hybrid F1 seedings |
3 讨论
非洲菊具有较高的观赏价值,在盆栽方面亦有很大的发展潜力,但在我国难以获得种子,常规杂交育种时间长[19],急需可缩短育种周期的技术体系。同时,从市场上收集的品种因无法有效了解其来源,为育种带来较大困扰。SSR分子标记以其稳定、高效及多态性好的优点成为种质资源鉴评的重要手段[20-21]。王继华等[10]对来源于Plant genome Network的非洲菊EST序列SSR进行系统分析,发现SSR重复单元中,富含A/T核苷酸的重复单元占据优势地位,而富含G /C的重复单元在基因编码区中含量较低。冗余与非冗余的SSR分布频率与密度相似,仅存在较小距差,说明可从现有的EST数据中筛选出有效的微卫星标记。林发壮等[9]对非洲菊‘云南红’转录组序列的SSR位点进行挖掘,发现14 928个SSR位点由73种重复基序构成,(A/T)、(AG/CT、AC/GT)、(AAT/ ATT、AAG/CTT) 分别是单核苷酸、二核苷酸和三核苷酸优势重复基元,分别占总SSR重复类型的62. 31%、18.13% 和6. 93%。类似地,本研究所选用的50对引物(表 2)的SSR重复单元中,富含A/T核苷酸的重复单元也高于富含G/C的重复单元。
非洲菊已有的SSR分子标记研究中,多集中在SSR位点信息[9]、SSR频率和分布特点分析[10]等方面,在资源鉴评与创新利用方面的研究较少。本研究利用18对扩增效果稳定的SSR引物检测了12份非洲菊种质,结果显示可以将其分为5组,其中,‘紫水晶’和‘深圳5号’单独为一23组,与‘粉佳人’亲缘关系较远,后续的杂交育种中将首先选用亲缘关系较远且观赏性状优良的‘紫水晶’和‘粉佳人’开展试验,也将选择‘紫水晶’和‘深圳5号’为亲本开展不同的杂交组合,探索不同品种间的杂交亲和性及结实情况。同时,以GHSSR-1、GHSSR-18、GHSSR-20和GHSSR-21 4对引物为核心,成功构建12份非洲菊种质的指纹图谱,为非洲菊种质资源鉴评提供了可靠的SSR荧光标记引物。在此基础上,利用GHSSR-18、GHSSR-20和GHSSR-21 3对引物对‘粉佳人’和‘紫水晶’的3个杂交F1后代进行真假杂种鉴定,综合得出3个杂交F1后代实生苗均为真杂种,初步建立了非洲菊杂交后代快速鉴定技术,为缩短非洲菊育种周期奠定基础。
4 结论本研究从云南宽霆生物科技有限公司和华南师范大学生命科学学院共收集了12份非洲菊种质,通过预实验筛选出18对多态性较好的引物,合成带M13接头的荧光引物。利用其检测12份非洲菊材料,经毛细管电泳检测获得对应的多态性结果,聚类分析将其分为5组。同时,借助GHSSR-1、GHSSR-18、GHSSR-20和GHSSR-21等4对核心引物构建了12个非洲菊品种的指纹图谱。利用后3对引物对‘粉佳人’和‘紫水晶’的杂交F1后代进行真假杂种检测,综合3对引物的结果判断3个单株均为真杂种。本研究为非洲菊种质资源鉴评和创新利用提供了可靠的SSR荧光标记引物,同时,也为非洲菊杂交后代的快速鉴定提供了可用的技术体系。
| [1] |
钟春梅, 王小菁. 非洲菊花色形成调控研究进展[J]. 园艺学报, 2021, 48(10): 2031-2043. DOI:10.16420/j.issn.0513-353x.2021-0477 ZHONG C M, WANG X J. Advance in research on regulation of flower pigmentation in Gerbera hybrida[J]. Acta Horticulturae Sinica, 2021, 48(10): 2031-2043. DOI:10.16420/j.issn.0513-353x.2021-0477 |
| [2] |
彭建宗, 李安, 黄志刚, 陈兆平, 文方德, 王小菁. 非洲菊耐热变异株系的筛选和田间鉴定[J]. 中国农业科学, 2010, 43(2): 380-387. DOI:10.3864/j.issn.0578-1752.2010.02.019 PENG J Z, LI A, HUANG Z G, CHEN Z P, WEN F D, WANG X J. Screening for heat-tolerant variants and field identification of Gerbera hybrida[J]. Scientia Agricultura Sinica, 2010, 43(2): 380-387. DOI:10.3864/j.issn.0578-1752.2010.02.019 |
| [3] |
TEERI T H, ELOMAA P, KOTILAINEN M, ALBERT V A. Mining plant diversity: Gerbera as a model system for plant developmental and biosynthetic research[J]. Bioessays News & Reviews in Molecular Cellular & Development Biology, 2006, 28(7): 756-767. DOI:10.1002/bies.20439 |
| [4] |
杜晓华, 杨雅萍, 朱小佩, 牛杨莉, 刘会超. 三色堇转录组SSR分析及分子标记开发[J]. 园艺学报, 2019, 46(4): 797-806. DOI:10.16420/j.issn.0513-353x.2018-0411 DU X H, YANG Y P, ZHU X P, NIU Y L, LIU H C. Development of genic-SSR markers by transcriptome sequencing in Viola × Wittrockiana[J]. Acta Horticulturae Sinica, 2019, 46(4): 797-806. DOI:10.16420/j.issn.0513-353x.2018-0411 |
| [5] |
孙陶泽, 母洪娜, 王良桂, 李火根. 桂花(Osmanthus fragrans) 转录组SSR特征分析[J]. 分子植物育种, 2019, 17(7): 2258-2263. DOI:10.13271/j.mpb.017.002258 SUN S Z, MU H N, WANG L G, LI H G. Characteristics analysis of SSR in the transcriptome of Osmanthus fragrans[J]. Molecular Plant Breeding, 2019, 17(7): 2258-2263. DOI:10.13271/j.mpb.017.002258 |
| [6] |
贺丹, 吴芳芳, 张佼蕊, 谢栋博, 李小康, 刘艺平, 栗燕, 何松林. 牡丹转录组SSR信息分析及其分子标记开发[J]. 江苏农业学报, 2019, 35(6): 1428-1433. DOI:10.3969/j.issn.1000-4440.2019.06.023 HE D, WU F F, ZHANG J R, XIE D B, LI X K, LIU Y P, SU Y, HE S L. Analysis of SSR information in transcriptome and development of molecular markers in Paeonia suffruticosa[J]. Jiangsu journal of Agricultural Sciences, 2019, 35(6): 1428-1433. DOI:10.3969/j.issn.1000-4440.2019.06.023 |
| [7] |
潘丽芹, 李纪元, 李绍翠, 范正琪, 殷恒福, 何丽波. 基于山茶转录组的SSR标记开发及亲缘关系分析[J]. 北京林业大学学报, 2019, 41(7): 111-120. DOI:10.13332/j.1000-1522.20190101 PAN L Q, LI J Y, LI S C, FAN Z Q, YIN H F, HE L B. Development of SSR markers based on transcriptome of Camellia japonica and analysis of genetic relationship[J]. Journal of Beijing Forestry University, 2019, 41(7): 111-120. DOI:10.13332/j.1000-1522.20190101 |
| [8] |
赵彤, 常圣鑫, 冷青云, 徐世松, 尹俊梅, 牛俊海. 基于三角梅转录组测序的SSR分子标记的开发[J]. 分子植物育种, 2019, 17(13): 4331-4341. DOI:10.13271/j.mpb.017.004331 ZHAO T, CHANG S X, LENG Q Y, XU S S, YIN J M, NIU J H. Development of SSR molecular markers based on transcriptome sequencing of Bougainvillea[J]. Molecular Plant Breeding, 2019, 17(13): 4331-4341. DOI:10.13271/j.mpb.017.004331 |
| [9] |
林发壮, 李锦烨, 安慧珍, 黄琦, 姚凤琴, 钟琳珊, 陈昌铭, 郭芸玮. 基于非洲菊转录组测序的SSR位点信息分析[J]. 福建农业科技, 2020(11): 1-6. DOI:10.13651/j.cnki.fjnykj.2020.11.001 LIN F Z, LI J Y, AN H Z, HUANG Q, YAO F Q, ZHONG L S, CHEN C M, GUO Y W. Analysis on SSR loci information in the transcriptome sequencing of Gerbera jamesonii L.[J]. Fujian Agricultural Science and Technology, 2020(11): 1-6. DOI:10.13651/j.cnki.fjnykj.2020.11.001 |
| [10] |
王继华, 瞿素萍, 唐开学, 李成云, 陈海如. 非洲菊ESTs-SSR标记的频率和分布特点[J]. 园艺学报, 2006(5): 1140. DOI:10.16420/j.issn.0513-353x.2006.05.051 WANG J H, QU S P, TANG K X, LI C Y, CHEN H R. Analysis of the frequency and distribution of microsa telllites in ESTs of Gerbera hybrida (Asteraceae)[J]. Acta Horticulturae Sinica, 2006(5): 1140. DOI:10.16420/j.issn.0513-353x.2006.05.051 |
| [11] |
肖雨沙, 陈秀清, 李红春, 王凯俐, 宋莉英. 基于南美蟛蜞菊转录组测序的SSR分子标记开发及鉴定[J]. 分子植物育种, 2021, 19(7): 2293-2299. DOI:10.13271/j.mpb.019.002293 XIAO Y S, CHEN X Q, LI H C, WANG K L, SONG L Y. Development and identification of SSR molecular markers based on transcriptome sequencing of Wedelia trilobata[J]. Molecular Plant Breeding, 2021, 19(7): 2293-2299. DOI:10.13271/j.mpb.019.002293 |
| [12] |
宋江琴, 唐楠, 唐道城, 丁圆圆, 马洪强. 基于表型性状和SSR标记的9份万寿菊种质遗传多样性分析[J]. 种子, 2021, 40(10): 6-11, 19. DOI:10.16590/j.cnki.1001-4705.2021.10.006 SONG J Q, TANG N, TANG D C, DING Y Y, MA H Q. Genetic diversity analysis of 9 marigold germplasms based on phenotypic traits and SSR markers[J]. Seed, 2021, 40(10): 6-11, 19. DOI:10.16590/j.cnki.1001-4705.2021.10.006 |
| [13] |
丁红旭. 基于全长转录组序列的菊花SSR标记开发与应用[D]. 郑州: 河南大学, 2020. DOI: 10.27114/d.cnki.ghnau.2020.002004. DING H X. Development and application of SSR markers in Chrysanthemum based on full-length transcriptome sequence [D]. Zhengzhou: Henan University, 2020. DOI: 10.27114/d.cnki.ghnau.2020.002004. |
| [14] |
ZHANG Y, DAI S, HONG Y, SONG X. Application of genomic SSR locus polymorphisms on the identification and classification of Chrysanthemum cultivars in China[J]. PLoS ONE, 9(8): e104856. DOI:10.1371/journal.pone.0104856 |
| [15] |
刘小飞, 孙映波, 黄丽丽, 于波. 白掌SSR引物筛选及12份种质资源亲缘关系分析[J]. 分子植物育种, 2022, 20(20): 6802-6810. DOI:10.13271/j.mpb.020.006802 LIU X F, SUN Y B, HUANG L L, YU B. Screening of SSR primer of Spathiphyllum and analysis of genetic relationship of 12 germplasm resources[J]. Molecular Plant Breeding, 2022, 20(20): 6802-6810. DOI:10.13271/j.mpb.020.006802 |
| [16] |
白松, 吴斌. 中国CBAVD患者CFTR基因内含子10-11 (TAAA)n短串联重复序列检测及意义[J]. 中国男科学杂志, 2019, 33(6): 8-13. BAI S, WU B. The detection and significance of cystic fibrosis transmembrane conductance regulator gene IVS10-11(TAAA)n STR in Chinese congenital bilateral absence of the vas deferens[J]. Chinese Journal of Andrology, 2019, 33(6): 8-13. |
| [17] |
刘新龙, 马丽, 陈学宽, 应雄美, 蔡青, 刘家勇, 吴才文. 云南甘蔗自育品种DNA指纹身份证构建[J]. 作物学报, 2010, 36(2): 202-210. DOI:10.3724/SP.J.1006.2010.00202 LIU X L, MA L, CHEN X K, YING X M, CAI Q, LIU J Y, WU C W. Establishment of DNA fingerprint ID in sugarcane cultivars in Yunnan[J]. Acta Agronomica Sinica, 2010, 36(2): 202-210. DOI:10.3724/SP.J.1006.2010.00202 |
| [18] |
刘小飞, 廖飞雄, 李冬梅, 刘晓荣. 基于SRAP标记的白鹤芋属资源鉴定与亲缘关系分析[J]. 广东农业科学, 2017, 44(11): 26-31. DOI:10.16768/j.issn.1004-874X.2017.11.005 LIU X F, LIAO F X, LI D M, LIU X R. Genetic relationship analysis and cultivar identification of Spathiphyllum using SRAP marke[J]. Guangdong Agricultural Sciences, 2017, 44(11): 26-31. DOI:10.16768/j.issn.1004-874X.2017.11.005 |
| [19] |
刘巧媛, 王小菁, 廖飞雄, 张孟锦, 王碧青. 卫星搭载后非洲菊种子的萌发和离体培养研究初报[J]. 中国农学通报, 2006(2): 281-284. DOI:10.3969/j.issn.1000-6850.2006.02.075 LIU Q Y, WANG X J, LIAO F X, ZHANG M J, WANG B Q. Effects of spaceflight treatment on seeds germination and culture of Gerbera jamesonii in vitro[J]. Chinese Agricultural Science Bulletin, 2006(2): 281-284. DOI:10.3969/j.issn.1000-6850.2006.02.075 |
| [20] |
李清, 罗永坚, 吴柔贤, 贾俊婷, 张文虎, 宋松泉, 刘军. 广东省大豆种质资源遗传多样性分析及DNA分子身份证构建[J]. 广东农业科学, 2020, 47(12): 221-228. DOI:10.16768/j.issn.1004-874X.2020.12.023 |
| [21] |
李桂花, 陈汉才, 张艳, 黎庭耀. 小白菜种质遗传多样性与亲缘关系的SRAP和SSR分析[J]. 广东农业科学, 2017, 44(5): 37-45. DOI:10.16768/j.issn.1004-874X.2017.05.007 LI G H, CHEN H C, ZHANG Y, LI T Y. Genetic diversity andphylogenetic relationships analysis of Chinese cabbage germplasm resources by SRAP and SSR[J]. Guangdong Agricultural Sciences, 2017, 44(5): 37-45. DOI:10.16768/j.issn.1004-874X.2017.05.007 |
(责任编辑 马春敏)
 2023, Vol. 50
2023, Vol. 50