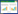文章信息
基金项目
- 海南省自然科学基金(321MS077);国家重点研发计划项目(2019YFD1000900);中央级公益性科研院所基本科研业务专项(1630042022004,1630062023017);国家荔枝龙眼产业技术体系专项(CARS-32-20)
作者简介
- 钱义容(2000—),女,在读本科生,研究方向为果树生物学,E-mail:204870970@qq.com; 李伟才,研究员,中国热带农业科学院南亚热带作物研究所荔枝龙眼研究中心主任及国家荔枝龙眼产业技术体系湛江综合试验站站长,主要从事荔枝龙眼栽培生理及种质资源研究。参与或主持科技部成果转化、农业农村部跨越计划、国家现代农业产业技术体系专项、农业农村部南亚热作专项、农业农村部教育部荔枝农科教人才培养基地、国家重点研发计划和广东省重点研发计划等荔枝科研项目(平台)20多项。入选广东省“扬帆计划”培养高层次人才项目(2017)。以第一或通信作者在《果树学报》等期刊发表学术论文30多篇,其中SCI期刊收录5篇。获海南省科技进步三等奖1项,神农中华农业科技一等奖1项,广东省科技进步一等奖1项,广东省农业技术推广奖一等奖2项、二等奖1项。以第一完成人获授权国家发明专利2件; 董晨,硕士,副研究员,中国热带农业科学院南亚热带作物研究所科研人员,主要从事荔枝资源收集与评价、荔枝生理生化分子生物学研究。主持海南省自然科学基金、中央科研院所基本业务费专项等项目,参与国家荔枝龙眼产业技术体系专项、国家自然科学基金、国家重点研发计划项目、国家公益性行业科技项目、广东省自然科学基金、广东省重点研发计划等项目多个。近年来在《Plant Science》《Frontiers in Plant Science》 《BMC Plant Biology》等期刊发表学术论文多篇.
通讯作者
- 李伟才(1975—),男,研究员,研究方向为荔枝栽培生理研究,E-mail:lwc-619@163.com; 董晨(1981—),女,硕士,副研究员,研究方向为果树生物学,E-mail:nysdongchen@sina.com.
文章历史
- 收稿日期:2023-05-29
2. 云南农业大学热带作物学院,云南 普洱 665099
2. School of Tropical Crops, Yunnan Agricultural University, Puer 665099, China
【研究意义】铝激活苹果酸转运蛋白(Alactivated malate transporter,ALMT)是植物中重要的一类膜蛋白,在植物有机酸的跨膜转运中起着重要作用,如参与苹果酸积累和转运、重金属胁迫、矿质营养、渗透势和pH值调节、果实品质形成、气孔运动、种子发育等过程[1-4]。【前人研究进展】在植物的生长过程中,酸性土壤中的铝离子(Al3+)会对植物根部造成毒害,ALMT作为阴离子通道能够释放苹果酸盐有机阴离子并以此为螯合剂,与Al3+形成稳定无毒的复合物,从而降低其毒性[5]。最早Sasaki等[6]在耐铝小麦(ET8)根尖中分离得到铝诱导表达的一个ALMT1基因(TaALMT1),是植物中克隆获得的第一个铝激活苹果酸转运基因。ALMT蛋白大多定位于细胞质膜、液泡膜等细胞器上,N端和C端均位于膜的外侧,其N端通常包含5~7个跨膜结构域,参与Al3+结合的苹果酸运输,C端有一个跨膜输水区来维持运输功能所必需[7-8]。基于ALMT的重要性,拟南芥AtALMT1和小麦TaALMT1基因的鉴定引起人们对该家族的研究兴趣,目前,已知在拟南芥基因组中有14个ALMTs蛋白,其相关功能基因的表达也有一些报道[9]。AtALMT1参与AL3+的耐受,主要在拟南芥根中表达,其表达水平受过氧化氢、pH值、植物激素的影响[10];AtALMT4主要在叶肉和保卫细胞中表达[11];AtALMT6主要在保卫细胞中表达,其表达水平受苹果酸、液泡pH值和胞质钙离子的影响[11-12]。据报道,多种植物ALMT家族基因的生物学功能也相应被鉴定,如橡胶树(Hevea brasiliensis)中鉴定出17个ALMTs基因[13];普通烟草(Nicotiana tabacum)中鉴定出30个ALMTs基因,该基因受AL3+的诱导影响,大多数在茎中表达较高而在根部表达相对较低[14];苹果(Malus domestica)基因组中鉴定出25个ALMTs成员,其中MaALMT1影响果实酸度、主要在果实中表达[15];大豆中鉴定出34个ALMTs基因,GmALMT5在低磷环境下显著表达[8];中国白梨中鉴定出27个ALMTs基因,其中Pbr020270.1作为候选基因可能在梨果实苹果酸的积累中发挥重要作用[16]。综上,ALMT基因家族成员在不同植物中均起着重要作用。荔枝(Litchi chinensis)是无患子科荔枝属常绿乔木,产于亚热带地区,喜高温高湿气候,在历史上有“百果之王”等美称。但荔枝产业中仍存在一些问题,如大小年、缺乏特早熟优质荔枝、早熟荔枝偏酸等。【本研究切入点】 ALMT蛋白与植物生长发育和逆境响应有密切关系,荔枝果实酸度的研究目前集中在生理水平,分子水平的研究较少,ALMT参与果实酸度调节,但在荔枝中ALMT基因家族的全基因组鉴定尚未见报道。【拟解决的关键问题】本研究基于全基因组水平对荔枝ALMT基因家族成员进行鉴定与分析,为ALMT基因家族在荔枝果实有机酸生物学功能研究方面提供初步依据。
1 材料与方法 1.1 试验材料供试材料为‘妃子笑’荔枝,种植于中国热带农业科学院南亚热带作物研究所荔枝种植园(21°10′02″N、110°16′34″E,海拔21.32 m),试验基地地势平坦、水源充足、灌溉条件优良,土壤为红壤、肥力中等,土肥水管理一致。采集‘妃子笑’不同组织样品,取秋梢新抽发的嫩梢叶片,老熟梢的成熟老叶,盛花期的雄花、雌花和根(新生长的须根),果实成熟期的果皮、果柄,用液氮速冻后于-80 ℃保存,用于后续RNA提取。
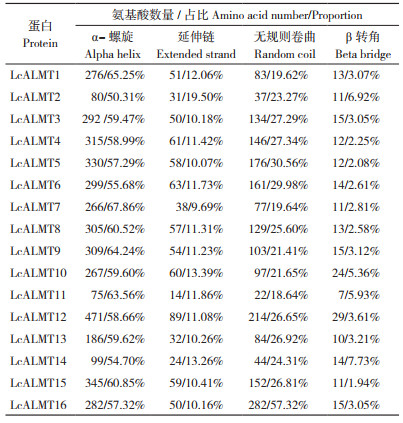
1.2 荔枝LcALMT家族成员鉴定及其蛋白理化性质、亚细胞定位分析荔枝品种‘妃子笑’(Litchi chinensis Sonn. cv. Feizixiao)的基因组来源于荔枝基因组数据库(http://www.sapindaceae.com/),META SEARCH工具搜索Al-activated malate transporter(铝激活苹果酸转运蛋白),搜索注释为Al-activated malate transporter的基因,进一步通过NCBI Conserved Domains Search(https://www.ncbi.nlm.nih.gov/cdd)验证搜索到的蛋白序列是否含有保守ALMT结构域,得到含有完整保守结构域的蛋白,并将其命名为LcALMT,最终从荔枝全基因组中确定有16个LcALMTs。运用ExPASy(https:web.expasy.org/protparam/)预测家族成员对应蛋白质的长度(aa)、分子量(kD)、等电点(pI)、不稳定系数和亲水指数,运用在线网站(https:wolfpsort.hgc.jp/)进行亚细胞定位预测。
1.3 荔枝LcALMTs系统进化关系与蛋白结构分析为进一步了解LcALMTs蛋白,利用公开发表模式植物拟南芥(14个)和水稻(8个)中的ALMTs蛋白序列,拟南芥AtALMTs蛋白序列从拟南芥官网TAIR(https://www.arabidopsis.org)下载获得,水稻OsALMTs蛋白序列从网站Rice Genome Annotation Project(http://eice.plantbiology.msu.edu/)获得。16个荔枝ALMTs蛋白序列,使用MEGA 11软件采用邻接法(Neighbor-Joining,NJ),保持其他参数不变,设置Bootstrap值为1 000,构建系统进化树。
利用GORIV(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_gor4.html)预测蛋白质二级结构,然后利用在线工具SWISSMODEL(https://swissmodel.expasy.org/)预测蛋白质三级结构。
1.4 荔枝LcALMTs的基因结构与保守基序分析从荔枝基因数据库中获取ALMT家族成员的基因序列和对应的CDS序列,运用GSDS(http:gsds.cbi.pku.edu.cn/)在线软件进行荔枝ALMTs成员编码区、内含子和非编码区的结构分析。
使用MEME(http:meme-suite.org/tools/meme)在线软件设置基数为12,其余为默认参数下预测分析荔枝ALMT家族成员编码蛋白的保守基序。
1.5 荔枝LcALMTs启动子上顺式作用元件分析利用在线网站Plantcare(http:bioinformatics.psb.ugent.be/webtools/plantcare/html/)对LcALMTs 5' 端上游2 000 bp的序列进行顺式作用元件分析。
1.6 荔枝LcALMTs的染色体定位根据荔枝全基因组注释信息得到染色体基因位置信息,借助TBtools软件实现可视化。
1.7 荔枝LcALMTs的组织表达从荔枝基因组数据库获取LcALMTs基因在不同组织中的表达量(http://www.sapindaceae.com/),通过TBtools绘制热图。
1.8 部分LcALMTs的实时荧光定量PCR使用植物RNA提取试剂盒(华越洋生物科技有限公司),提取妃子笑不同组织(根、嫩叶、老叶、雄花、雌花、果皮、果柄)RNA。取1 μL检测RNA质量和浓度,样品符合要求后利用M-MLV逆转录酶(TaKaRa)反转录合成cDNA。利用在线软件Primer 3.0设计荧光定量引物,以LcActin为内参(表 1),通过Blast分析引物的特异性,并交由广州艾基生物技术有限公司合成引物序列。
使用SYBR Premix Ex TaqTM(TaKaRa)试剂盒制备反应体系,其中cDNA 1 μL(相当于25 ng总RNA),2 μL基因特异性引物,10 μL 2×SYBR Premix ExTaq,用去RNA酶的ddH2O补足20 μL。使用Roche 480 Ⅱ定量PCR系统(瑞士)进行RT-PCR,反应条件为:94℃预变性2 min,94 ℃ 15 s,58 ℃ 30 s,72 ℃ 30 s,共40个循环。每个样品3次重复。采用2-ΔΔct法计算目标基因相对表达量,以根为对照。
2 结果与分析 2.1 荔枝LcALMT家族成员基本信息及蛋白理化性质、亚细胞定位分析本研究共鉴定出16个荔枝LcALMTs(LcALMT1~LcALMT16),其基本信息如表 2。理化性质分析发现,LcALMTs蛋白编码的氨基酸数目在118~803 aa,分子量大小在12.60~89.54 kD,等电点在5.16~9.07之间,其中碱性蛋白(pI > 7)10个、酸性蛋白(pI < 7)6个,不稳定系数介于25.57~45.17,且LcALMT1、LcALMT13、LcALMT14、LcALMT16属于不稳定蛋白(不稳定系数 > 40)。亚细胞定位预测显示,该家族成员蛋白均定位于质膜上。
|
2.2 荔枝LcALMTs系统进化树及蛋白结构分析
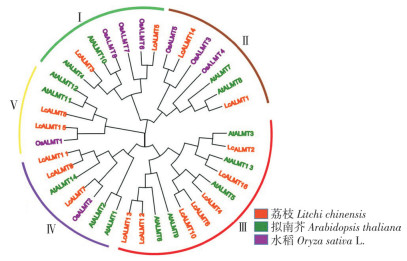
使用MEGA 11生成荔枝LcALMTs系统进化树图,由图 1可知,该家族成员可分为5个亚族。第Ⅰ、Ⅱ、Ⅴ亚族均包含2个LcALMT成员,第Ⅳ亚族包含3个LcALMT成员,第Ⅲ亚族包含7个LcALMT成员。荔枝LcALMTs成员在5个亚族中分布不均匀,主要在第Ⅲ亚族。从进化树来看,荔枝ALMT家族成员与拟南芥的ALMT家族成员亲缘关系更近。
|
| 图 1 荔枝、拟南芥和水稻ALMTs系统进化树 Fig. 1 Phylogenetic tree of ALMT proteins in Litchi chinesis, Arabidopsis thaliana and Oryza sativa L. |
对荔枝LcALMTs蛋白二级结构进行分析发现,该家族蛋白二级结构包含α-螺旋、延伸链、无规则卷曲和β转角(表 3)。其中α-螺旋占比最高、均大于50%,延伸链占比为9.69%~19.50%,无规则卷曲占比为18.64%~57.32%,β转角占比为1.94%~7.73%。蛋白质三级结构(图 2)预测显示,位于同一亚族的LcALMTs蛋白结构相似,如亚族I中的LcALMT3和LcALMT5,亚族Ⅲ中的LcALMT12、LcALMT13和LcALMT16均具有相似结构。
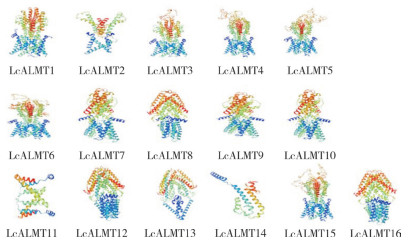
|
| 图 2 LcALMTs蛋白三级结构 Fig. 2 Tertiary structure of LcALMT proteins |
2.3 荔枝LcALMTs基因结构及保守基序分析
运用GSDS软件对荔枝ALMT家族成员编码区、内含子和非编码区进行结构分析,由图 3可知,荔枝LcALMTs外显子数目在3~10个,其中LcALMT12外显子数目最多(10个);LcALMT1、LcALMT3、LcALMT4、LcALMT5、LcALMT6、LcALMT8和LcALMT15均含有6个外显子,LcALMT7、LcALMT10、LcALMT11、LcALMT14基因均不含有非编码区。
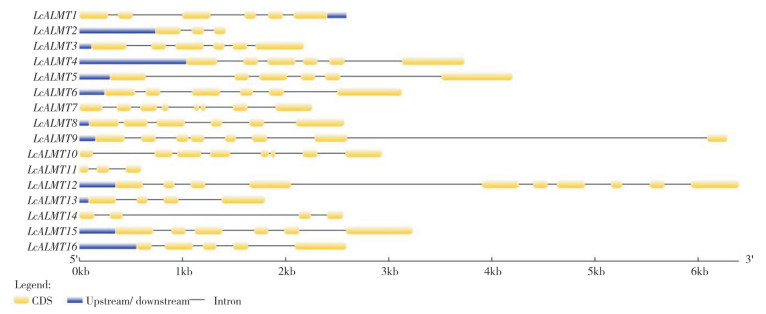
|
| 图 3 荔枝LcALMTs基因结构 Fig. 3 Gene structure of LcALMTs in litchi |
利用MEME在线网站分析保守基序,基序数量上限设置为12,其他参数不变,结果(图 4A)显示,有13个LcALMTs蛋白均含有motif 1;除LcALMT11外,其他蛋白均含有motif 4;LcALMT11和LcALMT14仅含有2个保守基序,分别为motif 11、motif 5和motif 6、motif 4。由NCBI网站分析得知荔枝ALMT家族含有ALMT和ALMT superfamily两个结构域,由图 4B可知,15个LcALMTs蛋白均只含有1个结构域,而LcALMT12包含上述2个结构域,其中ALMT superfamily结构域位于N端、ALMT结构域位于C端。由SMART(http://smart.embl.de/)网站分析可知,motif 1~motif 7均属于ALMT结构域,motif 8~motif 12未知。
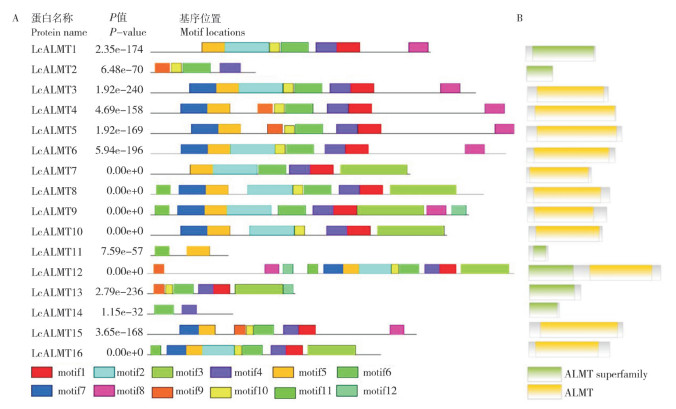
|
| 图 4 荔枝LcALMTs蛋白保守结构域 Fig. 4 Conservative domains of LcALMT proteins in Litchi |
2.4 荔枝LcALMTs的染色体定位分析
染色体定位分析结果(图 5)表明,LcALMT基因家族只定位在荔枝15条染色体中的6条染色体上,其中LcALMT1和LcALMT2定位在Chr3上,LcALMT3、LcALMT4和LcALMT5定位在Chr10上,LcALMT6、LcALMT15和LcALMT16分别定位在Chr12、Chr14和Chr15上,Chr13上LcALMT蛋白分布最多且紧密。
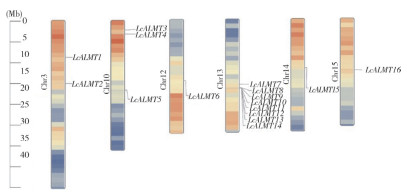
|
| 图 5 荔枝LcALMTs基因染色体定位 Fig. 5 Chromosomal localization of LcALMTgenes in Litchi |
2.5 荔枝LcALMTs启动子上顺式作用元件分析
利用Plantcare在线网站对LcALMTs基因5′端上游2 000 bp的序列预测顺式作用元件,除去一般性调控转录元件(如TATA-box、CAATbox)等未知功能元件外,共发现536个顺式作用元件,其中光响应元件最多、共有219个(占40.86%),荔枝LcALMTs基因均至少含有5个光响应元件,如TCT-motiff、G-box、Box4和AT1-motif等(图 6)。其次是激素响应元件、共有216个(占40.30%),主要包括脱落酸响应元件(ABRE)、水杨酸响应元件(TCA-element)、茉莉酸甲酯响应元件、赤霉素响应元件和生长素响应元件。其中LcALMT7含有的茉莉酸甲酯响应元件最多、有94个。整个LcALMT家族成员中,LcALMT4不含脱落酸响应元件。生长发育元件有30个(5.60%),主要包括胚乳表达元件、玉米醇溶蛋白代谢调节相关元件、栅栏叶肉细胞分化元件、种子特异性调控元件和参与细胞周期调控元件。非生物胁迫元件有44个(8.21%),主要包括防御应激响应元件TC-rich repeats、无氧诱导相关元件ARE、低温响应元件LTR和诱导子激活元件。其他元件有27个(5.04%),包括光响应MYB结合位点、干旱胁迫诱导MYB结合位点、蛋白结合位点、ATBP-1结合位点和MYBHv1结合位点。以上结果表明,荔枝LcALMTs成员可能具有差异化的生物学功能,参与荔枝的光响应、激素响应、生长发育与胁迫响应等相关过程。
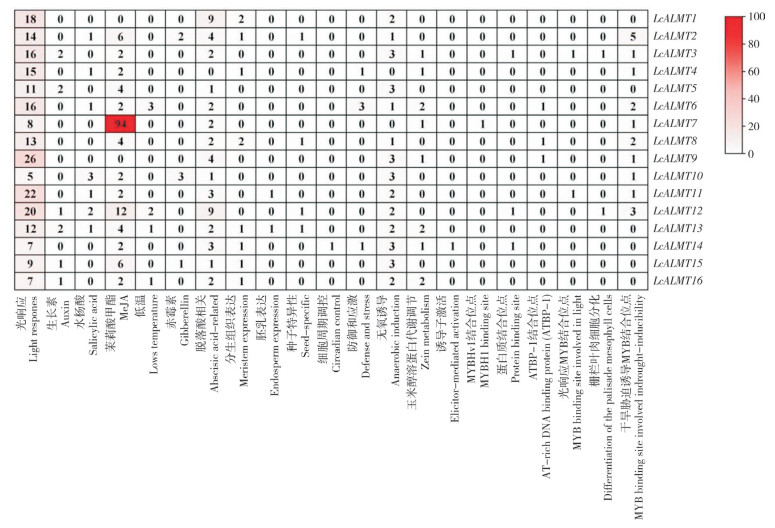
|
| 图 6 荔枝LcALMTs启动子上顺式作用元件分析 Fig. 6 Analysis of cis-regulatory elements on LcALMTs promoter in Litchi |
2.6 荔枝LcALMTs的组织表达
从荔枝基因组数据库中LcALMT家族成员在不同组织中的表达量(图 7)来看,LcALMT5和LcALMT15在不同组织中都有表达且表达量均较高,其中LcALMT5在雄花中的表达量最高,LcALMT15在假种皮中的表达量最高、是果皮中的16.9倍。LcALMT10和LcALMT14在荔枝的各组织中均未检测出表达。LcALMT3只在雄蕊中有表达,且表达量极低。LcALMT4在种子中的表达量最高、是叶中表达量的13.6倍,在不育雄蕊中未检测出表达。挑取LcALMT家族成员中表达量较高的3个基因LcALMT4、LcALMT5和LcALMT15进行荧光定量验证,分析妃子笑不同组织(根、嫩叶、老叶、雄花、雌花、果皮、果柄)中LcALMTs的表达情况,以根的表达量为1、各基因在各部位下的表达量与其比较进行定量,结果(图 8)显示,LcALMT4、LcALMT5和LcALMT15在不同组织中均有表达,但存在表达量的差异。LcALMT4、LcALMT5和LcALMT15均在雄花中表达最高、其次为雌花。LcALMT5的表达水平与转录组结果较为一致。
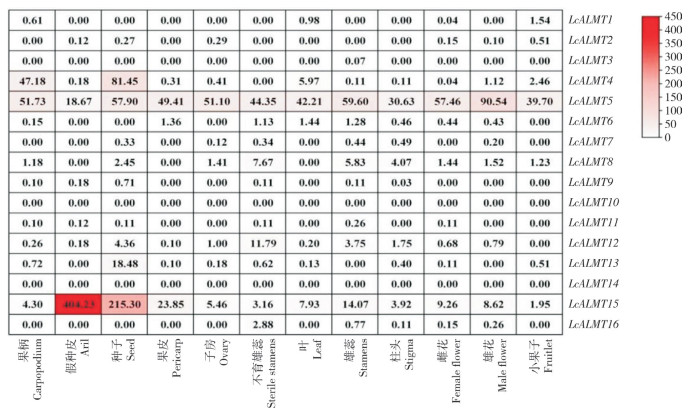
|
| 图 7 荔枝LcALMTs基因表达模式分析 Fig. 7 Expression patterns analysis of LcALMT genes in Litchi |
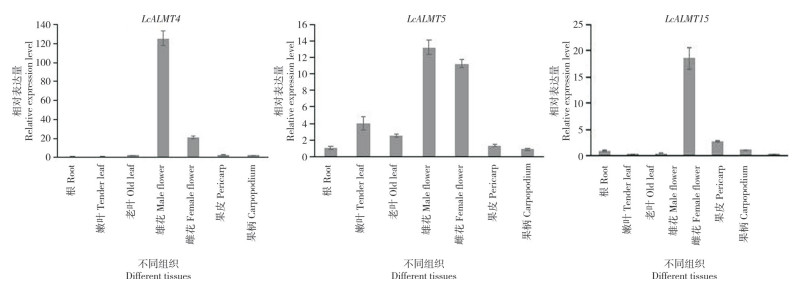
|
| 图 8 荔枝LcALMT4/5/15相对表达水平 Fig. 8 Relative expression levels of LcALMT4/5/15 in Litchi |
3 讨论
本研究对荔枝ALMT基因的全基因组进行鉴定与表达分析,对其部分功能进行预测,可为研究荔枝生物学功能奠定一定基础。ALMT广泛存在于植物中,参与植物的生理过程,其功能也相应被探索,如植物耐铝性[17-19]、矿质营养[20-21]、果实酸度[22-23]、气孔运动[24-27]、参与种子发育[28-29]等。第1个植物基因TaALMT1[6]被发现后,越来越多的ALMT家族成员在不同植物中也相应被研究,但在荔枝中未见到ALMT基因家族的报道。本研究从荔枝基因库得到ALMT数据,对其ALMT家族成员进行鉴定,并系统分析该家族成员的蛋白理化性质、系统发育、基因结构、染色体定位、保守基序、顺式作用元件、蛋白结构和表达模式等。
从荔枝基因组中鉴定出16个LcALMTs基因,数量与草莓相同、多于拟南芥(14个)[9]、少于苹果ALMT家族成员[14]。荔枝ALMT家族成员均定位于质膜上,与苹果中MdALMT13在烟草亚细胞定位结果[15]一致,均定位于质膜上。荔枝ALMT家族成员外显子数目在3~10个,苹果中ALMT家族成员外显子数量为4~12个[15],则两者之间外显子数量差距较大,这可能是荔枝在进化过程中发生了外显子的缺失。染色体只定位在荔枝15条染色体中的6条染色体上,Chr13上LcALMTs分布最多且紧密,与萝卜ALMT家族成员定位在9条染色体上有差异[18],具体原因还需进一步探究。荔枝ALMT基因家族成员含有多种顺式作用元件,均包含光响应元件,激素响应元件生长发育元件,且光响应元件数量最多,暗示LcALMTs基因的表达可能受光照、激素调节和生长发育条件的影响且受光照影响最大,这与前人在其他物种中的研究结果一致。LcALMT7基因含茉莉酸响应元件最多、达94个,表明该基因的表达量可能主要受茉莉酸的调控,故不同基因成员之间表达量不同主要与光照、激素调控,与生长发育条件有着巨大关系。该家族成员蛋白结构中α-螺旋占比最高,位于同一亚族的ALMT蛋白一般结构相似。系统进化分析发现,荔枝ALMTs蛋白可以分为5个亚族,这与萝卜ALMT家族分类[30]一致。荔枝ALMT家族成员在不同组织中的表达量不同,LcALMT4主要在种子中表达,与MdALMT13主要在根中高度表达结果[31]一致。采用qRT-PCR对LcALMT4、LcALMT5、LcALMT15在荔枝不同组织中的表达水平进行检测,结果表明LcALMT4、LcALMT5、LcALMT15在各组织中均有表达,且在雄花中高度表达,推测LcALMT4、LcALMT5、LcALMT15可能参与雄花的调控,在雄花发育中起作用。综上,不同物种之间的基因在进化过程中多数存在相同或相似功能,表达量之间的差异不同,与生长环境和激素调节相关联。
4 结论利用生物信息学方法从荔枝基因组中鉴定出16个ALMTs成员,这些成员蛋白均定位于质膜上,染色体定位在荔枝15条染色体中的6条染色体上,且在Chr13上LcALMTs分布最多且紧密。荔枝ALMT基因家族成员启动子含有多种顺式作用元件,光响应元件含量最多;蛋白结构中,α-螺旋占比最高;五个亚族中,位于同一亚族的ALMTs蛋白一般结构相似。其相对表达量来看LcALMT4、LcALMT5和LcALMT15在不同组织中均有表达,且均在雄花中表达最高,其次为雌花。
| [1] |
SHARMA T, DREYER I, KOCHIAN L, PIÑEROS M A. The ALMT family of organic acid transporters in plants and their involvement in detoxification and nutrient decurity[J]. Frontiers in Plant Science, 2016, 7: 1488. DOI:10.3389/fpls.2016.01488 |
| [2] |
BARBIER-BRYGOO H, DE ANGELI A, FILLEUR S, FRACHISSE J M, GAMBALE F, THOMINE S, WEGE S. Anion channels/transporters in plants: from molecular bases to regulatory networks[J]. Annual Review of Plant Biology, 2011, 62: 25-51. DOI:10.1146/annurevarplant-042110-103741 |
| [3] |
LIU J, ZHOU M. The ALMT gene family performs multiple functions in plants[J]. Agronomy, 2018, 8: 20. DOI:10.3390/agronomy8020020 |
| [4] |
XU M, GRUBER B D, DELHAIZE E, WHITE R G, JAMES R A, YOU J, YANG Z, RYAN P R. The barley anion channel, HvALMT1, has multiple roles in guard cell physiology and grain metabolism[J]. Plant Physiology, 2015, 153: 183-193. DOI:10.1111/ppl.12234 |
| [5] |
彭福程. 铁皮石斛ALMT基因家族全基因组研究及昼夜表达模式的分析[D]. 北京: 中国林业科学研究院, 2020. DOI: 10.27625/d.cnki.gz/ky.2020.000208. PENGF C. Study on the function of MdALMT13in response to drought and alkali stress in apple[D]. Beijing: Chinese Academy of Forestry, DOI: 10.27625/d.cnki.gz/ky.2020.000208. |
| [6] |
SASAKI T, YAMAMOTO Y, EZAKI B, KATSUHARA M, AHN S J, RYAN P R, DELHAIZE E, MATSUMOTO H. A wheat gene encoding an aluminum-activated malate transporter[J]. The Plant Journal, 2004, 37: 645-653. DOI:10.1111/j.1365-313X.2003.01991.x |
| [7] |
MOTODA H, SASAKI T, KANO Y, RYAN P R, DELHAIZE E, MATSUMOTO H, YAMAMOTO Y. The membrane topology of ALMT1, an aluminum-activated malate transport protein in wheat (Triticum aestivum)[J]. Plant Signaling & Behavior, 2007, 2: 467-472. DOI:10.4161/psb.2.6.4801 |
| [8] |
PENG W T, WU W W, PENG J C, LI J J, LIN Y, WANG Y N, TIAN J, SUN L L, LIANG C Y, LIAO H. Characterization of the soybean GmALMT family genes and the function of GmALMT5in response to phosphate starvation[J]. Journal of Integrative Plant Biology, 2018, 60: 216-231. DOI:10.1111/jipb.12604 |
| [9] |
KOVERMANN P, MEYER S, HÖRTENSTEINER S, PICCO C, SCHOLZ-STARKE J, RAVERA S, LEE Y, MARTINOIA E. The Arabidopsis vacuolar malate channel is a member of the ALMT family[J]. The Plant Journal, 2007, 52: 1169-1180. DOI:10.1111/j.1365-313X.2007.03367.x |
| [10] |
KOBAYASHI Y, KOBAYASHI Y, SUGIMOTO M, LAKSHMANAN V, IUCHI S, KOBAYASHI M, BAIS HP, KOYAMA H. Characterization of the complex regulation of AtALMT1expression in response to phytohormones and other inducers[J]. Plant Physiology, 2013, 162: 732-740. DOI:10.1104/pp.113.218065 |
| [11] |
EISENACH C, BAETZ U, HUCK NV, ZHANG J, DE ANGELI A, BECKERS GJM, MARTINOIA E. ABA-Induced stomatal closure involves ALMT4, a phosphorylation-dependent vacuolar anion channel of Arabidopsis[J]. The Plant Cell, 2017, 29: 2552-2569. DOI:10.1105/tpc.17.00452 |
| [12] |
MEYER S, SCHOLZ-STARKE J, DE ANGELI A, KOVERMANN P, BURLA B, GAMBALE F, MARTINOIA E. Malate transport by the vacuolar AtALMT6 channel in guard cells is subject to multiple regulation[J]. Plant Journal, 2011, 67: 247-257. DOI:10.1111/j.1365-313X.2011.04587.x |
| [13] |
MA X W, AN F, WANG L F, GUO D, XIE G S, LIU Z F. Genome-Wide identification of aluminum-activated malate transporter (ALMT) gene family in rubber trees (Hevea brasiliensis) highlights their involvement in aluminum detoxification[J]. Forests, 2020, 11: 142. DOI:10.3390/f11020142 |
| [14] |
张慧, 李泽锋, 徐国云, 金静静, 王晨, 翟妞, 金立锋, 郑庆霞, 陈千思, 刘萍萍, 周会娜. 普通烟草ALMT基因家族的鉴定与表达分析[J]. 烟草科技, 2020, 53: 1-9. ZHANG H, LI Z F, XU G Y, JING J J, WANG C, ZHAI N, JING L F, ZHENG Q X, CHEN Q S, LIU P P, ZHOU H N. Identification and expression analysis of ALMT gene family in Nicotiana tabacum[J]. Tobacco Science & Technology, 2020, 53: 1-9. |
| [15] |
MA B, LIAO L, ZHENG H, CHEN J, WU B, OGUTU C, LI S, KORBAN S S, HAN Y. Genes encoding aluminum-activated malate transporter Ⅱ and their association with fruit acidity in apple[J]. Plant Genome, 2015, 8: e2013-e2015. DOI:10.3835/plantgenome2015.03.0016 |
| [16] |
XU L, QIAO X, ZHANG M Y, ZHANG S L. Genome-Wide analysis of aluminum-activated malate transporter family genes in six rosaceae species, and expression analysis and functional characterization on malate accumulation in Chinese white pear[J]. Plant Science, 2018, 24(3): 431-442. DOI:10.1111/1744-7917.12336 |
| [17] |
HOEKENGA O A, MARON L G, PINEROS M A, CANCADO G M A, SHAFF J, KOBAYASHI Y, RYAN P R, DONG B, DELHAIZE E. AtALMT1, which encodes a malate transporter, is identified as one of several genes critical for aluminum tolerance in Arabidopsis[J]. Proceedings of the National Academy of Sciences, 2006, 20(25): 9738-9743. DOI:10.1073/pnas.0602868103 |
| [18] |
L IGABA A, K AT SUH AR A M, RYAN P R, SHIBASAK A M, MATSUMOTO H. The BnALMT1 and BnALMT2 genes from rape encode aluminum-activated malate transporters that enhance the aluminum resistance of plant cells[J]. Plant Physiolgy, 2006, 142: 1294-1303. DOI:10.1104/pp.106.085233 |
| [19] |
COLLINS N C, SHIRLEY N J, SAEED M, PALLOTTA M, GUSTAFSON P. An ALMT1 gene cluster controlling aluminum tolerance at the Alt4 locus of r ye (Secale cereale L.)[J]. Genetics Society of America, 2008, 179: 669-682. DOI:10.1534/genetics.107.083451 |
| [20] |
PINEROS M A, CANCADO G M A, MARON L G, LYI S M, MENOSSI 88 M, KOCHIAN L V. Not all ALMT1-type transporters mediate aluminum-activated organic acid responses: the case of ZmALMT1-an anion-selective transporter[J]. Plant Journal, 2018, 53(2): 352-367. DOI:10.1111/j.1365-313X.2007.03344.x |
| [21] |
LIGABA A, MARON L, SHAFF J, KOCHIAN L, MIGUEL P. Maize ZmALMT2 is a root anion transporter that mediates constitutive root malate efflux[J]. Plant Cell, 2012, 35: 1185-1200. DOI:10.1111/j.1365-3040.2011.02479.x |
| [22] |
BAI Y, DOUGHERTY L, LI M J, FAZIO G, CHENG L L, XU K N. A natural mutation-led truncation in one of the two aluminum-activated malate transporter-like genes at the Ma locus is associated with low fruit acidity in apple[J]. Molecular Genetic and Genomics, 2012, 287: 663-678. DOI:10.1007/s00438-012-0707-7 |
| [23] |
DE ANGELI A, BAETZ U, FRANCISCO R, ZHANG J B, CHAVES M M, REGALADO A. The vacuolar channel VvALMT9 mediates malate and tartrate accumulation in berries of Vitis vinifera[J]. Planta, 2013, 238(2): 283-291. DOI:10.1007/s00425-013-1888-y |
| [24] |
KOVERMANN P, MEY ER S, HORT ENST EINER S, PICCO C, SCHOLZ STARKE J, RAVERA S, LEE Y S, MARTINOIA E. The Arabidopsis vacuolar malate channel is a member of the ALMT family[J]. Plant Journal, 2007, 52: 1169-1180. DOI:10.1111/j.1365-313X.2007.03367.x |
| [25] |
GRUBER B D, RICHARDSON A E, RORSSNER U, JAMES R A. HvALMT1 from barley is involved in the transport of organic anions[J]. Functional Plant Biology, 2010, 61: 1455-1467. |
| [26] |
MEYER S, MUMM P, IMES D, ENDLER A, HEDRICH R. AtALMT12 represents an R-type anion channel required for stomatal movement in Arabidopsis guard cells[J]. Plant Journal, 2010, 63: 1054-1062. DOI:10.1111/j.1365-313X.2010.04302.x |
| [27] |
DE ANGELI A, ZHANG J B, MEYERS, MARTINOIA E. AtALMT9 is a malate-activated vacuolar chloride channel required for stomatal opening in Arabidopsis[J]. Nature Communcations, 2013, 4: 1804. DOI:10.1038/ncomms2815 |
| [28] |
魏志敏, 李亚林, 黄鑫, 李学文, 吴飞华, 刘家友, 喻敏. 植物阴离子通道铝激活苹果酸转运体ALMTs在植物营养与生理中的作用[J]. 植物生理学报, 2023, 59(6): 1072-1082. DOI:10.13592/j.cnki.ppj.300125 WEI Z M, LI Y L, HUANG X, LI X W, WU F H, LIU J Y, YU M. The role of plant anion channel aluminum-activated malate transporters (ALMTs) in plant nutrition and physiology[J]. Plant Physiology Journal, 2023, 59(6): 1072-1082. DOI:10.13592/j.cnki.ppj.300125 |
| [29] |
刘耀婷, 李芳, 高兆银, 王果, 李焕苓, 王树军, 王祥和, 王家保. 荔枝种子发育过程中有机营养变化与萌发的关系[J/OL]. 中国南方果树: 1-11. (2023-05-22)[2023-08-02]. DOI: 10.13938/j.issn.1007-1431.20230034. LIU Y T, LI F, GAO Z Y, WANG G, LI H L, WANG S J, WANG X H, WANG J B. Relationship between organic nutrition changes and germination of litchi seeds during development[J/OL]. South China Fruits, 1-11. (2023-05-22)[2023-08-02]. DOI: 10.13938/j.issn.1007-1431.20230034. |
| [30] |
刘同金, 徐铭捷, 汪金磊, 刘良峰, 崔群香, 包崇来, 王长义. 萝卜ALMT基因家族的鉴定与表达[J]. 浙江农业学报, 2022, 34(4): 746-755. DOI:10.3969/j.issn.1004-1524.2022.04.11 LIU T J, XU M J, WANG J L, LIU L F, CUN Q X, BAO C L, WANG C Y. Genome-wide identificatoin and expression of ALMT gene family in radish[J]. Acta Agriculturae Zhejiangensis, 2022, 34(4): 746-755. DOI:10.3969/j.issn.1004-1524.2022.04.11 |
| [31] |
李云浩. MdALMT13在苹果响应干旱和碱胁迫中的功能研究[D]. 杨凌: 西北农林科技大学, 2022. LI Y H. Study on the function of MdALMT13 in response to drought and alkali stress in apple[D]. Yangling: Northwest A & F University, 2022. |
(责任编辑 张辉玲)
 2023, Vol. 50
2023, Vol. 50