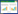文章信息
基金项目
- 广东省粤北食药资源利用与保护重点实验室开放基金(FMR2022001M);广东大学生科技创新培育专项资金(大学生科技创新培育)项目(pdjh2023a0470)
作者简介
- 袁晓(1989—),女,在职硕士生,研究方向为采后果蔬贮藏保鲜,E-mail:yxiao@sgu.edu.cn; 王斌,博士,副教授,韶关学院生物与农业学院专任教师,广东省园艺学会理事、副秘书长及教育分会理事,中国经济林协会芳香植物分会团体会员。主要从事采后果蔬贮藏保鲜、园艺植物逆境生物学、芳香植物功能性物质合成调控等研究。主持广东省自然科学基金面上项目、广东省教育厅项目、韶关市科技计划项目等项目6项。获授权国家发明专利3件,以第一或通信作者发表科技论文30余篇,其中SCI收录论文15篇。指导本科生参加“挑战杯”广东大学生课外学术科技作品竞赛获得省赛二等奖1项,获得广东省科技创新战略专项资金(大学生“攀登计划”科技创新培育)重点项目1项.
通讯作者
- 王斌(1991—),男,博士,副教授,研究方向为采后果蔬生物学,E-mail:b_wang@sgu.edu.cn.
文章历史
- 收稿日期:2023-07-15
2. 华南农业大学园艺学院 / 广东省果蔬保鲜重点实验室,广东 广州 510642
2. College of Horticulture, South China Agricultural University / Guangdong Province Key Laboratory of Postharvest Science of Fruits and Vegetables, Guangzhou 510642, China
【研究意义】芋头(Colocasia esculenta)是天南星科芋属植物,起源于印度、马来半岛以及中国南方等热带地区[1]。芋头在全球大部分地区均有栽培种植,其中以非洲和我国珠江流域的种植面积最大[2]。芋头的主要食用器官是地下肉质球茎,是非洲许多地区的主粮,在我国主要以菜用为主[3]。芋头球茎中淀粉含量很高,食用风味独特,烹饪后口感软糯香甜可口,深受消费者喜爱[4]。但芋头中的草酸含量也很高,每100 g鲜芋头的草酸含量可达574 mg[5],草酸能与钙离子结合形成草酸钙,多以草酸钙等草酸盐的形式储存植物体内,在芋头去皮、切分等前处理过程中,草酸钙结晶会使接触芋头的皮肤产生红肿、瘙痒难忍等过敏症状,给消费者的食用带来很多不便[6]。在生产基地或食品加工厂将芋头切配好销售,消费者在购买后无需再次加工处理,可有效避免消费者皮肤过敏的发生、促进芋头的销售。但切分好的芋头(鲜切芋头)在销售过程中切面会发生褐变现象,表现出变黄、变褐等不良症状,严重降低鲜切芋头的商品性,制约芋头产业的高质量发展[7]。研究表明,鲜切果蔬表现出褐变症状主要有两个方面的原因:一方面,果蔬感受到切割产生的损伤信号,会激活自身的防御系统诱导一些黄酮类物质的合成积累,使鲜切果蔬的切面表现出黄褐色;另一方面,切割处理破坏了切面细胞的完整性,使细胞的区隔功能丧失,导致酚酶能与底物(主要是酚类物质)直接反应,从而形成黄褐色的化合物。另外,切割处理会诱导细胞膜脂过氧化反应,使细胞膜的完整性和流动性降低,增加了参与酶促褐变反应的酶与底物的接触机会,加剧酶促反应[8-9]。因此,鉴定在鲜切芋头褐变过程中起促进作用的相关基因,并探究其表达与鲜切芋头褐变的相关性,对于解析鲜切芋头褐变发生机制、研发安全高效的鲜切芋头褐变防控技术具有重要意义。
【前人研究进展】近年研究表明,脂质氧化是促进鲜切果蔬褐变的重要原因[10],尤其膜脂过氧化导致的细胞膜完整性和流动性降低,使得底物和酶直接接触,加速了酶促褐变反应。丙二烯氧化物合成酶(Allene oxide synthase, AOS)是一种典型的细胞色素P450酶,在脂肪酸氧化过程中具有重要作用,能促进脂肪酸的氧化[11]。另外,植物AOS是茉莉酸(Jasmonic acid, JA) 合成途径中的关键酶,AOS以13(s)- 氢过氧化亚麻酸为底物直接催化13(s)- 氢过氧化亚麻酸生成12- 氧- 植物二烯酸,生成的产物随后进入细胞质经过1次还原和3次氧化反应最终生成JA;JA作为信号分子传递机械损伤信号使植物对机械损伤作出反应,也可以反馈调控AOS家族基因的表达[12],植物中诱导AOS的表达可能也是一种防御反应。植物AOS家族基因的表达受多种生物和非生物因素的诱导[13],例如:盐胁迫显著诱导水稻AOS基因的表达,而aos突变体水稻对盐胁迫的敏感性很低[14];真菌性生物胁迫处理显著诱导板栗AOS表达,在拟南芥中过表达板栗AOS1基因可显著延缓樟疫霉(Phytophthora cinnamomi)病原菌的生长,并促进拟南芥的生长[15]。在烟草中,伤信号能显著诱导AOS基因的表达,过表达一个细胞质定位的AOS基因能促进伤诱导的JA积累[16];在拟南芥中突变一个AOS基因CYP74A,会阻断伤信号诱导的JA合成积累[17]。【本研究切入点】芋头鲜切处理本身就是一种物理性的机械损伤,褐变可能是鲜切芋头对伤信号的一种反应。前期分析转录组测序数据时发现,在鲜切芋头褐变过程中,许多与脂质氧化和代谢相关基因的表达显著上调。植物AOS在脂肪酸氧化和JA合成过程中具有重要作用,但芋头AOS1是否参与对伤信号的响应,以及其表达是否与鲜切芋头有关,目前尚未见相关研究报道。此外,植物AOS基因最先在亚麻中成功克隆,之后陆续在拟南芥、水稻、烟草等模式植物和一些经济作物中成功克隆了AOSs基因[18],但尚未在芋头中见到AOS基因克隆的研究报道。【拟解决的关键问题】为研究脂质氧化代谢基因在鲜切芋头褐变中的作用,本研究从鲜切芋头中克隆AOS1基因的编码序列(Coding sequence, CDS),通过分析AOS1基因在鲜切芋头褐变过程中的表达变化,及抗褐变剂对其表达的影响,初步明确AOS1基因表达与鲜切芋头褐变的关系。
1 材料与方法 1.1 试验材料本试验所用芋头球茎分别于2021年11、12月购自广东省韶关市浈江区当地的一个农贸市场,品种为‘槟榔芋’。挑选个头大小基本一致,无病虫害和明显机械伤的芋头作为试验材料,自来水清洗干净表面的泥沙,去皮并切分成厚度约1 cm的薄片,备用。
1.2 试验方法1.2.1 鲜切芋头褐变试验 将鲜切芋头装在一次性塑料托盘,每个托盘装9片,3个重复共27片;用一次性塑料薄膜保鲜袋密封包装,分别放置在20 ℃和4 ℃的恒温培养箱中观察褐变变化。20 ℃贮藏期间,依次在0、12、24 h观察褐变变化,每个重复中随机取1片芋头作为代表拍照;4 ℃贮藏期间,每隔2 d测定色度值,并每次随机取3片芋头作为分析样品(每个重复取1片)。
1.2.2 褐变抑制处理试验 试验设3个处理,芋头片分别用0.1 g/L的肉桂酸(Cinnamic acid, CA)、乙醇酸(Glycolate, GA)和香草酸(Vanillic acid, VA)溶液浸泡30 min,用自来水浸泡30 min作为对照(CK)。捞出并沥干鲜切芋头表面的水分,用塑料薄膜保鲜袋密封包装,放置在4 ℃低温冰箱贮藏12 d。每个处理3次重复共27片鲜切芋头,在处理0、12 d分别收集样品,送至北京百迈客生物科技有限公司进行转录组测序分析。
1.2.3 鲜切芋头表面L* 值测定 使用CR-400型色差仪(日本,柯尼卡美能达)测定鲜切芋头表面的L* 值(亮度),分别在芋头切面的3个不同部位测定,以3次数据的平均值表示该片芋头表面的亮度。
1.2.4 芋头AOS1基因全长克隆 使用北京天根生化科技有限公司的总RNA提取试剂盒(产品编号:DP441)提取鲜切芋头的总RNA,利用反转录试剂盒合成cDNA。以芋头cDNA为模板,使用高保真Taq酶,通过RT-PCR法扩增AOS1基因全长序列。全长克隆引物序列如下:正向引物5'-ATGGCTTCGGCCTCTCTCT-3',反向引物5'-TCAGAAGGTCGCCCTCTTCAA-3'。PCR扩增完成后,通过琼脂糖凝胶电泳检测,扩增DNA片段在确认符合预期大小后,将PCR产物回收并连接到pUCm-T载体上,构建重组克隆载体,并转化DH 5α感受态细胞。使用含有氨苄霉素的LB平板筛选阳性克隆,并再次通过菌落PCR法鉴定克隆产物。
1.2.5 序列特性分析 根据测序序列推导出对应的编码蛋白序列,将蛋白序列提交至NCBI数据库中与拟南芥、烟草和番茄等模式植物的基因组比对,在相应的基因组数据中找到AOS1同源蛋白,使用DNAman软件绘制多序列比对图。在Expasy网站(https://www.expasy.org/) 分析芋头AOS1蛋白的理化性质。通过Plant-mPLoc网站(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/) 预测芋头AOS1蛋白的亚细胞定位。使用芋头AOS1蛋白氨基酸序列在NCBI数据库中Blast同源蛋白,在Blast结果中每种植物挑选一个AOS蛋白序列,使用MEGA软件中的邻接法(Neiborjoining, NJ)构建进化树。
1.2.6 AOS1表达分析 采用荧光定量PCR法检测鲜切芋头褐变过程中AOS1表达变化,引物序列如下:正向引物5'-TTCCCCACCGTCATCAAGTG- 3',反向引物5'-GTCCTGATCTCCTCCGCAAG-3'。利用转录组测序检测CA、GA和VA处理对AOS1表达的影响,结果用每千个碱基的转录每百万映射读取的片段数(Fragments per kilobase of exon model per million mapped fragments, FPKM)值表示。
1.2.7 启动子上顺式作用元件分析 根据克隆的AOS1基因cDNA序列,在NCBI数据库中检索同源基因(登录号:mQL89524.1),找到翻译起始密码子(ATG) 上游长度为2 000 bp左右的DNA序列[19]。在PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子序列中的顺式作用元件,根据预测结果,使用TBtools软件绘制顺式作用元件在启动子上的分布。
1.3 数据分析试验数据用Microsoft Power Point软件绘图,使用SPSS 22.0软件分析差异显著性。
2 结果与分析 2.1 鲜切芋头在不同温度下贮藏期间的褐变表现变化为观察鲜切芋头在贮藏期间的褐变变化,以及明确低温贮藏对鲜切芋头褐变的抑制作用,将鲜切芋头分别贮藏在20 ℃和4 ℃的环境下。在20 ℃贮藏期间,鲜切芋头贮藏12 h即产生轻微的变黄症状,在24 h时切面明显变黄,基本丧失了商品性(图 1A);在4 ℃贮藏期间,鲜切芋头褐变进程较为缓慢,贮藏6 d仅观察到轻微的变黄症状,在12 d时褐变症状才较为明显(图 1B)。表明贮藏温度是影响鲜切芋头褐变的重要因素,4 ℃低温贮藏可有效延缓鲜切芋头褐变。但即使在4 ℃低温贮藏期间,鲜切芋头褐变仍会缓慢发展。因此,探究鲜切芋头在低温贮藏期间的褐变发生机制,对于研发安全高效的抗褐变技术,减少鲜切芋头采后损失具有重要意义。

|
| A:鲜切芋头在20 ℃贮藏期间的切面颜色变化;B:鲜切芋头在4 ℃贮藏期间的切面颜色变化 A: Color changes of fresh-cut taros during storage at 20 ℃; B: Color changes of fresh-cut taros during storage at 4 ℃ 图 1 鲜切芋头在不同贮藏温度下的褐变变化 Fig. 1 Changes in browning of fresh-cut taros at different storage temperatures |
2.2 芋头AOS1全长序列克隆
转录组测序组装的芋头AOS1基因的CDS序列长度为1 560 bp。为从鲜切芋头中克隆AOS1全长,以鲜切芋头cDNA为模板,采用RT-PCR法扩增芋头AOS1基因全长序列。经PCR扩增后在1 000~2 000 bp间得到一条DNA条带(图 2A),表明初步扩增到目的片段。将该片段回收,并连接至T载上转化大肠杆菌。挑选2个单菌落,进行菌落PCR验证,结果(图 2B)显示,从2个单克隆菌落中均扩增出1条约1 500 bp长度的DNA条带,表明回收产物成功与T载连接,可用于测序鉴定。
|
| A:以cDNA为模板扩增的AOS1序列;B:以重组质粒为模板扩增的AOS1序列;M:DNA marker;1~3:AOS1扩增产物 A: AOS1 sequence amplified with cDNA as a template; B: AOS1 sequence amplified with recombinant plasmids as templates; M: DNA marker; 1-3: AOS1 amplification product 图 2 AOS1全长序列的PCR产物电泳图 Fig. 2 Electrophoregram of PCR product of AOS1 full-length sequence |
2.3 芋头AOS1生物信息学分析
芋头AOS1编码519个氨基酸,编码的蛋白质分子量大小为57.63 kD,理论等电点为8.68。氨基酸残基中,60个氨基酸带负电荷,64个带正电荷。蛋白质的不稳定指数为46.24,是一个不稳定蛋白;脂肪指数为87.92,亲水性指数为-0.108。Plant-mPLoc分析结果显示,芋头AOS1蛋白定位在叶绿体。
在拟南芥等模式植物中对具体基因的功能研究较为深入,基于已有文献分析芋头AOS1基因的潜在功能,比较芋头AOS1与其他植物AOS1蛋白的氨基酸序列一致性,结果(图 3)表明,芋头AOS1与同属天南星科的浮萍(Spirodela intermedia)SiAOS1的同源性最高,序列相似性为74.42%;与拟南芥(Arabidopsis thaliana)、烟草(Nicotiana tabacum)和番茄(Solanum lycopersicum) 等模式植物AOS1蛋白的序列相似性较低,相似性分别为38.50%、67.41%和28.87%,与番茄SlAOS1蛋白的序列相似性最低,与拟南芥AtAOS1蛋白的氨基酸序列一致性差异最大。

|
| 图 3 植物AOS1蛋白序列比对 Fig. 3 Sequence alignment of AOS1 proteins of plant |
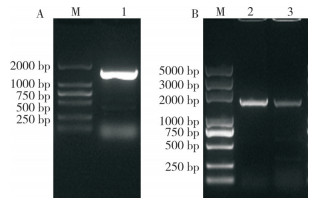
通过同源比对,筛选到与芋头AOS1蛋白同源性较高的植物AOS1蛋白,利用他们构建系统发育树,分析不同植物AOS1蛋白间的亲缘关系。同样,芋头AOS1与同属天南星科的浮萍SiAOS1的亲缘关系最近,聚在同一分支(图 4)。尽管与拟南芥AtAOS1和番茄SlAOS1聚在一大支上,但他们之间的亲缘关系很远,暗示着芋头AOS1可能与拟南芥等模式植物AOS1蛋白的功能有着较大差异。
|
| 芋头AOS1在方框中显示,NCBI登录号显示在蛋白名称后 Taro AOS1 is indicated in the box, and the accession number in the NCBI database is indicated behind each protein 图 4 几种同源性较高的植物AOS1蛋白系统发育分析 Fig. 4 Phylogenetic analysis of AOS1 proteins in several plants with high homology |
2.4 鲜切芋头褐变过程中AOS1表达变化
为探究芋头AOS1基因表达在鲜切芋头褐变过程中的作用,分析了其在鲜切芋头褐变过程中的表达变化及其与褐变指标的相关性。L* 是一个亮度指示指标,L* 值越小,物体表面亮度越低。在低温贮藏期间,鲜切芋头的L* 值逐渐降低(图 5A),表明切面的亮度在贮藏期间下降,鲜切芋头发生了较严重的褐变现象(图 1)。AOS1的表达量在鲜切处理3 d后迅速增加,表明鲜切处理诱导了AOS1表达。在低温贮藏期间,AOS1的表达总体呈增加趋势(图 5B)。相关性分析结果显示,L* 值与AOS1表达呈明显的负相关(图 5C)。

|
| A:鲜切芋头切面亮度(L*);B:AOS1表达模式;C:L* 与AOS1表达的相关性 A: L* value on the surface of fresh-cut taro; B: AOS1 expression pattern; C: Correlation between L* value and AOS1 expression 图 5 AOS1基因在鲜切芋头褐变过程中的表达 Fig. 5 Changes in expression of AOS1 gene during the browning process of fresh-cut taro |
2.5 褐变抑制剂处理对AOS1表达的抑制作用
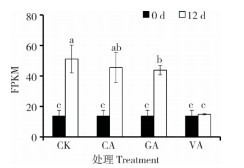
CA、GA和VA是天然的褐变抑制剂,外源处理可有效抑制鲜切芋头褐变[20]。分析0.1 g/L CA、GA和VA浸泡处理30 min对AOS1表达的影响,结果(图 6)表明,处理12 d后,对照(CK) 中AOS1表达量是0 d的3.71倍,再次证实鲜切后AOS1表达量显著增加;CA、GA和VA处理AOS1的表达量仅为CK的0.89、0.86和0.29倍,GA和VA处理中AOS1表达量显著低于CK,表明褐变抑制剂处理能有效抑制AOS1表达,尤其VA处理对AOS1表达的抑制作用最为强烈。这从另一个角度反映AOS1表达可能与鲜切芋头褐变相关。
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the columns represent significant differences 图 6 3种褐变抑制剂处理对AOS1基因表达的影响 Fig. 6 Effects of three browning inhibitors onAOS1 gene expression |
启动子是感受环境变化并直接调控基因表达的重要元件[19]。AOS1在鲜切处理后表达量显著增加,意味着鲜切处理产生的伤信号可能通过启动子中的响应元件调控AOS1表达。为此,在芋头基因组中查找到AOS1基因ATG上游2 053 bp的DNA序列,默认该序列为芋头AOS1基因的启动子序列,提交至PlantCARE网站分析其上的顺式作用元件。启动子序列中含有丰富的TATAbox和CAAT-box等启动子核心元件,证明查找的DNA序列符合启动子特性,是AOS1基因的启动子序列。
AOS1基因启动子序列中含有丰富的逆境响应元件,其中光响应元件(P-box、TCCC-motif、Box 4、Sp1、GT1-motif、G-box和GATA-motif) 数量最多、共11个,说明AOS1表达可能受光照的影响。此外,还鉴定到了多个植物激素响应元件,如2个赤霉素响应元件(GARE-motif和TATC-box)、4个脱落酸响应元件(ABRE)、4个水杨酸响应元件(TCA-element)、1个乙烯响应元件(ERE)(图 7)。启动子中还含有多个反式作用因子结合元件,如4个MYB识别位点(MYB)、2个MYC转录因子识别位点(Myc) 和2个WRKY结合位点(W box),表明AOS1的表达还受转录因子的调控。
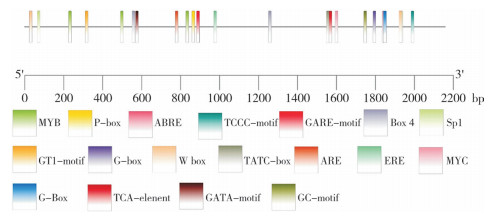
|
| 图 7 芋头AOS1基因启动子中的逆境响应元件 Fig. 7 Stress response elements in the promoter of taro AOS1 gene |
3 讨论
AOS是脂质氧化过程中的关键酶之一,也是通过脂质氧化途径合成JA前体物质的关键酶[21]。细胞膜脂过氧化是导致鲜切果蔬发生褐变的重要原因[22]。因此,克隆芋头AOS1基因并分析其在鲜切芋头褐变过程中的表达变化,明确其在鲜切芋头褐变过程中的作用,对于挖掘关键基因资源具有重要意义。本研究成功克隆了芋头AOS1基因,其编码519个氨基酸残基。芋头AOS1与同属天南星科的浮萍SiAOS1的进化关系最近,序列同源性最高,证明芋头AOS1属于植物AOS家族。但与拟南芥、烟草AOS1蛋白的亲缘关系较远,说明不同植物AOS1蛋白的生物学功能可能存在一定差异,暗示不同植物AOS1功能的多样性[23]。预测结果分析显示芋头AOS1定位在叶绿体,与其他植物AOS1蛋白的定位特性一致[24]。但芋头AOS1蛋白的亚细胞定位结果仍需进一步通过试验确认,因为芋头肉质球茎是淀粉等养分的主要贮藏器官,叶绿体数量不会很丰富。
机械伤诱导植物合成积累酚和黄酮以及醌等褐色物质,是植物对机械损伤作出反应的一种自我防御机制[25]。植物AOS1表达也受到机械伤处理的诱导,但机械伤诱导AOS1表达与鲜切果蔬褐变的关系尚不明确。水稻中含有4个AOSs基因,机械损伤能显著诱导OsAOS1的表达,但未能诱导OsAOS4表达[26]。本研究中,鲜切芋头AOS1在鲜切3 d后急剧增加,表明切分等物理损伤诱导了芋头AOS1表达。在随后的低温贮藏期间,芋头AOS1表达量随贮藏时间延长而逐渐增加,且与L* 值呈显著负相关性。褐变抑制剂处理又能显著抑制芋头AOS1表达,尤其是香草酸处理。以上结果表明,AOS1表达与鲜切芋头褐变密切相关。此外,我们还发现芋头AOS1与木薯AOS1的进化关系也较近,芋头和木薯的主要食用器官均是地下球茎,且在采后或切分后颜色会变黑变褐[27]。暗示着芋头AOS1和木薯AOS1可能具有类似的功能,其在鲜切后褐变发生过程中具有重要促进作用。
植物AOS家族基因的表达受多种因子的调控,启动子中的顺式作用元件是响应环境因子变化的重要元件。甘蔗AOS家族基因的启动子中存在光响应、ABA响应、JA响应、厌氧、干旱等多种胁迫响应元件[11]。与甘蔗AOS家族基因启动子相似,芋头AOS1启动子中含有丰富的光响应、植物激素(ABA、SA、JA、GA、乙烯)响应等逆境响应元件,表明机械伤诱导的激素信号在调控AOS1表达中发挥重要作用。在水稻叶片和茎中,红光和远红光能诱导OsAOS1和OsAOS4表达,其中OsAOS1的转录应答迅速但短暂,而OsAOS4的转录应答缓慢但持久,且OsAOS1的转录上调程度比OsAOS4高很多[26]。表明AOS1表达受光照调控,加之其表达与鲜切芋头褐变的相关性,意味着其可通过调节光照控制鲜切芋头褐变,为鲜切芋头绿色高效褐变防控技术研发提供了思路。此外,芋头AOS1启动子中还含有多个MYB、MYC和WRKY转录因子识别位点,表明芋头AOS1表达还受到MYB等反式作用因子的调控,但具体的转录调控机理尚需深入研究。
4 结论本研究克隆到的芋头AOS1属于植物AOS家族,芋头AOS1与同属天南星科的浮萍SiAOS1的氨基酸序列一致性最高,与模式植物拟南芥等AOS1蛋白的序列一致性较低,表明植物AOS家族基因可能具有丰富多样的生物学功能。鲜切处理诱导芋头AOS1表达,其表达与鲜切芋头褐变呈明显正相关,且褐变抑制剂处理能抑制其表达,证明AOS1表达可能与鲜切芋头褐变有关。芋头AOS1启动子中含有丰富的植物激素和环境响应元件,以及反式作用因子结合位点,表明其表达受到转录因子和植物激素的调控。
| [1] |
MATTHEWS P J. Genetic diversity in taro, and the preservation of culinary knowledge[J]. Ethnobotany Research and Applications, 2004, 2: 55-71. DOI:10.17348/era.2.0.55-71 |
| [2] |
郭巨先, 尹艳, 唐康, 李桂花, 符梅, 罗文龙, 骆善伟, 孙保娟. 芋种质资源研究进展与展望[J]. 广东农业科学, 2021, 48(9): 81-90. DOI:10.16768/j.issn.1004-874X.2021.09.009 GUO J X, YIN Y, TANG K, LI G H, FU M, LUO W L, LUO S W, SUN B J. Research progress and prospect of Colocasia esculenta germplasm resources[J]. Guangdong Agricultural Sciences, 2021, 48(9): 81-90. DOI:10.16768/j.issn.1004-874X.2021.09.009 |
| [3] |
XIAO Y H, HE J M, ZENG J, YUAN X, ZHANG Z M, WANG B. Application of citronella and rose hydrosols reduced enzymatic browning of fresh-cut taro[J]. Journal of Food Biochemistry, 2020, 44(8): e13283. DOI:10.1111/jfbc.13283 |
| [4] |
戴修纯, 罗燕羽, 黄绍力, 刘绍钦, 曹健松. 广东省芋头产业现状与发展对策[J]. 广东农业科学, 2021, 48(6): 126-135. DOI:10.16768/j.issn.1004-874X.2021.06.017 DAI X C, LUO Y Y, HUANG S L, LIU S Q, CAO J S. Present situation and development countermeasures of taro industry in Guangdong province[J]. Guangdong Agricultural Sciences, 2021, 48(6): 126-135. DOI:10.16768/j.issn.1004-874X.2021.06.017 |
| [5] |
张英鹏, 杨运娟, 杨力, 李彦, 高弼模, 王学君, 董晓霞. 植物体内的草酸危害及其调控措施[J]. 安徽农学通报, 2007(10): 34-39. DOI:10.16377/j.cnki.issn1007-7731.2007.10.016.issn1007-7731.2007.10.016 ZHANG Y P, YANG Y J, YANG L, LI Y, GAO B M, WANG X J, DONG X X. Hazard of oxalate in plants and its control manners[J]. Anhui Agricultural Science Bulletin, 2007(10): 34-39. DOI:10.16377/j.cnki.issn1007-7731.2007.10.016.issn1007-7731.2007.10.016 |
| [6] |
王斌, 方美珊, 肖艳辉, 谢景, 何金明. 热处理条件筛选及其提高鲜切芋头贮藏品质的生理机制[J]. 食品工业科技, 2020, 41(10): 284-288. DOI:10.13386/j.issn1002-0306.2020.10.047.j.issn1002-0306.2020.10.047 WANG B, FANG M S, XIAO Y H, XIE J, HE J M. Screening of heat treatment conditions and its physiological mechanism in enhancing storage quality of fresh-cut taro[J]. Science and Technology of Food Industr y, 2020, 41(10): 284-288. DOI:10.13386/j.issn1002-0306.2020.10.047.j.issn1002-0306.2020.10.047 |
| [7] |
王斌, 黄嘉坪, 肖艳辉, 谢景, 何金明. 芳香植物纯露处理对鲜切芋头保鲜效果的影响[J]. 保鲜与加工, 2020, 20(3): 41-46. DOI:10.3969/j.issn.1009-6221.2020.03.007.j.issn.1009-6221.2020.03.007 WANG B, HUANG J P, XIAO Y H, XIE J, HE J M. Effects of hydrosol extracted from aromatic plants on preservation of fresh-cut taro[J]. Storage and Process, 2020, 20(3): 41-46. DOI:10.3969/j.issn.1009-6221.2020.03.007.j.issn.1009-6221.2020.03.007 |
| [8] |
SUI X, MMENG Z, DONG T T, FAN X T, WANG Q G. Enzymatic browning and polyphenol oxidase control strategies[J]. Current Opinion in Biotechnology, 2023, 81: 102921. DOI:10.1016/j.copbio.2023.102921 |
| [9] |
杨坤, 贾文君, 李雯. 3种褐变抑制剂对黄皮果实褐变及抗氧化品质的影响[J]. 中国南方果树, 2021, 50(3): 57-63. DOI:10.13938/j.issn.1007-1431.20200843 YANG K, JIA W J, LI W. Effects of three browning inhibitors on browning and antioxidant characters of wampee fruit[J]. South China Fruits, 2021, 50(3): 57-63. DOI:10.13938/j.issn.1007-1431.20200843 |
| [10] |
LIU X H, XIAO K, ZHANG A D, ZHU W M, ZHANG H, TAN F, HUANG Q R, WU X X, ZHA D S. Metabolomic analysis, combined with enzymatic and transcriptome assays, to reveal the browning resistance mechanism of fresh-cut eggplant[J]. Foods, 2022, 11(8): 1174. DOI:10.3390/foods11081174 |
| [11] |
SUN T, CHEN Y, FENG A, ZOU W H, WANG D J, LIN P X, CHEN Y L, YOU C H, QUE Y X, SU Y C. The allene oxide synthase gene family in sugarcane and its involvement in disease resistance[J]. Industrial Crops and Products, 2023, 192: 116136. DOI:10.1016/j.indcrop.2022.116136 |
| [12] |
YANG L, SUN Q G, GEN B H, SHI J, ZHU H F, SUN Y M, YANG Q, YANG B, GUO Z F. Jasmonate biosynthesis enzyme allene oxide cyclase 2 mediates cold tolerance and pathogen resistance[J]. Plant Physiology, 2023, 1: kiad362. DOI:10.1093/plphys/kiad362 |
| [13] |
LU X, ZHANG F, JIANG W, LIN X Y, CHEN Y F, SHEN Q, WANG T, WU S Y, SUN X F, TANG K X. Characterization of the first specific jasmonate biosynthetic pathway gene allene oxide synthase from Artemisia annua[J]. Molecular Biology Reports, 2012, 39: 2267-2274. DOI:10.1007/s11033-011-0976-y |
| [14] |
HAZMAN M, HAUSE B, EICHE E, NICK P, RIEMANN M. Increased tolerance to salt stress in OPDA-deficient rice ALLENE OXIDE CYCLASE mutants is linked to an increased ROS-scavenging activity[J]. Journal of Experimental Botany, 2015, 66(11): 3339-3352. DOI:10.1093/jxb/erv142 |
| [15] |
SERRAZINA S, MACHADO H, CPSTA R L, DUQUE P, MALHO R. Expression of Castanea crenata allene oxide synthase in Arabidopsis improves the defense to Phytophthora cinnamomi[J]. Frontiers in Plant Science, 2021, 12: 628697. DOI:10.3389/fpls.2021.628697 |
| [16] |
WANG C, AVDIUSHKO S, HILDEBRAND D F. Overexpression of a cytoplasm-localized allene oxide synthase promotes the woundinduced accumulation of jasmonic acid in transgenic tobacco[J]. Plant Molecular Biology, 1999, 40(5): 783-793. DOI:10.1023/a:1006253927431 |
| [17] |
PARK J H, HALITSCHKE R, KIM H B, BALDWIN I T, FELDMANN K A, FEYEREISEN R. A knock-out mutation in allene oxide synthase results in male sterility and defective wound signal transduction in Arabidopsis due to a block in jasmonic acid biosynthesis[J]. Plant Journal, 2002, 31(1): 1-12. DOI:10.1046/j.1365-313x.2002.01328.x |
| [18] |
陈丽兰, 王亚如, 郭燕芳, 邓祖湖, 王锦达. 甘蔗丙二烯氧化物合成酶ScAOS的克隆与表达分析[J]. 分子植物育种, 2021, 19(11): 3549-3558. DOI:10.13271/j.mpb.019.003549.j.mpb.019.003549 CHEN L L, WANG Y R, GUO Y F, DENG Z H, WANG J D. Cloning and expression analysis of sugarcane allene oxide synthase ScAOS[J]. Molecular Plant Breeding, 2021, 19(11): 3549-3558. DOI:10.13271/j.mpb.019.003549.j.mpb.019.003549 |
| [19] |
王斌, 黄泳谚, 易景怡, 原远. 黄瓜GR-RBP3启动子克隆及低温对其活性的诱导[J]. 山东农业科学, 2022, 54(7): 15-23. DOI:10.14083/j.issn.1001-4942.2022.07.003 WANG B, HUANG Y Y, YI J Y, YUAN Y. Molecular cloning of cucumber GR-RBP3 promoter and the induction of low temperature on its activity[J]. Shandong Agricultural Sciences, 2022, 54(7): 15-23. DOI:10.14083/j.issn.1001-4942.2022.07.003 |
| [20] |
XIAO Y H, ZHANG J L, JIANG Y Y, YUAN Y, XIE J, HE J M, WANG B. Cinnamic acid treatment reduces the surface browning of fresh-cut taro[J]. Scientia Horticulturae, 2022, 291: 110613. DOI:10.1016/j.scienta.2021.110613 |
| [21] |
RUSTGI S, SPRINGER A, KANG C, WETTSTEIN D, REINBOTHE C, REINBOTHE S, POLLMANN S. ALLENE OXIDE SYNTHASE and HYDROPEROXIDE LYASE, two non-canonical cytochrome P450s in Arabidopsis thaliana and their different roles in plant defense[J]. International Journal of Molecular Science, 2019, 20(12): 3064. DOI:10.3390/ijms20123064 |
| [22] |
ZHU L, HU W, MURTAZA A, IQBAL A, KONG M J, ZHANG J, LI J X, XU X Y, PAN S Y. Browning inhibition in fresh-cut Chinese water chestnut under high pressure CO2 treatment: Regulation of reactive oxygen species and membrane lipid metabolism[J]. Food Chemistry, 2023, 427: 136586. DOI:10.1016/j.foodchem.2023.136586 |
| [23] |
FARMER E E, GOOSSENS A. Jasmonates: What allene oxide synthase does for plants[J]. Journal of Experimental Botany, 2019, 70(13): 3373-3378. DOI:10.1093/jxb/erz254 |
| [24] |
SIGUERIRA-JUNIOR C L, JARDIM B C, URMENYI T P, VICENTE A C, HANSEN E, OTSUKI K, D A CUNHA M, MADUREIRA H C, DE CARVALHO D R, JACINTO T. Wound response in passion fruit (Passiflora f. edulis flavicarpa) plants: gene characterization of a novel chloroplast-targeted allene oxide synthase up-regulated by mechanical injury and methyl jasmonate[J]. Plant Cell Report, 2008, 27(2): 387-397. DOI:10.1007/s00299-007-0451-3 |
| [25] |
IAKIMOVA E T, WOLTERING E J. The wound response in fresh-cut lettuce involves programmed cell death events[J]. Protoplasma, 2018, 255(4): 1225-1238. DOI:10.1007/s00709-018-1228-y |
| [26] |
HAGA K, ⅡNO M. Phytochrome-mediated transcriptional upregulation of ALLENE OXIDE SYNTHASE in rice seedlings[J]. Plant and Cell Physiology, 2004, 45(2): 119-128. DOI:10.1093/pcp/pch025 |
| [27] |
ZENG J, WANG C, DING Z H, WANG B, LIU Y J, GUO J, CHEN J, WU C L, TIE W W, YAN Y, PENG H Y, HU W. Identification and functional prediction of lncRNAs during cassava post-harvest physiological deterioration[J]. Agronomy Journal, 2020, 112(6): 4914-4925. DOI:10.1002/agj2.20343 |
(责任编辑 邹移光)
 2023, Vol. 50
2023, Vol. 50