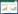文章信息
基金项目
- 国家自然科学基金项目(31801607, 32360785);广西自然科学基金项目(2020GXNSFAA259087);广西科技基地和人才专项(桂科AD23026269, 桂科AD23026036);贺州学院博士教授科研启动基金(2023JSQD03, HZUBS202106)
作者简介
-
宋慕波(1986—),博士,贺州学院食品与生物工程学院研究员,广西水生蔬菜保鲜与加工工程研究中心主任。2014年毕业于华南农业大学园艺学院,主要从事桂东北特色果蔬采后保鲜技术研发和采后品质变化分子机理研究。受聘于大连工业大学、广西科技大学和华南农业大学等院校硕士研究生导师。主持国家自然科学基金项目2项、广西自然科学基金4项和贺州市科技研发项目1项,参与省部级以上科研项目10余项。以第一或通信作者在《Postharvest Biology and Technology》《Scientia Horticultuae》等期刊发表论文30余篇;获授权国家发明专利2件。
宋慕波(1986—),男,博士,研究员,研究方向为果蔬加工与保鲜,E-mail:songmubo1@163.com.
通讯作者
- 陈振林(1963—),男,硕士,研究员,研究方向为农产品贮藏与加工,E-mail:18878479986@163.com.
文章历史
- 收稿日期:2023-10-28
2. 广西科技大学生物与化学工程学院,广西 柳州 545616;
3. 桂林爱明生态农业开发有限公司,广西 桂林 546601
2. College of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou 545616, China;
3. Guilin Aiming Ecological Agriculture Delvelopment Co., Ltd., Guilin 546601, China
【研究意义】荸荠(Eleocharis tuberosa)俗名马蹄,属莎草科浅水生草本植物,其肉质球茎富含淀粉和多糖,是主要的可食部位[1]。我国是荸荠种植大国,荸荠产量占世界总产量的90% 以上,其中广西、广东、安徽和福建地区均有种植[2-3]。荸荠球茎形状不规则且外皮较厚,食用或加工前的削皮处理较为困难,因此预先进行削皮和切分处理的鲜切荸荠深受市场欢迎。然而,鲜切荸荠的保鲜较为困难,尤其是贮藏过程中极易出现的黄化现象严重影响产品的外观品质[4]。探讨鲜切荸荠产品的色泽劣变机理和寻找有效的护色处理方法一直是研究热点。【前人研究进展】鲜切荸荠的黄化现象与传统多酚氧化酶(Polyphenol oxidase, PPO)和过氧化物酶(Peroxidase, POD)参与的氧化酶促褐变在发生机制上可能存在差异[5-6]。研究者通过分离和鉴定鲜切荸荠黄化部位的物质发现,柚皮素和圣草酚两种黄酮类物质的积累是导致黄化的主要原因[7]。抗坏血酸处理虽能抑制PPO活性,但并不能有效延缓鲜切荸荠的黄化[8-9]。同时,鲜切荸荠的黄化程度与黄酮代谢相关酶活性和关键基因的表达呈显著的相关性[10]。以上研究结果表明鲜切荸荠的黄化现象与果蔬传统的氧化酶促褐变不同,黄酮类物质的积累是其黄化的主要原因。目前抑制荸荠黄化的相关研究较少,寻找合适的黄化抑制剂对延长鲜切荸荠保鲜期具有重要意义。【本研究切入点】由于化学保鲜剂对人体健康有潜在危害,更安全的植物源保鲜剂是保鲜行业研究的热点,从植物根、茎、叶等组织中提取的活性物质在鲜切果蔬保鲜中的应用具有巨大潜力[11-13]。米糠是碾米加工过程的副产物,米糠和脱脂米糠中富含角鲨烯、植酸、肉桂酸、香豆酸、阿魏酸、肌醇和六磷酸等植物源抗氧化物质[14]。已有研究表明,米糠提取物处理可有效抑制鲜切果蔬的色泽劣变,如米糠提取物处理可以显著抑制鲜切马铃薯和苹果的褐变[15]。米糠提取物中富含的阿魏酸、肉桂酸等物质能有效抑制褐变相关PPO活性[15]。且米糠成本低廉,米糠提取物处理在鲜切果蔬护色保鲜领域有较大的应用潜力。目前,米糠提取物对鲜切荸荠的护色效果尚未进行深入研究。【拟解决的关键问题】本研究以鲜切荸荠为研究材料,通过分析米糠提取物处理对鲜切荸荠贮藏过程中的色泽、黄酮含量、黄酮代谢关键酶活性和基因表达的影响,研究米糠提取物对鲜切荸荠黄化的抑制效果及其可能机制,为市场上鲜切荸荠的保鲜和护色处理提供参考。
1 材料与方法 1.1 试验材料荸荠在2023年4月5日购于广西贺州市平桂区农产品市场。原料运回实验室用10 g/L次氯酸钠溶液浸泡5 min,清洗后选用大小均一、无机械损伤和病害的荸荠球茎用于后续研究。将荸荠球茎去皮并横切成0.5 cm厚度的圆片,鲜切荸荠分成2组,每组160片,对照组在清水中浸泡5 min,处理组用米糠提取物溶液浸泡5 min,沥干水分后置于塑料托盘中,每个托盘放8片,每组共用20个托盘,用0.02 mm聚乙烯保鲜膜包装,于10℃条件下贮藏。贮藏第0、2、4、6 d测定相关指标,并将部分样品置于-80℃超低温冰箱速冻,用于后续基因表达分析。
1.2 试验方法1.2.1 米糠提取物溶液制备 米糠购买于广西贺州市农资批发城,为全脂米糠,由新鲜稻谷的谷壳和米皮现磨制成。米糠运至实验室后立即进行成分提取,经45 ℃热风干燥后过孔径为180 μm筛,将过筛后的米糠加入水中,其中米糠质量占比为3%。用超声助提米糠中的活性成分(超声功率30 KHz),45 ℃提取120 min,将提取液过滤后用于鲜切荸荠浸泡处理。
1.2.2 鲜切荸荠色度测定 采用3 nh色差仪测定鲜切荸荠贮藏过程中的色度变化。色差仪经白板校正后,选择每个荸荠切片的中心点进行测定,每个样品测定3个点,每组测定6个样品,取平均值。选用L* 值和b* 值反映鲜切荸荠贮藏过程中的颜色变化。
1.2.3 鲜切荸荠总黄酮含量测定 称取鲜切荸荠组织5 g,加入10 mL 80% 无水乙醇,25℃水浴震荡提取2 h,提取液经4 000 r/min离心10 min,取上清液备用。总黄酮含量测定体系为1 mL酶粗提取液和0.3 mL 5%NaNO2溶液,静置6 min后再加入0.3 mL 10% Al(NO3)3溶液,摇匀,静置6 min后加入2 mL 4%NaOH溶液,摇匀静置15 min后在510 nm处测定吸光值。以每克鲜切荸荠果肉组织在510 nm处的吸光值为总黄酮含量,结果用mg/g表示,测定重复3次。
1.2.4 酶活性测定 PPO活性的测定采用邻苯二酚法[16]并稍作调整。准确称取鲜切荸荠组织5 g,加入30 mL 0.05 mol/L磷酸缓冲液(pH6.8),经研磨和过滤获得粗酶液。取3 mL配好的邻苯二酚和PBS混合液加入粗酶液中,测定410 nm波长处OD值在5 min内的变化,测定重复3次。以每分钟吸光度变化0.01表示1个活性单位。
PAL活性测定参照Peng等[17]方法略作修改。准确称取鲜切荸荠组织5 g用于粗酶液提取。取4 mL配好的20 mmol/L L- 苯丙氨酸和硼酸缓冲液混合液,加入0.5 mL粗酶液,置于37 ℃水浴锅中保温60 min,立即加入0.2 mL 6 mol/L HCl终止反应。采用超微量分光光度计测定290 nm处样品的OD值,以每分钟吸光度变化0.01表示1个活性单位。
1.2.5 鲜切荸荠样品总RNA提取 不同贮藏时间的鲜切荸荠样品总RNA的提取采用华越洋公司高效植物RNA提取试剂盒。采用K5600型超微量分光光度计分析所得RNA的浓度和质量。不同贮藏时间的RNA样品经反转录成cDNA用于后续基因表达分析。
1.2.6 基因表达分析 荸荠黄酮代谢相关基因的表达分析采用伯乐CFX Connect荧光定量PCR系统进行检测,反应过程中的扩增曲线、溶解曲线、标准曲线由仪器自带软件自动生成。以荸荠18S rRNA(登录号:MG742686)为内参,利用2-ΔΔCt方法计算鲜切荸荠CwPAL、CwCHS、CwC4H、CwF3H、CwMYB12和CwMYC2基因在贮藏过程中的表达量变化,所用引物见表 1。荧光定量PCR反应体系参考TaKaRa公司SYBR Green qPCR Master Mix试剂盒说明书进行,反应体系为25 μL。各样品的表达量均为3次生物学重复的平均值。
1.2.7 数据分析 使用Origin 2018对色度、黄酮含量、酶活性和基因表达量进行数据处理。使用SPSS 19.0进行差异显著性分析。所有数据为3次重复试验的平均值和标准误差。
2 结果与分析 2.1 米糠提取物处理对鲜切荸荠贮藏过程中色泽变化的影响由图 1可知,对照组和米糠提取物处理组鲜切荸荠表面亮度L* 值随贮藏时间的延长均呈下降趋势。贮藏至6 d时,对照组鲜切荸荠L* 值从0 d的75.32下降至55.64;而经米糠提取物处理的鲜切荸荠L* 值在贮藏4 d后显著高于对照(P < 0.05),且到6 d时L* 值仍维持在70以上。对照组鲜切荸荠b* 值在贮藏过程中呈快速上升趋势,贮藏6 d时b* 值上升到45.57、是0 d的2.3倍;米糠提取物处理组b* 值未显著提高,贮藏6 d时b* 值为20.62、显著低于对照组(P < 0.05)。以上结果表明,对照组鲜切荸荠在贮藏过程中快速黄化,而米糠提取物处理可显著延缓黄化。

|
| * 表示不同处理间差异显著(P<0.05) * represents significant difference between treatments (P < 0.05) 图 1 米糠提取物处理对鲜切荸荠L* 值和b* 值的影响 Fig. 1 Effects of rice bran extract treatments on L* and b* values of fresh-cut Chinese water chestnut |
2.2 米糠提取物处理对鲜切荸荠贮藏过程中总黄酮含量的影响
与PPO和POD参与的氧化酶促褐变不同,鲜切荸荠黄化主要由以柚皮素和圣草酚等黄酮类物质的积累导致的。鲜切荸荠贮藏过程中黄酮含量的变化如图 2所示,对照组鲜切荸荠的黄酮含量随着贮藏时间的延长快速提高,至贮藏6 d时组织中的总黄酮含量为0.377 mg/g、是0 d时的2.96倍。经米糠提取物处理后的鲜切荸荠总黄酮含量在贮藏6 d时间内未出现显著提高,在4 d和6 d时均显著低于对照组(P < 0.05)。以上结果表明,米糠提取物处理显著抑制了鲜切荸荠组织中黄酮类物质的积累。
|
| * 表示不同处理间差异显著(P<0.05) * represents significant difference between treatments (P < 0.05) 图 2 米糠提取物处理对鲜切荸荠组织中总黄酮含量的影响 Fig. 2 Effect of rice bran extracts treatment on total flavonoids content of fresh-cut Chinese water chestnut |
2.3 米糠提取物处理对鲜切荸荠贮藏过程中PPO和PAL活性的影响
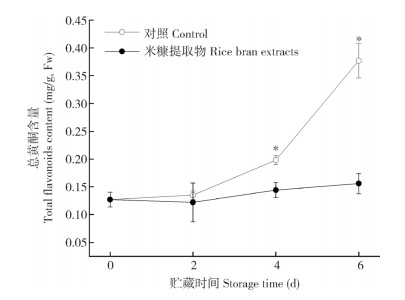
鲜切荸荠PPO和PAL活性在贮藏过程中的变化如图 3所示。对照组鲜切荸荠PPO活性在贮藏前期呈先下降后上升的趋势,由0 d的52.6 U/g下降至贮藏4 d时的40.7 U/g,贮藏6 d时上升至48.9 U/g;米糠提取物处理组PPO活性变化趋势与对照组相同,但贮藏2~6 d时其PPO活性均显著低于对照组。与PPO不同,对照组PAL活性在贮藏2 d后快速上升,6 d时PAL活性达71.03 U/g、是0 d的3倍;经米糠提取物处理的鲜切荸荠PAL活性受到显著抑制,在整个贮藏过程中未出现显著上升。以上结果表明,米糠提取物处理能显著抑制PPO和PAL的活性,而PAL活性在贮藏过程中快速上升,相较于PPO其与黄化呈现更显著的相关性。
|
| * 表示不同处理间差异显著(P<0.05) * represents significant difference between treatments (P < 0.05) 图 3 米糠提取物处理对鲜切荸荠组织中PPO和PAL活性的影响 Fig. 3 Effects of rice bran extract treatments on PPO and PAL activities of fresh-cut Chinese water chestnut |
2.4 米糠提取物处理对鲜切荸荠贮藏过程中黄酮代谢关键基因表达的影响
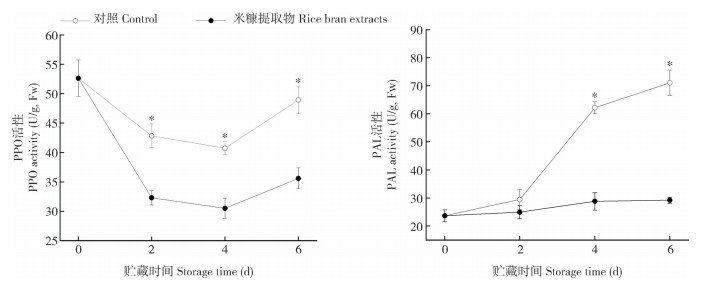
植物的黄酮合成和积累受黄酮代谢关键基因表达水平的显著影响。荸荠黄酮代谢关键基因表达水平如图 4所示,对照组CwPAL、CwC4H、CwCHI和CwCHS等4个黄酮合成关键基因在贮藏过程中呈现相似的表达模式,即在贮藏初期快速上升、至贮藏后期开始下降或上升速度降低,其中CwCHS表达的上升幅度最大。米糠提取物处理对4个基因的表达均有显著的抑制作用,在贮藏2 d和4 d时米糠处理组4个基因的表达水平均显著低于对照组(P < 0.05)。以上结果表明,米糠提取物处理能显著抑制切削处理后荸荠组织中黄酮代谢相关基因的表达。

|
| * 表示不同处理间差异显著(P<0.05) * represents significant difference between treatments (P < 0.05) 图 4 米糠提取物处理对鲜切荸荠黄化过程中CwPAL、CwC4H、CwCHI和CwCHS基因表达的影响 Fig. 4 Effects of rice bran extract treatments on relative expression of CwPAL, CwC4H, CwCHI and CwCHS during yellowing of fresh-cut Chinese water chestnut |
2.5 米糠提取物处理对鲜切荸荠贮藏过程中黄酮合成相关转录因子表达的影响
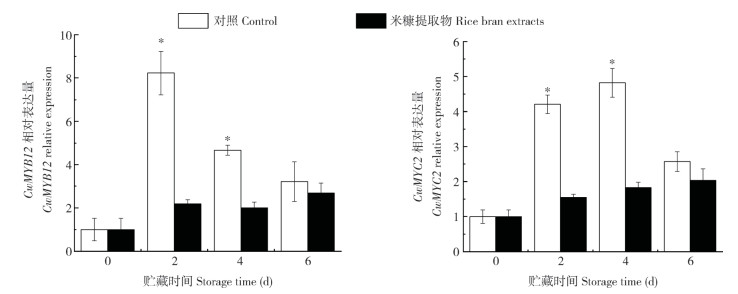
在外界环境因素影响下植物黄酮代谢的结构基因受到多种转录因子的复杂调控。参与黄酮代谢调控的转录因子CwMYB12和CwMYC2的表达水平如图 5所示。对照组CwMYB12的表达在贮藏2 d时快速上升后逐渐下降,但均高于0 d时的表达水平。米糠提取物处理组MYB 12的表达水平在贮藏2 d和4 d时均显著低于对照组(P < 0.05)。对照组CwMYC2表达也在贮藏初期显著上调,其表达水平最高值出现在贮藏第4 d。米糠提取物处理组CwMYC2的表达水平的上升受到抑制,在贮藏2 d和4 d时均显著低于对照组(P < 0.05)。以上结果表明,米糠提取物处理显著抑制了黄酮代谢调控相关转录因子的表达。
|
| * 表示不同处理间差异显著(P<0.05) * represents significant difference between treatments (P < 0.05) 图 5 米糠提取物处理对鲜切荸荠黄化过程中CwMYB12和CwMYC2基因表达的影响 Fig. 5 Effects of rice bran extract treatments on relative expression of CwMYB12 and CwMYC2 during yellowing of fresh-cut Chinese water chestnut |
3 讨论
鲜切荸荠贮藏过程中表面极易黄化,但荸荠球茎的黄化现象与传统果蔬的氧化酶促褐变存在差异。最明显的差异是荸荠黄化后果肉呈淡黄色,极少产生传统酶促褐变的褐色产物[18-19]。常规褐变抑制剂如抗坏血酸、柠檬酸和半胱氨酸,虽然均能显著抑制荸荠贮藏过程中PPO和POD活性上升,但并不能有效抑制荸荠黄化。本研究结果发现,米糠提取物处理能有效抑制鲜切荸荠的黄化,抑制b* 值的上升和L* 值的下降。同时,经米糠提取物处理后鲜切荸荠组织中的总黄酮含量也显著降低。机械伤经复杂的信号转导最终显著提高鲜切果蔬的次生代谢,黄酮等次生代谢产物会在组织中积累[20-21]。本研究也发现对照组鲜切荸荠在贮藏过程快速积累导致表面出现黄化现象,而米糠提取物则在抑制黄酮合成的同时延缓了黄化,进一步证实了黄化现象与黄酮积累的相关性。
PPO在果蔬氧化酶促褐变中起关键作用,其活性变化与果蔬褐变程度关系密切[22-23]。然而,荸荠组织中缺少PPO的底物,且本研究也发现鲜切荸荠PPO活性在黄化逐渐出现的前期呈下降趋势[24]。贮藏后期PPO活性出现的小幅提高可能与荸荠组织的进一步衰老和水分减少有关。外源抗坏血酸处理能有效抑制鲜切荸荠贮藏过程中的PPO活性,但不能延缓荸荠的黄化[9]。以上结果表明PPO在荸荠的色泽劣变过程中可能不起主要作用。PAL是苯丙烷代谢途径入口的限速酶,与植物抗性密切相关,在机械伤害刺激信号转导途径中受到复杂的调控[25]。鲜切果蔬受机械损伤后,受伤组织PAL活性会迅速升高,促进伤口的木质化和愈合[26]。米糠提取物能够抑制鲜切苹果和鲜切马铃薯的色泽劣变是由于其具有还原性且能有效抑制PPO活性[15]。然而,鲜切荸荠的黄化可能与PAL活性的变化更具相关性。以往研究发现,抗坏血酸和阿魏酸处理均能抑制鲜切荸荠的PPO活性,但只有阿魏酸能有效延缓黄化,推测这可能与其可抑制PAL活性相关[9]。本研究发现米糠提取物处理能显著抑制PPO和PAL的活性,且PAL活性与黄化呈现更显著的相关性。
机械伤诱导黄酮代谢关键酶活性的提高是通过调控其编码基因合成新酶实现的,米糠提取物处理对果蔬次生代谢相关基因表达的影响尚不清楚。鲜切果蔬经切削处理后在贮藏过程中仍然具有较强的适应性与调节能力,通过复杂的信号传导激活次生代谢[27]。本研究发现米糠提取物能显著抑制鲜切荸荠黄酮代谢关键结构基因CwPAL、CwC4H、CwCHI和CwCHS的表达。有研究利用转录组数据分析发现,鲜切荸荠在贮藏过程中黄酮合成途径中大量结构基因表达出现显著上调[10],这与本研究结果相似。高等植物基因表达特性依赖于转录因子和顺式作用元件的协同作用,MYBs是最大的植物转录因子家族之一,参与调控植物的次生代谢、环境因子的应答等生理过程[28]。MYB家族成员参与机械伤和强光胁迫的应答,并直接参与黄酮代谢关键结构基因的调控[29]。荸荠的CwMYB12转录因子是MYB第七亚族成员,参与黄酮的合成调控[18]。MYC2是IIIe类的bHLH转录因子,是茉莉酸信号转导的核心元件,介导了茉莉酸信号在多种代谢过程中的转录调控[30-31]。MYC2可激活黄酮代谢相关的MYBs转录因子的表达进而对黄酮合成进行调控。本研究发现米糠提取物处理可以抑制CwMYB12和CwMYC2的表达,这与多个结构基因表达下调的结果一致,表明米糠提取物浸泡处理存在对黄酮代谢分子层面的调控。富氢水处理鲜切荸荠能显著抑制CwMYB12的表达从而延缓鲜切荸荠黄化[18],这与本研究结果一致。米糠提取物中包含多种成分,其中哪些成分参与了鲜切荸荠黄酮代谢的分子调控值得进一步深入研究。
4 结论米糠提取物浸泡处理可有效延缓鲜切荸荠贮藏过程中的黄化现象,在贮藏6 d时间内未出现明显的色泽劣变。米糠提取物处理能显著抑制鲜切荸荠PPO和PAL的活性,PPO活性在鲜切荸荠黄化过程中呈先下降后上升趋势,从贮藏0 d的52.6 U/g下降至6 d时的48.9 U/g,而PAL活性与黄化呈现更显著的相关性。对照组鲜切荸荠贮藏6 d时的总黄酮含量为0.377 mg/g、是0 d时的2.96倍,而米糠提取物处理对鲜切荸荠组织中黄酮类物质的积累有显著抑制作用。米糠提取物处理显著下调了黄酮合成相关的4个结构基因的表达,并显著抑制上游参与黄酮合成调控的CwMYB12和CwMYC2两个转录因子的表达,表明其对鲜切荸荠的黄酮代谢存在分子水平的调控。上述结果为进一步阐明荸荠黄化的分子机理提供基础,并为鲜切荸荠的保鲜和护色处理提供参考。
| [1] |
李飞, 李洁, 严守雷. 荸荠采后贮藏保鲜研究进展[J]. 长江蔬菜, 2022(14): 27-33. DOI:10.3865/j.issn.1001-3547.2022.14.010 LI F, LI J, YAN S L. Research progress on postharvest storage and preservation of water chestnut[J]. Journal of Chang jiagn Vegetables, 2022(14): 27-33. DOI:10.3865/j.issn.1001-3547.2022.14.010 |
| [2] |
赵若男, 陈振林, 玉万国, 许薇, 刘英健, 宋慕波. 荸荠淀粉分支酶CwSBEII基因的克隆及其表达分析[J]. 福建农业学报, 2022, 37(12): 1546-1553. DOI:10.19303/j.issn.1008-0384.2022.012.005 ZHAO R N, CHEN Z L, YU W G, XU W, LIU Y J, SONG M B. Cloning and expression of CwSBEII in Eleocharis tuberosa[J]. Fujian Journal of Agricultural Sciences, 2022, 37(12): 1546-1553. DOI:10.19303/j.issn.1008-0384.2022.012.005 |
| [3] |
赵广河, 陈振林. 鲜切荸荠研究进展[J]. 食品研究与开发, 2012, 33(1): 197-200. DOI:10.3969/j.issn.1005-6521.2012.01.055 ZHAO G H, CHEN Z L. Study on fresh-cut Chinese water chestnut[J]. Food Research and Development, 2012, 33(1): 197-200. DOI:10.3969/j.issn.1005-6521.2012.01.055 |
| [4] |
PENG L T, JIANG Y M. Exogenous salicylic acid inhibits browning of fresh-cut Chinese water chestnut[J]. Food Chemistry, 2006, 94(4): 535-540. DOI:10.1016/j.foodchem.2004.11.047 |
| [5] |
陈夏鑫, 陈振林, 帅良, 段振华, 商飞飞, 宋慕波. 荸荠CCoAOMT基因的克隆与表达分析[J]. 分子植物育种, 2020, 18(20): 6685-6691. DOI:10.13271/j.mpb.018.006685 CHEN X X, CHEN Z L, SHUAI L, DUAN Z H, SHANG F F, SONG M B. Cloning and expression analysis of CCoAOMT gene in chinese water-chestnut[J]. Molecular Plant Breeding, 2020, 18(20): 6685-6691. DOI:10.13271/j.mpb.018.006685 |
| [6] |
XU Y H, YI Y, AI Y W, HOU W F, WANG L M, WANG H X, MIN T. Ethephon and 1-methylcyclopropene regulate storage quality and browning of fresh-cut Chinese water chestnuts[J]. Postharvest Biology and Technology, 2023, 200: 112331. DOI:10.1016/j.postharvbio.2023.112331 |
| [7] |
PAN Y G, LI Y X, YUAN M Q. Isolation, purification and identification of etiolation substrate from fresh-cut Chinese waterchestnut (Eleocharis tuberosa)[J]. Food Chemistry, 2015, 186: 119-122. DOI:10.1016/j.foodchem.2015.03.070 |
| [8] |
JIANG Y, PEN L, LI J. Use of citric acid for shelf life and quality maintenance of fresh-cut Chinese water chestnut[J]. Journal of Food Engineering, 2004, 63(3): 325-328. DOI:10.1016/j.jfoodeng.2003.08.004 |
| [9] |
SONG M B, WU S J, SHUAI L, DUAN Z H, CHEN Z L, SHANG F F, FANG F. Effects of exogenous ascorbic acid and ferulic acid on the yellowing of fresh-cut Chinese water chestnut[J]. Postharvest Biology and Technology, 2019, 148: 15-21. DOI:10.1016/j.postharvbio.2018.10.005 |
| [10] |
SONG M B, SHUAI L, HUANG S Q, WU S J, CAO X H, DUAN Z H, CHEN Z L, FANG F. RNA-Seq analysis of gene expression during the yellowing developmental process of fresh-cut Chinese water chestnuts[J]. Scientia Horticulturae, 2019(250): 421-431. DOI:10.1016/j.scienta.2019.02.081 |
| [11] |
李睿, 钟正泽, 王海燕. 植物源生物保鲜剂在动物食品应用中的研究进展[J]. 农产品加工, 2019(5): 66-67, 70. DOI:10.16693/j.cnki.1671-9646(X).2019.05.019 LI R, ZHONG Z Z, WANG H Y. Advances in the application of botanical biopreservatives in animal food[J]. Farm Products Processing, 2019(5): 66-67, 70. DOI:10.16693/j.cnki.1671-9646(X).2019.05.019 |
| [12] |
CHEN J Y, SHEN Y T, CHEN C Y, WAN C P. Inhibition of key citrus postharvest fungal strains by plant extracts in vitro and in vivo: A Review[J]. Plants(Basel), 2019, 8(2): 26. DOI:10.3390/plants8020026 |
| [13] |
NCAMA K, MAGWAZA L S, MDITSHWA A, TESFAY S Z. Plantbased edible coatings for managing postharvest quality of fresh horticultural produce: A review[J]. Food Packaging and Shelf Life, 2018, 16: 157-167. DOI:10.1016/j.fpsl.2018.03.011 |
| [14] |
JUN H L, SONG G S, YANG E L, YONG Y, KIM Y S. Antioxidant activities and phenolic compounds of pigmented rice bran extracts[J]. Journal of Food Science, 2012, 77(7): 759-764. DOI:10.1111/j.1750-3841.2012.02763.x |
| [15] |
SUKHONTHARA S, KAEWKA K, THEERAKULKAIT C. Inhibitory effect of rice bran extracts and its phenolic compounds on polyphenol oxidase activity and browning in potato and apple puree[J]. Food Chemistry, 2016, 190: 922-927. DOI:10.1016/j.foodchem.2015.06.016 |
| [16] |
胡晓华, 陈振林, 帅良, 刘云芬, 许薇, 宋慕波. 真空充氮包装对鲜切荸荠护色效果的研究[J]. 食品科技, 2021, 46(12): 49-54. DOI:10.13684/j.cnki.spkj.2021.12.008 HU X H, CHEN Z L, SHUAI L, LIU Y F, XU W, SONG M B. Effect of nitrogen-filled vacuum packaging on color protection of fresh-cut Chinese water chestnut[J]. Food Science and Technology, 2021, 46(12): 49-54. DOI:10.13684/j.cnki.spkj.2021.12.008 |
| [17] |
PENG L T, JIANG Y M. Exogenous salicylic acid inhibits browning of fresh-cut Chinese water chestnut[J]. Food Chemistry, 2006, 94(4): 535-540. DOI:10.1016/j.foodchem.2004.11.047 |
| [18] |
LI F J, HU Y, SHAN Y X, LIU J, DING X C, DUAN X W, ZENG J Q, JIANG Y M. Hydrogen-rich water maintains the color quality of freshcut Chinese water chestnut[J]. Postharvest Biology and Technology, 2022, 183: 111743. DOI:10.1016/j.postharvbio.2021.111743 |
| [19] |
NIE H, LUO Y H, HUANG S Q, MO Y W, HUANG Z L, LIAO Y M, JIANG L R, CAI W, SONG M B. Identification of two terpenoids that accumulate in Chinese water chestnut in response to fresh-cut processing[J]. Food Science and Nutrition, 2023, 11: 5166-5173. DOI:10.1002/fsn3.3475 |
| [20] |
SALTVEIT M E. The three responses of plant tissue to wounding[J]. Acta Horticulturae, 2016(1141): 13-20. DOI:10.17660/ActaHortic.2016.1141.2 |
| [21] |
SUN Y, GAO M, KANG S C, YANG C M, MENG H, YANG Y, ZHAO X S, GAO Z H, XU Y H, JIN Y, ZHAO X H, ZHANG Z, HAN J P. Molecular mechanism underlying mechanical woundinginduced flavonoid accumulation in Dalbergia odorifera T. Chen, an endangered tree that produces Chinese rosewood[J]. Genes, 2020, 11(5): 478. DOI:10.3390/genes11050478 |
| [22] |
MOON K M, KWON E B, LEE B, KIM C Y. Recent trends in controlling the enzymatic browning of fruit and vegetable products[J]. Molecules, 2020, 25(12): 2754. DOI:10.3390/molecules25122754 |
| [23] |
刘明, 刘海峰, 周慧, 何焕清, 肖自添, 罗学梅. 草菇多酚氧化酶基因的克隆与表达分析[J]. 广东农业科学, 2021, 48(9): 91-97. DOI:10.16768/j.issn.1004-874X.2021.09.010 LIU M, LIU H F, ZHOU H, HE H Q, XIAO Z T, LUO X M. Cloning and expression analysis of polyphenol oxidase gene family in Volvariella volvacea[J]. Guangdong Agricultural Sciences, 2021, 48(9): 91-97. DOI:10.16768/j.issn.1004-874X.2021.09.010 |
| [24] |
YOU Y L, JIANG Y M, SUN J, LIU H, SONG L L, DUAN X W. Effects of short-term anoxia treatment on browning of fresh-cut Chinese water chestnut in relation to antioxidant activity[J]. Food Chemistry, 2012, 132(3): 1191-1196. DOI:10.1016/j.foodchem.2011.11.073 |
| [25] |
DEGLINNOXWNTI E, PARSOSSI A, TOGNONI F, GUIDI L. Physiological basis of sensitivity to enzymatic browning in 'lettuce', 'escarole' and 'rocket salad' when stored as fresh-cut products[J]. Food Chemistry, 2007, 104(1): 209-215. |
| [26] |
KE D Y, SALTVEIT M E. Wound-induced ethylene production, phenolic metabolism and susceptibility to russet spotting in iceberg lettuce[J]. Physiologia Plantarum, 2006, 76(3): 412-418. DOI:10.1111/j.1399-3054.1989.tb06212.x |
| [27] |
穆师洋, 胡文忠, 姜爱丽. 水杨酸的信号分子作用及其在鲜切果蔬中的应用[J]. 食品安全质量检测学报, 2015(7): 2434-2438. DOI:10.19812/j.cnki.jfsq11-5956/ts.2015.07.008 MU S Y, HU W Z, JIANG A L. The role of salicylic acid as signal molecule and its application in fresh-cut fruits and vegetables[J]. Journal of Food Safety and Quality, 2015(7): 2434-2438. DOI:10.19812/j.cnki.jfsq11-5956/ts.2015.07.008 |
| [28] |
BISWAS D, GAIN H, MANDAL A. MYB transcription factor: A new weapon for biotic stress tolerance in plants[J]. Plant Stress, 2023, 10: 100252. DOI:10.1016/j.stress.2023.100252 |
| [29] |
AHARONI A, DE VOS C H, WEIN M, SUN J K, GRECOR, KROON A, MOL J, CONNELL A P. The strawberry FaMYB1 transcription factor suppresses anthocyanin and flavonol accumulation in transgenic tobacco[J]. The Plant Journal, 2001, 28(3): 319-332. DOI:10.1046/j.1365-313X.2001.01154.x |
| [30] |
LI M, YU G, CAO C, LIU P. Metabolism, signaling, and transport of jasmonates[J]. Plant Communications, 2021, 2(5): 100231. DOI:10.1016/j.xplc.2021.100231 |
| [31] |
BREEZE E. Master MYCs: MYC2, the jasmonate signaling 'master switch'[J]. Plant Cell, 2019, 31(1): 9-10. DOI:10.1105/tpc.19.00004 |
(责任编辑 张辉玲)
 2024, Vol. 51
2024, Vol. 51