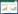文章信息
基金项目
- 广东省重点领域研发计划项目(2020B0202090002);广东省现代农业产业共性关键技术研发创新团队建设(2023KJ113);广东省农业科学院科技创新战略专项资金(高水平农科院建设)(R2023PY-JG011);广东省农业科学院“十四五”学科团队建设项目(202105TD);广东省乡村振兴战略专项(粤农农计〔2023〕13号)
作者简介
-
佘小漫(1981—),博士,硕士生导师,广东省农业科学院植物保护研究所研究员。主要从事植物病理学、蔬菜病害诊断和绿色防控等研究。主持和参与国家科技支撑计划、国家重点研发计划子课题、国家自然科学基金、现代农业产业技术体系、广东省自然科学基金等项目30余项,发表论文30余篇,其中SCI论文12篇。获各级科技成果奖励20项,授权国家发明专利8项,参与制定标准3项,参编专著3部。担任广东省植物病理学会副秘书长、广东省植物保护学会理事、广东省现代农业产业体系创新团队专题专家。
佘小漫(1981—),女,博士,研究员,研究方向为植物病理学,E-mail:lizer126@126.com.
通讯作者
- 黄真珍(1982—),女,硕士,高级农艺师,研究方向为农业技术推广,E-mail:lzsftgk@163.com; 何自福(1966—),男,博士,研究员,研究方向为植物病理学,E-mail:hezf@gdppri.com.
文章历史
- 收稿日期:2023-10-09
2. 广东省农业技术推广中心,广东 广州 510145
2. Guangdong Agricultural Technology Promotion Center, Guangzhou 510145, China
【研究意义】番茄(Solanum lycopersicum)为茄科茄属草本植物,2021年我国番茄播种面积为111.3万hm2,产量为6 609万t。广东省作为我国重要的北运蔬菜和供应港澳蔬菜产地,番茄种植面积排全国前列,且广东常年高温多雨、番茄可终年种植,为青枯菌的繁殖提供了有利条件,使得番茄青枯病发生普遍,田间病株率最高可达80%[1]。在实际生产中,番茄生产者普遍采用噻森铜、噻唑锌等化学药剂防治番茄青枯病,但大量使用化学药剂容易使病原菌产生抗药性,造成环境污染、农产品质量安全等问题。前期田间栽培试验发现,香葱伴生番茄后,番茄青枯病发病率下降。研究香葱伴生番茄对番茄青枯病发生、根际土壤微生态特征的影响,可揭示香葱伴生番茄降低青枯病发病率的原因,对研发番茄青枯病防控技术新模式具有重要意义。【前人研究进展】伴生(间套作)栽培是我国传统的栽培农艺措施。合理的伴生栽培可有效控制土传病害[2]。研究表明,旱作水稻伴生西瓜可有效降低西瓜枯萎病的发生[3],小麦伴生蚕豆显著降低了蚕豆土传枯萎病的发生[4],玉米伴生大豆显著降低了大豆红冠腐病的发病率和病情指数[5];分蘖洋葱与番茄伴生能显著降低土壤中线虫数量及减少番茄黄萎病的发生[6-7],葱伴生番茄可以降低番茄青枯病的发生程度[8]。伴生栽培控制土传病害的机理之一即通过伴生栽培改变寄主根际土壤微群落结构,维持土壤健康[2, 9]。付彦祥等[10]研究发现,分蘖洋葱伴生处理改变了番茄根际土壤细菌和真菌群落的组成,显著降低致病菌的相对丰度;李红玉[11]研究发现,分蘖洋葱伴生改变了番茄根际土壤微生物群落结构,进而提高了番茄防御酶活性和番茄根系抗病相关基因表达;胡国彬等[4]研究发现小麦伴生蚕豆可增加蚕豆根际微生物数量;夏秀波等[12]认为大葱伴生栽培对黄瓜根区土壤细菌种群有一定的影响,降低了土壤细菌种群的多样性指数和均匀度指数。伴生栽培控制土传病害的另一机理则是伴生增加了寄主地下部根系分泌物的多样性。根系分泌物能降低病原菌的存活与侵染、促进有益微生物生长和在寄主根际的定殖能力[2, 13]。在旱作水稻伴生西瓜中,水稻根系分泌物香豆酸可抑制西瓜枯萎病菌的孢子萌发和产孢,从而减少了西瓜根际病原菌数量,显著降低西瓜枯萎病发生[3];玉米伴生大豆显著促进了玉米分泌肉桂酸,以抑制大豆红冠腐病病原菌的孢子萌发和菌丝生长,最终降低了大豆红冠腐病发病率和病情指数[5];分蘖洋葱伴生番茄通过提高番茄根系总有机酸、总氨基酸和总可溶性糖含量,促进了有益微生物在根系的定殖能力、产抗生素能力,进而提高了番茄对黄萎病的抗病力[13]。【本研究切入点】香葱伴生可降低番茄青枯病发病率,解析香葱伴生番茄降低青枯病发病率的机理对研发香葱伴生番茄的栽培模式至关重要。目前关于香葱伴生对田间番茄青枯病的发生及番茄根际土壤微生态特征的影响未有研究报道。【拟解决的关键问题】通过田间试验,研究香葱伴生番茄对番茄青枯病发生的影响,进一步利用高通量测序技术,探究香葱伴生是否改变番茄根际土壤微生物群落结构和根际土壤代谢物质含量,揭示香葱伴生番茄降低青枯病发病率的机理,为番茄和香葱伴生栽培模式提供理论依据,为防控番茄青枯病提供新策略。
1 材料与方法 1.1 试验材料供试番茄品种为‘乐粉3号’,伴生香葱为农家品种。试验地土壤为砂壤土,pH值为5.58,有机质含量45.7 g/kg,全氮含量2.12 g/kg,全磷含量1.64 g/kg,全钾含量10.5 g/kg,铵态氮含量2.80 mg/kg,硝态氮含量45.6 mg/kg。
1.2 试验设计试验在广东省农业技术推广中心柯木塱基地(23° 18′97″N,113° 41′21″E)进行。为保证试验效果,在同一试验田地,按同样种植方式先连续种植番茄2茬(2022年4—7月、2022年9月至2023年1月),其中番茄青枯病田间病株率达85% 以上。
于2023年4—7月设置番茄单作和香葱伴生番茄2个处理,每个处理3次重复,每小区面积20 m2、种植35株。番茄和香葱于2023年4月26日同时定植,番茄株距65 cm,行距75 cm。番茄单作处理不栽植香葱,香葱伴生番茄处理则在番茄植株两侧5 cm处各栽1株香葱。
1.3 样品采集采用五点取样法采集各处理小区的番茄根际土壤。对于番茄单作处理,每小区分别采集5株发病(单作发病番茄,QK)和5株不发病(单作健康番茄,NBS)植株的根际土壤;对于香葱伴生番茄处理,每小区随机采集5株不发病(香葱伴生番茄,BS)植株的根际土壤。样品收集方法:从试验小区地里拔起番茄植株,轻轻抖落植株根际土;然后用毛刷轻轻扫植株根系,收集附着于根系周围的土壤,将5个点的土样混合即为该处理小区的样品。在采集根际土壤的同时对番茄青枯病发病率进行调查。
1.4 土壤DNA提取和高通量测序使用TianGen试剂盒(天根生化科技(北京)有限公司)提取根际土壤样品中总DNA,采用1% 琼脂糖凝胶电泳检测DNA的质量。取适量的样品DNA于离心管中,用无菌水稀释至浓度为1 ng/μL,利用细菌16S V3、V4区PCR扩增引物341F(5'- CCTAYGGGRBGCA SCAG-3')/806R(5'-GGACTACNNGGGTATCTAAT-3')[14]进行扩增。PCR反应条件为:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,28个循环;72 ℃延伸10 min[14]。PCR产物经检测、纯化、定量后,应用NEB Next⑥UltraTM II FS DNA PCR-free Library Prep Kit(New England Biolabs)构建文库,采用Pacbio Sequel三代测序平台对群落DNA片段进行SMRT(Single Molecule Real-Time)测序。
1.5 序列处理与统计分析使用FLASH(Version 1.2. 11, http://ccb.jhu.edu/software/FLASH/)[15]对每个样本的read进行拼接得到原始数据(Raw Tags)。使用fastp软件(Version 0.23.1)对原始数据进行过滤处理得到高质量的Tags序列[16]。Tags序列通过与物种注释数据库(Silva database, https://www.arbsilva.de/ for 16S)进行比对检测嵌合体序列,并去除其中的嵌合体序列得到有效数据[17]。使用QIIME2(Version QIIME2-202202)软件DaDa2模块进行降噪,以所有测序序列数的0.005% 作为阈值,过滤获得扩增子序列变异体(Amplicon sequence variants,ASV)以及特征表[18],使用QIIME2软件进行物种注释。根据每个样本在不同分类等级(门、纲、目、科)丰度前10的物种和属丰度前30的物种,通过SVG函数绘制Perl中相对丰度的分布直方图。使用QIIME2软件进行α多样性指数分析和β多样性分析。
1.6 代谢物提取及LC-MS分析取适量的根际土壤于2 mL离心管中,浓缩干燥备用。代谢物提取及LC-MS分析委托北京诺禾致源科技股份有限公司完成。土壤中加入80% 甲醇溶液500 μL,放入液氮速冻5 min;冰上融化后涡旋30 s,超声6 min;5 000 r/min、4 ℃离心2 min,取上清液冻干成干粉;按所取样本体积加入相应的10% 甲醇溶液溶解,取样到检测瓶中,用于LC-MS检测。色谱条件:色谱柱采用Hypersil Gold column(C18),柱温40℃,流速0.2 mL/min。正模式:流动相A为0.1% 甲酸,流动相B为甲醇;负模式:流动相A为5 mmol/L醋酸铵,pH9.0,流动相B为甲醇。色谱梯度洗脱程序如下,0 h和1.5 h:98%A+2%B,3 h:15%A+85%B,10 h:100%B,10.1 h、11 h和12 h:98%A+2%B。质谱条件:扫描范围选择100~1500m/z;ESI源设置:喷雾电压3.5 kV;鞘气流速35 psi;辅助气流速10 L/min;离子传输管温度320 ℃;离子导入射频电平60;辅助气加热器温度350 ℃;极性positive、negative;MS/MS二级扫描为数据依赖性扫描。
1.7 代谢物鉴定及统计分析将下机数据文件导入CD3.3搜库软件中进行处理,设置质量偏差为5 ppm、信号强度偏差30%、最小信号强度、加合离子等信息进行峰提取,同时对峰面积进行定量,再整合目标离子,通过分子离子峰和碎片离子进行分子式的预测,并与mzCloud、mzVault和Masslist数据库进行比对。用blank样本(53% 甲醇水溶液代替试验样本,前处理过程与试验样本相同)去除背景离子,将原始定量结果进行标准化处理,得到相对峰面积;并将QC样本中相对峰面积CV>30% 的化合物删除,最后得到代谢物的鉴定和相对定量结果。
利用KEGG数据库(https://www.genome.jp/kegg/pathway.html)对鉴定得到的代谢物进行注释。应用代谢组学数据处理软件metaX[19]对数据转换后进行偏最小二乘法判别分析(PLS-DA),进而得到每个代谢物的VIP值。单变量分析部分,基于t检验计算各代谢物在两组间统计学显著性,并计算代谢物在两组间的差异倍数(Fold change,FC)。差异代谢物筛选的默认标准为VIP > 1,P < 0.05且FC > 1.5或FC < 0.667。
2 结果与分析 2.1 香葱伴生番茄对青枯病发生的影响对番茄青枯病发病率进行调查并统计,结果(表 1)显示,番茄单作处理番茄青枯病平均病株率为50.48%,香葱伴生番茄处理番茄青枯病平均病株率为31.43%,香葱伴生番茄处理番茄青枯病平均病株率显著低于番茄单作处理,香葱伴生对番茄青枯病防治效果为37.74%。结果表明香葱伴生番茄能延缓番茄青枯病的发生。
2.2 样本测序统计结果
对原始数据进行过滤处理后,从9份样本中共获得1 000 399条高质量16S rRNA序列;在97% 相似度水平下进行归类,并去除代表序列少的ASV,最终分别得到6 757个细菌的ASV(表 2)。使用QIIME2软件进行物种注释,最终分类学地位明确的细菌有20门、56纲、92目、225科、511属、776种。
2.3 根际土壤微生物群落α多样性
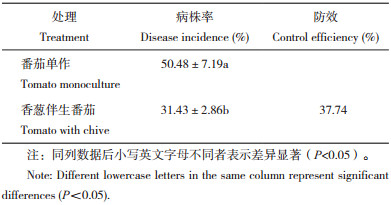
α多样性分析结果(表 3)显示,香葱伴生番茄根际土壤(BS)、单作健康番茄根际土壤(NBS)和单作发病番茄根际土壤(QK)细菌的覆盖率均大于0.99,表明测序结果可代表样本中细菌的真实情况。BS细菌的Cha1o指数、Pielou-e指数、Shannon指数和Simpson指数均高于NBS和QK,NBS细菌的Chao1指数、Pielou-e指数、Shannon指数和Simpson指数均高于QK,表明BS细菌的群落丰度及物种多样性高于NBS细菌的群落丰度及物种多样性,但差异不显著;BS和NBS细菌的群落丰度及物种多样性均高于QK细菌群落丰度及物种多样性,其差异均达到极显著水平。
2.4 根际土壤微生物群落β多样性
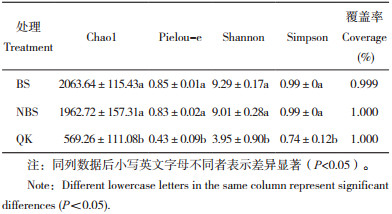
采用基于Bray-Curtis距离矩阵的主成分分析(PCoA)方法,分析香葱伴生番茄根际土壤(BS)、单作健康番茄根际土壤(NBS)和单作发病番茄根际土壤(QK)细菌群落结构差异,结果(图 1)表明,2个主成分解释了77.24% 的细菌群落变异,BS和NBS与QK的距离较远。上述结果说明,香葱伴生番茄和单作健康番茄、单作发病番茄间的细菌结构有差异,而BS和NBS之间有交叉,说明香葱伴生番茄和单作健康番茄两处理间无差异。
|
| BS:葱伴生番茄;NBS:单作健康番茄;QK:单作发病番茄 BS: Tomatoes with chives treatment; NSB: Tomato monoculture treatment; QK: Diseased tomatoes in tomato monoculture 图 1 基于Bray-Curtis距离的土壤细菌群落结构分析 Fig. 1 Analysis of soil bacterial community structure based on Bray-Curtis |
2.5 根际土壤样品中细菌菌落结构
为揭示香葱伴生番茄对其根际细菌群落组成和结构的影响,比较了香葱伴生番茄根际土壤(BS)、单作健康番茄根际土壤(NBS)和单作发病番茄根际土壤(QK)之间不同细菌类群相对丰度的差异,结果(图 2)显示,在科和属水平上BS、NBS和QK的细菌均存在差异。在科的水平上(图 2A),BS排前5的细菌科分别是鞘脂单胞菌科(Sphingomonadaceae)、芽孢杆菌科(Bacillaceae)、根瘤菌科(Rhizobiaceae)、噬几丁质菌科(Chitinophagaceae)和微球菌科(Micrococcaceae),其相对丰度分别为15.85%、6.87%、6.29%、5.36% 和5.28%;NBS排前5的细菌科分别是鞘脂单胞菌科、微球菌科、鞘脂单胞菌科、芽孢杆菌科和芽单胞菌科(Gemmatimonadaceae),其相对丰度分别为18.67%、8.02%、6.75%、4.15% 和3.97%;QK排前5的细菌科分别是伯克氏菌科(Burkholderiaceae)、根瘤菌科、周蝶菌科(Weeksellaceae)、鞘脂单胞菌科和噬几丁质菌科,其相对丰度分别为60.62%、11.30%、6.33%、3.64% 和2.34%。与QK相比,BS和NBS的鞘脂单胞菌科的相对丰度均极显著高于QK(P < 0.001),而BS和NBS的伯克氏菌科的相对丰度仅为2.29% 和2.47%;与NBS相比,BS的芽孢杆菌科的相对丰度显著高于NBS(P < 0.05)。
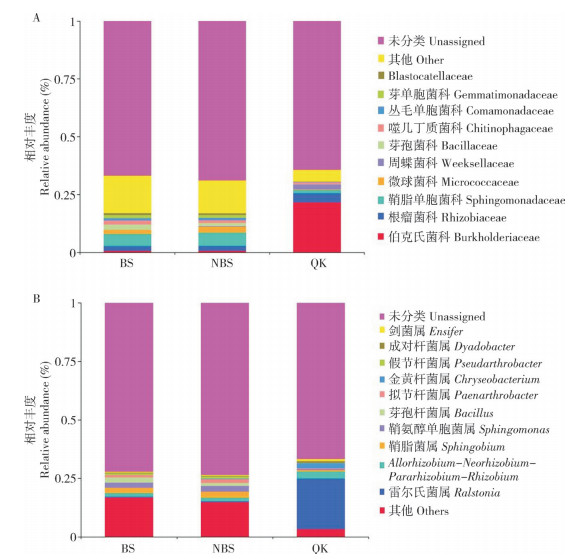
|
| BS:葱伴生番茄;NBS:单作健康番茄;QK:单作发病番茄 BS: Tomatoes with chives treatment; NSB: Tomato monoculture treatment; QK: Diseased tomatoes in tomato monoculture 图 2 番茄根际土壤细菌菌落结构 Fig. 2 Bacteria community structure in tomato rhizosphere soil |
在属的水平上(图 2B),BS排前5的细菌属分别是鞘氨醇单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、鞘脂菌属(Sphingobium)、Allorhizobium- Neorhizobium-Pararhizobium-Rhizobium属、假节杆菌属(Pseudarthrobacter),其相对丰度分别为6.73%、6.57%、6.53%、4.65% 和3.19%,雷尔氏菌属的相对丰度为0.88%;NBS排前5的细菌属分别是鞘氨醇单胞菌属、鞘脂菌属、假节杆菌属菌种、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium和芽孢杆菌属(Bacillus),其相对丰度分别为8.19%、7.74%、5.14%、4.80% 和4.0%,雷尔氏菌属的相对丰度为1.20%;QK排前5的细菌属分别是雷尔氏菌属(Ralstonia)、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、金黄杆菌属(Chryseobacterium)、成对杆菌属(Dyadobacter)和剑菌属(Ensifer),其相对丰度分别为60.52%、8.32%、6.33%、2.48% 和2.27%,芽孢杆菌属的相对丰度为1.62%。与QK相比,BS和NBS的雷尔氏菌属的相对丰度显著低于QK(P < 0.05),BS的芽孢杆菌属的相对丰度显著高于QK(P < 0.05);与NBS相比,BS的芽孢杆菌属相对丰度显著高于NBS(P < 0.05),其余4个属相对丰度差异不显著。
2.6 根际土壤样品中代谢物鉴定应用LC-MS技术,从香葱伴生番茄根际土壤和单作健康番茄根际土壤样品中共鉴定到代谢物586种,其中正离子模式代谢物320种,负离子模式代谢物266种。将鉴定到的代谢物的Class I分类进行统计分析,其中脂质和类脂分子占总量的29.23%,有机酸及其衍生物占总量的27.81%,有机杂环化合物占总量的14.38%,核苷、核苷酸和类似物占总量的9.57%,苯型烃类占总量的8.20%,有机氧化物占总量的6.31%,苯丙类和聚酮类占总量的3.36%,有机氮化合物占总量的0.96%,有机硫化合物占总量的0.18%。对鉴定到的代谢物进行功能和分类注释,主要将注释至3大类生物代谢通路:新陈代谢(Metabolism)、遗传信息加工(Genetic information processing)和环境信息加工(Environmental information processing),其中新陈代谢通路主要涉及核酸代谢、萜类和多酮类代谢、其他氨基酸代谢、辅助因子和维生素代谢、脂质代谢、全局和概述图谱、能量代谢、碳水化合物代谢、其他次生代谢物的生物合成和氨基酸代谢(图 3)。
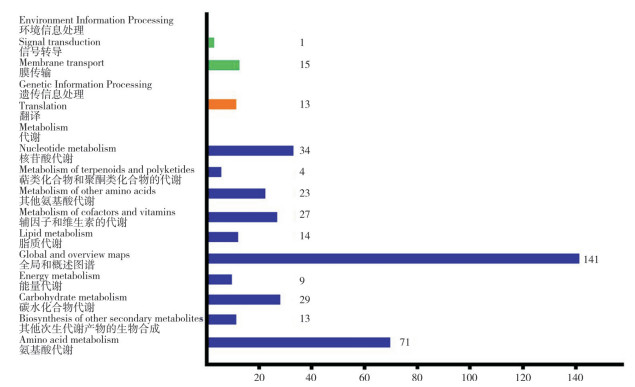
|
| 图 3 番茄根际土壤代谢物分类 Fig. 3 Classification of metabolites in tomato rhizosphere soil |
2.7 根际土壤差异代谢物筛选
为了解香葱伴生的番茄根际土壤代谢变化,使用偏最小二乘法判别分析法建立代谢物表达量和样品之间的关系模型。结果显示,在正离子和负离子模式下,香葱伴生番茄和单作健康番茄的根际土壤代谢物组间存在明显的分离趋势,正离子模式中R2:1.00、Q2:0.97(图 4A),负离子模式中R2:1.00、Q2:0.98(图 4B),说明建模符合样本数据的真实情况,不同处理间差异大;同时,Q的回归线与纵轴的截距在0以下,说明原模型具有良好的稳定性,可用于后续分析(图 4C、4D)。
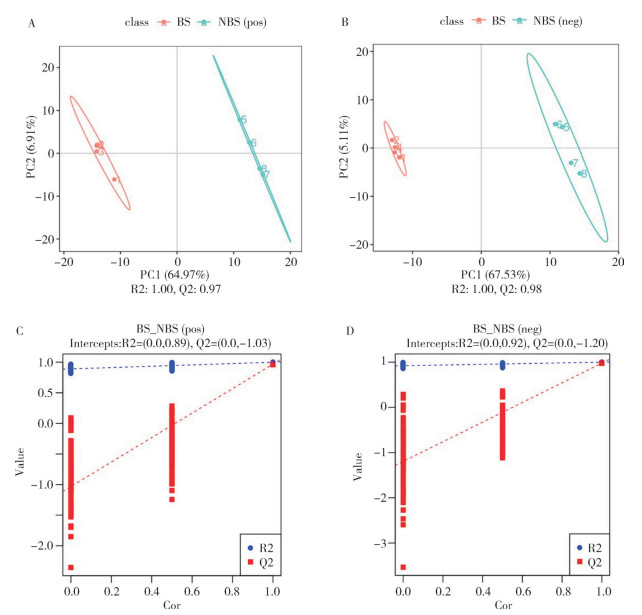
|
| BS:葱伴生番茄;NBS:单作健康番茄 BS: Tomatoes with chives treatment; NSB: Tomato monoculture treatment 图 4 BS、NBS根际土壤差异代谢物偏最小二乘法判别分析 Fig. 4 PLS-DA of differential metabolites in rhizosphere soils of BS and NBS |
按VIP > 1.0,FC > 1.5或FC < 0.667且P < 0.05的标准进行差异代谢物筛选。与单作健康番茄相比,香葱伴生番茄根际土壤代谢物中有310种代谢物含量差异显著,其中201种代谢物含量显著上调,主要涉及有机酸及其衍生物57种、脂质和类脂分子48种、核苷、有机杂环化合物类25种和核苷酸和类似物24种等;109代谢物含量显著下调,主要涉及有机酸及其衍生物27种、脂质和类脂分子26种、有机杂环化合物13种和有机氧化物类型3种等。进一步分析对青枯菌有引诱作用有机酸及其衍生物类代谢物含量变化,共筛选出有含量变化的有机酸7种,包括缬氨酸、L- 天冬酰胺、柠檬酸、L- 赖氨酸、谷氨酸、D- 谷氨酰胺和异亮氨酸等。与单作健康番茄相比,香葱伴生番茄根际土壤代谢物中的缬氨酸、L- 天冬酰胺和柠檬酸的含量均显著低于单作健康番茄NBS的含量(P < 0.05),而L- 赖氨酸、谷氨酸、D- 谷氨酰胺和异亮氨酸的含量也低于单作健康番茄的含量,但差异不显著(图 5)。

|
| BS:葱伴生番茄;NBS:单作健康番茄 BS: Tomatoes with chives treatment; NSB: Tomato monoculture treatment 图 5 BS、NBS根际土壤差异有机酸代谢物分析 Fig. 5 Analysis of differential organic acids metabolites in rhizosphere soils of BS and NBS |
3 讨论
伴生栽培在我国农业中的应用历史悠久,利用植物间相生效应进行合理的伴生栽培可有效控制土传病害[2]。番茄青枯病是我国及世界番茄生产上的毁灭性土传病害之一,本研究首次开展香葱伴生番茄对田间番茄青枯病发生情况以及番茄根际微生态特征影响的研究,为香葱伴生番茄的栽培模式提供理论依据。张静薇[8]利用盆栽试验发现葱伴生番茄能显著降低番茄青枯病的发病程度,对番茄青枯病的防治效果为90.1%,但未阐明葱伴生番茄降低青枯病发病率的原因。本研究田间试验结果表明,香葱伴生番茄能显著降低田间番茄青枯病的发病率,对番茄青枯病防治效果为37.74%,但远远低于90.1%[8]的防效。这可能是伴生葱的品种不同和试验方法不同所致,田间试验环境复杂可能导致田间试验比室内栽培试验防治效果低。
香葱伴生可增加番茄根际土壤有益微生物的相对丰度,降低病原菌的相对丰度。本研究对高通量测序结果比较分析发现,香葱伴生番茄、单作健康番茄根际土壤细菌群落丰富度和多样性均显著高于单作发病番茄,与刘婷[20]、杨尚东等[21]研究结果一致。此外,香葱伴生番茄和单作健康番茄根际土壤细菌群落多样性差异不显著,这与付彦祥等[10]的研究结果一致。引起番茄青枯病的病原菌隶属伯克氏菌科、雷尔氏菌属,相比单作发病番茄,香葱伴生番茄和单作健康番茄根际土壤中伯克氏菌科、雷尔氏菌属的相对丰度均降低,而有益微生物如芽孢杆菌的相对丰度均增加,且香葱伴生后番茄根际土壤有益微生物相对丰度比单作健康番茄高,病原菌雷尔氏菌属的相对丰度比单作健康番茄低。这可能是香葱伴生抑制番茄青枯病发生的原因之一。
香葱伴生改变番茄根际土壤氨基酸、有机酸等代谢物的含量。为明确香葱伴生对番茄根际土壤代谢物的影响,本研究对香葱伴生番茄和单作健康番茄根际土壤代谢物开展代谢组检测并进行差异分析。结果表明,香葱伴生番茄后,番茄根际土壤代谢物的含量发生改变,共检测到含量显著上调代谢物201种,含量显著下调代谢物109种,差异代谢物主要为有机酸及其衍生物、脂质及类脂分子和核苷、核苷酸及类似物。趋化性是指有机体对某种化学物质的趋向性运动,有机体被化学物质吸引或排斥。趋化性在微生物- 植物互作过程如侵染、共生或根际定殖中起到非常重要的作用[22]。缬氨酸、异亮氨酸、赖氨酸、谷氨酸、谷氨酰胺、天冬酰胺等氨基酸,柠檬酸、苹果酸、琥珀酸等有机酸以及番茄次生代谢产物被证明对番茄青枯病病原菌有强引诱作用,是番茄青枯病病原菌侵染初期定殖番茄根系的趋化物质[22-23]。通过对有机酸及其衍生物含量差异比较分析发现,香葱伴生番茄根际土壤代谢物中缬氨酸、L- 天冬酰胺、柠檬酸、L- 赖氨酸、谷氨酸、D- 谷氨酰胺和异亮氨酸的含量均低于单作健康番茄的含量,由此推测,香葱伴生改变了番茄根际土壤对番茄青枯病病原菌有强引诱作用的氨基酸、有机酸等代谢物的含量,减少番茄对青枯菌的诱集,从而影响青枯菌在番茄根际的定殖,这可能是香葱伴生抑制番茄青枯病发生的另一原因。
4 结论香葱伴生番茄可显著降低田间番茄青枯病发病率,对番茄青枯病的防治效果为37.74%。香葱伴生改变了番茄根际土壤中细菌群落结构,香葱伴生番茄、单作健康番茄根际土壤细菌群落相对丰度和多样性均显著高于单作发病番茄;与单作发病番茄相比,香葱伴生番茄和单作健康番茄根际土壤中的茄科雷尔氏菌属相对丰度显著降低,芽孢杆菌属相对丰度升高;而香葱伴生番茄根际土壤茄科雷尔氏菌属相对丰度低于单作健康番茄,芽孢杆菌属相对丰度显著高于单作健康番茄。香葱伴生改变了番茄根际土壤代谢物含量,香葱伴生番茄根际土壤代谢物中有310种代谢物含量差异显著,其中201种代谢物含量显著上调, 109代谢物含量显著下调;香葱伴生番茄根际土壤代谢物中的缬氨酸、L- 天冬酰胺和柠檬酸含量均显著低于单作健康番茄,L- 赖氨酸、谷氨酸、D- 谷氨酰胺和异亮氨酸的含量也低于单作健康番茄根际土壤代谢物的含量,但差异不显著。
| [1] |
佘小漫, 何自福. 作物青枯病研究进展[J]. 广东农业科学, 2020, 47(12): 82-89. DOI:10.16768/j.issn.1004-874X.2020.12.009 SHE X M, HE Z F. Advances in studies on crop bacterial wilt caused by Ralstonia solanacearum[J]. Guangdong Agricultural Sciences, 2020, 47(12): 82-89. DOI:10.16768/j.issn.1004-874X.2020.12.009 |
| [2] |
朱锦惠, 董坤, 杨智仙, 董艳. 间套作控制作物病害的机理研究进展[J]. 生态学杂志, 2017, 36(4): 1117-1126. DOI:10.13292/j.1000-4890.201704.016 ZHU J H, DONG K, YANG Z X, DONG Y. Advances in the mechanism of crop disease control by intercropping[J]. Chinese Journal of Ecology, 2017, 36(4): 1117-1126. DOI:10.13292/j.1000-4890.201704.016 |
| [3] |
HAO W Y, REN L X, RAN W, SHEN Q R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f. sp. niveum[J]. Plant and Soild, 2010, 336: 485-497. DOI:10.1007/s11104-010-0505-0 |
| [4] |
胡国彬, 董坤, 董艳, 郑毅, 汤利, 李欣然, 刘一鸣. 间作缓解蚕豆连作障碍的根际微生态效应[J]. 生态学报, 2016, 36(4): 1010-1020. DOI:10.5846/stxb201407011357 HU G B, DONG K, DONG Y, ZHENG Y, TANG L, LI X R, LIU Y M. Effects of cultivars and intercropping on the rhizosphere microenvironment for alleviating the impact of continuous cropping of faba bean[J]. Acta Ecologica Sinica, 2016, 36(4): 1010-1020. DOI:10.5846/stxb201407011357 |
| [5] |
GAO X, WU M, XU R N, WANG X, PAN R, KIN H J, LIAO H. Root interactions in a maize/soybean intercropping system control soybean soil borne disease, red crown rot[J]. Plos One, 2014, 9: 95031. DOI:10.1371/journal.pone.0095031 |
| [6] |
白晶芝, 高欢, 杨帆, 周新刚, 刘守伟, 吴凤芝. 分蘖洋葱与番茄伴生根系分泌物对根结线虫的影响[J]. 植物保护, 2021, 47(3): 22-28. DOI:10.16688/j.zwbh.2020076 BAI J Z, GAO H, YANG F, ZHOU X G, LIU S W, WU F Z. Effects of root exudates on root-knot nematodes in tomato-potato onion interplant system[J]. Plant Protection, 2021, 47(3): 22-28. DOI:10.16688/j.zwbh.2020076 |
| [7] |
FU X P, WU X, ZHOU X G, LIU S W, SHEN Y H, WU F Z. Companion cropping with potato onion enhances the disease resistance of tomato against Verticillium dahlia[J]. Frontiers in Plant Science, 2015, 6: 36445. DOI:10.3389/fpls.2015.00726 |
| [8] |
张静薇. 番茄相生相克植物的筛选和应用及全程有机植物体系的实施[D]. 南京: 南京农业大学, 2019. ZHANG J W. Screening tomato allelopathy plants and application of holistic organic planting system[D]. Nanjing: Nanjing Agricultural University, 2019. |
| [9] |
覃欣仪, 何丽珍, 肖可卓, 庞师婵, 宋静静, 杨尚东. 伴生不同作物对主栽番茄植株根系内生微生物群落结构的影响[J/OL]. 华中农业大学学报: 1-9, [2023-12-06]. https://kns.cnki.net/kcms/detail/42.1181.S.20230406.0954.002.html. QIN X Y, HE L Z, XIAO K Z, PANG S C, SONG J J, YANG S D. Effects of different associated crops on endophytic microbial community structure in tomato roots[J/OL]. Journal of Huazhong Agricultural University: 1-9, [2023-12-06]. https://kns.cnki.net/kcms/detail/42.1181.S.20230406.0954.002.html. |
| [10] |
付彦祥, 李乃荟, 刘佳遥, 吴凤芝. 伴生分蘖洋葱对番茄根际微生物群落结构的影响[J]. 中国蔬菜, 2020(6): 49-57. DOI:10.19928/j.cnki.1000-6346.2020.06.010 FU Y X, LI N H, LIU J Y, WU F Z. Effects of concomitant tillering onion on microbial community structure in tomato rhizosphere soil[J]. China Vegetable, 2020(6): 49-57. DOI:10.19928/j.cnki.1000-6346.2020.06.010 |
| [11] |
李红玉. 分蘖洋葱伴生番茄根际微生物对番茄黄萎病抗性的影响[D]. 黑龙江: 东北农业大学, 2018. LI H Y. Effect of rhizosphere microorganism of tomato intercropping with potato onion on Verticillium wilt resistance in tomato[D]. Heilongjiang: Northeast Agricultural University, 2018. |
| [12] |
夏秀波, 王全华, 葛晨辉, 曹守军, 李涛, 姚建刚, 张瑞清. 大葱伴生栽培对黄瓜根区土壤细菌种群的影响[J]. 中国蔬菜, 2013(16): 72-77. DOI:10.3969/j.issn.1000-6346.2013.16.012 XIA X B, WANG Q H, GE C H, CAO S J, LI T, YAO J G, ZHANG R Q. Effect of companion planting Chinese onion on soil bacterial communities in root zone of cucumber[J]. China Vegetables, 2013(16): 72-77. DOI:10.3969/j.issn.1000-6346.2013.16.012 |
| [13] |
宫超, 黎振兴, 麦培婷, 孙保娟, 李植良, 李涛. 番茄青枯病抗性相关根际微生物的研究进展[J]. 广东农业科学, 2021, 48(9): 51-61. DOI:10.16768/j.issn.1004-874X.2021.09.006 GONG C, LI Z X, MAI P T, SUN B J, LI Z L, LI T. Research progress of rhizosphere microorganisms related to tomato bacterial wilt resistance[J]. Guangdong Agricultural Sciences, 2021, 48(9): 51-61. DOI:10.16768/j.issn.1004-874X.2021.09.006 |
| [14] |
WALTERS W, HYDE E R, BERG-LYONS D, ACKERMANN G, HUMPHREY G, PARADA A, GILBERT J A, JANSSON J K, CAPORASO G, FUHRMAN J A, APPRILL A, KNIGHT R. Improved bacterial 16s rRNA gene (v4 and v4-5) and fungal internal transcribed spacer marker gene primers for microbial community surveys[J]. mSystems, 2016, 1(1): 9-15. DOI:10.1128/mSystems.00009-15 |
| [15] |
MAGOC T, SALZBERG S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatic, 2011, 27(21): 2957-2963. DOI:10.093/bioinformatics/btr507 |
| [16] |
BOKULICH N A, SUBRAMANIAN S, FAITH J J, GEVERS D, GORDON J I, KNIGHT R, DAVID A M, CAPORASO J G. Qualityfiltering vastly improves diversity estimates from illumina amplicon sequencing[J]. Nature Methods, 2012, 10(1): 57-59. DOI:10.1038/nmeth.2276 |
| [17] |
EDGAR R C, HAAS B J, CLEMENTE J C, QUINCE C, KNIGHT R. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [18] |
WANG Y, GUO H, GAO X, WANG J. The intratumor microbiota signatures associate with subtype, tumor stage, and survival status of esophageal carcinoma[J]. Frontiers in Oncology, 2021, 11: 754788. DOI:10.3389/fonc.2021.754788 |
| [19] |
WEN B, MEI Z L, ZENG CW, LIU S Q. MetaX: A flexible and comprehensive software for processing metabolomics data[J]. BMC Bioinformatics, 2017, 18: 183. DOI:10.1186/s12859-017-1579-y |
| [20] |
刘婷. 番茄根际土壤代谢特征及其对青枯菌入侵的影响[D]. 南京: 南京农业大学, 2020. LIU T. Metabolic characteristic of tomato rhizosphere soil and its effect on the invasion of Ralstonia solanacearum[D]. Nanjing: Nanjing Agricultural University, 2020. |
| [21] |
杨尚东, 赵久成, 郭伊娟, 吴俊, 龙明华. 番茄青枯病罹病植株和健康植株根际土壤细菌群落结构的初步分析[J]. 中国蔬菜, 2014(8): 25-29. DOI:10.3969/j.issn.1000-6346.2014.08.008 YANG S D, ZHAO J C, GUO Y J, WU J, LONG M H. Characterization of soils bacterial community structures in rhizospheres of tomatoes infected with bacterial wilt and its non-infected plants[J]. China Vegetable, 2014(8): 25-29. DOI:10.3969/j.issn.1000-6346.2014.08.008 |
| [22] |
HASEGAWA T, OKABE A, KATO Y, OOSHIRO A, KAWAIDE H, NATSUME M. Bioassay-guided isolation of a novel chemoattractant for Ralstonia solanacearum in tomato root exudates[J]. Journal of General Plant Pathology, 2018, 84: 20-26. DOI:10.1007/s10327-017-0752-5 |
| [23] |
HASEGAWA T, KATO Y, OKABE A, ITOI C, OOSHIRO A, KAWAIDE H, NATSUME M. Effect of secondary metabolites of tomato (Solanum lycopersicum) on chemotaxis of Ralstonia solanacearum, pathogen of bacterial wilt disease[J]. Journal of Agricultural and Food Chemistry, 2019, 67(7): 1807-1813. DOI:10.1021/acs.jafc.8b06245 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51