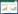文章信息
基金项目
- 和平县猕猴桃省级现代农业产业园专项(KA1803558);和平县(腐竹)省级现代农业产业园专项(KA1905737);和平红阳猕猴桃及其改良品系良种良法技术集成与推广专项(GDTK-09)
作者简介
- 欧光敏(1997—),男,在读硕士生,研究方向为植物保护,E-mail:guangminou@163.com.
通讯作者
- 周玲艳(1972—),女,博士,教授,研究方向为植物生物技术,E-mail:lingyanzh@163.com.
文章历史
- 收稿日期:2023-06-11
2. 广东省中药研究所,广东 广州 510520
2. Guangdong Institute of Traditional Chinese Medicine, Guangzhou 510520, China
【研究意义】猕猴桃(Actinidia chinensis) 是广东省和平县特色水果之一,其成熟时间早、营养丰富、市场销路好,果农收益高,产业优势突出[1],但近几年受种植户盲目种植、品种单一、水肥管理差等因素影响,果实产量和品质有所降低[2]。土壤微生物对植物的生长发育起着重要作用,微生物可以将土壤中的有机物分解成氮、磷、钾等容易吸收的养分,从而改良土壤、促进植物生长,同时微生物还可提高土壤酶活性,促进碳源的利用、水的有效渗透以及防御病害等[3-5]。土壤优势菌群和主要营养元素的变化直接影响猕猴桃的产量和品质[6]。大豆是重要的油料作物,是国家重点支持的种业发展方向[7],大豆还有很强的固氮能力,可提高土壤肥力[8]。猕猴桃林下套种大豆可充分利用空间和资源,提高有限土地最大利用率和作物的单位面积产出量,增加种植户的经济收益,同时,微生物多样性的研究对提高猕猴桃产量和质量具有重要意义。【前人研究进展】李磊等[9] 研究发现,猕猴桃园套种蕺菜有利于提高猕猴桃根际土壤养分含量、微生物数量和酶活性,提高猕猴桃果实产量,改善猕猴桃果实品质。张承等[10] 研究发现,套种吉祥草对提高猕猴桃根际土壤微生物数量和酶活性、增加果实产量和改善品质具有明显作用。胡培蓉[11] 研究发现,猕猴桃园套种紫云英能有效地提高土壤肥力、提升猕猴桃鲜果品质。井赵斌等[12] 研究发现,种植牧草对猕猴桃果园土壤酶活性和微生物数量有改善作用。常威等[13] 以油菜、黑豆、白菜、紫云英、苦荞和蒲公英等6种作物进行猕猴桃林下套种试验,发现所选择的6种套作作物均能降低猕猴桃溃疡病的发病率,并认为套种提高了果园的资源利用率,实现了农民增收增产。大豆根系上常长有瘤状突起物,是附生在根组织中的根瘤菌,可为大豆提供一定的氮素,同时对土壤来说有固氮增肥的作用[14-16],大豆套种作物研究主要有玉米[16-17]、高粱[18] 等。自从2008年全国大规模进行以间、套、复种为中心的耕作制度改革以及农田林网建设以来,果园间套种豆类发展迅速[19],但由于劳动力价格攀升、农资价格上涨以及果园间套种栽培技术不成熟等原因,导致后期果园间套种大豆发展滞缓[20]。果园间套种大豆不仅具备推进扩面增豆的社会效益和稳产增收的经济效益,还具有改善农田小气候、保持水土、减少病虫害等生态效益[21]。目前,豆类逐渐成为现代果园间套作主流作物,形成了苹果园、柑橘园、芒果园、核桃园间套种大豆等多种区域化栽培模式[7, 21-22]。【本研究切入点】猕猴桃是和平县的支柱产业之一。大豆是我国进口依存度最高的农产品,其生产发展与国家粮食和油脂油料安全密切相关。近年来,果园间套种大豆的关注度不断提升,但猕猴桃林下套种大豆尚未见报道。【拟解决的关键问题】本试验在猕猴桃林下种植大豆,采用高通量测序检测猕猴桃林下种植大豆与未种植大豆土壤的微生物群落丰度,探究猴桃林下套种大豆对土壤微生物群落结构和多样性的影响,以期为猕猴桃园区绿色种植和提高单位面积经济效益提供参考,进一步促进乡村振兴。
1 材料与方法 1.1 试验材料土壤样品于2020年11月采自河源市和平县大坝镇猕猴桃试验示范基地,基地的猕猴桃林下套种大豆,待大豆收获后取种植地的土壤为试验组(EK),以同一区域未种植大豆的猕猴桃林下土壤为对照组(CK)。
1.2 试验方法1.2.1 土壤取样 采用5点取样法,除去土壤表面2~3 cm厚土层杂物,取样深度为5~20 cm,将土壤样本中的动植物残体、石子等杂质去除,过2 mm筛分离出简单样本,再用四分法混合均匀。对照组和试验组土壤取样重复3次,分别标记为CK1、CK2、CK3、EK1、EK2、EK3,共6份。
1.2.2 DNA提取与高通量测序 各称取土壤1 g,用DNA提取试剂盒(NucleoSpin Kit,Macherey-Nagel GmbH,Germany)提取样品总DNA。使用引物ITS1-F(5'-CTTGGTCATTTAGAG GAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCG ATGC-3')对真菌ITS片段进行扩增,使用引物341F(5'-CCTACGGGNGGCWGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3') 对细菌16S rRNA V3-V4区进行PCR扩增,使用引物Arch519F(5'-CAGCMGCCGCGGTAA-3') 和Arch915R(5'-GTGCTCCCCCGCCAATTCCT-3')对16S古菌V4-V5区片段进行扩增。PCR扩增产物使用AMPure XP试剂盒(Beckman Coulter Life Sciences,USA) 和QuantiFluorTM-ST荧光定量系统(Promega,USA)进行纯化和定量,利用Illumina HiSeq 2500 PE250进行高通量测序。测序工作由广州基迪奥生物科技有限公司完成。
1.3 数据分析用FASTP[23]进行数据预处理、OTU(Operational Taxonomic Units)统计分析及Alpha、Beta多样性指数均使用QIIME2[24]计算;在R软件中进行分析共有和特有的物种、距离矩阵和主坐标分析(PCoA)、物种丰度、可视化堆积模块组合和物种丰度的热图[25-26];利用LEfSe软件[27]对每个组的生物标志物特征进行分析,两组间差异采用t检验,P < 0.05表示差异显著。
2 结果与分析 2.1 土壤微生物的测序分析本研究利用高通量测序技术对CK(CK1、CK2、CK3) 和EK(EK1、EK2、EK3) 共6个土壤样本中微生物物种特征序列的16S(V3+V4)区域进行测序。为确保分析数据的准确可靠,本研究对质控所得到CK和EK的有效Tags数量及占比进行统计分析。结果(图 1)表明,CK1、CK2、CK3、EK1、EK2、EK3的有效Tags数量及占比分别为102 574(84.16%)、103 643 (85.32%)、109 086(84.45%)、115 277(85.55%)、116 500(85.20%)、104 803(85.24%)。所有样本的Tags数量均占80% 以上,表明数据可靠性较高,且EK的平均有效Tags丰度大于CK,表明EK的微生物群落丰度和多样性高于CK。

|
| 图 1 CK和EK土壤微生物群落测序数据预处理分布 Fig. 1 Distribution of sequence data pretreatment for soil microbial communities in CK and EK |
2.2 土壤微生物的OTU分类
为了解种植大豆对土壤微生物群落结构的影响,本研究对土壤微生物群落OTU数据进行分析。高通量测序和优化后,从6个土壤样品中共得到651 883条有效序列,经聚类后CK与EK分别获得4 551和4 740个OTU。将不同样品3次重复归为一组,绘制韦恩(Venn)图。结果(图 2)表明,EK特有OTU数比CK多,表明EK的微生物群落丰度和多样性高于CK,即猕猴桃林下种植大豆(EK)增加了土壤微生物群落的丰度和多样性。

|
| 不同颜色代表不同样本,重叠区域内的数值表示所有样本共享的OTU数,非重叠区域上的数值表示样本唯一的OTU数 Diferent color represents diferent sample. The numbers in the overlap region represent the number of OTU shared by different samples. The numbers on the non-overlap region represent the number of OTU unique to the sample 图 2 基于CK和EK土壤微生物群落OUT的Venn图 Fig. 2 Venn diagram of OTU for soil microbial communities in CK and EK |
2.3 土壤微生物的Alpha多样性
为进一步了解CK与EK土壤微生物群落丰富度和多样性,本研究进行Ace、Chao1、Simpson等多样性指数分析[24-26]。结果(表 1)显示,各样本覆盖指数均达0.99,表明CK和EK的测序数据量均较高。Chao1和Ace越大,表明土壤微生物群落丰度越高;Simpson越大,表明土壤微生物群落多样性越高。表 1结果显示,CK的Ace指数和Chao1指数高于EK,EK的Simpson指数值高于CK,表明EK土壤样本微生物群落多样性高于CK。

|
2.4 土壤微生物的Beta多样性
为了解不同样本的微生物群落组成差异,本研究采用R软件对加权的样本数据进行非度量多维尺度法分析,并通过二维图显示CK与EK样本的群落结构分布。在PCoA图中不同颜色的点属于不同样本(组),每个点代表 1个样本,点与点之间的距离越远,表明样本之间的微生物群落结构相似度越低,差异越显著。图 3结果表明,CK与EK土壤的微生物在PCoA第一轴上明显分开,且CK1、CK2、CK3和EK1、EK2、EK3的距离较远,尤其是EK3与CK以及CK1与EK的距离,表明CK和EK之间的微生物群落构成差异明显。
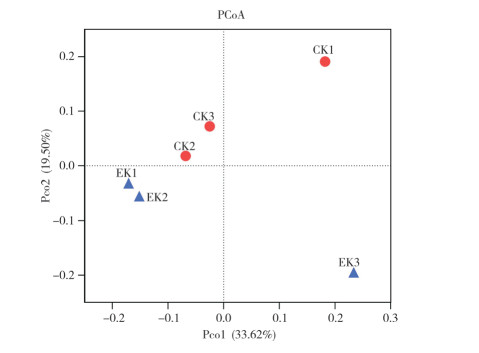
|
| 图 3 CK和EK土壤微生物群落的PCoA图 Fig. 3 PCoA diagram of soil microbial communities in CK and EK |
2.5 土壤微生物的组成及分布规律
为揭示样本间土壤微生物群落分布情况,本研究分别在界、门、纲、目、科、属、种水平上对不同样本的微生物群落结构进行分析。结果(图 4)表明,CK1、CK2、CK3、EK1、EK2和EK3在科(Family)水平上的数值和占比分别为45572(32.13%)、43 671(24.87%)、52 034 (27.32%)、56 539(23.14%)、65 812(31.13%)、54 049(26.90%);在属(Genus) 水平上的数值和占比分别为22 503(29.52%)、24 194 (28.89%)、27 602(29.57%)、33 746(32.68%)、34 994(33.10%)、30 480(32.20%);在种分类水平上的数值和占比分别为1 309(0.39%)、1 566(0.45%)、1 155(0.28%)、1 560(0.35%)、2 228(0.47%)、2 263(0.55%),CK和EK在科、属、种水平上的占比分别平均为28.11% 和27.06%、29.33% 和32.66%、0.37% 和0.46%,表明EK土壤微生物群落在属、种水平上均高于CK。
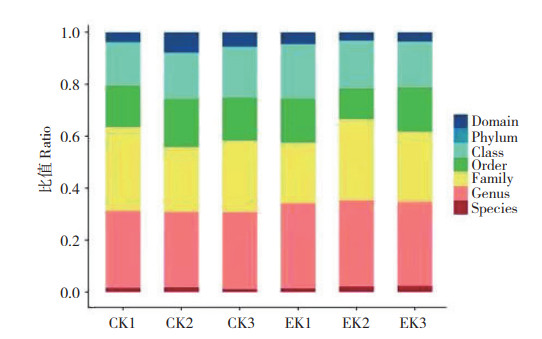
|
| 图 4 CK和EK土壤微生物群落在各分类水平的序列构成 Fig. 4 Sequence composition of soil microbial communities in CK and EK at different classification levels |
从6份样本中共分析出30门,其中有9个菌门相对丰度均大于1%。由图 5A可知,CK与EK丰度较高的微生物门类主要有绿弯菌门(Chloroflexi)、占比分别为35.75% 和37.06%,酸杆菌门(Acidobacteria)、占比分别为16.54% 和13.98%,放线菌门(Actinobacteria)、占比分别为14.47% 和14.96%,变形菌门(Proteobacteria)、占比分别为11.20%和14.36%,浮霉菌门(Planctomycetes)、占比分别为6.03% 和6.23%,疣微菌门(Verrucomicrobia)、占比分别为3.40% 和2.43%,拟杆菌门(Bacteroidetes)、占比分别为1.10%和1.87%,芽单胞菌门(Gemmatimonadales)、占比分别为1.86% 和0.95%,髌骨细菌门(Patescibacteria)、占比分别为1.00% 和0.99%。其中,绿弯菌门占比最高、丰度最大,其次是酸杆菌门、放线菌门和变形菌门,其共占CK与EK土壤微生物丰度的77.96% 和80.36%。另外,样品中均有一定比例的未知菌门。优势物种丰度热图可以通过颜色直观表达出物种丰度,颜色越红,表示丰度越大,结果与相对丰度图符合,表明测序结果真实可靠(图 5B)。

|
| A、B:门水平;C、D:种水平 A, B: Phylum level; C, D: Species level 图 5 CK和EK土壤微生物群落组成相对丰度和丰度热图 Fig. 5 Relative abundance and heat map of soil microbial communities composition in CK and EK |
从6份样本中发现162种菌,不同土壤样本丰度较高的微生物种类是拟无枝酸菌(Amycolatopsis sp.)、放线菌(Catenulispora acidiphila DSM 44928)、滋养节杆菌(Arthrobacter pascens)、热单孢菌(Thermomonosporaceae bacterium YE4-D4-16-CH2)、分枝杆菌(Mycobacterium sp. 1245111)、库兹纳菌(Kutzneria albida DSM 43870)、伯克霍尔德菌(Paraburkholderia caribensis)、粒皮菌属未分类菌(Bacterium enrichment culture clone auto39_4W)、放线菌属未分类菌(Bacterium Ellin5012)、消旋杆菌(Ktedonobacter racemifer DSM 44963)(图 5C)。其中,CK丰度较高的微生物种类主要是分枝杆菌(Mycobacterium sp. 1245111)、消旋杆菌(Ktedonobacter racemifer DSM 44963)、粒皮菌属未分类菌(Bacterium enrichment culture clone auto39 4W) 和放线菌(Catenulispora acidiphila DSM 44928)。EK丰度较高的微生物种类主要是滋养节杆菌(Arthrobacter pascens)、库兹纳菌(Kutzneria albida DSM 43870)、人参黄异杆菌(Flavisolibacter ginsengisoli)、拟无枝酸菌(Amycolatopsis sp.)、嗜铁藻菌(Leptolyngbya cf Albertano-Kovacik green Es Yyy1800)、热单孢菌(Thermomonosporaceae bacterium YE4-D4-16-CH2)和定湖杆菌(Aliidongia dinghuensis)(图 5D)。
2.6 土壤微生物的优势菌群分析为进一步了解猕猴桃林下种植大豆对土壤微生物群落变化的影响,本研究对土壤微生物优势菌群进行了分析。结果(图 6)显示,EK的优势菌群主要是变形菌门(Proteobacteria)、链藻目(Streptomycetales)、黄单胞菌目(Xanthomonadales)、1921-2属、罗丹菌科(Rhodanobacteraceae)、链霉菌科(Streptomycetaceae)、剑菌属(Ensifer)和剑菌(Ensifer adhaerens)等。CK的优势菌群主要是未知菌群Escherichia shigella、Subgroup 13、ADurbBin063 1、Subgroup 2和Lineage llc等19个。其中,Subgroup 13、ADurbBin063 1、Subgroup 2属于放线菌门(Actinobacteria),即CK和EK的门水平优势菌群分别为放线菌门(Actinobacteria)和变形菌门(Proteobacteria),这与土壤微生物组成及分布分析结果一致;而EK的剑菌属(Ensifer)和剑菌(Ensifer adhaerens)属于根瘤菌科。EK优势菌群数量高于CK,进一步表明种植大豆能显著提高土壤优势微生物群落种类。

|
| 每个环代表下一个分类学级别(门、纲、科、属和种) Each ring represents the next taxonomic level (phylum, class, family, genus and species) 图 6 基于LEfSe分析CK和EK土壤微生物群落的丰度类群(LDA > 2、P < 0.05) Fig. 6 Abundance groups for soil microbial communities in CK and EK based on LEfSe analysis (LDA > 2、P < 0.05) |
3 讨论
猕猴桃具有较高的营养和经济价值,在我国南方地区广泛种植,其在不同生长阶段与不同植物间种套种对土壤中微生物的物种组成和群落结构均有明显影响[6, 28]。本研究结果发现,在猕猴桃林下种植大豆土壤(EK)的微生物群落特有OTU数高于对照土壤(CK),表明猕猴桃林下种植大豆增加了土壤微生物群落丰度和多样性。Tan等[29]利用3种不同的土壤介质种植羊肚菌,发现土壤真菌和细菌特有OTU种类具有明显差异,认为增加土壤有机质有利于增加土壤微生物丰度。本研究Alpha多样性分析发现,猕猴桃林下种植大豆土壤微生物群落Simpson指数有所提高,表明其微生物多样性高。
本研究通过主坐标分析(PCoA)CK和EK土壤微生物群落结构差异,发现CK与EK土壤的微生物在PCoA第一轴上明显分开,且CK1、CK2、CK3和EK1、EK2、EK3的距离较远,表明猕猴桃林下种植大豆不仅增加了土壤微生物丰度,而且改变了土壤微生物群落结构。蔡杰等[31]在研究施肥方式对木薯根际土壤细菌多样性与群落结构特征影响时发现,未施肥土壤和常规施肥土壤微生物群落结构相似,但与化肥减量土壤微生物群落不同,表明常规施肥只改变木薯根际微生物的丰度,微生物群落结构并无太大变化,但是化肥减施不仅降低了木薯根际微生物的丰度,还改变了微生物群落结构。胡峻峰等[31]在研究广藿香间作生姜与豇豆对根际微生物群落多样性影响时也发现,间作可以改变土壤细菌菌群结构。
土壤微生物群落组成受宿主植物、微生物与土壤理化环境互作的影响[32]。微生物群落结构的差异也受到间种、套种的植物品种、施肥方式和种植类型等因素影响,绿弯菌门、变形菌门和放线菌门对改善土壤营养成分和抵抗逆境有关,变形菌门和放线菌门大多是富营养型细菌类群,变形菌门与土壤有机质、碱解氮和有效磷等呈显著正相关,土壤pH值与绿弯菌门呈显著负相关,而与变形菌门显著正相关[33-36]。本研究发现,猕猴桃林下种植大豆土壤微生物群落在属、种水平上均高于CK,表明猕猴桃林下种植大豆可以提高土壤微生物群落丰度和多样性。且猕猴桃林下土壤微生物丰度较高的为酸杆菌门、放线菌门、变形菌门、绿弯菌门。Ren等[37]不同套种模式研究也发现,变形菌门、酸杆菌门、放线菌门和绿弯菌门为土壤中微生物群落丰度较高的门类。通过对土壤优势菌进行分析发现,CK的优势菌群包括未知菌群Lineage llc、Subgroup 13、ADurbBin063 1、Subgroup 2和Escherichia shigella等19个;EK的优势菌群包括变形菌门、1921-2属、黄单胞菌、罗丹菌科、链霉菌科、链藻目、剑菌属和剑菌等41个。其中,猕猴桃林下种植大豆土壤(EK)的门水平优势菌群为变形菌门(Proteobacteria),而CK的门水平优势菌群为放线菌门(Actinobacteria)。同时,EK的剑菌属(Ensifer)和剑菌(Ensifer adhaerens)属于变形菌门(Proteobacteria)根瘤菌科。表明猕猴桃林下种植大豆能显著提高土壤优势微生物种类,能提高有益菌群的丰富度和多样性,对改善猕猴桃林下土壤有效成分和提高土壤肥力有重要促进作用,对猕猴桃的产量和品质提升有重要影响。
4 结论通过对比猕猴桃林下种植与未种植大豆的土壤微生物菌群,种植大豆能够提高猕猴桃土壤OTU水平上特有的微生物菌群和改变微生物菌群丰度。通过Alpha多样性和Beta多样性分析,发现猕猴桃林下种植大豆不仅可增加土壤微生物丰度,还可改变土壤微生物群落结构。猕猴桃林下种植大豆土壤的优势菌群有41种,而CK只有19种,EK的微生物菌群多样性也优于CK;猕猴桃林下种植大豆土壤微生物群落在门水平上的优势菌群为变形菌门(Proteobacteria),而CK优势菌群为放线菌门(Actinobacteria),EK优势菌还包括根瘤菌科下剑菌属(Ensifer)的剑菌(Ensifer adhaerens)。表明猕猴桃林下种植大豆提高了土壤微生物群落丰富度和多样性以及一些有益菌群,为发展猕猴桃林下经济以及改善猕猴桃林土壤、提高猕猴桃品种和质量打下基础。
| [1] |
黄春源, 梁红. 影响广东猕猴桃产量与品质的主要因素及其对策[J]. 安徽农业科学, 2018, 46(7): 57-58, 85. DOI:10.13989/j.cnki.0517-6611.2018.07.018 HUANG C Y, LIANG H. Main factors affecting the yield and quality of Guangdong kiwifruit and their countermeasures[J]. Journal of Anhui Agricultural Sciences, 2018, 46(7): 57-58, 85. DOI:10.13989/j.cnki.0517-6611.2018.07.018 |
| [2] |
黄春源, 梁红, 刘忠平. 丘陵山地猕猴桃绿色轻简高效栽培技术的应用[J]. 南方农业, 2020, 14(11): 15-16. DOI:10.19415/j.cnki.1673-890x.2020.11.008 HUANG C Y, LIANG H, LIU Z P. Application of green, light, simple, and efficient cultivation techniques for kiwifruit in hilly mountains[J]. Journal of Southern Agriculture, 2020, 14(11): 15-16. DOI:10.19415/j.cnki.1673-890x.2020.11.008 |
| [3] |
王兵爽, 李淑君, 张舒桓, 徐昊, 徐国华, 任丽轩. 西瓜根系分泌酸性磷酸酶对有机肥营养的响应[J]. 土壤学报, 2019, 56(2): 454-465. DOI:10.11766/trxb201807090318 WANG B S, LI S J, ZHANG S H, XU H, XU G H, REN L X. Responses of acid phosphatase secreted by watermelon roots to organic manure nutrition[J]. Acta Pedologica Sinica, 2019, 56(2): 454-465. DOI:10.11766/trxb201807090318 |
| [4] |
李洁, 王飞, 徐凌川. 基于高通量分析泰山白首乌根际土壤细菌群落结构[J]. 广东农业科学, 2019, 56(5): 75-84. DOI:10.16768/j.issn.1004-874X.2022.05.009 LI J, WANG F, XU L C. Bacterial community structure of rhizosphere soil of cynanchum bungei decne based on high-throughput analysis[J]. Guangdong Agricultural Sciences, 2019, 56(2): 454-465. DOI:10.16768/j.issn.1004-874X.2022.05.009 |
| [5] |
李青梅, 张玲玲, 刘红梅, 张艳军, 赵建宁, 张海芳, 杨殿林, 王慧. 覆盖作物多样性对猕猴桃园土壤微生物群落功能的影响[J]. 农业环境科学学报, 2020, 39(2): 351-359. DOI:10.11654/jaes.2019-0968 LI Q M, ZHANG L L, LIU H M, ZHANG Y J, ZHAO J N, ZHANG H F, YANG D L, WANG H. Effects of cover crop diversity on soil microbial community functions in a kiwifruit orchard[J]. Journal of Agro-Environment Science, 2020, 39(2): 351-359. DOI:10.11654/jaes.2019-0968 |
| [6] |
任春光, 苏文文, 饶念贤, 龙云川, 王加国, 李苇洁. 猕猴桃苗不同生长时期根际细菌群落结构分析[J]. 西南农业学报, 2022, 35(4): 932-940. DOI:10.16213/j.cnki.scjas.2022.4.025 REN C G, SU W W, RAO N X, LONG Y C, WANG J G, LI W J. Analysis on rhizosphere bacterial community structure of kiwifruit seedlings at different growth stages[J]. Southwest China Journal of Agricultural Sciences, 2022, 35(4): 932-940. DOI:10.16213/j.cnki.scjas.2022.4.025 |
| [7] |
杨钰莹, 司伟, 汤松, 陈渊, 张明荣, 马俊奎, 梁福琴. 果园间套种大豆: 生产现状、发展潜力与政策建议[J]. 大豆科学, 2022, 43(2): 235-244. DOI:10.11861/j.issn.1000-9841.2023.02.0235 YANG Y Y, SI W, TANG S, CHEN Y, ZHANG M R, MA J K, LIANG F Q. Soybean interplanting in orchards: Production status, development potential and policy recommendations[J]. Soybean Science, 2022, 43(2): 235-244. DOI:10.11861/j.issn.1000-9841.2023.02.0235 |
| [8] |
JENNIFER B. Functional traits in cover crop mixtures: Biological nitrogen fixation and multifunctionality[J]. Journal of Applied Ecology, 2018, 55(1): 38-48. |
| [9] |
李磊, 龙友华, 尹显慧, 吴小毛, 杨再福, 张竹竹, 舒然. 猕猴桃园套种蕺菜对土壤养分、酶活性及果实品质的影响[J]. 经济林研究, 2019, 37(3): 128-137. DOI:10.14067/j.cnki.1003-8981.2019.03.019 LI L, LONG Y H, YIN X H, WU X M, YANG Z F, ZHANG Z Z, SHU R. Effects of intercropping Houttuynia cordata on soil nutrients, soil enzyme activity and fruit quality in kiwifruit orchard[J]. Non-wood Forest Research, 2019, 37(3): 128-137. DOI:10.14067/j.cnki.1003-8981.2019.03.019 |
| [10] |
张承, 王秋萍, 周开拓, 吴小毛, 龙友华, 李姣红, 尹显慧. 猕猴桃园套种吉祥草对土壤酶活性及果实产量、品质的影响[J]. 中国农业科学, 2018, 51(8): 1556-1567. DOI:10.3864/j.issn.0578-1752.2018.08.013 ZHANG C, WANG Q P, ZHOU K T, WU X M, LONG Y H, LI J H, YIN X H. Effects of intercropping reineckia carnea on soil enzyme activity and kiwifruit fruit yield, quality in kiwifruit orchard[J]. Scientia Agricultura Sinica, 2018, 51(8): 1556-1567. DOI:10.3864/j.issn.0578-1752.2018.08.013 |
| [11] |
胡培蓉. 猕猴桃园套种紫云英对土壤肥力及猕猴桃品质的影响[J]. 东南园艺, 2019(5): 15-17. HU P R. Effect of interplanting chinese milk vetch in kiwifruit orchard on soil fertility and kiwifruit quality[J]. Southeast Horticulture, 2019(5): 15-17. |
| [12] |
井赵斌, 李腾飞, 龙明秀, 马文娟. 生草对猕猴桃果园土壤酶活性和土壤微生物的影响[J]. 草业科学, 2020, 37(9): 1710-1718. DOI:10.11829/j.issn.1001-0629.2020-0043 JING Z B, LI T F, LONG M X, MA W J. Effects of planted grasses on soil enzyme activities and microbial communities in a kiwifruit orchard[J]. Pratacultural Science, 2020, 37(9): 1710-1718. DOI:10.11829/j.issn.1001-0629.2020-0043 |
| [13] |
常威, 刘军, 邓思怡, 刘全科, 陈富华, 蔡高磊, 汪华, 罗小康. 林下套种对猕猴桃溃疡病的影响[J]. 湖北植保, 2023(2): 22-24. CHANG W, LIU J, DENG S Y, LIU Q K, CHEN F H, CAI G L, WANG H, LUO X K. Effect of intercropping under the forest on kiwifruit canker disease[J]. Hubei Plant Protection, 2023(2): 22-24. |
| [14] |
李欣欣, 许锐能, 廖红. 大豆共生固氮在农业减肥增效中的贡献及应用潜力[J]. 大豆科学, 2016, 35(4): 531-535. DOI:10.11861/j.issn.1000-9841.2016.04.0531 LI X X, XU R N, LIAO H. Contributions of symbiotic nitrogen fixation in soybean to reducing fertilization while increasing efficiency in agriculture[J]. Soybean Science, 2016, 35(4): 531-535. DOI:10.11861/j.issn.1000-9841.2016.04.0531 |
| [15] |
朱海荣. 减氮条件下增施根瘤菌肥和叶面液肥对大豆生长发育和产量的影响[J]. 江苏农业科学, 2022, 50(1): 60-65. DOI:10.15889/j.issn.1002-1302.2022.01.011 ZHU H R. Effects of increased application of rhizobia fertilizer and foliar liquid fertilizer on growth and yield of soybean under nitrogen reduction condition[J]. Jiangsu Agricultural Sciences, 2022, 50(1): 60-65. DOI:10.15889/j.issn.1002-1302.2022.01.011 |
| [16] |
张晓娜, 陈平, 杜青, 周颖, 任建锐, 金福, 杨文钰, 雍太文. 玉米/大豆、玉米/花生间作对作物氮素吸收及结瘤固氮的影响[J]. 中国生态农业学报, 2019, 27(8): 1183-1194. DOI:10.13930/j.cnki.cjea.181055 ZHANG X N, CHEN P, DU Q, ZHOU Y, REN J R, JIN F, YANG W Y, YONG T W. Effects of maize/soybean and maize/peanut intercropping systems on crops nitrogen uptake and nodulation nitrogen fixation[J]. Chinese Journal of Eco-Agriculture, 2019, 27(8): 1183-1194. DOI:10.13930/j.cnki.cjea.181055 |
| [17] |
何忠军, 张秀英, 龙德祥, 姚平波, 李勤, 张增川, 温友斌, 陈浩, 李云, 王一璞, 李戈莲, 任晓菊, 赵建新. 秦巴山地玉米套种条件下大豆品种丰产及稳产性分析[J]. 湖北农业科学, 2022, 61(16): 47-51. DOI:10.14088/j.cnki.issn0439-8114.2022.16.008 HE Z J, ZHANG X Y, LONG D X, YAO P B, LI Q, ZHANG Z C, WEN Y B, CHEN H, LI Y, WANG Y P, LI G L, REN X J, ZHAO J X. Analysis on the high yield and stable yield of soybean varieties under the condition of maize interplanting in Qinba mountain area[J]. Hubei Agricultural Sciences, 2022, 61(16): 47-51. DOI:10.14088/j.cnki.issn0439-8114.2022.16.008 |
| [18] |
杜勇利, 周俊辉, 廖霏霏, 刘兴贵, 熊湖, 张林, 殷勇, 张德银. 糯红高粱-大豆间作对鲜大豆农艺性状及经济效益的影响研究[J]. 广东农业科学, 2021, 48(2): 17-25. DOI:10.16768/j.issn.1004-874X.2021.02.003 DU Y L, ZHOU J H, LIAO F F, LIU X G, XIONG H, ZHANG L, YIN Y, ZHANG D Y. Study on effects of glutinous sorghum and soybean intercropping mode on agronomic characters of fresh soybean and economic benefits[J]. Guangdong Agricultural Sciences, 2021, 48(2): 17-25. DOI:10.16768/j.issn.1004-874X.2021.02.003 |
| [19] |
彭晓邦. 农林复合生态系统研究与实践[M]. 杨凌: 西北农林科技大学出版社, 2017. PENG X B. Research and practice of agroforestry ecosystem[M]. Yangling: Northwest A & F University Press, 2017. |
| [20] |
屠娟丽, 庄应强, 任萍. 果园间作套种立体栽培实用技术[M]. 北京: 中国农业出版社, 2014. TU J L, ZHUANG Y Q, REN P. Practical technology of intercropping and intercropping three-dimensional cultivation in orchard[M]. Beijing: China Agricultural Press, 2014. |
| [21] |
屈洋, 王可珍, 康军科, 梁福琴. 苹果幼园套种大豆模式对产量及农田环境的影响[J]. 农学学报, 2021, 11(10): 28-32. DOI:10.11923/j.issn.2095-4050.cjas20200100005 QU Y, WANG K Z, KANG J K, LIANG F Q. Young apple orchard intercropping soybean: Effects on soybean yield and farmland environment[J]. Journal of Agriculture, 2021, 11(10): 28-32. DOI:10.11923/j.issn.2095-4050.cjas20200100005 |
| [22] |
张德, 龙会英. 4个豆科牧草在干热河谷生态芒果园的应用研究[J]. 草地学报, 2017, 25(3): 612-617. DOI:10.11733/j.issn.1007-0435.2017.03.02 ZHANG D, LONG H Y. Research of four Leguminous forages application in ecologic Mangifera indica orchard of the dry-hot valley[J]. Acta Grestia Sinica, 2017, 25(3): 612-617. DOI:10.11733/j.issn.1007-0435.2017.03.02 |
| [23] |
CHEN S F, ZHOU Y Q, CHEN Y R, GU J. FASTP: an ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics, 2018, 34(17): 884-890. DOI:10.1101/274100 |
| [24] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, BITTINGER K, BUSHMAN F D, COSTELLO E K, FIERER N, PEÑA A G, GOODRICH J K, GORDON J I, HUTTLEY G A, KELLEY S T, KNIGHTS D, KOENIG J E, LEY R E, LOZUPONE C A, MCDONALD D, MUEGGE B D, PIRRUNG M, REEDER J, SEVINSKY J R, TURNBAUGH P J, WALTERS W A, WIDMANN J, YATSUNENKO T, ZANEVELD J, KNIGHT R. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [25] |
CONWAY J R, LEX A, GEHLENBORG N. UpSetR: An R package for the visualization of intersecting sets and their properties[J]. Bioinformatics, 2017, 33(18): 2938-2940. DOI:10.1093/bioinformatics/btx364 |
| [26] |
TAUNO M, JAAK V. ClustVis: A web tool for visualizing clustering of multivariate data using Principal Component Analysis and heatmap[J]. Nucleic Acids Research, 2015, 43(S1): 566-570. DOI:10.1093/nar/gkv468 |
| [27] |
SEGATA N, IZARD J, WALDROM L, DIRK G, LARISA M, WENDY S G, CURTIS H. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 2011, 12(6): 1-18. DOI:10.1186/gb-2011-12-6-r60 |
| [28] |
靳旭妹, 王莹莹, 刘崇义, 陈新义, 龙明秀, 何树斌. 生草对关中地区有机猕猴桃园土壤养分及细菌群落的影响[J]. 草业学报, 2022, 31(10): 53-63. DOI:10.11686/cyxb2021414 JIN X M, WANG Y Y, LIU C Y, CHEN X Y, LONG M X, HE S B. Effects on soil nutrients and bacterial communities of different cover crops in an organic kiwifruit orchard in the Guanzhong region of China[J]. Acta Prataculturae Sinica, 2022, 31(10): 53-63. DOI:10.11686/cyxb2021414 |
| [29] |
TAN H, YU Y, TANG J, LIU T H, MIAO R Y, HUANG Z Q, MARTIN F M, PENG W. Build your own mushroom soil: Microbiota succession and nutritional accumulation in semi-synthetic substratum drive the fructification of a soil-saprotrophic morel[J]. Frontiers in Microbiology, 2021, 12: 656656. DOI:10.3389/fmicb.2021.656656 |
| [30] |
蔡杰, 张洁, 喻珊, 林洪鑫, 李开绵, 陈松笔, 欧文军. 施肥方式对木薯根际土壤细菌多样性与群落结构特征的影响[J]. 福建农林大学学报(自然科学版), 2022, 51(1): 15-20. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2022.01.002 CAI J, ZHANG J, YU S, LIN H X, LI K M, CHEN S B, OU W J. Effect of fertilization on bacterial diversity and community structure characteristics in cassava rhizospheric soil[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2022, 51(1): 15-20. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2022.01.002 |
| [31] |
胡峻峰, 曾建荣, 刘键锺, 张宏意, 庞玉新, 严寒静. 广藿香间作生姜与豇豆对其根际微生物群落多样性的影响[J]. 中药材, 2022, 45(10): 2316-2321. DOI:10.13863/j.issn1001-4454.2022.10.006 HU J F, ZENG J R, LIU J Z, ZHANG H Y, PANG Y X, YANG H J. Patchouli intercropping with ginger cowpea on rhizosphere m icrobia l com mun it y diver sit y[J]. Journal of Chinese Medicinal Materials, 2022, 45(10): 2316-2321. DOI:10.13863/j.issn1001-4454.2022.10.006 |
| [32] |
郑灏, 杨志坚, 冯金玲, 陈世品, 林文俊, 白玉娜, 郑国华, 陈辉. 不同林下套种模式对油茶幼林根区土壤化学特性及微生物的影响[J]. 福建农林大学学报(自然科学版), 2015, 44(2): 147-153. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2015.02.007 ZHENG H, YANG Z J, FENG J L, CHEN S P, LIN W J, BAI Y N, ZHENG G H, CHEN H. Effects of interplanting patterns on chemical properties and microbial community in root zone soils of young Camellia oleifera forest[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2015, 44(2): 147-153. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2015.02.007 |
| [33] |
斯林林, 徐静, 曹凯, 张贤, 王建红. 绿肥种植对红壤旱地生土细菌群落结构的影响[J/OL]. 浙江农业学报, https://kns.cnki.net/kcms2/detail/33.151.S.20230711.1605.002.html. SI L L, XU J, CAO K, ZHANG X, WANG J H. Response of bacterial community to planting cover crops in virgin red soil under upland [J/OL]. Acta Agriculturae Zhejiangensis. https://kns.cnki.net/kcms2/detail/33.151.S.20230711.1605.002.html. |
| [34] |
ZHANG Y G, CONG J, LU H, LI G L, QU Y Y, SU X J, ZHOU J Z, LI D Q. Community structure and elevational diversity patterns of soil acidobacteria[J]. Journal of Environmental Sciences, 2014, 26(8): 1717-1724. DOI:10.1016/j.jes.2014.06.012 |
| [35] |
梁满, 孟维伟, 陈志德, 沈一, 刘永惠, 沈悦, 刘柱, 南镇武, 徐杰, 张正. 施氮水平对花生根际土壤微生物群落结构和多样性的影响[J]. 山东农业科学, 2023, 55(2): 78-83. DOI:10.14083/j.issn.1001-4942.2023.02.011 LIANG M, MENG W W, CHEN Z D, SHEN Y, LIU Y H, SHEN Y, LIU Z, NAN Z W, XU J, ZHANG Z. Effects of nitrogen application levels on microbial community structure and diversity of peanut rhizosphere soil[J]. Shandong Agricultural Sciences, 2023, 55(2): 78-83. DOI:10.14083/j.issn.1001-4942.2023.02.011 |
| [36] |
刘沙沙, 操江飞, 陈显宇, 梁绮彤. 微塑料-多环芳烃对农用地土壤微生物群落结构和功能的影响[J]. 广东农业科学, 2022, 49(8): 64-72. DOI:10.16768/j.issn.1004-874X.2022.08.008 LIU S S, CAO J F, CHEN X Y, LIANG Q T. Effects of microplastics-polycyclic aromatic hydrocarbons on microbial community structure and function in agricultural soil[J]. Guangdong Agricultural Sciences, 2022, 49(8): 64-72. DOI:10.16768/j.issn.1004-874X.2022.08.008 |
| [37] |
REN C J, ZHANG W, ZHONG Z K, HAN X H, YANG G H, FENG Y Z, REN G X. Differential responses of soil microbial biomass, diversity, and compositions to altitudinal gradients depend on plant and soil characteristics[J]. Science of the Total Environment, 2018, 610-611. DOI:10.1016/j.scitotenv.2017.08.110 |
(责任编辑 张辉玲)
 2024, Vol. 51
2024, Vol. 51