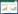文章信息
基金项目
- 肇庆市农业工程技术中心项目(2019);肇庆市科技创新指导类项目(2022)
作者简介
- 李霜霜(1990—),女,硕士,农艺师,研究方向为柑橘等温热带水果栽培技术,E-mail:18819266171@163.com.
通讯作者
- 钟春燕(1977—),女,硕士,正高级农艺师,研究方向为水稻、番薯等农作物育种栽培、试验示范和推广应用,E-mail:nkszcy@163.com.
文章历史
- 收稿日期:2023-09-28
【研究意义】柑橘是橘、柑、橙、金柑,柚、枳等的总称,属芸香科植物。根据世界柑橘组织发布的报告,全球有140多个国家和地区生产柑橘,中国是柑橘的重要原产地之一,有4 000多年的栽培历史,中国的柑橘园面积及柑橘产量常年稳居世界首位。肇庆是我国柑橘重要起源地和广东传统的柑橘产业大市,全市柑橘种植面积6.3万hm2以上,肇庆市辖区的四会砂糖橘、德庆贡柑等地方特色柑橘享誉中外,已成为农户发家致富、助力乡村振兴的重要产业之一。铺地木蓝(Indigofera spicata)又称穗序木蓝,属豆科(Leguminosae) 木蓝属(Indigofera) 植物,具有多种功能,被用于医药、园林绿化、生态治理、农业等领域,分布于中国、印度、东南亚及热带非洲。铺地木蓝在我国主要分布在台湾、广东、广西和云南等地区,生于空旷地、竹园、路边潮湿的向阳处,对土壤条件要求不高,具有较强的抗瘠薄、抗旱能力,耐一定程度的荫蔽。当荫蔽度在30% 以下时,铺地木蓝可正常生长、开花结果[1-2],超过一定的荫蔽度时,其虽能正常生长,但生长较瘦弱,基本不开花结果;同时,铺地木蓝还耐水淹,不同水质淹没21 d后存活率仍为100%[3-4],亦能忍受一定的低温,短时间0 ℃下不会发生冻伤。【前人研究进展】铺地木蓝含有一种天然的肝毒素物质:吲哚吡啶(Indospicine),其作为牧草全株都会对食草动物(牛、羊、马、骆驼等)产生毒害,长期食用铺地木蓝会导致食草动物肝中毒和生殖丧失,产生的毒素会在组织与器官中积累且清除缓慢,投喂中毒动物的肉会对狗造成二次毒害,造成致命的肝中毒[5-6]。在医学领域,铺地木蓝作为药用植物,其含的某些特殊物质可作为抗癌先导化合物[7-9];吲哚吡啶联合精氨酸可对人结肠直肠癌细胞产生毒性,克服了某些癌细胞对单一疗法的耐药性[10]。在热带与温热带地区,铺地木蓝在咖啡、茶叶和橡胶种植园中被广泛种植,用于覆盖物、绿肥和控制侵蚀植物[11]。在赞比亚地区其还被种植于废弃矿区,用于稳定重金属物质、减少矿区上空重金属气溶胶含量,降低周边居民的健康风险[12]。【本研究切入点】目前,国内主要报道铺地木蓝作为一种地被植物种植在果园、茶园、坡地、人工经济林、河涌、绿化带等地方,用于绿肥、护坡、观赏植物等,也可改良土壤理化性质、增加土壤有机质、降低土壤酸度。同其他豆科绿肥一样,铺地木蓝能“以磷钾增氮”,也可“以固氮集磷钾” [13]。但在铺地木蓝对其他杂草的抑制作用,以及对土壤多样性的影响方面很少报道。肇庆地区的柑橘大多种植在山地,机械化作业程度不高,随着人工成本的增高,果园杂草管理成为果农的难题之一。【拟解决的关键问题】本试验探究了铺地木蓝在柑橘果园种植1年后对杂草、土壤理化性质与土壤多样性的影响,以期为铺地木蓝在果园生草方面的推广应用提供理论基础和技术支持。
1 材料与方法 1.1 试验地概况本试验开展于肇庆市鼎湖区肇庆市农业科学研究所沙浦柑橘资源圃基地(23°15′~23°20′N、112°65′~112°90′E),海拔为3.9 m,位处亚热带季风气候区,年平均气温21.93 ℃,年平均降雨量约2 000 mm,雨量充沛,平均日照1 815.72 h,平均全年无霜期为336 d,平均年总积温1 989.3 ℃。该柑橘资源圃种有沙糖桔、贡柑等8个品种,均为3年生果树,按高垄窄株宽行(株距2.0~3.0 m,株行距5.0 m,垄高60 cm,垄宽1.0 m)进行栽培管理。
1.2 试验材料供试铺地木蓝为肇庆市农业科学研究所2019年从珠海市现代农业发展中心引种,并在排水渠防护坡、道路两旁空闲地等场所试种成功。试验所用铺地木蓝为扦插苗。
遮草布(克重90,4×100 m/卷)、银黑地膜(4 m宽,20 kg/卷)均购自广州万木奇园林用品有限公司。
1.3 试验设计试验设置4个处理:CK1为自然生草,PD1处理为土壤覆盖遮草布,PD2处理为土壤覆盖银黑地膜后,再种植铺地木蓝(株行距50 cm×50 cm),PD3处理为种植铺地木蓝(株行距50 cm×50 cm),每个处理3次重复,共12个小区,每小区面积为20 m×4 m。采用随机区组设计,试验前统一清理柑橘果树行间杂草,于2022年3月开始铺地木蓝扦插育苗,4月初移栽。为避免铺地木蓝抢夺果树营养,生草区与种植垄面保持1.0 m距离。PD2与PD3处理铺地木蓝移栽后,前7 d进行浇水保湿管理,保证成活率95% 以上。4个处理前6个月进行人工统一拔除杂草3次,之后不再除草,次年4月初进行杂草调查。
2023年4月24日,每个处理小区按“S”型5点取样,3个重复取样土壤充分混合为一个样,过孔径为2 mm筛后分为2份,1份风干后用于土壤理化性质测定,另1份干冰保存,及时送样至南京佰壹生物技术有限公司进行测序。
1.4 测定指标和方法1.4.1 杂草调查 2023年4月3日,调查每个处理小区的杂草种类,同一处理不同小区的杂草种类归纳在一起。
1.4.2 土壤理化性质测定 用内径2.5 cm土钻取0~20 cm处的土壤,采用NY/T 1377-2007测定土壤pH值;采用NY/T 1121.24-2012测定土壤全氮含量;参考鲍士旦[14]采用碱解扩散法测定土壤碱解氮含量;采用NY/T 1121.7-2014测定土壤速效磷含量;采用NY/T 88-1988测定土壤全磷含量;采用NY/T 87-1988测定土壤全钾含量;采用NY/T 889-2004测定土壤速效钾含量;采用NY/T 1121.6-2006测定土壤有机质含量。
1.4.3 土壤细菌多样性测序 通过16S rDNA扩增子测序,设计16S V3-V4区特定引物进行PCR扩增特异区域,得到420 bp左右扩增片段。加接头,采用Illumina Novaseq 6000平台,测序得到2×250 bp的paired-end数据,通过拼接得到较长原始序列,对原始数据进行拼接、过滤,得到有效数据,进行16S分析[15-17]。
1.5 数据分析用Microsoft Excel 2020进行数据初步整理。α多样性和β多样性均使用QIIME(V1.9.1)计算,使用R(V3. 6. 2)作图;OTU物种注释通过软件QIIME(V1.9.1)从各个OTU中挑选出丰度最高的一条序列作为代表序列,再使用Uclust方法比对代表序列至Silva rRNA数据库(Release_132),对OTU进行物种归类;使用Python (V2.7.18) matplotlib库进行主坐标分析(Principal Co-ordinates Analysis,PCoA);使用R(V3.6.2)vegan程序包进行非度量多维尺度分析NMDS分析(Non-metric multidimensional scaling,NMDS);使用软件PICRUSt2(V2.1.2)比对OTU代表序列至KEGG PATHWAY数据库和COG数据库,对OTU功能进行预测,分别使用R(V3.6.2)ggplot 2程序包和Pheatmap程序包绘制KEGG不同分类水平下功能丰度堆叠柱状图和功能注释聚类热图。
2 结果与分析 2.1 4种不同处理对柑橘园杂草的抑制作用经过1年的试验,PD1、PD2、PD3处理对杂草的抑制效果见表 1。对照组CK1杂草种类涉及21个科45个种,主要集中在禾本科、莎草科、菊科、蓼科、茄科;PD1处理防草效果最好,无杂草出现,其次是PD2处理,只在地膜边缘长有零星杂草,涉及7个科8种杂草,PD3处理杂草种类涉及18个科30个种,主要集中在禾本科、莎草科和菊科,调查发现PD3明显减少了鬼针草、牛筋草等恶性杂草数量;说明使用遮草布防控杂草效果最好,种植铺地木蓝+地膜处理对杂草的防控效果也较佳,只有地膜边缘长有零星杂草,实际生产中可以便利除掉;种植铺地木蓝的处理,前3个月杂草生长较多,但经过1年的相互竞争,虽然涉及的杂草种类还有30种,但只是零星出现,除构树、苎麻等乔木或灌木类的杂草外,其他科的杂草已无生态位优势(图 1)。

|
| 图 1 铺地木蓝对禾本科和苋科(A)、蕨科(B)、荨麻科(C)杂草的抑制效果 Fig. 1 Inhibition effects of Indigofera spicata on weeds of Gramineae and Amaranthaceae (A), Pteridiaceae (B) and Urticaceae (C) |
2.2 4种不同处理对柑橘园土壤理化性质的影响
由表 2可知,4个处理土壤pH值均呈弱碱性;土壤全氮含量PD2>PD3>CK1>PD1,碱解氮含量PD3>PD2>CK1>PD1,PD2、PD3处理全氮含量分别为0.86、0.85 mg/g,比CK1、PD1处理提高1.7~1.8倍,碱解氮含量PD3处理比PD2处理仅高出0.30 mg/g,PD2处理碱解氮含量比分别PD1、CK1处理高出27.48、20.99 mg/kg,PD1处理比CK1处理土壤全氮、碱解氮含量分别低0.03、6.44 mg/kg,说明与自然生草模式相比,种植铺地木蓝可以提高土壤全氮与碱解氮含量,增加土壤碱解氮的,覆盖遮草布刚好相反,会降低土壤全氮和碱解氮的含量;铺地木蓝主要靠直根系固氮,匍匐茎节间长出的不定根对全株固氮作用影响甚微;种植铺地木蓝、铺地木蓝+地膜2种模式对提高土壤全氮含量几乎无差别,但前者能稍微提高土壤碱解氮含量。PD2处理土壤全磷、速效磷含量最高,PD1处理土壤全磷含量最低,两者相差0.37 g/kg,PD3处理与CK1处理全磷含量一样,但PD3处理速效磷含量最低,与PD1、PD2、CK1分别相差4.48、13.17、6.88 mg/kg,说明铺地木蓝+地膜种植模式,不仅可以增加土壤全磷含量,还能提高土壤速效磷含量,裸种铺地木蓝会降低土壤速效磷含量,但土壤全氮含量与自然生草处理效果一致,覆盖遮草布会一定程度降低土壤全氮、速效磷含量;土壤全钾含量PD1、PD2、PD3 3个处理均大于CK1处理,土壤速效钾含量刚好相反,CK1处理高于3个处理,其中,PD2处理土壤全钾含量最高,速效钾含量比CK1处理低7.03 mg/kg,比PD1、PD3高出近20.0 mg/kg,PD1与PD3处理对土壤全钾、速效钾含量影响效果相当,说明土壤表面有覆盖物(遮草布、农膜、铺地木蓝)能一定程度提高土壤全钾含量,但会减少土壤有效钾含量。土壤有机质含量PD2>PD1,均比CK1处理高,PD3最低,说明铺地木蓝+地膜种植模式能明显增加土壤有机质含量,增加量约是自然生草的21%,裸种铺地木蓝处理土壤有机质含量最低,可能是因为有机质发生了矿化作用,部分有机质分解并释放出氮元素,这与PD3处理碱解氮含量最高相吻合。

|
2.3 4种不同处理对柑橘园土壤细菌多样性的影响
通过Illumina Novaseq 6000平台对样本土壤细菌16S rDNA的V3-V4区进行序列测定,4个样品测序共获得503 341条原始序列,经过滤后共产生353 528条有效序列,每个样品至少产生71 528条有效序列,平均产生88 382条有效序列。利用vsearch在0.97相似度下对测试结果进行聚类,4个样品共产生5 748个OTU。
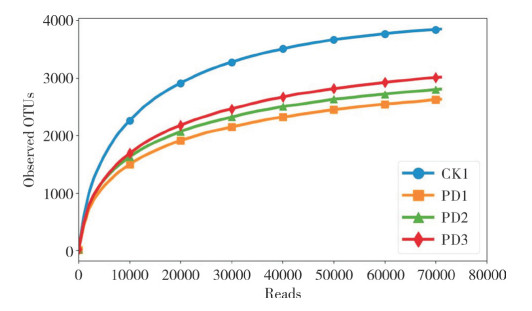
根据OTUs稀释曲线(图 2)可知,4个样品曲线均有渐进平坦的趋势,说明样品测序数据量合理,OTUs的覆盖度高,测序深度可以满足试验要求。图 3是在0.97的相似度下得到每一样品的OTU个数,可知4个样品共有991个核心OTUs,CK1、PD1、PD2、PD3分别共有3 848、2 646、2 805、3 025个OTUs,特有OTUs分别为892、690、330、336个,说明与自然生草相比,采用遮草布、种植铺地木蓝或铺地木蓝+地膜处理,会减少土壤中总物种类别和特有物种类别。图 4对4个处理的土壤细菌群落进行非度量多维尺度分析(Weighted_unifrac NMDS)分析,结果表明4个处理土壤细菌群落结构有明显差异。
|
| 图 2 OTUs稀释曲线 Fig. 2 OTUs rarefaction curve |
|
| 图 3 样品Venn图 Fig. 3 Venn diagram of different samples |

|
| 当stress<0.1时,可认为是一个好的排序;当stress<0.05时,则具有很好的代表性;通常认为,当Stress<0.2时,表明NMDS分析具有一定的可靠性;在坐标图上距离越近的样品,相似性越高 When stress < 0.1, it can be considered a good sorting; When stress < 0.05, it has a good representative. It is generally believed that when the Stress is < 0.2, it indicates that the NMDS analysis has a certain reliability; The closer the samples are on the graph, the higher the similarity 图 4 土壤细菌群落结构的非度量多维尺度分析 Fig. 4 Nonmetric multidimensional scaling (weighted_unifrac NMDS) analysis of soil bacterial community structure |
2.4 4种不同处理对柑橘园土壤细菌α多样性指数的影响
α多样性(α Diversity)是对某个样品中物种多样性的分析,包含样品中的物种组成的丰富度(Richness)和均匀度(Evenness)两个因。Chao指数(Chao1 index)反映样品中群落的丰富度(Species richness),即简单指群落中物种的数量,而不考虑群落中每个物种的丰度情况。PD_whole_tree值(PD_whole_tree)反映了样品中物种对进化历史保存的差异,PD_whole_tree值越大说明物种对进化历史保存的差异越大。香农指数(Shannon)以及辛普森指数(Simpson)反映群落的多样性,受样品群落中物种丰富度和物种均匀度的影响。相同物种丰富度的情况下,群落中各物种均匀度越大,则认为群落多样性越大。香农指数和辛普森指数值越大,说明个体分配越均匀。如果每一个体都属于不同的种,香农指数和辛普森指数值就大,如果每一个体都属于同一种,则香农指数和辛普森指数值就小。覆盖度(Goods_coverage)反映了测序的深度,覆盖度越接近于1,说明测序深度已经基本覆盖到样品中所有的物种。
由表 3可知,供试土壤样品的覆盖度为0.993~0.994,说明测序深度已经基本覆盖到样品中所有的物种,可以代表各处理土壤细菌种类的真实情况。4个处理的α多样性指数从高到底为:CK1>PD3>PD2>PD1,但差异不明显,表明4个处理土壤的细菌群落均匀度相当;土壤覆盖遮草布、种植铺地木蓝+地膜、裸种铺地木蓝都会一定程度降低土壤中细菌物种数量与多样性,尤其覆盖遮草布后土壤微生物丰富度与多样性降低明显,裸种铺地木蓝的α多样性指数高于铺地木蓝+地膜种植模式,表明后者在减少恶性杂草生长的同时,也相应降低了土壤微生物物种数量与多样性,但两者差异不大。

|
图 5、图 6表明,随着序列增多,Chao1、Simpson指数曲线逐渐趋向平坦,说明测序数据量足够大,可以反映样品中绝大多数的微生物多样性信息。

|
| 图 5 Chao1稀释曲线图 Fig. 5 Chao1 rarefaction curve |

|
| 图 6 Simpson稀释曲线图 Fig. 6 Simpson rarefaction curve |
2.5 4种不同处理对柑橘园土壤细菌组成与丰富度的影响
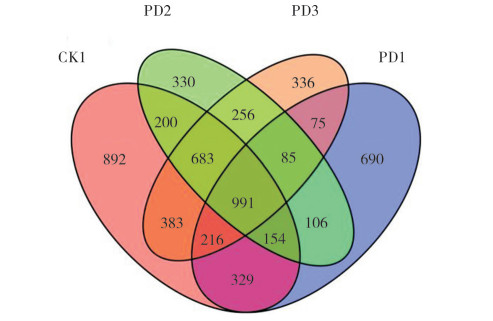
所有样本16s rDNA在门分类水平的丰富信息,4个处理共有的Top10优势细菌群落相似(图 7),其相对丰度依次为:变形菌门(Proteobacteria, 23.17%~32.35%)、绿弯菌门(Chloroflexi, 11.07%~ 19.11%)、酸杆菌门(Acidobacteria, 13.31%~ 16.76%)、浮霉菌门(Planctomycetes, 2.81%~ 12.70%)、罗库菌门(Rokubacteria, 4.27%~11.44%)、芽单胞菌门(Gemmatimonadetes, 4.80%~6.94%)、匿杆菌门(Latescibacteria, 0.78%~11.79%)、放线菌门(Actinobacteria, 2.12%~6.36%)、GAL15 (0.51%~8.08%)、疣微菌门(Verrucomicrobia, 1.23%~3.41%),排名前3的优势细菌群落在4个处理中均占50% 以上的相对丰度。其中,CK1处理的变形菌门(32.35%)相对丰度最高;PD1处理的绿弯菌门(19.11%)、GAL15(8.08%) 相对丰度比较高,浮霉菌门(2.81%)与匿杆菌门(0.78%)相对丰度较低;PD2的酸杆菌门(16.76%)与罗库菌门(11.44%)相对丰度较高,GAL15(0.51%)相对丰度较低;PD3的浮霉菌门(12.70%)、匿杆菌门(11.79%)、芽单胞菌门(6.94%)相对丰度较高,GAL15(0.97%)相对丰度较低。
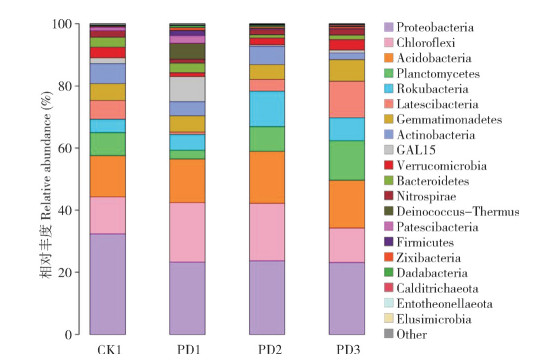
|
| 图 7 不同处理土壤细菌群落组成在细菌门水平(Top 20)的相对丰度 Fig. 7 Relative abundance of top 20 bacterial communities at bacterial phylum level in the soil under different treatments |
为研究不同样本间的相似性,对样本进行聚类分析、构建聚类树。在环境生物学中,算术平均的未加权配对法(Unweighted Pair-group Method with Arithmetic Mean, UPGMA) [18] 是一种较为常用的聚类分析方法。图 8表明,4个处理在门水平分为3类,PD2、PD3处理聚为一类,说明2个处理具有较为相似的土壤细菌群落结构,且2个处理的土壤样品间分枝长度较短,表明两者间物种组成和丰度相似;CK1处理为一类,PD1处理为一类,说明PD1处理的土壤样品细菌群落与PD2、PD3处理差别较大。可见,与自然生草相比,土壤覆盖遮草布会明显改变门水平的土壤细菌群落结构,种植铺地木蓝也会一定程度影响门水平土壤细菌群落结构。
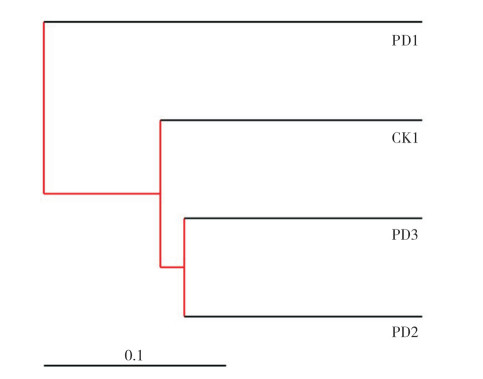
|
| 图 8 不同处理土壤细菌在门水平上的UPGMA聚类树 Fig. 8 UPGMA cluster tree at bacterial genus level in the soil under different treatments |
4个处理在属水平Top 20物种的相对丰度存在差异(图 9),表明不同处理可能对细菌属群落结构产生影响。其中,MND1(1.3%~4.67%)、硝化螺菌属(Nitrospira,0.42%~1.96%)在4个处理相对丰度从大到小为CK1>PD3>PD2>PD1;MND1(4.67%)、Sphingomonas(1.96%)是CK1处理的优势属;亚栖热菌属(Meiothermus,5.10%)、拉姆利杆菌属(Ramlibacter,1.40%)、芽单胞菌属(Gemmatimonas,2.06%)、UTBCD1(1.90%) 是PD1处理的优势属;Sh765B-TzT-35(4.40%)、RB41(1.29%)、Haliangium(1.30%)、Dongia(1.22%)是PD2处理的优势属;Urania-1B-19 marine sediment group(1.61%) 是PD3处理的优势属,无亚栖热菌属(Meiothermus,0.00%)、UTBCD1(0.00%)。

|
| 图 9 不同处理土壤细菌群落组成在细菌属水平(Top 20)的相对丰度 Fig. 9 Relative abundance of top 20 bacterial communities at bacterial genus level in the soil under different treatments |
3 讨论
随着广大消费者对绿色食品的追求,以及果农面对日渐增长的人工、农资等生产成本带来的压力,果园生草带来的生态效益和经济效益日益凸显。铺地木蓝是综合性状较优良且适合山地茶园和果园套种的绿肥作物之一,其生长速度快、生物产量高,同时具备保水护坡、改善土壤、增加土壤有机质,以及抗逆性、抗病虫害能力强等特点。据观察,在肇庆鼎湖区种植的铺地木蓝,日平均温度在20~30 ℃,每月均能萌发新枝。如每年3—4月份种植,2个月左右可以密闭覆盖土壤(株行距20 cm×20 cm),4—6个月覆盖厚度50~60 cm。据黄德川[19]测算,铺地木蓝每667 m2年生长量达3 000 kg以上。此外,铺地木蓝的枯枝落叶含有丰富的营养元素[13],如N、P2O5、K2O、CaO、粗蛋白(4.09%)、有机质(18%)等,还含有多种微量元素,如Mg、S、Fe、B、Mn、Mo、Cu、Zn,且重金属含量相对较低,是一种安全的有机绿肥[20]。土壤养分在植物生长和有机物腐解等过程中起重要作用,影响土壤生态系统中能量流动和物质循环,是反映土壤质量和土壤健康的重要指标[21]。种植铺地木蓝1~3年,表层土壤的碱解氮增加量趋于稳定,速效钾与有机质含量呈增加趋势[22-23]。
种植铺地木蓝不仅可以有效地抑制牛筋草、鬼针草等恶性杂草的生长,减少生产成本,还能改善小气候环境、增加生物多样性、提高作物产量和品质[13, 24]。结合以前的研究结果与本研究的数据可得,覆盖铺地木蓝的土壤温度在冬季比裸露地面要高2~3 ℃,日变温差为2~3 ℃,在夏季铺地木蓝可降低地表温度12~15 ℃,日变温差在7~9 ℃,起到冬暖夏凉的生物覆盖作用,为作物生长提供了良好环境条件[13]。将种植1年的铺地木蓝地上部分全部压青作为肥料,可提高42.6% 的茶叶产量,仅覆盖不割青也能增加3.99% 茶叶产量[13, 23]。种植铺地木蓝还能增加8%~25% 青枣产量[24]。种植铺地木蓝虽会降低土壤细菌群落的多样性,但会增加土壤有益细菌群落的相对丰度,这与前人的研究结果一致,土壤的物理特性、养分有效性和覆盖物的变化会导致土壤微生物群落发生改变[25]。采用铺地木蓝或铺地木蓝+地膜2种模式后,土壤中有益细菌,如绿弯菌门、酸杆菌门、浮霉菌门、罗库菌门、芽单胞菌门的相对丰度增加。碳水化合物在土壤中的转化与微生物密切相关[26],采用地膜+铺地木蓝种植的土壤中各项土壤营养指标和有机质含量较高的原因,可能与绿弯菌门、放线菌门相对丰度较高有关,因为绿弯菌门、放线菌门在土壤碳水化合物的水解中发挥较强作用,能将纤维素、木质素、芳香族化合物等转化成植物容易吸收的营养物质[27-28],此外,放线菌可驱动环境中有机质的转化,在保持土壤肥力、维持土壤结构和强度方面均有促进作用,可促进农业增产增效[29-32];因其突出的抗逆性,放线菌作为生态友好菌群在环境修复方面效果显著,可降解或清除杀虫剂、重金属等环境污染物[33],同时降低成本,具有广阔的环境应用前景[30, 34]。罗库菌门具有多功能、混合营养代谢的潜力[35],与变形菌门类似[36]。酸杆菌门是土壤优势菌门之一,可在相对较为严峻的条件下实现纤维类残体的降解,参与各种生态环境的铁循环、氮素循环、单碳化合物代谢和反硝化作用,还具有光合能力。然而,酸杆菌门生长较慢,且对环境因子的响应较为敏感,尤其对海拔、pH值及土壤中的C、N含量敏感[37-41]表明种植铺地木蓝后,土壤中的pH值、C与N的含量能维持在一个相对稳定的状态。铺地木蓝的庞大根际系统提高了土壤中浮霉菌门相对丰度,而浮霉菌门通常与植物根际联系紧密[42],可在调节营养循环或抑制病原体方面发挥重要作用[43-45]。浮霉菌门中包含大量的厌氧氨氧化菌属,可以在缺氧的环境中,将NH4+用NO2-氧化为氮气,从而影响土壤中全氮和速效氮的含量,最终影响作物产量[46]。覆盖遮草布1年后,土壤中异常球菌-栖热菌门(Deinococcus-Thermus)的相对丰度明显增加,此类菌群的出现被视为土壤环境恶化的标志[47]。
在实际生产中如不使用地膜覆盖,可在整地后、种植铺地木蓝前喷施封闭类除草剂,种植后使用豆科类专用的除草剂,以减少人工除草成本;在育苗移栽方面也可以优化,例如可以采用类似于草皮的片状种植的方式,有利于商业化育苗,方便运输与移栽。还有专家推测种植铺地木蓝可在一定程度上趋避红火蚁,因为铺地木蓝可以在地面形成50~60 cm的荫蔽环境,而红火蚁喜欢在阳光充足的地方筑巢,因此铺地木蓝可以起到一定的趋避作用,这种趋避作用为减少红火蚁的危害提供了一种生态防控的方法。总之,种植铺地木蓝在农业生产中具有多方面的潜在优势,未来可以进一步探究种植铺地木蓝在时间和空间上对柑橘土壤微生物多样性的影响,以及如何利用土壤微生物来促进柑橘的生长和健康,例如通过种植铺地木蓝引入有益微生物来抑制病原体或提高养分利用效率等方面的研究。
4 结论试验结果表明,柑橘果园行道覆盖地膜+种植铺地木蓝综合表现最好。覆盖地膜可在前期抑制杂草的生长,减少人工除草的成本,降低除草剂对土壤的危害;随着铺地木蓝后期的生长,与自然生草相比,土壤(0~20 cm)有机质含量增加7.21 g/kg;与覆盖遮草布的土壤相比,土壤全氮、碱解氮、全磷、速效磷、速效钾含量分别提高0.37、27.43、0.37、8.69、20.55 mg/kg;覆盖遮草布处理后,土壤中异常球菌-栖热菌门的相对丰度增加,而浮霉菌门、匿杆菌门、疣微菌门等有益菌门的相对丰度降低,导致土壤环境趋于恶化。地膜+种植铺地木蓝增加了土壤绿弯菌门、酸杆菌门、浮霉菌门、罗库菌门、芽单胞菌门等有益细菌群落的相对丰度,虽然会一定程度降低细菌群多样性,但不影响细菌群落分布的均匀性。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志(第40卷)[M]. 北京: 科学出版社, 1994: 316. Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China (Vol. 40)[M]. Beijing: Science Press, 1994: 316. |
| [2] |
秦明辉, 温玉芳. 一种新的优良地被植物——铺地木蓝[J]. 广东园林, 2002(2): 46-47, 43. DOI:10.3969/j.issn.1671-2641.2002.02.012 QIN M H, WEN Y F. A new excellent ground cover plant—Indigofera spicata[J]. Guangdong Garden, 2002(2): 46-47, 43. DOI:10.3969/j.issn.1671-2641.2002.02.012 |
| [3] |
辛俊亮, 黄白飞, 杨中艺, 袁剑刚, 徐亚幸. 铺地木蓝对不同程度淹水胁迫的生理响应[J]. 草业学报, 2012, 21(3): 177-183. XIN J L, HUANG B F, YANG Z Y, YUAN J G, XU Y X. Physiological responses of lndigofera spicata to different flooding stress[J]. Acta Prataculturae Sinica, 2012, 21(3): 177-183. |
| [4] |
黄白飞, 辛俊亮, 袁剑刚, 杨中艺. 铺地木蓝对不同水质淹水胁迫的生理响应[J]. 生态科学, 2014, 33(4): 625-630. DOI:10.14108/j.cnki.1008-8873.2014.04.001 HUANG B F, XIN J L, YUAN J G, YANG Z Y. Responses of Indigofera spicata to flooding stress of different water[J]. Ecological Science, 2014, 33(4): 625-630. DOI:10.14108/j.cnki.1008-8873.2014.04.001 |
| [5] |
FLETCHER, MARY T, REICHMANN, KEITH G, OSSEDRYVER, SELINA M. Accumulation and depletion of indospicine in calves (Bos taurus) fed creeping indigo (Indigofera spicata)[J]. Animal Production Science, 2018, 58(3): 568-576. DOI:10.1071/AN16394 |
| [6] |
TAN EDDIE T T, JASSIM AL, RAFAT, CAWDELL-SMITH JUDY A. Accumulation, persistence, and effects of indospicine residues in camels fed indigofera plant[J]. Journal of Agricultural and Food Chemistry, 2016, 64(34): 6622-6629. DOI:10.1021/acsjafc.6b02707 |
| [7] |
BUENO P L. Phytochemical and biological evaluation of two Vietnamese plants, Indigofera spicata and Millettia caerulea. [D]. Ohio State: The Ohio State University. 2014.
|
| [8] |
BUENO P L, LI J, CHAI H, PAN L, NINH T N. Potential cancer chemotherapeutic agents from Indigofera spicata[J]. Planta Medica, 2012, 78(11). DOI:10.1055/s-0032-1320881 |
| [9] |
BUENO P L, LI J, LANTVIT, DANIEL D. Bioactive constituents of Indigofera spicata[J]. Journal of Natural Products, 2013, 76(8): 1498-1504. DOI:10.1021/np400567c |
| [10] |
GALYNA Y S, YAROSLAV P B, OLENA I V, LEONI A K, MARY T F, OLEH V S. Indospicine combined with arginine deprivation triggers cancer cell death via caspase‐dependent apoptosis[J]. Cell Biology International, 2021, 45(3): 518-527. DOI:10.1002/cbin.11321 |
| [11] |
MORTON J F. Indigofera spicata (Indigofera spicata Forsk.) (Fabaceae)—A hazard to herbivores in Florida[J]. Economic Botany, 1989, 43(3): 314-327. DOI:10.1007/BF02858731 |
| [12] |
LETEINTURIER B, LAROCHE J, MATERA J. Reclamation of lead/zinc processing wastes at Kabwe, Zambia: A phytogeochemical approach[J]. South African Journal of Science, 2001, 97(11): 624-627. |
| [13] |
蒋雪林, 吴德敬, 吕云青. 优良旱地绿肥——铺地木蓝及其综合利用[J]. 广西热作科技, 1994(1): 47-50. JIANG X L, WU D J, LYU Y Q. Indigofera spicata (Indigofera spicata forsk.) (Fabaceae)—Excellent dry land green manure and its comprehensive utilization[J]. Guangxi Hot Crop Science and Technology, 1994(1): 47-50. |
| [14] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000: 56-58. BAO S J. Soil agrochemical analysis[M]. Beijing: China Agricultural Press, 2000: 56-58. |
| [15] |
CAPORASO J G, CHRISTIAN L L, WILLIAN A W, ROB K. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences, 2010(108): 4516-4522. DOI:10.1073/pnas.1000080107 |
| [16] |
NOHA Y, CODY S S, LEE R K, FARES Z N, BRUCE A R, FARES N. Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA gene-based environmental surveys[J]. Applied and Environmental Microbiology, 2009, 75(16): 5227-5236. DOI:10.1128/AEM.00592-09 |
| [17] |
MATTHIA H, ALEXANDER S, ROB E, TAE-WAN K. Metagenomic discovery of biomass-degrading genes and genomes from cow rumen[J]. Science, 2011, 331(6016): 463-467. DOI:10.1126/science.1200387 |
| [18] |
李玉鉴, 徐立业. 不加权算术平均组对方法的改进及应用[J]. 北京工业大学学报, 2007, 33(12): 1333-1339. DOI:10.3969/j.issn.0254-0037.2007.12.019 LI Y J, XU L Y. An improvement for unweighted pair group method with arithmetic mean and its application[J]. Journal of Beijing University of Technology, 2007, 33(12): 1333-1339. DOI:10.3969/j.issn.0254-0037.2007.12.019 |
| [19] |
黄德川. 速生高产绿肥——爬地兰[J]. 土壤肥料, 1998(6): 18-19. HUANG D C. Fast growing and high yield green fertilizer—Indigofera spicata[J]. Soil and Fertilizer, 1998(6): 18-19. |
| [20] |
刘壮, 罗瑛, 刘国道, 郇树乾, 王海慧, 黎春花, 高玲. 木蓝属11份热带绿肥营养元素含量及品质评价[J]. 中国农学通报, 2009, 25(23): 283-286. LIU Z, LUO Y, LIU G D, HUAN S Q, WANG H H, NI C H, DAO L. Contents and quality evaluation of nutrition elements in 11 germplasms of indigofera linnaeus tropical green manure[J]. Chinese Agricultural Science Bulletin, 2009, 25(23): 283-286. |
| [21] |
吴流通, 张智, 解国玲, 邸雪嫣, 石浩, 苏友波. 元阳梯田不同植被类型土壤养分及酶活性特征[J]. 广东农业科学, 2022, 49(3): 86-95. DOI:10.16768/j.issn.1004-874X.2022.03.010 WU L T, ZHANG Z, JIE G L, DI X Y, SHI H, SU Y B. Contents of soil nutrients and characteristics of enzyme activities in different vegetation types of the Yuanyang Terraces[J]. Guangdong Agricultural Sciences, 2022, 49(3): 86-95. DOI:10.16768/j.issn.1004-874X.2022.03.010 |
| [22] |
夏汉平, 刘世忠, 敖惠修. 介绍两种优良的"铺地"植物[J]. 中国园林, 2002, 18(4): 78-80. DOI:10.3969/j.issn.1000-6664.2002.04.021 XIA H P, LIU S Z, AO H X. Two excellent "paving" plants are introduced[J]. Chinese Journal of Landscape Architecture, 2002, 18(4): 78-80. DOI:10.3969/j.issn.1000-6664.2002.04.021 |
| [23] |
吴志丹, 尤志明, 江福英, 汪峰, 朱留刚, 翁伯琦. 行间覆盖绿肥对幼龄茶园土壤理化性状的影响[J]. 福建农业学报, 2013, 28(12): 1285-1290. DOI:10.3969/j.issn.1008-0384.2013.12.020 WU Z D, YOU Z M, JIANG F Y, WANG F, ZHU L G, WENG B Q. Effects of inter-row green manure mulching on soil physical and chemical properties of Young Tea Plantation[J]. Fujian Journal of Agricultural Sciences, 2013, 28(12): 1285-1290. DOI:10.3969/j.issn.1008-0384.2013.12.020 |
| [24] |
俞艳春, 文定良, 罗心平. 绿肥覆盖对改善台湾青枣园微环境的效果初报[J]. 热带农业科技, 2005, 28(3): 18-20. DOI:10.3969/j.issn.1672-450X.2005.03.004 YU Y C, WEN D L, LUO X P. A preliminary effect to cover with green manure on environment of the Jujuba Garden[J]. Tropical Agricultural Science and Technology, 2005, 28(3): 18-20. DOI:10.3969/j.issn.1672-450X.2005.03.004 |
| [25] |
郭冲, 曾淑华, 刘雅洁, 杨懿德, 杨洋, 鄢敏, 陈佛源, 韩伟, 刘雷. 烤烟全生育期覆膜栽培对植烟土壤理化性质及细菌群落结构的影响[J]. 广东农业科学, 2023, 50(8): 1-9. DOI:10.16768/j.issn.1004-874X.2023.08 GUO C, ZENG S H, LIU Y J, YANG Y D, YANG Y, YAN M, GHEN F Y, HAN W, LIU L. Effects of cultivation with plastic cover during the whole growth period of flue-cured tobacco on physicochemical properties and bacterial community structure of tobacco-planting soil[J]. Guangdong Agricultural Sciences, 2023, 50(8): 1-9. DOI:10.16768/j.issn.1004-874X.2023.08 |
| [26] |
SIX J, FREYD S, THIET K R. Bacterial and fungal contributions to carbon sequestration in agroecosystems[J]. Soil Science Society of America Journal, 2006, 70: 555-569. DOI:10.2136/sssaj2004.0347 |
| [27] |
KANOKRATANA P, UENGWETWANIT T, RATTANACHOMSRI U, BUNTERNG S B, NIMCHUA T, TANGPHATSORNRUANG S, PLENGVIDHYA V, CHAMPREDA V, EURWILAICHITR L. Insights into the phylogeny and metabolic potential of a primary tropical peat swamp forest microbial community by metagenomic analysis[J]. Microbial Ecology, 2011, 61: 518. DOI:10.1007/s00248-010-9766-7 |
| [28] |
ZIEGLER S E, WHITE P W, WOLF D C. Tracking the fate and recycling of 13C-labeled glucose in soil[J]. Soil Science, 2005, 170: 767-778. DOI:10.1097/00010694-200510000-00002 |
| [29] |
OKORO C K, BROWN R, JONES A L, ANDREWS B A, ASENJO J A, GOODFELLOW M, BULL A T. Diversity of culturable actinomycetes in hyper-arid soils of the Atacama desert, Chile[J]. Antonie Van Leeuwenhoek, 2009, 95(2): 121-133. DOI:10.1007/s10482-008-9295-2 |
| [30] |
MAWANG C I, AZMAN A S, FUAD A S M, AHAMAD M. Actinobacteria: An eco-friendly and promising technology for the bioaugmentation of contaminants[J]. Biotechnology Reports, 2021(32): 679. DOI:10.1016/j.btre.2021.e00679 |
| [31] |
GLICK B R. Plant growth-promoting bacteria: Mechanisms a nd appl icat ion s[J]. Scientifica, 2012, 963401. DOI:10.6064/2012/963401 |
| [32] |
SAHUR A, ALA A, PATANDJENGI B, SYAM'UN E. Effect of seed inoculation with actinomycetes and Rhizobium isolated from indigenous soybean and rhizosphere on nitrogen fixation, growth, and yield of soybean[J]. International Journal of Agronomy, 2018, 1-7. DOI:10.1155/2018/4371623 |
| [33] |
BEATRICE F, PIHAB D, LLARIA V, MADDALENA D G, MARIKA P. Actinomycetes from caves: An overview of their diversity, biotechnological properties, and insights for their use in soil environments[J]. Microorganisms, 2022, 10(2): 453. DOI:10.3390/microorganisms10020453 |
| [34] |
崔熙雯, 林小锐, 李家兵, 张虹, 韩永和. 抗逆放线菌的多样性、功能特性及其在环境修复中的应用[J]. 微生物学报, 2023, 63(5): 1930-1943. DOI:10.13343/j.cnki.wsxb.20220941 CUI X W, LIN X R, LI J B, ZHANG H, HAN Y H. Diversity, functional characteristics, and environmental remediation potential of stress-tolerant Actinomycetes[J]. Acta Microbiologica Sinica, 2023, 63(5): 1930-1943. DOI:10.13343/j.cnki.wsxb.20220941 |
| [35] |
ERIC D B, TANJA W, DODOY V. Rokubacteria: Genomic giants among the uncultured bacterial phyla[J]. Frontiers in Microbiology, 2017(8): 2264. DOI:10.3389/fmicb.2017.02264 |
| [36] |
KARTHIK A, CHRISTOPHER T B, LAURA A H. Thousands of microbial genomes shed light on interconnected biogeochemical processes in an aquifer system[J]. Nature Communications, 2016(7): 13219. DOI:10.1038/ncomms13219 |
| [37] |
LAURA A H, BRETT B, KARTHIK A. A new view of the tree of life[J]. Nature Microbiology, 2016(1): 16048. DOI:10.1038/nmicrobiol.2016.48 |
| [38] |
刘彩霞, 董玉红, 焦如珍. 森林土壤中酸杆菌门多样性研究进展[J]. 世界林业研究, 2016, 29(6): 17-22. DOI:10.13348/j.cnki.sjlyyj.2016.0041.y LIU C X, DONG Y H, JIAO R Z. Research progress on phylum diversity of Acidobacterium in forest soil[J]. World Forestry Research, 2016, 29(6): 17-22. DOI:10.13348/j.cnki.sjlyyj.2016.0041.y |
| [39] |
王光华, 刘俊杰, 于镇华, 王新珍, 金剑, 刘晓冰. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14-20. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.002 WANG G H, LIU J J, YU Z H, WANG X Z, JIN J, LIU X B. Research progress on bacterial ecology of acidobacterium soil[J]. Biotechnology Bulletin, 2016, 32(2): 14-20. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.002 |
| [40] |
刘沙沙, 操江飞, 陈显宇, 梁绮彤. 微塑料-多环芳烃对农用地土壤微生物群落结构和功能的影响[J]. 广东农业科学, 2022, 49(8): 64-72. DOI:10.16768/j.issn.1004-874X.2022.08.008 LIU S S, CAO J F, CHEN X Y, LIANG Q T. Effects of microplastics-polycyclic aromatic hydrocarbons on microbial community structure and function in in agricultural soil[J]. Guangdong Agricultural Sciences, 2022, 49(8): 6. DOI:10.16768/j.issn.1004-874X.2022.08.008 |
| [41] |
LIU Q M, HE X Y, LUO G W, WANG K L, LI D J. Deciphering the dominant components and functions of bacterial communities for lignocellulose degradation at the composting thermophilic phase[J]. Bioresource Technology, 2022, 348: 126808. DOI:10.1016/j.biortech.2022.126808 |
| [42] |
MENDES R, GARBEVA P, RAAIJMAKERS J M. The rhizosphere microbiome: Significance of plant beneficial, plant pathogenic, and human pathogenic microorganisms[J]. FEMS Microbiology Reviews, 2013, 37(5): 634-663. DOI:10.1111/1574-6976.12028 |
| [43] |
KWAK M, KONG H G, CHOI K. Rhizosphere microbiome structure alters to enable wilt resistance in tomato[J]. Nature Bioteclmology, 2018, 36(11): 1100-1109. DOI:10.1038/nbt.4232 |
| [44] |
XU J, ZHANG Y Z, ZHANG P F. The structure and function of the global citrus rhizosphere microbiome[J]. Nature Communications, 2018, 9(1): 4894. DOI:10.1038/s41467-018-07343-2 |
| [45] |
BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486. DOI:10.1016/j.tplants |
| [46] |
JETTEN M S, WAGNER M, FUERST J. Microbiology and application of the anaerobic ammonium oxidation ('anammox') process[J]. Current Opinion in Biotechnology, 2001, 12(3): 283-288. DOI:10.1016/s0958-1669(00)00211-1 |
| [47] |
邢平平. 黄河三角洲土壤微生物群落结构对盐生植被演替的响应[D]. 济南: 山东师范大学, 2013. XING P P. The response of soil archaeal community structure to halophyte vegetation succession in the Yellow River Delta[D]. Jinan: Shandong Normal University, 2013. |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51