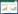文章信息
基金项目
- 福建农林大学学科交叉融合专项(XKJC-712021030);福建省科技计划重大专项(2021NZ029009);福建省自然资源厅专项(KKY22003XA);福建省农业农村厅农业资源保护与利用专项(KKY22001XA)
作者简介
- 范锦琳(1990—),女,博士,研究方向为微生物学,E-mail:446902336@qq.com.
通讯作者
- 林占熺(1943—),男,研究员,研究方向为菌草学,E-mail:lzxjuncao@163.com.
文章历史
- 收稿日期:2023-07-09
2. 福建农林大学生命科学学院,福建 福州 350002
2. College of Life Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China
【研究意义】菌草(JUNCAO)的名称最早于1986年由福建农林大学林占熺研究员提出,菌草主要包括巨菌草、柠檬香茅、紫象草、五节芒、绿洲1号等45个品种[1-4]。其中,巨菌草(Cenchrus fungigraminus Z. X. Lin & D. M. Lin & S. R. Lan sp. Nov.)具有产量高、纤维含量高、粗蛋白和糖分含量高的特点[5-7];柠檬香茅(Cymbopogon citratus Stapf)富含多糖、多酚、黄酮类及香茅精油[8]。白酒酿造在我国有上千年的悠久历史,享有“国酒”美誉[9]。但目前菌草酒作为一种采用菌草为原料酿造的白酒尚未得到充分研究。了解菌草酒中真菌群落的演变规律和不同发酵时期的优势真菌群落,对提升菌草酒的品质具有重要意义。【前人研究进展】研究表明,巨菌草和柠檬香茅具有作为菌草酒发酵原料的可行性。巨菌草含有丰富的纤维素和还原糖,可用于制备乙醇[10]。童金华[11]采用柠檬香茅、巨菌草和紫宿花等为原料,研制了菌草复合饮料。这些研究为巨菌草和柠檬香茅作为菌草酒的发酵原料提供了有价值的理论参考。范锦琳等[12]利用巨菌草和柠檬香茅为原料,添加安琪白酒曲作为糖化发酵剂,采用固态发酵,经过多次蒸馏后得到具有独特风味的发酵酒。已知微生物在白酒酿造过程中发挥极其重要的作用,不同菌群微生物在酿酒过程中的活动对白酒品质有重要影响[13]。白酒口感醇厚,其特殊口感来源于酒醅中各类微生物代谢的醇类、醛类、酯类、杂环类等风味物质[14]。Gan等[15]对我国茅台酒的微生物群落组成和功能进行研究,揭示了185个茅台发酵剂样本的微生物组成,发现微生物菌落对茅台酒复杂的香气物质形成至关重要。陈申习等[16]研究发现,真菌对酒醅中的大分子物质具有很高的降解能力。与传统的菌种分离法相比,高通量测序技术基于基因角度分离菌种,严谨性更强,对细微的基因突变有更好的分辨能力,因此被广泛应用于白酒领域的微生物研究中[17-19]。目前,高通量测序技术在浓香型、酱香型和清香型白酒的微生物研究应用方面有较多报道[20-22]。周森等[23]将传统微生物分离方法与高通量测序技术相结合,阐明了牛栏山二锅头发酵过程中真菌的演替规律。杨婧等[24]利用高通量测序技术解析了单宁物质含量对白酒发酵过程中真菌群落的影响。姜明慧等[25]通过高通量测序技术对酱香型白酒下沙轮次堆积发酵过程中微生物的菌落变化规律进行研究。这些研究均为进一步研究酱香型白酒的酿造机理提供理论基础。
【本研究切入点】目前尚未见利用高通量测序技术研究菌草酒发酵过程中真菌群落变化的研究。因此,本研究首次以不同发酵时期的菌草酒酒醅样本为研究对象展开相关研究。【拟解决的关键问题】本研究利用高通量测序技术初步解析菌草酒发酵动态过程中真菌群落的组成和动态变化,为进一步探究菌草酒的风味物质形成与微生物菌落特征之间的关系提供科学依据,并为后续建立菌草酒微生物信息数据库、探究菌草酒发酵机理、提升菌草酒品质提供理论基础。
1 材料与方法 1.1 试验材料供试巨菌草、柠檬香茅由福建农林大学旗山校区菌草中心基地提供,白酒曲购自安琪酵母股份有限公司,白砂糖为市售。
试验主要试剂:E.Z.N.A. Stool DNA Kit试剂盒(上海生工生物工程有限公司)、无水乙醇(分析纯,上海阿拉丁试剂有限公司)、琼脂糖(西班牙Biowest Agarose公司)、DNA Marker〔宝生物工程(大连)有限公司〕、Axy Prep DNA凝胶回收试剂盒〔爱思进生物技术(杭州)有限公司〕、Gengreen染料(上海赛百盛有限公司),引物由北京奥维森基因科技有限公司合成。
试验主要仪器:Illumina Miseq PE250高通量测序仪(美国Illumina公司)、T100 Thermal Cycler聚合酶链式反应仪(美国伯乐BIO-RAD公司)、InvitrogenQubit3.0荧光计〔赛默飞世尔科技(中国)有限公司〕、ZF-288凝胶成像系统(美国Analytik Jena US LLC公司)。
1.2 试验方法1.2.1 酒醅样品制备及预处理 新鲜巨菌草、柠檬香茅经过清洗和切分,在发酵温度为29 ℃、初始糖度为24 °Bx、酒曲接种量为0.45 g/L的条件下自然发酵30 d[12]。分别采集0、0.5、1、2、3、5、7、10、15、21、30 d酒醅样品,分别标记为D0、D0.5、D1、D2、D3、D5、D7、D10、D15、D21和D30。从发酵罐的上、中、下层3个位置分别取50 g酒醅进行等量混匀作为1个样品,并置于无菌采样袋密封。样品采集后迅速置于盛有干冰的泡沫箱中快速冷冻,于-80 ℃低温环境中保存[26]。
1.2.2 酒醅样品真菌群落基因组DNA提取、PCR扩增及高通量测序 参照DNA Kit试剂盒说明书提取酒醅样品中真菌群落的基因组DNA,采用引物(5'-CTTGGTCATTTAGAGGAAGTAA-3',5'- TGCGTTCTTCATCGATGC-3')对ITS1~ITS2区进行PCR扩增[27]。PCR扩增体系为50 μL:10×PCR buffer 5 μL,10 mmol/L dNTP 0.5 μL,基因组DNA 10 ng,50 μmol/L上/ 下游引物各0.5 μL,5 U/μL Plantium Taq酶0.5 μL,加ddH2O至50 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性45 s、55 ℃退火50 s、72 ℃延伸45 s,28个循环;72 ℃后延伸10 min。PCR产物用2% 琼脂糖凝胶电泳检测,使用Axy Prep DNA凝胶回收试剂盒回收PCR产物,Tris-HCl洗脱,再以2% 琼脂糖电泳检测,通过凝胶成像系统观察结果[28]。将经过琼脂糖凝胶电泳检测合格的扩增产物,依托北京奥维森基因科技有限公司进行Illumina Miseq高通量测序。
1.3 数据处理通过Fastqc进行质量检测,过滤Q20以下的碱基,以及质控后50 bp以下的read。通过Cope软件(Connecting Overlapped Pair-end,V1.2.3.3)进行序列拼接与过滤[23]。通过Uclust(Version 1.2.22 http://www.drive5.com/uclust/downloads1_2_22q.html)将序列按照相似性>97% 阈值进行操作分类单元(Operational taxonomic unit,OUT)聚类,统计各个样品每个OTU中的丰度信息。通过Blast法对一定相似度水平的OTU代表序列进行分类学比对分析,获得OTU种名。基于每个样品的Alpha多样性指数分析,用稀释曲线、Rank-abundance曲线、Observed species指数、Chao1指数、PD whole tree指数和Shannon指数等评估样品中微生物菌落的物种丰度和多样性。通过Beta多样性指数分析样品之间菌落组成的相异性[29]。最后基于OTU丰度通过R语言工具进行主成分分析(PCA)[30]。
2 结果与分析 2.1 高通量测序技术扩增目的基因结果对各样本真菌ITS1~ITS2区的PCR扩增结果进行琼脂糖凝胶电泳检测,结果(图 1)表明,所有样品的PCR产物均无拖带,主要分布在100~250、250~500 bp之间,大小与预期相符,总量满足试验需要,可用于后续建库和高通量测序工作。

|
| 图 1 不同发酵时期酒醅样品真菌的ITS PCR扩增结果 Fig. 1 Results of ITS PCR amplification of fungi from fermented grain samples at different fermentation periods |
2.2 菌草酒发酵过程酒醅的真菌测序文库评价
从测序数据得到各样本的稀释曲线如图 2所示,测序数量达到15 000之后11条稀释曲线均趋向平坦,表明随着测序深度的增加微生物的丰度不再增加,测序深度满足后续试验要求。

|
| 图 2 不同发酵时期酒醅样品的稀释曲线 Fig. 2 Dilution curves of fermented grain samples at different fermentation periods |
Rank-abundance曲线主要用来解释样品的多样性和均匀度,曲线越宽物种多样性越高,曲线越平坦物种组成越均匀。由图 3可知,不同发酵过程中酒醅的真菌在横坐标上的宽度总体变小,说明菌落丰富度逐渐变小,推测发酵初期存在的某些真菌无法适应新的环境而逐渐被淘汰;纵坐标显示曲线下降幅度较大,表明发酵过程中几种优势菌占比较大。

|
| 图 3 不同发酵时期酒醅样品的Rank-abundance曲线 Fig. 3 Rank-abundance curves of fermented grain samples at different fermentation periods |
2.3 菌草酒发酵过程酒醅的真菌测序分析及丰富度和多样性指数分析
对各样本的测序数据、OTU及多样性指数进行统计分析,结果表明,从不同发酵时期的11个酒醅样品中共注释到8个门、22个纲、50个目、110个科、243个属。对11个酒醅样品测序所得序列预处理,去除低质量序列,共得到429 108条原始序列,过滤后得到402 891条有效序列(表 1)。11个酒醅样品文库的覆盖率均高于99.20%,说明测序结果可真实反映样本内真菌的实际存在情况。通过归类共得到3 188个OTU,OTU数量整体呈发酵中期(7~15 d)>发酵前期(0~7 d)>发酵末期(15~30 d)的规律(表 1)。
|
Alpha多样性指数通常包括Observed species指数、Chao1指数、Shannon指数和PD wholetree指数等[14, 16]。由表 2可知,酒醅样本中真菌菌群的Observed species指数、Chao1指数、Shannon指数和PD whole tree指数整体呈发酵中期>发酵前期>发酵末期的趋势。菌草酒发酵过程中真菌群落丰富度和多样性在发酵的前2 d呈上升趋势,发酵10 d后呈下降趋势。推测可能是由于发酵前2 d的生长环境适合微生物繁殖,发酵中后期酒精度增加较快,抑制了部分微生物生长[31]。在发酵30 d时指数值均最小,表明菌群丰度和多样性在发酵30 d时最小,可能是由于发酵30 d时酒精度达到最高,许多微生物耐受力较弱,导致菌群丰度下降[32]。以上结果表明,菌草酒发酵过程中真菌群落微生物的Alpha多样性指数呈波动变化,可能与发酵环境中的氧气浓度、酒精度和有机酸含量的变化有关[33]。

|
2.4 菌草酒发酵过程酒醅的真菌物种组成分析
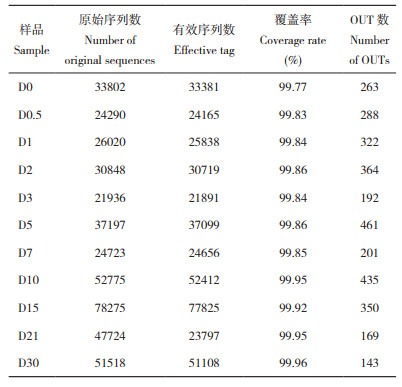
2.4.1 基于门水平的真菌群落结构分析 由图 4可知,在门水平上,不同发酵过程菌草酒的酒醅真菌优势门(相对丰度>1.00%)有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota),3类真菌相对丰度总和均超过95%,充分说明在门水平上不同发酵过程酒醅的真菌群落结构具有明显的稳定性。在整个发酵过程中,子囊菌门均为主要发酵核心菌群,相对丰度始终保持在90% 以上,平均为92.32%;担子菌门的平均相对丰度为4.88%,其丰度随着发酵时间延长整体呈降低趋势,在发酵0 d时丰度最高(7.85%);接合菌门平均相对丰度为1.34%,主要出现在发酵中后期,在发酵30 d时丰度达到最高值(4.58%)。
|
| 图 4 菌草酒发酵过程中酒醅样品的真菌群落结构(基于门水平) Fig. 4 Fungal community structure of fermented grain samples during the fermentation of JUNCAO win (Based on phylum level) |
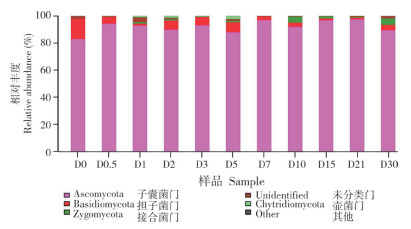
2.4.2 基于属水平的真菌群落结构分析 在属水平上分析不同发酵过程菌草酒酒醅真菌的种类相对丰度,样本中菌属平均相对丰度≥ 1.00% 定为优势菌属[34-35],共获得7个优势菌属,分别为未分类属(Unidentified)、酵母属(Saccharomyces)、曲霉属(Aspergillus)、青霉属(Penicillium)、木耳属(Auricularia)、被孢霉属(Mortierella)、镰刀菌属(Fusarium),平均相对丰度分别为45.53%、35.11%、2.72%、2.06%、1.60%、1.25%、1.00%,不同酒醅样品中优势真菌属的相对丰度之和为89.30% ~ 98.57%。
由图 5可知,发酵0 d酒醅样品中相对丰度较高的有拟盘多毛孢属(Pestalotiopsis)、枝孢属(Cladosporium)、毛孢子菌属(Trichosporon)、支顶孢属(Acremonium)、曲霉属、镰刀菌属(Fusarium)、青霉属,相对丰度介于2.16%~7.51% 之间,这些菌属为发酵原料自身的优势菌群。在整个发酵期均含有大量的未知菌属,可能与采用生料发酵酿造且菌草原料自身含有丰富的微生物有关。进入发酵时期的酵母属丰度迅速上升,说明菌草酒的发酵条件有利于酵母菌生长繁殖。随着发酵时间延长,青霉属相对丰度整体呈下降趋势,发酵中后期丰度极低,可能与发酵中后期有机酸积累及酒精度快速增长有关[36]。曲霉属在整个发酵过程中相对丰度较高,整体呈先升高后降低趋势,发酵0.5 d时相对丰度达到最高(5.58%)。木耳属主要在发酵2 ~ 7 d时相对丰度较高,发酵3 d的相对丰度最高(4.50%)。镰刀菌属主要在发酵中后期相对丰度较高,在发酵15 d时相对丰度最高(2.98%)。综上,菌草酒发酵过程中酒醅的微生物菌落呈动态变化。
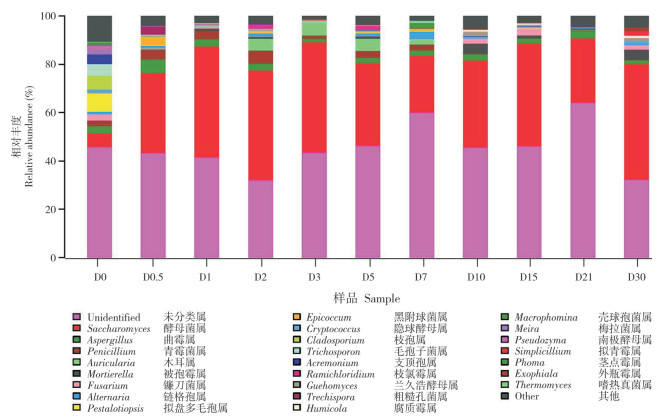
|
| 图 5 菌草酒发酵过程中酒醅样品的真菌群落结构(基于属水平) Fig. 5 Fungal community structure of fermented grain samples during the fermentation of JUNCAO wine (Based on genus level) |
2.5 菌草酒发酵过程酒醅的真菌群落PCA分析
基于属水平,通过R软件对菌草酒发酵过程中酒醅样品的真菌群落变化进行PCA分析,结果(图 6)显示,第1主成分和第2主成分的贡献率分别为43.30% 和22.04%,累积的方差贡献率为65.34%,说明2个主成分可以解释发酵过程中真菌群落变化的65.34%。由图 6可知,发酵0 d与其他发酵时期样本真菌群落的遗传距离均较远;发酵0.5 d和1 d的样本真菌群落遗传距离均较接近;发酵2、3、5、7 d的样本真菌群落遗传距离均较为接近;发酵中期10、15、21 d的样本真菌群落遗传距离与前期酒醅的样本真菌群落遗传距离均较远。值得注意的是,发酵30 d与0.5、1 d的真菌群落遗传距离均较为接近,可能随着发酵的进行,酒醅样本中的环境改变,导致优势菌种发生变化,促使菌种群落组成结构发生变化,表明发酵初期的真菌群落可能通过特定的发酵途径与发酵末期的真菌群落进行相互转换。
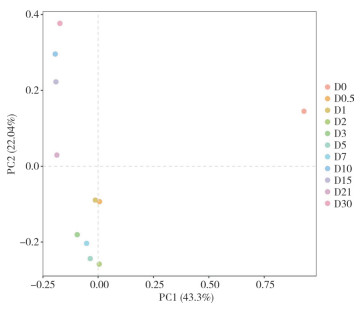
|
| 图 6 菌草酒发酵过程酒醅样品中属水平真菌群落的PCA分析 Fig. 6 PCA analysis of fungal communities on genus level in fermented grain samples during the fermentation of JUNCAO wine |
3 讨论
白酒的酿造主要是通过原料与酒曲中的微生物共同发生作用生成大量醇类、酯类、有机酸和氨基酸等风味物质。在酿造过程中,不同发酵时期微生物的结构、种类组成存在差异。选取不同时间段的酒醅样本进行检测,研究其菌群变化、数量特征等,对提升白酒品质具有积极意义。本研究通过高通量测序技术,对菌草酒发酵过程中11个不同发酵时期酒醅样本的真菌群落进行测序,初步解析了菌草酒自然发酵过程中真菌群落的结构及多样性。结果表明,发酵过程中菌草酒酒醅的微生物菌落结构随发酵时间发生动态变化,真菌群落组成及丰度均存在较大差异。
对ITS1~ITS2区进行PCR扩增得到的序列主要分布在100~250、250~500 bp之间,满足建库和高通量测序试验要求。邢德峰等[37]研究表明,当DNA片段为200 bp左右的分离效果较好,为450~500 bp则分类信息相对更为丰富。菌草酒酒醅中真菌丰富度和指数多样性结果显示,发酵前2 d真菌微生物多样性缓慢上升,第3 d急剧下降,推测可能由于发酵初期酒精浓度增加较快,抑制了部分微生物的生长繁殖。发酵3 d后大部分微生物逐渐适应并开始快速生长,物种丰度指数在发酵5 d时达到最高值。发酵7 d后OTU急剧下降,可能由于酒精浓度过高导致多数微生物不耐受。发酵10 d后OTU逐渐下降,可能随着发酵时间延长,菌群受发酵环境中的乙醇浓度、有机酸含量和氧气浓度的影响,引起菌群数量发生变化。可见菌草酒发酵过程中真菌微生物多样性呈波动式变化。该结果和戴奕杰等[38]对酱香型白酒大曲和糟醅的真菌多样性分析结果一致,发酵过程中菌群在不断调整和平衡。
在门水平上,子囊菌门、担子菌门和接合菌门为菌草酒酒醅中所有分离样本的优势真菌门类。戴奕杰等[38]对不同发酵过程中酱香型白酒真菌群落结构进行分析,发现子囊菌门占比最多,其次是担子菌门,在轮次的最后阶段发现接合菌门。张春林等[39]在酱香型白酒堆积发酵的酒醅中共检出4个门真菌,分别为子囊菌门、接合菌门、壶菌门和担子菌门,其中子囊菌门在堆积酒醅真菌群落中平均丰度超过94%,与本研究结果基本一致。
在属水平上,菌草酒发酵初期和中期菌群组成较高,这与传统发酵过程中菌属的丰富度变化趋势相近,即发酵过程中微生物菌落种属类别呈现先增加后降低的趋势,在发酵中期微生物种属较多[40]。推测可能是发酵初期带入杂菌及发酵原料自身的内生菌,随着发酵进行,优势菌种生长并保持菌群结构稳定[41]。本研究比较各样本在属分类水平上的主要真菌类群,结果表明,不同发酵时期的酒醅样品中除了优势真菌不同外,其他真菌群落结构组成也有所不同。菌草酒发酵过程中未分类属和酵母属为核心属,始终存在于发酵过程中的各个样本中。牟穰[42]研究发现,在清爽型黄酒酿造过程中,曲霉属在整个发酵过程中一直以最高相对丰度存在,与本研究结果不一致,可能与发酵原料和发酵方式不同有关。
酵母属是白酒酿造过程中乙醇代谢的核心功能菌群,对酯类物质的产生及白酒风味的形成具有重要贡献[43]。菌草酒发酵第0 d的酵母属丰度很低,进入发酵阶段即迅速变成优势菌群,并且在整个菌草酒发酵过程中均占绝对优势。汪慧慧等[44]发现在浓香型酒醅发酵过程中酵母属为酒醅样品的主要优势菌属。赫飞等[45]对酱香型白酒酿造酒醅中酵母属的多样性进行研究,发现其蕴藏极其丰富的酵母菌资源,与本研究结果一致。尚柯[46]发现曲霉属在酱香型白酒酿造过程中具有重要作用,具有糖化力、液化力和分解蛋白质的作用,可以提高白酒的风味和生产力。菌草酒发酵过程中曲霉属相对丰度在发酵2 d时达到最高值,青霉属在发酵第0 d的相对丰度最高,随着发酵时间的延长,曲霉属和青霉属的丰度逐渐下降。Lyu等[47]研究发现,曲霉属与发酵过程中酒精的产生具有密切关系,霉菌通过产生大量还原糖淀粉酶促使原料中有机质分解为可被酵母菌直接利用的还原糖,进而产生大量酒精,而在发酵中后期可能由于发酵环境中酒精和有机酸含量不断增加,以及一些耐酸、耐酒精的菌群大量繁殖,导致霉菌含量不断减少。这与本研究曲霉属在菌草酒酿造过程中的变化趋势一致。
曲霉属具有好气性,在发酵罐里较难生长繁殖,因此其主要作用是在发酵初期将纤维素半纤维素等水解为糖,使直接利用糖的微生物得以生长和发酵。酵母属在入罐后迅速增加,将糖发酵生成酒精。随着发酵时间延长,发酵罐内的温度、酸度和酒精度逐渐上升、糖分逐渐降低,有利于不耐渗透压的微生物生长,一些酒精部分被氧化为醋酸。发酵末期真菌中酵母菌属逐渐衰亡,数量减少,但仍然为优势菌群,推测发酵末期酵母属可能有产酯酵母或耐高温酵母。王松等[48]研究发现,发酵50 d后酒醅中的真菌群落多样性降低,曲霉属的丰度从1.8% 上升到60.4%,取代酵母菌(Saccharomyces cerevisiae)成为新的优势真菌,在该发酵条件下酵母菌对浓香型白酒的酿造不利。这与本研究结果不同,可能与酿造原料和发酵方式的不同有关。以上优势菌属的变化说明菌草酒发酵过程中酒醅的微生物菌落呈动态变化。
发酵的好坏决定了成品酒最终品质的优劣,而微生物的新陈代谢在发酵过程中扮演重要角色。因此,对微生物菌落和物种关系的了解对于优化白酒生产工艺和确保成品酒的品质至关重要。近年来,许多学者对酿酒过程中微生物菌落的动态变化规律进行了研究。然而,菌草酒发酵过程中微生物菌落结构的多样性及其动态变化规律尚未见相关报道。
4 结论本研究采用高通量测序技术对菌草酒发酵过程中的真菌群落进行分析,共注释到8个门、22个纲、50个目、110个科、243个属。在门水平上分析,优势真菌门(平均相对丰度>1%)为子囊菌门、担子菌门和接合菌门,其中子囊菌门为核心优势菌门;在属水平上分析,优势菌属(平均相对丰度≥ 1%)为未分类属、酵母属、曲霉属、青霉属、木耳属、被孢霉属和镰刀菌属,其中未分类属和酵母属为核心优势菌属。研究结果显示,发酵早期和中期的真菌群落丰度高于发酵末期,表明不同发酵阶段的真菌群落结构呈动态变化。此外,通过PCA分析发现,发酵0 d与其他发酵时期的样本真菌群落遗传距离均较远;发酵0.5 d和1 d的样本真菌群落遗传距离均较接近;发酵2、3、5、7 d的样本真菌群落遗传距离均较接近;发酵中期10、15、21 d的样本真菌群落遗传距离与前期酒醅的样本真菌群落遗传距离均较远。这表明菌草酒真菌菌群的遗传距离在发酵过程中呈现明显的阶段性变化,并且与发酵时间密切相关。本研究首次对菌草酒发酵过程中的真菌群落进行了系统解析,为菌草酒的现代化、规模化和标准化生产提供了新思路。
| [1] |
LIN B S, SONG Z Z, JIA Y L, JIA Y L, ZHANG Y L, WANG L F, FAN J L, LIN Z X. Biological characteristics and genome-wide sequence analysis of endophytic nitrogen-fixing bacteria Klebsiella variicola GN02[J]. Biotechnology & Biotechnological Equipment, 2019, 33(3): 1-10. DOI:10.1080/13102818.2018.1555010 |
| [2] |
梅嘉沼, 葛红柳, 刘翠翠, 朱专为, ALAM I, 阳宴清, 卢运海. 菌草种质资源AFLP多样性分析[J]. 热带农业科学, 2017, 37(11): 32-38. DOI:10.12008/j.issn.1009-2196.2017.11.007 MEI J Z, GE H L, LIU C C, ZHU Z W, ALAM I, YANG Y Q, LU Y H. AFLP diversity analysis of myces germplasm resources[J]. Chinese Journal of Tropical Agriculture, 2017, 37(11): 32-38. DOI:10.12008/j.issn.1009-2196.2017.11.007 |
| [3] |
翁志强, 许钰滢, 吕正阳, 刘娟, 王哲, 蔡杨星, 王荣波, 叶文雨. 巨菌草根际土壤微生物群落代谢功能多样性分析[J]. 广东农业科学, 2021, 48(4): 62-68. DOI:10.16768/j.issn.1004-874X.2021.04.009 WENG Z Q, XU Y Y, LYU Z Y, LIU J, WANG Z, CAI Y X, WANG R B, YE W Y. Analysis on metabolic functional diversity of rhizosphere microbial communities of Pennisetum giganteum[J]. Guangdong Agricultural Sciences, 2021, 48(4): 62-68. DOI:10.16768/j.issn.1004-874X.2021.04.009 |
| [4] |
李望豪, 周瑞鹏, 许钰滢, 赵琪琪, 刘娟, 王荣波, 叶文雨. 一株海南菌草"绿洲一号"内生细菌的分离鉴定及其生物学特性研究[J]. 广东农业科学, 2022, 49(7): 81-88. DOI:10.16768/j.issn.1004-874X.2022.07.011 LI W H, ZHOU R P, XU Y Y, ZHAO Q Q, LIU J, WANG R B, YE W Y. Isolation, identification and biological characteristics of an endophytic bacterium from Juncao "Oasis No.1" in Hainan[J]. Guangdong Agricultural Sciences, 2022, 49(7): 81-88. DOI:10.16768/j.issn.1004-874X.2022.07.011 |
| [5] |
邱余杨, 赵辉, 何啸宇, 祝芙蓉, 刘斌, 刘庆华. 巨菌草饲料最佳发酵工艺及发酵过程中菌群结构与功能研究[J]. 福建农林大学学报(自然科学版), 2023, 52(1): 106-116. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2023.01.016.sci.).2023.01.016 QIU Y Y, ZHAO H, HE X Y, ZHU F R, LIU B, LIU Q H. Study on the optimal fermentation process of Megamyces feed and the structure and function of flora during fermentation[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2023, 52(1): 106-116. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2023.01.016.sci.).2023.01.016 |
| [6] |
JIN Y Q, LAI C M, CHENG X S, LI Y L. Preparation and catalytic performance of biomass-based solid acid catalyst from Pennisetum sinense for cellulose hydrolysis[J]. International Journal of Biological Macromolecules, 2020, 165: 1149-1155. DOI:10.1016/j.ijbiomac.2020.09.256 |
| [7] |
LIN B S, CHEN Y, ZHENG S Z, JIA Y L, WANG L F, LU G D, LIN Z X. Construction of nitrogen-fixing Klebsiella variicola GN02 expression vector pET28a-Lac-EGFP and its colonization of Pennisetum sinense Roxb roots[J]. Biotechnology & Biotechnological Equipment, 2019, 33(1): 1074-1084. DOI:10.1080/13102818.2019.1638301 |
| [8] |
谷瑶, 朱永杰, 周丽珠, 梁忠云, 李桂珍, 曾永明. 柠檬香茅草总黄酮和多糖含量的测定[J]. 应用化工, 2018, 47(4): 846-848. DOI:10.16581/j.cnki.issn1671-3206.20180119.002 GU Y, ZHU Y J, ZHOU L Z, LIANG Z Y, LI G Z, ZENG Y M. Determination of total flavonoid and polysaccharide content of lemongrass[J]. Applied Chemical Industry, 2018, 47(4): 846-848. DOI:10.16581/j.cnki.issn1671-3206.20180119.002 |
| [9] |
王雨晴. 川贵白酒包装的发展沿革与设计创新研究[D]. 无锡: 江南大学, 2021. DOI: 10.27169/d.cnki.gwqgu.2021.001222. WANG Y Q. Research on the development and design innovation of Chuangui liquor packaging[D]. Wuxi: Jiangnan University, 2021. DOI: 10.27169/d.cnki.gwqgu.2021.001222. |
| [10] |
师静, 林占熺, 林冬梅, 苏德伟, 罗海凌, 林兴生, 林占森, 郑丹, 陈锦华, 姚俊新. 巨菌草纤维素的酶解条件[J]. 草业科学, 2014, 31(4): 760-765. DOI:10.11829/j.issn.1001-0629.2013-0147 SHI J, LIN Z X, LIN D M, SU D W, LUO H L, LIN X S, LIN Z S, ZHENG D, CHEN J H, YAO J X. Enzymatic hydrolysis conditions of cellulose of Megamycetes[J]. Pratacultural Science, 2014, 31(4): 760-765. DOI:10.11829/j.issn.1001-0629.2013-0147 |
| [11] |
童金华. 菌草复合饮料配方的研究[J]. 农产品加工, 2021(13): 26-29, 33. DOI:10.16693/j.cnki.1671-9646(X).2021.07.006 DONG J H. Study on the formulation of fungus compound drinks[J]. The Processing of Agricultural Products, 2021(13): 26-29, 33. DOI:10.16693/j.cnki.1671-9646(X).2021.07.006 |
| [12] |
范锦琳, 张丽丽, 张煜隆, 林辉, 易超, 林占熺, 林冬梅. 菌草酒酿造工艺优化及其品质分析[J]. 福建农林大学学报(自然科学版), 2023, 52(1): 98-105. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2023.01.015.sci.).2023.01.015 FAN J L, ZHANG L L, ZHANG Y L, LIN H, YI C, LIN Z X, LIN D M. Optimization of brewing process and quality analysis of fungus wine[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2023, 52(1): 98-105. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2023.01.015.sci.).2023.01.015 |
| [13] |
戎梓溢, 白茹, 闫学娇, 李超, 林良才, 张翠英. 酱香型白酒酿造微生态中酵母菌的研究进展[J]. 食品研究与开发, 2022, 43(13): 180-188. DOI:10.12161/j.issn.1005-6521.2022.13.026 RONG Z Y, BAI R, YAN X J, LI C, LIN L C, ZHANG C Y. Research progress of yeast in the microecology of sauce-flavored liquor brewing[J]. Food Research and Development, 2022, 43(13): 180-188. DOI:10.12161/j.issn.1005-6521.2022.13.026 |
| [14] |
陈慧颖, 李慧星, 许彬, 曹斌, 王春艳. 河南浓香型酒醅的真菌微生物菌群多样性及共变性[J]. 工业微生物, 2021, 51(2): 36-45. DOI:10.3969/j.issn.1001-6678.2021.02.006 CHEN H Y, LI H X, XU B, CAO B, WANG C Y. Diversity and covariance of fungal microbiota in Henan fragrant liquor[J]. Industrial Microbiology, 2021, 51(2): 36-45. DOI:10.3969/j.issn.1001-6678.2021.02.006 |
| [15] |
GAN S H, YANG F, LUO R Y, LIAO S L, WANG H Y, JIN T, WANG L, ZHANG P F, LIU X, JIN X, JING X, WANG Y Y, LIU H. Deciphering the composition and functional profile of the microbial communities in Chinese moutai liquor starters[J]. Frontiers in Microbiology, 2019, 10: 1540. |
| [16] |
陈申习, 宿智新, 张磊, 林斌, 陈凯, 刘源才, 杨强. 基于高通量测序的清香型和酱香型酒曲真菌群落特征研究[J]. 中国酿造, 2021, 40(7): 49-53. DOI:10.11882/j.issn.0254-5071.2021.07.010 CHEN S X, XU Z X, ZHANG L, LIN B, CHEN K, LIU Y C, YANG Q. Study on the characteristics of fungal communities of Qingxiang and sauce-flavored koji based on high-throughput sequencing[J]. China Brewing, 2021, 40(7): 49-53. DOI:10.11882/j.issn.0254-5071.2021.07.010 |
| [17] |
KUMAR K R, COWLEY M J, DAVIS R L. Next-generation sequencing and emerging technologies[J]. Seminars in Thrombosis and Hemostasis, 2019, 45: 661-673. DOI:10.1055/s-0039-1688446 |
| [18] |
CONRADS G, ABDELBARY M M H. Challenges of next-generation sequencing targeting anaerobes[J]. Anaerobe, 2019, 58: 47-52. DOI:10.1016/j.anaerobe.2019.02.006 |
| [19] |
ZHAO X X, WANG Y R, CAI W C, YANG M J, ZHONG X D, GUO Z, SHAN C H. High-throughput sequencing-based analysis of microbial diversity in rice wine koji from different areas[J]. Current Microbiology, 2020, 77: 882-889. DOI:10.1007/s00284-020-01877-9 |
| [20] |
DAI Y, TIAN Z, MENG W, LI Z J. Microbial diversity and physicochemical characteristics of the maotai-flavored liquor fermentation process[J]. Journal of Nanoscience and Nanotechnology, 2020, 20(7): 4097-4109. DOI:10.1166/jnn.2020.17522 |
| [21] |
MA S Y, LUO H B, ZHAO D, QIAO Z W, ZHENG J, AN M, HUANG D. Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing Daqu[J]. Bioresource Technology, 2022, 345: 126549. DOI:10.1016/J.BIORTECH.2021.126549 |
| [22] |
FAN G S, SUN B G, FU Z L, XIA Y Q, HUANG M Q, XU C Y, LI X T. Analysis of physicochemical indices, volatile flavor components, and microbial community of a light-flavor Daqu[J]. Journal of the American Society of Brewing Chemists, 2018, 76(3): 209-218. DOI:10.1080/03610470.2018.1424402 |
| [23] |
周森, 韩培杰, 胡佳音, 崔阳, 赵卫鹏, 王勇, 郝文军, 张如金, 魏金旺. 牛栏山二锅头酿造过程中的真菌多样性分析[J]. 食品工业科技, 2018, 39(1): 127-130, 136. DOI:10.13386/j.issn1002-0306.2018.01.024 ZHOU S, HAN P J, HU J Y, CUI Y, ZHAO W P, WANG Y, HE W J, ZHANG R J, WEI J W. Analysis of fungal diversity in the brewing process of Niulanshan Erguotou[J]. Science and Technology of Food Industry, 2018, 39(1): 127-130, 136. DOI:10.13386/j.issn1002-0306.2018.01.024 |
| [24] |
杨婧, 李娜娜, 刘子恒, 田文滨. 高粱单宁对清香型大曲白酒发酵过程中真菌群落结构的影响[J]. 食品科技, 2022, 47(7): 1-9. DOI:10.13684/j.cnki.spkj.2022.07.032 YANG J, LI N N, LIU Z H, TIAN W B. Effect of sorghum tannin on fungal community structure during fermentation of fragrant Daqu liquor[J]. Food Science and Technology, 2022, 47(7): 1-9. DOI:10.13684/j.cnki.spkj.2022.07.032 |
| [25] |
姜明慧, 许玲, 于文娟, 董乔娟, 于盼盼, 杨庆振, 白秀彬, 赵纪文. 高通量测序技术分析酱香型白酒下沙轮次堆积过程的微生物多样性[J]. 酿酒, 2020, 47(4): 51-55, 59. JIANG M H, XU L, YU W J, DONG Q J, YU P P, YANG Q Z, BAI X B, ZHAO J W. High-throughput sequencing technology to analyze the microbial diversity of the sand round accumulation process under sauce-flavored liquor[J]. Liquor Making, 2020, 47(4): 51-55, 59. |
| [26] |
LI X R, MA E B, YAN L Z, MENG H, DU X W, ZHANG S W, QUAN Z X. Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J]. International Journal of Food Microbiology, 2011, 146(1): 31-37. DOI:10.1016/j.ijfoodmicro.2011.01.030 |
| [27] |
HONG X T, CHEN J, LIU L, WU H, TAN H Q, XIE G F, XU Q, ZOU H J, YU W J, WANG L, QIN N. Metagenomic sequencing reveals the relationship between microbiota composition and quality of Chinese rice wine[J]. Scientific Reports, 2016, 6: 26621. DOI:10.1038/srep26621 |
| [28] |
白农恩, 刘李蕾, 邓巍, 姜林, 杨晓燕. 小生境范围内3种园林植物叶际细菌群落结构及多样性分析[J]. 广东农业科学, 2022, 49(6): 43-50. DOI:10.16768/j.issn.1004-874X.2022.06.006 BAI N E, LIU L L, DENG W, JIANG L, YANG X Y. Analysis on phyllosphere bacterial community structure and diversity of three Garden plants in niche area[J]. Guangdong Agricultural Sciences, 2022, 49(6): 43-50. DOI:10.16768/j.issn.1004-874X.2022.06.006 |
| [29] |
XU C L, SUN R, QIAO X J, XU C C, SHANG X Y, NIU W N. Protective effect of glutamine on intestinal injury and bacterial community in rats exposed to hypobaric hypoxia environment[J]. World Journal of Gastroenterology, 2014, 16: 4662-4674. DOI:10.3748/wjg.v20.i16.4662 |
| [30] |
YU W, HUA F S, HE Y, Wu J Y, JIANG Y X, TAM N, FUNG Y, ZHOU H W. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Applied and Environmental Microbiology, 2012, 78(23): 8264. DOI:10.1128/AEM.01821-12 |
| [31] |
汪江波, 周敏, 沈永祥, 黄琴, 陈守文, 蔡凤娇, 薛栋升. 白酒机械化酿造过程中主要风味物质的生成规律[J]. 湖北农业科学, 2014, 53(22): 5499-5503. DOI:10.14088/j.cnki.issn0439-8114.2014.22.044 WANG J B, ZHOU M, SHENG Y X, HUANG Q, CHEN S W, CAI F J, XUE D S. The formation law of main flavor substances in the process of mechanized brewing of liquor[J]. Hubei Agricultural Sciences, 2014, 53(22): 5499-5503. DOI:10.14088/j.cnki.issn0439-8114.2014.22.044 |
| [32] |
周志立. 绍兴黄酒生麦曲的微生物群落演替驱动力研究与制曲工艺优化[D]. 无锡: 江南大学, 2021. DOI: 10.27169/d.cnki.gwqgu.2021.001403. ZHOU Z L. Study on the driving force of microbial community succession and optimization of koji making process of Shaoxing rice wine raw wheat koji[D]. Wuxi: Jiangnan University, 2021. DOI: 10.27169/d.cnki.gwqgu.2021.001403. |
| [33] |
周袁璐, 师苑, 陆跃乐, 朱林江, 陈小龙. 传统发酵过程微生物互作研究进展[J]. 中国食品学报, 2021, 21(11): 349-358. DOI:10.16429/j.1009-7848.2021.11.038 ZHOU Y L, SHI Y, LU Y L, ZHU L J, CHEN X L. Research progress on microbial interaction in traditional fermentation process[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(11): 349-358. DOI:10.16429/j.1009-7848.2021.11.038 |
| [34] |
王雪山, 杜海, 徐岩. 清香型白酒发酵过程中微生物种群空间分布[J]. 食品与发酵工业, 2018, 44(9): 1-8. DOI:10.13995/j.cnki.11-1802/ts.017334 WANG X S, DU H, XU Y. Spatial distribution of microbial community during Chinese light-flavor liquor fermentation[J]. Food and Fermentation Industries, 2018, 44(9): 1-8. DOI:10.13995/j.cnki.11-1802/ts.017334 |
| [35] |
孙哲, 黄芷珊, 刘幼强, 曹荣冰, 黄桂东, 钟先锋. 酒饼叶对豉香型白酒酒饼细菌多样性影响研究[J]. 食品与发酵工业, 2022, 48(13): 63-69. DOI:10.13995/j.cnki.11-1802/ts.029725 SUN Z, HUANG Z S, LIU Y Q, CAO R B, HUANG G D, ZHONG X F. Effects of herbal leaves on bacterial diversity of Chi-flavor Baijiu Jiuqu[J]. Food and Fermentation Industries, 2022, 48(13): 63-69. DOI:10.13995/j.cnki.11-1802/ts.029725 |
| [36] |
彭丽娟, 李孟伟, 杨承剑, 谢华德, 彭开屏, 郭艳霞, 唐振华, 梁辛. 不同乳酸菌和酵母菌添加量及发酵天数对甘蔗尾青贮发酵品质及营养价值的影响[J]. 畜牧与兽医, 2022, 54(3): 21-27. PENG L J, LI M W, YANG C J, XIE H D, PENG K P, GUO Y X, TANG Z H, LIANG X. Effects of different lactic acid bacteria and yeast addition and fermentation days on fermentation quality and nutritional value of sugarcane tail silage[J]. Animal Husbandry and Veterinary Medicine, 2022, 54(3): 21-27. |
| [37] |
邢德峰, 任南琪. 应用DGGE研究微生物群落时的常见问题分析[J]. 微生物学报, 2006(2): 331-335. DOI:10.13343/j.cnki.wsxb.2006.02.034 XING D F, REN N Q. Analysis of common problems when applying DGGE to study microbial communities[J]. Journal of Microbiology, 2006(2): 331-335. DOI:10.13343/j.cnki.wsxb.2006.02.034 |
| [38] |
戴奕杰, 李宗军, 田志强. 酱香型白酒大曲和糟醅的真菌多样性分析[J]. 现代食品科技, 2018, 34(7): 97-104. DOI:10.13982/j.mfst.1673-9078.2018.7.015 DAI Y J, LI Z J, TIAN Z Q. Analysis of fungal diversity of sauce-f lavored liquor Daqu and mash[J]. Modern Food Science and Technology, 2018, 34(7): 97-104. DOI:10.13982/j.mfst.1673-9078.2018.7.015 |
| [39] |
张春林, 杨亮, 李喆, 甘广东, 何珺珺. 酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J]. 食品科技, 2022, 47(4): 111-118. DOI:10.13684/j.cnki.spkj.2022.04.036 ZHANG C L, YANG L, LI Z, GAN G D, HE J J. Accumulation of microbial diversity in sauce-flavored liquor and its relationship with flavor substances[J]. Food Science and Technology, 2022, 47(4): 111-118. DOI:10.13684/j.cnki.spkj.2022.04.036 |
| [40] |
葛云飞, 赵舒婷, 刘德志, 王维浩, 曹龙奎. 基于宏基因组技术分析自然发酵高粱菌群结构[J]. 食品研究与开发, 2019, 40(24): 26-32. DOI:10.12161/j.issn.1005-6521.2019.24.005 GE Y F, ZHAO X T, LIU D Z, WANG W H, CAO L K. Analysis of naturally fermented sorghum flora structure based on metagenomic technology[J]. Food Research and Development, 2019, 40(24): 26-32. DOI:10.12161/j.issn.1005-6521.2019.24.005 |
| [41] |
胡晓龙, 王康丽, 余苗, 田瑞杰, 张治刚, 王永亮, 赵东, 何培新, 魏涛. 浓香型酒醅微生物菌群演替规律及其空间异质性[J]. 食品与发酵工业, 2020, 46(10): 66-73. DOI:10.13995/j.cnki.11-1802/ts.023321 HU X L, WANG K L, YU M, TIAN R J, ZHANG Z G, WANG Y L, ZHAO D, HE P X, WEI T. Succession law of microbial flora and spatial heterogeneity of aromatic liquor[J]. Food and Fermentation Industries, 2020, 46(10): 66-73. DOI:10.13995/j.cnki.11-1802/ts.023321 |
| [42] |
牟穰. 清爽型黄酒酿造微生物群落结构及其与风味物质相关性研究[D]. 无锡: 江南大学, 2015. MOU R. Study on the microbial community structure of refreshing rice wine brewing and its correlation with flavor substances[D]. Wuxi: Jiangnan University, 2015. |
| [43] |
WU Q, CHEN B, XU Y. Requlating yeast f lavor metabolism by controling saccharification reaction rate in simultaneous saccharification and fermentation of Chinese maotai flavor liquor[J]. International Journal of Food Microbiology, 2015, 200: 39-46. DOI:10.1016/j.ijfoodmicro.2015.01.012 |
| [44] |
汪慧慧, 高俊杰, 李庆腾, 苗译文, 李顺涛, 李志星, 李泽, 邱磊. 浓香型酒醅发酵过程中真核微生物群落的研究[J]. 食品科技, 2022, 47(8): 14-20. DOI:10.13684/j.cnki.spkj.2022.08.013 WANG H H, GAO J J, LI Q T, MIAO Y W, LI S T, LI Z X, LI Z, QIU L. Study of eukaryotic microbial communities during fermentation of aromatic liquor[J]. Food Science and Technology, 2022, 47(8): 14-20. DOI:10.13684/j.cnki.spkj.2022.08.013 |
| [45] |
郝飞, 吕锡斌, 吴耀领, 曾祥炼, 张巧玲, 陈良强, 袁颉, 罗汝叶, 杨帆, 王和玉, 王莉, 尉洪涛, 韩培杰, 白逢彦. 酱香型白酒酿造酒醅中酵母菌多样性研究[J]. 菌物学报, 2019, 38(5): 620-630. DOI:10.13346/j.mycosystema.180313 HE F, LYU X B, WU Y L, ZENG X L, ZHANG Q L, CHEN L Q, YUAN J, LUO R Y, YANG F, WANG H Y, WANG L, WEI H T, HAN P J, BAI F Y. Study on yeast diversity in sauce-flavored liquor brewing liquor[J]. Mycosystema, 2019, 38(5): 620-630. DOI:10.13346/j.mycosystema.180313 |
| [46] |
尚柯. 酱香型白酒高温堆积工艺机理的初步研究[D]. 乌鲁木齐: 新疆农业大学, 2016. SHANG K. Preliminary study on the mechanism of high-temperature stacking process of sauce-flavored liquor[D]. Urumqi: Xinjiang Agricultural University, 2016. |
| [47] |
LYU X C, HUANG Z Q, ZHANG W, RAO P F, NI L. Identification and characterization of filamentous fungi isolated from fermentation starters for hong qu glutinous rice wine brewing[J]. The Journal of General Applied Microbiology, 2012, 58(1): 33-42. DOI:10.2323/jgam.58.33 |
| [48] |
王松, 汤涵岚, 王陟垚, 姜玉婷, 毛晶晶, 游玲, 王涛. Saccharomyces cerevisiae对浓香型白酒发酵的影响[J]. 食品工业科技, 2017, 38(21): 142-146, 150. DOI:10.13386/j.issn1002-0306.2017.21.029 WANG S, TANG H L, WANG Z Y, JIANG Y T, MAO J J, YOU L, WANG T. Effect of Saccharomyces cerevisiae on the fermentation of aromatic liquor[J]. Science and Technology of Food Industry, 2017, 38(21): 142-146, 150. DOI:10.13386/j.issn1002-0306.2017.21.029 |
(责任编辑 崔建勋)
 2024, Vol. 51
2024, Vol. 51