文章信息
基金项目
- 国家自然科学基金(31800012);广州市科技计划重点研发计划(202206010050);广东省自然科学基金(2018A0303130164);广州市科技计划重点项目(201804020018)
作者简介
-
张成花,博士,广东省科学院微生物研究所副研究员。主要从事食药用菌组学、功能基因和活性物质以及种质资源评价与利用研究。近5年先后主持国家自然科学基金青年基金项目1项、省部级项目2项、广东省科学院人才项目2项;参与国家级项目5项、广州市科技计划重点项目1项、广州市重点研发项目1项;发表学术论文28篇,其中SCI论文20篇;获授权国家发明专利8件;选育珍稀食药用菌广东虫草新品种1个;参与编写著作1部。
张成花(1986—),女,博士,副研究员,研究方向为食药用菌资源利用与品种选育,E-mail:zhangch@gdim.cn.
通讯作者
- 邓旺秋(1973—),女,博士,研究员,研究方向为大型真菌资源与应用,E-mail:dengwq@gdim.cn.
文章历史
- 收稿日期:2023-12-11
【研究意义】原生质体是植物细胞去除细胞壁组分后的总称,在生物技术研究方面有良好的应用前景,主要用于原生质体融合、原生质体突变、原生质体转化等。因此,原生质体可广泛应用于品种改良及新品种选育等领域[1-3];同时,基于原生质体建立的遗传转化方法还可用于基因功能、蛋白定位等分子生物学基础研究。【前人研究进展】原生质体制备的关键在于对细胞壁的消化,不同物种的细胞壁成分存在差异,因此所用的细胞壁消化酶也不同。而影响原生质体产量和质量的因素除了酶的种类,还包括材料种类、酶解体系、酶解时间、酶解温度、渗透压稳定剂等[4]。不同真菌的细胞壁组成有所不同,主要由β葡聚糖、几丁质、甘露聚糖等多糖及糖蛋白组成[5],酶解时需要根据细胞壁的组成特点,选择合适的消化酶、消化时间、消化温度,从而获得大量优质的原生质体。成熟的遗传转化体系是开展基因功能研究的基础。目前常用的遗传转化方法主要有根癌农杆菌转化法(Agrobacterium tumefaciens-mediated transformation,ATMT)、聚乙二醇(Polyethylene glycol,PEG)介导的原生质体转化法、基因枪法(Biolistic)和CRISPR-Cas9转化法等[6]。其中最常用的是ATMT法[7-8]和PEG介导的原生质体转化法。目前,ATMT法已成功应用到多种食药用菌中,虫草真菌中也有不少报道,如蛹虫草(Cordyceps militaris)[9]、球孢白僵菌(Beauveria bassiana)[10]、罗伯茨绿僵菌(Metarhizium robertsii)[11]、冬虫夏草(Ophiocordyceps sinensis)[12]等。而PEG介导的原生质体转化法在食用菌中报道较多,如香菇(Lentinula edodes)[13-14]、灵芝(Ganoderma lucidum)[15]、银耳(Tremella fuciformis)[16]、双孢蘑菇(Agaricus bisporus)[17]、茶树菇(Agrocybe aegerita)[18]、杏鲍菇(Pleurotus eryngii)[19]、金针菇(Flammulina velutipes)[20]等,但在虫草真菌中仅有少数报道,如爪哇虫草(Cordyceps javanica)[21]、蛹虫草[22]等。与ATMT法相比,PEG介导的原生质体转化法具有操作更为简便的优势。在广东虫草中,郝转等[23]采用ATMT法构建了热激蛋白40 CgDnaJ05基因沉默转化子,证实CgDnaJ05基因明显影响广东虫草菌丝生长和原基形成。但PEG介导的原生质体转化法在广东虫草中尚未报道。
【本研究切入点】广东虫草是我国特有珍稀食药用菌,其营养成分丰富,活性功效显著,具有抗氧化[24]、防治慢性肾衰竭[25]、治疗慢性支气管炎[26]、抗疲劳及延长动物寿命[27]、保护禽流感病毒小鼠肺部[28]、缓减肥胖、降血脂[29-30]等作用。目前该虫草已实现子实体规模化栽培,在食品、保健品、医药及化妆品领域均有广阔的应用前景,因此选育高产优质新品种对促进其产业化应用具有重要意义。团队前期对广东虫草全基因组进行了测序,挖掘到部分子实体发育关键基因,如CgPro1,该基因是真菌中特有的锌指半胱氨酸结构转录因子,在多数真菌中参与有性发育过程,但其具体功能尚不清楚,而建立成熟的原生质体制备技术和相关的遗传转化体系是原生质体应用及基因功能研究的前提基础。【拟解决的关键问题】以广东虫草为材料,建立成熟的原生质体制备及PEG介导的原生质体转化法,并以广东虫草中的CgPro1基因为目的转化片段对转化系统进行验证,为广东虫草新品种选育及重要功能基因研究奠定基础。
1 材料与方法 1.1 试验材料与试剂1.1.1 供试菌株 供试广东虫草菌株GDGM 30035,由广东省微生物研究所华南微生物资源中心提供。
1.1.2 供试培养基 PDA固体培养基:200 g土豆去皮切成1 cm3的小块,加800 mL纯水煮沸后继续煮30 min,纱布过滤,加入葡萄糖20 g,琼脂粉15 g(在转化子筛选时使用低熔点琼脂),加水定容至1 L;YMPT固体培养基:麦芽汁培养基6 g,酵母提取物6 g,胰蛋白胨10 g,葡萄糖20 g,低熔点琼脂粉15 g,加水定容至1 L;HPDA固体培养基:250 g黄豆芽加水煮沸后继续煮10 min,定容至400 mL,加入PDA培养基定容至1 L;TB3固体培养基:酵母提取物3 g,酸水解酪蛋白3 g,蔗糖200 g,低熔点琼脂15 g,加水定容至1 L;0.6 mol/L KCl-PDA固体培养基:在PDA配方基础上加入KCl 44.73 g,定容至1 L;上述培养基均121 ℃灭菌20 min。
1.1.3 试剂及溶液配制 KC缓冲液:KCl 13.42 g,CaCl2 1.665 g,加去离子水定容至300 mL。亚精胺溶液:配制500 mmol/L的亚精胺母液,用直径0.22 μm的细菌过滤器过滤备用。PEG4000溶液(现配现用):称取PEG4000 0.25 g,加入10 mmol/mL Tris-HCl 500 μL、50 mmol/mL CaCl2 500 μL,搅拌溶解后,用直径0.22 μm的无菌滤器过滤备用。裂解酶、崩溃酶购于Sigma-Aldrich.Inc公司(货号L1412、85186-71-6);溶壁酶、蜗牛酶购于上海源叶生物科技有限公司(货号S10107、S10083)。
1.2 广东虫草原生质体制备最佳条件筛选将广东虫草菌株接种至YMPT液体培养基中,120 r/min、24 ℃摇床培养12 d,获得广东虫草菌丝体(菌球)。分别称取0.5 g菌球,用KC缓冲液清洗后,置于六孔板中,用于后续试验分析,试验重复3次。
1.2.1 菌丝最佳酶解体系筛选 分别在每10 mL KC缓冲液中加入裂解酶、裂解酶+ 蜗牛酶、裂解酶+ 崩溃酶、溶壁酶、溶壁酶+蜗牛酶、溶壁酶+崩溃酶各0.15 g(混合酶按1∶1比例加入),制成6种酶液,用直径0.22 μm细菌过滤器过滤后备用。往盛有菌球的孔板中每孔加入5 mL不同的酶液,酶解4.5 h后镜检并使用血球计数板计算原生质体数量。
1.2.2 广东虫草菌丝最佳酶解时间筛选 往盛有菌球的孔板中加入5 mL最佳酶液后,从第3.5 h开始镜检(前期试验发现前3.5 h酶解效果较差,原生质体释放极少),并使用血球计数板计算原生质体数量,每1 h取样计数1次。
1.2.3 广东虫草菌丝最佳酶解温度筛选 往盛有菌球的孔板中加入5 mL最佳酶液后,分别将孔板置于24 ℃、28 ℃、32 ℃,100 r/min酶解5.5 h,镜检并使用血球计数板计算原生质体数量。
1.3 广东虫草原生质体最佳复苏培养基及潮霉素抗性浓度筛选将获得的原生质体用KC缓冲液悬浮,调整其浓度为107个/mL备用。分别吸取200 μL原生质体悬浮液混入15 mL低熔点PDA、HPDA、0.6 mol/L KCl-PDA、TB3、YMPT培养基,置于24 ℃下恒温培养;分别吸取200 μL原生质体加入到含有不同潮霉素浓度的低熔点TB3培养基中,潮霉素浓度梯度为0、150、200、250、300 μg/mL,置于24 ℃下恒温培养。每个处理3次重复,观察原生质体复苏情况。
1.4 潮霉素抗性标记质粒pCAMBIA1300及CgPro1基因敲除转化片段准备将含潮霉素抗性标记质粒pCAMBIA1300的菌液于LB平板上划线培养,挑取单菌落接种于新的LB培养基中,摇瓶过夜培养。收集菌液,采用Takara质粒提取试剂盒进行质粒提取,检测浓度,采用KpnI内切酶将质粒进行单酶切线性化,回收,使其终浓度达到200 ~ 300 ng/μL备用。
PCR扩增CgPro1上下游1 kb左右同源臂,采用融合PCR将同源臂分别与潮霉素抗性标记基因片段连接,获得转化片段,PCR扩增连接后的全长转化DNA片段,回收,克隆到大肠杆菌感受态细胞中测序验证(引物见表 1)。
1.5 PEG介导的原生质体转化过程优化
取质粒转化DNA片段100 μL,加入亚精胺溶液(终浓度设置为2、5、7 mmol/L 3个不同梯度),混匀后,加入200 μL广东虫草原生质体,轻轻混匀后,冰浴10 min。室温条件下,在广东虫草原生质体与目的基因转化DNA片段混合液中,分3次分别加入100、200、500 μL的25% 体积分数的PEG4000溶液(设置5、10、15 min 3个不同的加入时间间隔),轻轻混匀后,将混合液全部加入到TB3再生培养基中,倒板,25 ℃恒温培养。TB3再生培养基培养一定天数后(设置不同时间间隔1、2、3、4、5 d),平板中再倒1层含有250 μg/mL潮霉素抗性标记的PDA培养基,继续培养。待转化子长到上层板后,挑取单个转化子于新的含有潮霉素抗性标记的PDA平板中,传代培养3代,获得稳定的转化子。
1.6 转化子鉴定及表型分析提取pCAMBIA1300质粒转化子DNA,PCR检测潮霉素抗性基因片段;提取转化子RNA,RT-PCR检测潮霉素抗性基因片段的表达情况,确认潮霉素基因插入到转化子中并正确表达。提取广东虫草锌指结构转录因子CgPro1敲除突变株DNA及RNA,检测CgPro1基因片段的存在及表达情况,并参照广东虫草子实体栽培方法对突变株进行子实体栽培表型分析[31-32]。
1.7 统计学分析采用SPSS 17.0统计软件中的单因素方差分析(One-way ANOVA)和Duncan多重比较法对数据结果进行显著性分析。
2 结果与分析 2.1 酶解组合对广东虫草原生质体释放的影响在其他酶解条件相同的前提下,不同酶解组合对广东虫草原生质体释放的影响如图 1所示。使用裂解酶+ 崩溃酶的组合获得的原生质体最多(7.54×106个/mL),且菌丝的裂解程度最高;单独使用裂解酶的效果次之;而溶壁酶及其混合酶体系对广东虫草菌丝酶解能力均较弱。因此认为裂解酶+ 崩溃酶是最佳的混合酶体系,后续试验中均使用该组合。
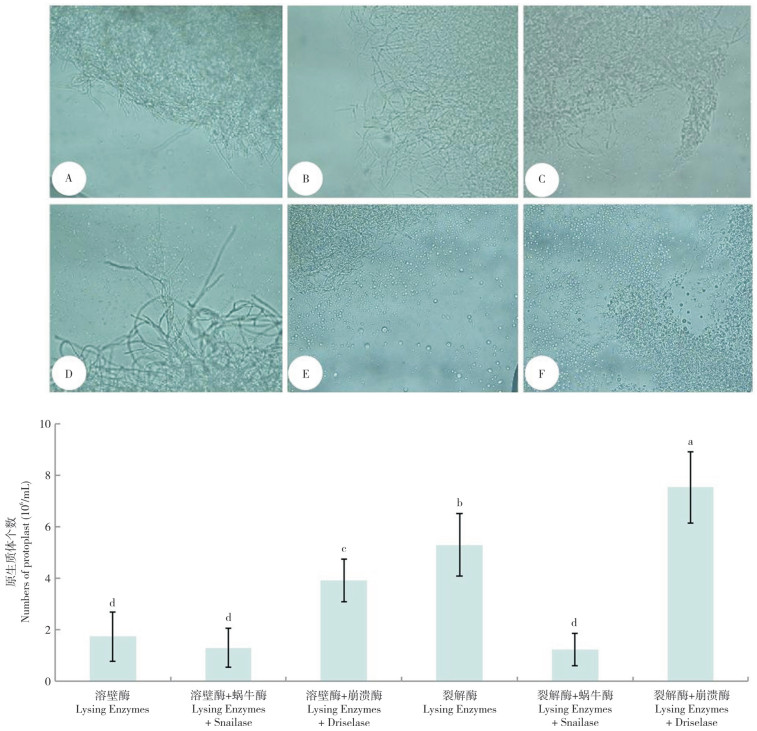
|
| A:溶壁酶;B:溶壁酶+ 蜗牛酶;C:溶壁酶+ 崩溃酶;D:裂解酶;E:裂解酶+ 蜗牛酶;F:裂解酶+ 崩溃酶;小写英文字母不同者表示差异显著 A: Lytic enzyme; B: Lytic enzyme+Snailase; C: Lytic enzyme+Driselase; D: Lytic enzyme; E: Lytic enzyme+Snailase; F: Lytic enzyme+Driselase; Different lowercase letters represent significant differences 图 1 酶解组合对广东虫草原生质体释放的影响 Fig. 1 Effects of enzyme combinations on protoplast release of Cordyceps guangdongensis |
2.2 酶解时间对广东虫草原生质体释放的影响
由图 2可知,裂解3.5~5.5 h广东虫草菌丝有较少量的原生质体释放,在5.5 h原生质体的增长最多,浓度为1.77×107个/mL,几乎翻倍增长;5.5 h后还有持续增长,后续研究发现广东虫草原生质体在22.5 h后仍存活,镜检无破裂现象。为方便试验进行,后续酶解温度筛选以5.5 h作为取样点。
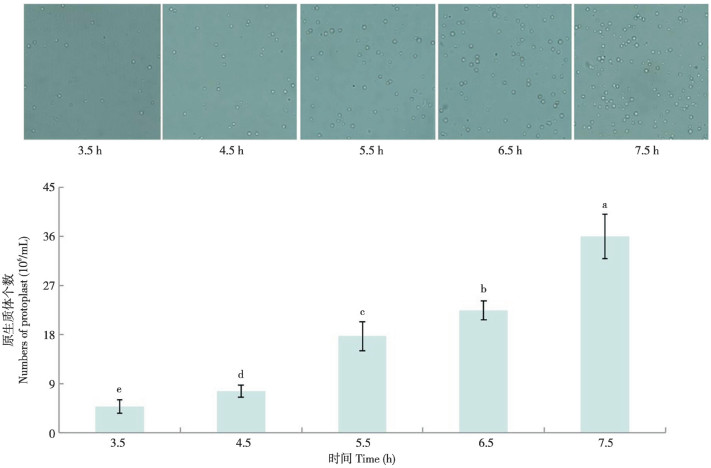
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 2 酶解时间对广东虫草原生质体释放的影响 Fig. 2 Effects of enzyme digestion time on protoplast release of Cordyceps guangdongensis |
2.3 酶解温度对广东虫草原生质体释放的影响
广东虫草菌丝体在裂解酶+ 崩溃酶作用下,裂解5.5 h时,不同酶解温度下原生质体释放情况如图 3所示。当酶解温度为28 ℃时,菌丝裂解获得的原生质体数量最多、达4.53×107个/mL,酶解温度为32 ℃时,酶解获得的原生质体数量相对较少,而酶解温度为24 ℃时,酶解获得的原生质体数量最少。
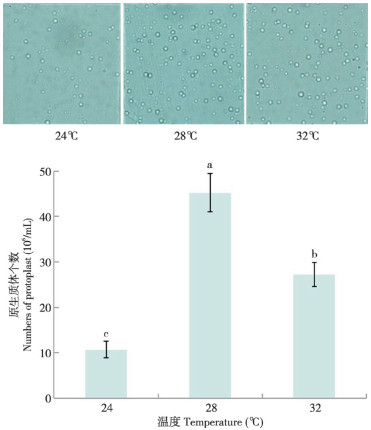
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 3 酶解温度对广东虫草原生质体释放的影响 Fig. 3 Effects of enzyme digestion temperature Cordyceps guangdongensis |
2.4 广东虫草原生质体复苏培养基及潮霉素抗性浓度筛选
原生质体复苏需要不同的营养条件,本研究发现广东虫草的原生质体在高渗的TB3复苏培养基中复苏效率最高(图 4),新长出的菌落几乎布满整个培养皿,0.6 mol/L KCl-PDA次之;而非高渗的培养基PDA、HPDA、YMPT的复苏效果均较差,只有较稀疏的单菌落长出,说明TB3培养基最适合广东虫草原生质体复苏。
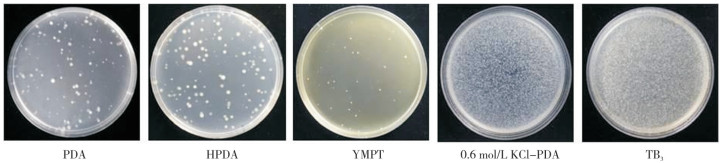
|
| 图 4 广东虫草原生质体复苏培养基筛选 Fig. 4 Screening of protoplast regeneration media of Cordyceps guangdongensis |
潮霉素抗性浓度筛选试验发现,当潮霉素浓度为0~200 μg/mL时,随浓度的升高,菌落数减少,在浓度为250 μg/mL时已无菌落生长(图 5),因此将250 μg/mL作为最佳潮霉素抗性浓度,并以此浓度后期筛选转化子。

|
| 图 5 广东虫草原生质体潮霉素抗性浓度筛选 Fig. 5 Screening of hygromycin resistance concentration for protoplasts of Cordyceps guangdongensis |
2.5 PEG介导的原生质体转化体系建立及优化
按照上述转化方法,筛选了亚精胺浓度、加入PEG4000的间隔时间、TB3再生培养基添加潮霉素抗性标记上层板的间隔时间对转化效率的影响。结果(表 2)显示,亚精胺的终浓度为5 mmol/L、加入PEG4000的间隔时间为10 min、TB3再生培养基添加潮霉素抗性标记上层板的间隔时间为3 d时,转化子筛选效率最高。
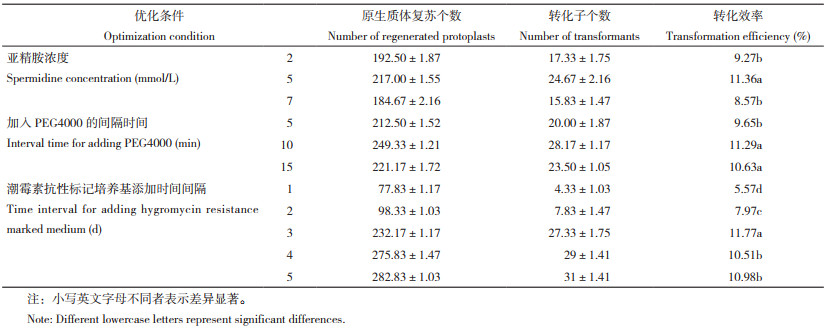
|
2.6 转化子鉴定及转化系统验证
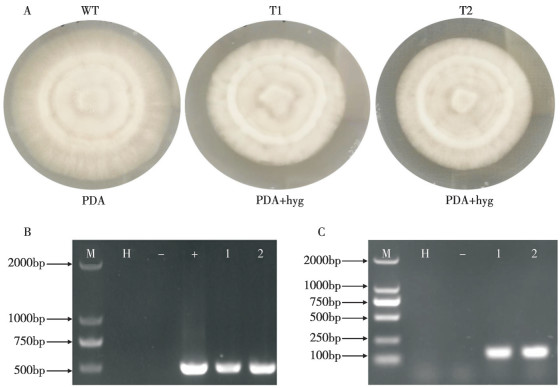
通过潮霉素抗性标记质粒pCAMBIA1300建立了广东虫草原生质体转化体系,并获得多个转化子,且转化子在含有潮霉素的培养基上稳定生长。潮霉素基因检测结果显示,转化子中潮霉素基因稳定存在且正常表达(图 6)。同时以广东虫草中的锌指半胱氨酸转录因子CgPro1敲除片段为目的转化片段,对转化系统进行了验证。以广东虫草DNA为模板,通过PCR扩增获得锌指结构转录因子CgPro1上游同源臂、潮霉素表达框、下游同源臂分别为925、2 221、1 077 bp。最终获得融合转化片段长度为4 223 bp(图 7)。将转化片段克隆到大肠杆菌中,挑取克隆子提取质粒进行测序验证,序列正确,证明转化片段构建成功。通过上述转化系统,本研究成功获得了3个CgPro1敲除突变株及3个杂合子,子实体栽培比较试验结果(图 8)显示,广东虫草中的锌指半胱氨酸转录因子CgPro1也参与其子实体发育过程。
|
| A:广东虫草野生型菌株WT与转化子T1、T2形态图;B:转化子DNA水平潮霉素片段检测;C:转化子RNA水平潮霉素片段检测;M:D2000 marker,H:水,-表示野生型菌株,+ 表示含有潮霉素的质粒 A: Phenotypes of wild type strain WT and transformer T1、T2; B: Transformants detection on DNA level; C: Transformants detection on RNA level; M: D2000 marker, H: H2O, -: Wild type strain, +: Plasmid containing hygromycin resistance marker (HPH) 图 6 转化子形态及潮霉素抗性标记片段鉴定 Fig. 6 Phenotype of transformants and identification of hygromycin resistance marker (HPH) fragments |

|
| 图 7 广东虫草锌指结构转录因子CgPro1敲除片段构建 Fig. 7 Construction of knockout fragment of zinc finger structure transcription factor CgPro1 of Cordyceps guangdongensis |

|
| WT: 野生型;KO: 缺失突变株;HS:杂合子(CgPro1基因和潮霉素标记同时存在) WT: Wild type; KO: Knockout mutant strain; HS: Heterozygote (both of CgPro1 and Hygromycin fragments are presented) 图 8 广东虫草锌指结构转录因子CgPro1敲除突变株表型分析 Fig. 8 Phenotypic analysis of zinc finger transcription factor CgPro1 knockout mutants of Cordyceps guangdongensis |
3 讨论
原生质体的制备在多种食药用真菌中得到了广泛研究[33-34],但不同真菌原生质体制备所用酶类、酶解温度、时间等均存在差异。在虫草真菌中,不同物种原生质体制备的最佳酶类组合也有所不同。如在冬虫夏草中,采用2% 溶壁酶和1% 蜗牛酶组合于32 ℃条件下酶解2 h可获得较多的原生质体[35];采用4 mg/mL和3 mg/mL的Yatalase和Glucanex酶组合酶解3 h也可以获得较多的冬虫夏草原生质体[36-37];采用0.5% 的裂解酶于30 ℃条件下酶解2 h可获得质量较好的原生质体[38]。在蛹虫草中,1% 的蜗牛酶和0.5% 的纤维素酶组合于35 ℃条件下酶解3 h[39]、或1.5% 的蜗牛酶和1.5 % 的溶壁酶组合于34 ℃条件下酶解4 h可获得较多的原生质体[40]。采用2.06% 的溶壁酶于26.1 ℃条件下对单核蛹虫草芽生孢子酶解2.57 h以及2.5% 的溶壁酶于24 ℃条件下对蛹虫草芽生孢子酶解2.5 h均可获得数量较多的原生质体[41];高雄山虫草的无性型细脚拟青霉细胞壁用1 % 的溶壁酶在30 ℃条件下酶解2.5 h可获得较多原生质体[42];而古尼虫草小孢变种上分离的无性型古尼拟青霉小孢变种原生质体产量较高的细胞壁消化条件为0.5% 的溶壁酶和0.5 % 的蜗牛酶的混合酶液于28 ℃条件下酶解时间1.5~2 h[43]。由本研究结果也可明显看出,酶的种类、酶解温度、及酶解时间显著影响广东虫草原生质体的释放和数量,广东虫草中原生质体得量最多的细胞壁消化条件为1∶1的裂解酶和崩溃酶组合于28 ℃条件下酶解5.5 h。上述差异现象说明真菌原生质体的制备不仅与真菌细胞壁结果和组成有关,也与所用酶的来源有关,不同真菌制备的酶,其活力也存在差异。真菌细胞壁的组分较为复杂,不同真菌细胞壁的结构和组分均存在差异[44],因此原生质体制备的最佳酶类组合也有所不同。影响原生质制备的关键因素是细胞壁溶解酶,活性好且适宜的酶可使菌丝细胞壁降解更充分、释放出更多的原生质体。本研究中,采用裂解酶和崩溃酶的组合对广东虫草菌丝酶解的效果最佳,获得的原生质体数量最多,且菌丝裂解最完全,这可能与广东虫草细胞壁成分有关。崩溃酶是一类含有昆布多糖酶、木聚糖酶及纤维素酶的复合酶,广泛应用于多种植物病原真菌的原生质体制备[45];而来自哈茨木霉的裂解酶则具有蛋白酶、几丁质酶及纤维素酶等活性,在子囊菌的原生质体制备中效果较好[46]。
酶解时间和酶解温度都是影响原生质体释放的因素。酶解时间不足时原生质体得不到充分释放,而酶解过久则会使已裂解出来的原生质体破裂,影响其质量及数量。一般而言,真菌菌丝在一定酶解时间内,原生质体数量会随着时间的延长而增加,但随着反应时间的延长,分离的原生质体数量转为缓慢增加,在达到一定时间后其数量开始下降[36]。酶解时间因真菌而异,在试验中发现广东虫草原生质体的酶解时间比许多真菌都要长,甚至在22.5 h后依然有继续增加,而且其形态保持完好。酶解温度可以直接影响到酶促反应的速度,真菌脱壁酶的温度一般在24~35 ℃之间[47],而广东虫草菌丝的最佳酶解温度为28 ℃,此时脱壁最快。原生质体的再生与原生质体的制备同样重要,需要寻找合适的再生培养基。原生质体由于缺乏细胞壁的支撑显得相当脆弱,高渗的复苏培养基有助于维持质膜系统渗透压,对原生质体起保护作用[4]。而不同真菌原生质体所适合的复苏培养基也有所差异。通常情况下,学者很少对再生培养基进行筛选,多用常规培养基或改良的常规培养基作为再生培养基,如冬虫夏草中所用的再生培养基为常规培养基添加不同的渗稳剂[35];蛹虫草常使用PDA培养基作为再生培养基[40]等。陈晓琳等[43]对古尼虫草小孢变种上分离的无性型古尼拟青霉小孢变种原生质体在0.6 mol/L氯化钠的SDAY培养基上再生率最高。本研究比较了培养基对广东虫草原生质体再生的影响,结果显示高渗的TB3培养基效果最佳,其次为高渗的0.6 mol/mL-KCl PDA培养基。由此可见,原生质体的再生不仅与培养基营养有关,同时还与培养基中的渗透稳定剂有关。
PEG介导的原生质体转化广泛应用于真菌中,但在虫草真菌中应用相对较少。PEG介导的原生质体转化过程大致相同,只是不同的真菌所用的渗透稳定剂、PEG规格、再生培养基类型、抗性标记及浓度有所差异。如蛹虫草常用甘露醇作为渗透稳定剂[40],而本研究中广东虫草采用KC溶液作为渗透稳定剂;真菌中常采用PEG4000作为转化媒介,而少数真菌中也有采用PEG8000作为转化媒介的[48]。不同真菌对抗生素的抗性存在显著差异,抗性标记的选择对于遗传转化过程中转化子的筛选至关重要。目前虫草真菌中常用的抗性标记可分为药物抗性筛选和营养缺陷型筛选,本研究采用的是药物抗性筛选中的潮霉素抗性筛选。潮霉素磷酸转移酶基因产物的作用底物潮霉素B(Hygromycin B),是一种氨基糖苷类抗生素,可通过破坏核糖体的功能,导致基因的翻译受阻,使蛋白质合成受到抑制,而潮霉素磷酸转移酶可使受体菌产生潮霉素抗性,使转化子能正常生长。多数真菌对潮霉素B有更高的敏感性,在浓度50~400 μg/mL的范围内可以抑制大多数真核微生物的生长[49]。但不同真菌对潮霉素的抗性能力存在差异,如蛹虫草对潮霉素的抗性能力较强,通常采用650 mg/L的浓度进行筛选[40],而本研究结果显示广东虫草对潮霉素的抗性能力较弱,培养基中添加250 mg/L潮霉素时,再生原生质体不能正常生长。
4 结论本研究建立和优化了珍稀虫草真菌广东虫草的原生质体制备及PEG介导的转化方法。广东虫草菌丝在裂解酶+ 崩溃酶(1∶1)中酶解效果最佳、获得原生质体数量最多,酶解时间为5.5 h时原生质体数量增长最多,但随后仍有增加;广东虫草原生质体最佳酶解温度为28 ℃、最佳复苏培养基为TB3、潮霉素抗性浓度为250 μg/mL。转化过程中所用亚精胺浓度为5 mmol/L、加入PEG4000的间隔时间为10 min、TB3再生培养基添加潮霉素抗性标记上层板的间隔时间为3 d时,转化子筛选效率最高。通过该转化系统,成功获得广东虫草中锌指半胱氨酸转录因子CgPro1的敲除突变株及杂合子,并通过与野生型菌株比较,发现CgPro1参与广东虫草子实体发育过程。
| [1] |
李亚娇, 孙国琴, 郭九峰, 王海燕, 于传宗, 庞杰. 原生质体融合技术在食用菌上应用研究进展[J]. 北方农业学报, 2021, 49(6): 121-127. DOI:10.12190/j.issn.2096-1197.2021.06.16 LI Y J, SUN G Q, GUO J F, WANG H Y, YU C Z, PANG J. Research progress on the protoplast fusion technique in edible mushroom[J]. Journal of Northern Agriculture, 2021, 49(6): 121-127. DOI:10.12190/j.issn.2096-1197.2021.06.16 |
| [2] |
唐梦瑜, 么越, 荣丹, 姜明. 食用菌育种技术的研究进展[J]. 中国食用菌, 2022, 41(8): 1-6. DOI:10.13629/j.cnki.53-1054.2022.08.001 TANG M Y, YAO Y, RONG D, JIANG M. Research progress of edible fungi breeding technology[J]. Edible of Fungi, 2022, 41(8): 1-6. DOI:10.13629/j.cnki.53-1054.2022.08.001 |
| [3] |
夏会楠, 李东晓, 赵玉阳, 王春霞, 郑素月, 郭金英. 原生质体融合技术在食用菌遗传育种中的应用概述[J]. 食用菌, 2023, 45(6): 1-3. XIA H N, LI D X, ZHAO Y Y, WANG C X, ZHENG S Y, GUO J Y. Overview of application of protoplast fusion technology in genetic breeding of edible fungi[J]. Edible Fungi, 2023, 45(6): 1-3. |
| [4] |
沈慧敏, 李超, 高利, 刘太国, 刘博陈, 万权. 原生质体法介导真菌遗传转化的研究进展[J]. 植物保护, 2017, 43(2): 25-28. DOI:10.3969/j.issn.0529-1542.2017.02.004 SHEN H M, LI C, GAO L, LIU T G, LIU B C, WAN Q. Research progress in transformation of fungi mediated by protoplasts[J]. Plant Protection, 2017, 43(2): 25-28. DOI:10.3969/j.issn.0529-1542.2017.02.004 |
| [5] |
覃启剑, 房文霞. 真菌感染防控及真菌细胞壁靶标的研究进展[J]. 广西科学院学报, 2023, 39(3): 213-222. DOI:10.13657/j.cnki.gxkxyxb.20230829.001 TAN Q J, FANG W X. Research porgress in peventionand cntrolof fungal infections and fungal cell wall tragets[J]. Journal of Guangxi Academy of Sciences, 2023, 39(3): 213-222. DOI:10.13657/j.cnki.gxkxyxb.20230829.001 |
| [6] |
王越, 李雅凝, 曲晓磊, 王旭彤. 丝状真菌遗传转化体系及筛选技术的研究进展[J]. 中国林副特产, 2020(6): 69-75. DOI:10.13268/j.cnki.fbsic.2020.06.028 WANG Y, LI Y N, QU X L, WANG X T. The research progress on genetic transformation system and screening techniques of filamentous fungi[J]. Forest By-Product and Speciality in China, 2020(6): 69-75. DOI:10.13268/j.cnki.fbsic.2020.06.028 |
| [7] |
何丽云, 张树林, 崔百元, 朱庆峰, 刘圣杰, 刘文华. 根癌农杆菌介导的遗传转化及其在稻瘟病菌中的应用[J]. 广东农业科学, 2019, 46(3): 93-100. DOI:10.16768/j.issn.1004-874X.2019.03.014 HE L Y, ZHANG S L, CUI B Y, ZHU Q F, LIU S J, LIU W H. Application of Ag robacterium tumefaciens -mediated transformation in Magnaporthe or yzae[J]. Guangdong Agricultural Sciences, 2019, 46(3): 93-100. DOI:10.16768/j.issn.1004-874X.2019.03.014 |
| [8] |
王立平, 何展泳, 年海, 王宏杰, 马启彬. 大豆遗传转化方法及再生体系研究进展[J]. 广东农业科学, 2020, 47(3): 16-27. DOI:10.16768/j.issn.1004-874X.2020.03.003 WANG L P, HE A Y, NIAN H, WANG H J, MA Q B. Research progress in genetic transformation and regeneration system of Soybean[J]. Guangdong Agricultural Sciences, 2020, 47(3): 16-27. DOI:10.16768/j.issn.1004-874X.2020.03.003 |
| [9] |
JIANG K Q, HAN R C. Rhf1 gene is involved in the fruiting body production of Cordyceps militaris fungus[J]. Journal of Industrial Microbiology and Biotechnology, 2015, 42(8): 1183-1196. DOI:10.1007/s10295-015-1637-2 |
| [10] |
NAI Y S, LEE M R, KIM S, LEE S J, KIM J C, YANG Y T, KIM J S. Relationship between expression level of hygromycin B-resistant gene and Agrobacterium tumefaciens-mediated transformation efficiency in Beauveria bassiana JEF-007[J]. Journal of Applied Microbiology, 2017, 123(3): 724-731. DOI:10.1111/jam.13529 |
| [11] |
XIE X Y, WANG Y L, JIN S X, HE L L, JIA Z F, HUANG B. MrCreC, a carbon catabolite repression gene, is required for the growth, conidiation, stress tolerance and virulence of Metarhizium robertsii[J]. Journal of Invertebrate Pathology, 2023, 201: 108009. DOI:10.1016/j.jip.2023.108009 |
| [12] |
LIU G Q, LI C, RAO Z C, QIU X H, HAN R C. Identification of the genes involved in growth characters of medicinal fungus Ophiocordyceps sinensis based on Agrobacterium tumefaciens-mediated transfor mation[J]. Applied Microbiolog y and Biotechnology, 2020, 104(6): 2663-2674. DOI:10.1007/s00253-020-10417-1 |
| [13] |
闫培生, 李桂舫, 罗信昌, 周启. 外源抗药性基因导入香菇体内的研究[J]. 食用菌学报, 2002, 9(1): 6-9. DOI:10.16488/j.cnki.1005-9873.2002.01.002 YAN P S, LI G F, LUO X C, ZHOU Q. Introduction of foreign drug-resistant gene into Lentinula edodes[J]. Acta Edulis Fungi, 2002, 9(1): 6-9. DOI:10.16488/j.cnki.1005-9873.2002.01.002 |
| [14] |
鲍大鹏, 杨瑞恒, 王莹, 茅文俊, 汪莹, 李燕. 运用萎锈灵抗性基因构建香菇聚乙二醇介导的遗传转化方法[J]. 微生物学通报, 2018, 45(8): 1824-1828. DOI:10.13344/j.microbiol.china.170861 BAO D P, YANG R H, WANG Y, MAO W J, WANG Y, LI Y. PEG-mediated genetic transformation of Lentinula edodes by using carboxin resistant gene as selective marker[J]. Microbiology China, 2018, 45(08): 1824-1828. DOI:10.13344/j.microbiol.china.170861 |
| [15] |
李刚, 王强, 刘秋云, 李宝健. 利用PEG法建立药用真菌灵芝的转化系统[J]. 菌物学报, 2004, 23(2): 255-261. DOI:10.13346/j.mycosystema.2004.02.016 LI G, WANG Q, LIU Q Y, LI B J. Establishment of a transformation system of Ganoderma lucidum using PEG method[J]. Mycosystema, 2004, 23(2): 255-261. DOI:10.13346/j.mycosystema.2004.02.016 |
| [16] |
郭丽琼, 刘二鲜, 王杰, 林俊芳. 高效银耳芽孢遗传转化体系的建立[J]. 中国农业科学, 2008, 41(11): 3728-3734. DOI:10.3864/j.issn.0578-1752.2008.11.038 GUO L Q, LIU E X, WANG J, LIN J F. Development of highly efficient genetic transformation system of yeast-like conidia of Tremella fuciformis[J]. Scientia Agricultura Sinica, 2008, 41(11): 3728-3734. DOI:10.3864/j.issn.0578-1752.2008.11.038 |
| [17] |
蔡昌杨, 王文佳, 卢园萍, 陈美元, 蔡志欣, 朱强. 一种有效的双孢蘑菇原生质体制备及瞬时转化体系[J]. 菌物学报, 2020, 39(7): 1339-1345. DOI:10.13346/j.mycosystema.190444 CAI C Y, WANG W J, LU Y P, CHEN M Y, CAI Z X, ZHU Q. An effective protoplast preparation and transient transformation system of Agaricus bisporus[J]. Mycosystema, 2020, 39(7): 1339-1345. DOI:10.13346/j.mycosystema.190444 |
| [18] |
陶南, 崔祥华, 柴红梅, 马渊浩, 赵永昌, 陈卫民. PEG介导的柱状田头菇遗传转化体系建立[J]. 菌物学报, 2020, 39(6): 1100-1108. DOI:10.13346/j.mycosystema.200068 TAO N, CUI X H, CHAI H M, MA Y H, ZHAO Y C, CHEN W M. Establishment of genetic transformation system of Agrocybe aegerita using PEG-mediated method[J]. Mycosystema, 2020, 39(6): 1100-1108. DOI:10.13346/j.mycosystema.200068 |
| [19] |
邹优花, 连玲丹, 钟武杰, 杜敏如, 黄颖茵, 王杰. 杏鲍菇原生质体制备、再生及其遗传转化体系的建立[J]. 食品研究与开发, 2023, 44(21): 138-144. DOI:10.12161/j.issn.1005-6521.2023.21.019 ZOU Y H, LIAN L D, ZHONG W J, DU M R, HUANG Y Y, WANG J. Preparation and regeneration of protoplasts of Pleurotus eryngii and establishment of its genetic transformation system[J]. Food Research and Development, 2023, 44(21): 138-144. DOI:10.12161/j.issn.1005-6521.2023.21.019 |
| [20] |
伍土恒. 冷诱导金针菇子实体发育相关基因分析及CRISPR-Cas9突变技术体系的建立[D]. 广州: 华南农业大学, 2019. WU T H. Analysis of genes associated with cold-induced fruiting in Flammulina velutipes and genome editing using CRISPR-Cas9[D]. Guangzhou: South China Agricultural University, 2019. |
| [21] |
WANG W X, WANG Y H, DONG G P, CHEN F M. Development of Cordyceps javanica BE01 with enhanced virulence against Hyphantria cunea using polyethylene glycol-mediated protoplast transformation[J]. Frontiers in Microbiology, 2022, 13: 972425. DOI:10.3389/fmicb.2022.972425 |
| [22] |
LOU H W, YE Z W, YUN F, LIN J F, GUO L Q, CHEN B X, MU Z X. Targeted gene deletion in Cordyceps militaris using the split-marker approach[J]. Molecular biotechnology, 2018, 60(5): 380-385. DOI:10.1007/s12033-018-0080-9 |
| [23] |
郝转, 张成花, 黄秋菊, 黄浩, 李泰辉, 王刚正, 邓旺秋. RNAi法分析广东虫草热激蛋白40 CgDnaJ05基因功能[J]. 菌物学报, 2022, 41(11): 1786-1795. DOI:10.13346/j.mycosystema.220308 HAO Z, ZHANG C H, HUANG Q J, HUANG H, LI T H, WANG G Z, DENG W Q. Function of the heat shock protein 40 gene CgDnaJ05 in Cordyceps guangdongensis analysed by RNAi[J]. Mycosystema, 2022, 41(11): 1786-1795. DOI:10.13346/j.mycosystema.220308 |
| [24] |
曾宏彬, 李泰辉, 宋斌, 林群英, 黄浩. 广东虫草抗氧化活性的研究[J]. 天然产物研究与开发, 2009, 21(5): 201-204. ZENG H B, LI T H, SONG B, LIN Q Y, HUANG H. Study on antioxidant activity of Cordyceps guangdongensis[J]. Natural Product Research and Development, 2009, 21(5): 201-204. |
| [25] |
闫文娟, 李泰辉, 姜子德. 广东虫草对腺嘌呤诱导的慢性肾衰竭大鼠的治疗作用[J]. 菌物学报, 2012, 31(3): 432-442. DOI:10.13346/j.mycosystema.2012.03.017 YAN W J, LI T H, JIANG Z D. Therapeutic effects of Cordyceps guangdongensis on chronic renal failure rats induced by adenine[J]. Mycosystema, 2012, 31(3): 432-442. DOI:10.13346/j.mycosystema.2012.03.017 |
| [26] |
YAN W J, LI T H, ZHONG Z Y. Anti-inflammatory effect of a novel food Cordyceps guangdongensis on experimental rats with chronic bronchitis induced by tobacco smoking[J]. Food and Function, 2014, 5(10): 2552-2557. DOI:10.1039/c4fo00294f |
| [27] |
闫文娟, 李泰辉, 姜子德. 广东虫草抗疲劳及延寿作用的研究[J]. 食品研究与开发, 2011, 32(3): 164-167. DOI:10.3969/j.issn.1005-6521.2011.03.047 YAN W J, LI T H, JIANG Z D. Anti-fatigue and life-prolonging effects of Cordyceps Guangdongensis[J]. Food Research and Development, 2011, 32(3): 164-167. DOI:10.3969/j.issn.1005-6521.2011.03.047 |
| [28] |
闫文娟, 李泰辉, 姜子德. 广东虫草抗禽流感病毒的初步研究[J]. 食用菌学报, 2010, 17(3): 64-66. DOI:10.16488/j.cnki.1005-9873.2010.03.019 YAN W J, LI T H, JIANG Z D. Antiviral activity of Cordyceps guangdongensis against inf luenza virus infections in mice[J]. Acta Edulis Fungi, 2010, 17(3): 64-66. DOI:10.16488/j.cnki.1005-9873.2010.03.019 |
| [29] |
孙程远, 王刚正, 张成花, 黄秋菊, 黄浩, 李泰辉, 习平根, 邓旺秋. 广东虫草子实体乙醇提取物对高脂饮食诱导小鼠肥胖指标及肠道菌群的影响[J]. 食用菌学报, 2022, 29(2): 73-83. DOI:10.16488/j.cnki.1005-9873.2022.02.009 SUN C Y, WANG G Z, ZHANG C H, HUANG Q J, HUANG H, LI T H, XI P G, DENG W Q. Effects of Cordyceps guangdongensis fruiting body ethanol extract on obesity-related indices and gut microbiota in high-fat diet fed mice[J]. Acta Edulis Fungi, 2022, 29(2): 73-83. DOI:10.16488/j.cnki.1005-9873.2022.02.009 |
| [30] |
WANG G Z, SUN C Y, XIE B J, WANG T, LIU H W, CHEN X L, HUANG Q J, ZHANG C H, LI T H, DENG W Q. Cordyceps guangdongensis lipid-lowering formula alleviates fat and lipid accumulation by modulating gut microbiota and short-chain fatty acids in high-fat diet mice[J]. Frontiers in Nutrition, 2022, 9: 1038740. DOI:10.3389/fnut.2022.1038740 |
| [31] |
林群英, 李泰辉, 黄浩, 宋斌. 广东虫草人工栽培的光温条件研究[J]. 华南农业大学学报, 2009, 30(1): 42-45. LIN Q Y, LI T H, HUANG H, SONG B. Studies on light and temperature conditions for cultivation of Cordyceps guangdongensis[J]. Journal of South China Agricultural University, 2009, 30(1): 42-45. |
| [32] |
LIN Q Y, SONG B, HUANG H, LI T H. Optimization of selected cultivation parameters for Cordyceps guangdongensis[J]. Letters in Applied Microbiology, 2010, 51(2): 219-225. DOI:10.1111/j.1472-765X.2010.02881.x |
| [33] |
许琳, 刘洋, 张雪超, 胡清秀, 闫梅霞. 2种灵芝原生质体制备及再生条件优化[J/OL]. 吉林农业大学学报: 1-10[2024-01-26]. DOI: 10.13327/j.jjlau.2021.1920. XU L, LIU Y, ZHANG X C, HU Q X, YAN M X. Optimization of preparation and regeneration conditions of two kinds of Ganoderma lucidum protoplasts[J]. Journal of Jilin Agricultural University: 1-10[2024-01-26]. DOI: 10.13327/j.jjlau.2021.1920. |
| [34] |
骈永茹, 李婧怡, 李勤奋, 王欢, 李玉, 杨阳. 巨大侧耳原生质体制备条件的优化[J]. 广西植物, 2023, 43(7): 1308-1316. DOI:10.11931/guihaia.gxzw202207046 PIAN Y R, LI J Y, LI Q F, WANG H, LI Y, YANG Y. Optimization of protoplast preparation conditions of Pleurotus giganteus[J]. Guihaia, 2023, 43(7): 1308-1316. DOI:10.11931/guihaia.gxzw202207046 |
| [35] |
郭成金, 赵润. 冬虫夏草原生质体制备与再生条件的研究[J]. 食品科学, 2009, 30(5): 166-170. DOI:10.3321/j.issn:1002-6630.2009.05.038 GUO J C, ZHAO R. Study on protoplast preparation and regeneration of Cordyceps sinensis[J]. Food Science, 2009, 30(5): 166-170. DOI:10.3321/j.issn:1002-6630.2009.05.038 |
| [36] |
肖岩岩. 冬虫夏草无性型原生质体制备及种群遗传多样性研究[D]. 合肥: 安徽农业大学, 2011. XIAO Y Y. Studies on protoplast preparation and genetic diversity of populations of the anamorph of Ophiocordyceps sinensis[D]. Hefei: Anhui Agricultural University, 2011. |
| [37] |
潘丹丹, 肖岩岩, 陈超, 张磊, 李春如. 冬虫夏草无性型菌丝体的原生质体制备条件研究[J]. 安徽农业大学学报, 2012, 39(5): 793-797. DOI:10.13610/j.cnki.1672-352x.2012.05.015 PAN D D, XIAO Y Y, CHEN C, ZHANG L, LI C R. Conditions for protoplast preparation of Ophiocordyceps sinensis[J]. Journal of Anhui Agricultural University, 2012, 39(5): 793-797. DOI:10.13610/j.cnki.1672-352x.2012.05.015 |
| [38] |
JIN L Q, XU Z W, MEN X H, ZHANG B, LIU Z Q, ZHENG Y G. Enhancement of protoplast preparation and regeneration of Hirsutella sinensis based on process optimization[J]. Biotechnology Letters, 2020, 42(11): 2357-2366. DOI:10.1007/s10529-020-02958-2 |
| [39] |
陈宏伟, 陈安徽, 王陶, 邵颖. 蛹虫草无性型原生质体制备条件的研究[J]. 徐州工程学院学报(自然科学版), 2008, 23(4): 22-26. CHEN H W, CHEN A H, WANG T, SHAO Y. Preparation conditions of protoplast of anamorphic strains of Cordyceps militaris[J]. Journal of Xuzhou Institute of Technology (Natural Sciences), 2008, 23(4): 22-26. |
| [40] |
孙丹, 张敏, 解长睿, 郭晓威, 徐赫韩, 高红桃, 李晓薇, 孙天旭, 李海燕. PEG法介导蛹虫草遗传转化体系的建立[J]. 中国生物工程杂志, 2017, 37(4): 76-82. DOI:10.13523/j.cb.20170410 SUN A, ZHANG M, XIE C R, GUO X W, XU H H, GAO H T, LI X W, SUN T X, LI H Y. Establishment of genetic transformation system of Cordyceps militaris using PEG mediated method[J]. China Biotechnology, 2017, 37(4): 76-82. DOI:10.13523/j.cb.20170410 |
| [41] |
娄海伟, 余颖豪, 林俊芳, 郭丽琼, 叶志伟, 李艳, 魏韬, 云帆. 基于蛹虫草单核芽生孢子的原生质体制备条件的优化[J]. 中国食品学报, 2020, 20(6): 129-136. DOI:10.16429/j.1009-7848.2020.06.016 LOU H W, YU Y H, LIN J F, GUO L Q, YE Z W, LI Y, WEI T, YUN F. Optimization of the preparation conditions of protoplasts from mononuclear blastospores of Cordyceps militaris[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(6): 129-136. DOI:10.16429/j.1009-7848.2020.06.016 |
| [42] |
PU S C, LI C R, WANG X Y, HUANG B. Preparation of protoplast from Paecilomyces tenuipes, the anamorph of Cordyceps takaomontana[J]. Journal of Anhui Agricultural University, 2008, 35(3): 421-425. DOI:10.13610/j.cnki.1672-352x.2008.03.009 |
| [43] |
陈晓琳, 樊美珍, 李增智. 古尼虫草小孢变种无性型原生质体制备及再生条件的研究[J]. 菌物学报, 2005, 24(4): 63-68. DOI:10.13346/j.mycosystema.2005.04.010 CHEN X L, FAN M Z, LI Z Z. Preparation and regeneration of protoplasts of Paecilomyces gunnii var. Minor[J]. Mycosystema, 2005, 24(4): 63-68. DOI:10.13346/j.mycosystema.2005.04.010 |
| [44] |
韦明肯, 赖洁玲, 詹萍, 何盛斌, 门杏花. 蜗牛酶高效制备白色念珠菌原生质体的研究[J]. 广东农业科学, 2012, 39(9): 99-102. DOI:10.16768/j.issn.1004-874X.2012.09.004 WEI M K, LAI J L, ZHAN P, HE S B, MEN X H. Preparing high quality protoplast of Candida albicans by snailase[J]. Guangdong Agricultural Sciences, 2012, 39(9): 99-102. DOI:10.16768/j.issn.1004-874X.2012.09.004 |
| [45] |
陈孝仁, 王源超, 张正光, 郑小波. 大豆疫霉菌原生质体制备及再生菌株的生物学性状[J]. 南京农业大学学报, 2005, 28(4): 45-49. CHEN X R, WANG Y C, ZHANG Z G, ZHENG X B. Protoplast preparation of Phytophthora sojae and biologicalcharacterization of regenerated cells[J]. Journal of Nanjing Agricultural University, 2005, 28(4): 45-49. |
| [46] |
张颖, 王刚, 王美南. 小麦全蚀病菌原生质体制备的条件及再生菌株的致病性[J]. 微生物学杂志, 2005, 25(5): 29-32. ZHANG Y, WANG G, WANG M N. Protoplast preparation conditions and pathogenicity of regenerated strains of Gaeumannomyces graminis var. Tritici[J]. Journal of Microbiology, 2005, 25(5): 29-32. |
| [47] |
宋爱环, 李红叶, 刘小红. 指状青霉(Penicillium digitatum) 原生质体制备和再生条件[J]. 农业生物技术学报, 2004, 12(2): 197-201. SONG A H, LI H Y, LIU X H. Protoplast isolation and regeneration in Penicillium digitatum[J]. Journal of Agricultural Biotechnology, 2004, 12(2): 197-201. |
| [48] |
韩小路, 白静科, 张玮, 张荣, 孙广宇. PEG介导的苹果果生刺盘孢Colletotrichum fructicola原生质体转化[J]. 西北农业学报, 2016, 25(3): 442-449. DOI:10.7606/j.issn.1004-1389.2016.03.017 HAN X L, BAI J K, ZHANG W, ZHANG R, SUN G Y. PEG-mediated transformation of Colletotrichum fructicola[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2016, 25(3): 442-449. DOI:10.7606/j.issn.1004-1389.2016.03.017 |
| [49] |
BLOCHLINGER K, DIGGELMANN H. Hygromycin B phosphotransferase as a selectable marker for DNA transfer experiments with higher eucaryotic cells[J]. Molecular and Cellular Biology, 1984, 4(12): 2929-2931. DOI:10.1128/mcb.4.12.2929-2931.1984 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51





