文章信息
基金项目
- 广州市科技计划项目(2023A04J0137);国家自然科学基金(32102333);广东省荔枝产业技术体系项目(2023-JK107-1);国家园艺种质资源库运行服务项目(NHGRC2023-NH17)
作者简介
- 史发超(1988—),男,博士,助理研究员,研究方向为荔枝遗传育种,E-mail:shifachao@126.com.
通讯作者
- 陈洁珍(1968—),女,硕士,副研究员,研究方向为荔枝资源收集及评价,E-mail:chenjiezhen@gdaas.cn.
文章历史
- 收稿日期:2023-10-12
【研究意义】荔枝(Litchi chinensis Sonn.),为无患子科、热带亚热带常绿乔木,在我国已有2 000多年栽培历史[1]。荔枝汁液丰富,果肉含有丰富的糖类、有机酸、维生素、胡萝卜素、蛋白质和微量元素等营养成分,具有良好的营养价值和保健功能[2-3]。广东荔枝每年于6—8月集中上市,成熟时期气温高、湿度大,导致其呼吸强度大,采后易褐变腐烂,极易造成烂果。荔枝烂果量占年产量的20% 以上,严重影响荔枝产业健康发展[4-5]。内生菌在植物生长过程中直接或间接发挥生物学作用,探究不同品种荔枝果肉中内生细菌的组成及结构,挖掘优异的荔枝内生菌种资源,对研究荔枝与内生细菌的互作关系及采后延长保鲜功能菌株的开发具有重要意义。【前人研究进展】植物内生菌是指能在植物各组织器官内不引起明显病害症状且与植物形成动态平衡共生关系的微生物类群,通常指内生细菌或内生真菌[6-8]。几乎所有植物都有内生菌[9],随着测序技术的发展,通过对内生菌基因的可变区域进行高通量测序,无需内生菌分离培养过程,即可全面分析植物各组织器官中微生物的组成和多样性[10]。内生菌在植物生长发育过程中发挥各种生物学作用。在促进养分吸收方面,内生菌具有固氮效果[11-12];在植物保护方面,内生菌可以拮抗病原菌并分泌代谢物诱导植物提高抗病性[13];在促生方面,内生菌可分泌生长素,促进植物生长[14]、调节开花时间[15];在非生物胁迫方面,内生菌可提高植物对重金属、除草剂等胁迫的耐受程度[16-18]。不同物种的植物之间内生菌群不同,同一物种植物种内内生菌群也存在差异,高通量测序比较发现5个不同品种南瓜内生细菌菌群结构组成相似,但丰度占比不同,品质优良的南瓜品种具有优势内生菌属[19],相似的结果也在谷子[20]、桑树[21]、火棘[22]、苹果[23]、梨[24] 等相关研究中发现。
【本研究切入点】目前针对不同作物内生细菌多样性与群落结构特征均有研究报道[19-24],而有关荔枝果肉内生细菌群落结构的研究鲜有报道。本研究以荔枝果肉内生细菌为研究对象,以探究不同品种荔枝果肉内生细菌菌群组成及差异为目的,分析不同品种荔枝果肉内生细菌多样性及群落结构特征。【拟解决的关键问题】以6个荔枝品种的新鲜果肉为材料,通过高通量测序,明确不同品种荔枝果肉内生细菌在门、科、属、种分类水平上的群落组成及差异,挖掘优异的内生细菌资源,可为建立荔枝果实微生物信息系统提供数据支撑,为荔枝果实品质提升工作中内生菌的开发利用提供理论基础和重要参考。
1 材料与方法 1.1 试验材料供试6个荔枝品种为‘观音绿’(GYL)、‘义桥蜜荔’(YQML)、‘糯米糍’(NMC)、‘妃子笑’(FZX)、‘岭腰1号’(YL)、‘鹅蛋荔’(EDL),种植于国家荔枝香蕉种质资源圃(广州)(23°09′N、113°22′E),海拔20 m,海洋性亚热带季风气候,年平均气温约21 ℃,年平均降水量1 761.7 mm。果园呈微丘陵地势,土肥水管理一致,树龄15年,生长状况良好。2023年,每个品种随机选取3株树(分别记为1、2、3),在果实成熟时,每株树选取长势一致、无病虫害、无机械损伤的果实各20个,用无菌水冲洗荔枝果壳表面浮尘3次,取出果肉存入无菌管,液氮速冻后-80 ℃冰箱保存,用于果肉内生菌总DNA提取。
1.2 PCR扩增与高通量测序采用Qiagen DNeasy kit(QIAGENR, Hilden, Germany)提取荔枝果肉总DNA,使用通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA V3~V4区进行扩增测序。PCR反应体系为30 μL,反应程序为:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃延伸7 min。使用1% 琼脂糖凝胶电泳检测扩增目的条带大小、NanoDrop2000微量核酸分光光度计检测DNA浓度和纯度。使用Agencourt AMPure XP核酸纯化试剂盒(北京全式金生物技术股份有限公司)纯化DNA,最后利用Illumina公司Miseq PE300平台进行测序。委托上海派森诺生物科技有限公司完成高通量测序。
1.3 数据处理与分析高通量数据下机后,使用QIIME2中的DADA2通道进行数据过滤。首先切除序列的引物片段,弃去未匹配引物的序列;然后调用DADA2进行质控、去噪、拼接、去嵌合体,完成对所有文库的去噪后,合并ASV特征序列和ASV表格,去除序列总数仅为1的ASV,进行各个样本抽平[25];选取Greengenes数据库进行物种组成分析,调用最小抽平深度为10;最大抽平深度设为全体样本中最低测序深度样本序列量的95%,再在这一深度与最小深度之间均匀选取10个深度值,每个深度值抽平10次,进行Alpha多样性分析。选取平均丰度前20位的属的丰度数据绘制热图,进行样本间差异优势菌群分析。以上分析均在上海派森诺生物科技有限公司的基因云平台(www.genescloud.cn)进行。
2 结果与分析 2.1 高通量测序的序列有效性分析高通量测序共获得原始下机序列2 515 285条,经质控去除低质量及接头序列后,获得高质量序列2 135 259条;将所获得高质量序列经过抽平均一化处理后,共获得2 139 086条序列,序列的平均长度为376 bp(表 1)。不同品种荔枝果肉内生菌群落在不同分类水平上的组成如图 1所示,其中,FZX鉴定到的分类类群最多,YQML鉴定到的分类类群最少。
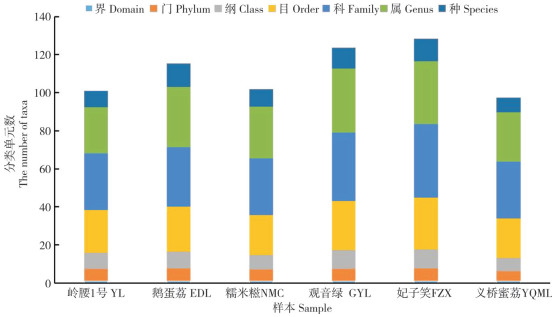
|
| 图 1 不同品种荔枝果肉内生菌ASV在不同分类水平上的统计不同品种荔枝果肉内生菌ASV在不同分类水平上的统计 Fig. 1 Statistics of endophytic bacteria ASV in pulp of different litchi varieties at different classification levels |
2.2 不同品种荔枝果肉内生细菌群落组成
2.2.1 基于门水平的不同品种荔枝果肉内生细菌组成结构 如图 2所示,在门水平上变形菌门(Proteobacteria)是6个样本中的绝对优势菌群,相对丰度达93.53%,其次为放线菌门(Actinobacteria,2.83%)和厚壁菌门(Firmicutes,2.03%)。变形菌门在样本NMC中的相对丰度最高、达95.69%,相对丰度依次为NMC>GYL>EDL>YQML>YL>FZX;放线菌门在FZX中相对丰度最高、达3.52%,相对丰度依次为FZX>YL>EDL>YQML>GYL>NMC。酸酐菌门(Acidobacteria)仅在YL、FZX和YQML果肉中检测到,相对丰度分别为0.31%、0.25%、0.29%。
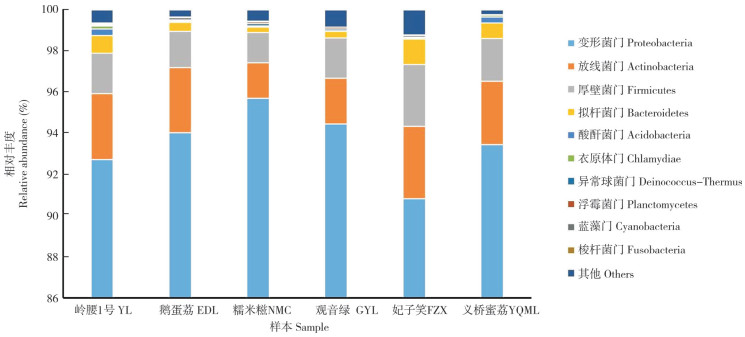
|
| 图 2 不同品种荔枝果肉中门水平的细菌组成 Fig. 2 Bacteria community composition in pulp of different litchi varieties at phylum level |
2.2.2 基于科水平的不同品种荔枝果肉内生细菌组成结构 基于科水平的不同品种荔枝果肉内生菌群变化如图 3所示,其中,相对丰度>1% 的科共7个,分别为无形小体科(Anaplasmataceae)、弧菌科(Vibrionaceae)、盐单胞菌科(Halomonadaceae)、产碱菌科(Alcaligenaceae)、布鲁氏菌科(Brucellaceae)、变形菌科(Pectobacteriaceae)、丙酸杆菌科(Propionibacteriaceae),相对丰度分别为54.39%、18.72%、5.88%、3.93%、3.59%、1.98%、1.92%。此外,产碱菌科在FZX果肉中相对丰度最大、达10.31%,在EDL相对丰度最小、仅为0.21%。丙酸杆菌科在YL果肉中相对丰度最大、达2.58%,变形菌科只在EDL、NMC和GYL果肉组织中检测到,相对丰度分别为3.80%、3.88%、4.02%。
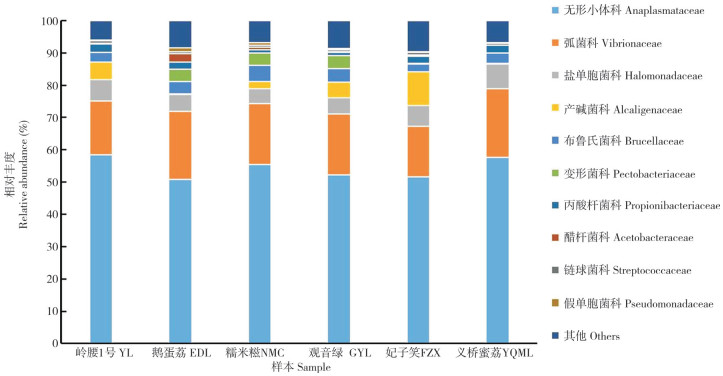
|
| 图 3 不同品种荔枝果肉中科水平的细菌组成 Fig. 3 Bacteria community composition in pulp of different litchi varieties at family level |
2.2.3 基于属水平的不同品种荔枝果肉内生细菌组成结构 如图 4所示,在属分类水平上,不同荔枝果肉组织中相对丰度前10的优势菌群分别为弧菌属(Vibrio)、盐单胞菌属(Halomonas)、苍白杆菌属(Ochrobactrum)、丙酸杆菌属(Cutibacterium)、共生菌属(Candidatus Portiera)、果胶杆菌属(Pectobacterium)、氏菌属(Brenneria)、博代氏杆菌(Bordetella)、链球菌属(Streptococcus)和假单胞菌属(Pseudomonas),相对丰度分别为18.50%、4.56%、3.53%、1.89%、1.21%、1.21%、0.63%、0.62%、0.60%、0.52%。在属水平上,不同品种荔枝果肉优势菌群差异不明显,其中共生菌属只在YL、FZX和YQML果肉组织中检测到,相对丰度分别为2.36%、2.69%、2.18%,果胶杆菌属和氏菌属只在EDL、NMC、GYL和FZX果肉组织中检测到。
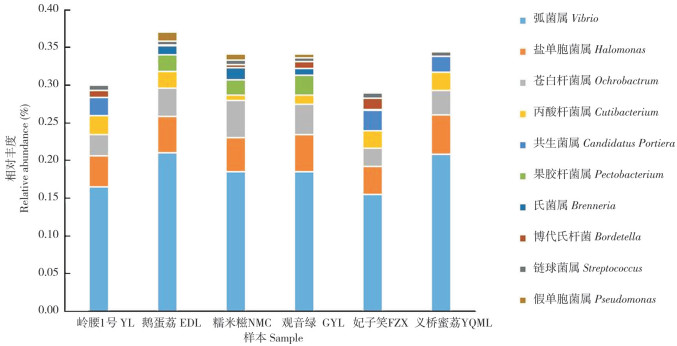
|
| 图 4 不同品种荔枝果肉中属水平的细菌组成 Fig. 4 Bacteria community composition in pulp of different litchi varieties at genus level |
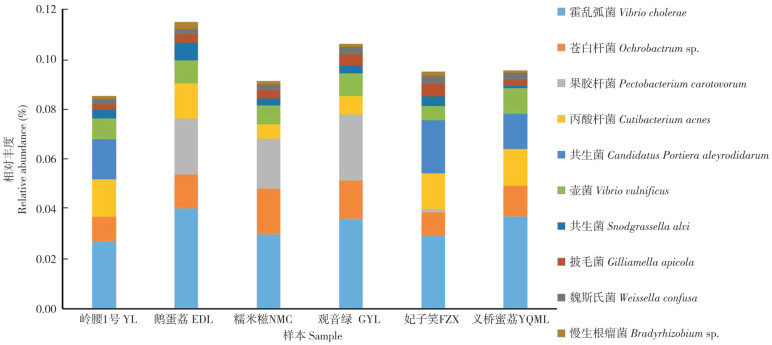
2.2.4 基于种水平的不同品种荔枝果肉内生细菌组成结构 不同品种荔枝果肉组织在种分类水平上丰度前10的优势菌群为霍乱弧菌(Vibrio cholerae)、苍白杆菌(Ochrobactrumsp.)、果胶杆菌(Pectobacterium carotovorum)、丙酸杆菌(Cutibacterium acnes)、共生菌Candidatus Portiera aleyrodidarum、创伤弧菌(Vibrio vulnificus)、共生菌Snodgrassella alvi、披毛菌(Gilliamella apicola)、魏斯杆菌(Weissella confusa)、慢生根瘤菌(Bradyrhizobium sp.),其相对丰度分别为3.31%、1.31%、1.18%、1.18%、0.86%、0.83%、0.36%、0.34%、0.27%、0.15%(图 5)。在种水平上,在EDL果肉组织中注释到的菌群相对丰度最大、达11.5%,YL果肉注释到的菌群相对丰度最小、为8.6%;果胶杆菌在YL和YQML果肉组织中的相对丰度基本为0,但在EDL、NMC和GYL果肉组织中相对丰度较高,分别达2.25%、2.02%、2.65%;共生菌Candidatus Portiera aleyrodidarum只在YL、FZX和YQML样本中检测到,相对丰度分别为1.62%、2.13%、1.42%。
|
| 图 5 不同荔枝种种水平荔枝样品中细菌组成 Fig. 5 Bacteria community composition in pulp of different litchi varieties at species level |
2.3 不同品种荔枝果肉组织显著差异菌群分析
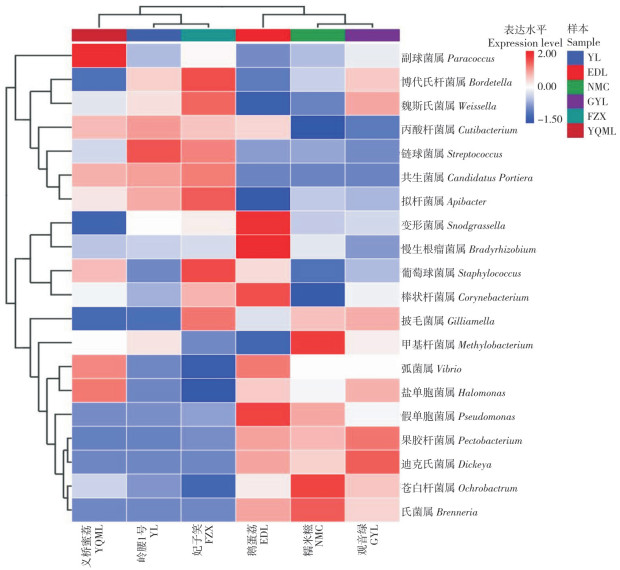
为进一步分析不同品种荔枝果肉中内生菌菌群的相似性和差异性,根据ASV平均丰度前20位属的数据进行聚类热图分析,结果(图 6)显示,EDL果肉组织中特异性积累慢性根瘤菌属(Bradyrhizobium)、变形菌属(Snodgrassella);YQML果肉组织中特异富集副球菌属(Paracoccus);假单胞菌属(Pseudomonas)、果胶杆菌属(Pectobacterium)、苍白杆菌属(Ochrobactrum)和迪基氏菌属(Dickeya)在EDL、NMC和GYL果肉组织中特异性积累;丙酸杆菌属(Cutibacterium)在YQML、YL、FZX和EDL果肉组织中显著积累;链球菌属(Streptococcus)和共生菌属(Candidatus portiera)在YQML、YL和FZX果肉组织中显著积累。根据果肉内生菌群积累种类和相对丰度聚类分析,NMC、GYL和EDL聚类在一起。
|
| 图 6 不同品种荔枝属水平差异菌群分析 Fig. 6 Analysis of differential bacterial community in different litchi varieties at genus level |
2.4 荔枝果肉内生细菌菌群Alpha多样性分析
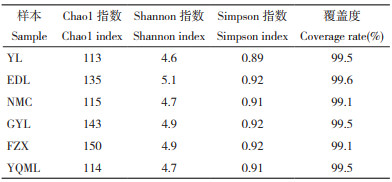
利用Alpha多样性分析评估不同品种荔枝果肉组织中内生细菌群落的丰富和多样性,其中Chao1指数为物种丰度指数,评估群落中的ASV数目;Shannon、Simpson指数评估物种多样性,其中Shannon指数越大,表明中物种的多样性越高,Simpson指数则相反。结果(表 2)显示,不同品种荔枝的果肉内生菌群在丰度和多样性上存在差异,其中EDL、GYL和FZX果肉组织内生细菌的丰度和多样性均高于其他3种荔枝,覆盖度均达到99% 以上,表明置信水平良好。
|
3 讨论
内生菌广泛存在于植物的各组织器官中,表现出丰富的物种多样性,并对植物的生长和健康起重要作用[26-27]。内生菌群落多样性由寄主植物的遗传背景和外部环境条件等因素共同决定[28]。同种作物不同品种间内生菌的菌群结构和相对丰度上存在差异,可能由品种间基因型的差异所致。本研究通过高通量测序技术,对6个不同品种荔枝果肉进行内生细菌菌群结构和多样性分析,发现不同分类水平的最优内生菌类型相同,但相对丰度存在差异。对不同栽培品种棉花内生细菌的研究发现,定殖其内部的内生细菌菌群结构有明显差异,是由遗传亲缘关系、外部形态等差异导致[29];对玉米亲本和子代进行内生菌分析发现,玉米子代中假单胞菌的多样性明显高于亲本,推测可能与子代玉米表达更多的蛋白质有关[30];一些木本果树内生菌的研究也有相近结果,如对8个不同品种的苹果树内生菌群分析,发现新疆本地品种内生菌的种类和丰度均高于吉尔吉斯斯坦品种[23];7个梨品种内生菌多样性和相对丰度也不相同[24],在棕榈[31]、蝉花[32] 和桑树[21] 上有类似发现。由此可见,不同品种间基因的差异影响内生菌的菌群结构和相对丰度,推测可能是内生菌群参与品种选育过程并与寄主达到相对稳定的状态。针对此推测,后续我们将比对不同品种荔枝内生菌菌群结构与多样性,结合品种的进化关系,全面揭示荔枝内生菌的分布规律。
变形菌门、放线菌门和厚壁菌门为主要的优势内生细菌菌群,覆盖了6个荔枝品种内生细菌总量的98% 以上,说明荔枝果肉内生细菌在门水平上组成相似。酸杆菌门是基于分子生态学研究的新细菌类群,大多数为嗜酸菌,在土壤中存在比例较大[33-34],但仅在‘义桥蜜荔’‘妃子笑’和‘岭腰1号’果肉中发现,推测可能是上述品种果肉酸度较高。根据属水平上的细菌丰度差异进行聚类分析可将这6个荔枝品种分为2大类,‘糯米糍’‘观音绿’和‘鹅蛋荔’聚在一起,剩下3种聚在一起。其中,‘观音绿’和‘糯米糍’为优质荔枝品种[35-36],其假单胞菌属、果胶杆菌属、苍白杆菌属和迪基氏菌属显著富集,推测这些菌属可能在优质荔枝中发挥重要作用。接种假单胞菌可提高植物脯氨酸、氨基酸和可溶性糖的含量[37],提高抗病菌能力[38];果胶杆菌属是植物细菌性软腐病的主要病原菌,可侵染蔬菜作物,分泌水解酶降解细胞壁的果胶质[39];苍白杆菌属的菌株具有抗病促生功能[40],这些优势菌属在优质荔枝品种中发挥的作用及其与荔枝品质的相关性需要作进一步研究。
4 结论本研究首次通过高通量技术分析,明确6个不同品种荔枝果肉的内生菌群结构和组成。在门分类水平,变形菌门细菌是荔枝果肉中主要优势细菌门,相对丰度达93.53%,其次为放线菌门(2.83%)和厚壁菌门(2.03%)。不同品种荔枝果肉内生细菌菌群结构在科、属、种分类水平上具有相似性,但在菌群的丰度上存在差异。在种水平上,‘鹅蛋荔’果肉组织中的菌群相对丰度最大、为0.11%,并特异含有慢性根瘤菌属和变形菌属;‘糯米糍’‘观音绿’和‘鹅蛋荔’果肉中内生细菌在属水平上具有更高的相似性,并聚集在一起。荔枝果肉内生细菌菌群的构建过程与荔枝果实成熟度和品质高度相关,以上结果可为荔枝内生菌细菌的开发利用和荔枝品质提升和评价提供参考。
| [1] |
崔永宁, 陈洁珍, 史发超, 姜永华, 严倩, 欧良喜, 刘海伦, 蔡长河. 基于TPA法的荔枝资源果肉质地品质分析[J]. 果树学报, 2022, 39(12): 2241-2252. DOI:10.13925/j.cnki.gsxb.20220202 CUI Y N, CHEN J Z, SHI F C, JIANG Y H, YAN Q, OU L X, LIU H L, CAI C H. Analysis of texture quality of the fruits in litchi based on the texture profile analysis (TPA)[J]. Journal of Fruit Science, 2022, 39(12): 2241-2252. DOI:10.13925/j.cnki.gsxb.20220202 |
| [2] |
温靖, 徐玉娟, 肖更生, 吴继军, 陈于陇, 余元善. 广东省17个不同荔枝品种果实品质比较分析[J]. 食品科学技术学报, 2016, 34(2): 39-45. DOI:10.3969/j.issn.2095-6002.2016.02.006 WEN J, XUE Y J, XIAO G S, WU J J, CHEN Y L, YU Y S. Comparative analysis on fruit qualities of litchi varieties from Guangdong Province[J]. Journal of Food Science and Technology, 2016, 34(2): 39-45. DOI:10.3969/j.issn.2095-6002.2016.02.006 |
| [3] |
郑锦锦, 陈岩, 刘帅, 刘香香, 杨慧, 王富华. 荔枝品质评价的研究进展[J]. 中国食物与营养, 2019, 25(2): 10-14. DOI:10.3969/j.issn.1006-9577.2019.02.002 ZHENG J J, CHEN Y, LIU S, LIU X X, YANG H, WANG F H. Research progress on quality evaluation of litchi[J]. Food and Nutrition in China, 2019, 25(2): 10-14. DOI:10.3969/j.issn.1006-9577.2019.02.002 |
| [4] |
黄方, 唐杰, 黄敏, 李丽, 易萍, 覃楚懿. 低温结合气调包装对荔枝保鲜作用[J]. 食品工业, 2022, 43(10): 51-55. HUANG F, TANG J, HUANG M, LI L, YI P, XUN C Y. Preservation effect of low temperature combined with modified atmosphere packaging of litchi[J]. The Food Industry, 2022, 43(10): 51-55. |
| [5] |
杨碧敏, 林育钊, 吴一晶, 林丽娟, 林河通. 采后荔枝果实安全保鲜技术研究进展[J]. 包装与食品机械, 2017, 35(2): 56-60. DOI:10.3969/j.issn.1005-1 YANG B M, LIN Y Z, WU Y J, LIN L J, LIN H T. Research advances in safety technologies of keeping quality for harvested litchi fruit[J]. Packaging and Food Machinery, 2017, 35(2): 56-60. DOI:10.3969/j.issn.1005-1 |
| [6] |
KANDEL S L, JOUBERT P M, DOTY S L. Bacterial endophyte colonizationand distribution within plants[J]. Microorganisms, 2017, 5(4): 77. DOI:10.1094/MPMI-11-21-0274-R |
| [7] |
ZHANG Y, YU X X, ZHANG W J, LANG D Y, ZHANG X J, GUI G C, ZHANG X H. Interactions between endophytes and plants: Beneficial effect of endophytes to ameliorate biotic and abiotic stresses in plants[J]. Journal of Plant Biology, 2019, 62(1): 1-13. DOI:10.1007/s12374-018-0274-5 |
| [8] |
陈招荣, 刘新悦, 赵欣迪, 马洪峥, 梁红春. 植物内生菌群落组成及其功能研究进展[J]. 生命科学, 2023, 35(2): 132-139. DOI:10.13376/j.cbls/2023019 CHEN Z R, LIU X Y, ZHAO X D, MA H Z, LIANG H C. Research progress on community composition and function of endophytes in plants[J]. Chinese Bulletin of Life Sciences, 2023, 35(2): 132-139. DOI:10.13376/j.cbls/2023019 |
| [9] |
RYAN R P, GERMAINE K, FRANKS A, RYAN D J, DOWLING D N. Bacterial endophytes: Recent developments and applications[J]. FEMS Microbiology Letters, 2008, 278(1): 1-9. DOI:10.1111/j.1574-6968.2007.00918.x |
| [10] |
KEMP P F, ALLER J Y. Bacterial diversity in aquatic and other environments: What 16S rDNA libraries can tell us[J]. FEMS Microbiology Ecology, 2004, 47(2): 161-177. DOI:10.1016/S0168-6496(03)00257-5 |
| [11] |
汪晶晶, 王嘉浩, 黄致云, OKECHUKW V C, 胡蝶, 祁珊珊, 戴志聪, 杜道林. 不同氮水平下内生固氮菌对入侵植物南美蟛蜞菊生长策略的影响[J]. 植物生态学报, 2023, 47(2): 195-205. DOI:10.17521/cjpe.2022.0004 WANG J J, WANG J H, HUANG Z Y, OKECHUKW V C, HU D, QI S S, DAI Z C, DU D L. Effects of endophytic nitrogen-fixing bacteria on the growth strategy of an invasive plant Sphagneticola trilobata under different nitrogen levels[J]. Chinese Journal of Plant Ecology, 2023, 47(2): 195-205. DOI:10.17521/cjpe.2022.0004 |
| [12] |
黄雪珍, 赵龙飞. 药用植物内生菌对宿主植物促生作用机制研究进展[J]. 微生物学通报, 2023, 50(4): 1653-1665. DOI:10.13344/microbiol.china.221120 HUANG X Z, ZHAO L F. Mechanism of endophytes of medicinal plants in promoting the growth of host plants[J]. Microbiology China, 2023, 50(4): 1653-1665. DOI:10.13344/microbiol.china.221120 |
| [13] |
张永华, 刘岩, 赵兴民, 王道亮. 植物内生菌对苹果树腐烂病防治的研究进展[J]. 农业与技术, 2021, 41(16): 69-72. DOI:10.19754/j.nyyjs.20210830019 ZHANG Y H, LIU Y, ZHAO X M, WANG D L. Resea rch progress of endophytic bacteria against apple tree rot disease[J]. Agriculture and Technology, 2021, 41(16): 69-72. DOI:10.19754/j.nyyjs.20210830019 |
| [14] |
林国钦, 张婷, 左杰, 何锦欣, 蓝灿华, 田宝玉. 产IAA根内生菌的分离鉴定及对小麦促生效果[J]. 福建农业科技, 2022, 53(4): 10-17. DOI:10.13651/j.cnki.fjnykj.2022.04.002 LIN G X, ZHANG D, ZUO J, HE J X, LAN C H, TIAN B Y. Isolation and identification of IAA-producing endophytic bacteria and its growth promoting effect on growth of wheat[J]. Fujian Agricultural Science and Technology, 2022, 53(4): 10-17. DOI:10.13651/j.cnki.fjnykj.2022.04.002 |
| [15] |
LU T, KE M, LAVOIE M, LAVOIE M, JIN Y J, FAN X J, ZHANG Z Y, FU Z W, SUN L W, GILINGS M, PENUELAS J, QIAN H F, ZHU Y G. Rhizosphere microorganisms can influence the timing of plant flowering[J]. Microbiome, 2018, 6(1): 1-12. DOI:10.1186/s40168-018-0615-0 |
| [16] |
王伯勋, 王学东, 段桂兰. 水稻不同生长时期不同组织中抗砷内生菌的筛选与鉴定[J]. 环境科学, 2018, 39(5): 2464-2471. DOI:10.13227/j.hjkx.201709184 WANG B X, WANG X D, DUAN G L. Screening and identification of arsenic-resistant endophytic bacteria from different rice tissues (Oryza sativa L.) in different growth stages[J]. Environmental Science, 2018, 39(5): 2464-2471. DOI:10.13227/j.hjkx.201709184 |
| [17] |
陈柯璇, 汤雯婷, 李丽娜, 李绍仕, 和丽萍, 李海燕. 种子内生菌增强宿主植物重金属抗性的功能机制研究进展[J]. 微生物学通报, 2021, 48(6): 2187-2194. DOI:10.13344/j.microbiol.china.200925 CHEN K X, TANG W T, LI L N, LI S S, HE L P, LI H Y. Functional mechanism of seed endophytes enhancing heavy metal resistance of host plants: A review[J]. Microbiology China, 2021, 48(6): 2187-2194. DOI:10.13344/j.microbiol.china.200925 |
| [18] |
徐亚军. 植物内生菌资源多样性研究进展[J]. 广东农业科学, 2011, 38(24): 149-152. DOI:10.16768/j.issn.1004-874x.2011.24.036 XUE Y J. Research progress on pesources diversity of plant endophytes[J]. Guangdong Agricultural Sciences, 2011, 38(24): 149-152. DOI:10.16768/j.issn.1004-874x.2011.24.036 |
| [19] |
黄子粤, 刘文君, 覃仁柳, 庞师婵, 肖健, 杨尚东. 不同品种南瓜内生细菌多样性及PICRUST基因功能预测分析[J]. 中国农业科学, 2021, 54(18): 4018-4032. DOI:10.3864/j.issn.0578-1752.2021.18.019 HUANG Z Y, LIU W J, XUN R L, PANG S C, XIAO J, YANG S D. Endophytic bacterial community composition and PICRUST gene functions in different pumpkin varieties[J]. Scientia Agricultura Sinica, 2021, 54(18): 4018-4032. DOI:10.3864/j.issn.0578-1752.2021.18.019 |
| [20] |
刘佳悦, 贾丽霞, 王苗苗, 孙东辉, 孙贺贺, 郝志敏, 李志勇. 抗(感) 谷瘟病谷子品种内生菌多样性分析[J]. 华北农学报, 2022, 37(5): 187-193. DOI:10.7668/hbnxb.20192900 LIU J Y, JIA L X, WANG M M, SUN D H, SUN H H, HAO Z M, LI Z Y. Analysis of endophytic diversity of foxtail millet varieties resistant(susceptible) to foxtail millet blast[J]. Acta Agriculturae Boreali-Sinica, 2022, 37(5): 187-193. DOI:10.7668/hbnxb.20192900 |
| [21] |
吴燕燕, 徐伟芳, 罗琴, 王玲莉, 刘祎杨, 陈凯, 谢洁. Illumina MiSeq高通量测序分析不同品种桑树内生细菌多样性[J]. 蚕学通讯, 2018, 38(3): 1-10. DOI:10.3969/j.issn.1006-0561.2018.03.001 WU Y Y, XU W F, LUO Q, WANG L L, LIU Y Y, CHEN K, XIE J. An illumina-based analysis of the diversity of endophytic bacteria from different mulberry genotypes[J]. Newsletter of Sericult ural Science, 2018, 38(3): 1-10. DOI:10.3969/j.issn.1006-0561.2018.03.001 |
| [22] |
张丽芳, 胡海林, 桂腾茸, 高秀, 徐晴芳, 朱铃, 徐启贺, 蔡建. 火棘不同组织内生细菌群落多样性[J]. 广西植物, 2023, 43(7): 1193-1200. DOI:10.11931/guihaia.gxzw202206031 ZHANG L F, HU H L, GUI T R, GAO X, XUE Q F, ZHU L, XU Q H, CAI J. Diversity of endophytic bacterial community in different tissue of Pyracantha fortuneana[J]. Guihaia, 2023, 43(7): 1193-1200. DOI:10.11931/guihaia.gxzw202206031 |
| [23] |
古丽尼沙·沙依木, 张志东, 杨波, 章世奎, 唐琦勇, 宋素琴, 朱静, 郭春苗, 顾美英. 不同品种苹果树内生细菌群落多样性及功能[J]. 微生物学通报, 2020, 47(2): 500-511. DOI:10.13344/j.microbiol.china.190494 GULINISHA S Y M, ZHANG Z D, YANG B, ZHANG S K, TANG Q Y, SONG S Q, ZHU J, GUO C M, GU M Y. Endophytic bacterial community diversity and function in apple trees of different varieties[J]. Microbiology China, 2020, 47(2): 500-511. DOI:10.13344/j.microbiol.china.190494 |
| [24] |
李秋桦, 尹敏, 裴妍, 任禛, 陈泽斌, 夏体渊, 胡靖祥, 徐胜光, 陈秀. 基于高通量测序技术分析七种梨内生细菌多样性[J]. 云南大学学报(自然科学版), 2021, 43(3): 598-607. DOI:10.7540/j.ynu.20200114 LI Q Y, YIN M, PEI Y, REN Z, CHEN Z B, XIA T Y, HU J X, XU S G, CHEN X. Analysis of endophytic bacterial diversity in seven pear varieties based on high-throughput sequencing[J]. Journal of Yunnan University(Natural Sciences), 2021, 43(3): 598-607. DOI:10.7540/j.ynu.20200114 |
| [25] |
CALLAHAN B J, MCMURDIE P J, ROSEN M J, HAN A W, JOHNSON A J, HOLMES S P. DADA2: High-resolution sample inference from Illumina amplicon data[J]. Nature Methods, 2016, 13(7): 581-3. DOI:10.1038/nmeth.3869 |
| [26] |
白农恩, 刘李蕾, 邓巍, 姜林, 杨晓燕. 小生境范围内3种园林植物叶际细菌群落结构及多样性分析[J]. 广东农业科学, 2022, 49(6): 43-50. DOI:10.16768/j.issn.1004-874X.2022.06.006 BAI N E, LIU L L, DENG W, JIANG L, YANG X Y. Analysis on phyllosphere bacterial community structure and diversity of three garden plants in niche area[J]. Guangdong Agricultural Sciences, 2022, 49(6): 43-50. DOI:10.16768/j.issn.1004-874X.2022.06.006 |
| [27] |
王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. DOI:10.13344/j.microbiol.china.130815 WANG Z W, JI Y L, CHEN Y G. Studies and biological significances of plant endophytes[J]. Microbiology China, 2015, 42(2): 349-363. DOI:10.13344/j.microbiol.china.130815 |
| [28] |
刘洋, 赵燃, 黎妮, 曹艳花, 张超, 白飞荣, 张欣, 袁隆平, 王伟平, 程池. 超级杂交水稻种子内生细菌群落结构及其多样性[J]. 食品与发酵工业, 2016, 42(1): 31-36. DOI:10.13995/j.cnki.11-1802/ts.201601006 LIU Y, ZHAO R, LI N, CAO Y H, ZHANG C, BAI F R, ZHANG X, YUAN L P, WANG W P, CHENG C. Diversity of endophytic bacterial communities in seeds of super hybrid rice (Oryza sativa L.)[J]. Food and Fermentation Industries, 2016, 42(1): 31-36. DOI:10.13995/j.cnki.11-1802/ts.201601006 |
| [29] |
ADAMS P D, KLOEPPER J W. Effect of host genotype on indigenous bacterial endophytes of cotton (Gossypium hirsutum L.)[J]. Plant and Soil, 2002, 240(1): 181-189. DOI:10.1023/A:1015840224564 |
| [30] |
PICARD C, BOSCO M. Heterozygosis drives maize hybrids to select elite 2, 4-diacethylphloroglucinol-producing Pseudomonas strains among resident soil populations[J]. FEMS Microbiology Ecology, 2006, 58(2): 193-204. DOI:10.1111/j.1574-6941.2006.00151.x |
| [31] |
刘媛, 渠露露, 叶美迪, 黄曹生, 朱月丹, 王俏然, 李淑彬. 棕榈科植物种子内生细菌群落多样性的高通量测序分析[J]. 微生物学报, 2019, 59(3): 554-565. DOI:10.13343/j.cnki.wsxb.20180211 LIU Y, QU L L, YE M D, HUANG C S, ZHU Y D, WANG Q R, LI S B. Diversity of bacterial endophytes communities in the seeds of several Palmae plants via high throughput sequencing method[J]. Acta Microbiologica Sinica, 2019, 59(3): 554-565. DOI:10.13343/j.cnki.wsxb.20180211 |
| [32] |
屈青松, 杨芳, 赵崇妍, 王婧茹, 曾金花, 史新元. 安徽和浙江蝉花内生细菌的分离及其多样性研究[J]. 中药材, 2019, 42(5): 992-999. DOI:10.13863/j.issn1001-4454.2019.05.009 QU Q S, YANG F, ZHAO C Y, WANG J R, ZENG J H, SHI X Y. Isolation and diversity of Cordyceps cicadae endophytic bacteria in Anhui and Zhejiang[J]. Journal of Chinese Medicinal Materials, 2019, 42(5): 992-999. DOI:10.13863/j.issn1001-4454.2019.05.009 |
| [33] |
王光华, 刘俊杰, 于镇华, 王新珍, 金剑, 刘晓冰. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14-20. DOI: 10.13560/j.cnki.biotech.bull.1985.2016.02.002. WANG G H, LIU J J, YU Z H, WANG X Z, LIU X B. Research progress of acidobacteria ecology in soils[J]. Biotechnology Bulletin, 2016, 32(2): 14-20. DOI: 10.13560/j.cnki.biotech.bull.1985.2016.02.002. |
| [34] |
BARNS S M, TAKALA S L, KUSKE C R. Wide distribution and diversity of members of the bacterial kingdom Acidobacterium in the environment[J]. Applied and Environmental Microbiology, 1999, 65(4): 1731-1737. DOI:10.1128/AEM.65.4.1731-1737.1999 |
| [35] |
吴晓方. '观音绿'等三个荔枝新品种DUS测试及SNP分子标记分析[D]. 广州: 华南农业大学, 2019. DOI: 10.27152/d.cnki.ghanu.2019.000593. WU X F. DUS testing and snp molecular marker analysis of three new litchi culitivars[D]. Guangzhou: South China Agriculture University, 2019. DOI: 10.27152/d.cnki.ghanu.2019.000593. |
| [36] |
董晨, 郑雪文, 王弋, 李伟才, 胡桂兵. 优质荔枝品种"观音绿"在粤西地区的引种试验[J]. 南方农业, 2022, 16(3): 104-106, 120. DOI:10.19415/j.cnki.1673-890x.2022.03.022 DONG C, ZHEN X W, WANG Y, LI W C, HU G B. Introduction experiment of high quality litchi variety 'Guanyin Lv' in western Guangdong[J]. South China Agriculture, 2022, 16(3): 104-106, 120. DOI:10.19415/j.cnki.1673-890x.2022.03.022 |
| [37] |
SANDHYA V, ALI S Z, GROVER M, et al. Effect of plant growth promoting Pseudomonas spp. on compatible solutes, antioxidant status and plant growth of maize under drought stress[J]. Plant Growth Regulation, 2010, 62: 21-30. DOI:10.1007/s10725-010-9479-4 |
| [38] |
代雪凤, 朱丽, 张盛林, 牛义, 刘海莉. 软腐果胶杆菌Pectobacterium的致病机理及生物防治研究进展[J/OL]. 分子植物育种: 1-16[2023-04-28]. http://kns.cnki.net/kcms/detail/46.1068.S.20211015.1432.014.html. DAI X F, ZHU L, ZHANG S L, NIU Y, LIU H L. Research progress on pathogenic mechanism and biological control of Pectobacterium soft rot[J/OL]. Molecular Plant Breeding, 1-16[2023-04-28]. http://kns.cnki.net/kcms/detail/46.1068.S.20211015.1432.014.html. |
| [39] |
郑京, 梁乐霞, 宣倩倩, 郭慧滢, 周志国, 孙泽敏, 左国才. 黄瓜疫霉菌拮抗内生细菌的筛选与鉴定[J]. 广东农业科学, 2022, 49(4): 81-87. DOI:10.16768/j.issn.1004-874X.2022.04.010 ZHENG J, LIANG L X, XUAN Q Q, GUO H Y, ZHOU Z G, SUN Z M, ZUO G C. Screening and identification of antagonistic endophytic bacteria against phytophthora drechsleri in cucumber[J]. Guangdong Agricultural Sciences, 2022, 49(4): 81-87. DOI:10.16768/j.issn.1004-874X.2022.04.010 |
| [40] |
余涵霞, 梁浩林, 王子轩, 杨晓宇, 李伟华. 薇甘菊根际可培养固氮菌和氨化细菌的分离鉴定与促生作用[J]. 微生物学报, 2022, 62(5): 1851-1863. DOI:10.13343/j.cnki.wsxb.20210583 YU H X, LIANG H L, WANG Z X, YANG X Y, LI W H. Isolation, identification and growth-promoting effects of culturable nitrogen-fixing bacteria and ammonifying bacteria in rhizosphere soil of Mikania micrantha[J]. Acta Microbiologica Sinica, 2022, 62(5): 1851-1863. DOI:10.13343/j.cnki.wsxb.20210583 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51





