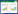文章信息
基金项目
- 广东省基础与应用基础研究基金温氏联合基金项目(2019B1515210013);广东省重点领域研发计划项目(2022B0202090002);国家重点实验室建设项目(ZQQZ-38);广东省农业科学院协同创新中心项目(XTXM202203-XT202217)
作者简介
- 李新明(1998—),男,在读硕士生,研究方向为动物遗传与育种,E-mail:lxm980421@163.com.
通讯作者
- 王塑天(1989—),男,博士,副研究员,研究方向为家畜抗病基因功能与抗病育种,E-mail:wstlyt@126.com.
文章历史
- 收稿日期:2023-12-21
2. 广东省农业科学院动物科学研究所/猪禽种业全国重点实验室/广东省畜禽育种与营养研究重点实验室,广东 广州 510610;
3. 佛山科学技术学院医学院/广东省基因编辑工程技术研究中心,广东 佛山 528000
2. Institute of Animal Science, Guangdong Academy of Agricultural Sciences/State Key Laboratory of Swine and Poultry Breeding Industry/Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510610, China;
3. Medical School, Foshan University/Guangdong Research Center of Gene Editing Engineering Technology, Foshan 528000, China
【研究意义】近年来,我国的生猪产业在技术创新的推动下逐步走向规模化。但猪传染性疾病一直是导致养殖经济损失的主要因素,在很大程度上制约了生猪产业的健康发展。目前,畜牧业主要依赖疫苗接种和日常防控措施来防止病原侵袭。随着国家推行禁用抗生素方针,仅依靠疫苗、药物和加强饲养环境管理的方法具有一定的局限性。因此,培育具有较强抗病性的新品种猪,已成为解决猪病问题、提高经济效益和保障食品安全的新方向。
【前人研究进展】先天免疫系统依赖模式识别受体(Pattern recognition receptor,PRR)可以识别特定的病原体相关分子模式。根据蛋白结构域同源性,PRR可分为Toll样受体(TLR)、C型凝集素受体(CLR)、RIG-Ⅰ样受体(RLR)、NOD样受体(NLR)和黑素瘤-2样受体(ALR)5种类型[1],它们广泛分布于细胞膜、胞腔膜和细胞质中。PRR主要由配体识别域、中间域和效应域组成[2],通过识别其配体激活下游信号通路,启动先天免疫杀伤及随后的获得性免疫反应,维持宿主微生态平衡。其中,TLR是哺乳动物先天免疫中被广泛研究的PRR,这种受体分子通常有两种功能,一是与配体特异性结合,二是传递信号。相应的信号转导会放大抗病原体感染的作用,使炎症反应中活跃的免疫细胞通过基因转录被激活,诱导多种炎性细胞因子(如IL-1、IL-6、TNF-α)和抗病毒因子Ⅰ型干扰素(IFN-1)的产生[3]。目前,在哺乳动物中已发现的TLR共有13种,其中10种TLR只在人类和猪中发现(TLR1~TLR10),在小鼠中发现12种(TLR1~TLR9和TLR11~TLR13)。由于逆转录酶的插入,TLR10在小鼠中失去了功能。此外,TLR11~TLR13的功能仅在小鼠中表达,在人类和猪中未发现其功能[4-5]。可见,不同物种的TLR表达和功能存在一定差异。
根据TLR分布的位置可分为两大类,一类是细胞外类(TLR1、TLR2、TLR4、TLR5、TLR6和TLR10),以异二聚体或同源二聚体的形式定位于细胞膜上,主要识别细菌的脂质、脂蛋白和蛋白质等成分;另一类是细胞内类(TLR3、TLR7、TLR8和TLR9),主要定位于细胞内的室间(如内质网、核内体、溶酶体),识别微生物的核酸成分[6]。不同的TLR通过识别不同的配体发挥作用。TLR2与TLR1和TLR6形成异源二聚体后可以识别细菌脂蛋白,TLR3可识别双链病毒RNA和来自受损细胞的自身RNA,而TLR4可以特异性结合细菌脂多糖(LPS),TLR5可以结合细菌的鞭毛蛋白,TLR7、TLR8识别单链病毒RNA,TLR9识别含CpG基序的微生物DNA[4]。研究发现,猪细小病毒感染PK-15细胞后,TLR9 mRNA表达水平在24 h显著升高,48 h达到峰值,并伴随NF-κB信号通路的激活最终导致炎症因子IL-6水平升高[7]。副猪嗜血杆菌也能够被TLR识别,进而诱导NF-κB和MAP激酶信号通路的激活[8]。此外,Vesatolimod(GS-9620)作为TLR7激活剂,能够通过激活TLR7产生IFN-1来显著减少口蹄疫病毒的感染并降低病毒载量[9]。另一种TLR7激活剂SZU101也被证实可以抑制猪肺泡巨噬细胞中猪繁殖与呼吸综合征病毒的复制[10]。这些结果均表明病原微生物侵入机体时,可以通过TLR来激活宿主细胞的免疫应答。因此,猪TLR被认为是监测猪病原微生物的第一道防线,与抗病性密切相关。
抗菌肽(Antimicrobial peptide,AMP)是一种具有抗菌、抗病毒和抗真菌活性的小蛋白质,广泛存在于多细胞真核生物的上皮屏障和系统诱导防御中[11],是先天免疫的重要组成部分。大多数AMP是由5~100个氨基酸组成的寡肽,带有正电荷和大量疏水残基[12]。AMP作用的典型机制是融入细菌细胞膜并破坏其完整性,最终导致细胞裂解。此外,AMP可能具有更复杂的活性,包括影响代谢和蛋白质翻译[13-14]。AMP最初的研究集中于阐明其杀菌活性,而近些年已经证明抗菌肽可以调节先天和适应性免疫反应,以保护宿主免受感染。研究最多的AMP家族是哺乳动物防御素和Cathelicidins。防御素是具有6个保守半胱氨酸残基和3个二硫键、大小为2~6 kD的多肽[15],对多种细菌、真菌均有抑制作用。根据这些残基的排列,它们被分为α-防御素、β-防御素和θ-防御素[16]。β-防御素家族通常由皮肤和黏膜的上皮细胞表达,其表达可以由TLR配体或某些类型的细胞因子(如肿瘤坏死因子TNF)或白介素-1β刺激诱导[17]。猪β-防御素-1(PBD-1)最早报道于1999年,随后该基因被发现对大肠杆菌、黄金葡萄球菌、沙门氏菌等具有抑制作用[18-19]。Cathelicidins是哺乳动物宿主防御肽的一个主要亚群,具有强大的抗菌和免疫调节活性,与其他AMP家族相比,表现出更强的抗菌活性。尤其在偶蹄目动物中,抗菌素基因表现得更加普遍和多样化。脯氨酸-精氨酸-39(PR-39)是Cathelicidins家族中一种富含脯氨酸和精氨酸的小型阳离子抗菌肽,在猪的先天免疫系统中同样具有重要作用[20]。PR-39最初在猪肠道细胞裂解液中被发现,但随后的研究表明,它主要在骨髓和淋巴组织等免疫组织中表达[21]。防御素和Cathelicidins广泛存在于生物体中,具有抵御各种病原微生物致病因子的能力。例如,β-防御素可显著抑制伪狂犬等病毒的增殖[22],而PR-39可有效减少大肠杆菌的生长[23]。因此,它们都在先天免疫中扮演着重要角色。
【本研究切入点】杜长大三元猪是世界范围内常见的商业猪品种,其以生长快速、饲料转化比高、经济效益高等优势深受养殖者喜爱。该猪也具有一定的环境适应能力,对病原微生物表现出一定的抗病性,但与我国地方品种的抗病性能可能存在一定差距[24]。藏猪是我国本土优良品种,一般分布于西藏、青海、甘肃等高海拔地区,具有耐粗粮、脂肪沉淀能力强、鲜味氨基酸丰富等特点[25],并展现出较强的抗逆抗病能力[26]。猪的淋巴组织和免疫器官中大量聚集着各种免疫系统细胞,如巨噬细胞、中性粒细胞和树突状细胞,它们都表达TLR和AMP。因此,确定它们在免疫组织如肺脏、肠系膜淋巴结、腹股沟淋巴结、颌下淋巴结和脾脏中的表达水平具有重要意义。尽管前人已经研究了TLR、pBD-1和PR-39在不同猪品种或组织中的表达特征[27-29],但目前尚缺乏对杜长大三元猪和藏猪免疫系统组织之间的差异分析研究。
【拟解决的关键问题】本研究拟比较TLR(TLR1、TLR2、TLR4、TLR7、TLR9),以及抗菌肽基因(pBD-1和PR-39)在杜长大三元猪和藏猪主要免疫系统组织中的转录表达,以阐明其在先天免疫中的特异性。本研究有助于深入了解不同猪种在免疫系统水平上的差异,为猪抗病育种提供理论依据,为我国地方猪开发利用提供科学支持。
1 材料与方法 1.1 实验动物及样品采集供试的纯种藏猪、杜长大三元猪来自广东省农业科学院动物科学研究所猪场,两品种实验猪在相同的营养水平和饲喂方式下进行饲养,管理条件相同,6月龄时藏猪体重为30~40 kg,杜长大三元猪为100 ~110 kg。为确保试验结果的准确性和可靠性,每组随机选取6头健康猪只屠宰,每头各取肺脏、脾脏、腹股沟淋巴结、肠系膜淋巴结和颌下淋巴结样品,无菌PBS冲洗,迅速裁剪后,装入冻存管中于液氮中快速冷冻,-80 ℃保存。
1.2 RNA提取和cDNA合成每个组织各取100 mg样品于EP管中,加入研磨珠和0.8 mL Trlzol(北京Takara生物医学技术有限公司)试剂,于研磨破碎仪中研磨组织后,加入0.16 mL三氯甲烷,剧烈摇晃15 s,静置5 min后,12 000 r/min、4 ℃离心15 min,使RNA与DNA、蛋白质分离。随后抽取约0.4 mL上清液,加入等体积冰冻异丙醇,缓慢摇晃15 s,静置10~15 min,12 000 r/min、4 ℃离心15 min,使RNA沉淀。弃去上清液,加入1 mL 75% 乙醇,12 000 r/min、4 ℃离心7 min,洗涤RNA中的盐离子。重复洗涤1次,弃去上清液后,12 000 r/min、4 ℃离心2 min,移液枪吸去多余上清液。干燥2 min去除乙醇残留后,加入30 μL无酶水。使用Nano DLY Photometer N60仪器在260 nm下测定分离的RNA浓度,所提RNA的260 nm/280 nm比值均在1.90 ~ 2.10之间,纯度符合要求。通过变性琼脂糖凝胶电泳和溴化乙锭染色进一步检查RNA完整性。按照试剂说明书,使用HiScript® Ⅲ RT SuperMix for qPCR(+gDNA wiper)试剂盒(南京诺唯赞医疗科技有限公司)将RNA逆转录成cDNA,-20 ℃保存。
1.3 引物设计根据NCBI中报道的TLR1、TLR2、TLR4、TLR7、TLR9、pBD-1和PR-39基因序列,使用Primer Primer 5.0设计引物,共筛选得到8对特异性引物(表 1),引物由上海生工生物工程股份有限公司合成。
1.4 qPCR反应体系与反应条件
使用Bio-Rad CFX Maestro系统(美国),在Bio-Rad CFX Connect荧光定量PCR仪(美国)上进行qPCR,分析TLR1、TLR2、TLR4、TLR7、TLR9、pBD-1和PR-39基因表达,SYBR green荧光染料采用Taq Pro Universal SYBR qPCR Master Mix试剂(南京诺唯赞医疗科技有限公司)。qPCR反应体系:2×Taq Pro Universal SYBR qPCR Master Mix 10 μL、cDNA模板1 μL、上下游引物各1 μL、加水补至20 μL。qPCR反应条件:95 ℃预变性3 min;95 ℃ 10 s,按照表 1中的温度退火/ 延伸30 s,40个循环;95 ℃ 5 s终止退火/ 延伸反应,60 ℃ 5 s后以0.5 ℃/s升温至95 ℃,并记录产物荧光值。以甘油醛-3-磷酸脱氢酶(GAPDH)为管家基因,检测mRNA表达。每个样品设置3个重复。
1.5 数据分析采用周期阈值(Ct)对qPCR基因扩增进行相对定量。将所选基因的相对mRNA表达量进行归一化处理,管家基因为GAPDH,以杜长大三元猪为对照,并采用2−ΔΔCt法计算目的mRNA的相对表达。试验数据使用SPASS 27.0软件进行独立样品T检验和单因素方差分析,利用GraphPad Prism 9.4.1软件绘图。
2 结果与分析 2.1 肺脏中Toll样受体与抗菌肽mRNA表达水平本研究比较了藏猪与杜长大三元猪肺脏中TLR1、TLR2、TLR4、TLR7、TLR9与抗菌肽基因pBD-1和PR-39的表达水平,结果(图 1)显示,TLR和抗菌肽基因在藏猪与杜长大三元猪肺脏中的mRNA表达水平存在差异,藏猪肺脏中TLR1、TLR2的mRNA丰度比杜长大三元猪显著提高50% 左右,PR-39显著提高2.6倍。
|
| * P<0.05,**P<0.01,***P<0.001 图 1 藏猪、杜长大三元猪肺脏中Toll样受体与抗菌肽mRNA表达水平对比 Fig. 1 Comparison of mRNA expression levels of Toll-like receptor and antimicrobial peptide in lungs of Tibetan and Duroc-Landrace-Yorkshire pigs |
2.2 肠系膜淋巴结中Toll样受体与抗菌肽mRNA表达水平
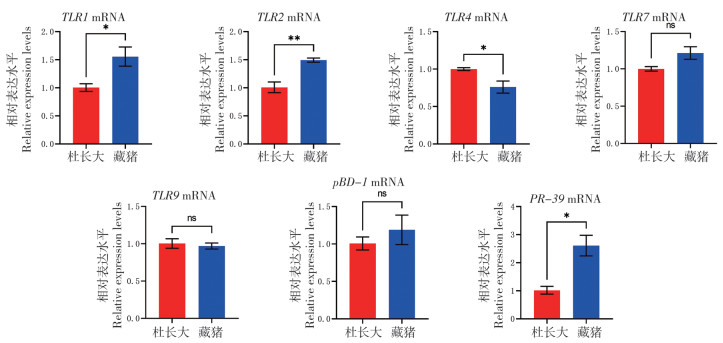
由图 2可知,藏猪与杜长大三元猪肠系膜淋巴结中TLR2的mRNA表达差异不明显,而TLR1、TLR4、PR-39的mRNA表达显著高于杜长大三元猪,分别提高88%、40% 和3倍。
|
| * P<0.05,**P<0.01,***P<0.001 图 2 藏猪、杜长大三元猪肠系膜淋巴结中Toll样受体与抗菌肽mRNA表达水平对比 Fig. 2 Comparison of mRNA expression levels of Toll-like receptor and antimicrobial peptide in mesenteric lymph nodes of Tibetan and Duroc-Landrace-Yorkshire pigs |
2.3 腹股沟淋巴结中Toll样受体与抗菌肽mRNA表达水平
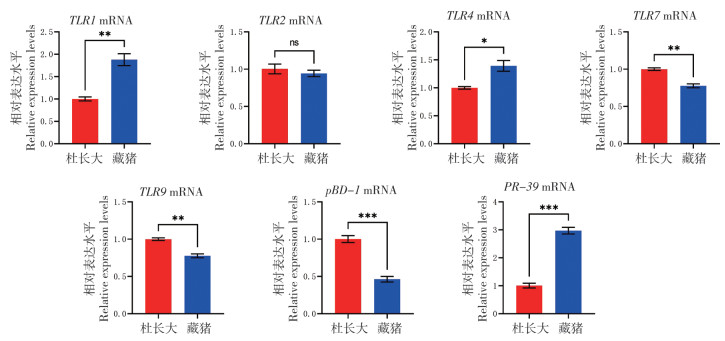
由图 3可知,藏猪腹股沟淋巴结中TLR1、TLR2、TLR4、TLR9、pBD-1和PR-39的mRNA丰度显著高于杜长大三元猪,其中,TLR1、TLR2、TLR9、pBD-1、PR-39的表达在两组猪中呈现极显著差异,TLR1、TLR2的mRNA表达提高约2倍,TLR9、PR-39的mRNA表达提高近70%,PR-39的mRNA表达提高7倍以上。此外,腹股沟淋巴结中TLR9、PR-39的mRNA表达明显高于在其他免疫器官或组织中的表达。
|
| * P<0.05,**P<0.01,***P<0.001 图 3 藏猪、杜长大三元猪腹股沟淋巴结中Toll样受体与抗菌肽mRNA表达水平对比 Fig. 3 Comparison of mRNA expression levels of Toll-like receptors and antimicrobial peptides in inguinal lymph nodes of Tibetan and Duroc-Landrace-Yorkshire pigs |
2.4 颌下淋巴结中Toll样受体与抗菌肽mRNA表达水平
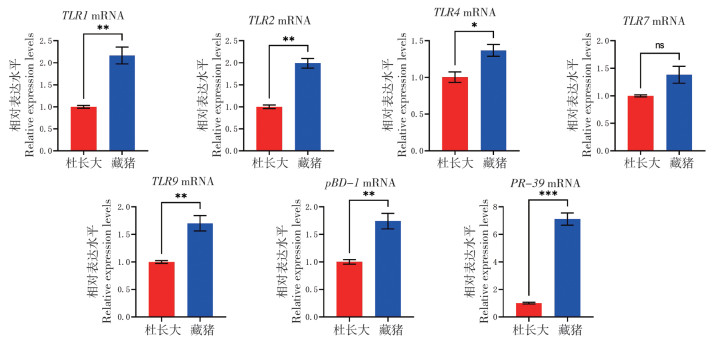
由图 4可知,藏猪颌下淋巴结中TLR1、TLR2、TLR4、TLR7、TLR9和PR-39的mRNA丰度显著高于杜长大三元猪,TLR1、TLR2、TLR4、TLR7的mRNA丰度均高出杜长大三元猪2倍以上,PR-39的mRNA丰度高出近7倍,与在腹股沟淋巴结中的表达水平相近。此外,颌下淋巴结中TLR1(与脾脏中表达相近)、TLR2(与腹股沟淋巴结中表达相近)、TLR4、TLR7的mRNA表达水平明显高于在其他免疫器官或组织中的表达水平。
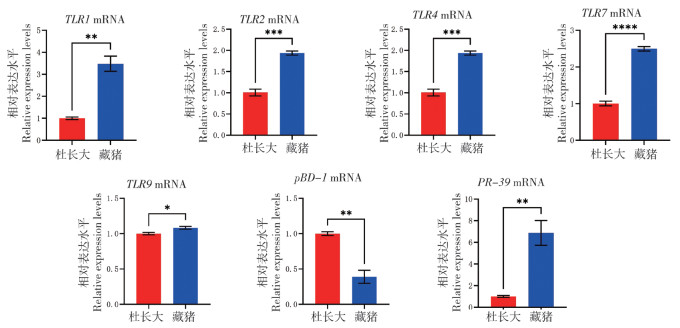
|
| * P<0.05,**P<0.01,***P<0.001 图 4 藏猪、杜长大三元猪颌下淋巴结中Toll样受体与抗菌肽mRNA表达水平对比 Fig. 4 Comparison of mRNA expression levels of Toll-like receptors and antimicrobial peptides in submandibular lymph nodes of Tibetan and Duroc-Landrace-Yorkshire pigs |
2.5 脾脏中Toll样受体与抗菌肽mRNA表达水平
由图 5可知,藏猪脾脏中TLR1、TLR4、TLR9和PR-39的mRNA表达显著高于杜长大三元猪,TLR1上升3.5倍,与在颌下淋巴结中的表达结果相似;TLR4、TLR9均上升50% 左右,PR-39上升2.5倍。
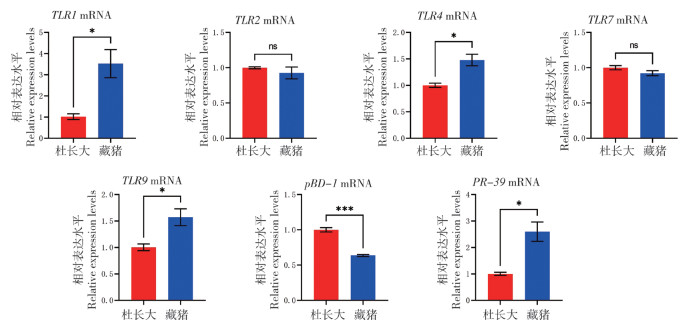
|
| * P<0.05,**P<0.01,***P<0.001 图 5 藏猪、杜长大三元猪脾脏中Toll样受体与抗菌肽mRNA表达水平对比 Fig. 5 Comparison of mRNA expression levels of Toll-like receptors and antimicrobial peptides in the spleens of Tibetan and Duroc-Landrace-Yorkshire pigs |
3 讨论
Liang等[30]针对PRRSV感染的本土猪种和大白猪进行转录组分析,在本土猪中检测到2 245个差异表达基因,而在大白猪中检测到1 839个差异表达基因;本土猪的差异表达基因GO富集主要与免疫应答过程相关,包括受体信号传导、病毒防御反应、NF-κB信号通路、MHC Ⅰ类肽抗原的加工和呈递等,而大白猪的差异表达基因富集涉及炎症反应、病毒防御反应、Ⅰ型干扰素信号通路、DNA复制、脂多糖的细胞反应和细胞粘附等;此外,大白猪中炎症反应增加,但在抗原加工和呈递过程中并未增加,而且在大白猪中,参与免疫应答的下调差异表达基因较多。可见,大白猪的免疫应答受到一定程度的抑制,本土猪的免疫应答能力更强。Toll样受体和抗菌肽基因是先天免疫应答的重要组成部分。因此,我们分析了抗病性强的本土猪种藏猪与杜长大三元猪免疫组织或器官中的Toll样受体和抗菌肽基因的差异表达。在本研究中,我们观察到TLR的mRNA在不同组织中的丰度不同,这与之前的报道一致[27-29],它们在猪组织中的丰度变化揭示其生物活性,说明不同的免疫器官或组织具有不同功能。此外,抗菌肽PR-39在藏猪的所有免疫器官或组织中的表达水平均显著高于杜长大三元猪,表明藏猪在抗菌及抗病毒等方面可能更具有优势。
肺脏是一个通过呼吸道长期暴露于外界环境的免疫器官,它会遭受潜在的病原微生物威胁。因此,肺脏内聚集着大量具有高清除能力的免疫细胞。目前,TLR在呼吸道上皮中的表达和功能已被广泛研究。这些TLR由整个呼吸道的上皮细胞表达,并对感染或组织损伤时出现的局部微生物和宿主源性因子迅速作出反应。在识别配体后,TLR激活细胞内下游信号级联,导致固有免疫反应和适应性免疫激活相关的基因表达变化[31]。本研究发现,藏猪肺脏中TLR1、TLR2、PR-39的mRNA表达水平较高,TLR2能够识别细菌脂蛋白脂磷壁酸和肽聚糖,并与TLR1或TLR6形成异二聚体,进而产生一系列免疫信号。这表明藏猪对革兰氏阴性细菌和病毒可能具有更强的先天免疫能力。
脾脏作为人体最大的外周免疫器官,负责启动对血源抗原的免疫反应。它不仅在控制红细胞的功能、调节淋巴细胞循环中扮演重要角色,还在抵抗细菌、病毒和寄生虫感染方面发挥重要作用[32]。当病原体进入血液时,脾脏会发起免疫反应,大量免疫系统细胞在细胞膜或细胞质上表达TLR。本研究在藏猪体内检测到的大部分TLR和PR-39基因相对于杜长大三元猪更为丰富,说明藏猪可能具有更强的免疫能力,可以在外周血识别各种病原体相关的分子模式,能更快地在全身范围内激活适应性免疫应答。
淋巴结是淋巴系统的重要组成部分,在先天免疫中起至关重要的作用。淋巴结中有许多不同类型的免疫细胞,包括巨噬细胞、T细胞和B细胞。这些免疫细胞在淋巴结中相互作用,共同保护身体免受感染[33],它们遍布全身,主要聚集在颈部、腋窝、腹股沟和肠道周围。这些淋巴结的分布和数量因个体而异,但功能相同,当机体受到外来抗原或微生物的侵袭时,淋巴结中的TLR识别病原体相关的分子模式,启动先天免疫反应和随后的适应性免疫。本研究中,我们观察到TLR和抗菌肽的mRNA表达在腹股沟淋巴结中比在其他组织中更丰富,尤其是TLR1、TLR2、TLR4、TLR7、pBD-1和PR-39。此外,藏猪颌下淋巴结中TLR1、TLR2、TLR4、TLR7、TLR9、PR-39和肺脏中TLR1、TLR2、PR-39的mRNA水平显著升高,说明藏猪的呼吸道具有较强的先天免疫抗感染能力。此外,肠系膜淋巴结中TLR1、TLR4及腹股沟TLR1、TLR2、TLR4、TLR9、PR-39的mRNA表达水平显著升高,说明藏猪在局部消化道和生殖道中免受细菌、真菌、寄生虫、病毒等病原体的侵害更具优势。
4 结论本研究选取藏猪、杜长大三元猪深入研究了TLR和抗菌肽基因在不同免疫器官或组织中的mRNA表达水平及特点,结果表明,藏猪大部分TLR mRNA水平的表达显著高于杜长大三元猪,其中藏猪颌下淋巴结中TLR1、TLR2、TLR4、TLR7、TLR9和肺脏中TLR1、TLR2的mRNA表达显著高于杜长大三元猪,提示呼吸系统面临病原微生物可能具有更强的抗感染能力。肠系膜淋巴结中TLR1、TLR4及腹股沟TLR1、TLR2、TLR4、TLR9的mRNA表达水平显著升高,提示藏猪在局部消化道和生殖道中抵御病原体侵袭可能更具优势。此外,藏猪脾脏中TLR1、TLR4、TLR9的mRNA表达水平更高,这说明在面临病原体入侵时,藏猪能更快响应免疫应答,减少病原体在体内的繁殖和扩散,从而保护机体免受感染。同时,抗菌肽PR-39在所有免疫器官或组织中的mRNA表达均显著高于杜长大三元猪。抗菌肽能够破坏细菌的细胞壁结构,从而达到抑制或杀死细菌的效果。这进一步证实藏猪在抗病能力方面的优势。
| [1] |
LI D, WU M. Pattern recognition receptors in health and diseases[J]. Signal Transduct Target Therapy, 2021, 6(1): 291. DOI:10.1038/s41392-021-00687-0 |
| [2] |
YANG X, LIN G, HAN Z, CHAI J. Structural biology of NOD-like receptors[J]. Advances in Experimental Medicine and Biology, 2019, 1172: 119-141. DOI:10.1007/978-981-13-9367-9_6 |
| [3] |
ASAMI J, SHIMIZU T. Structural and functional understanding of the toll-like receptors[J]. Protein Science, 2021, 30(4): 761-72. DOI:10.1002/pro.4043 |
| [4] |
DUAN T, DU Y, XING C, WANG H Y, WANG R F. Toll-like receptor signaling and its role in cell-mediated immunity[J]. Frontiers in Immunology, 2022, 13: 812774. DOI:10.3389/fimmu.2022.812774 |
| [5] |
戴超辉, 冯海悦, 吴圣龙, 包文斌. 猪源Toll样受体家族(TLRs) 及其在抗病育种中的应用[J]. 浙江农业学报, 2018, 30(3): 507-20. DOI:10.3969/j.issn.1004-1524.2018.03.21 DAI C H, FENG H Y, WU S L, BAO W B. Pig-derived Toll-like receptor families (TLRs) and their application in disease resistance breeding[J]. Acta Agriculturae Zhejiangensis, 2018, 30(3): 507-520. DOI:10.3969/j.issn.1004-1524.2018.03.21 |
| [6] |
KAWASAKI T, KAWAI T. Toll-like receptor signaling pathways[J]. Frontiers in Immunology, 2014, 5: 461. DOI:10.3389/fimmu.2014.00461 |
| [7] |
ZHOU Y, JIN X H, JING Y X, SONG Y, HE X X, ZHENG L L, WANG Y B, WEI Z Y, ZHANG G P. Porcine parvovirus infection activates inflammatory cytokine production through Toll-like receptor 9 and NF-κB signaling pathways in porcine kidney cells[J]. Veterinary Microbiology, 2017, 207: 56-62. DOI:10.1016/j.vetmic.2017.05.030 |
| [8] |
CHEN Y, LIU T, LANGFORD P, HUA K, ZHOU S, ZHAI Y, XIAO H, LUO R, BI D, JIN H. Haemophilus parasuis induces activation of NF-κB and MAP kinase signaling pathways mediated by toll-like receptors[J]. Molecular Immunology, 2015, 65(2): 360-366. DOI:10.1016/j.molimm.2015.02.016 |
| [9] |
LEE G, KANG H R, KIM A, PARK J H, LEE M J, KIM S M. Antiviral effect of vesatolimod (GS-9620) against foot-and-mouth disease virus both in vitro and in vivo[J]. Antiviral Research, 2022, 205: 105384. DOI:10.1016/j.antiviral.2022.105384 |
| [10] |
HUANG Q, YANG H, YANG D, HAO Y, YU S, GUO Z, TIAN L, CAI X, HUANG B, ZHANG A. A synthetic toll-like receptor 7 agonist inhibits porcine reproductive and respiratory syndrome virus replication in piglets[J]. Veterinary Microbiology, 2022, 271: 109475. DOI:10.1016/j.vetmic.2022.109475 |
| [11] |
PEN G, YANG N, TENG D, MAO R, HAO Y, WANG J. A Review on the use of antimicrobial peptides to combat porcine viruses[J]. Antibiotics (Basel), 2020, 9(11): 801. DOI:10.3390/antibiotics9110801 |
| [12] |
杜志强. 先天免疫系统中抗菌肽的研究进展[J]. 广东农业科学, 2012, 39(10): 231-233. DOI:10.16768/j.issn.1004-874X.2012.10.021 DU Z Q. Research progress of antimicrobial peptides in the innate immune system[J]. Guangdong Agricultural Sciences, 2012, 39(10): 231-233. DOI:10.16768/j.issn.1004-874X.2012.10.021 |
| [13] |
FLORIN T, MARACCI C, GRAF M, KARKI P, KLEPACKI D, BERNINGHAUSEN O, BECKMANN R, VÀZQUEZ-LASLOP N, WILSON D N, RODNINA M V. An antimicrobial peptide that inhibits translation by trapping release factors on the ribosome[J]. Nature Structural & Molecular Biology, 2017, 24(9): 752-757. DOI:10.1038/nsmb.3439 |
| [14] |
LOTH K, VERGNES A, BARRETO C, VOISIN S N, MEUDAL H, DA SILVA J, BRESSAN A, BELMADI N, BACHÈRE E, AUCAGNE V. The ancestral N-terminal domain of big defensins drives bacterially triggered assembly into antimicrobial nanonets[J]. mBio, 2019, 10(5): e01821. DOI:10.1128/mBio.01821-19 |
| [15] |
FU J, ZONG X, JIN M, MIN J, WANG F, WANG Y. Mechanisms and regulation of defensins in host defense[J]. Signal Transduct Target Therapy, 2023, 8(1): 300. DOI:10.1038/s41392-023-01553-x |
| [16] |
易道生, 魏晓东, 缪永建, 陈燕飞. 鸡β-防御素7的克隆及表达[J]. 广东农业科学, 2018, 45(2): 130-134. DOI:10.16768/j.issn.1004-874X.2018.02.021 YI D S, WEI X D, MU Y J, CHEN Y F. Cloning and expression of chicken β-defensin 7[J]. Guangdong Agricultural Sciences, 2018, 45(2): 130-134. DOI:10.16768/j.issn.1004-874X.2018.02.021 |
| [17] |
HERTZ C J, WU Q, PORTER E M, ZHANG Y J, WEISMÜLLER K H, GODOWSKI P J, GANZ T, RANDELL S H, MODLIN R L. Activation of Toll-like receptor 2 on human tracheobronchial epithelial cells induces the antimicrobial peptide human beta defensin-2[J]. Journal of Immunology, 2003, 171(12): 6820-6826. DOI:10.4049/jimmunol.171.12.6820 |
| [18] |
BOLATCHIEV A. Antibacterial activity of human defensins against Staphylococcus aureus and Escherichia coli[J]. PeerJ, 2020, 8: e10455. DOI:10.7717/peerj.10455 |
| [19] |
HUANG C, YANG X, HUANG J, LIU X, YANG X, JIN H, HUANG Q, LI L, ZHOU R. Porcine Beta-defensin 2 provides protection against bacterial infection by a direct bactericidal activity and alleviates inflammation via interference with the TLR4/NF-κB pathway[J]. Frontiers in Immunology, 2019, 10: 1673. DOI:10.3389/fimmu.2019.01673 |
| [20] |
JEON H, LE M T, AHN B, CHO H S, LE V C Q, YUM J, HONG K, KIM J H, SONG H, PARK C. Copy number variation of PR-39 cathelicidin, and identification of PR-35, a natural variant of PR-39 with reduced mammalian cytotoxicity[J]. Gene, 2019, 692: 88-93. DOI:10.1016/j.gene.2018.12.065 |
| [21] |
HOLANI R, SHAH C, HAJI Q, INGLIS G D, UWIERA R R E, COBO E R. Proline-arginine rich (PR-39) cathelicidin: Structure, expression and functional implication in intestinal health[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2016, 49: 95-101. DOI:10.1016/j.cimid.2016.10.004 |
| [22] |
HUANG J, QI Y, WANG A, HUANG C, LIU X, YANG X, LI L, ZHOU R. Porcine β-defensin 2 inhibits proliferation of pseudorabies virus in vitro and in transgenic mice[J]. Virology Journal, 2020, 17(1): 18. DOI:10.1186/s12985-020-1288-4 |
| [23] |
HAIWEN Z, RUI H, BINGXI Z, QINGFENG G, BEIBEI W, JIFENG Z, XUEMEI W, KEBANG W. Cathelicidin-derived PR39 protects enterohemorrhagic Escherichia coli O157:H7 challenged mice by improving epithelial function and balancing the microbiota in the intestine[J]. Scientific Reports, 2019, 9(1): 9456. DOI:10.1038/s41598-019-45913-6 |
| [24] |
陈鹏杨, 张庆, 姜淑贞. 里岔黑猪与"杜长大"三元猪生长性能和免疫性能的对比研究[J]. 猪业科学, 2017, 34(1): 131-133. CHEN P Y, ZHANG Q, JIANG S Z. Comparative study on the growth and immunity performance of Lichuan black pigs and "Du Changda" ternary pigs[J]. Swine Science, 2017, 34(1): 131-133. |
| [25] |
王塑天, 潘婕, 胡斌, 李宝红, 杜宗亮, 吴珍芳, 李剑豪, 孟繁明. 广东地区藏猪繁殖、屠宰和肉质性状调查分析[J]. 广东农业科学, 2020, 47(6): 78-83. DOI:10.16768/j.issn.1004-874X.2020.06.011 WANG S T, PAN J, HU B, LI B H, DU Z L, WU Z F, LI J H, MENG F M. Investigation and analysis of breeding, slaughtering and meat quality traits of Tibetan pigs in Guangdong[J]. Guangdong Agricultural Sciences, 2020, 47(6): 78-83. DOI:10.16768/j.issn.1004-874X.2020.06.011 |
| [26] |
LI M, TIAN S, JIN L, ZHOU G, LI Y, ZHANG Y, WANG T, YEUNG C K, CHEN L, MA J. Genomic analyses identify distinct patterns of selection in domesticated pigs and Tibetan wild boars[J]. Nature Genetics, 2013, 45(12): 1431-1438. DOI:10.1038/ng.2811 |
| [27] |
CHENG C, SUN W K, LIU R, WANG R M, CHEN Y H, WANG Y, LI J L, LU X B, GAO R. Comparison of gene expression of Toll-like receptors and antimicrobial peptides in immune organs and tissues between Yorkshire and Tibetan pigs[J]. Animal Genetics, 2015, 46(3): 272-279. DOI:10.1111/age.12286 |
| [28] |
UDDIN M J, KAEWMALA K, TESFAYE D, THOLEN E, LOOFT C, HOELKER M, SCHELLANDER K, CINAR M U. Expression patterns of porcine Toll-like receptors family set of genes (TLR1-10) in gut-associated lymphoid tissues alter with age[J]. Research in Veterinary Science, 2013, 95(1): 92-102. DOI:10.1016/j.rvsc.2013.01.027 |
| [29] |
张敬梅, 顾以韧, 李江淩, 陈晓晖, 曾凯, 吕学斌, 高荣. 乌金猪、青峪猪和成华猪免疫器官与组织Toll样受体和抗菌肽基因表达比较研究[J]. 四川动物, 2018, 37(5): 525-532. DOI:10.11984/j.issn.1000-7083.20180086 ZHANG J M, GU Y L, LI J L, CHEN X H, ZENG K, LYU X B, GAO R. Comparative study on the expression of Toll-like receptor and antimicrobial peptide genes in immune organs and tissues of Wujin, Qingyu and Chenghua pigs[J]. Sichuan Animals, 2018, 37(5): 525-532. DOI:10.11984/j.issn.1000-7083.20180086 |
| [30] |
LIANG W, MENG X, ZHEN Y, ZHANG Y, HU X, ZHANG Q, ZHOU X, LIU B. Integration of transcriptome and proteome in lymph nodes reveal the different immune responses to PRRSV between PRRSVresistant tongcheng pigs and PRRSV-susceptible Large White pigs[J]. Frontiers in Genetics, 2022, 13: 800178. DOI:10.3389/fgene.2022.800178 |
| [31] |
HARTL D, TIROUVANZIAM R, LAVAL J, GREENE C M, HABIEL D, SHARMA L, YILDIRIM A, DELA CRUZ C S, HOGABOAM C M. Innate immunity of the lung: From basic mechanisms to translational medicine[J]. Journal of Innate Immunity, 2018, 10(5/6): 487-501. DOI:10.1159/000487057 |
| [32] |
LEWIS S M, WILLIAMS A, EISENBARTH S C. Structure and function of the immune system in the spleen[J]. Science Immunology, 2019, 4(33): eaau6085. DOI:10.1126/sciimmunol.aau6085 |
| [33] |
BUETTNER M, BODE U. Lymph node dissection--understanding the immunological function of lymph nodes[J]. Clinical and Experimental Immunology, 2012, 169(3): 205-212. DOI:10.1111/j.1365-2249.2012.04602.x |
(责任编辑 崔建勋)
 2024, Vol. 51
2024, Vol. 51