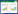文章信息
基金项目
- 广东省自然科学基金(2021A1515010498);广东省农业科学院协同创新中心项目(XT202305);广东省畜禽疫病防治研究重点实验室项目(2023B1212060040)
作者简介
- 马艳平(1984—),女,博士,副研究员,研究方向为水产病害防控,E-mail: mayanping2292@163.com.
通讯作者
- 刘振兴(1981—),男,博士,研究员,研究方向为水产病害防控,E-mail: liuzhenxing@gdaas.cn.
文章历史
- 收稿日期:2023-11-22
2. 汕尾市农业科学院,广东 汕尾 516600;
3. 广东省农业科学院蚕业与农产品加工研究所,广东 广州 510640
2. Shanwei Academy of Agricultural Sciences, Shanwei 516600, China;
3. Sericultural & Agri-food Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
【研究意义】细胞肿大病毒属病毒严重威胁海水鱼养殖业安全,易感宿主包括鲈形目、鳕形目、鲽形目和鲀形目等100多种鱼类[1-3]。花鲈虹彩病毒(Lateolabrax maculatus iridovirus,LMIV)隶属于虹彩病毒科细胞肿大病毒属,发病花鲈具有脾脏肿大的典型症状。我们已从发病花鲈体内分离到该病毒,根据细胞肿大病毒属成员主衣壳蛋白(Major caspid protein,MCP)基因序列同源性比对,发现LMIV为真鲷虹彩病毒(Red sea bream iridovirus,RSIV)的变异株,致死率超过90%,最高可达100%[4]。建立一种高效、快速、灵敏的现场检疫检测方法,对于该病的及时发现、有效防治意义重大。
【前人研究进展】基于核酸检测的快速检测技术在水生动物苗种产地检疫、疫病监测等方面发挥重要作用,如常规PCR检测[5-6]、实时荧光定量检测[7-10]、环介导等温扩增技术(LAMP)检测[11-12]等,但不同检测方法各有利弊。常规PCR检测需要专业的PCR仪器和电泳分析等后续操作;实时荧光定量检测耗时相对较短,但检测成本高,需设计荧光探针,并且需要购置相对昂贵的仪器,同时还要求操作人员有较系统的专业知识;LAMP检测的灵敏度高,但易产生气溶胶,使试验结果易受到污染,产生假阳性。随着分子生物学技术的快速发展,Fang等[13]开发了新型核酸等温扩增技术——交叉引物恒温扩增技术(Cross priming amplification,CPA),根据体系中交叉引物的数量可分为单交叉引物恒温扩增(Single-CPA)和双交叉引物恒温扩增(Double-CPA)。其技术原理是针对目的基因4~5个区域设计4~5条特异性引物,利用具有链置换特性的Bst DNA聚合酶,在63 ℃条件下高效、快速、高特异地扩增靶序列。CPA技术不需要专门的温度循环仪器,只需简单的恒温装置即可进行快速扩增,极大降低经济成本,目前已在转基因食品检测、农产品质量安全检测、疫病检测等领域广泛应用。【本研究切入点】据《中国渔业统计年鉴2023》显示,我国花鲈养殖产量达到21.81万t,占海水鱼总产量的11.33%,位居全国海水鱼养殖产量第2位。其中广东省花鲈养殖产量13.82万t,占全国花鲈养殖产量的63.37%,位居广东省海水鱼养殖产量第1位[14]。但随着花鲈集约化养殖规模的不断扩大,花鲈养殖业病害频发且日趋严重,造成极大的经济损失,严重威胁花鲈养殖业的稳定与发展[14-17]。【拟解决的关键问题】 LMIV引起的海水养殖鱼类疾病日益加剧,且通常发病迅速、难以治疗,因此本研究拟采用交叉引物恒温扩增技术并结合一次性核酸试纸条,建立LMIV-CPA现场快速检测技术,为LMIV的准确快速诊断和有效防控提供技术手段。
1 材料与方法 1.1 试验材料供试花鲈虹彩病毒(LMIV)、锦鲤疱疹病毒(Koi herpesvirus,KHV)、鲤浮肿病毒(Carp edema virus,CEV)、大肠杆菌(Escherichia coli)、无乳链球菌(Streptococcus agalactiae)、肺炎克雷伯菌(Klebsiella pneumoniae)、嗜水气单胞菌(Aeromonas hydrophila)为广东省农业科学院动物卫生研究所水产病害研究室分离并保存;中华鳖虹彩病毒病毒(Soft-shell turtle iridovirus,STIV)核酸、斑点叉尾鮰病毒(Channel catfish virus,CCV)核酸、流行性造血器官坏死病毒(Epizootic haematopoietic necrosis virus,EHNV)核酸由中国检验检疫科学研究院张旻博士惠赠。临床检测样品为2018年1月至2023年11月期间由广东省农业科学院动物卫生研究所水产病害研究室收集。
TIANamp Genomic DNA Kit购自TIANGEN生物工程有限公司;10×Thermopol Reaction Buffer、MgSO4、dNTPs、Betaine、Bst DNA聚合酶购自New England Biolabs公司;一次性核酸试纸条及配套缓冲液购自杭州优思达生物公司。
1.2 引物设计根据LMIV保守基因ATPase片段设计1套单交叉引物(1对外引物F3/B3,1对探针引物B1/B2,1个交叉引物CPF),以及ATPase片段特异性扩增引物MATPase-F和MATPase-R(表 1),由生工生物工程(上海)股份有限公司合成,引物稀释为10 μmol/L备用。
1.3 LMIV病毒阳性模板的制备
取100 mg感染LMIV的花鲈脾组织,匀浆提取DNA,10倍梯度稀释。以脾组织DNA为模板、MATPase-F和MATPase-R为引物,扩增ATPase保守片段,连接T载体并提取质粒DNA,测定浓度并计算质粒拷贝数。用无核酸酶水调整质粒DNA浓度,10倍梯度稀释,作为后续试验的DNA模板及阳性对照。
1.4 LMIV-CPA基础扩增反应体系的建立参照文献[18]建立LMIV-CPA基础反应体系进行预试验;基础反应体系产生预期的阳性反应后再进行反应体系优化。引物优化主要根据各引物之间的比例进行调节(表 2),选取最优浓度引物组合,采用控制变量法,对扩增体系中的MgSO4、dNTPs、Betaine、Bst DNA聚合酶浓度,以及扩增温度和扩增时间进行优化,确定最佳反应体系和条件。
1.5 LMIV-CPA方法交叉反应检测
以水生动物常见病毒毒株花鲈虹彩病毒(LMIV)、锦鲤疱疹病毒(KHV)、鲤浮肿病毒(CEV)、中华鳖虹彩病毒(STIV)、斑点叉尾鮰疱疹病毒(CCV)、流行性造血器官坏死病毒(EHNV),以及水生动物常见细菌病菌株无乳链球菌、肺炎克雷伯菌、嗜水气单胞菌核酸作为反应模板,用建立好的LMIV-CPA优化体系进行交叉试验。
1.6 LMIV-CPA与常规PCR的灵敏度比较用无核酸酶水调整组织DNA浓度,10倍梯度稀释,共稀释5个梯度,用建立的LMIV-CPA最佳反应体系和常规PCR[19]方法对上述不同浓度组织DNA进行扩增,比较灵敏度差异;用无核酸酶水调整质粒DNA浓度为3.97×1010、3.97×109、3.97×108、3.97×107、3.97×106、3.97×105、3.97×104、3.97×103、3.97×102 copies/µL。用建立的LMIV-CPA方法对上述不同浓度质粒DNA进行扩增。常规PCR检测,则使用WOAH推荐的LMIV特异性引物4F(5'-CGGGGGCAATGACGACTACA-3')和4R(5'-CCGCCTGTGCCTTTTCTGGA-3')[20],PCR反应总体系为25 µL,包括阳性模板1 µL,上下游引物各1 µL,灭菌双蒸水9.5 µL,Taq Mix 12.5 µL;反应条件为94 ℃预变性2 min;94 ℃变性30 s、58 ℃退火1 min、72 ℃延伸30 s,35个循环;72 ℃延伸5 min,4 ℃保存。PCR产物用1% 琼脂糖凝胶电泳,紫外检测并拍照。
1.7 LMIV-CPA的可视化试纸条检测将LMIV-CPA法的扩增产物放入核酸试纸条检测装置中,5 min后通过肉眼即可判读结果。结果判读规则:阳性,出现质控线(C线)和检测线(T线)2条红色条带;阴性,只在质控区出现1条带(C线);不出现任何条带判为无效。
1.8 不同检测方法的检出率比较用建立的LMIV-CPA方法、常规PCR方法检测156份临床样品(已知120份阳性、36份阴性)。按以下公式计算不同检测方法的检出率,综合分析评定不同方法的检测效能:

|
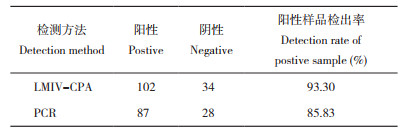
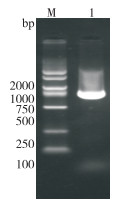
以花鲈脾组织DNA为模版、MATPase-F和MATPase-R为引物,PCR扩增得到720 bp目的片段。切胶回收目的片段,连接T载体,PCR鉴定阳性质粒,并测序验证,阳性质粒命名为ATPase-T质粒(图 1)。提取质粒DNA,浓度经测定为114 µg/mL,质粒浓度为3.92× 1010 copies/µL,对该提取的组织DNA进行梯度稀释,作为后续试验的DNA模板及阳性对照。以质粒DNA为模板,按表 2配制基础反应体系,60 ℃扩增60 min后,反应产物电泳后于紫外灯下观察,阳性模板有特征性的梯形条带,阴性对照无梯形条带(图 2)。结果表明,LMIV-CPA基础反应体系能对LMIV进行有效扩增。
|
| M:DNA Marker;1:ATPase-T质粒 M: DNA Marker; 1: ATPase-T plasmid 图 1 TPase-T质粒PCR鉴定结果 Fig. 1 PCR identification result of ATPase-T plasmid |
|
| M:DNA Marker;1:阴性对照;2:阳性对照 M: DNA Marker; 1: Negative control; 2: Positive control 图 2 LMIV-CPA基础扩增体系电泳结果 Fig. 2 Electrophoresis result of LMIV-CPA basic amplification system |
2.2 LMIV-CPA反应体系优化结果
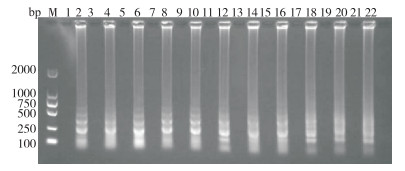
对LMIV-CPA反应体系中的Bst DNA聚合酶、MgSO4、dNTPs、Betaine浓度进行优化,得到的最佳工作浓度分别为0.256 U/µL、6 mmol/L、0.6 mmol /L、0.4 mol/L,以上述的最佳工作浓度对引物浓度进行优化,结果(图 3)显示,当交叉引物CPF为1.0 μmol/L、引物F3和B3均为0.4 μmol/L、探针引物B1(FAM)和B2(Biotin)均为0.8 μmol/L时扩增产物量多,条带较为清晰,为最佳浓度组合。以最佳的Betaine、MgSO4、dNTPs、Bst DNA聚合酶浓度,对扩增温度和扩增时间进行优化,结果(图 4、图 5)显示,LMIV-CPA最适反应条件为58 ℃扩增45 min。

|
| M:DNA Marker;1、3、5、7、9、11为阴性对照;2、4、6、8、10、12的反应时间依次为15、30、45、60、75、90 min M: DNA Markerr; 1, 3, 5, 7, 9, 11 were negative controls; 2, 4, 6, 8, 10, 12 correspond to 15, 30, 45, 60, 75 and 90 min, respectively 图 4 不同反应时间下LMIV-CPA产物电泳结果 Fig. 4 Electrophoresis results of LMIV-CPA products at different reaction times |
|
| M:DNA Marker;1、3、5、7、9、11、13、15、16、17、19、21为阴性对照;2、4、6、8、10、12、14、16、18、20、22的反应温度依次为56、57、58、59、60、61、62、63、64、65、66 ℃ M: DNA Marker; 1, 3, 5, 7, 9, 11, 13, 15, 16, 17, 19 and 21 are negative controls; The temperature of 2, 4, 6, 8, 10, 12, 14, 16, 18, 20 and 22 are 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 and 66℃, respectively 图 5 不同反应温度下LMIV-CPA产物电泳结果 Fig. 5 Electrophoresis results of LMIV-CPA products at different reaction temperatures |
2.3 LMIV-CPA交叉反应检测结果
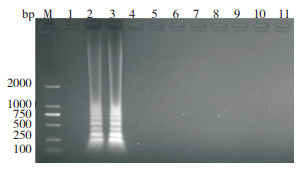
用LMIV-CPA最佳反应体系进行特异性检测试验,结果(图 6)显示,仅LMIV质粒和病毒DNA出现典型的梯状条带,其余均无反应条带,说明建立的LMIV-CPA方法特异性较好。
|
| M:DNA Marker;1:阴性对照;2:LMIV阳性组织DNA;3:阳性质粒DNA;4:锦鲤疱疹病毒(KHV)核酸;5:鲤浮肿病毒(CEV)核酸;6:中华鳖虹彩病毒(STIV)核酸;7:斑点叉尾鮰疱疹病毒(CCV)核酸;8:流行性造血器官坏死病毒(EHNV)核酸;9:无乳链球菌核酸;10:肺炎克雷伯菌核酸;11:嗜水气单胞菌核酸 M: DNA Marker; 1: Negative control; 2: Tissue DNA of LMIV; 3: Positive plasmid DNA; 4: KHV DNA; 5: CEV DNA; 6: STIV DNA; 7: CCV DNA; 8: EHNV DNA; 9: Streptococcus Agalactiae DNA; 10: Klebsiella pneumoniae DNA; 11: Aeromonas hydrophila DNA 图 6 LMIV-CPA交叉反应电泳结果 Fig. 6 Electrophoresis results of LMIV-CPA cross-reaction |
2.4 LMIV-CPA与常规PCR的灵敏度比较
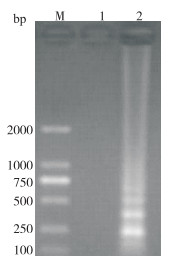
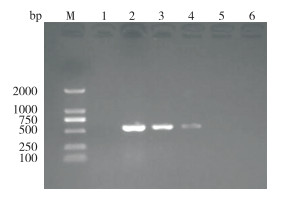
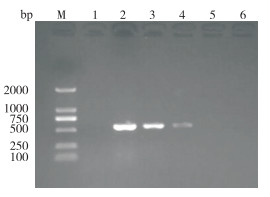
用LMIV-CPA最佳反应体系和常规PCR方法对梯度稀释10倍的花鲈脾组织DNA进行扩增,结果(图 7)显示,LMIV-CPA能检出103倍稀释的组织DNA,而PCR方法只能检出102倍稀释液的组织DNA(图 8),可见LMIV-CPA的灵敏度较常规PCR高10倍。
|
| M:DNA Marker;1:阴性对照;2~6:分别为组织DNA原液、10、102、103、104倍稀释液 M: DNA Marker; 1: Negative control; 2-6: DNA tissue solution, DNA tissue diluted 10, 102, 103, 104 times, respectively 图 7 以DNA为模板的LMIV-CPA灵敏度反应电泳结果 Fig. 7 LMIV-CPA sensitivity reaction electrophoresis results with DNA as template |
|
| M:DNA Marker;1:阴性对照;2~6:分别为组织DNA原液、10、102、103、104倍稀释液 M: DNA Marker; 1: Negative control; 2-6: DNA tissue solution, DNA tissue diluted 10, 102, 103, 104 times, respectively 图 8 常规PCR反应产物电泳结果 Fig. 8 Electrophoresis results of conventional PCR reaction products |
用LMIV-CPA最佳反应体系进行灵敏度检测试验,结果(图 9)显示,LMIV质粒DNA浓度在3.97×1010~3.97×102 copies/µL时,均有大量扩增,阴性对照和3.97×101 copies/µL无扩增,即建立的LMIV-CPA方法最低检出限为3.97×102 copies/µL。
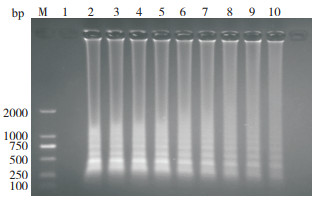
|
| M:DNA Marker;1:阴性对照;2~10:LMIV质粒DNA分别3.97×1010、3.97×109、3.97×108、3.97×107、3.97×106、3.97×105、3.97×104、3.97×103、3.97×102 copies/µL M: DNA Marker; 1: Negative control; 2-10: LMIV plasmid DNA concentrations were 3.97×1010, 3.97×109, 3.97×108, 3.97×107, 3.97×106, 3.97×105, 3.97×104, 3.97×103 and 3.97×102 copies/µL respectively 图 9 LMIV-CPA灵敏度检测反应产物电泳结果 Fig. 9 Electrophoresis results of reaction products detected by LMIV-CPA sensitivity |
2.5 LMIV-CPA的可视化试纸条检测结果
应用一次性核酸试纸条检测装置对2.3、2.4中LMIV-CPA扩增的各个产物进行检测,结果显示,交叉反应产物中,仅病毒DNA和质粒DNA阳性对照结果显示为阳性,其余为阴性(图 10);灵敏度检测反应产物中,LMIV质粒DNA浓度在3.97×1010 ~3.97×102 copies/µL时,检测结果为阳性,阴性对照和3.97×101 copies/µL为阴性(图 11)。

|
| 1:阴性对照;2:花鲈虹彩病毒攻毒感染花鲈后提取的组织DNA;3:花鲈虹彩病毒质粒DNA;4:锦鲤疱疹病毒(KHV);5:鲤浮肿病毒(CEV);6:中华鳖虹彩病毒(STIV);7:斑点叉尾鮰病毒(CCV);8:流行性造血器官坏死病毒(EHNV);9:无乳链球菌;10:肺炎克雷伯菌;11:嗜水气单胞菌 1: Negative control; 2: Tissue DNA extracted from Lateolabrax maculatus infected by LMIV; 3: Plasmid DNA of LMIV; 4: KHV; 5: CEV; 6: STIV; 7: CCV; 8: EHNV; 9: Streptococcus Agalactiae; 10: Klebsiella pneumoniae; 11: Aeromonas hydrophila 图 10 LMIV-CPA交叉反应产物可视化试纸条检测结果 Fig. 10 Visual strip test results of LMIV-CPA reaction products |

|
| 1:阴性对照,2~11:LMIV质粒DNA浓度依次为3.97×1010、3.97×109、3.97×108、3.97×107、3.97×106、3.97×105、3.97×104、3.97×103、3.97×102、3.97×101 copies/µL 1: Negative control, 2-11: LMIV plasmid DNA concentrations were 3.97×1010, 3.97×109, 3.97×108, 3.97×107, and 3.97×106, 3.97×105, 3.97×104, 3.97×103 and 3.97×102 copies/µL, respectively 图 11 LMIV-CPA灵敏度检测反应产物可视化试纸条检测结果 Fig. 11 Visual strip test results of LMIV-CPA sensitivity detection reaction products |
2.6 不同检测方法的检出率
用建立的LMIV-CPA方法和常规PCR方法检测156份临床样品。已知的120份标准阳性样品中,经LMIV-CPA和PCR检测出的真阳性样品分别为112份和103份;36份标准阴性样品中,LMIV-CPA和PCR检测出的真阴性样品分别为34份和28份,两种检测方法的检出率如表 3所示,可见LMIV-CPA检测优于PCR检测。
3 讨论
本研究建立的LMIV-CPA检测方法,只需简单的恒温系统(金属浴或水浴锅),即可用于现场对病原进行检测,有效克服了环介导等温扩增技术检测病原菌存在的缺陷,在结果观察方面交叉引物恒温扩增技术明显优于环介导等温技术[21],结果判定快速、精确、客观,全过程无需开盖,对扩增产物不会造成气溶胶污染,整个检测过程约耗时1 h。
本试验根据特异性表达基因ATPase为靶基因,设计1套CPA引物,其中对B1和B2的5'端分别标记FAM和Biotin,以便使用一次性核酸试纸条装置对LMIV-CPA扩增产物进行可视化检测。CPA检测特异性和灵敏度与反应体系中的各个组分浓度有很大关系,其中引物自身的序列结构和浓度比例对扩增起决定性作用[22]。因此,在引物设计时尽量减少错配和引物间的互配,从而提高LMIV-CPA的特异性,然后对引物浓度比例、MgSO4浓度、dNTP浓度、Bst DNA聚合酶量、反应温度和时间进行优化,最终确立了LMIV-CPA最佳反应体系和反应条件。
本试验中(CPF︰F3︰B3︰B1︰B2)的浓度比例为(1︰0.4︰0.4︰0.8︰0.8),引物F3和B3需要量最少,其次为探针引物B1和B2,交叉引物CPF所需量最多,这符合CPA引物工作原理。Betaine对试验结果影响很大,体系中一定量的Betaine能提高引物对目的基因的结合,降低非目的基因对核酸扩增的干扰[23]。Betaine不存在时,有少量特异性扩增,当Betaine浓度为0.4 mol/L时,扩增效率最佳,随着Betaine浓度的增加,扩增效率逐渐下降。Mg2+能与Bst DNA聚合酶上的活性位点相结合而起催化作用[24],可影响Bst DNA聚合酶活性,当Mg2+浓度过低时,对Bst DNA聚合酶几乎没有催化作用,酶的活性降低,随着Mg2+浓度的增加,其催化作用增强,扩增产物逐渐增多,但Mg2+浓度过高时,会抑制Bst DNA聚合酶的活性而导致扩增产物减少,这与王璐璐[25]的研究结果一致。Bst DNA聚合酶只需要少量即可有5' → 3' 聚合酶活性和强链置换活性,考虑成本,我们选择Bst DNA聚合酶的最佳工作浓度为0.256 U/µL。反应温度也影响Bst DNA聚合酶的活性,LMIV-CPA扩增体系在56~66 ℃下均有扩增,其中58℃扩增效率最好,62 ℃起扩增产物条带不明显,扩增效率下降。扩增时间也是影响扩增效率的一大因素,扩增时间在30~60 min时,扩增效率较好,扩增时间低于30 min或者高于60 min,扩增效率不佳,本试验中,扩增时间为45 min时扩增效率最佳。
虹彩病毒科有包括ATPase、主衣壳蛋白MCP、解旋酶、胞嘧啶甲基转移酶基因、蛋白激酶、核糖核酸还原酶小亚单位等26个核心基因片段[26]。ATPase是参与氧化磷酸化和生物体能量转换的核心酶,在所有生命形式中都有重要作用[27]。根据文献[28]选用专门扩增细胞肿大病毒属虹彩病毒ATPase基因的特异性引物,产物大小为720 bp,经胶回收再进行克隆,最后随机选样测序,测序结果经NCBI blast比对,显示所测基因序列与笋壳鱼虹彩病毒(JF264208.1MGIV)的ATPase相似度最高、为99.72%,仅有2 bp的差别,与真鲷虹彩病毒(AB666350.RSIV-2HSB)、花鲈虹彩病毒(AB043977.RSIV)、石斑鱼虹彩病毒(AB043978.GIV)的相似率分别为99.58%、99.58%、98.61%,序列高度保守。因此本研究以ATPase为靶基因,设计1套CPA引物,不与常见水产病毒与细菌核酸发生交叉反应,灵敏度优于PCR,确保了本研究建立方法的特异性和灵敏度。
4 结论本研究结合一次性核酸试纸条,建立了基于花鲈虹彩病毒ATPase基因的可视化LMIV-CPA检测方法;该方法最优引物浓度比组合为交叉引物CPF1.0 µmol/L,引物F3和B3均为0.4 μmol/L,探针引物B1(FAM)和B2(Biotin)均为0.8 μmol/L;Mg2+浓度为6 mmol/L、Betaine浓度为0.4 mol/L、dNTP浓度为0.6 mmol/L、Bst DNA聚合酶浓度为0.256 U/µL;最佳反应温度为62℃,最佳反应时间45 min。该检测方法具有良好的灵敏性和特异性,最低检测限可达102 copies/µL,检测灵敏度较常规PCR高约10倍,且不与其他同属常见的水生病毒及水生常见细菌发生交叉反应,在临床样品的快速筛选检测方面有很大优势,操作简单且不需要复杂的仪器设备,满足基层设备简单的要求,可为口岸、养殖场等一线进行动物疫病检测,提供有效的技术支撑。
| [1] |
KIM K H, CHOI K M, JOO M S, KANG G, WOO W S, SOHN M Y, SON H J, KWON M G, KIM J O, KIM D H, PARK C I. Red sea bream iridovirus (RSIV) kinetics in rock bream (Oplegnathus fasciatus) at various fish-rearing seawater temperatures[J]. Animals (Basel), 2022, 12(15): 1978. DOI:10.3390/ani12151978 |
| [2] |
KURITA J, NAKAJIMA K. Megalocytiviruses[J]. Viruses, 2012, 4(4): 521-538. DOI:10.3390/v4040521 |
| [3] |
QIN P, MUNANG'ANDU H M, XU C, XIE J J. Megalocytivirus and other members of the familyiridoviridaein finfish: A review of the etiology, epidemiology, diagnosis, prevention and control[J]. Viruses, 2023, 15(6): 1359. DOI:10.3390/v15061359 |
| [4] |
LIU Z Z, MA Y P, HAO L. Characterization of three novel cell lines derived from the brain of spotted sea bass: Focusing on cell markers and susceptibility toward iridoviruses[J]. Fish Shellfish Immunology, 2022, 130: 175-185. DOI:10.1016/j.fsi.2022.08.031 |
| [5] |
徐俊. 鳜传染性脾肾坏死病毒流行调查及模拟刺激免疫应答[D]. 上海: 上海海洋大学, 2023. DOI: 10.27314/d.cnki.gsscu.2022.000353. XU J. Investigation on epidemic of infectious spleen and kidney necrosis virus of Siniperca chuatsi and immune response to Poly I: C stimulation[D]. Shanghai: Shanghai Ocean University, 2023. DOI: 10.27314/d.cnki.gsscu.2022.000353. |
| [6] |
王海波, 史成银, 谢国驷, 刘冉阳, 任宁欣. 真鲷虹彩病毒引起养殖斑石鲷大规模死亡的研究[J]. 渔业科学进展, 2020, 41(4): 151-158. DOI:10.19663/j.issn2095-9869.20190430001 WANG H B, SHI C Y, XIE G S, LIU R Y, REN N X. Red seabream iridovirus causing mass mortality in farmed spotted knifejaw, Oplegnathus punctatus[J]. Progress in Fishery Sciences, 2020, 41(4): 151-158. DOI:10.19663/j.issn2095-9869.20190430001 |
| [7] |
KODA S A, SUBRAMANIAM K, HICK P M, HALL E, WALTZEK T, BECKER J A. Partial validation of a TaqMan quantitative polymerase chain reaction for the detection of the three genotypes of Infectious spleen and kidney necrosis virus[J]. PLoS One, 2023, 18(2): e0281292. DOI:10.1371/journal.pone.0281292 |
| [8] |
FONSECA A A J R, LAGUARDIA-NASCIMENTO M, FERREIRA A P S, PINTO C D A, dA SILVA GONCALVES V L, BARBOSA A A S, RIVETTI JUNIOR A V, CAMARGOS M F. Genetic differentiation of megalocytivirus by real time PCR and sequencing[J]. Molecular Biology Reports, 2023, 50(4): 3439-3450. DOI:10.1007/s11033-023-08282-y |
| [9] |
陈平亚, 张亮亮, 吴少荣, 黄纪徽, 王绥家, 吴山楠. 致对虾肝胰腺坏死病副溶血弧菌荧光定量PCR检测方法的建立[J]. 广东农业科学, 2021, 48(11): 119-125. DOI:10.16768/j.issn.1004-874X.2021.11.015 CHEN P Y, ZHANG L L, WU S R, HUANG J W, WANG T J, WU S N. Establishment of real-time PCR for detection of Vibrio parahaemolyticus causing acute hepatopancreas necrosis disease in shrimps[J]. Guangdong Agricultural Sciences, 2021, 48(11): 119-125. DOI:10.16768/j.issn.1004-874X.2021.11.015 |
| [10] |
余波, 罗永成, 徐景峨, 周思旋, 杨莉, 马永兵. 大鲵柱状黄杆菌SYBR Green Ⅰ荧光定量PCR诊断试剂盒的研制[J]. 广东农业科学, 2014, 41(21): 144-148. DOI:10.16768/j.issn.1004-874X.2014.21.037 YU B, LUO Y C, XU J E, ZHOU S X, YANG L, MA Y B. A SYBR green Ⅰ real-time quantitative PCR kit for detection of Flavobacterium columnar of giant salamander[J]. Guangdong Agricultural Sciences, 2014, 41(21): 144-148. DOI:10.16768/j.issn.1004-874X.2014.21.037 |
| [11] |
刘金叶, 冯娟, 刘广峰, 苏友禄, 徐力文, 郭志勋, 王云新. 鲨鱼弧菌LAMP检测方法的建立[J]. 广东农业科学, 2012, 39(3): 146-149. DOI:10.16768/j.issn.1004-874X.2012.03.077 LIU J Y, FENG J, LIU G F, SUN Y L, XU L W, GUO Z X, WANG YX. Rapid detection of Vibrio carchariae by loop-mediated isothermal amplification[J]. Guangdong Agricultural Sciences, 2012, 39(3): 146-149. DOI:10.16768/j.issn.1004-874X.2012.03.077 |
| [12] |
袁向芬, 石素婷, 吕继洲, 吴绍强. 真鲷虹彩病毒LAMP检测方法的建立[J]. 中国动物检疫, 2018, 35(1): 95-99. YUAN X F, SHI S T, LYU J Z, WU S Q. Establishment of LAMP for detection of red sea bream iridovirus[J]. China Animal Health Inspection, 2018, 35(1): 95-99. |
| [13] |
FANG R D, LI X, HU L, YOU Q M, LI J, WU J, XU P, ZHONG H Y, LUO Y, MEI J, GAO Q. Cross-priming amplification for rapid detection of Mycobacterium tuberculosis in sputum specimens[J]. Journal of Clinical Microbiology, 2009, 47(3): 845-847. DOI:10.1128/JCM.01528-08 |
| [14] |
农业农村部渔业渔政管理局. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023. Fisheries Administration, Ministry Agriculture and Rural Affairs of the People's Republic of China. China fishery statistical yearbook [M]. Beijing: China Agriculture Press, 2023. |
| [15] |
陈雪影, 叶彩燕, 柴文君, 黄锦炉, 曾林. 73株海鲈源嗜水气单胞菌的耐药性分析[J]. 安徽农学通报, 2020, 26(17): 110-112. DOI:10.16377/j.cnki.issn1007-7731.2020.17.050 CHEN X Y, YE C Y, CHAI W J, HUANG J L, ZENG L. The resistance to antibiotics of Aeromonas hydrophila isolated from Lateolabrax japonicas[J]. Anhui Agricultural Science Bulletin, 2020, 26(17): 110-112. DOI:10.16377/j.cnki.issn1007-7731.2020.17.050 |
| [16] |
韦成昱, 刘西磊, 李义辉, 杜玉兰, 贾立国. 海鲈养殖的主要疾病与防治技术[J]. 安徽农业科学, 2015, 43(33): 84-85. DOI:10.13989/j.cnki.0517-6611.2015.33.031 WEI C Y, LIU X L, LI Y H, DU Y L, JIA L G. Major diseases in culturing Lateolabrax japonicus and their prevention techniques[J]. Journal of Anhui Agricultural Sciences, 2015, 43(33): 84-85. DOI:10.13989/j.cnki.0517-6611.2015.33.031 |
| [17] |
GUO H W, ZHANG B, WANG P F, ZHAO C, YAN L L, LIN Y X, QIU L H. Spotted sea bass (Lateolabrax maculatus) NOD2 gene involved in the immune response against Vibrio harveyi infection[J]. Journal of Fish Diseases, 2023, 46(8): 897-901. DOI:10.1111/jfd.13794 |
| [18] |
FU W X, LI Y, FU Y T, ZHANG W F, LUO P P, SUN Q Q, YU F Z, WENG S P, LI W D, HE J G, DONG C F. The inactivated ISKNV-Ⅰ vaccine confers highly effective cross-protection against epidemic RSIV-Ⅰ and RSIV-Ⅱ from cultured spotted sea bass Lateolabrax maculatus[J]. Microbiology Spectrum, 2023, 11(3): e0449522. DOI:10.1128/spectrum.04495-22 |
| [19] |
袁旦一, 金亚南, 李玲, 何谦, 胡林, 李晓琪, 孙志勇. 猪圆环病毒2型交叉引物恒温扩增检测方法的建立[J]. 畜牧兽医学报, 2016, 47(9): 1905-1913. DOI:10.11843/j.issn.0366-6964 YUAN D Y, JIN Y N, LI L, HE Q, HU L, LI X Q, SUN Z Y. Establishment of cross priming isothermal amplification for porcine circovirus 2 detection[J]. Acta Veterinaria et Zootechica Sinica, 2016, 47(9): 1905-1913. DOI:10.11843/j.issn.0366-6964 |
| [20] |
JUN K, KAZUHIRO N, IKUO H, TAKASHI A. Polymerase chain reaction (PCR) amplification of DNA of red sea bream iridovirus (RSIV)[J]. Fish Pathology, 1998, 33(1): 17-23. DOI:10.3147/jsfp.33.17 |
| [21] |
张晶, 吴新伟, 陈惠玲, 陈佳璇, 狄飚, 白志军. 交叉引物恒温扩增技术检测创伤弧菌的应用研究[J]. 中国人兽共患病学报, 2019, 35(8): 711-714. DOI:10.2969/j.issn.1002-2694 ZHANG J, WU X W, CHEN H L, CHEN J X, DI S, BAI Z J. Establishment of cross priming amplification assay for detection of Vibrio vulnificus[J]. Chinese Journal of Zoonoses, 2019, 35(8): 711-714. DOI:10.2969/j.issn.1002-2694 |
| [22] |
李聪慧, 徐进, 刘文枝, 周勇, 曾令兵. 锦鲤疱疹病毒单交叉引物等温扩增检测方法的建立[J]. 水产学报, 2015, 39(9): 1422-1431. DOI:10.11964/jfc.20150409805 LI C H, XU J, LIU W Z, ZHOU Y, ZENG L B. Establishment of single cross priming isothermal amplification for Koi herpesvirus detection[J]. Journal of Fisheries of China, 2015, 39(9): 1422-1431. DOI:10.11964/jfc.20150409805 |
| [23] |
MARSHALL P L, KING J L, BUDOWLE B. Utility of amplification enhancers in low copy number DNA analysis[J]. International Journal of Legal Medicine, 2015, 129(1): 43-52. DOI:10.1007/s00414-014-1021-1 |
| [24] |
XU Y M, LIU X L, MA J, LI Y S, HU P, ZOU D Y, GUO X, CHEN X F, TANG F, LIU N N, WEI L B, ZHOU Y, LIU Z S, REN H L, LU S Y. Simple, specific, sensitive and rapid loop-mediated method for detecting Yersinia enterocolitica[J]. Southeast Asian Journal of Tropical Medicine & Public Health, 2014, 45(3): 670-679. |
| [25] |
王璐璐. 交叉引物扩增技术快速检测肠出血性大肠杆菌的研究[D]. 长春: 吉林大学, 2013. WANG L L. Study on development of cross priming amplification method for rapid detection of EHEC[D]. Changchun: Jilin University, 2013. |
| [26] |
EATON H E, METCALF J, PENNY E, TCHEREPANOV V, UPTON C, BRUNETTI C R. Comparative genomic analysis of the family Iridoviridae: Re-annotating and defining the core set of iridovirus genes[J]. Virology Journal, 2007, 4(1): 11. DOI:10.1186/1743-422X-4-11 |
| [27] |
张锐, 张奇亚. 大鲵蛙病毒编码96L蛋白(ADRV-96L) 的腺苷三磷酸酶活性和促进细胞生长作用[J]. 微生物学通报, 2018, 45(5): 1090-1099. DOI:10.13344/j.microbiol.china.170945 ZHANG R, ZHANG Q Y. Adenosine triphosphatase activity and cell growth promotion of Andrias davidianus ranavirus 96L-encoded protein (ADRV-96L)[J]. Microbiology China, 2018, 45(5): 1090-1099. DOI:10.13344/j.microbiol.china.170945 |
| [28] |
HUANG S M, TU C, TSENG C H, HUANG C C, CHOU C C, KUO H C, CHANG S K. Genetic analysis of fish iridoviruses isolated in Taiwan during 2001-2009[J]. Archives of Virology, 2011, 156: 1505-1515. DOI:10.1007/s00705-011-1017-9 |
责任编辑 崔建勋
 2024, Vol. 51
2024, Vol. 51