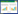文章信息
基金项目
- 上海市自然科学基金(20ZR1423600);上海海洋大学科技发展专项基金(A2-2006-22-2002);国家自然科学基金(31902376)
作者简介
- 何恺轩(1998—),男,在读硕士生,研究方向为特色鱼类养殖,E-mail:1745385732@qq.com.
通讯作者
- 温彬(1987—),男,博士,副教授,研究方向为特色鱼类养殖,E-mail:bwen@shou.edu.cn.
文章历史
- 收稿日期:2023-08-06
【研究意义】七彩神仙鱼(Symphysodon aequifasciatus)隶属鲈形目慈鲷科盘丽鱼属,原产于亚马逊河流域,因其体色艳丽,具有极高的观赏价值,被誉为“观赏鱼之王” [1-2]。七彩神仙鱼具有独特的亲代抚育行为,即孵化后的仔鱼通过啄食亲本体表分泌的粘液获取营养及免疫[3]。七彩神仙鱼子代对亲本皮肤粘液的咬食率呈现先上升后下降的趋势,并于抚育2周左右达到顶峰[4]。尽管抚育期七彩神仙鱼幼鱼不断啄食亲鱼皮肤,但亲鱼皮肤并未遭受感染。探究功能基因在七彩神仙鱼亲代抚育期皮肤免疫防御中的作用具有重要意义。【前人研究进展】研究发现,七彩神仙鱼体表黏液中的免疫球蛋白M含量随亲代抚育过程呈先上升后下降的显著变化[5]。而在无亲代抚育下,七彩神仙鱼仔鱼的死亡率会显著增加[6]。这说明七彩神仙鱼体表粘液在双亲和子代免疫防御中发挥重要作用。嗜乳脂蛋白(Butyrophilin,BTN)属于免疫球蛋白超家族成员,其胞外Ig结构域与B7家族共刺激分子同源,参与机体免疫调节[7]。嗜乳脂蛋白1A1(Butyrophilin 1A1,BTN1A1)最先从乳脂肪球膜的研究中被分离[8],具有抑制细胞因子(IL-2和IFN-γ)分泌,以及通过CD3单克隆抗体刺激CD4+和CD8+ T细胞增殖的功能[9]。在哺乳动物中,嗜乳脂蛋白主要表达在淋巴组织及免疫相关细胞如T细胞、B细胞中[10]。1个嗜乳脂蛋白存在1个或多个配体,同一嗜乳脂蛋白基因在不同刺激下可能表现出不同的表达情况[11]。在对太平洋岩鱼的研究中发现,嗜乳脂蛋白的多态性可能与疾病的发生相关[12]。在细菌脂多糖刺激下,尖吻鲈体内BTN1A1表达会发生显著上升[13]。纹鳢感染嗜水气单胞菌(Aeromonas hydrophila)后,其皮肤组织中的BTN基因表达显著上升[14]。【本研究切入点】 BTN1A1在机体免疫中发挥重要作用,但相关研究主要集中在哺乳动物,对于鱼类研究较少,在七彩神仙鱼机体免疫中的作用尚无报道。我们前期对七彩神仙鱼抚育期的皮肤转录组进行分析,发现BTN1A1基因在不同抚育阶段差异表达显著,BTN1A1-1呈先下降后上升趋势,而BTN1A1-2呈先上升后下降趋势[15],因此,本研究以该对基因作为研究对象作进一步探析。嗜水气单胞菌是水产动物细菌性出血病的病原菌,也是七彩神仙鱼常见病原之一[16-18]。深入研究BTN1A1基因在嗜水气单胞菌感染后的表达模式,有利于揭示BTN1A1在七彩神仙鱼体表粘膜免疫中的潜在功能。【拟解决的关键问题】本研究克隆并分析了七彩神仙鱼BTN1A1-1和BTN1A1-2基因,对其在七彩神仙鱼各组织中的表达情况及其在嗜水气单胞菌感染后的表达模式进行分析,以期揭示BTN1A1在七彩神仙鱼粘膜免疫中的潜在功能,丰富鱼类嗜乳脂蛋白研究,为深入研究BTN1A1在七彩神仙鱼亲代抚育中的功能奠定基础。
1 材料与方法 1.1 试验材料供试七彩神仙鱼来自上海海洋大学滨海养殖基地,其使用获得上海海洋大学实验动物伦理委员会批准(SHOU-DW-2021-026)。嗜水气单胞菌菌株由上海海洋大学国家水生动物病原库提供。选取体重匀称、生长良好且健康的七彩神仙鱼(体长11.0 ± 1.5 cm)72尾,随机平均分至12个水族缸中进行暂养1周,暂养期间保证养殖条件恒定(28.0 ± 0.5℃,pH 7.8 ± 0.5,DO > 6.0 mg/L)。
1.2 试验方法为分析七彩神仙鱼BTN1A1基因的组织表达模式,选取暂养1周后的七彩神仙鱼,在无菌无酶条件下采集心脏、肝脏、脾脏、头肾、肠道、脑、鳃、皮肤9个组织,立即装入冻存管后置于液氮中,-80 ℃保存。
为探究嗜水气单胞菌刺激对七彩神仙鱼BTN1A1基因表达的影响,将12个水族缸分别设置为对照组与感染组,每组各6缸。感染组每尾鱼腹腔注射0.2 mL浓度为1.0×107 CFU/mL的菌液,对照组注射0.2 mL 1×PBS缓冲液[17]。注射后0、6、12、24、48、72 h进行取样,取其脾脏、头肾、肠道、皮肤4个组织,置于液氮中,-80 ℃保存。
1.3 七彩神仙鱼BTN1A1-1和BTN1A1-2基因克隆使用上海生工生物工程股份有限公司UNIQ-10柱式总RNA抽提试剂盒(B511321)对组织样品的RNA进行提取,使用日本Takara公司的PrimeScript RT Master Mix试剂盒(RR036A)对提取的RNA进行反转录。根据前期测得的七彩神仙鱼皮肤转录组数据,选取BTN1A1-1和BTN1A1-2基因的CDS区,使用Primer Premier 5.0进行PCR引物设计(表 1),由上海生工生物工程股份有限公司合成。以七彩神仙鱼皮肤cDNA作为模板,使用C1000 TouchTM PCR仪(Bio-Rad,美国),对BTN1A1-1和BTN1A1-2进行PCR扩增。反应体系为25 μL:金牌Mix(TSE101)22 μL、cDNA 1 μL、上下引物游各1 μL。反应条件:98 ℃预变性1 min;98 ℃变性10 s、56 ℃退火10 s、72 ℃延伸10 s,35个循环;72 ℃延伸1 min。产物经1% 琼脂糖凝胶电泳、胶回收后送至生工生物工程有限公司进行测序。
|
1.4 七彩神仙鱼BTN1A1-1和BTN1A1-2生物信息学分析
使用NCBI ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)对获得的序列查找基因的开放阅读框(ORF),并预测相应的氨基酸序列。将获得的cDNA全长序列与基因组序列比对,得到外显子、内含子相对位置和长度;使用SMART网站(http://smart.emblheidelberg.de/)进行结构域预测;使用ExPASy在线网站(http://web.expasy.org/compute_pi/)对理论等电点(pI)和分子量进行预测;使用SWISS-MODEL(https://swissmodel.expasy.org/interactive)对蛋白质三级结构进行预测;使用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性分析对比;使用MEGA 5.0软件构建NJ系统发育树[19]。
1.5 七彩神仙鱼BTN1A1-1和BTN1A1-2组织表达差异分析采用荧光定量法,以β-actin作为内参基因,对七彩神仙鱼心脏、肝脏、脾脏、头肾、肠道、脑、鳃、皮肤9个组织的BTN1A1-1和BTN1A1-2进行组织表达分析,引物见表 1。反应体系:cDNA模板1.6 μL、ddH2O 6.8 μL、上下游引物各0.8 μL、2×T5 Fast qPCR Mix(TSE301)10 μL。反应条件:95 ℃ 1 min;95 ℃ 10 s、58 ℃ 20 s,40个循环;95 ℃ 10 s、65℃ 5 s、95℃ 5 s。嗜水气单胞菌感染后,提取七彩神仙鱼脾脏、头肾、肠道、皮肤4个组织的cDNA进行表达分析,反应程序同上。所有试验3次重复。试验数据采用2−ΔΔCt法进行相对定量分析,使用SPSS 20.0软件进行单因素方差分析(One-way ANOVA)。
2 结果与分析 2.1 七彩神仙鱼BTN1A1-1和BTN1A1-2基因克隆及结构分析七彩神仙鱼BTN1A1-1(GenBank登录号:OQ815886)和BTN1A1-2(GenBank登录号:OQ815887)的cDNA ORF区序列长度分别为894、1 275 bp,分别编码298、424个氨基酸。BTN1A1-1和BTN1A1-2蛋白质分子量分别为33.2、47.3 kD,理论等电点分别为8.64和8.24。BTN1A1-1具有7个外显子和6个内含子,而BTN1A1-2有6个外显子和5个内含子。结构域预测结果(图 1A)显示,BTN1A1-1包含1个信号肽(13~39 aa)、1个Ig结构域(52~158 aa)、1个Ig_like结构域(174~243 aa)和1个跨膜结构域(252~274 aa);BTN1A1-2包含1个信号肽(1~21 aa)、1个Ig结构域(25~134 aa)、1个lg_like结构域(140~228 aa)、1个跨膜结构域(235~257 aa)和1个胞内结构域(365~386 aa)。BTN1A1-1和BTN1A1-2均参照奶牛BTN1A1模型建模(图 1B),模型一致性分别为30.43%、31.5%,其序列覆盖度分别为69%、47%,相似度均为37%,序列范围分别为44~251 aa和23~226 aa。

|
| 图 1 七彩神仙鱼BTN1A1结构域预测(A)及蛋白三级结构示意图(B) Fig. 1 Domain prediction (A) and tertiary structure diagram (B) of BTN1A1 in Symphysodon aequifasciatus |
2.2 七彩神仙鱼BTN1A1-1和BTN1A1-2同源性及进化分析
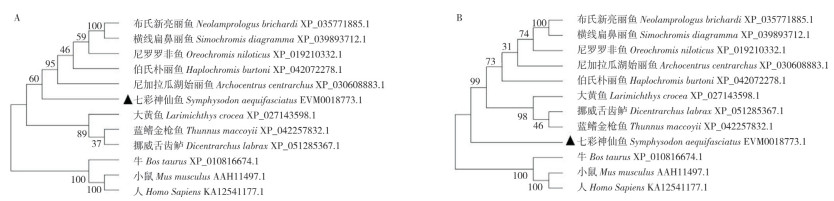
将七彩神仙鱼BTN1A1-1和BTN1A1-2氨基酸序列分别与其他鱼类进行同源性对比,结果(图 2)显示,BTN1A1-1与其他鱼类的同源性较高(59.4%~94.14%),BTN1A1-2与其他鱼类的同源性较低(42%~65.04%)。将七彩神仙鱼BTN1A1-1、BTNB1-2基因分别与尼罗罗非鱼、伯氏朴丽鱼、尼加拉瓜湖始丽鱼、布氏新亮丽鱼、横线扁鼻丽鱼、深裂眶锯雀鲷、大黄鱼、蓝鳍金枪鱼8种鱼类,以及人、牛、小鼠3种哺乳动物构建NJ进化树(图 3),两个进化树均显示鱼类聚为一簇、哺乳动物聚为一簇;BTN1A1-1与同为慈鲷科的尼加拉湖始丽鱼进化关系最近,而BTN1A1-2与其他鱼类的BTN1A1分开单独形成1个分支。

|
| 图 2 七彩神仙鱼BTN1A1-1(A)和BTN1A1-2(B)的氨基酸序列多重比对 Fig. 2 Multiple alignment of amino acid sequences of BTN1A1-1 (A) and BTN1A1-2 (B) in Symphysodon aequifasciatus |
|
| 图 3 七彩神仙鱼BTN1A1-1(A)和BTN1A1-2(B)的NJ进化树 Fig. 3 NJ-based evolutionary tree of BTN1A1-1 (A) and BTN1A1-2 (B) in Symphysodon aequifasciatus |
2.3 七彩神仙鱼BTN1A1-1和BTN1A1-2组织表达分析
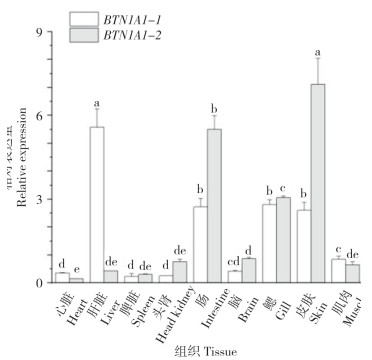
通过荧光定量分析发现,BTN1A1-1和BTN1A1-2基因在七彩神仙鱼各组组织中均有表达,且存在组织表达差异。BTN1A1-1基因主要在肝脏中表达,其次为鳃、肠道、皮肤等器官,在肾脏中的表达量最低;BTN1A1-2基因主要在皮肤中表达,其次为肠道、鳃、脑等组织,在心脏中的表达量最低(图 4)。
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant difference 图 4 七彩神仙鱼BTN1A1-1和BTN1A1-2在不同组织中的表达分析 Fig. 4 Expression analysis of BTN1A1-1 and BTN1A1-2 in different tissues of Symphysodon aequifasciatus |
2.4 七彩神仙鱼BTN1A1-1和BTN1A1-2免疫刺激表达变化
qPCR结果(图 5)显示,嗜水气单胞菌胁迫后BTN1A1-1基因表达呈现先下降后上升的趋势。在肠道组织中,BTN1A1-1表达水平先稍上调,胁迫12 h后为对照组的1.25倍,随后开始显著下降,并在48 h降到最低,为对照组的0.35倍。在皮肤组织中,BTN1A1-1基因表达显著下降,在48 h达到最低值,为对照组的0.15倍,于72 h恢复正常水平。在脾脏组织中,BTN1A1-1基因于胁迫12 h后出现显著下降,于48 h达到最低值,分别为对照组的0.62、0.31倍,于72 h恢复正常水平。在头肾组织中,BTN1A1-1基因表达量在胁迫6~48 h期间均显著低于对照组,于72 h恢复正常水平。
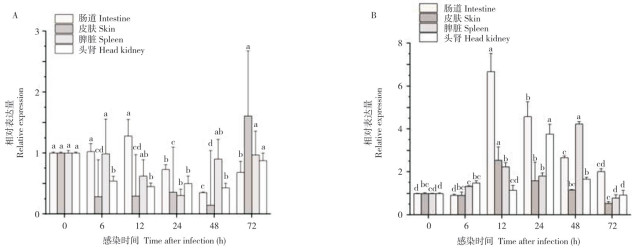
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant difference 图 5 嗜水气单胞菌胁迫后七彩神仙鱼BTN1A1-1(A)、BTN1A1-2(B)在不同组织中的表达分析 Fig. 5 Expression analysis of BTN1A1-1 (A) and BTN1A1-2 (B) in different tissues of Symphysodon aequifasciatus infected by Archocentrus centrarchus |
七彩神仙鱼BTN1A1-2基因在嗜水气单胞菌胁迫后表达量总体呈现先上升后下降的趋势。在肠道组织中,BTN1A1-2基因于胁迫12 h后达到顶峰,为对照组的6.6倍,随后开始显著下降,于72 h恢复正常水平。在皮肤组织中,BTN1A1-2基因于胁迫12 h后达到最高值,为对照组的2.8倍,随后开始显著下降。在脾脏组织中,BTN1A1-2基因从胁迫6 h后开始上升,于48 h达到峰值,为对照组的4.2倍,于72 h恢复正常水平。在头肾组织中,BTN1A1-2基因在胁迫6 h后开始上升,为对照组的1.48倍,于12 h略微下降,为对照组的1.15倍,于24 h达到顶峰,为对照组的3.8倍,随后开始下降,于72 h恢复正常水平。
3 讨论嗜乳脂蛋白是免疫球蛋白超家族成员,在机体免疫中发挥重要作用[20]。已知BTN1A1蛋白经典结构均由1个信号肽、1个Ig结构域、1个Iglike结构域和1个跨膜结构域组成[21]。此外,BTN1A1的Ig结构域位置都较为保守,其胞浆区独特的胞质结构域具有较高的多样性,与其特殊的生理功能相关[22]。本研究发现,BTN1A1-1和BTN1A1-2蛋白都具有BTN蛋白保守结构域,但BTN1A1-2蛋白具有胞质结构域,且在进化上更为特殊。哺乳动物BTN基因家族成员是由8个祖先嗜乳脂蛋白基因经过复制而产生的。在复制过程中,不同物种之间的BTN同源基因会发生差异丢失,进而导致同种基因在不同物种间并不保守。且BTN基因在同一物种间由于同源结构域存在差异,也会导致功能不同[23]。结合本研究结果,BTN1A1-2基因虽然在进化树上与鱼类聚为一簇,但是形成了一个独特的分支,暗示其进化的独特性。
BTN1A1可通过降低T细胞活性从而抑制疾病的发展[24]。肝脏、脾脏、头肾、鳃是鱼的主要免疫器官,肠道和皮肤组织周围由于富含淋巴细胞,与鱼体粘液免疫相关[25]。本研究发现,BTN1A1-1和BTN1A1-2在七彩神仙鱼各个组织中均有表达,且主要在肝脏、肠道、皮肤、鳃等与鱼类免疫相关的组织中表达,故可推断BTN1A1-1和BTN1A1-2在七彩神仙鱼亲代抚育期中与机体免疫相关。皮肤作为鱼体与外界环境隔离的第一道屏障,对保护鱼体免受外界病原体刺激具有重要作用[26-27]。尽管在亲代抚育期七彩神仙鱼小鱼不断啄食亲鱼皮肤,但亲鱼不会受到严重感染,且BTN1A1-1和BTN1A1-2基因在鱼体皮肤组织均有较高表达,故推测其可能在鱼体粘膜免疫中具有重要作用。
已有研究证明,BTN家族参与调控T细胞免疫反应,既可正向调控也可负向抑制[28]。本研究使用荧光定量法检测了嗜水气单胞菌刺激下七彩神仙鱼在BTN1A1-1和BTN1A1-2主要免疫组织中的表达。BTN1A1-1的总体表达量呈现先下降后上升的趋势,这种变化趋势可能是由于其在炎症反应中对T细胞活化产生抑制,从而防止免疫过度所造成的[22]。BTN1A1-2的总体表达量呈现上升趋势,这与其对抑制病菌感染的促进作用有关[20]。在肠道和脾脏中,BTN1A1-1的表达量在嗜水气单胞菌胁迫24 h后才出现显著下降;而在皮肤和肾脏中,则在6 h后就出现显著下降。在皮肤和肠道中,BTN1A1-2的表达量均在胁迫12 h后达到最高峰;而在脾脏和头肾中,其表达分别在48 h和24 h达到最高峰。这种变化可能是由不同免疫组织的不同反应机理造成的。BTN1A1-1和BTN1A1-2在免疫刺激下的表达量变化显著但表达模式不同,表明它们在七彩神仙鱼亲代抚育期发挥不同作用。
4 结论本研究首次克隆了七彩神仙鱼BTN1A1-1和BTN1A1-2基因,对其结构及进化进行分析,并解析了其在嗜水气单胞菌胁迫下的表达情况。结果表明,七彩神仙鱼BTN1A1-1基因相对保守,但BTN1A1-2基因在进化上较为特殊,具有特殊的胞质结构。二者在七彩神仙鱼各组织中均有表达,但在皮肤、肝脏、鳃、肠道等免疫相关组织中表达量均较高,暗示其在七彩神仙鱼机体免疫中具有重要作用。在嗜水气单胞菌刺激下,尽管二者的表达模式在时序上呈现互补关系,但二者表达量均表现出显著差异,暗示其可能在七彩神仙鱼嗜水气单胞菌感染后的免疫防御中发挥重要作用,且发生功能分化。本研究为深入了解鱼类粘膜免疫、研究BTN1A1基因在七彩神仙鱼皮肤粘液免疫中的作用和具体机制奠定基础。
| [1] |
刘颖, 刘怡南, 刘汉鹏, 温彬, 王南, 陈再忠, 高建忠. 饵料钙磷水平对七彩神仙鱼生长、体组成及消化酶活性的影响[J]. 上海海洋大学学报, 2018, 27(6): 833-843. DOI:10.12024/jsou.20180402271 LIU Y, LIU Y N, LIU H P, WEN B, WANG N, CHEN Z Z, GAO J Z. Effects of dietary phosphorus and calcium levels on growth, body composition and digestive enzyme activities of juvenile discus fish (Symphysodon haraldi)[J]. Journal of Shanghai Ocean University, 2018, 27(6): 833-843. DOI:10.12024/jsou.20180402271 |
| [2] |
鲁凯, 高建忠, 温彬, 陈再忠. 黑格尔(Symphysodon discus Heckel)× 松石七彩神仙鱼(Symphysodon discus Turquoise) 杂交后代的遗传变异[J]. 基因组学与应用生物学, 2019, 38(11): 4951-4960. DOI:10.13417/j.gab.038.004951 LU K, GAO J Z, WEN B, CHEN Z Z. Genetic variation of heckel (Symphysodon discus Heckel) and turquoise discus (Symphysodon discus Turquoise) hybrid progeny[J]. Genomics and Applied Biology, 2019, 38(11): 4951-4960. DOI:10.13417/j.gab.038.004951 |
| [3] |
BUCKLEY J, MAUNDER R J, FOEY A, PEARCE J, VAL A L, SLOMAN K A. Biparental mucus feeding: A unique example of parental care in an Amazonian cichlid[J]. Journal of Experimental Biology, 2010, 213(22): 3787-3795. DOI:10.1242/jeb.042929 |
| [4] |
WEN B, ZHOU J Q, GAO J Z, CHEN H R, SHEN Y Q, CHEN Z Z. Sex-dependent changes in the skin mucus metabolome of discus fish (Symphysodon haraldi) during biparental care[J]. Journal of Proteomics, 2020, 221: 103784. DOI:10.1016/j.jprot.2020.103784 |
| [5] |
周建桥, 欧阳明艳, 温彬, 陈再忠, 高建忠. 七彩神仙鱼繁殖间期与繁殖期体表黏液的部分组分分析[J]. 上海海洋大学学报, 2021, 30(1): 39-46. DOI:10.12024/jsou.20190302571 ZHOU J Q, OUYANG M Y, WEN B, CHEN Z Z, GAO J Z. Epidermal mucus components analysis of discus fish (Symphysodon haraldi) during breeding period and interval-breeding period[J]. Journal of Shanghai Ocean University, 2021, 30(1): 39-46. DOI:10.12024/jsou.20190302571 |
| [6] |
SHUN S, HIDEAKI T, MASAHIKO M. Costs and benefits of biparental mucus provisioning in discus fish (Symphysodon aequifasciatus)[J]. Ichthyological Research, 2018, 65(4): 510-514. DOI:10.1007/s10228-018-0636-5 |
| [7] |
FRECH M, OMATA Y, SCHMALZL A, WIRTZ S, TAHER L, SCHETT G, ZAISS M M, SARTER K. Btn2a2 regulates ILC2–T cell cross talk in type 2 immune responses[J]. Frontiers in Immunology, 2022, 13: 757436. DOI:10.3389/FIMMU.2022.757436 |
| [8] |
LU Y Z, ZHOU T, XU C S, WANG R, FENG D Y, LI J Y, WANG X, KONG Y, HU G H, KONG X Y, LU P F. Occludin is a target of Src kinase and promotes lipid secretion by binding to BTN1a1 and XOR.[J]. PLoS Biology, 2022, 20(1): e3001518. DOI:10.1371/JOURNAL.PBIO.3001518 |
| [9] |
SMITH L A, KNEZEVIC B R, AMMANN J U, RHODES D A, AW D, PALMER D B, MATHER L H, TROWSDALE J. BTN1A1, the mammary gland butyrophilin, and BTN2A2 are both inhibitors of T cell activation[J]. Journal of Immunology, 2010, 184(7): 3514-3525. DOI:10.4049/jimmunol.0900416 |
| [10] |
DANG A T, STRIETZ J, ZENOBI A, KHAMENEH H J, BRANDL S M, LOZZA L, CONRADT G, KAUFMANN S H E, REITH W, KWEE I, MINGUET S, CHELBI S T, GUARDA G. NLRC5 promotes transcription of BTN3A1-3 genes and Vγ9Vδ2 T cell-mediated killing[J]. iScience, 2021, 24(1): 101900. DOI:10.1016/J.ISCI.2020.101900 |
| [11] |
MESSAL N, MAMESSIER E, SYLVAIN A, CELISGUTIERREZ J, THIBULT M, CHETAILLE M, FIRAGUAY G, PASTOR S, GUILLAUME Y, WANG Q. Differential role for CD277 as a co-regulator of the immune signal in T and NK cells[J]. European Journal of Immunology, 2011, 41(12): 3443-3454. DOI:10.1002/eji.201141404 |
| [12] |
KOLORA S R R, OWENS G L, VAZQUEZ J M, STUBBS A, CHATLA K, JAINESE C, SEETO K, MCCREA M, SANDEL M W, VIANNA J A, MASLENIKOV K, BACHTROG D, ORR J W, LOVE M, SUDMANT P H. Origins and evolution of extreme life span in Pacific Ocean rockfishes[J]. Science, 2021, 374(6569): 842-847. DOI:10.1126/SCIENCE.ABG5332 |
| [13] |
XIA J H, LIU P, LIU F, LIN G, SUN F, TU R, YUE J H. Analysis of stress-responsive transcriptome in the intestine of Asian seabass (Lates calcarifer) using RNA-seq[J]. DNA Research, 2013, 20(5): 449-460. DOI:10.1093/dnares/dst022 |
| [14] |
KUMARESAN V, PASUPULETI M, PARAY B A, AL-SADOON M K, AROCKIARAJ J. Gene profiling of antimicrobial peptides, complement factors and MHC molecules from the skin transcriptome of Channa striatus and its expression pattern during Aeromonas hydrophila infection[J]. Fish and Shellfish Immunology, 2019, 84: 48-55. DOI:10.1016/j.fsi.2018.09.061 |
| [15] |
LIU X, DING X F, WEN B, MA T F, WANG Q, LI Z J, ZHANG Y S, GAO J Z, CHEN Z Z. Genome-wide identification and skin expression of immunoglobulin superfamily in discus fish (Symphysodon aequifasciatus) reveal common genes associated with vertebrate lactation[J]. Gene, 2023, 862: 147260-147260. DOI:10.1016/J.GENE.2023.147260 |
| [16] |
叶伟东, 郭成, 曹海鹏, 杨先乐. 加州鲈出血病嗜水气单胞菌的分离鉴定、致病性和体外抑菌药物研究[J]. 淡水渔业, 2018, 48(5): 54-60. DOI:10.13721/j.cnki.dsyy.2018.05.009 YE W D, GUO C, CAO H P, YANG X L. Isolation, identification, pathogenicity and in vitro antibacterial drugs of pathogenic Aeromonas hydrophila from Micropterus salmoides with hemorrhagic diseas[J]. Freshwater Fisheries, 2018, 48(5): 54-60. DOI:10.13721/j.cnki.dsyy.2018.05.009 |
| [17] |
翟文娅, 李博, 王济秀, 王焕岭, 刘红. 团头鲂SOCS家族基因的分子特征及其对嗜水气单胞菌胁迫的响应[J]. 华中农业大学学报, 2022, 41(6): 222-229. DOI: 10.13300/j.cnki.hnlkxb.2022.06.026. ZHAI W Y, LI B, WANG J X, LIU H. Molecular characterization of SOCS family genes in Megalobrama amblycephala and their responses to Aeromonas hydrophila infection[J]. Journal of Huazhong Agricultural University, 2022, 41(6): 222-229. DOI: 10.13300/j.cnki.hnlkxb.2022.06.026. |
| [18] |
EL-GHANY N A A, EL-KHATIB N R, SALAMA S S A. Causes of mortality in discus fish (Symphysodon) and trials for treatment[J]. Egyptian Journal for Aquaculture, 2014, 4(2): 1-12. |
| [19] |
包琦, 赵凯, 段子渊. 猪Btnl5基因的克隆、表达分析及对NF-κB信号通路的调控作用[J]. 生物技术通报, 2017, 33(6): 142-148. DOI:10.13560/j.cnki.biotech.bull.1985.2016-1151 BAO Q, ZHAO K, DUAN Z Y. Cloning, expression analysis and regulation to NF-κB pathway of Btnl5 in porcine[J]. Biotechnology Bulletin, 2017, 33(6): 142-148. DOI:10.13560/j.cnki.biotech.bull.1985.2016-1151 |
| [20] |
HERRMANN T, KARUNAKARAN M M. Butyrophilins: γδ T cell receptor ligands, immunomodulators and more[J]. Frontiers in Immunology, 2022, 13: 876493. DOI:10.3389/FIMMU.2022.876493 |
| [21] |
MAGDALENA M, TOKARZ-DEPTULA B, DEPTULA W. Butyrophilins: An important new element of resistance[J]. Central-European Journal of Immunology, 2017, 42(4): 399-403. DOI:10.5114/ceji.2017.72806 |
| [22] |
陶璐, 周嘉青, 黄一可, 张正华. 嗜乳脂蛋白家族研究进展: 超越乳脂球膜到调节免疫[J]. 国际免疫学杂志, 2020, 43(5): 5. DOI:10.3760/cma.j.issn.1673-4394.2020.05.010 TAO L, ZHOU J Y, HUANG Y K, ZHANG Z H. Advances in the butyrophilin gene family: From milk fat globules to the regulation of the immune response[J]. International Journal of Immunology, 2020, 43(5): 5. DOI:10.3760/cma.j.issn.1673-4394.2020.05.010 |
| [23] |
YANG G, ATTARDO G M, LOHS C, AKSOY S. Molecular characterization of two novel milk proteins in the tsetse fly (Glossina morsitans morsitans)[J]. Insect Molecular Biology, 2010, 19(2). DOI:10.1111/j.1365-2583.2009.00987.x |
| [24] |
JAEKWANG J, KADEGOWDA A K G, MEYER T J, JENKINS L M, DINAN J C. The butyrophilin 1a1 knockout mouse revisited: Ablation of Btn1a1 leads to concurrent cell death and renewal in the mammary epithelium during lactation[J]. FASEB BioAdvances, 2021, 3(12): 971-997. DOI:10.1096/FBA.2021-00059 |
| [25] |
YAO J, MU W, LIU S, ZHANG J, WEN H S, LIU Z J. Identification, phylogeny and expression analysis of suppressors of cytokine signaling in channel catfish[J]. Molecular Immunology, 2015, 64(2): 276-284. DOI:10.1016/j.molimm.2014.12.003 |
| [26] |
刘晓晨, 佟长青, 李伟. 鱼类体表黏液研究进展[J]. 农产品加工, 2022(1): 66-69. DOI:10.16693/j.cnki.1671-9646(X).2022.01.014 LIU X C, DONG C Q, LI W. Research progression in fish skin mucou[J]. Farm Products Processing, 2022(1): 66-69. DOI:10.16693/j.cnki.1671-9646(X).2022.01.014 |
| [27] |
XIE X, MA R R, QIAN D, YU Y B, LIU X, LEI Y H, LIN Y N, YIN F. MicroRNA regulation during Nibea albiflora immunoresistant against Cryptocaryon irritans challenge in fish skin[J]. Aquaculture, 2019, 507: 211-221. DOI:10.1016/j.aquaculture.2019.04.034 |
| [28] |
ZHOU J, ZHANG J J, TAO L, PENG K X, ZHANG Q A, YAN K X, LUAN J, PAN J W, SU X H, SUN J P, ZHANG Z H, SHEN L. Up-regulation of BTN3A1 on CD14+ cells promotes Vγ9Vδ2 T cell activation in psoriasis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(44): e2117523119. DOI:10.1073/PNAS.2117523119 |
(责任编辑 崔建勋)
 2024, Vol. 51
2024, Vol. 51