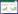文章信息
基金项目
- 国家自然科学基金(82373976); 广东省乡村振兴战略专项资金种业振兴项目(GDNK20230331); 云浮市科技创新战略专项(202301)
作者简介
- 陈立凯,博士,副研究员,博士生导师,广州中医药大学杏林引进人才、中药资源学教研室副主任。主要从事南药种质资源保护、评价与质量遗传调控研究及南药新品种选育推广工作,主持国家自然科学基金、广东省自然科学基金各2项,主要参与国家重点研发专项、广东省重点研发专项、广东省种业振兴项目等项目12项;在《 Food Research International》《 Horticulture Research》《 Journal of Agricultural and Food Chemistry》《 Industrial Crops and Products》等期刊发表论文30余篇;参编出版《中药资源学》国家规划教材2部;曾获广东省科技进步一等奖1项,指导大学生创新创业大赛国赛等获奖6项;参与标准制定5项;参与选育广东省农业主导品种1个;兼任国家自然科学基金评审专家、广东省现代农业产业技术体系创新团队岗位专家(广东南药产业技术体系)、广东省南药种植标准化技术委员会委员、广东省中药材种植行业协会专家。陈立凯(1986—),男,博士,副研究员,研究方向为中药资源利用与药效成分的遗传调控,E-mail: chenlk@gzucm.edu.cn.
文章历史
- 收稿日期:2024-01-06
2. 岭南中药资源教育部重点实验室(广州中医药大学),广东 广州 510006
2. Key Laboratory of Chinese Medicinal Resource from Lingnan, Ministry of Education (Guangzhou University of Chinese Medicine), Guangzhou 510006, China
【研究意义】广藿香〔Pogostemon cablin(Blanco)Benth.〕作为一种重要的药用植物,广泛分布于亚热带和热带地区,其地上部分可入药,味辛,性微温,归脾、胃、肺经,具有芳香化浊、发表解暑、和中止呕的作用[1],是广东省大宗道地中药材。此外,广藿香提取物和精油还被广泛用于食品及日用化妆品行业[2-3],市场需求旺盛[4-5]。广藿香中存在多种活性成分,其中广藿香醇(Patchouli alcohol)是其主要活性成分之一,也是2020年版《中国药典》评价广藿香药材及广藿香油质量的关键指标[1]。现代药理学研究表明,广藿香醇具有抗病毒、抗菌、抗氧化、抗炎等多种生物活性[6],对人类健康具有重要意义。广藿香是广藿香醇的唯一天然来源,其自然资源有限,且产量和质量表现不稳定,限制了其在医药和香料行业中的开发与利用。因此,深入探究广藿香醇的生物合成及调控机制,揭示环境与代谢互作的内在规律,具有重要的科学意义。这将为代谢工程技术在广藿香药用资源保护和生产管理中的应用提供理论支撑,进而促进广藿香药材品质的保障和提升。
【前人研究进展】目前,广藿香醇生物合成途径已得到基本解析。其中,合成途径下游的广藿香醇合酶(Patchouli alcohol synthase,PcPTS)催化法尼基焦磷酸生成包括广藿香醇在内的多种倍半萜,该酶是广藿香醇生物合成途径中的关键酶[7],也是影响广藿香药效品质的重要调控位点。随着研究深入,大量研究表明广藿香醇的生物合成途径是一个复杂的网络,涉及多种酶和多个调控因子的协同作用。PcPTS基因的克隆[8]、表达[9]、酶学功能[10-11]及其在代谢工程[12-14]中的应用多有报道,但关于该基因的具体调节因子和分子互作机制亟待探索。现有研究表明,广藿香醇的合成积累具有时空特异性[15-16],并受到发育阶段、光照、茉莉酸甲酯(Methyl jasmonate,MeJA)、温度等环境因子的影响[17-18]。然而,其生物合成及动态积累的分子调控机制尚不清晰。转录因子在次生代谢物的积累中起着关键作用,因此PcPTS基因的转录调控备受关注。研究发现,某些转录因子(如miR156)可通过调控SQUAMOSA启动子结合蛋白SPLs来影响PcPTS基因的转录水平,从而调控广藿香中倍半萜成分的合成[19]。另有研究指出,其他转录因子如DREB[20]、MYC2a[21]、MYC2b[21]、SWC4[22]等也会响应外源激素MeJA来调控PcPTS的表达,直接影响广藿香醇的合成。
【本研究切入点】对于PcPTS涉及到的蛋白-蛋白互作调控,国内外尚未见研究报道。植物体内的生理生化环境极为复杂,酶活性和理化特性受多重因素调控,包括转录翻译调控、产物抑制、蛋白互作、亚细胞定位及代谢物反馈等[23]。蛋白质协同合作实现细胞功能正常发挥,蛋白互作在调控信号传导、代谢途径和基因表达中起关键作用[24]。在植物次生代谢过程中,合成酶常与其他蛋白发生相互作用,这些互作蛋白影响合成酶的催化活性[25]、稳定性[26]及产物的特异性[27]等,导致代谢物含量与组成变化。此外,MeJA等外源物质能调控萜类代谢,如影响广藿香醇含量[28-29],但其具体机制待解析。因此,筛选PcPTS互作蛋白、比较其在外源激素诱导下的差异变化,对于揭示广藿香醇等萜类药效化合物的合成分子调控机制具有重要意义,为代谢过程解析与调控提供新思路。
【拟解决的关键问题】本研究基于广藿香转录组数据库克隆PcPTS基因,构建广藿香酵母双杂交文库和GST-PcPTS表达载体,利用酵母双杂交技术和GST pull-down联合LC-MS/MS技术,全面筛选并验证PcPTS的互作蛋白,有助于深入揭示PcPTS在广藿香醇生物合成途径中的调节机理,为进一步研究广藿香醇等活性代谢成分合成的分子调控机制奠定坚实基础。
1 材料与方法 1.1 试验材料供式的广藿香材料于2017年11月采集自广州中医药大学时珍山种植基地,扦插苗繁育在岭南中药资源教育部重点实验室的光照培养箱中进行。2018年1月用溶于0.1% 乙醇和0.01% Tween 20的300 μmol/L的MeJA对八叶期生长状态良好的广藿香叶片进行喷洒,作为MeJA处理组;以叶片喷洒0.1% 乙醇和0.01% Tween 20溶剂作为CK对照组,每组设置3个生物学重复,8 h后采集喷湿的第二和第三对叶片样品,保存于-80 ℃备用。
1.2 试验方法1.2.1 PcPTS基因的克隆及重组载体的构建 根据NCBI上的PcPTS基因序列,通过本地Blast从广藿香全长转录组数据库(NCBI:PRJNA528262)中筛选得到全长转录本。利用RNA提取试剂盒(康为世纪公司)获取广藿香总RNA,并通过Vazyme公司的反转录试剂合成cDNA。根据获得的PcPTS全长序列设计引物(表 1),以广藿香cDNA为模板,通过PCR技术扩增PcPTS的cDNA序列。PCR产物纯化后,使用pLB零背景连接试剂盒〔天根生化科技(北京)有限公司〕将其连接到克隆载体pLB上,并转化至DH5α大肠杆菌中培养。挑取单菌落进行PCR鉴定,将阳性克隆送至广州天一辉远基因科技有限公司测序。根据克隆得到的PcPTS基因编码区,设计带有同源臂的引物,利用同源重组法将PcPTS基因连接到pGBKT7载体上(EcoR I和BamH I酶切位点)和pGEX-6P-1载体上(EcoR Ⅰ和Not Ⅰ酶切位点),连接产物转化大肠杆菌DH5α,经菌落PCR和菌液测序结果验证后提取重组质粒pGBKT7-PcPTS(BD-PcPTS)和pGEX-6P-1-PcPTS(GST-PcPTS)。
1.2.2 酵母双杂交cDNA文库构建 利用CTAB法[30]提取广藿香总RNA,并分别通过Thermo Nanodrop核酸分析仪和琼脂糖凝胶电泳检测总RNA的浓度、纯度和完整性。采用FastTrack MGA Maxi mRNA isolation kit(Thermo Fisher scientific Inc.)分离mRNA。按照CloneMiner Ⅱ cDNA Library Construction Kit(Invitrogen)说明书步骤,构建cDNA初级文库。首先,按照说明书获得带有attB接头的attB-flanked cDNA。然后,对合成的cDNA进行分级分离,并与入门载体pDONRTM222进行BP重组反应。最后,通过电击转化的方式将其转化至大肠杆菌DH10B中,构建cDNA初级文库,并对文库容量、重组率和插入片段长度进行鉴定。使用PureLink® HiPure Plasmid Filter Midiprep Kit从初级文库菌液中提取质粒,并与pGADT7-DEST进行LR重组反应。随后将该反应产物转入大肠杆菌DH10B感受态细胞中,以获得次级文库菌液。进一步取50 μL稀释1 000倍的次级文库菌液涂布在含50 μg/mL氨苄青霉素钠的LB培养基上,并进行菌落PCR扩增,以检测库容量、文库重组率和插入片段的大小。从菌液中提取质粒,得到次级文库质粒,用于后续的酵母双杂交共转化。
1.2.3 诱饵载体的毒性和自激活检测 分别将测序正确的BD-PcPTS重组载体和BD空载(阴性对照)转化到酵母菌株Y2HGold中,用SD/-Trp培养基(Coolaber)筛选并观察菌落生长情况。分别挑取诱饵蛋白BD-PcPTS和BD空载(阴性对照)单克隆于10 mL SD/-Trp液体培养基中,调整OD600值使诱饵菌液与空载对照的一致,28 ℃、220 r/min振动过夜培养(18 h),测定OD600值进而分析诱饵载体的毒性。分别挑取生长状态一致的诱饵蛋白BD-PcPTS和BD空载(阴性对照)单克隆至去离子水中,取100 μL稀释菌液分别涂布于SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/AbA培养基上,28 ℃培养3~5 d,进行BD-PcPTS载体自激活检测。
1.2.4 酵母双杂交筛选互作蛋白 将诱饵载体酵母菌株Y2H [BD-PcPTS]接种至SD/-Trp液体培养基上过夜培养,将重悬液与1 mL广藿香cDNA文库菌液混合,28 ℃培养20 h,利用显微镜观察培养物中是否形成米奇老鼠头状的二倍体杂合子。收集培养菌体并将重悬菌液分别涂布至约50个SD-Trp/Leu/X-a-Gal/AbA培养基上筛选。将蓝色单菌落接种至SD/-Trp/-Leu/-His/-Ade/ABA/X-a-Gal四缺培养基上,挑取阳性菌株作为模板,使用I-5TM 2×High-Fidelity Master Mix进行PCR扩增,选取阳性克隆产物送至广州天一辉远基因科技有限公司进行测序。利用UniProt的Blast数据库对候选蛋白进行比对分析。
1.2.5 带有GST标签的融合蛋白表达和纯化 将重组质粒GST-PcPTS和pGEX-6P-1空载质粒分别转化至BL21(DE3)菌株,验证成功的阳性菌落加入含羧苄(50 mg/L)的液体LB培养基,225 r/min,37 ℃振荡培养至OD600=0.4~0.6,然后加入IPTG(终浓度为0.1~0.5 mmol/L),16 ℃,120 r/min条件下诱导表达18 h。收集诱导后的菌体并用PBS溶液(含1 mmol/L PMSF)重悬,超声破碎。破碎后的细胞在12 000 r/min条件下离心20 min,离心后取上清蛋白液,4℃保存备用。GST融合蛋白使用Genscript公司的谷胱甘肽树脂纯化。纯化后的蛋白经10% SDS-PAGE凝胶电泳检测后,用Bradford试验评估蛋白浓度。
1.2.6 广藿香总蛋白的提取 按照植物蛋白抽提试剂盒〔生工生物工程(上海)股份有限公司〕说明书操作,将广藿香叶片和植物样本裂解液加入玻璃匀浆器中。使用玻璃匀浆器将广藿香叶片充分研磨,然后涡旋震荡。将混合液离心,并吸取下层含有可溶性总蛋白的水相[31],备用。
1.2.7 GST pull-down试验 将20 mL 1×PBS溶液加入含有2 mL谷胱甘肽树脂的柱子中,平衡柱子。随后将含有GST-PcPTS蛋白的上清液加入柱中,同时以GST蛋白上清液和不加入任何蛋白作为对照,并使用1×PBS洗涤液充分洗涤。加入提取的广藿香总蛋白,分别与树脂、固定于谷胱甘肽树脂的GST或GST-PcPTS在4 ℃共孵育1 h,以30 mL 1×PBS溶液充分洗涤去除GST非特异性结合蛋白质。使用新配制20 mL的10 mmol/L谷胱甘肽洗脱缓冲液(0.154 g还原型谷胱甘肽溶于50 mL 50 mmol/L Tris-HCl,pH为8.0)洗脱GST-PcPTS蛋白和互作蛋白的复合物。然后,进行SDS-PAGE分析并切下胶条进行质谱鉴定。
1.2.8 质谱检测和数据库检索 胶条经DTT还原、胰蛋白酶解成肽段。为了鉴定蛋白质,用C18柱(300 μm i.d. x 5 mm,填料为Acclaim PepMap RSLC C18,5 μm,100 Å,nanoViper,Thermo Fisher Scientific)分离得到的肽段,用流动相B(0.1% 甲酸溶于80% 乙腈)洗脱,流速为300 nL/min。分离后的肽段使用Q Exactive质谱仪进行在线检测,分析其氨基酸序列[31]。利用MASCOT软件在NCBI数据库(https://www.ncbi.nlm.nih.gov/)检索,检索物种为Sesamum indicum(35797)。
1.2.9 酵母双杂交验证候选互作蛋白 将两种方法筛选候选互作蛋白进行数据库检索注释,剔除管家基因,并查阅文献、选取己报道参与其他蛋白互作、影响蛋白转运、可以对蛋白进行修饰或降解、参与次生代谢调控的蛋白作为候选。根据获得的蛋白登录号,下载候选蛋白的参考序列。利用本地Blast方法,从广藿香转录组文库数据中获取具有完整ORF的候选基因序列,并将候选基因片段克隆至pGADT7载体。以Y2H [BD-PcPTS]菌株制作酵母感受态,然后利用利用醋酸锂/聚乙二醇介导法将目的质粒AD-gene和空载AD转化Y2H [BD-PcPTS]感受态,待长出阳性菌落后,挑取单克隆稀释3个10倍梯度浓度点涂于SD/-Trp-Leu(DDO)、SD/-Trp-Leu-Ade-His(QDO)、SD/-Trp-Leu-Ade-His+X-α-Gal(QDO/X)、SD/-Trp-Leu-Ade-His+X-α-Gal+AbA(QDO/X/A)缺陷培养基上,30 ℃倒置培养3 d,待显菌斑。
1.2.10 生物信息学分析 酵母双杂交筛库获得的片段和GST pull-down实验获得的肽段分别用Uniprot数据库和NCBI数据库进行BLASTp分析,获得Uniprot注释结果。利用NCBI的ORF finder预测PcC3H6、PcENO3、PcACR11和PcHAD基因编码的氨基酸,利用NCBI的CD Search和InterProScan网站预测保守结构域,利用PSORT Ⅱ和CellPLoc 2.0进行亚细胞定位预测分析。
2 结果与分析 2.1 广藿香PcPTS基因的克隆利用本地Blast方法,以NCBI收录的PTS基因序列为查询序列,从广藿香三代全长转录组中筛选获得PcPTS的全长转录本,全长2 054 bp,其中5' UTR为52 bp,3' UTR为343 bp,ORF为1 659 bp。根据全长序列设计引物,以广藿香的cDNA为模板进行PCR扩增获得PcPTS的cDNA序列(图 1),目的条带切胶回收,通过零背景克隆,测序后获得PcPTS 1 659 bp的cDNA序列。ORF finder预测PcPTS编码552个氨基酸,BLAST对比分析发现PcPTS与NCBI收录的PcPTS变体1(AHL24448.1)相似性达99.64%。
|
| M:DL 2000 DNA Marker;1~3: PcPTS cDNA的扩增 M: DL 2000 DNA Marker; 1-3: Amplification of PcPTS cDNA 图 1 广藿香PcPTS cDNA的克隆 Fig. 1 Cloning of the cDNA of PcPTS from Pogostemon cablin |
2.2 广藿香cDNA初级文库和酵母杂交文库的构建与鉴定
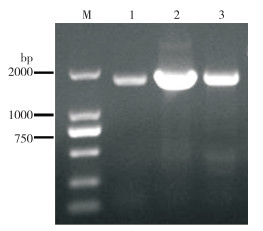
使用Thermo Nanodrop核酸分析仪和琼脂糖凝胶电泳对广藿香叶片的总RNA进行质量分析。结果(图 2A、B)显示,RNA样品完整无降解,浓度>1 000 ng/μL,总量超过500 μg,符合cDNA文库建库测序要求。从广藿香的总RNA中成功分离出广藿香的mRNA,并进行琼脂糖凝胶电泳检测。结果(图 2C)显示,广藿香的主要集中分布在1~3 kb的范围内,符合建库要求。
|
| A: 琼脂糖凝胶检测总RNA完整性;B: Thermo Nanodrop检测总RNA质量;C: 琼脂糖凝胶检测mRNA质量 A: Detection of total RNA integrity by agarose gel electrophoresis; B: Quality analysis of total RNA by Thermo Nanodrop; C: Detection of quality of mRNA by agarose gel electrophoresis 图 2 广藿香总RNA和mRNA质量检测 Fig. 2 Quality detection of total RNA and mRNA from Pogostemon cablin |
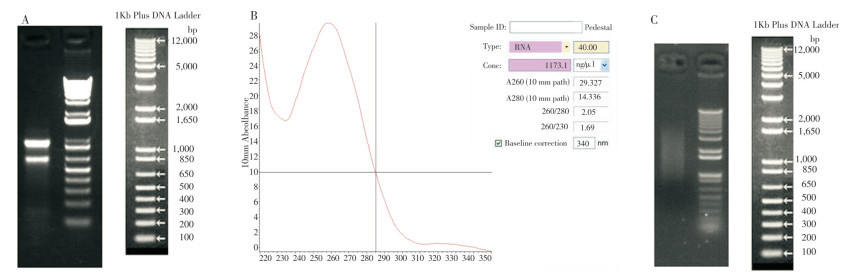
按照试剂盒说明书构建广藿香cDNA初级文库和酵母杂交文库,并鉴定文库的容量、重组率和插入片段长度。结果显示,初级文库容量为7.6×106 CFU(图 3A),重组率为100%(图 3B),且多数片段长度在800 bp以上。而酵母杂交文库容量为8.6×106 CFU(图 3C),重组率也达100%(图 3D),且多数片段长度也在800 bp以上。综上,已成功构建符合实验要求的酵母文库达,可用于后期酵母杂交实验。
|
| A: 初级文库稀释1 000倍后的库容量检测;B: 菌落PCR检测初级文库的重组率和插入片段;C: 次级文库稀释1 000倍后的库容量检测;D: 菌落PCR检测次级文库的重组率和插入片段 A: Detection of the capacity of the primary cDNA library by diluted bacterial suspension (10-3); B: Agarose gel electrophoresis is used to determine the recombination rate and inserted cDNA fragment of the primary cDNA library; C: Detection of the capacity of the yeast hybrid cDNA library by diluted bacterial suspension (10-3); D: Agarose gel electrophoresis is used to determine the recombination rate and inserted cDNA fragment of the yeast hybrid cDNA library 图 3 广藿香cDNA初级、次级文库质量检测 Fig. 3 Quality detection of the primary cDNA library and the yeast hybrid cDNA library from Pogostemon cablin |
2.3 诱饵载体的毒性与自激活检测
将构建好的BD-PcPTS与空载BD(阴性对照)分别转化至酵母Y2H菌株检测毒性和自激活活性。与空载相比,诱饵酵母菌株Y2H [BD-PcPTS]在SD/-Trp培养基上生长基本类似,且其Y2H [BD-PcPTS]单克隆在SD/-Trp液体培养基培养24 h时OD600 ≥ 0.8,表明诱饵蛋白不会对酵母细胞产生毒性,诱饵菌株Y2H [BD-PcPTS] 可用于后续文库筛选。此外,转化后的诱饵酵母菌株Y2H [BD-PcPTS] 在SD/-Trp和SD/-Trp/X-α-Gal上均长出白色菌落,但在SD/-Trp/X-α-Gal/AbA上不能正常生长(图 4),表明诱饵质粒已转入酵母细胞,且无自激活活性。因此,所构建的诱饵表达载体可用于后续的筛选实验。
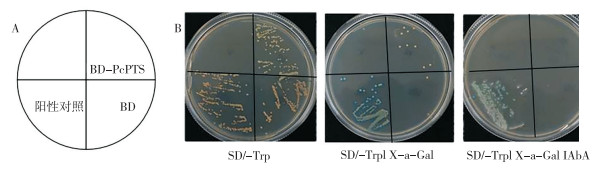
|
| A: 平板培养示意图;B: 自激活性活性检测 A: Schematic diagram of plate culture; B: Self-activation activity detection 图 4 酵母菌株Y2H[BD-PcPTS]自激活活性检测 Fig. 4 Self-activation activity detection of bait yeast strain named Y2H[BD-PcPTS] |
2.4 酵母双杂交筛选PcPTS互作蛋白
以PcPTS为诱饵蛋白筛选广藿香cDNA文库。将含有诱饵载体转化的酵母菌液和广藿香cDNA文库菌液混合并涂布于营养缺陷型SD/-Leu/-Trp/X-α-Gal/AbA和SD/-Trp/-Leu/-His/-Ade/X-α-Gal/AbA培养基上进行筛选,共获得44个阳性酵母单克隆。对阳性克隆进行PCR检测分析,结果显示,基因的片段大小并不一致,主要集中在1 000~2 000 bp。选取扩增条带单一且大小在700 bp以上的PCR产物进行测序分析,并使用UniProt的Blast数据库进行比对分析。结果(表 2)显示,存在17个可能与PcPTS互作的蛋白,其功能涉及植物的转录调控、植物防御响应、离子跨膜转运的调节、蛋白水解等多个方面(表 2)。
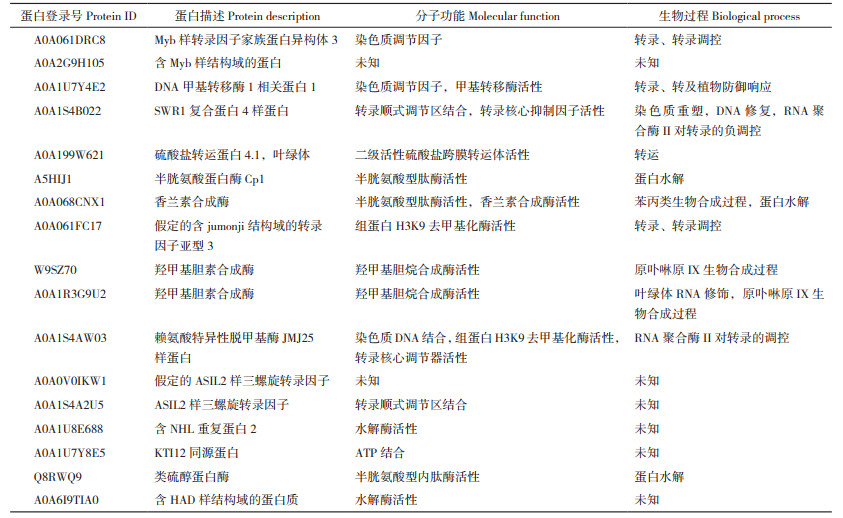
|
2.5 融合蛋白的诱导表达和纯化
GST-PcPTS载体转化BL21(DE3)后用不同浓度IPTG诱导表达,提取和纯化蛋白并利用SDS-PAGE检测。结果(图 5A)表明,发现终浓度0.1、0.3、0.5、1.0 mmol/L IPTG均可诱导GST-PcPTS融合蛋白表达,且主要以可溶性蛋白质的形式存在于菌液裂解后的上清中。纯化后的GST-PcPTS,条带清晰且单一,与预测的GST-PcPTS(84 kD)蛋白大小一致(图 5B),说明纯化效果较好,可作为诱饵蛋白用于蛋白体外结合实验(pull-down),以筛选互作蛋白。
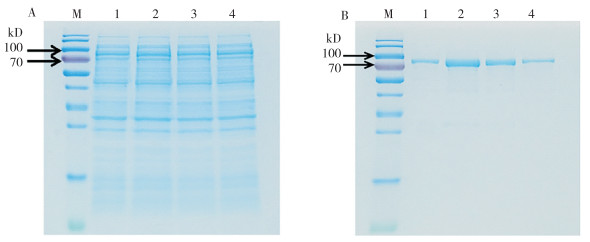
|
| M: 蛋白marker;泳道1~4:IPTG诱导浓度分别为0.1、0.3、0.5、1.0 mmol/L M: Protein marker; Lanes 1-4: IPTG-induced concentrations of 0.1, 0.3, 0.5, and 1.0 mmol/L, respectively 图 5 IPTG诱导(A)和纯化重组蛋白GST-PcPTS(B)的SDS-PAGE分析 Fig. 5 SDS-PAGE analysis of induced by IPTG (A) and purified recombinant protein GST-PcPTS (B) |
2.6 GST pull-down联合串联质谱筛选与PcPTS互作的蛋白质
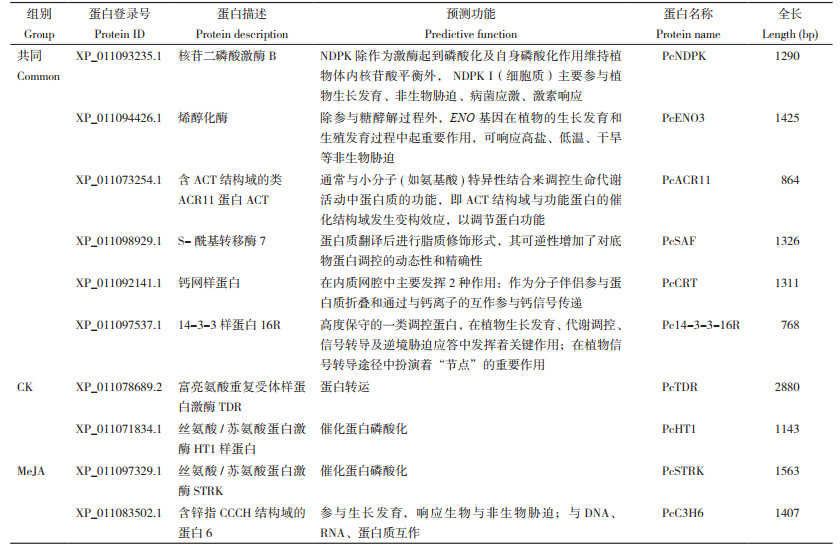
课题组前期利用广藿香叶片总蛋白验证其与GST柱及GST标签吸附情况,结果表明总蛋白不与GST柱及GST标签吸附[31]。利用GST pull-down技术对PcPTS互作蛋白进行筛选,将筛选得到的CK组和MeJA组的互作蛋白胶条切下进行LC-MS/MS鉴定及MASCOT与蛋白质数据库检索。通过筛选质谱中鉴定到的肽段匹配数≥ 2的蛋白,结果(图 6)显示,GST-PTS样品中鉴定到的蛋白质总数为98,部分候选互作蛋白信息见表 3。CK组和MeJA组中共同鉴定得到的候选蛋白有22个,其中核苷二磷酸激酶(XP_011093235.1)、烯醇化酶(XP_011094426.1)、14-3-3样蛋白16R(XP_011097537.1)等在植物生长发育、非生物胁迫中发挥作用,另ACR11蛋白(XP_011073254.1)、S-酰基转移酶7(XP_011098929.1)等可调节蛋白功能、在蛋白翻译后进行修饰。CK组鉴定得到特有的蛋白有33个,其中,富亮氨酸重复受体样蛋白激酶TDR(XP_011078689.2)、丝氨酸/苏氨酸蛋白激酶HT1(XP_011071834.1)等参与蛋白转运和催化蛋白磷酸化。MeJA处理后鉴定得到特有的蛋白43个,这些蛋白在未经处理的对照组中并未检出,表明它们的互作可能是MeJA处理特异性的。对MeJA处理组筛选到的互作蛋白进行功能注释和分类,结果发现这些蛋白主要涉及次生代谢途径(XP_011090121.1)、信号转导(XP_011097329.1)、应激响应(XP_011083502.1、XP_011079962.2、AGX27506.1)等多个生物学过程。这与MeJA在植物中作为重要的信号分子,调控多种生物学功能的角色相一致。
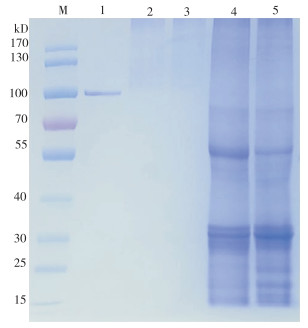
|
| M:蛋白marker;1:GST-PcPTS融合蛋白;2、3:GST-PcPTS与CK组、MeJA互作蛋白;4、5:CK组、MeJA组总蛋白 M: Protein marker; 1: GST-PacPTS fusion protein; 2, 3: GST-PcPTS interacting with CK group, MeJA group; 4, 5: Total protein of CK group, MeJA group 图 6 GST pull-down技术筛选PcPTS在广藿香中的互作蛋白 Fig. 6 Screening of PcPTS interacting proteins by GST pull-down in Pogostemon cablin |
|
2.7 利用酵母双杂验证候选蛋白互作关系
通过注释结果和查阅文献,选取已有文献报道参与其他蛋白互作、影响蛋白转运、可以对蛋白进行修饰或降解、参与次生代谢调控的蛋白作为候选互作蛋白。经过严格筛选,从GST pull-down和酵母双杂交筛库实验所筛选的蛋白中确定了14个候选蛋白(表 2中的A5HIJ1、A0A068CNX1、A0A1U8E688及A0A6I9TIA0[32]和表 3中的10个蛋白)。
利用本地Blast方法从广藿香转录组文库数据中获得具有完整ORF的候选基因序列,并根据tblast分析结果中相似性最高的蛋白对候选蛋白命名(表 3),A5HIJ1(PcAP1)、A0A068CNX1(PcVAN)、A0A1U8E688(PcNHL)及A0A6I9TIA0(PcHAD)。
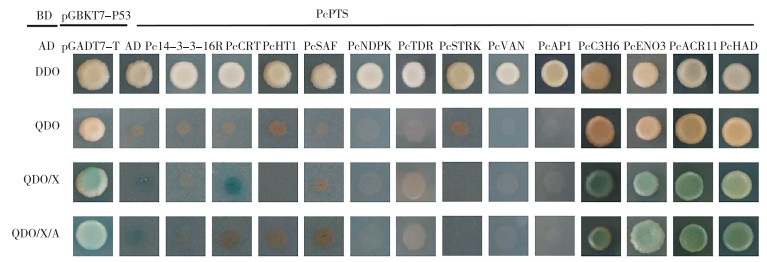
将14个诱饵蛋白的基因片段克隆至pGADT7载体。以Y2H [BD-PcPTS]制作酵母感受态,然后利用醋酸锂/聚乙二醇介导法将猎物质粒和空载pGADT7转化Y2H [BD-PcPTS] 感受态,3 d后挑取酵母菌落进行酵母双杂点对点验证,其中Y2H [pGADT7]×[BD-PcPTS] 转化为阴性对照,以Y2H [pGADT7-T]× [pGBKT7-P53]为阳性对照,其余为实验组。结果(图 7)表明,阳性对照、[AD-PcHAD]× [BD-PcPTS]、[AD-PcACR11]×[BD-PcPTS]、[AD-PcENO3] ×[BD-PcPTS] 和[AD-PcC3H6]×[BD-PcPTS] 实验组能在DDO和QDO筛选平板上生长且能在QDO/X和QDO/X/A筛选平板上变为蓝色,而阴性对照和其他实验组不能在QDO系列培养基上正常生长且变蓝色。综上,GST pull-down技术筛选的10个蛋白中有3个蛋白(PcC3H6、PcENO3和PcACR11)与PcPTS相互作用,其余7个蛋白[33](PcNDPK、PcSAF、PcCRT、Pc14-3-3-16R、PcTDR、PcHT1和PcSTRK)在酵母系统中不与PcPTS相结合,而酵母双杂技术筛选的4个蛋白中仅有PcHAD与PcPTS存在相互作用。
|
| 图 7 酵母双杂验证候选蛋白质与PcPTS之间的相互作用 Fig. 7 Interaction between candidate proteins and PcPTS in Y2H assays |
2.8 PcPTS互作蛋白的生物信息学分析
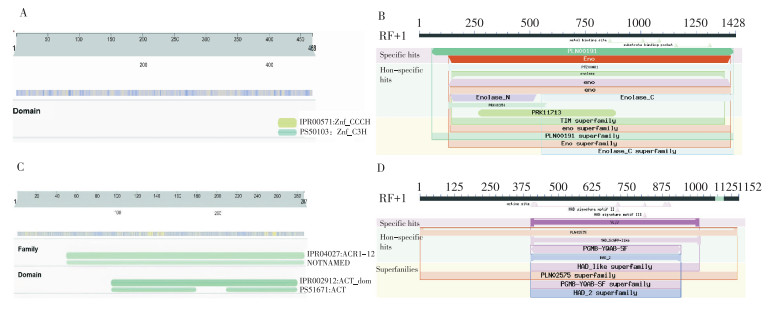
通过生物信息学方法对PcC3H6、PcENO3、PcACR11和PcHAD 4个蛋白的保守结构域及亚细胞定位进行分析。结果发现,PcC3H6在C末端CX8CX5CX3H型的CCCH锌指结构,属于CCCH锌指蛋白家族(图 8A);PcENO3含有典型的烯醇酶结构域,存在金属和底物结合位点,且含有TIM磷酸结合超家族保守结构域(图 8B),为烯醇化酶蛋白;PcACR11含有2个ACT结构域,属于ACR亚家族(图 8C);PcHAD含有1个HAD-like结构域,属于HAD-like超家族(图 8D)。亚细胞定位预测分析显示,PcC3H6、PcENO3、PcACR11和PcHAD可能分别定位于细胞核、细胞质、叶绿体及叶绿体中。
|
| 蛋白PcC3H6(A)、PcENO3(B)、PcACR11(C)、PcHAD(D)的保守结构域分析 Conserved domain analysis of PcC3H6 (A), PcENO3 (B), PcACR11 (C) and PcHAD (D) 图 8 PcPTS互作蛋白的保守结构域分析 Fig. 8 Conserved domain analysis of PcPTS interacting proteins |
3 讨论
广藿香醇是广藿香的主要活性成分,占广藿香油的20%~65%[34],具有广泛的生物活性,包括抗病毒和抗炎症等作用[6],并且其含量已经明确作为药典中广藿香药材和广藿香油质量标准的指标之一。广藿香醇的生物合成途径是一个复杂的过程,其中PcPTS是直接合成广藿香醇的功能酶。目前,关于PcPTS的研究仅局限于转录水平上的调控等,本研究则报道了PcPTS的互作蛋白,因挖掘PcPTS的互作蛋白是深入解析其调控广藿香醇合成的关键。
本研究利用酵母双杂交和GST pull-down技术系统筛选挖掘PcPTS的互作蛋白,共筛选到115个候选蛋白。其中,通过前者获得17个候选互作蛋白,通过后者获得98个候选互作蛋白,两种技术互为补充,无共同筛选到的蛋白。酵母双杂交系统是一种基于真核生物转录调控机制的体内实验方法,它通过检测蛋白质间的相互作用来筛选与目标蛋白互作的候选蛋白[35-36]。而GST pull-down技术则是一种体外实验方法,它利用GST融合蛋白与固化GST亲和配体的结合,从细胞提取物中钓取与目标蛋白有相互作用的蛋白。由于这两种方法在实验环境、筛选条件和敏感性上存在差异,因此它们筛选出的候选互作蛋白可能会有所不同。酵母双杂交在体内进行,可能更接近真实的生物环境,但也可能受到酵母细胞内其他因素的影响。GST pull-down在体外进行,条件相对更可控,但可能无法完全模拟细胞内的复杂环境。这些差异可能导致两种方法筛选出的候选蛋白无重叠。
MeJA作为一种重要的植物激素类似物,其在植物生长发育、次生代谢产物的合成与积累,以及响应环境胁迫等方面发挥着关键作用,如中、低浓度的MeJA可促进甘草根中甘草酸的合成和积累[37]。课题组前期研究发现,MeJA诱导可提高广藿香醇含量且上调广藿香醇生物合成途径中关键基因的表达[29],但具体的调控机制还有待进一步研究。为了深入分析MeJA诱导后广藿香醇含量上升的机制,本研究通过外源施加MeJA处理广藿香叶片,旨在模拟植物在自然条件下受到的诱导信号,然后利用GST pull-down技术筛选PcPTS互作蛋白。结果表明,MeJA组筛选到的特有互作蛋白比CK组的多,且这些蛋白大都具有蛋白水解活性、转移酶活性、转运蛋白活性,这表明MeJA可能通过影响这些互作蛋白的活性或表达进而影响PcPTS蛋白的活性或稳定性,从而调控广藿香醇的合成与积累。此外,还发现了一些与信号转导和应激响应相关的互作蛋白,这暗示着MeJA可能还通过PcPTS参与了更广泛的细胞信号网络和抗逆过程。这些蛋白与PTS的互作需要进一步利用蛋白互作技术进行验证,其响应MeJA调控机制也需要进一步分析。
为了深入探究是否存在特定蛋白与PcPTS发生互作,进而调控其催化活性与稳定性,本研究基于功能注释和已有文献报道,选取了14个候选蛋白。这些蛋白可与其他蛋白互作、影响蛋白转运、对蛋白修饰或降解、参与次生代谢调控。这些蛋白与PcPTS在功能上的相关性使得它们可能成为研究PcPTS互作网络的重要成员。通过酵母双杂交实验进行点对点验证,发现PcC3H6、PcENO3、PcACR11和PcHAD可与PcPTS在酵母体内直接互作,但由于酵母双杂交技术为异源系统,可能会造成假阳性结果,后续还需利用BiFC等其他技术辅助证实PcC3H6、PcENO3、PcACR11和PcHAD可与PcPTS互作。
PcC3H6在C末端CX8CX5CX3H型的CCCH锌指结构,属于CCCH锌指蛋白家族。据报道,CCCH锌指蛋白基因广泛参与植物的多种生物过程,包括植物生长发育、非生物胁迫应答等[38]。此外,CCCH型锌指蛋白可通过蛋白的N端、C端或锌指结构域与其他蛋白质结合来调控基因的表达,如AtC3H59通过其WD40结构域与Desi1相互作用[39]。故后续可以通过酵母双杂交实验进行截短的C3H蛋白与截短的PTS互作验证,进一步分析互作结构域。PcC3H6是MeJA处理后筛选到的特有蛋白,表明PcC3H6可能响应MeJA诱导,但MeJA诱导下PcC3H6与PcPTS互作情况变化暂不清晰。烯醇化酶(ENO)是糖酵解过程中的一种金属酶,具有多种功能。目前发现PcENO3能在体外提高广藿香醇的活性从而促进广藿香醇等倍半萜的合成,但具体调控机制还需要进一步研究[33]。根据已有文献报道,ACR蛋白可能在植物响应逆境胁迫和激素的信号响应中发挥作用[40-41]。ACT结构域可与小分子(如氨基酸)特异性结合发生变构效应来调控生命代谢活动中蛋白质的功能[42]。PcHAD属于大型的水解酶超家族HAD超家族,该家族蛋白在多种代谢途径中发挥作用,如细菌中HAD家族蛋白在碳水化合物新陈代谢过程中起着关键作用[43]。在广藿香中瞬时过表达PcHAD后能促进广藿香叶中广藿香醇的合成和积累,但PcHAD与PcPTS互作对PTS酶活性的影响及PcHAD影响广藿香醇合成的机制尚不清晰[32],后续可通过体外酶促反应和遗传转化手段进一步揭示PcHAD的功能。
综上所述,这些筛选出来的互作蛋白可能与PcPTS互作以调节PcPTS的酶活性、稳定性等从而影响广藿香醇等倍半萜类化合物的合成,且PcC3H6可能与MeJA的诱导调控有一定关联,这为进一步解析PcPTS调控广藿香醇生物合成的作用机制和调控网络奠定了基础。下一步可继续利用其他方法进一步验证这些互作蛋白,并进行功能研究,深入地了解其调节机理。
4 结论本研究成功克隆了PcPTS的cDNA序列,并对其ORF和编码的氨基酸等进行分析。通过试剂盒法成功构建了符合酵母杂交实验要求的广藿香酵母杂交文库。以pGBKT7-PcPTS为诱饵载体从广藿香酵母杂交文库中筛选并鉴定出17个候选蛋白。此外,利用GST-PcPTS诱饵蛋白从广藿香总蛋白中捕获并鉴定了98个候选互作蛋白。并从候选蛋白中筛选了14个已知可能参与其他蛋白互作、影响蛋白转运、对蛋白进行修饰或降解、参与次生代谢调控的关键蛋白。利用酵母双杂交技术初步分析了这些蛋白与PcPTS的互作情况,并发现PcC3H6、PcENO3、PcACR11和PcHAD这4个蛋白与PcPTS存在显著的相互作用,这为后续研究这些蛋白与PcPTS之间的具体作用机制提供了方向。上述结果不仅有助于深入理解PcPTS的功能与调控机制,而且为揭示PcPTS与其他蛋白间的互作关系及为广藿香醇的生物合成和调控提供了重要的理论支撑。
| [1] |
国家药典委员会. 中华人民共和国药典(第一部)[M]. 北京: 中国医药科技出版社, 2020. State Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Part 1)[M]. Beijing: China Pharmaceutical Science and Techndogy Press, 2020. |
| [2] |
ZHAN X, ZHANG Y H, CHEN D F, SIMONSEN H T. Metabolic engineering of the moss Physcomitrella patens to produce the sesquiterpenoids patchoulol and α/β-santalene[J]. Frontiers in Plant Science, 2014, 5: 636. DOI:10.3389/fpls.2014.00636 |
| [3] |
王玥, 郭苗苗, 施雁勤, 潘仙华, 卢艳花, 曹平. 广藿香精油抗炎祛痘功效研究[J]. 日用化学工业, 2017, 47(5): 272-276. DOI:10.13218/j.cnki.csdc.2017.05.007 WANG Y, GUO M M, SHI Y Q, PAN X H, LU Y H, CAO P. Anti-acne efficacy of essential oil from Pogostemon cablin (Blanco) Benth[J]. China Surfactant Detergent and Cosmetics, 2017, 47(5): 272-276. DOI:10.13218/j.cnki.csdc.2017.05.007 |
| [4] |
SWANMY M K, SINNIAH U R. Patchouli (Pogostemon cablin Benth.): Botany, agrotechnology and biotechnological aspects[J]. Industrial Crops and Products, 2016, 87: 161-176. DOI:10.1016/j.indcrop.2016.04.032 |
| [5] |
VAN B T A, JOULAIN D. The essential oil of patchouli, Pogostemon cablin: A review[J]. Flavour and Fragrance Journal, 2018, 33(1): 6-51. DOI:10.1002/ffj.3418 |
| [6] |
THAKUR A. Therapeutic potential of Pogostemon cablin herb: A comprehensive review[J]. Pharmaceutical Patent Analyst, 2022, 11(6): 213-224. DOI:10.4155/ppa-2022-0021 |
| [7] |
DEGUERRY F, PASTORE L, WU S Q, CLARK A, CHAPPELL J, SCHALK M. The diverse sesquiterpene profile of patchouli, Pogostemon cablin, is correlated with a limited number of sesquiterpene synthases[J]. Archives of Biochemistr y and Biophysics, 2006, 454(2): 123-136. DOI:10.1016/j.abb.2006.08.006 |
| [8] |
刘信丹, 张英, 吴孟华, 曹晖. 广藿香醇合成酶基因Pc-PTS1的克隆和生物信息学分析[J]. 中药材, 2018, 2(41): 292-298. DOI:10.13863/j.issn1001-4454.2018.02.010 LIU X D, ZHANG Y, WU M H, CAO H. Cloning and bioinformatics analysis of patchoulol synthase gene Pc-PTS1 from Pogostemon cablin[J]. Journal of Chinese Medicinal Material, 2018, 2(41): 292-298. DOI:10.13863/j.issn1001-4454.2018.02.010 |
| [9] |
ZHANG H Y, DENG W J, LU C H, HE M L, YAN H J. SMRT sequencing of full-length transcriptome and gene expression analysis in two chemical types of Pogostemon cablin (Blanco) Benth[J]. PeerJ, 2022, 10: e12940. DOI:10.7717/peerj.12940 |
| [10] |
XU H C, GOLDFUSS B, SCHNAKENBURG G, DICKSCHAT J S. The enzyme mechanism of patchoulol synthase[J]. Beilstein Journal of Organic Chemistry, 2022, 18: 13-24. DOI:10.3762/bjoc.18.2 |
| [11] |
EKRAMZADEH K, BRAMER C, FRISTER T, FOHRER J, KIRSCHNING A, BEUTEL S. Optimization of factors influencing enzyme activity and product selectivity and the role of proton transfer in the catalytic mechanism of patchoulol synthase[J]. Biotechnology Progress, 2020, 36(2): e2935. DOI:10.1002/btpr.2935 |
| [12] |
MITSUI R, NISHIKAWA R, YAMADA R, MATSUMOTO T, OGINO H. Construction of yeast producing patchoulol by global metabolic engineering strategy[J]. Biotechnology and Bioengineering, 2020, 117(5): 1348-1356. DOI:10.1002/bit.27284 |
| [13] |
FU X Q, ZHANG F Y, MA Y N, HASSANI D, PENG B, PAN Q F, ZHANG Y H, DENG Z X, LIU W B, ZHANG J X, HAN L, CHEN D F, ZHAO J Y, LI L, SUN X F, TANG K X. High-level patchoulol biosynthesis in Artemisia annua L.[J]. Frontiers in Bioengineering and Biotechnology, 2021, 8: 621127. DOI:10.3389/fbioe.2020.621127 |
| [14] |
CHEN J, TAN J, DUAN X Y, WANG Y, WEN J, LI W, LI Z G, WANG G D, XU H Y. Plastidial engineering with coupled farnesyl diphosphate pool reconstitution and enhancement for sesquiterpene biosynthesis in tomato fruit[J]. Metabolic Engineering, 2023, 77: 41-52. DOI:10.1016/j.ymben.2023.03.002 |
| [15] |
刘璐, 吴友根, 于靖, 张军锋, 杨东梅, 陈萍. 广藿香中PTS基因不同时间点的表达分析[J]. 热带生物学报, 2016, 7(1): 89-91. DOI:10.15886/j.cnki.rdswxb.2016.01.015 LIU L, WU Y G, YU J, ZHANG J F, YANG D M, CHEN P. Expression analysis of PTS gene of Pogostemon cablin at different time points[J]. Journal of Tropical Biology, 2016, 7(1): 89-91. DOI:10.15886/j.cnki.rdswxb.2016.01.015 |
| [16] |
罗集鹏, 郭晓玲, 冯毅凡. 不同采收期海南广藿香挥发油成分分析[J]. 中药材, 2002(1): 21-23. DOI:10.13863/j.issn1001-4454.2002.01.010 LUO J P, GUO X L, FENG Y F. Constituents analysis on volatile oil of Pogostemon cablin from different collection time cultivated in Hainan[J]. Journal of Chinese Medicinal Materials, 2002(1): 21-23. DOI:10.13863/j.issn1001-4454.2002.01.010 |
| [17] |
邓文静, 张宏意, 欧晓华, 卢昌华, 黄伟展, 严寒静. 茉莉酸甲酯对广藿香JA信号转导途径及倍半萜合成途径关键基因表达的影响[J]. 广西植物, 2021, 41(4): 559-566. DENG W J, ZHANG H Y, OU X H, LU C H, HUANG W Z, YAN H J. Effects of MeJA treatment on key genes involved in JA signal transduction and biosynthesis pathway of sesquiterpene in Pogostemon cablin[J]. Guihaia, 2021, 41(4): 559-566. |
| [18] |
OUYANG P Y, LIU Y L, WANG Y, MO X L, ZENG S H. Aging and/or tissue-specific regulation of patchoulol and pogostone in two Pogostemon cablin (Blanco) Benth. cultivars[J]. Physiologia Plantarum, 2016, 158(3): 272-283. DOI:10.1111/ppl.12466 |
| [19] |
YU Z X, WANG L J, ZHAO B, SHAN C M, ZHAN Y H, CHEN D F, CHEN X Y. Progressive regulation of sesquiterpene biosynthesis in Arabidopsis and Patchouli (Pogostemon cablin) by the miR156-Targeted SPL transcription factors[J]. Molecular Plant, 2015, 8(1): 98-110. DOI:10.1016/j.molp.2014.11.002 |
| [20] |
CHEN X Z, WANG X B, WU D D, LI J R, HUANG H L, ZHAN R T, CHEN L K. PatDREB transcription factor activates patchoulol synthase gene promoter and positively regulates jasmonate-induced patchoulol biosynthesis[J]. Journal of Agricultural and Food Chemistry, 2022, 70(23): 7188-7201. DOI:10.1021/acs.jafc.2c01660 |
| [21] |
WANG X B, CHEN X Z, ZHONG L T, ZHOU X X, LIU Y T, LI J R, ZHENG H, ZHAN R T, CHEN L K. PatJAZ6 acts as a repressor regulating JA-induced biosynthesis of patchouli alcohol in Pogostemon Cablin[J]. International Journal of Molecular Sciences, 2019, 20(23): 6038. DOI:10.3390/ijms20236038 |
| [22] |
CHEN X Z, LI J R, LIU Y T, WU D D, HUANG H L, ZHAB R T, CHEN W W, CHEN L K. PatSWC4, a methyl jasmonate-responsive MYB (v-myb avian myeloblastosis viral oncogene homolog)-related transcription factor, positively regulates patchoulol biosynthesis in Pogostemon cablin[J]. Industrial Crops and Products, 2020, 154: 112672. DOI:10.1016/j.indcrop.2020.112672 |
| [23] |
HILDEBRANDT T M, NUNES N A, ARAUJO W L, BRAUN H P. Amino acid catabolism in plants[J]. Molecular Plant, 2015, 8(11): 1563-1579. DOI:10.1016/j.molp.2015.09.005 |
| [24] |
MINNER M R, WEBER J N, ALBRECHT A, MATIS R, BEHNECKE M, TIETGE C, FRANK S, SCHULZE J, BUSCHMANN H, WALLAP J, MENDEL R R, HANSCH R, KAUFHOLDT D. Split-HaloTag imaging assay for sophisticated microscopy of protein-protein interactions in planta[J]. Plant Communications, 2021, 2(5): 100212. DOI:10.1016/j.xplc.2021.100212 |
| [25] |
IGLESIAS-SANCHEZ A, NAVARRO-CARCELEN J, MORELLI L, RODRIGUEZ-CONCEPCION M. Arabidopsis FIBRILLIN6 influences carotenoid biosynthesis by directly promoting phytoene synthase activity[J]. Plant Physiology, 2024, 194(3): 1662-1673. DOI:10.1093/plphys/kiad613 |
| [26] |
YU H Z, LI D Y, YANG D F, XUE Z Y, LI J, XING B C, YAN K J, HAN R L, LIANG Z S. SmKFB5 protein regulates phenolic acid biosynthesis by controlling the degradation of phenylalanine ammonia-lyase in Salvia miltiorrhiza[J]. Journal of Experimental Botany, 2021, 72(13): 4915-4929. DOI:10.1093/jxb/erab172 |
| [27] |
ZHOU F, WANG C Y, GUTENSOHN M, JIANG L, ZHANG P, ZHANG D, DUDAREVA N, LU S. A recruiting protein of geranylgeranyl diphosphate synthase controls metabolic flux toward chlorophyll biosynthesis in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(26): 6866-6871. DOI:10.1073/pnas.1705689114 |
| [28] |
何梦玲, 何芳, 熊洋, 马嘉瑜, 龚伟骏, 严寒静. 茉莉酸甲酯对广藿香叶中百秋里醇含量的影响[J]. 北方园艺, 2014(5): 147-150. HE M L, HE F, XIONG Y, MA J Y, GONG W J, YAN H J. Effect of Methyl Jasmonate on the content of patchouli alcohol from the leaves of Pogostemoncablin (Blanco) Benth[J]. Northern Horticulture, 2014(5): 147-150. |
| [29] |
CHEN X Z, LI J R, WANG X, ZHONG L T, TANG Y, ZHOU X X, LIU Y T, ZHAN R T, ZHENG H, CHEN W W, CHEN L K. Full-length transcriptome sequencing and methyl jasmonate-induced expression profile analysis of genes related to patchoulol biosynthesis and regulation in Pogostemon cablin[J]. BMC Plant Biology, 2019, 19(1): 266. DOI:10.1186/s12870-019-1884-x |
| [30] |
GHANGAL R, RAGHUVANSHI S, CHAND S P. Isolation of good quality RNA from a medicinal plant seabuckthom, rich in secondry metabolites[J]. Plant Physiology and Biochemistry, 2009, 47(11/12): 1113-1115. DOI:10.1016/j.plaphy.2009.09.004 |
| [31] |
钟李婷, 陈秀珍, 唐云, 李俊仁, 王小兵, 刘彦婷, 周璇璇, 詹若挺, 陈立凯. 广藿香FPPS重组蛋白表达及互作蛋白筛选分析[J]. 生物技术通报, 2019, 35(12): 10-15. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0475 ZHONG L T, CHEN X Z, TANG Y, LI J R, WANG X B, LIU Y T, ZHOU X X, ZHAN R T, CHEN L K. Expression of FPPS recombinant protein from Pogostemon cablin and screening of the interaction proteins[J]. Biotechnology Bulletin, 2019, 35(12): 10-15. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0475 |
| [32] |
吴带娣, 黄慧玲, 单耀楷, 邹璇, 龚丽珍, 詹若挺, 陈立凯. 广藿香PcHAD基因克隆及其参与广藿香醇生物合成功能分析[J]. 中草药, 2022, 53(13): 4100-4108. WU D D, HUANG H L, SHAN Y K, ZOU X, GONG L Z, ZHAN R T, CHEN L K. Cloning of PcHAD gene from Pogostemon cablin and functional analysis of its involvement in biosynthesis of patchouli alcohol[J]. Chinese Traditional and Herbal Drugs, 2022, 53(13): 4100-4108. |
| [33] |
WU D D, CHEN L, ZHONG B Y, ZHANG Z S, HUANG H L, GONG L Z, ZOU X, ZHAN R T, CHEN L K. PcENO3 interacts with patchoulol synthase to positively affect the enzymatic activity and patchoulol biosynthesis in Pogostemon cablin[J]. Physiologia Plantarum, 2023, 175(6): e14055. DOI:10.1111/ppl.14055 |
| [34] |
JAIN P L B, PATEL S R, DESAI M A. Patchouli oil: An overview on extraction method, composition and biological activities[J]. Journal of Essential Oil Research, 2021, 1-11. DOI:10.1080/10412905.2021.1955761 |
| [35] |
刘浩, 王加峰, 孙大元, 王慧, 陈志强. 水稻抗稻瘟病蛋白Pik2-H4基因的克隆及互作蛋白的筛选[J]. 广东农业科学, 2014, 41(4): 156-160. DOI:10.16768/j.issn.1004-874X.2014.04.005 LIU H, WANG J F, SUN D Y, WANG H, CHEN Z Q. Clone of rice blast resistance gene Pik2-H4 and it's interaction protein screening[J]. Guangdong Agricultural Sciences, 2014, 41(4): 156-160. DOI:10.16768/j.issn.1004-874X.2014.04.005 |
| [36] |
宫宇, 魏建华, 张少斌, 王宏芝. 酵母双杂交筛选与杨树Subgroup 4 MYB转录因子相互作用的蛋白质[J]. 广东农业科学, 2014, 41(11): 157-162. DOI:10.16768/j.issn.1004-874X.2014.11.032 DONG Y, WEI J H, ZHANG S B, WANG H Z. Identification of Subgroup 4 MYB transcription factorinteractive proteins using yeasttwo-hybrid systemg[J]. Guangdong Agricultural Sciences, 2014, 41(11): 157-162. DOI:10.16768/j.issn.1004-874X.2014.11.032 |
| [37] |
梁晓薇, 杨全, 李丹, 程轩轩, 唐晓敏, 潘利明, 张春荣. 茉莉酸甲酯对甘草根次生代谢的调控[J]. 广东农业科学, 2017, 44(6): 57-62. DOI:10.16768/j.issn.1004-874X.2017.06.008 LIANG X W, YANG Q, LI D, CHENG X X, TANG X M, PAN L M, ZHANG C R. Regulation of methyl jasmonate on secondary metabolism of Glycyrrhiza uralensis root[J]. Guangdong Agricultural Sciences, 2017, 44(6): 57-62. DOI:10.16768/j.issn.1004-874X.2017.06.008 |
| [38] |
HAN G L, QIAO Z Q, LI Y X, WANG C F, WANG B S. The roles of CCCH Zinc-Finger proteins in plant abiotic stress tolerance[J]. International Journal of Molecular Sciences, 2021, 22(15): 8327. DOI:10.3390/ijms22158327 |
| [39] |
SEOK H Y, BAE H, KIM T, MEHDI S M M, NGUYEN L V, LEE S Y, MOON Y H. Non-TZF protein AtC3H59/ZFWD3 is involved in seed germination, seedling development, and seed development, interacting with PPPDE Family protein desi1 in Arabidopsis[J]. International Journal of Molecular Sciences, 2021, 22(9): 4738. DOI:10.3390/ijms22094738 |
| [40] |
SINGH S K, SUNG T Y, CHUNG T Y, LIN S Y, LIN S C, LIAO J C, HSIEH W C, HSIEH M H. ACR11 modulates levels of reactive oxygen species and salicylic acid-associated defense response in Arabidopsis[J]. Scientifi c Reports, 2018, 8(1): 11851. DOI:10.1111/ppl.14055 |
| [41] |
HSIEH M H, GOODMAN H M. Molecular characterization of a novel gene family encoding ACT domain repeat proteins in Arabidopsis[J]. Plant Physiology, 2002, 130(4): 1797-1806. DOI:10.1104/pp.007484 |
| [42] |
CHIPMAN D. The ACT domain family[J]. Current Opinion in Structural Biology, 2001, 11(6): 694-700. DOI:10.1016/S0959-440X(01)00272-X |
| [43] |
BURROUGHS A M, ALLEN K N, DUNAWAY-MARIANO D, ARAVIND L. Evolutionary genomics of the HAD superfamily: Understanding the structural adaptations and catalytic diversity in a superfamily of phosphoesterases and allied enzymes[J]. Journal of Molecular Biology, 2006, 361(5): 1003-1034. DOI:10.1016/j.jmb.2006.06.049 |
(责任编辑 马春敏)
 2024, Vol. 51
2024, Vol. 51