文章信息
基金项目
- 广东省科技计划项目(2019B030316008, 2023B1212060038); 国家重点研发计划项目(2022YFD1600300); 广东省农业科研类及技术推广示范类项目(粤财农〔2022〕16号)
作者简介
- 邱道寿,博士,广东省农业科学院作物研究所研究员,硕士生导师,九三学社社员,华中农业大学、厦门大学博士后,《广东省岭南中药材保护条例》立法起草组专家。主要从事南药资源、育种与栽培技术研究。在广东省岭南中药材资源保护、新品种选育、仿野生栽培和林下栽培等方面取得了多项科研成果,这些成果对乡村振兴、精准扶贫和发展林下经济具有重要意义。主持(含第二主持)省(部)级项目12项、市(厅)级项目12项;以第一和通讯作者发表论文30篇,主编出版科技著作1部。先后获省级科技进步二等奖3项、三等奖1项;省农业推广二等奖1项、三等奖1项;广东省烟草专卖局(公司)科技三等奖1项;广东省农业科学院科技二等奖1项。获国家发明专利10件,实用新型专利6件,计算机软件著作权6项。通过广东省品种审定4个,参与制订广东省地方标准2项,团体标准10多项;主持完成的成果入选省级农业主推技术2项。邱道寿(1965—),男,博士,研究员,研究方向为南药资源、育种与栽培,E-mail:dsqiu@163.com.
文章历史
- 收稿日期:2023-12-26
2. 中南林业科技大学生命科学与技术学院,湖南 长沙 410004;
3. 广州白云山和记黄埔中药有限公司,广东 广州 510515
2. School of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, China;
3. Hutchison Whampoa Guangzhou Baiyunshan Chinese Medicine Co., Ltd., Guangzhou 510515, China
【研究意义】溪黄草是我国岭南地区民间习用中草药,因其喜生于山谷阴湿溪旁、新鲜叶片捣碎有黄汁而得名[1-2]。溪黄草具有清热、利湿、退黄、凉血、散瘀等功效,用于治疗黄疽型肝炎、胆结石、胆囊炎、痢疾、肠炎、湿热泻痢、跌打癖肿等症[1, 3-4]。溪黄草是《中国药典》收载“消炎利胆片”“胆石通胶囊”等中成药的组成药材[5],其基源之一为唇形科植物线纹香茶菜〔Isodon lophanthoides(Buch.-Ham.ex D.Don)H.Hara〕 [6]。现代药理学研究表明,溪黄草主要含有萜类、酚酸类、黄酮类、甾醇类等化学成分,具有保肝、抗炎、抗氧化、抗菌、抗病毒、抗肿瘤、免疫调节、降血压等多种药理作用[7-9]。药材溪黄草的来源较为复杂,基源植物广受学者争议,目前公认的主要有线纹香茶菜〔Isodon lophanthoides(Buch.-Ham. ex D. Don)H. Hara〕、狭基线纹香茶菜〔Isodon lophanthoides var. gerardianus(Bentham)H. Hara〕、纤花(细花)线纹香茶菜〔Isodon lophanthoides var. graciliflorus(Bentham)H. Hara〕与溪黄草〔Isodon serra(Maxim.)Kudô〕 4种植物[1-2, 10],以及民间习用品种长叶香茶菜〔Isodon walkeri(Arn.)H. Hara〕、显脉香茶菜〔Isodon nervosus(Hemsley)Kudo〕等[4]。近年来,随着溪黄草药材的需求量不断增大,仅靠其野生药材资源已无法满足市场的需求。因此,溪黄草的人工栽培日益受到重视。2023年8月,溪黄草入选《广东省岭南中药材保护条例》第二批保护种类,预示着由溪黄草人工栽培带动的种质资源收集保存、鉴定评价和新品种选育等研究将受到更大的关注。顺应产业需求,开展种质鉴评、创制和新品种选育研究,将为溪黄草种植产业提供有力而持久的技术支撑。
【前人研究进展】在我国,药材溪黄草(溪黄草、线纹香茶菜及其变种)广泛分布于黑龙江、吉林、辽宁、山西、河南、陕西、甘肃、西藏、云南、贵州、四川、广西、广东、湖南、湖北、安徽、浙江、江苏、江西、福建、台湾等地,国外如俄罗斯远东地区、朝鲜也有分布[11]。作为传统民间草药,多数省区的中药材标准收载为线纹香茶菜的干燥地上部分,例如云南收载为狭基线纹香茶菜的干燥全草[12],广东则收载为线纹香茶菜及其变种纤花线纹香茶菜或溪黄草的干燥地上部分[10];而民间也有将长叶香茶菜、显脉香茶菜等当作溪黄草药材使用[4]。鉴于溪黄草药材来源的复杂性,很多研究关注于基源植物的考证和鉴定[1-2, 12],包括不同基源植物间的形态鉴定[10, 13]、显微鉴定[14]、核型鉴定[15-16]、分子鉴定[4, 17-19],以及化学成分差异鉴定[3, 7, 20-21]等,但极少有人关注其种内种质的多样性。
【本研究切入点】本团队前期从广泛栽培的紫花型线纹香茶菜种质群体中筛选到一株白花型种质,并经多代观察,发现该性状可稳定遗传,且植株群体一致性好,符合新颖性种质的要求,是新品种选育的潜在材料。代谢组学是一种在特定条件下对生物系统内所有代谢产物进行全面定性或定量分析的方法[22],可用于评估不同地理区域中草药的种内和种间差异[23]。目前,其已用于香茶菜属中草药碎米桠(Isodon rubescens)的不同地理种源鉴定[23]、拟缺香茶菜(Isodon excisoides)的护肝机制[24]、溪黄草(Rabdosia serra)对胆汁淤积症的分子机制[25]等研究,这些新进展可为溪黄草种质的深度鉴评、功效物质筛选、治疗机制等研究提供借鉴和参考。【拟解决的关键问题】为探讨新种质与广泛栽培种质主要成分的差异,本研究在形态性状鉴定的基础上,以主栽的紫花型线纹香茶菜种质为对照,进一步开展了两种质的广泛靶向代谢组学研究,比较分析了二者主要代谢产物的差异,以期为种质创新和新品种选育提供依据。
1 材料与方法 1.1 试验材料供试种质广泛栽培的紫花型线纹香茶菜(以下简称紫花型种质,PF)和新选育的白花型线纹香茶菜(以下简称白花型种质,WF)均来自广州白云山和记黄埔中药有限公司清远基地,2023年3~5月,通过营养基质杯式育苗后,移栽于广东省农业科学院白云试验基地大田内。
主要仪器:数据采集仪器系统主要包括超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC)(Shim-pack UFLC SHIMADZU CBM30A,https://www.shimadzu.com/)和串联质谱(Tandem mass spectrometry,MS/MS)(QTRAP® 4500+,https://sciex.com/)。
主要试剂:甲醇,色谱纯,Merck;乙腈,色谱纯,Merck;标准品,色谱纯,BioBioPha/Sigma-Aldrich。
1.2 试验方法1.2.1 主要性状测试方法 田间试验小区随机分布,每份种质随机排列设置3小区。当杯苗高达10~15 cm时选取粗壮、无病、整齐一致的苗进行移植。畦宽1.5 m,每畦种5行,每穴栽1株,株行距为30 cm×40 cm,每小区种植50株。按常规种植方式进行田间管理和病虫害防治。当植株生长到现蕾至种子成熟期,参考线纹香茶菜DUS测试指南的方法观测茎、叶、花等主要性状。
1.2.2 供试材料取样方法 用于代谢组学测试的紫花和白花2份种质样品材料(各3次生物学重复)采集于1.2.1的试验小区内,待药材生长至采收阶段,每小区选取生长健壮、无病虫害为害的植株3~5株,割取地上部分,于室内晾干后,粉碎混匀,称取适量粉末交武汉慧赢生物有限公司进行广泛靶向代谢组学测试。
1.2.3 样品提取 将样品放置于冻干机中真空冷冻干燥后,利用研磨仪研磨至粉末状。称取50 mg粉末,溶解于1.0 mL 70% 甲醇提取液中,超声破碎10 min,然后每10 min涡旋1次,每次持续10 s,共涡旋3次,样本置于4 ℃冰箱过夜。待离心(转速12 000 rpm,10 min)后,吸取上清,用微孔滤膜(0.22 μm)过滤样品,并保存于进样瓶中,用于UPLC-MS/MS分析。
1.2.4 色谱质谱采集条件 液相条件:(1)色谱柱:Waters ACQUITY UPLC HSS T3 C18 1.8 µm,2.1 mm×100 mm。(2)流动相:A相为超纯水(加入0.04% 乙酸),B相为乙腈(加入0.04% 乙酸)。(3)洗脱梯度:0 min,水∶乙腈= 95∶5(V/V);10.0 min,水∶乙腈= 5∶95(V/V);11.0 min,水∶乙腈= 5∶95(V/V);11.1 min,水∶乙腈= 95∶5(V/V);15.0 min,水∶乙腈= 95∶5(V/V)。(4)流速0.35 mL/min,柱温40 ℃,进样量2 μL。
质谱条件:电喷雾离子源温度550 ℃,质谱电压5 500 V(正),-4 500 V(负),离子源气体I 55 psi,气体Ⅱ 60 psi,气帘气25 psi,碰撞诱导电离参数设置为高。在三重四极杆中,每个离子对是根据优化的去簇电压和碰撞能进行扫描检测。
1.3 数据处理基于武汉慧赢生物有限公司的植物代谢组数据库,进行样本代谢物的质谱定性定量分析,采用MultiaQuant软件测算色谱峰面积和对应物质相对含量。采用变量重要性投影值(Variable importance in projection,VIP)和差异倍数值(Fold change,FC),对正交偏最小二乘法判别分析(OPLS-DA)的结果进行差异代谢物筛选,以VIP值>1判定为差异显著的代谢物,FC≥2判定为含量增加的代谢物,或FC≤0.5判定为含量减少的代谢物。随后,利用KEGG PATHWAY数据库(http://www.genome.jp/kegg/pathway.html)平台,将得到的差异代谢物进行通路富集分析,经过超几何检验,以P值确定其显著性。
2 结果与分析 2.1 白花型与紫花型线纹香茶菜的主要形态特征在植株生长的始花期,本研究对两份种质的主要性状(植株、茎、叶、花等)进行了系统鉴定,发现二者整体差异较为细微。个别性状差异较明显。例如,叶片形状:二者均为菱形至窄卵圆形,但紫花型略显狭长(图 1A、B);叶片颜色:二者均为深绿色,但白花型略带中等绿色(图 1A、B);花萼颜色:白花型绿色略带红褐色斑点(图 1C,左;图 1D,左),紫花型为红褐色(图 1C,右;图 1D,右);花瓣-下唇瓣色斑颜色:白花型的下唇瓣无色斑显色,整体为白色(图 1D,左),而紫花型的下唇瓣色斑为紫色(图 1D,右),此为二者最为显著的可区别性状特征。

|
| A、B:白花、紫花型种质田间植株形态;C:花序;D:花;C、D中左:白花型种质,右:紫花型种质 A, B: Morphology of field plants of white flower and purple flower germplasms; C: Inflorescence; D: Flower; C, D in the left: White flower germplasm, right: Purple flower germplasm 图 1 白花型与紫花型线纹香茶菜主要形态特征 Fig. 1 Main morphological characteristics of white flower and purple flower Isodon lophanthoides |
2.2 白花型与紫花型线纹香茶菜代谢物检测与质量控制分析
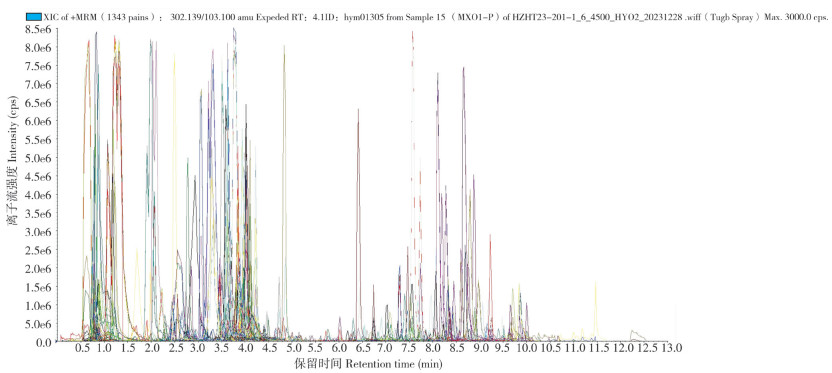
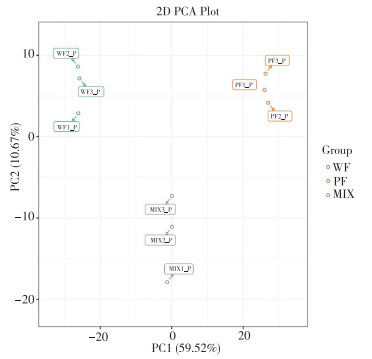
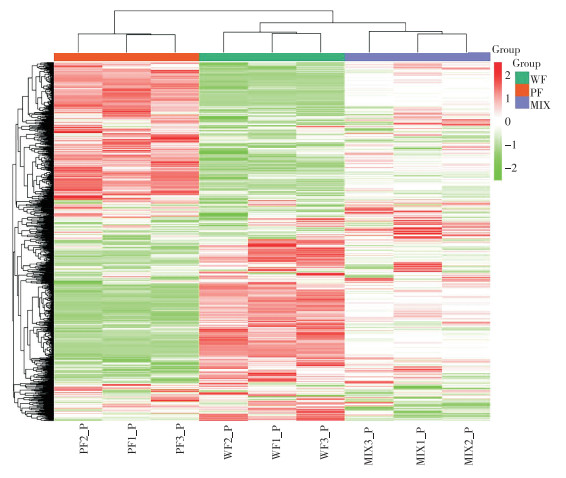
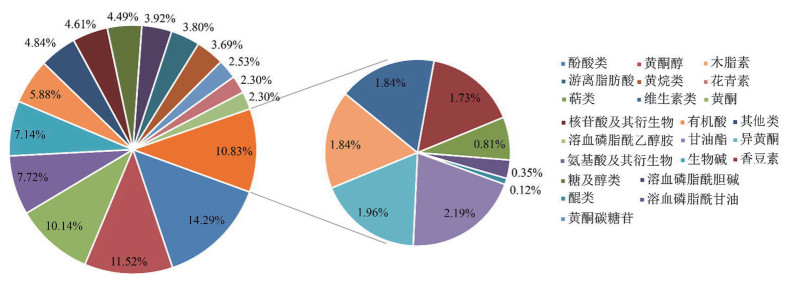
从图 2可以看出,MRM代谢物检测多峰图展示了线纹香茶菜种质样本中能够检测到的物质丰富度。将线纹香茶菜种质样品质控的总离子流图进行叠加处理,总离子流曲线重叠性好,说明同一样品不同时间检测时,保留时间和峰强度一致,信号稳定。此外,色谱峰的基线平稳,且可被有效分离,表明仪器稳定性高、数据重复性和可靠性强。为探查组间和组内样品之间的变异度,对样品进行主成分分析(PCA)(图 3),第一主成分PC1和第二主成分PC2的贡献率分别为59.52% 和10.67%,2个主成分能基本反映种质样品的主要特征信息。组内样本间变异度均较小,说明组内重复性好;组间样本代谢物呈分离趋势。将白花和紫花型两份种质样品的代谢物进行聚类分析,结果(图 4)显示,通过横向左侧的代谢物(Class)聚类线和纵向上方的样品(Group)聚类线,不仅可直观地看出样品的代谢物组成,还可以通过颜色(红高绿低)分辨出代谢物相对含量存在明显差异。经UPLC-MS/MS检测、代谢物公共数据库筛查和统计分析,在2份种质样品中共检测到868种代谢物。其中包括23类主要代谢物,如酚酸类(14.29%)、黄酮醇(11.52%)、黄酮(10.14%)、氨基酸及其衍生物(7.72%)、生物碱(7.14%)、有机酸(5.88%)(图 5)。此外,本研究还发现大量溶血磷脂酰类代谢物,如溶血磷脂酰胆碱(3.92%)、溶血磷脂酰乙醇胺(2.30%)和溶血磷脂酰甘油(0.35%)(图 5)。
|
| 图 2 线纹香茶菜种质样本MRM代谢物检测多峰图 Fig. 2 Multiple peaks of detection of MRM metabolites in germplasm samples of Isodon lophanthoides |
|
| WF:白花型样品;PF:紫花型样品;MIX:混合样品 WF: White flower sample; PF: Purple flower sample; MIX: Mixed sample 图 3 线纹香茶菜种质样本的主成分分析 Fig. 3 Principal component analysis of Isodon Lophanthoides germplasm samples |
|
| WF:白花型样品;PF:紫花型样品;MIX:混合样品 WF: White flower sample; PF: Purple flower sample; MIX: Mixed sample 图 4 线纹香茶菜种质样本全部代谢物聚类热图 Fig. 4 Cluster heatmap of all metabolites in Isodon lophanthoides germplasm samples |
|
| 图 5 白花型与紫花型线纹香茶菜种质检测到的差异代谢物分类图 Fig. 5 Classification diagram of differential metabolites detected in white flower and purple flower germplasms of Isodon lophanthoides |
2.3 白花型与紫花型线纹香茶菜差异代谢物筛选和鉴定
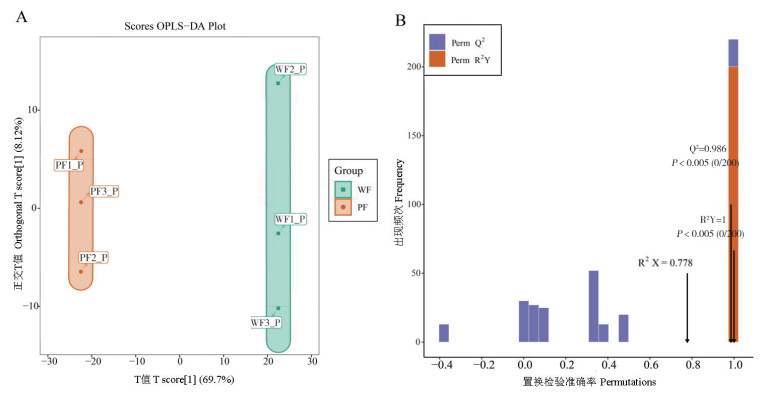
对白花型和紫花型种质的GC-MS代谢总数据进行OPLS-DA分析,由图 6A可知,白花型线纹香茶菜和紫花型线纹香茶菜在PC1主成分上有明显的分离,OPLS-DA模型对X和Y矩阵的解释率分别为R2X = 0.778、R2Y =1,对模型预测的Q2值为0.986,表明所建的模型稳定可靠,能有效地预测结果。为避免过拟合,使用OPLS-DA模型进行200次随机排列组合实验进行验证,检验发现R2X和R2Y均为P<0.005,符合对本试验数据模型的预期,所建立的OPLS-DA模型可以有效说明白花型和紫花型线纹香茶菜的代谢产物存在差异,可根据VIP对差异代谢物进行筛选(图 6B)。
|
| A:代谢物OPLS-DA得分,横坐标方向表示组间差距,纵坐标方向表示组内差距;百分比表示解释度;点表示样品;WF为白花样品,PF为紫花样品;B:代谢物OPLS-DA模型验证,是OPLS-DA模型200次随机排列组合实验结果;R2X为模型对X矩阵的解释率,R2Y为模型对Y矩阵的解释率,Q2为模型的预测平方相关系数;一般情况下,P<0.05时模型最佳 A: Metabolite OPLS-DA score, the horizontal axis indicates inter group difference, while the vertical axis indicates intra group difference; Percentage represents interpretability; Each point represents a sample; WF: white flower sample, PF: purple flower sample; B: Metabolite OPLS-DA model validation, showing the results of 200 random permutation and combination experiments of the OPLS-DA model; R2X is the explanatory power of the model to the X matrix, R2Y is the explanatory power of the model to the Y matrix, and Q2 is the predicted squared correlation coefficient of the model; In general, the model is optimal when P < 0.05 图 6 白花型与紫花型线纹香茶菜代谢物OPLS-DA得分与模型验证 Fig. 6 OPLS-DA scores and model validation of metabolites in white flower and purple flower Isodon lophanthoides |
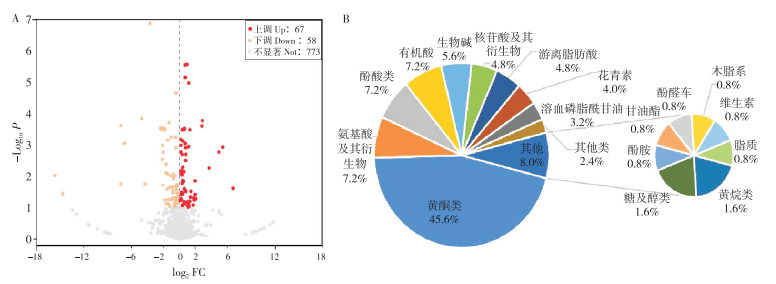
以紫花型线纹香茶菜为基准,以VIP>1、P<0.05、|Log2FC|>1的为筛选条件筛选两种质间的差异代谢物。结果(图 7A)表明,总共筛选到125种显著差异代谢物,其中,在白花型线纹香茶菜种质中显著上调的代谢物有67种,下调的有58种。这些差异代谢物主要包括黄酮类化合物、有机酸、氨基酸及其衍生物、酚酸类、生物碱、游离脂肪酸等代谢物,其中黄酮类化合物占总差异代谢物的45.6%(图 7B)。
|
| A:差异代谢物火山图,点表示代谢物,log2FC绝对值越大,说明在两样品间表达量倍数差异越大;P值越大,表明差异表达越显著;UP为上调,Down为下调,Not为差异不显著;B:差异代谢物分类与比例 A: Differential metabolites volcano map, each point represents a metabolite. The larger the absolute value of log2FC on the x-axis, the greater the difference in expression level between the two samples. The larger the P value on the y-axis, the more significant the differential expression; UP-Upregulated, Down-Downregulated, Not-Not significant; B: Classification and percentage of differential metabolites 图 7 白花型与紫花型线纹香茶菜差异代谢物分析 Fig. 7 Analysis of differential metabolites between white flower and purple flower Isodon lophanthoides |
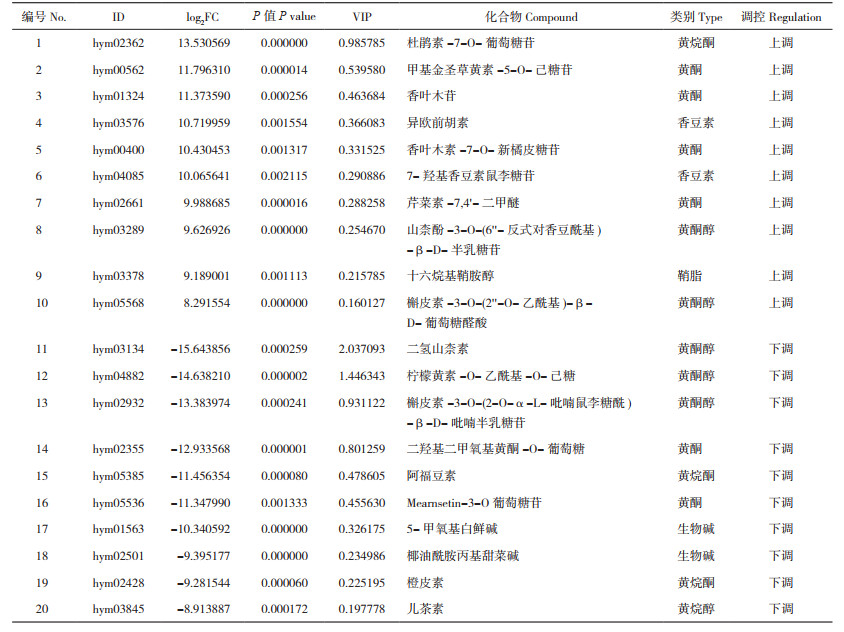
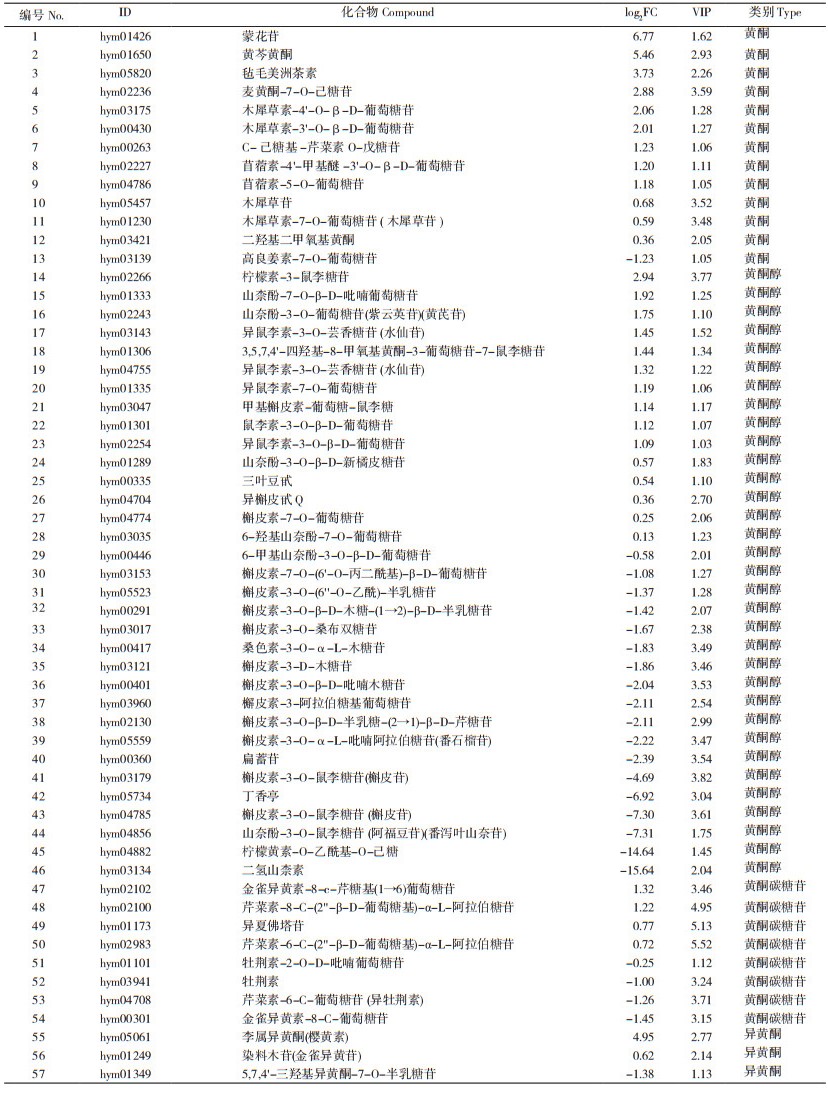
将差异代谢物的Log2FC值进行排序,列出差异倍数最高(上调和下调)的代谢物,结果如表 1所示。其中,上调幅度前10的差异代谢物中有4种黄酮、2种黄酮醇、1种黄烷酮、1种鞘脂和2种香豆素,上调差异倍数最大的代谢物是杜鹃素-7-O-葡萄糖苷,在白花型线纹香茶菜种质中约为紫花型种质中的13.53倍。下调幅度前10的差异代谢物中有2种黄酮、3种黄酮醇、1种黄烷醇、2种黄烷酮和2种生物碱,其中,下调差异倍数最大的代谢物为二氢山柰素(Dihydrokaempferide),其差异倍数高达15.64倍。由表 1可知,两种质的差异代谢物种类较多,主要为黄酮类化合物。
|
2.4 白花型与紫花型线纹香茶菜差异代谢物代谢通路分析
利用KEGG PATHWAY数据库,根据注释检测到的差异代谢物进行通路富集分析。如图 8所示,富集指数(Rich factor)值越大表示富集程度越大;P值越接近于0,表示富集越显著;圆点越大,代表富集到相应通路上的差异显著代谢物的个数越多。本研究的通路富集分析结果发现,125种差异代谢物共注释到47条代谢通路,其中,差异代谢物在类黄酮生物合成,异黄酮生物合成,花青素生物合成,黄酮和黄酮醇生物合成,嘌呤代谢,芪类化合物、二芳基庚烷和姜酚生物合成通路中有较多的富集,且显著富集。从图 8可以看出,每种代谢途径有多种代谢物参与,部分代谢物也可参与多个代谢途径。

|
| 点的颜色代表P值,越红表示富集越显著;点的大小代表富集到的差异代谢物的数量多少 The color of the point represents the P value, and the redder the point, the more significant the enrichment; The size of the point represents the amount of enriched differential metabolites 图 8 白花型与紫花型线纹香茶菜差异代谢物KEGG富集图 Fig. 8 KEGG enrichment map of differential metabolites between white flower and purple flower Isodon lophanthoides |
基于溪黄草的主要药用成分(萜类、酚酸类、黄酮类、甾醇类等),重点对黄酮差异代谢物进行分析发现,在黄酮类别的差异代谢物中,除了高良姜素-7-O-葡萄糖苷(Galangin-7-glucoside)在白花型线纹香茶菜种质中相对于紫花型下降外,其余黄酮代谢物均高于紫色花型。黄酮醇类化合物则是白花和紫花两种质差异代谢物最多的类别。与白花种质比较,紫花种质檞皮素相关的代谢物数量积累较多,且显著上调。此外,柠檬黄素-O-乙酰基-O-己糖(Limocitrin-O-Acetyl-O-Hexoside)和二氢山柰素(Dihydrokaempferide)差异高达14倍和15倍。在黄酮碳糖苷和异黄酮两类化合物中,也都是白花种质上调代谢物数量高于紫花种质(表 2)。
|
此外,对生物碱和氨基酸及其衍生物的差异代谢物分析发现,大多数代谢物在白花种质中含量高于紫花种质(表 3)。而在酚酸类代谢物中,则是白花型略逊于紫花型。本研究还发现花青素代谢物中,矢车菊素类化合物在白花种质中显著下降,而矢车菊素通常在植物呈色上具有重要作用,白花种质的叶片、茎秆、花萼等颜色相对紫花种质较浅淡(图 1),可能跟这一类代谢物显著下调有关。

|
3 讨论
药材溪黄草是我国传统民间中草药,野生资源在我国分布广泛[11],在各省区发布的药材标准中,大多以线纹香茶菜及其变种收载为其基源植物,也有部分省区同时收载了溪黄草[10, 12]。作为多基源药材,不同种之间、种内不同变种之间,不仅在形态上有所差异,其化学成分也存在差异 [7, 10, 13]。我国作为药材溪黄草多基源的野生分布区,种间、种内变种间、甚至变种内,理论上可能存在丰富的种质资源多样性,本研究在线纹香茶菜种内发现了一株不同于广泛栽培种的白花型种质,通过代谢组比较分析,筛选到了多达125种显著差异代谢物。因此,探索种内种质资源的创新可为种质资源深度鉴评、种质创制和新品种选育提供依据。尽管本研究与前人开展基源考证、多基源化学成分的研究不完全相同,但寻求差异鉴别、精准鉴评的思路一致。同时,本研究筛选到的多数差异代谢物,如黄酮类、酚酸类、生物碱类和氨基酸类等,也是现有报道组成溪黄草的主要功效成分[3, 7, 20-21]。
随着技术的不断进步和检测成本的下降,多组学技术被日益广泛地应用到中草药的各领域研究中,代谢组学作为一种在特定条件下对代谢产物进行全面定性或定量分析的方法[22],极大地便利了人们开展中草药区域差异、种内和种间差异,以及药理机制等研究[23-25],因而受到广泛关注。Xie等[24]采用UHPLC-Q-TOF-MS/MS与代谢组学相结合的方法研究了我国香茶菜属中草药冬凌草(Isodon rubescens)的代谢物,从4个地理种源的24份样品中鉴定了60个铀烷二萜类化合物,其中12种被视为负责区分物种的标记化合物。本研究采用广靶代谢组学技术对比分析了线纹香茶菜种内两份种质的代谢物,在白花型和紫花型种质样品中总共筛选到125种显著差异代谢物,其中有67种在白花型种质中显著上调、58种下调。这些差异代谢物主要包括黄酮类化合物、有机酸、氨基酸及其衍生物、酚酸类、生物碱、游离脂肪酸等代谢物,其中作为溪黄草主要成分之一的黄酮类化合物占总差异代谢物的45.6%。本研究不仅从形态上鉴别了白花与紫花型两份种质,也在主要代谢物上找到了二者的显著差异,该结果与上述基于代谢组学技术的中草药种质研究结果相似,均一致认为代谢组学技术可较好地应用于中药材种质的精准鉴评、品种鉴别和筛选。
差异代谢物的通路富集分析有助于了解代谢途径的变化机制,赵熙等[26]以汝城白毛茶为对象,对比研究了湖南四大茶树地方群体资源(另外三种为安化群体、城步峒茶、江华苦茶),通路富集结果表明,汝城白毛茶的差异代谢物主要富集于类黄酮生物合成、黄酮与黄酮醇生物合成、苯丙烷生物合成等途径上。而本研究中,差异代谢物也在类黄酮生物合成、异黄酮生物合成、黄酮和黄酮醇生物合成等通路上显著富集,与其极为相似。溪黄草是我国岭南地区常用特色草药[4],也是广东省连州市的地理标志产品[27],民间保持着代作“凉茶”饮用的习惯,溪黄草茶作为一种传统保健茶、代用茶,在本研究结果中得到了应证。
目前,药材溪黄草公认有多种基源植物来源,《中国药典》及各省份中药材标准共收录2种、2变种,即线纹香茶菜及其变种纤花香茶菜、狭基线纹香茶菜和溪黄草,民间也将外形相似的长叶香茶菜、显脉香茶菜等植物作为溪黄草药材使用[4]。本研究为探讨基源植物之一的线纹香茶菜种内种质的差异性,用白花和紫花型2种线纹香茶菜种质作为研究对象,虽然筛选到了可以显著区分2份种质的125种差异代谢物,但研究结果仍然有所局限和偏颇,比如,它们与同属异种基源溪黄草、长叶香茶菜、显脉香茶菜之间及与同种不同变种纤花香茶菜、狭基线纹香茶菜之间的差异代谢物如何,仍然值得进一步扩充和深入研究。
4 结论本研究以药材溪黄草基源植物线纹香茶菜两份种质的形态性状鉴评为基础,采用广泛靶向代谢组学技术对白花和紫花型线纹香茶菜种质开展了代谢物比较分析,从检测到的868种代谢物中筛选到125种差异代谢物。其中,有67种在白花种质中显著上调,58种表现下调。二者的主要差异代谢物包括黄酮类、有机酸、氨基酸及其衍生物、酚酸类、生物碱、游离脂肪酸等,其中黄酮类化合物占比最高、达45.6%。进一步的通路富集分析结果显示,125种差异代谢物共注释到47条代谢通路,其中,显著富集的有类黄酮、异黄酮、花青素、黄酮和黄酮醇、芪类化合物、二芳基庚烷和姜酚生物合成及嘌呤代谢等途径。本研究深度鉴评了白花型线纹香茶菜种质,不仅形态特征上可与广泛栽培的紫花型线纹香茶菜种质显著区别,在代谢物上也明显表现不同,其黄酮类、黄酮醇类化合物显著多于紫花型种质。因此,白花型线纹香茶菜是一份外观性状新颖、可深度挖掘和创新利用的优良种质资源,是药材溪黄草新品种选育的上好材料。
| [1] |
肖树雄, 杨启存, 吕红. 溪黄草的来源及与混淆品的鉴别[J]. 中药材, 1993(6): 24-26. DOI:10.13863/j.issn1001-4454.1993.06.012 XIAO S X, YANG Q C, LYU H. The source of Isodon lophanthoides and identification of its confounding substances[J]. Journal of Chinese Medicinal Materials, 1993(6): 24-26. DOI:10.13863/j.issn1001-4454.1993.06.012 |
| [2] |
邓乔华, 张慧晔, 梁惠瑜, 黄亦南. 溪黄草药材的基原考证[J]. 现代中药研究与实践, 2012, 26(2): 82-84. DOI:10.13728/j.1673-6427.2012.02.024 DENG Q H, ZHANG H Y, LIANG H Y, HUANG Y N. Research on the origin of medicinal Herb Isodon lophanthoides[J]. Research and Practice on Chinese Medicines, 2012, 26(2): 82-84. DOI:10.13728/j.1673-6427.2012.02.024 |
| [3] |
冯秀丽. 南药" 溪黄草"化学成分研究—线纹香茶菜(Isodon lophanthoides) 化学成分研究[D]. 广州: 广州中医药大学, 2016. FENG X L. Studies on the chemical constituents from the aerial parts of Isodon lophanthoides (Buch.-Ham. ex D. Don)Hara[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2016. |
| [4] |
孟爽爽. 溪黄草药材种质资源遗传多样性分析及SCAR标记的开发[D]. 广州: 广州中医药大学, 2019. MENG S S. The study in genetic diversity and development SCAR markers of Xihuangcao[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2019. |
| [5] |
国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2020: 1530-1531, 1360-1361. State Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Part 1)[M]. Beijing: China Medical Technology Press, 2020: 1530-1531, 1360-1361. |
| [6] |
国家药典委员会. 中华人民共和国药典(四部)[M]. 北京: 中国医药科技出版社, 2020: 558. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Part 4)[M]. Beijing: China Pharmaceutial Science and Technology Press, 2020: 558. |
| [7] |
孙礼芹, 钱菲, 李医明, 贾琦. 多基源溪黄草的化学成分和药理作用研究进展[J]. 上海中医药大学学报, 2020, 34(6): 88-98. DOI:10.16306/j.1008-861x.2020.06.014 SUN L Q, QIAN F, LI Y M, JIA Q. Research progress on chemical constituents and pharmacological effects of Linearstripe rabdosia Herb from various origins[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2020, 34(6): 88-98. DOI:10.16306/j.1008-861x.2020.06.014 |
| [8] |
张帆, 庞雪冰. 溪黄草浸膏对动物胆汁分泌及免疫功能的影响[J]. 中国药师, 2012, 15(4): 575-576. DOI:10.3969/j.issn.1008-049X.2012.04.051 ZHANG F, PANG X B. Effects of herba Rabdosiae serrae extract on bile secretion and immune function[J]. China Pharmacist, 2012, 15(4): 575-576. DOI:10.3969/j.issn.1008-049X.2012.04.051 |
| [9] |
姜科声. 华东地区五种香茶菜药理比较及其资源保护[J]. 中国野生植物资源, 2004(2): 35-38. JIANG K S. Pharmacological effects of five species of Isodon from east China and their conservation[J]. Chinese Wild Plant Resources, 2004(2): 35-38. |
| [10] |
刘凡, 黄海波, 楼步青, 李玲慧. 溪黄草四种基源植物的形态鉴别[J]. 现代中药研究与实践, 2010, 24(3): 30-31. DOI:10.13728/j.1673-6427.2010.03.017 LIU F, HUANG H B, LOU B Q, LI L H. Morphological identification of four basal plants of Rabdosia lophanthoides[J]. Research and Practice on Chinese Medicines, 2010, 24(3): 30-31. DOI:10.13728/j.1673-6427.2010.03.017 |
| [11] |
中国科学院中国植物志编辑委员会. 中国植物志 第66卷[M]. 北京: 科学出版社, 1977. Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China, Volume 66[M]. Beijing: Science Press, 1977. |
| [12] |
邓乔华, 王德勤, 黄亦南, 梁惠瑜, 徐友阳, 徐小飞, 张为亮. 溪黄草考证及性状鉴别法的验证[J]. 现代中药研究与实践, 2014, 28(2): 15-18, 12. DOI:10.13728/j.1673-6427.2014.02.009 DENG Q H, WANG D Q, HUANG Y N, LIANG H Y, XU Y Y, XU X F, ZHANG W L. To textual research Isodon serra and verify character identifi cation method[J]. Research and Practice on Chinese Medicines, 2014, 28(2): 15-18, 12. DOI:10.13728/j.1673-6427.2014.02.009 |
| [13] |
张翘, 潘超美. 溪黄草、线纹香茶菜、线纹香茶菜狭基变种、线纹香茶菜细花变种的外观形态比较[J]. 今日药学, 2012, 22(1): 21-24. ZHANG Q, PAN C M. Different morphology of Rabdosia serra, Rabdosia lophanthoides, Rabdosia lophanthoides var. gerardiana and Rabdosia lophanthoides var. graciliflora[J]. Pharmacy Today, 2012, 22(1): 21-24. |
| [14] |
陈新. 线纹香茶菜和溪黄草的鉴别[J]. 今日药学, 2009, 19(5): 51-54. CHENG X. Identification of Isodon lophanthoides Hara and Isodon serra Hara[J]. Pharmacy Today, 2009, 19(5): 51-54. |
| [15] |
黄珊珊, 莫小路, 曾庆钱. 线纹香茶菜染色体核型分析[J]. 种子, 2012, 31(6): 20-22, 27. DOI:10.16590/j.cnki.1001-4705.2012.06.043 HUANG S S, MO X L, ZENG Q Q. Analysis on kar yotye of Isodon lophanthoides (Buch.-Ham. ex D. Don) Hara[J]. Seed, 2012, 31(6): 20-22, 27. DOI:10.16590/j.cnki.1001-4705.2012.06.043 |
| [16] |
张翘, 潘超美, 黄向旭. 线纹香茶菜狭基变种和线纹香茶菜细花变种的染色体核型分析[J]. 安徽农业科学, 2012, 40(10): 5858-5859, 5875. DOI:10.13989/j.cnki.0517-6611.2012.10.170 ZHANG Q, PAN C M, HUANG X X. Karyotype analysis of Rabdosia lophanthoides var. gerardianus and Rabdosia lophanthoides Hara var. graciliflorus Chromosomes[J]. Journal of Anhui Agricultural Sciences, 2012, 40(10): 5858-5859, 5875. DOI:10.13989/j.cnki.0517-6611.2012.10.170 |
| [17] |
陈林姣, 陈月琴, 屈良鹄, 叶创兴, 赖小平. 中药溪黄草及其药用近缘种的RAPD分析[J]. 中山大学学报(自然科学版), 1999(1): 104-108. CHEN L J, CHEN Y Q, QU L H, YE C X, LAI X P. RAPD analysis on Chinese medicine Xihuangcao and its related species[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1999(1): 104-108. |
| [18] |
谭瑞湘, 黄娟, 徐文, 丘小惠, 徐江, 黄志海. 溪黄草及其混淆品的DNA分子鉴定研究[J]. 中药材, 2017, 40(2): 320-324. DOI:10.13863/j.issn1001-4454.2017.02.015 TAN R X, HUANG J, XU W, QIU X H, XU J, HUANG Z H. DNA molecular identification of Rabdosia serra and its confused products[J]. Journal of Chinese Medicinal Materials, 2017, 40(2): 320-324. DOI:10.13863/j.issn1001-4454.2017.02.015 |
| [19] |
莫小路, 曾庆钱, 黄珊珊, 蔡岳文, 王玉生, 严振. 应用RAPD技术对溪黄草基原植物分类鉴定[J]. 中药材, 2012, 35(9): 1388-1391. DOI:10.13863/j.issn1001-4454.2012.09.015 MO X L, ZENG Q Q, HUANG S S, CAI Y W, WANG Y S, YAN Z. Identification of Herba Rabdosiae serrae from different plant resources by RAPD method[J]. Journal of Chinese Medicinal Materials, 2012, 35(9): 1388-1391. DOI:10.13863/j.issn1001-4454.2012.09.015 |
| [20] |
孟艳辉, 邓芹英, 许国. 溪黄草的化学成分研究(Ⅱ)[J]. 天然产物研究与开发, 2000(3): 27-29. DOI:10.16333/j.1001-6880.2000.03.006 MENG Y H, DENG Q Y, XU G. Studies on the chemical constituents of chinese herb Rabdosia serra (Maxim) hara (Ⅱ)[J]. Natural Product Research and Development, 2000(3): 27-29. DOI:10.16333/j.1001-6880.2000.03.006 |
| [21] |
陈文飞, 陈晨, 夏凡, 师亦洁, 胡丹丹, 李玉鹏, 李鲜. 纤花线纹香茶菜化学成分的研究[J]. 云南中医学院学报, 2017, 40(2): 76-80. DOI:10.19288/j.cnki.issn.1000-2723.2017.02.018 CHEN W F, CHEN C, XIA F, SHI Y J, HU D D, LI Y P, LI X. Chemical constituents study on Isodon lophanthoides var. graciliflora[J]. Journal of Yunnan University of Traditional Chinese Medicine, 2017, 40(2): 76-80. DOI:10.19288/j.cnki.issn.1000-2723.2017.02.018 |
| [22] |
TÖPFER N, KLEESSEN S, NIKOLOSKI Z. Integration of metabolomics data into metabolic networks[J]. Frontiers in Plant Science, 2015, 17(6): 49. DOI:10.3389/fpls.2015.00049 |
| [23] |
JIA X, SUN S, YANG M, ZHANG Q, WANG N, JIN Y, DU Y. Integrated metabolomics, network pharmacology, and molecular docking to reveal the mechanisms of Isodon excisoides against drug-induced liver injury[J]. Biomed Chromatogr, 2023, 37(9): e5682. DOI:10.1002/bmc.5682 |
| [24] |
XIE W, MA Y, SUN W, GUAN S, JIN Y, DU Y. An integrative method based on UHPLC-Q-TOF-MS/MS combined with metabolomics to authenticate Isodon rubescens[J]. Analytical Biochemistry, 2021, 629: 114297. DOI:10.1016/j.ab.2021.114297 |
| [25] |
ZHANG K, YAO Y, WANG M, LIU F, WANG Q, MA H, XIE Y, MA Y, DAI P, ZHU C, LIN C. A UPLC-MS/MS-based metabolomics analysis of the pharmacological mechanisms of Rabdosia serra against cholestasis[J]. Phytomedicine, 2021, 91: 153683. DOI:10.1016/j.phymed.2021.153683 |
| [26] |
赵熙, 赵洋, 杨培迪, 宁静, 杨阳, 成杨, 刘振. 茶树种质资源汝城白毛茶的代谢物差异研究[J]. 热带作物学报, 2023, 44(1): 83-91. DOI:10.3969/j.issn.1000-2561.2023.01.009 ZHAO X, ZHAO Y, YANG P D, NING J, YANG Y, CHENG Y, LIU Z. Metabonomic analysis of metabolic differences in Rucheng baimaocha tea germplasm[J]. Chinese Journal of Tropical Crops, 2023, 44(1): 83-91. DOI:10.3969/j.issn.1000-2561.2023.01.009 |
| [27] |
DB4418/T 009-2020. 地理标志产品: 连州溪黄草[S]. 清远: 清远市市场监督管理局, 2020-10-01. http://www.csres.com/detail/265436.html. DB4418/T 009-2020. Geographical Indication Products: Lianzhou XIhuangcao[S]. Qingyuan: Qingyuan City Market Supervision Administration, 2020-10-01. http://www.csres.com/detail/265436.html. |
(责任编辑 马春敏)
 2024, Vol. 51
2024, Vol. 51