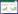文章信息
基金项目
- 广西自然科学基金(2021GXNSFBA075058);广西科技基地与人才专项项目(桂科AD20297037)
作者简介
- 高春莲(1999-),女,硕士,研究方向为生态系统服务,E-mail: gaochunlian25@163.com.
通讯作者
- 汪珍川(1990-),女,博士,助理研究员,研究方向为人工林生态与生态修复,E-mail: zhenchuan_wang@126.com.
文章历史
- 收稿日期:2024-01-17
2. 广西国有高峰林场,广西 南宁 530000;
3. 河池市林产工业工作站,广西 河池 547000
2. State-owned Gaofeng Forestry of Guangxi, Nanning 530000, China;
3. Hechi City Forestry Industry Workstation, Hechi 547000, China
【研究意义】氮是限制植物生长的重要营养元素[1]。自然界中部分微生物可以在固氮酶的作用下将大气中的氮气转化成植物可以直接利用的氮,这一过程称之为生物固氮,生物固氮是生态系统氮循环的重要环节,可根据固氮微生物的特点及其与植物的关系,分为共生固氮与非共生固氮两种类型[2]。一般而言,非共生固氮被定义为除在植物和微生物之间划定的共生固氮之外的任何生物固氮形式,包括异养固氮和自养固氮[2],其广泛分布于土壤、凋落物、苔藓、冠层叶片等不同生态系统组分中[3]。虽然在大多数森林生态系统中,共生固氮量要大于非共生固氮,但近年越来越多的研究表明,在缺乏固氮植物的生态系统中,普遍存在的非共生固氮是氮素输入的关键[4]。我国是世界上人工林面积增长速率最快的国家之一,人工林保存面积占世界的1/3,位居世界首位,但在人工林营林过程中,树种单一化现象十分常见,固氮植物缺乏、林内凋落物减少、土壤固氮能力降低,导致土地生产能力降低[5]。非共生固氮可能是人工林氮素积累及补偿森林氮素流失的重要来源,其可促进植物的生长和发育,维持人工林生产力的可持续性。
【前人研究进展】目前对非共生固氮的研究主要集中于固氮速率、固氮微生物、固氮酶类型等方面[6-8]。研究发现,非共生固氮的固氮效率常低于共生固氮,但非共生固氮的分布范围更广,不需要与植物形成特定的固氮结构[9],且不同样点间的非共生固氮效率差异显著,尤其在缺乏氮素、对氮素需求较高的生态系统中通过非共生固氮途径输入的氮素比例较大[10]。非共生固氮速率在不同的系统演替和土壤发育阶段内也有所不同[11],相对于常规耕作,非共生固氮在长期免耕地下土壤中的固氮量更高[12],农田或人工林等生态系统中往往也会通过非共生固氮途径实现部分氮素的输入[13]。不同人工林树种因凋落物输入和分解的不同,林分中的氮含量会有较大差异,如有研究表明桦木(Betula spp.)混交林木质根的非共生固氮量(0.17 kg/hm2·y)显著高于挪威云杉(Picea asperata mast)单作林木质根的非共生固氮量(0.06~0.15 kg/hm2·y)[14]。不同树种会影响土壤中的微生物群落结构和组成,从而影响土壤的氮转换速率,例如落叶松(Larix gmelinii)凋落物分解后的氮比常绿松凋落物保留在土壤中的氮更高[15]。当前学者们对人工林固氮的研究主要集中于不同树种的氮含量和速率量化分析[16-17]、氮元素含量和氮矿化、硝化作用研究[18-19]、外来氮源输入对固氮形成机制研究[20-21]等方面,但对人工林非共生固氮量空间分布等方面的研究较少。地统计学方法是以区域化变量为基础,将空间格局与生态过程联系起来,有效地揭示空间格局对生态过程的影响[22]。普通克里金(Ordinary Kriging)插值作为地统计学分析中应用范围比较广泛且普遍的一种空间插值预测方法,它在插值过程中不考虑全局趋势,在有限区域内对区域化的变量进行线型无偏最优估计,使预测结果更加接近实际情况[23],已有学者使用其展开生物固氮量的空间分异研究。如王鑫等[24]通过普通克里金插值分析稻田表层土壤生物固氮量的空间分布特征,发现稻田土壤的生物固氮量总体呈带状分布;马亚斌等[25]通过插值方法分析冬小麦生育期内土壤氮素的时空变异特征;方炫等[26]对比分析不同插值方法对土壤氮空间分布预测的影响。【本研究切入点】杉木(Cunninghamia lanceolata)、桉树(Eucalyptus)和马尾松(Pinus massoniana)作为我国南方主要的人工树种,具有生长快、产量高、用途广、材质好等特点,在广西种植面积极广[27],占广西全区乔木林总面积的48.9% 和乔木林总蓄积量的49.2%[28],但其非共生固氮量的空间分布尚不明晰。【拟解决的关键问题】在短期的人工林中,林内缺乏固氮植物,人工林生长所需的氮主要来源于非共生固氮和氮肥输入。因此,本研究在广西规模最大的国有高峰林场内分别选取3种主要的人工林(杉木、桉树、马尾松),测定并分析其不同生长季土壤、凋落物和冠层叶片的非共生固氮量并分析其空间分布特征,同时探讨非共生固氮量差异性和主要影响因子,以期为人工林系统氮输入、氮循环和氮利用提供基础数据,为广西人工林种植和管理等方面提供科学参考。
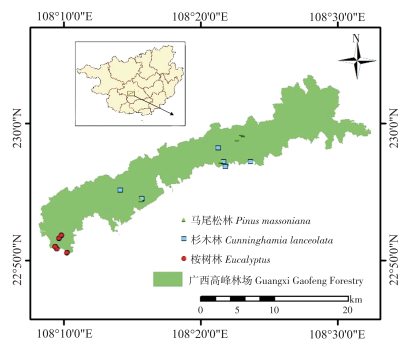
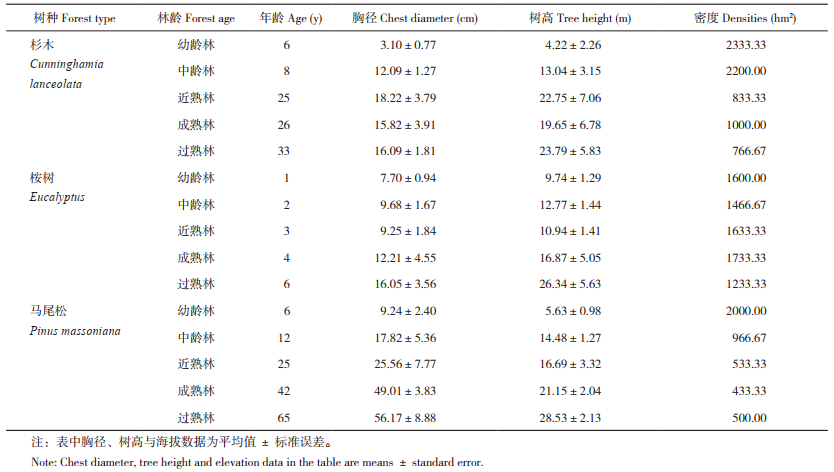
1 材料与方法 1.1 研究区概况本研究区位于广西规模最大的国有高峰林场(22°54'3.67''N、108°12'34.11''E)(图 1),属于热带季风气候,雨热同期,年均气温22.6 ℃,年均降雨量1 010.7mm,水资源丰富。主要人工林类型为杉木、桉树、马尾松,3种人工林生长迅速,其生产力均较高[29]。
|
| 图 1 研究区样点分布概况 Fig. 1 Overview of the distribution of sample sites in the study area |
高峰林场经营总面积约为5.933万hm2,其中场内造林面积3.2万hm2,域跨南宁市宾阳、上林2个县及兴宁、青秀、西乡塘、武鸣4个城区;场外造林面积2.73万hm2。在全区37个市(县、区)的森林蓄积量265万m3,森林覆盖率为83.7%。
1.2 研究方法1.2.1 样方布设 采用地理信息科学方法,在广西国有高峰林场分别选取具有代表性的杉木、桉树和马尾松3种人工林区域,在遥感影像上设置投影面积为400 m × 400 m的样地。考虑到非共生固氮量测定的难度及人工林主要分布在林场中西部,故选择立地条件相对一致(中下坡,坡度约35°)、代表性强的杉木、桉树和马尾松连片生长区域,按林龄(幼龄林、中龄林、近熟林、成熟林和过熟林)及各林龄的林分密度,分别建立3个面积20 m × 20 m的生态样方,样方间距 > 50 m,共计45个样方,杉木、桉树和马尾松样点信息如表 1所示。其中,幼龄林、中龄林和近熟林的杉木采用袋苗培育,成熟林和过熟林的杉木则为裸根苗培育,所有杉木均根据林分郁闭度进行间伐管理,且不施肥。桉树在袋育后按常规方法进行管理,对幼龄林、中龄林和近熟林的桉树进行抚育(每年施用桉树专用肥7.5 kg/hm2),而成熟林及以后的桉树无须进行抚育。幼龄林、中龄林和近熟林的马尾松用袋苗培育,成熟林和过熟林的马尾松则由直升飞机播种,均不施肥。
|
1.2.2 样品采集与预处理 于2021年5月和11月分别按生长季和非生长季采集样方内土壤、凋落物和冠层叶片3种样品。在每个样方内,随机选择5个15 cm × 15 cm的采样点。采样时,先用20 cm × 20 cm不锈钢框框取固定面积的凋落物,并将框内全部凋落物(剔除直径大于2 cm的枝条)装入无菌封口袋后充分混匀[11]。然后,利用直径为5 cm的土钻在每个凋落物采集点钻取1~2钻0~10 cm的表层土壤,挑除土壤中的杂物后充分混匀,同一个样方采集的土壤混合成一个样品。在每个样方内,随机选择3~5棵树,采用高枝剪剪取冠层不同采光面(包括顶部、中部和底部)的叶片后混合均匀。每个样方各采集土壤、凋落物和冠层叶片样品各1份,共3份。每个样方的土壤、凋落物和冠层叶片样品各取1份测定非共生固氮速率[30]。
1.2.3 非共生固氮量的估算 非共生固氮量的估算采用乙炔还原法[30]测定,非共生固氮速率及质量-面积转换因子计算结合进行。从每份混合样品中,首先取一定质量样品(土壤约10 g、凋落物和冠层叶片约3 g)后,分别置于130 mL带橡胶塞的玻璃培养瓶中。将瓶子密封后,用高纯乙炔(C2H2,纯度大于99.99%)置换瓶中10% 的空气。在野外自然条件下培养24 h后,利用无菌注射器将瓶内气体充分混匀后,抽出30 mL气体注入12 mL已抽真空的玻璃储气瓶中(Labco Exetainer, Labco Limited, UK),以仅有乙炔和仅有样品(土壤、凋落物、冠层叶片)的培养瓶作为对照,分别测定乙炔和样品本身的背景乙烯产生情况。所有样品带回实验室于1周内用配有毛细管柱的气相色谱仪(GC-FID;Agilent GC 7890A, Agilent, USA)测定乙烯浓度,并计算乙烯生成速率(即非共生固氮速率,nmol C2H4 /g·d)。在数据分析之前,减去乙烯平均背景值,再根据乙烯浓度、培养时间及实时培养温度,换算得到非共生固氮速率[30]。
参考Reed等[31]方法,分别采用以往研究在同一区域测定的土壤、凋落物和冠层叶片的转换系数(非共生固氮速率:氮气固氮速率)将非共生固氮速率转换成非共生固氮年通量(kg/hm2·y)。其中,土壤固氮年通量基于土壤容重、采集深度和基于单位重量的非共生固氮速率估算。凋落物的质量-面积转换因子计算单位面积的凋落物重量,结合基于单位重量的非共生固氮速率估算凋落物的非共生固氮年通量。凋落物质量-面积转换因子测定方法:在每个样方中随机放置5个不锈钢框(20 cm×20 cm)。然后,收集每个框内直径小于2 cm的散落的叶片和枝条。最后,将凋落物样品带回实验室装入信封内后,在65 ℃下烘干至恒重,记录重量,并计算质量-面积的转换因子。冠层叶片的质量-面积转换因子则通过将采集的冠层叶片带回实验室后测定比叶面积和叶面积指数进行计算。
1.2.4 数据处理 用SPSS 26.0软件中的描述性统计、变异系数及Shapiro-Wilk(S-W)检验样本数据的正态分布情况;采用ArcGIS 10.8软件的趋势分析工具和普通克里金插值方法模拟杉木、桉树和马尾松人工林生长季和非生长季土壤、凋落物和冠层叶片非共生固氮量在特定方向上存在的趋势和空间分布特征;使用SPSS 26.0软件的单因素方差(One-way ANOVA)和相关性分析方法,测算杉木、桉树和马尾松人工林生长季与非生长季土壤、凋落物和冠层叶片各组分之间非共生固氮量的差异性和相关性。
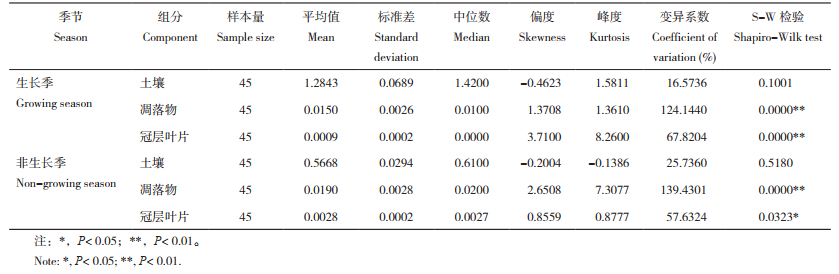
2 结果与分析 2.1 描述性分析通过对3种人工林生长季和非生长季的不同组分样本的非共生固氮量进行S-W检验、描述性统计及变异系数分析,结果如表 2所示。人工林土壤非共生固氮量在生长季和非生长季的S-W检验显著性均大于0.05,数据呈正态分布;而凋落物和冠层叶片S-W检验显著性均小于0.05,数据并非正态分布,其中生长季凋落物和冠层叶片的偏度、峰度分别为1.3708、3.7100和1.3610、8.2600,变异系数为124.1440%、67.8204%,非生长季凋落物和冠层叶片偏度、峰度分别为2.6508、0.8559和7.3077、0.8777,变异系数为139.4301%、57.6324%,体现了无论在生长季和非生长季凋落物非共生固氮量变异程度属于强空间变异程度,而冠层叶片属于中等空间变异程度[32],但生长季和非生长季凋落物、冠层叶片非共生固氮量偏度绝对值小于3并且峰度绝对值小于10,基本可接受为正态分布[33],数据可以进行地统计学分析。
|
2.2 人工林非共生固氮量的空间异质性
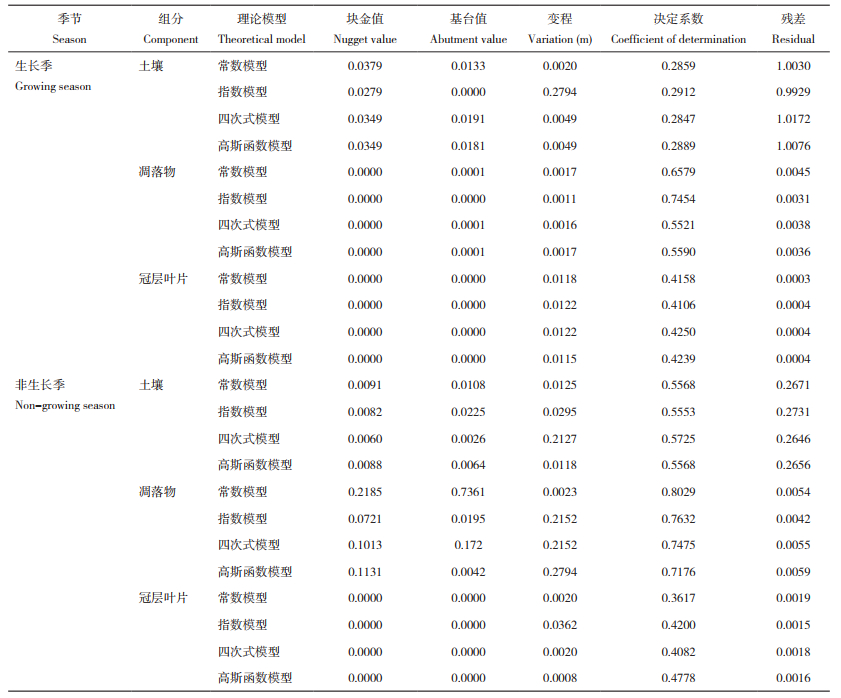
通过ArcGIS 10.8软件普通克里金插值方法模拟对比,为杉木、桉树和马尾松人工林土壤、凋落物和冠层叶片非共生固氮量插值选择最佳拟合模型(表 3),其中模拟结果中决定系数越接近1,残差越小则插值拟合效果越好[24]。由表 3可知,生长季土壤和凋落物指数型理论模型插值拟合效果最好,其决定系数分别为0.2912、0.7454,残差为0.9929、0.0031;冠层叶片则四次式模型插值拟合效果最好,决定系数为0.4250,残差为0.0004。非生长季,土壤四次式模型插值拟合效果最好,决定系数为0.5725,残差为0.2646;凋落物常数模型插值拟合效果最好,决定系数为0.8029,残差为0.0054,冠层叶片高斯函数模型插值拟合效果最好,决定系数为0.4778,残差为0.0016。无论生长季或非生长季,土壤、凋落物和冠层叶片非共生固氮量插值效果最好理论模型块金值都小于0.25,空间相关程度强烈,即人工林不同组分非共生固氮量受到季节、施肥量、种植密度、土地利用变化等因素的影响较大[34]。
|
2.3 人工林非共生固氮量空间分布特征
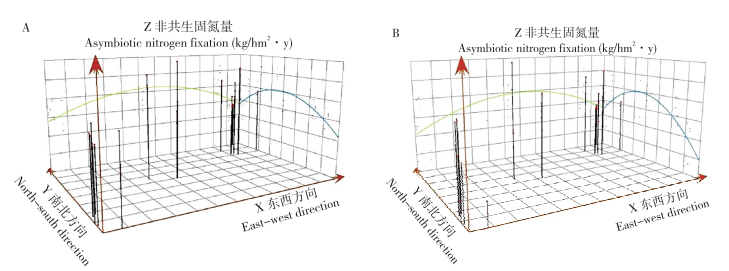
2.3.1 趋势分析 利用ArcGIS趋势分析得到人工林生长季和非生长季土壤、凋落物和冠层叶片非共生固氮量空间变化趋势(图 2~图 4)。在趋势分析图中,X轴和Y轴分别表示东西方向和南北方向的地理坐标,Z轴表示人工林不同组分的非共生固氮量,将采样点的空间位置与非共生固氮量投影到XZ表示东西方向上人工林不同组分非共生固氮量的全局变化趋势,则YZ表示南北方向上的全局变化趋势。对于生长季,土壤非共生固氮量在东西和南北方向上的趋势线表现为倒“U”型(图 2A);凋落物在东西和南北方向上为递增的曲线(图 3A);冠层叶片在东西方向为先增后减的曲线,南北方向为递增的抛物线(图 4A)。对于非生长季,土壤非共生固氮量与生长季变化趋势一致,为倒“U”型(图 2B);凋落物在东西方向上为先减后增的抛物线,南北方向上为递减的曲线(图 3B);冠层叶片与生长季变化趋势一致,但变化程度较大(图 4B)。总体来看,土壤、凋落物和冠层叶片非共生固氮量在生长季和非生长季的空间变化趋势显著,由此可以看出人工林不同季节不同组分非共生固氮量空间异质性较强。
|
| A:生长季;B: 非生长季 A: Growing season; B: Non-growingseason 图 2 人工林土壤非共生固氮量趋势分析图 Fig. 2 Trend analysis of ANF in plantation soil |
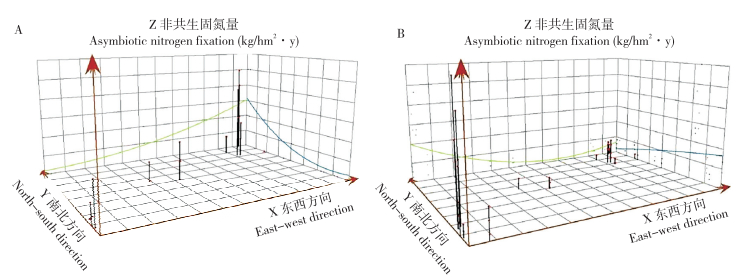
|
| A:生长季;B: 非生长季 A: Growing season; B: Non-growing season 图 3 人工林凋落物非共生固氮量趋势分析图 Fig. 3 Trend analysis of ANF by apoplastic litter in plantation forests |
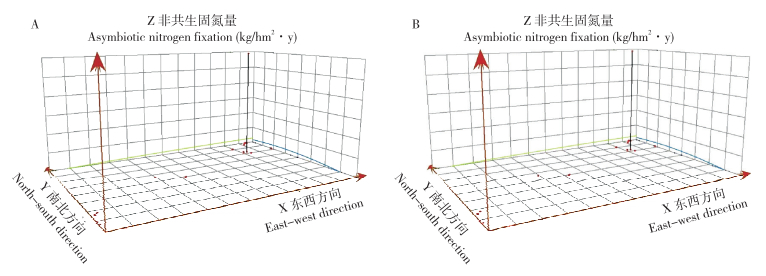
|
| A:生长季;B: 非生长季 A: Growing season; B: Non-growing season 图 4 人工林冠层叶片非共生固氮量趋势分析图 Fig. 4 Trend analysis of ANF in canopy leaves of plantation forests |
2.3.2 空间分布 选择插值最佳拟合模型对生长季和非生长季土壤、凋落物和冠层叶片非共生固氮量进行空间插值,插值时选择不同移除趋势阶数的插值方法对比分析插值结果,目的是使插值结果符合一定的评断标准内,使插值结果更为准确,插值测试结果见表 4。一般情况下,空间预测值平均误差和标准化平均误差越接近0,平均标准误差和均方根误差越接近,标准化均方根误差越接近1,插值模拟效果越好[35]。因此综合分析,生长季土壤和凋落物在移除趋势阶数为1时,插值模拟效果最好,冠层叶片为2时模拟效果最好;非生长季土壤、凋落物和冠层叶片三者除趋势阶数为1时,插值模拟效果最好。
根据上述插值方法选择最优拟合模型对人工林非共生固氮量进行空间插值,得到人工林生长季和非生长季不同组分非共生固氮量空间分布图(图 5~6)。由图可知,人工林生长季和非生长季不同组分非共生固氮量空间分布不相同,生长季土壤非共生固氮量空间分布呈现东北低西南高的特征,凋落物、冠层叶片与之相反,呈现东北高西南低的特征(图 5);非生长季,凋落物空间分布特征与生长季相反,呈现东北低西南高的分布特征,而土壤和冠层叶片空间分布大体上与生长季相似(图 6)。无论生长季与非生长季,土壤非共生固氮量预测均值(1.4911、0.6625 kg/hm2·y)远大于凋落物(0.0223、0.0255 kg/hm2·y)和冠层叶片(0.0011、0.0027 kg/hm2·y),这体现非共生固氮量主要集中在人工林土壤组分中。
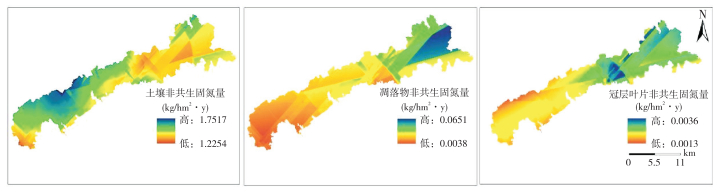
|
| 图 5 人工林生长季不同组分非共生固氮量空间分布 Fig. 5 Spatial distribution of ANF in different components of plantation forests during the growing season |
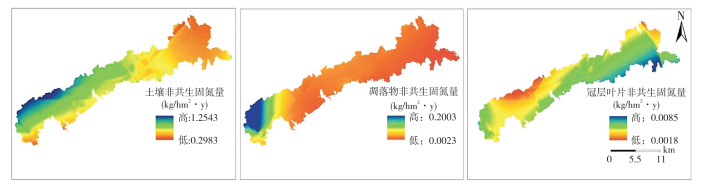
|
| 图 6 人工林非生长季不同组分非共生固氮量空间分布 Fig. 6 Spatial distribution of ANF in different components of plantation forests in the non-growing season |
采用普通克里金插值方法预测的生长季人工林土壤、凋落物和冠层叶片非共生固氮量范围分别为1.2254~1.7517、0.0038~0.0651、0.0013~0.0036 kg/hm2·y与实测值范围0.7638~1.9738、0.0000~0.0636、0.0000~0.0052 kg/hm2·y较为接近,非生长季插值预测范围0.2983~1.2543、0.0023~0.2003、0.0018~0.0085 kg/hm2·y与实测值范围0.2728~0.9827、0.0012~0.2185、0.0002~0.0077 kg/hm2·y也很接近,说明普通克里金插值方法能够较好地反映广西高峰林场人工林不同季节不同组分非共生固氮量的空间分布特征,预测结果较为准确。
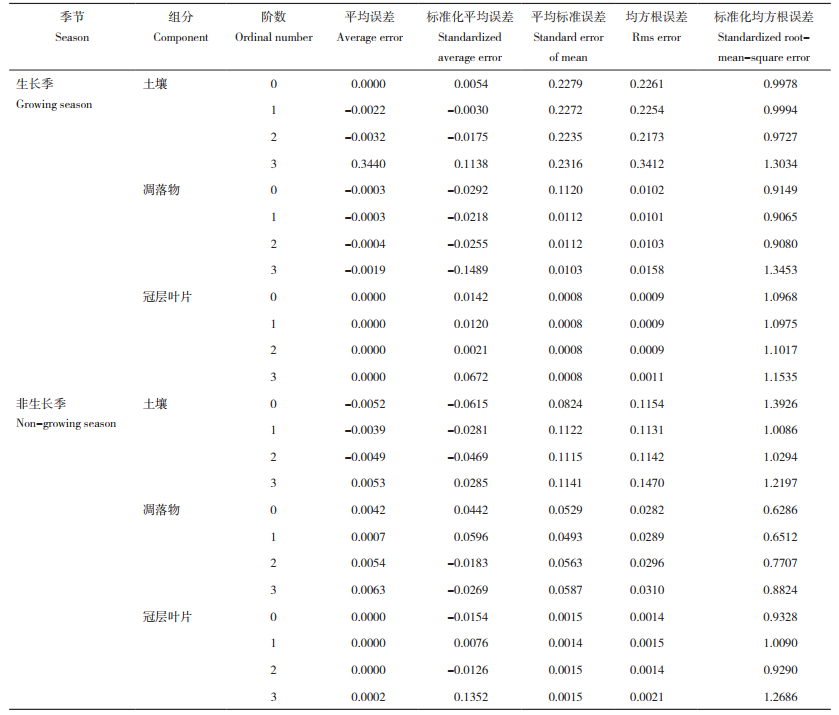
2.4 人工林非共生固氮量差异性和相关性分析利用单因素方差和相关性分析对比人工林非共生固氮量差异性和相关性,结果如表 4、表 5所示。由表 5可知,人工林土壤、凋落物和冠层叶片非共生固氮量在生长季和非生长季期间差异显著(P < 0.05),土壤非共生固氮量在生长季和非生长季期间变化更为明显,凋落物和冠层叶片非共生固氮量变化则不明显。此外,生长季人工林土壤、凋落物和冠层叶片非共生固氮量分别为1.2834、0.0150、0.0009 kg/hm2·y,非生长季分别为0.5668、0.0190、0.0028 kg/hm2·y。不论生长季或非生长季,人工林不同组分非共生固氮量大小均为土壤 > 凋落物 > 冠层叶片,土壤非共生固氮量与凋落物和冠层叶片差异显著,凋落物非共生固氮量与冠层叶片差异未达显著水平(P < 0.05)。
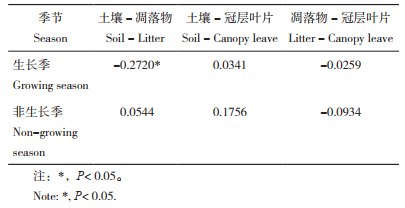
由表 6可知,人工林土壤、凋落物和冠层叶片非共生固氮量在生长季和非生长季期间相关性不同且显著性不强,主要体现在生长季,土壤非共生固氮量与凋落物呈显著负相关,与冠层叶片呈不显著正相关,凋落物与冠层叶片呈不显著负相关;在非生长季,土壤非共生固氮量与凋落物、冠层叶片呈不显著正相关,凋落物与冠层叶片呈不显著负相关。
|
3 讨论
季节、气温等的不同会引起森林生态系统非共生固氮效率的差异,从而造成非共生固氮量的差异及不同空间分布特征[36],本研究中人工林土壤、凋落物和冠层叶片非共生固氮量在生长季与非生长季期间差异显著且空间分布不同,尤其是生长季土壤非共生固氮量大于非生长季期间,非共生固氮量变化明显,这可能是非共生固氮微生物、非共生固氮酶活性、土壤团聚体等受到温度的影响从而影响非共生固氮速率[8];此外由于生长季人工林的施肥,如桉树生长通常需施入大量含氮、磷、钾等元素的桉树专用肥来促进生长,增加外来氮的输入从而提升土壤中的氮含量,抑制了人工林非共生固氮微生物的活动进而减少人工林土壤非共生固氮量[37];而在非生长季,土壤外源氮素的减少会使生态系统增加对非共生固氮的依赖和消耗[38],同时,凋落物中丰富营养物质和微生物为土壤非共生固氮微生物提供了有利的环境[39],且非生长季人工林的凋落物数量大于生长季,故而造成了非生长季人工林凋落物非共生固氮量大于生长季。本研究中生长季土壤非共生固氮量与凋落物呈显著负相关(P < 0.05),非生长季呈不显著正相关,这极有可能是凋落物的增加影响土壤有机碳含量从而影响土壤中的非共生固氮量,但具体是提高还是抑制土壤中的非共生固氮速率目前还未有研究指明[40],因此,土壤和凋落物非共生固氮量的空间分布具有一定的相似性(图 5~6)。已有研究表明,凋落物非共生固氮速率对温度的敏感性最高[41],因此,凋落物非共生固氮量在生长季与非生长季空间分布变化明显。
无论生长季还是非生长季,人工林不同组分非共生固氮量大小依次为土壤 > 凋落物 > 冠层叶片,这是因为土壤表层微生物活动更为剧烈,能够利用较多的土壤氮素,非共生固氮土壤中更加明显[12],进而导致土壤非共生固氮量与凋落物和冠层叶片非共生固氮含量差异显著,此外,人工林冠层叶片也会通过非共生固氮实现一部分氮素输入,但森林冠层固氮比较容易受到冠层叶片中磷、钼元素养分限制[8],因此冠层叶片中非共生固氮量往往较少。有研究表明,在次生林生长初期,土壤非共生固氮量较高可促植被冠层叶片扩大,而冠层叶片扩大可减少土壤水分的蒸散,间接增加土壤湿度,从而增加土壤固氮速[42],因此本文中冠层叶片非共生固氮量与土壤为正相关(表 6);同时,冠层叶片数量的增加会提升降雨截留能力,凋落物层增厚可以降低雨水的冲刷与减少径流,能够减少养分流失,从而提升土壤养分含量[43]。综上,当今社会经济的快速发展及社会对林产品的需求迅速增加,作为林场分布广、经济效益好具有广大发展前景的广西高峰林场,则可考虑不同季节在杉木、桉树和马尾松人工林非共生固氮含量较少的地区、对土壤合理地施入一定氮肥,既为经济、节能又环保的管理措施。此外,本文对杉木、桉树和马尾松人工林人工林非共生固氮空间变化特征和含量差异的驱动机制没有进行深入探究,这是本文的不足之处,今后研究可以着重从此方面进行深入探讨,为后续人工林种植培育提供更具有实质意义的理论支撑。
4 结论本研究选取广西高峰林场杉木、桉树和马尾松人工林测定分析生长季与非生长季土壤、凋落物、冠层叶片的非共生固氮量空间分布特征、差异性及相关性,得到如下结论:生长季,土壤、凋落物和冠层叶片非共生固氮量空间分布总体呈现东北高西南低的空间分布特征;非生长季,凋落物非共生固氮量空间分布特征与生长季相反,呈现东北低西南高的分布特征,而土壤和冠层叶片非共生固氮量空间分布大体上与生长季相似。人工林不同组分非共生固氮量大小依次为土壤(1.2843、0.5668 kg/hm2·y) > 凋落物(0.0150、0.0190 kg/hm2·y) > 冠层叶片(0.0009、0.0028 kg/hm2·y),土壤非共生固氮量与凋落物和冠层叶片差异显著,非共生固氮量主要集中在人工林土壤组分中。因此,未来林场种植杉木、桉树和马尾松可在不同生长季对土壤非共生固氮含量较少区域施入合适的氮肥,使土壤较快的恢复肥力,促进人工林的增长。
| [1] |
LEBAUER D S, TRESEDER K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed[J]. Ecology, 2008, 89(2): 371-379. DOI:10.1890/06-2057.1 |
| [2] |
REED S C, CLEVELAND C C, TOWNSEND A R. Functional ecology of free-living nitrogen fixation: A contemporary perspective[J]. Annual Review of Ecology, Evolution & Systematics, 2011, 42(1): 489-512. DOI:10.1146/annurev-ecolsys-102710-145034 |
| [3] |
DIÁKOVÁ K, BIASI C, ČAPEK P, MARTIKAINEN P J, MARUSHCHAK M E, PATOVA E N, ŠANTRŮČKOVÁ H. Variation in N2 fixation in subarctic tundra in relation to landscape position and nitrogen pools and fluxes[J]. Arctic, Antarctic, and Alpine Research, 2016, 48(1): 111-125. DOI:10.1657/AAAR0014-064 |
| [4] |
BENTON N T, ROBIN L C, DUNCAN N L M. Successional dynamics of nitrogen fixation and forest growth in regenerating cost a Rican rainforests[J]. Ecology, 2019, 100(4): e02637. DOI:10.1002/ecy.2637 |
| [5] |
SWANTJE O, HOOSHANG M, MATS O. Impact of tree species on soil carbon stocks and soil acidity in Southern Sweden[J]. Scandinavian Journal of Forest Research, 2006, 21(5): 364-371. DOI:10.1080/02827580600950172 |
| [6] |
陈利云, 张海林, 周志宇. 生物与非生物因素对共生固氮的影响[J]. 草业科学, 2010, 27(6): 64-70. CHEN L Y, ZHANG H L, ZHOU Z Y. Effect of biotic and abiotic factors on symbiotic nitrogen fixation[J]. Pratacultural Science, 2010, 27(6): 64-70. |
| [7] |
徐鹏霞, 韩丽丽, 贺纪正, 罗峰, 张丽梅. 非共生生物固氮微生物分子生态学研究进展[J]. 应用生态学报, 2017, 28(10): 3440-3450. DOI:10.13287/j.1001-9332.201710.035 XU P X, HAN L L, HE J Z, LONG F, ZHANG L M. Research advance on molecular ecology of asymbiotic nitrogen fixation microbes[J]. Chinese Journal of Applied Ecology, 2017, 28(10): 3440-3450. DOI:10.13287/j.1001-9332.201710.035 |
| [8] |
STANTON D E, BATTERMAN S A, VON FISCHER J C, HEDIN L O. Rapid nitrogen fixation by canopy microbiome in tropical forest determined by both phosphorus and molybdenum[J]. Ecology, 2019, 100(9): e02795. DOI:10.1002/ecy.2795 |
| [9] |
CLEVELAND C C, TOWNSEND A R, SCHIMEL D S, FISHER H, HOWARTH R W, HEDIN L O, PERAKIS S S, LATTY E F, FISHER J C, ELSEROAD A, WASSON M F. Global patterns of terrestrial biological nitrogen (N2) fixation in natural ecosystems[J]. Global Biogeochemical Cycles, 1999, 13(2): 623-645. DOI:10.1029/1999GB900014 |
| [10] |
HEDIN L O, BROOKSHIRE E N J, MENGE D N L, BARRON A R. The nitrogen paradox in tropical forest ecosystems[J]. Annual Review of Ecology, Evolution & Systematics, 2009, 40(4): 613-635. DOI:10.1146/annurev.ecolsys.37.091305.110246 |
| [11] |
WANG J P, WU Y H, LI J J, HE Q Q, HE Z, BING H J. Energetic supply regulates heterotrophic nitrogen fixation along a glacial chronosequence[J]. Soil Biology and Biochemistry, 2021, 154: 108150. DOI:10.1016/j.soilbio.2021.108150 |
| [12] |
FRANZEN D W, INGLETT P, GASCH C K. Asymbiotic nitrogen fixation is greater in soils under long-term no-till versus conventional tillage[J]. Soil Science Society of America Journal, 2019, 83(4): 1148-1152. DOI:10.2136/sssaj2019.03.0062 |
| [13] |
BOMFIM B, SILVA L C R, DOANE T A, HOWARTH W R. Interactive effects of land-use change and topography on asymbiotic nitrogen fixation in the Brazilian Atlantic Forest[J]. Biogeochemistry, 2019, 142: 137-153. DOI:10.1007/s10533-018-0525-z |
| [14] |
MÄKIPÄÄ R, HUHTINIEMI S, KASEVA J, SMOLANDER A. Asymbiotic nitrogen fixation on woody roots of Norway spruce and silver birch[J]. Canadian Journal of Forest Research, 2018, 48(2): 172-179. DOI:10.1139/cjfr-2017-0270 |
| [15] |
SMOLANDER A, KITUNEN V. Soil microbial activities and characteristics of dissolved organic C and N in relation to tree species[J]. Soil Biology & Biochemistry, 2002, 34(5): 651-660. DOI:10.1016/S0038-0717(01)00227-9 |
| [16] |
郑璐嘉, 黄志群, 何宗明, 刘瑞强, 肖好燕, 杜婷. 不同林龄杉木人工林细根氮稳定同位素组成及其对氮循环的指示[J]. 生态学报, 2016, 36(8): 2185-2191. ZHENG L J, HUANG Z Q, HE Z M, LIU R Q, XIAO H Y, DU T. N in fine roots of Cunninghamia lanceolata plantations of different ages and implications for soil nitrogen cydling rates[J]. Acta Ecologica Sinica, 2016, 36(8): 2185-2191. |
| [17] |
孔涛, 张莹, 雷泽勇, 王东丽, 刘洋, 于吉, 吴丹. 沙地樟子松人工林土壤氮矿化特征[J]. 干旱区研究, 2019, 36(2): 31-41. DOI:10.13866/j.azr.2019.02.04 KONG T, ZHANG Y, LEI Z Y, WANG D L, LIU Y, YU J, WU D. Soil nitrogen mineralization under Pinus sylvestris var. mongolica plantation on sandy soil[J]. Arid Zone Research, 2019, 36(2): 31-41. DOI:10.13866/j.azr.2019.02.04 |
| [18] |
王良桂, 张焕朝, 朱强根, 蒋永丰, 颜开义, 王福好. 不同林龄和连栽代次杨树人工林土壤氮矿质化特性[J]. 河南农业大学学报, 2010, 44(1): 28-33. DOI:10.16445/j.cnki.1000-2340.2010.01.018 WANG L G, ZHANG H C, ZHU Q G, JIANG Y F, YAN K Y, WANG F H. Characteristics of soil nitrogen mineralization in different aged stands and the successive rotation stands of poplar plantation[J]. Journal of Henan Agricultural University, 2010, 44(1): 28-33. DOI:10.16445/j.cnki.1000-2340.2010.01.018 |
| [19] |
张芸, 李惠通, 魏志超, 刘春华, 蒋宗垲, 马祥庆. 不同发育阶段杉木人工林土壤有机质特征及团聚体稳定性[J]. 生态学杂志, 2016, 35(8): 2029-2037. DOI:10.13292/j.1000-4890.201608.018 ZHANG Y, LI H T, WEI Z C, LIU C H, JIANG Z K, MA X Q. Soil organic matter characteristics and aggregate stability in different development stages of Chinese fir plantation[J]. Chinese Journal of Ecology, 2016, 35(8): 2029-2037. DOI:10.13292/j.1000-4890.201608.018 |
| [20] |
郑棉海, 陈浩, 朱晓敏, 毛庆功, 莫江明. 矿质养分输入对森林生物固氮的影响[J]. 生态学报, 2015, 35(24): 14. ZHEN M H, CHEN H, ZHU X M, MAO Q G, MO J M. Effects of the addition of mineral nutrients on biological nitrogen fixation in forest ecosystems[J]. Acta Ecologica Sinica, 2015, 35(24): 14. |
| [21] |
邓米林, 叶桂萍, 胥超, 宛颂, 贺纪正, 林永新. 林分类型和氮添加对亚热带森林土壤氧化亚氮排放的影响[J]. 水土保持学报, 2023, 37(6): 262-267. DOI:10.13870/j.cnki.stbcxb.2023.06.033 DENG M L, YE G P, XU C, WA S, HE J Z, LIN Y X. Effects of forest types and nitrogen addition on soil nitrous oxide emissions in a subtropical forest[J]. Journal of Soil and Water Conservation, 2023, 37(6): 262-267. DOI:10.13870/j.cnki.stbcxb.2023.06.033 |
| [22] |
WEI J B, XIAO D N, ZHANG X Y, ZHEN L X, YU L X. Spatial variability of soil organic carbon in relation to environmental factors of a typical small watershed in the black soil region, Northeast China[J]. Environmental Monitoring and Assessment, 2006, 121: 597-613. DOI:10.1007/s10661-005-9158-5 |
| [23] |
姚拓, 龙瑞军, 王刚, 胡自治. 兰州地区盐碱地小麦根际联合固氮菌分离及部分特性研究[J]. 土壤学报, 2004(3): 444-448. DOI:10.3321/j.issn:0564-3929.2004.03.018 YNO T, LONG R J, WANG G, HU Z Z. Isolation and characteristics of associative symbiotic nitrogen bacteria from rhizosphere of wheat in saline soil in Lanzhou area[J]. Acta Pedologica Sinica, 2004(3): 444-448. DOI:10.3321/j.issn:0564-3929.2004.03.018 |
| [24] |
王鑫, 姚尧, 徐梦洁, 庄舜尧. 宜兴市稻田表层土壤生物固氮量的空间分异特征[J]. 土壤, 2020, 52(3): 618-624. DOI:10.13758/j.cnki.tr.2020.03.028 WANG X, YAO Y, XU M J, ZHUANG X Y. Study on spatial characteristics of biological nitrogen fixation of rice paddy soils in Yixing City[J]. Soils, 2020, 52(3): 618-624. DOI:10.13758/j.cnki.tr.2020.03.028 |
| [25] |
马亚斌, 宋晓宇, 杨贵军, 王仁红, 全斌, 竞霞, 刘晓. 冬小麦生育期内土壤氮素的时空变异[J]. 中国农业科学, 2015, 48(20): 4086-4099. MA Y B, SONG X Y, YANG G J, WANG R H, QUAN B, LIU X. Emporal and spatial variation of soil nitrogen within growth stage of winter wheat[J]. Scientia Agricultura Sinica, 2015, 48(20): 4086-4099. |
| [26] |
方炫, 安韶山, 薛志婧, 李壁成. 基于最大似然法与矩法的黄土高原小流域土壤碳氮空间变异分析[J]. 水土保持通报, 2014, 34(4): 141-146. DOI:10.13961/j.cnki.stbctb.2014.04.041 FANG X, AN S S, XUAN Z J, LI B C. Analysis on spatial variability of soil organic carbon and nitrogen based on REML and MOM in a small watershed on Loess Plateau[J]. Bulletin of Soil and Water Conservation, 2014, 34(4): 141-146. DOI:10.13961/j.cnki.stbctb.2014.04.041 |
| [27] |
陶玉华, 隆卫革, 马麟英, 曹书阁, 向永达, 郭耆. 柳州市马尾松、杉木、桉树人工林碳储量及其分配[J]. 广东农业科学, 2011, 38(22): 42-45. DOI:10.16768/j.issn.1004-874X.2011.22.068 TAO Y H, LONG W G, MA L Y, CAO S G, XIANG Y D, GUO D. Carbon stocks and their allocation in plantation forests of Pine, Fir and Eucalyptus in Liuzhou city, China[J]. Guangdong Agricultural Sciences, 2011, 38(22): 42-45. DOI:10.16768/j.issn.1004-874X.2011.22.068 |
| [28] |
杨支齐, 杜虎, 曾馥平, 彭晚霞, 郭诗语, 宋同清, 何霄嘉. 广西主要人工林生态系统氮储量格局[J]. 生态学报, 2022, 42(13): 5446-5457. YANG Z Q, DU H, ZENG F P, PENG W X, GUO S Y, SONG T Q, HE X J. Nitrogen storage patterns of main plantation ecosystems in Guangxi[J]. Acta Ecologica Sinica, 2022, 42(13): 5446-5457. |
| [29] |
杜虎, 曾馥平, 王克林, 宋同清, 温远光, 李春干, 彭晚霞, 梁宏温, 朱宏光, 曾昭霞. 中国南方3种主要人工林生物量和生产力的动态变化[J]. 生态学报, 2014, 34: 2712-2724. DU H, ZENG F P, WANG K L, SONG T Q, WEN Y G, LI C G, PENG W X, LIANG H W, ZHU H G, ZENG Z X. Dynamics of biomass and productivity of three major plantation types in southern China[J]. Acta Ecologica Sinica, 2014, 34: 2712-2724. |
| [30] |
WANG Z C, LI D J, ZHENG M H, CHEN H, SUN X B, WANG K L. Topography modulates effects of nitrogen deposition on asymbiotic N2 fixation in soil but not litter or moss in a secondary karst forest[J]. Journal of Geophysical Research: Biogeosciences, 2019, 124(10): 3015-3023. DOI:10.1029/2019JG005291 |
| [31] |
REED S C, CLEVELAND C C, TOWNSEND A R. Tree species control rates of free-living nitrogen fixation in a tropical rain forest[J]. Ecology, 2008, 89(10): 2924-2934. DOI:10.1890/07-1430.1 |
| [32] |
HAAHTELA K, KARI K, SUNDMAN V. Nitrogenase activity (acetylene reduction) of root-associated, cold-climate Azospirillum, Enterobacter, Klebsiella, and Pseudomonas species during growth on various carbon sources and at various partial pressures of oxygen[J]. Applied and Environmental Microbiology, 1983, 45(2): 563. DOI:10.1128/aem.45.2.563-570.1983 |
| [33] |
DREZNER Z, ZEROM O T D. A modified Kolmogorov-Smirnov test for normality[J]. Mpra Paper, 2010, 39(4): 693-704. DOI:10.1080/03610911003615816 |
| [34] |
胡碧峰. 基于地统计学与GIS的区域土壤重金属污染评价与不确定性分析[D]. 杭州: 浙江大学, 2017. HU B F. Regional soil heavy metal pollution evaluation and uncertainty analysis based on Geostatistics and GIS[D]. Hangzhou: Zhejiang University, 2017. |
| [35] |
李小曼, 刘勤, 徐梦洁, 孟令仪. 苏南村镇土壤重金属空间变异性研究[J]. 土壤通报, 2016, 47(1): 179-185. DOI:10.19336/j.cnki.trtb.2016.01.028 LI X M, LIU Q, XU M J, MENG L Y. Spatial variability of heavy metal contents in towns of southern Jiangsu province[J]. Chinese Journal of Soil Science, 2016, 47(1): 179-185. DOI:10.19336/j.cnki.trtb.2016.01.028 |
| [36] |
WONG M Y, NEILL C, MARINO R, SILVÉRIO D, HOWARTH R W. Molybdenum, phosphorus, and pH do not constrain nitrogen fixation in a tropical forest in the southeastern Amazon[J]. Ecology, 2021, 102(1): e03211. DOI:10.1002/ecy.3211 |
| [37] |
韩晓日, 邹德乙, 郭鹏程, 陈恩凤. 长期施肥条件下土壤生物量氮的动态及其调控氮素营养的作用[J]. 植物营养与肥料学报, 1996(1): 16-22. HAN X R, ZHOU D Y, GUO P C, CHEN E F. Change of soil biomass-N and its role in adjusting-controlling nitrogen nutrition under long-term fertilization condetions[J]. Journal of Plant Nutrition and Fertilizers, 1996(1): 16-22. |
| [38] |
ROLEY S S, DUNCAN D S, LIANG D, GAROUTTE A, JACKSON R D, TIEDJE J M, ROBERTSON G P. Associative nitrogen fixation (ANF) in switchgrass (Panacum virgatum) across a nitrogen input gradient[J]. PLoS One, 2018, 13(6): e0197320. DOI:10.1371/journal.pone.0197320 |
| [39] |
NORMAN J S, FRIESEN M L. Complex N acquisition by soil diazotrophs: how the ability to release exoenzymes affects N fixation by terrestrial free-living diazotrophs[J]. Isme Journal, 2017, 11(2): 315-326. DOI:10.1038/ismej.2016.127 |
| [40] |
GUPTA V V S R, ROPER M M, ROGET D K. Potential for nonsymbiotic N2-fixation in different agroecological zones of Southern Australia[J]. Australian Journal of Soil Research, 2006, 44(4): 343-354. DOI:10.1071/SR05122 |
| [41] |
LI D J, ZHANG Q S, XIAO K C, WANG Z C, WANG K L. Divergent responses of biological nitrogen fixation in soil, litter and moss to temperature and moisture in a karst forest, southwest China[J]. Soil Biology and Biochemistry, 2018, 118: 1-7. DOI:10.1016/j.soilbio.2017.11.026 |
| [42] |
KEUTER A, VELDKAMP E, CORRE M D. Asymbiotic biological nitrogen fixation in a temperate grassland as affected by management practices[J]. Soil Biology and Biochemistry, 2014, 70: 38-46. DOI:10.1016/j.soilbio.2013.12.009 |
| [43] |
韦自强, 郑磊, 贺怀宇, 王振国, 伊坏虎, 任鹏, 辛颖. 大兴安岭重度火烧迹地不同林龄落叶松人工林土壤团聚体养分特征[J]. 水土保持学报, 2024, 38(1): 347-356. DOI:10.13870/j.cnki.stbcxb.2024.01.024 WEI Z Q, ZHENG L, HE H Y, WANG Z G, YI H H, REN P, XING Y. Nutrient characteristics of soil aggregates in larix gmelinii plantations of different forest ages from seriously burned area in Great Khingan Mountains[J]. Journal of Soil and Water Conservation, 2024, 38(1): 347-356. DOI:10.13870/j.cnki.stbcxb.2024.01.024 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51