文章信息
基金项目
- 国家自然科学基金(32270381);"十四五"广东省农业科技创新十大主攻方向"揭榜挂帅"项目(2022SDZG07)
作者简介
- 李鸿雁(1999—),男,在读硕士生,研究方向为植物- 微生物互作,E-mail:976716627@qq.com.
通讯作者
- 梁祥修(1985—),男,博士,教授,研究方向为植物- 微生物互作,E-mail:liangxiangxiu@scau.edu.cn.
文章历史
- 收稿日期:2023-10-22
2. 岭南现代农业科学与技术广东省实验室,广东 广州 510642
2. Guangdong Laboratory for Lingnan Modern Agricultural Science and Technology, Guangzhou 510642, China
柑橘黄龙病(Citrus Huanglongbing, HLB),又称嫩芽病(Citrus yellow shoot)或青果病(Citrus greening),是柑橘生产上最具毁灭性的病害,每年造成全球数百亿元的经济损失,严重阻碍了全世界范围内柑橘产业的发展[1]。柑橘黄龙病的病原菌来自变形菌纲根瘤菌目根瘤菌科的韧皮部杆菌属(Candidatus Liberibacter spp.),柑橘黄龙病菌包括3个种:亚洲种(Candidatus Liberibacter asiaticus, CLas)、非洲种(Candidatus Liberibacter africanus, CLaf)和美洲种(Candidatus Liberibacter americanus, Clam)[2]。亚洲种又被称为亚洲韧皮部杆菌,是全球范围内分布最广、为害最严重的柑橘黄龙病致病菌。亚洲韧皮部杆菌属于革兰氏阴性菌,其基因组大小约为1.2 Mb,编码约1 136个不同的蛋白。亚洲韧皮部杆菌基因组缺少合成色氨酸、酪氨酸、亮氨酸、异亮氨酸和缬氨酸的相关酶类,以及与有氧呼吸相关的关键酶,无法在人工培养基中生长,在营养和代谢方面均对柑橘类植物有很强的依赖性[3]。亚洲韧皮部杆菌主要定殖于营养丰富的柑橘韧皮部,通过柑橘木虱(Diaphorina citri)取食时的刺吸行为在柑橘类植物中传播。柑橘木虱是黄龙病菌的中间宿主,感染黄龙病菌的柑橘木虱终身带菌,给黄龙病的防控带来巨大挑战。黄龙病蔓延速度极快,一旦有柑橘感染黄龙病,会在数年内使整片果园患病,最终导致柑橘全部死亡。
效应子(Effectors)是一类广泛存在于病原微生物中的分泌蛋白,又称效应蛋白。病原菌能够通过特殊分泌结构将效应子运输到宿主细胞内,从而靶向宿主细胞重要的免疫调控组分,进而抑制宿主细胞防御反应,增强病原菌的定殖。效应子是病原微生物重要的毒力因子,除了N端普遍具有引导分泌的信号肽序列外,效应子通常无跨膜结构域和明显的已知蛋白结构域[4]。病原微生物效应子通过多种分泌机制被运输到宿主细胞中,如革兰氏阴性菌往往通过类似注射器状的Ⅲ型分泌系统(Type III secretion system, T3SS)来向宿主分泌效应子。亚洲韧皮部杆菌缺乏Ⅲ型分泌系统,其效应子的分泌依赖Sec分泌途径和一些未知的分泌途径。效应子是病原菌侵染植物的重要武器,效应子与宿主靶标的互作是研究植物与病原微生物互作的主要方向之一,对于解析病原菌致病机制和寻找植物重要抗病基因具有重要的意义[5-7]。近年来,随着亚洲韧皮部杆菌和柑橘基因组的解析,研究者们开始关注黄龙病菌效应子的相关研究,一些黄龙病菌效应子的致病机制也陆续被揭示,这对于理解黄龙病菌致病机制和黄龙病的科学防控具有重要的指导意义。本文主要以亚洲韧皮部杆菌为主,总结柑橘黄龙病菌效应子的研究进展。
1 柑橘黄龙病研究概况柑橘黄龙病于1919年在我国广东首次被报道,主要感染芸香科柑橘属植物柑橘(Citrus reticulata Blanco),时至今日仍是我国乃至世界范围内重要的柑橘病害[1]。柑橘在大约140个国家及地区种植,是全世界范围内最重要的果树之一,也是我国产量最高的水果之一。柑橘原产中国,其果实是重要的水果,柑橘的皮可药用,也可提取精油、制成香水[8]。在岭南地区,柑橘成熟干燥的果皮经陈化成为重要的中药材——广陈皮[9-10]。据统计,2022年广东新会陈皮全产业链产值达190亿元,而每年需花费大量的经费投入到防治柑橘黄龙病,大量病树被砍伐,造成巨额的经济损失,柑橘黄龙病已然成为柑橘生产的头号病害[11]。柑橘黄龙病严重影响柑橘类果实的产量与品质,患病柑橘表现为叶片硬化,出现不规则黄绿斑块,新芽发黄,果实小、畸形、着色不均且过早掉落,根系腐烂,树势衰弱,生长缓慢[12-13]。研究表明,这些症状与定殖在柑橘韧皮部的黄龙病菌密切相关,黄龙病菌严重损害了柑橘韧皮部装载以及光同化产物的分配等过程[14]。亚洲韧皮部杆菌是全球分布最广、为害最严重的柑橘黄龙病致病菌,由于其不能在人工培养基上进行生长,无法对菌株进行遗传转化等操作,严重阻碍了柑橘黄龙病致病机制的研究[15]。目前,柑橘黄龙病的主要防治措施包括施用抗生素、植物激素、抗菌肽,温热疗法以及多种方法联用等,各种方法均有一定成效,但都无法根治柑橘黄龙病[12]。因此,预防感染仍是目前柑橘黄龙病的主要防控策略,例如,及时发现并清除带病苗木,阻断中间宿主柑橘木虱的传播,切断其他可能的疾病传播途径[16]。柑橘黄龙病防治较为困难,因此迫切需要增强对黄龙病菌致病机制的理解,开发新的黄龙病病害防控策略,以保障柑橘产业的发展。
随着对柑橘黄龙病研究的深入,各种黄龙病防控手段被相继提出,目前的防治手段主要是从抑制病原菌致病力和增强柑橘抗病性两个方面着手。一是对柑橘黄龙病菌的一些关键生化过程进行抑制。Barnett等[17]在异源菌株Sinorhizobium meliloti(Sme)中通过高通量筛选,获得61种具有抑制亚洲韧皮部杆菌转录激活能力的化合物。有研究者利用基于分子对接的虚拟筛选系统鉴定到新型的小分子抑制剂,其能够抑制Sec分泌途径的关键组分SecA蛋白,抑制效应子分泌,从而抑制病原菌致病力,体外抑菌实验结果表明P684-2850、P684-3808两种化合物被证明具有很强的抑菌活性[18]。二是从柑橘抗病性研究出发,寻找柑橘重要的抗病蛋白。有研究通过比较分析柑橘黄龙病易感柑橘品种和耐受柑橘品种的小RNA和mRNA差异,鉴定到一类与柑橘黄龙病耐受性有关的稳定抗菌肽(Stable antimicrobial peptides, SAMPs),这种抗菌肽能够诱导宿主免疫反应的激活,从而实现对黄龙病菌侵染的抗性[19]。CiNPR4是水杨酸(Salicylic acid, SA)介导的防御反应中的重要调控基因,将HLB耐受品种‘杰克逊’葡萄柚(Citrus paradisi Macf.)的CiNPR4转入易感型品种‘万金城橙’(Citrus sinensis Obseck)中后,转基因柑橘对黄龙病的抗性显著增强,且在染病后淀粉异常积累得更加缓慢、韧皮部结构损伤更小,表现出更轻微的病症[20]。
2 效应子与植物天然免疫效应子是病原微生物攻击植物的重要武器,对病原菌的致病力有重要贡献。很多效应子能够被分泌到宿主细胞中,并靶向宿主细胞一些重要的调控蛋白,从而操纵宿主的生长发育和代谢过程,抑制宿主免疫反应,以促进病原菌的生长和侵染[21-22]。自然界中的植物时刻处于富含微生物的环境,在植物与微生物长期协同进化过程中,植物进化出能够抵御病原菌的防御系统,即植物天然免疫系统(Plant innate immune system)。成功感知病原微生物的存在是植物激活免疫反应的关键,位于植物细胞表面的模式识别受体(Pattern recognition receptors, PRRs)能够感知一些微生物保守的特征性分子,这些分子被称为病原相关分子模式(Pathogen-associated molecular patterns, PAMPs),如细菌的鞭毛蛋白、转录延伸因子、脂多糖等。植物通过识别PAMP分子,从而感知病原菌的入侵,并激活一系列免疫反应,如感染部位活性氧(Reactive oxygen species, ROS)的产生、细胞壁上的胼胝质沉积、防卫相关基因的表达等,这类免疫反应被称为PAMPs诱导的免疫(PAMP-triggered immunity, PTI)。一些病原菌能够向植物分泌致病蛋白(即效应子),靶向植物重要的免疫调控组分,从而阻断植物免疫激活,促进病原菌的侵染[23]。而植物细胞内存在特异性识别效应子的NLR(Nucleotide-binding domain and leucine-rich repeat)免疫受体,能够识别一些效应子,从而激活更为强烈的效应子诱导的免疫(Effector-triggered immunity, ETI),该反应包括超敏反应(Hypersensitive response, HR)、细胞壁木质化、植物抗菌素累积等[24]。由于黄龙病菌遗传和分子生化操作体系的难度较高,目前关于植物对黄龙病菌免疫的研究相对较少。Ma等[25]发现柑橘黄龙病是一种病原菌诱导的植物免疫相关病害,亚洲韧皮部杆菌侵染诱导韧皮部组织缓慢且系统性的免疫反应,包括防御相关基因的表达、ROS的产生和胼胝质沉积。同时,亚洲韧皮部杆菌上调了柑橘与ROS爆发相关的NADPH氧化酶基因的表达,下调了抗氧化酶基因的表达,从而引起持续的氧化应激,对柑橘细胞造成损伤。该研究认为持续的氧化应激是造成柑橘黄龙病症状的重要原因[25-26]。总之,目前关于柑橘对黄龙病菌的免疫响应机制仍需要更多研究去揭示。
3 亚洲韧皮部杆菌效应子分类病原菌需要将效应子分泌至宿主细胞,该过程依赖于病原菌的分泌系统[27]。革兰氏阴性菌中存在多种分泌系统,根据底物运输的方式可以分为一步分泌系统和两步分泌系统:一步分泌系统直接将底物从细菌胞质运输到胞外,包括Ⅰ、Ⅲ、Ⅳ、Ⅵ型分泌系统;两步分泌系统的底物运输是不连续的,主要包括双精氨酸转运酶(Tat)分泌途径、一般分泌(Sec)途径、Ⅱ型分泌系统、Ⅴ型分泌系统等[28]。在两步分泌系统中,Tat分泌途径与Sec分泌途径作为输出系统,将底物从胞质跨内膜运输到细菌内外膜间的周质空间,再由Ⅱ型、Ⅴ型分泌系统将蛋白运输至胞外[29]。相关研究表明,亚洲韧皮部杆菌具有Sec分泌途径、Ⅰ型分泌系统、不完整的Ⅱ型分泌系统和一些尚不明确的途径[3]。Sec分泌途径的特征是蛋白质的N端具有引导蛋白质合成加工的信号肽(Signal peptide, SP)序列,具有这类信号肽的效应子被称为Sec依赖型效应子。效应子信号肽预测结合分泌实验分析表明,亚洲韧皮部杆菌存在近百种Sec依赖型效应子,其中多个效应子已被证明能够抑制植物抗病反应,引起植物细胞坏死[30]。这类效应子在黄龙病菌的致病过程中发挥重要作用,能够靶向宿主细胞多个重要的免疫调控组分,从而促进黄龙病菌侵染,关于黄龙病菌Sec依赖型效应子功能和机制的相关报道见表 1。分泌途径尚不明确的效应子被称为非经典分泌效应子,其缺乏已知的信号肽序列或分泌基序,对应的分泌途径也尚不清楚。有研究推测亚洲韧皮部杆菌中有15个通过非经典分泌途径分泌的效应子。与Sec依赖型效应子相比,目前关于非经典分泌效应子的研究较少,这些效应子主要由原噬菌体区域的基因编码,原噬菌体基因组由于被整合到亚洲韧皮部杆菌基因组中得以保留,研究表明该部分基因在亚洲韧皮部杆菌致病性、适应性和生存等方面发挥重要作用[31]。Du等[32]通过筛选发现,亚洲韧皮部杆菌中10个非经典分泌效应子能够抑制细胞死亡发生、抑制激发子BAX和INF1诱导的H2O2积累,并诱导防卫基因PR1、PR2、PR5等的表达。
4 亚洲韧皮部杆菌效应子抑制宿主防御反应效应子在病原菌侵染宿主细胞过程中发挥重要作用,其通过扰乱植物免疫信号转导、细胞自噬、蛋白转运、基因转录、营养和代谢等多个细胞生理过程,以达到病原菌定殖的目的[51-54]。柑橘黄龙病菌效应子同样对宿主的多个细胞生理过程进行扰乱,从而引发严重的柑橘黄龙病。
4.1 效应子操纵植物免疫信号转导病原菌侵染会激活植物免疫反应,如激活PR1等防卫基因的表达、引发超敏性细胞死亡等。Ying等[40]利用生物信息学手段对黄龙病菌Sec依赖型效应子进行预测,并利用烟草瞬时表达体系对候选效应子进行功能分析。研究发现,多个Sec依赖型效应子能够干扰宿主免疫反应,如瞬时表达效应子CLIBASIA_05150和CLIBASIA_04065能引发烟草细胞死亡,而表达CLIBASIA_00470和CLIBASIA_04025能够抑制本氏烟生长发育,使烟草矮化。亚细胞定位结果表明,CLIBASIA_05150在高尔基体中表达,CLIBASIA_04065定位于线粒体,而CLIBASIA_00470和CLIBASIA_04025位于细胞质中。酵母双杂交实验发现,这些效应子与柑橘中多个防卫蛋白存在互作。
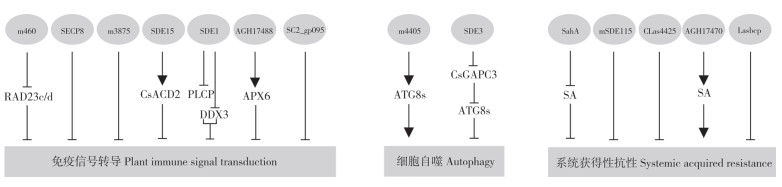
黄龙病菌效应子能够在多个水平上影响植物免疫,调控植物细胞基因的转录、翻译等过程。研究报道,效应子m460能够被宿主感知,并诱导植物免疫反应,烟草中瞬时表达m460后,叶片产生坏死斑点。带有N端核定位序列(Nuclear localization sequence, NLS)的NLS-m460在入核后,能引发烟草叶片局部严重萎黄和坏死,推测m460可能影响细胞核内基因转录等过程,从而干扰植物免疫[37]。进一步研究发现,m460能够与参与植物蛋白周转调控的RAD23c和RAD23d蛋白相互作用,并且能够抑制抗病蛋白PRFD1416V诱导的超敏反应,进一步揭示了效应子m460在柑橘中的致病机制[38]。
病原菌效应子的核心作用是抑制植物免疫[55-56]。SECP8是Sec依赖型效应子,研究表明SECP8能够抑制激发子BAX和INF1诱导的超敏反应相关表型,包括细胞死亡、H2O2积累和胼胝质沉积。在过表达SECP8的转基因柑橘中,包括PR1、PR2、PR5和FRK1在内的多个防卫基因表达下调,植物对柑橘黄龙病感病性显著增强,表明SECP8能够显著抑制宿主免疫反应[50]。此外,Sec依赖型效应子m3875同样可以抑制BAX和INF1诱导的细胞死亡和H2O2积累,瞬时表达m3875还下调了介导Ca2+转运的CNGC(Cyclic nucleotide-gateated channels)基因表达,CNGC是一类重要的离子通道,参与植物防御机制[41, 57]。木瓜蛋白酶类半胱氨酸蛋白酶(Papain-like cysteine proteases, PLCPs)被报道在植物对多种病原菌的抗性中发挥重要功能[58]。亚洲韧皮部杆菌的侵染能够显著诱导PLCPs表达量上调,黄龙病菌效应子SDE1(Sec-delivery effector 1)又称Las5315mp,能够与柑橘PLCPs相互作用,并抑制该蛋白酶活性,从而抑制PLCPs参与的植物免疫反应[48]。进一步研究发现,SDE1与烟草和柑橘中的DEAD-box RNA解旋酶(DEAD-box RNA helicase, DDX3)相互作用,在感病的柑橘叶片中DDX3表达下调,引起柑橘黄龙病典型的黄化症状[49],推测SDE1可能存在多个毒性靶标,以多种方式干扰柑橘免疫反应。
为防止植物免疫被过度激活,植物细胞内通常存在一些免疫负调控因子,而有些免疫负调控因子也被称为感病基因,是基因编辑的优良候选靶标,通过对感病基因的编辑可以提高植物抗病性[59]。例如,ACD2(Accelerated cell death 2)能够编码叶绿素分解代谢还原酶、抑制植物程序性细胞死亡,是植物重要的感病基因[60]。在沉默CsACD2的转基因柑橘株系中,植物免疫被异常激活,防卫基因FRK1、PR1、PR3、PR5等的表达显著上调,并引发植物细胞死亡。研究发现,亚洲韧皮部杆菌效应子SDE15会靶向柑橘感病基因CsACD2,推测SDE15可能通过激活CsACD2来抑制植物免疫,促进黄龙病侵染[43]。
此外,一些非经典分泌效应子的功能也被报道。例如,效应子SC2_gp095被认为是活性氧清除过氧化物酶,能够抑制宿主ROS的产生,在烟草中瞬时表达SC2_gp095后,NADPH氧化酶基因RbohB转录显著下调,从而抑制ROS爆发[61]。抗坏血酸过氧化物酶6(Ascorbate peroxidase 6, APX6)是叶绿体中清除活性氧的关键酶,效应子AGH17488通过靶向本氏烟和柑橘中的APX6来抑制植物免疫。蛋白质正确的亚细胞定位对细胞正常行使功能至关重要。通过在烟草细胞中共表达AGH17488与APX6发现,APX6由叶绿体定位逐渐转为膜定位,受激活的APX6抑制植物中ROS的积累,从而抑制植物免疫,促进病原菌增殖[62]。
4.2 效应子干扰宿主自噬相关的免疫反应自噬是植物一种重要的防御机制,作为一种保守的降解途径,自噬通过回收裂解细胞中受损或不需要的物质来维持细胞稳态[63-64]。ATG蛋白是自噬途径中的一类关键调控蛋白,其中,ATG8与各类自噬受体相互作用,靶向特定蛋白、细胞器或病原体形成自噬小体,并进一步运输到液泡进行降解[65-66]。自噬有利于植物抵御病原菌的侵染,在植物抗病中也发挥重要作用,因此自噬过程也成为病原菌效应子攻击的靶标。
病原菌效应子通过靶向宿主自噬过程的重要调控组分,从而操控植物自噬过程,以利于病原菌侵染。亚洲韧皮部杆菌分泌的m4405(SDE4405)是一种Sec依赖型效应子,可抑制基于超敏反应的细胞死亡,在异源过表达m4405的转基因烟草中,作为植物防御调节因子的6个小分子热激蛋白编码基因表达显著提升。相比野生型柑橘,亚洲韧皮部杆菌更易于定殖表达m4405的转基因柑橘,转基因柑橘也更早地出现缺锌、黄化等柑橘黄龙病症状[44]。进一步研究发现,效应子m4405与植物ATG8s蛋白存在相互作用,能够激活本氏烟和柑橘中的细胞自噬[45]。此外,Shi等[34]研究发现,黄龙病菌Sec依赖型效应子SDE3直接与柑橘甘油醛-3- 磷酸脱氢酶(Citrus cytosolic glyceraldehyde-3-phosphate dehydrogenases, CsGAPCs)结合,并以CsGAPC1依赖性方式降解CsATG8家族蛋白,以破坏宿主细胞自噬介导的免疫。GAPCs被报道在烟草和拟南芥中负调控植物免疫,在柑橘中CsGAPCs如何抑制防御信号并促进黄龙病菌增殖还有待进一步研究。
4.3 效应子干扰植物系统获得性抗性系统获得性抗性(Systemic acquired resistance, SAR)是指病原微生物侵染植物局部组织和细胞后,通过SA等信号分子的产生,诱导植物整株免疫抗性被激活的现象。SAR对保护未受侵染的远端组织、防止病原菌的扩散具有重要意义[67]。SAR主要依赖于受侵染部位产生的一些可以长距离运输的信号分子,包括植物激素(如SA)、次生代谢产物、抗菌肽、壬二酸(Azelaic acid, AzA)等[68-70]。这些物质除诱导侵染部位的免疫反应外,还能够被运输到远端的健康细胞中,诱导植物产生系统获得性抗性,防止病原菌侵染的扩散[71-72]。由于SAR在植物防御病原菌侵染中的重要性,SAR信号分子的合成途径及其诱导的信号传导通路经常被病原菌效应子靶向攻击。
据报道,亚洲韧皮部杆菌非经典分泌效应子SahA具有水杨酸羟化酶活性,能够降解宿主SA并抑制SAR反应[73]。mSDE115(CaLasSDE115)是亚洲韧皮部杆菌分泌的一种Sec依赖型效应子,研究发现在柑橘中过表达mSDE115后,柑橘中SA水平下降,PR1、PR2、PR5等抗病基因的表达水平也下降,柑橘系统获得性抗性被显著抑制,加剧了柑橘黄龙病症状[47]。此外,Sec依赖型效应子CLas4425也被报道能够抑制SA介导的抗病反应,在柑橘中瞬时表达CLas4425显著降低SA积累水平,抑制SA信号通路相关基因表达,表明效应子CLas4425能够抑制SA介导的防卫反应[46]。BIK1(Botrytis-induced kinase 1)是植物免疫调控中的一个关键激酶,在SA信号通路中发挥重要调控作用[74-75]。研究表明,在烟草中沉默BIK1基因抑制了CLas4425诱导的细胞死亡,但效应子CLas4425是否通过靶向BIK1操纵SA信号通路仍有待进一步研究。非经典分泌效应子AGH17470瞬时表达后可引起烟草超敏性细胞死亡,转基因表达AGH17470的柑橘中SA积累量显著上调,一些SA响应基因的表达量也明显提高,柑橘对黄龙病的抗性增强,推测该效应子可能被宿主胞内免疫受体识别并激活SA介导的免疫途径[76]。壬二酸也被报道是SAR的一个重要信号分子,研究表明非经典分泌效应子Lasbcp能够破坏壬二酸介导的信号级联,从而抑制烟草中SAR的发生。同时,Lasbcp能够抑制脂多糖诱导的NO的产生,减弱NO介导的SAR信号传导,从而利于亚洲韧皮部杆菌的定殖[77-78]。
|
| 图 1 亚洲韧皮部杆菌效应子靶向宿主关键免疫调控组分 Fig. 1 CLas effectors targeting host key immune regulatory components |
5 展望
研究亚洲韧皮部杆菌效应子的功能和作用机制,能够增强对黄龙病菌致病机制的理解。寻找黄龙病菌效应子的靶标并解析其作用的分子生化机理,增强对黄龙病菌与柑橘互作机制的理解,对推进黄龙病的科学绿色防控具有重要意义。随着病原菌和宿主柑橘基因组数据的揭示,通过生物信息学分析,目前已基本清晰黄龙病菌效应子的数量和类型。但相较于其他重要病原菌效应子的研究,目前对黄龙病菌效应子功能和机制的理解仍十分欠缺。尤其是由于柑橘黄龙病菌不能在人工培养基上生长,无法完成科赫法则的验证,严重局限了效应子对病原菌致病力的重要性研究[79-80]。
未来对于黄龙病菌效应子的研究可从以下几方面开展:(1)鉴定柑橘黄龙病菌效应子在宿主中的靶标,综合运用生物信息学、分子生物学、生物化学以及人工智能(如Alpha fold)等手段,系统解析效应子功能、结构和致病机理,以增强对黄龙病菌致病机制的理解。(2)柑橘木虱是黄龙病菌传播的重要途径,对致病力有重要贡献的效应子往往在侵染宿主阶段特异性高表达,而在柑橘木虱中的表达量可能相对较低,因此分析效应子在柑橘木虱和柑橘中的表达量差异,有助于寻找在侵染阶段发挥毒性功能的关键效应子[81]。(3)由于黄龙病菌无法人工培养,很难实现对病原菌的分子遗传操作,难以获得效应子的突变菌株,未来可尝试使用宿主诱导的基因沉默(Host-induced gene silencing,HIGS)等技术对病原菌效应子进行沉默,以明确在黄龙病菌致病力中发挥关键作用的效应子[82]。(4)基于黄龙病菌Sec分泌系统的结构特点,筛选抑制效应子分泌的小分子化合物,从而破坏柑橘黄龙病菌效应子的分泌,降低黄龙病菌的致病力。进一步探索基于小分子化合物开发商业化抑制剂,降低柑橘黄龙病的发病率或为害程度[83]。(5)效应子通常靶向宿主细胞的关键免疫调控组分,鉴定效应子宿主靶标是寻找植物重要免疫调控基因的一种手段,以效应子为工具,寻找植物关键免疫调控因子,并解析其功能和作用机制,增强对宿主免疫系统的理解[84]。同时,这些关键免疫调控基因也可以作为改良柑橘抗病性的候选基因。
| [1] |
范国成, 刘波, 吴如健, 李韬, 蔡子坚, 柯冲. 中国柑橘黄龙病研究30年[J]. 福建农业学报, 2009, 24(2): 183-190. DOI:10.19303/j.issn.1008-0384.2009.02.019 FAN G C, LIU B, WU R J, LI T, CAI Z J, KE C. Thirty years of research on Citrus Huanglongbing in China[J]. Fujian Journal of Agricultural Sciences, 2009, 24(2): 183-190. DOI:10.19303/j.issn.1008-0384.2009.02.019 |
| [2] |
邓晓玲, 郑永钦, 郑正, 许美容. 柑橘黄龙病菌基因组学的研究进展[J]. 华南农业大学学报, 2019, 40(5): 137-148. DOI:10.7671/j.issn.1001-411X.201905066 DENG X L, ZHENG Y Q, ZHENG Z, XU M R. Current research on genomic analysis of "Candidatus Liberibacter spp.[J]. Journal of South China Agricultural University, 2019, 40(5): 137-148. DOI:10.7671/j.issn.1001-411X.201905066 |
| [3] |
DUAN Y, ZHOU L, HALL D G, LI W, DODDAPANENI H, LIN H, LIU L, VAHLING C M, GABRIEL D W, WILLIAMS K P, DICKERMAN A, SUN Y, GOTTWALD T. Complete genome sequence of Citrus Huanglongbing bacterium, 'Candidatus Liberibacter asiaticus' obtained through metagenomics[J]. Molecular Plant-Microbe Interactions, 2009, 22(8): 1011-1020. DOI:10.1094/MPMI-22-8-1011 |
| [4] |
DALIO R J D, HERLIHY J, OLIVEIRA T S, MCDOWELL J M, MACHADO M. Effector biology in focus: A primer for computational prediction and functional characterization[J]. Molecular Plant-Microbe Interactions, 2018, 31(1): 22-33. DOI:10.1094/MPMI-07-17-0174-FI |
| [5] |
DALIO R J D, MAGALHAES D M, RODRIGUES C M, ARENA G D, OLIVEIRA T S, SOUZA-NETO R R, PICCHI S C, MARTINS P M M, SANTOS P J C, MAXIMO H J, PACHECO I S, SOUZA A A D, MACHADO M A. PAMPs, PRRs, effectors and R-genes associated with citrus–pathogen interactions[J]. Annals of Botany, 2017, 119(5): 749-774. DOI:10.1093/aob/mcw238 |
| [6] |
THAPA S P, DE FRANCESCO A, TRINH J, GURUNG F B, PANG Z, VIDALAKIS G, WANG N, ANCONA V, MA W, COAKER G. Genome‐wide analyses of Liberibacter species provides insights into evolution, phylogenetic relationships, and virulence factors[J]. Molecular Plant Pathology, 2020, 21(5): 716-731. DOI:10.1111/mpp.12925 |
| [7] |
崔学进, 马世绵, 沈盼, 时洪伟, 傅仕敏, 贺俊, 邹修平, 周常勇, 王雪峰. 柑橘黄龙病菌效应蛋白与寄主互作研究进展与展望[J]. 植物保护, 2023, 49(5): 127-132, 220. DOI:10.16688/j.zwbh.2023384 CUI X J, MA S M, SHEN P, SHI H W, FU S M, HE J, ZOU X P, ZHOU C Y, WANG X F. Research progress and prospect of interactions between 'Candidatus Liberibacter asiaticus' effectors and hosts[J]. Plant Protection, 2023, 49(5): 127-132, 220. DOI:10.16688/j.zwbh.2023384 |
| [8] |
尹凯静. 柑橘的功能成分和生物活性研究进展[J]. 现代食品, 2022, 28(6): 19-22. DOI:10.16736/j.cnki.cn41-1434/ts.2022.06.006 YIN K J. Research progress on the functional components and biological activities of citrus[J]. Modern Food, 2022, 28(6): 19-22. DOI:10.16736/j.cnki.cn41-1434/ts.2022.06.006 |
| [9] |
SU J, WANG Y, BAI M, PENG T, LI H, XU H, GUO G, BAI H, RONG N, SAHU S K, HE H, LIANG X, JIN C, LIU W, STRUBE M L, GRAM L, LI Y, WANG E, LIU H, WU H. Soil conditions and the plant microbiome boost the accumulation of monoterpenes in the fruit of Citrus reticulata 'Chachi'[J]. Microbiome, 2023, 11(1): 61. DOI:10.1186/s40168-023-01504-2 |
| [10] |
朱从一, 马静, 吴文, 张瑞敏, 黄永敬, 曾继吾. 广东柑橘品种改良研究进展[J]. 广东农业科学, 2020, 47(11): 42-49. DOI:10.16768/j.issn.1004-874X.2020.11.005 ZHU C Y, MA J, WU W, ZHANG R M, HUANG Y J, ZENG J W. Progress of citrus variety improvement in guangdong[J]. Guangdong Agricultural Sciences, 2020, 47(11): 42-49. DOI:10.16768/j.issn.1004-874X.2020.11.005 |
| [11] |
王睛, 李方晖. 新会陈皮撬动百亿产业链[J]. 中国品牌, 2023(6): 78-79. WANG J, LI F H. Xinhui Chenpi leverages billions of industrial chains[J]. China Brand, 2023(6): 78-79. |
| [12] |
MUNIR S, HE P, WU Y, HE P, KHAN S, HUANG M, CUI W, HE P, HE Y. Huanglongbing control: Perhaps the end of the beginning[J]. Microbial Ecology, 2018, 76: 192-204. DOI:10.1007/s00248-017-1123-7 |
| [13] |
雷梦英, 杨贤智, 黄少彬. 柑橘黄龙病菌与柑橘根系关系研究进展[J]. 广东农业科学, 2018, 45(5): 58-64. DOI:10.16768/j.issn.1004-874X.2018.05.011 LEI M Y, YANG X Z, HUANG S B. Research progress on the relationship between Candidatus Liberibacter spp. and citrus root system[J]. Guangdong Agricultural Sciences, 2018, 45(5): 58-64. DOI:10.16768/j.issn.1004-874X.2018.05.011 |
| [14] |
LEWIS J D, KNOBLAUCH M, TURGEON R. The phloem as an arena for plant pathogens[J]. Annual Review of Phytopathology, 2022, 60: 77-96. DOI:10.1146/annurev-phyto-020620-100946 |
| [15] |
宋晓兵, 彭埃天, 陈霞, 程保平, 凌金锋. 柑橘黄龙病病原培养及分子检测技术研究进展[J]. 广东农业科学, 2013, 40(23): 65-69. DOI:10.16768/j.issn.1004-874X.2013.23.023 SONG X B, PENG A T, CHEN X, CHENG B P, LING J F. Research advances of Citrus Huanglongbing pathogenculture and detection technology[J]. Guangdong Agricultural Sciences, 2013, 40(23): 65-69. DOI:10.16768/j.issn.1004-874X.2013.23.023 |
| [16] |
王海漫, 俞婷, 肖明明, 杨嘉诚, 陈富荣, 易干军, 林德球, 罗敏. 基于改进YOLOX模型的柑橘木虱检测方法[J]. 广东农业科学, 2022, 49(11): 43-49. DOI:10.16768/j.issn.1004-874X.2022.11.005 WANG H M, YU T, XIAO M M, YANG J C, CHEN F R, YI G J, LIN D Q, LUO M. Detection of citrus psyllid based on improved yolox model[J]. Guangdong Agricultural Sciences, 2022, 49(11): 43-49. DOI:10.16768/j.issn.1004-874X.2022.11.005 |
| [17] |
BARNETT M J, SOLOW-CORDERO D E, LONG S R. A high-throughput system to identify inhibitors of Candidatus Liberibacter asiaticus transcription regulators[J]. Proceedings of the National Academy of Sciences, 2019, 116(36): 18009-18014. DOI:10.1073/pnas.1905149116 |
| [18] |
ZHANG Z, HAN Q, MAO X, LIU J, WANG W, LI D, ZHOU F, KE Y, XU L, HU L. Discovery of novel SecA inhibitors against "Candidatus Liberibacter asiaticus" through virtual screening and biological evaluation[J]. Chemical Biology & Drug Design, 2021, 98(3): 395-404. DOI:10.1111/cbdd.13859 |
| [19] |
HUANG C Y, ARAUJO K, S NCHEZ J N, KUND G, TRUMBLE J, ROPER C, GOD K E, JIN H. A stable antimicrobial peptide with dual functions of treating and preventing Citrus Huanglongbing[J]. Proceedings of the National Academy of Sciences, 2021, 118(6): e2019628118. DOI:10.1073/pnas.2019628118 |
| [20] |
PENG A, ZOU X, HE Y, CHEN S, LIU X, ZHANG J, ZHANG Q, XIE Z, LONG J, ZHAO X. Overexpressing a NPR1-like gene from Citrus paradisi enhanced Huanglongbing resistance in C.sinensis[J]. Plant Cell Reports, 2021, 40: 529-541. DOI:10.1007/s00299-020-02648-3 |
| [21] |
SUGIO A, MACLEAN A M, KINGDOM H N, GRIEVE V M, MANIMEKALAI R, MANIMEKALAI S A. Diverse targets of phytoplasma effectors: From plant development to defense against insects[J]. Annual Review of Phytopathology, 2011, 49: 175-195. DOI:10.1146/annurev-phyto-072910-095323 |
| [22] |
CUI H, TSUDA K, PARKER J E. Effector-triggered immunity: From pathogen perception to robust defense[J]. Annual Review of Plant Biology, 2015, 66: 487-511. DOI:10.1146/annurev-arplant-050213-040012 |
| [23] |
严霞, 牛晓磊, 陶均. 病原菌诱发的植物先天免疫研究进展[J]. 分子植物育种, 2018, 16(3): 821-831. DOI:10.13271/j.mpb.016.000821 YAN X, NIU X L, TAO J. Research advances on pathogen-induced plant innate immunity[J]. Molecular Plant Breeding, 2018, 16(3): 821-831. DOI:10.13271/j.mpb.016.000821 |
| [24] |
YUAN M, NGOU B P M, DING P, XIN X. PTI-ETI crosstalk: An integrative view of plant immunity[J]. Current Opinion in Plant Biology, 2021, 62: 102030. DOI:10.1016/j.pbi.2021.102030 |
| [25] |
MA W, PANG Z, HUANG X, XU J, PANDEY S S, LI J, ACHOR D S, VASCONCELOS F N C, HENDRICH C, HUANG Y, WANG W, LEE D, STANTON D, WANG N. Citrus Huanglongbing is a pathogen-triggered immune disease that can be mitigated with antioxidants and gibberellin[J]. Nature Communications, 2022, 13(1): 1-13. DOI:10.1038/s41467-022-28189-9 |
| [26] |
PITINO M, ARMSTRONG C M, DUAN Y. Molecular mechanisms behind the accumulation of ATP and H2O2 in citrus plants in response to 'Candidatus Liberibacter asiaticus' infection[J]. Horticulture Research, 2017, 4: 17040. DOI:10.1038/hortres.2017.40 |
| [27] |
SWIETNICKI W. Secretory system components as potential prophylactic targets for bacterial pathogens[J]. Biomolecules, 2021, 11(6): 892. DOI:10.3390/biom11060892 |
| [28] |
GREEN E R, MECSAS J. Bacterial secretion systems: an overview[J]. Virulence Mechanisms of Bacterial Pathogens, 2016, 213-239. DOI:10.1128/microbiolspec.VMBF-0012-2015 |
| [29] |
GROSSMAN A S, MAUER T J, FOREST K T, GOODRICH-BLAIR H. A widespread bacterial secretion system with diverse substrates[J]. MBio, 2021, 12(4): e01956. DOI:10.1128/mBio.01956-21 |
| [30] |
PRASAD S, XU J, ZHANG Y, WANG N. SEC-translocon dependent extracytoplasmic proteins of Candidatus Liberibacter asiaticus[J]. Frontiers in Microbiology, 2016, 7: 1989. DOI:10.3389/fmicb.2016.01989 |
| [31] |
黄家权, 李莉, 吴丰年, 郑正, 邓晓玲. 携带不同原噬菌体的黄龙病菌在柑橘木虱体内的增殖及致病力[J]. 中国农业科学, 2022, 55(4): 719-728. DOI:10.3864/j.issn.0578-1752.2022.04.008 HUANG J Q, LI L, WU F N, ZHENG Z, DENG X L. Proliferation of two types prophage of 'Candidatus Liberibacter asiaticus' in Diaphorina citri and their pathogenicity[J]. Scientia Agricultura Sinica, 2022, 55(4): 719-728. DOI:10.3864/j.issn.0578-1752.2022.04.008 |
| [32] |
DU P, ZHANG C, ZOU X, ZHU Z, YAN H, WURIYANGHAN H, LI W. "Candidatus Liberibacter asiaticus" secretes nonclassically secreted proteins that suppress host hypersensitive cell death and induce expression of plant pathogenesis-related proteins[J]. Applied and Environmental Microbiology, 2021, 87(8): e19. DOI:10.1128/AEM.00019-21 |
| [33] |
SHI Q, PITINO M, ZHANG S, KRYSTEL J, CANO L, JR R G, HALL D, STOVER E. Temporal and spatial detection of Candidatus Liberibacter asiaticus putative effector transcripts during interaction with Huanglongbing-susceptible, tolerant, and-resistant citrus hosts[J]. BMC Plant Biology, 2019, 19: 1-12. DOI:10.1186/s12870-019-1703-4 |
| [34] |
SHI J, GONG Y, SHI H, MA X, ZHU Y, YANG F, WANG D, FU Y, LIN Y, YANG N, YANG Z, ZENG C, LI W, ZHOU C, WANG X, QIAO Y. 'Candidatus Liberibacter asiaticus' secretory protein SDE3 inhibits host autophagy to promote Huanglongbing disease in citrus[J]. Autophagy, 2023, 19(9): 2558-2574. DOI:10.1080/15548627.2023.2213040 |
| [35] |
DE FRANCESCO A, LOVELACE A H, SHAW D, QIU M, WANG Y, GURUNG F, ANCONA WANG C, LEVY A, JIANG T, MA W. Transcriptome profiling of 'Candidatus Liberibacter asiaticus' in citrus and psyllids[J]. Phytopathology, 2022, 112(1): 116-130. DOI:10.1094/PHYTO-08-21-0327-FI |
| [36] |
THAPA S P, DE FRANCESCO A, TRINH J, GURRUNG F, PANG Z, VIDALAKIS G, WANG N, ANCONA V, MA W, COAKER G. Genome-wide analyses of Liberibacter species provides insights into evolution, phylogenetic relationships, and virulence factors[J]. Molecular Plant Pathology, 2020, 21(5): 716-731. DOI:10.1111/mpp.12925 |
| [37] |
LIU X, FAN Y, ZHANG C, DAI M, WANG X, LI W. Nuclear import of a secreted "Candidatus Liberibacter asiaticus" protein is temperature dependent and contributes to pathogenicity in Nicotiana benthamiana[J]. Frontiers in Microbiology, 2019, 10: 1684. DOI:10.3389/fmicb.2019.01684 |
| [38] |
OH J, LEVY J G, KAN C C, IBANEZ-CARRASCO F, TAMBORINDEGUY C. CLIBASIA_00460 disrupts hypersensitive response and interacts with citrus Rad23 proteins[J]. International Journal of Molecular Sciences, 2022, 23(14): 7846. DOI:10.3390/ijms23147846 |
| [39] |
YAN Q, SREEDHARAN A, WEI S, WANG J, PELZ-STELINSKI K, FOLIMONOVA S, WANG N. Global gene expression changes in Candidatus Liberibacter asiaticus during the transmission in distinct hosts between plant and insect[J]. Molecular Plant Pathology, 2013, 14(4): 391-404. DOI:10.1111/mpp.12015 |
| [40] |
YING X, WAN M, HU L, ZHANG J, LI H, LV D. Identification of the virulence factors of Candidatus Liberibacter asiaticus via heterologous expression in Nicotiana benthamiana using tobacco mosaic virus[J]. International Journal of Molecular Sciences, 2019, 20(22): 5575. DOI:10.3390/ijms20225575 |
| [41] |
ZHANG C, WANG X, LIU X, FAN Y, ZHANG Y, ZHOU X, LI W. A novel 'Candidatus Liberibacter asiaticus' -encoded Sec-dependent secretory protein suppresses programmed cell death in Nicotiana benthamiana[J]. International Journal of Molecular Sciences, 2019, 20(22): 5802. DOI:10.3390/ijms20225802 |
| [42] |
LI H, YING X, SHANG L, REDFERN B, KYPRAIOS N, XIE X, XU F, WANG S, ZHANG J, JIAN H, YU H, LV D. Heterologous expression of CLIBASIA_03915/CLIBASIA_04250 by tobacco mosaic virus resulted in phloem necrosis in the senescent leaves of Nicotiana benthamiana[J]. International Journal of Molecular Sciences, 2020, 21(4): 1414. DOI:10.3390/ijms21041414 |
| [43] |
PANG Z, ZHANG L, COAKER G, MA W, HE S, WANG N. Citrus CsACD2 is a target of Candidatus Liberibacter asiaticus in Huanglongbing disease[J]. Plant Physiology, 2020, 184(2): 792-805. DOI:10.1104/pp.20.00348 |
| [44] |
ZHANG C, DU P, YAN H, ZHU Z, WANG X, LI W. A Sec-dependent secretory protein of the Huanglongbing-associated pathogen suppresses hypersensitive cell death in Nicotiana benthamiana[J]. Frontiers in Microbiology, 2020, 11: 594669. DOI:10.3389/fmicb.2020.594669 |
| [45] |
SHI H, YANG Z, HUANG J, WU H, FU S, LI W, ZOU X, ZHOU C, WANG X. An effector of 'Candidatus Liberibacter asiaticus' manipulates autophagy to promote bacterial infection[J]. Journal of Experimental Botany, 2023, 74. DOI:10.1093/jxb/erad176 |
| [46] |
ZHANG S, WANG X, HE J, ZHANG S, ZHAO T, FU S, ZHOU C. A Sec-dependent effector, CLIBASIA_04425, contributes to virulence in 'Candidatus Liberibater asiaticus'[J]. Frontiers in Plant Science, 2023, 14: 1224736. DOI:10.3389/fpls.2023.1224736 |
| [47] |
DU M, WANG S, DONG L, QU R, ZHENG L, HE Y, CHEN S, ZOU X. Overexpression of a "Candidatus Liberibacter asiaticus" effector gene CaLasSDE115 contributes to early colonization in Citrus sinensis[J]. Frontiers in Microbiology, 2022, 12: 4274. DOI:10.3389/fmicb.2021.797841 |
| [48] |
CLARK K, FRANCO J Y, SCHWIZER S, PANG Z, HAWARA E, LIEBRAND T W H, PAGLIACCIA D, ZENG L, GURUNG F B, WANG P, SHI J, WANG Y, ANCONA V, HOORN R A L, WANG N, COAKER G, MA W. An effector from the Huanglongbing-associated pathogen targets citrus proteases[J]. Nature Communications, 2018, 9(1): 1-11. DOI:10.1038/s41467-018-04140-9 |
| [49] |
ZHOU Y, WEI X, LI Y, LIU Z, DUAN Y, ZOU H. 'Candidatus Liberibacter asiaticus' SDE1 effector induces Huanglongbing chlorosis by downregulating host DDX3 gene[J]. International Journal of Molecular Sciences, 2020, 21(21): 7996. DOI:10.3390/ijms21217996 |
| [50] |
SHEN P, LI X, FU S, ZHOU C, WANG X. A "Candidatus Liberibacter asiaticus"-secreted polypeptide suppresses plant immune responses in Nicotiana benthamiana and Citrus sinensis[J]. Frontiers in Plant Science, 2022, 13: 3425. DOI:10.3389/fpls.2022.997825 |
| [51] |
XING Y, XU N, BHANDARI D D, LAPIN D, SUN X, LUO X, WANG Y, CAO J, WANG H, COAKER G, PARKER J E, LIU J. Bacterial effector targeting of a plant iron sensor facilitates iron acquisition and pathogen colonization[J]. The Plant Cell, 2021, 33(6): 2015-2031. DOI:10.1093/plcell/koab075 |
| [52] |
LEONG J X, RAFFEINER M, SPINTI D, LANGIN G, FRANZ- WACHTEL M, GUZMAN A R, KIM J, PANDEY P, MININA A E, MACEK B, HAFR N A, BOZKURT T O, MUDGETT M B, B RNKE F, HOFIUS D, ST N S. A bacterial effector counteracts host autophagy by promoting degradation of an autophagy component[J]. The EMBO Journal, 2022, 41(13): e110352. DOI:10.15252/embj.2021110352 |
| [53] |
BREIA R, CONDE A, BADIM H, FORTES A M, GER S H, GRANELL A. Plant SWEETs: From sugar transport to plant– pathogen interaction and more unexpected physiological roles[J]. Plant Physiology, 2021, 186(2): 836-852. DOI:10.1093/plphys/kiab127 |
| [54] |
SUN L, WU X, DIAO J, ZHANG J. Pathogenesis mechanisms of phytopathogen effectors[J]. WIREs Mechanisms of Disease, 2023, 15(2): e1592. DOI:10.1002/wsbm.1592 |
| [55] |
IRIEDA H, INOUE Y, MORI M, YAMADA K, OSHIKAWA Y, SAITOH H, UEMURA A, TERAUCHI R, KITAKURA S, KOSAKA A, SINGKARAVANIT-OGAWA S, TAKANO Y. Conserved fungal effector suppresses PAMP-triggered immunity by targeting plant immune kinases[J]. Proceedings of the National Academy of Sciences, 2019, 116(2): 496-505. DOI:10.1073/pnas.1807297116 |
| [56] |
张美祥, 杨超, 刘俊. 植物病原菌效应子[J]. 科学通报, 2023, 68(36): 4895-4917. DOI:10.1360/TB-2023-0788 ZHANG M X, YANG C, LIU J. Research advances of phytopathogen effectors[J]. Chinese Science Bulletin, 2023, 68(36): 4895-4917. DOI:10.1360/TB-2023-0788 |
| [57] |
张佳默, 史江伟. 基于钙的植物免疫研究进展[J]. 福建农林大学学报(自然科学版), 2020, 49(6): 721-727. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2020.06.001 ZHANG J M, SHI J M. Research progress of plant immunity based on calcium[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2020, 49(6): 721-727. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2020.06.001 |
| [58] |
ROONEY H C E, VAN'T KLOOSTER J W, HOORN R A L, JOOSTEN M H A J, JONES J D G, WIT P J G M D. Cladosporium Avr2 inhibits tomato Rcr3 protease required for Cf-2-dependent disease resistance[J]. Science, 2005, 308(5729): 1783-1786. |
| [59] |
CHEN K, WANG Y, ZHANG R, ZHANG H, GAO C. CRISPR/Cas genome editing and precision plant breeding in agriculture[J]. Annual Review of Plant Biology, 2019, 70: 667-697. DOI:10.1146/annurev-arplant-050718-100049 |
| [60] |
PATTANAYAK G K, VENKATARAMANI S, HORTENSTEINER S, KUNZ L, CHRIST B, MOULIN M, SMITH A G, OKAMOTO Y, TAMIAKI H, SUGISHIMA M, GREENBERG J T. Accelerated cell death 2 suppresses mitochondrial oxidative bursts and modulates cell death in Arabidopsis[J]. The Plant Journal, 2012, 69(4): 589-600. DOI:10.1111/j.1365-313X.2011.04814.x |
| [61] |
JAIN M, FLEITES L A, GABRIEL D W. Prophage-encoded peroxidase in 'Candidatus Liberibacter asiaticus' is a secreted effector that suppresses plant defenses[J]. Molecular Plant-Microbe Interactions, 2015, 28(12): 1330-1337. DOI:10.1094/MPMI-07-15-0145-R |
| [62] |
DU J, WANG Q, SHI H, ZHOU C, HE J, WANG X. A prophage‐ encoded effector from "Candidatus Liberibacter asiaticus" targets ASCORBATE PEROXIDASE6 in citrus to facilitate bacterial infection[J]. Molecular Plant Pathology, 2023, 24(4): 287-395. DOI:10.1111/mpp.13296 |
| [63] |
LEARY A Y, SAVAGE Z, TUMTAS Y, BOZKURT T O. Contrasting and emerging roles of autophagy in plant immunity[J]. Current Opinion in Plant Biology, 2019, 52: 46-53. DOI:10.1016/j.pbi.2019.07.002 |
| [64] |
周如欣, 史树德. 植物细胞自噬及在逆境胁迫中的作用[J]. 内蒙古林业科技, 2023, 49(3): 53-58. ZHOU R X, SHI S D. Plant autophagy and its role in adversity stress[J]. Journal of Inner Mongolia Forestry Science and Technology, 2023, 49(3): 53-58. |
| [65] |
王云, 张镇武, 孙逊, 张绍铃. 植物自噬与病原菌互作研究进展[J]. 园艺学报, 2022, 49(10): 2205-2222. DOI:10.16420/j.issn.0513-353x.2021-0647 WANG Y, ZHANG Z W, SUN X, ZHANG S L. A state-of-the-air review on the interaction between plant autophagy and pathogens[J]. Acta Horticulturae Sinica, 2022, 49(10): 2205-2222. DOI:10.16420/j.issn.0513-353x.2021-0647 |
| [66] |
SHARMA I, KIRTI P B, PATI P K. Autophagy: A game changer for plant development and crop improvement[J]. Planta, 2022, 256(6): 103. DOI:10.1007/s00425-022-04004-z |
| [67] |
MUTHAMILARASAN M, PRASAD M. Plant innate immunity: An updated insight into defense mechanism[J]. Journal of Biosciences, 2013, 38: 433-449. DOI:10.1007/s12038-013-9302-2 |
| [68] |
王浩, 张松杰, 李航, 王晓宇, 黄浪平, 张松涛. 植物壬二酸的研究进展[J]. 植物生理学报, 2022, 58(3): 483-491. DOI:10.13592/j.cnki.ppj.2021.0305 WANG H, ZHANG S J, LI H, WANG X Y, HUANG L P, ZHANG S T. Research progress of azelaic acid in plants[J]. Plant Physiology Journal, 2022, 58(3): 483-491. DOI:10.13592/j.cnki.ppj.2021.0305 |
| [69] |
赵珂, 郑林, 杜美霞, 龙俊宏, 何永睿, 陈善春, 邹修平. 柑橘SAR及其信号转导基因CsSABP2在黄龙病菌侵染中的响应特征[J]. 中国农业科学, 2021, 54(8): 1638-1652. DOI:10.3864/j.issn.0578-1752.2021.08.006 ZHAO K, ZHENG L, DU M X, LONG J H, HE Y R, CHEN S C, ZOU X P. Response characteristic of plant SAR and its signaling gene CsSABP2 to Huanglongbing infection in citrus[J]. Scientia Agricultura Sinica, 2021, 54(8): 1638-1652. DOI:10.3864/j.issn.0578-1752.2021.08.006 |
| [70] |
SHINE M B, XIAO X, KACHROO P, AARDRA K. Signaling mechanisms underlying systemic acquired resistance to microbial pathogens[J]. Plant Science, 2019, 279: 81-86. DOI:10.1016/j.plantsci.2018.01.001 |
| [71] |
DURRANT W E, DONG X. Systemic acquired resistance[J]. Annual Review of Phytopathology, 2004, 42: 185-209. |
| [72] |
GAO H, GUO M, SONG J, MA Y, XU Z. Signals in systemic acquired resistance of plants against microbial pathogens[J]. Molecular Biology Reports, 2021, 48(4): 3747-3759. DOI:10.1007/s11033-021-06344-7 |
| [73] |
LI J, PANG Z, TRIVEDI P, ZHOU X, YING X, JIA H, WANG N. 'Candidatus Liberibacter asiaticus' encodes a functional salicylic acid (SA) hydroxylase that degrades SA to suppress plant defenses[J]. Molecular Plant-Microbe Interactions, 2017, 30(8): 620-630. DOI:10.1094/MPMI-12-16-0257-R |
| [74] |
LAL N K, NAGALAKSHMI U, HURLBURT N K, FLORES R, BAK A, SONE P, MA X, SONG G, WALLEY J, SHAN L, HE P, CASTEEL C, FISHER A J, DINESH-KUMAR S P. The receptor-like cytoplasmic kinase BIK1 localizes to the nucleus and regulates defense hormone expression during plant innate immunity[J]. Cell Host & Microbe, 2018, 23(4): 485-497. DOI:10.1016/j.chom.2018.03.010 |
| [75] |
梅双双, 戎伟. 野油菜黄单胞菌效应蛋白AvrXccC与拟南芥BIK1在植物体内相互作用[J]. 植物病理学报, 2016, 46(2): 207-212. DOI:10.13926/j.cnki.apps.2016.02.008 MEI S S, RONG W. Xanthomonas campestris pv. campestris effector protein AvrXccC interacts with the cytoplasmic kinase BlK1[J]. Acta Phytopathologica Sinica, 2016, 46(2): 207-212. DOI:10.13926/j.cnki.apps.2016.02.008 |
| [76] |
DU J, WANG Q, ZENG C, ZHOU C, WANG X. A prophage-encoded nonclassical secretory protein of "Candidatus Liberibacter asiaticus" induces a strong immune response in Nicotiana benthamiana and citrus[J]. Molecular Plant Pathology, 2022, 23: 1022-1034. DOI:10.1111/mpp.13206 |
| [77] |
JAIN M, MUNOZ-BODNAR A, ZHANG S, GABRIEL D W. A secreted 'Candidatus Liberibacter asiaticus' peroxiredoxin simultaneously suppresses both localized and systemic innate immune responses in planta[J]. Molecular Plant-Microbe Interactions, 2018, 31(12): 1312-1322. DOI:10.1094/MPMI-03-18-0068-R |
| [78] |
JAIN M, CAI L, BLACK I, AZADI P, CARLSON R W, JONES K M, GABRIEL D W. 'Candidatus Liberibacter asiaticus'-encoded BCP peroxiredoxin suppresses lipopolysaccharide-mediated defense signaling and nitrosative stress in planta[J]. Molecular Plant-Microbe Interactions, 2022, 35(3): 257-273. DOI:10.1094/MPMI-09-21-0230-R |
| [79] |
CAI L, JAIN M, MUNOZ-BODNAR A, HUGUET-TAPIA J C, GABRIEL D W. A synthetic 'essentialome' for axenic culturing of 'Candidatus Liberibacter asiaticus'[J]. BMC Research Notes, 2022, 15(1): 1-7. DOI:10.1186/s13104-022-05986-5 |
| [80] |
雷天刚. 柑橘黄龙病菌半离体培养系统的构建及其应用研究[D]. 重庆: 西南大学, 2023. DOI: 10.27684/d.cnki.gxndx.2022.000093. LEI T G. Study on establishment and application of a semi-in vitro culture system for Candidatus Liberibacter asiaticus in citrus[D]. Chongqing: Southwest University, 2023. DOI: 10.27684/d.cnki.gxndx.2022.000093. |
| [81] |
吴丰年, 谢素金, 赵雅轩, 许鹏彬, 李俊杰, 肖朝锦, 林晓娜, 杨少辉, 岑伊静, 黄剑坚. 不同种类寄主对柑橘黄龙病菌侵染能力及虫媒适应性的影响[J]. 环境昆虫学报, 2023, 45(1): 63-72. DOI:10.3969/j.issn.1674-0858.2023.01.6 WU F N, XIE S J, ZHAO Y X, XU P B, LI J J, XIAO C J, LIN X N, YANG S H, CEN Y J, HUANG J J. Effects of host plant species on the infection ability of "Candidatus Liberibacter asiaticus" and adaptability of Diaphorina citri[J]. Journal of Environmental Entomology, 2023, 45(1): 63-72. DOI:10.3969/j.issn.1674-0858.2023.01.6 |
| [82] |
张小雪, 孙天歌, 张迎春, 陈丽华, 张新宇, 李艳军, 孙杰. 大丽轮枝菌木糖苷酶基因的鉴定及基于HIGS技术的功能分析[J]. 中国农业科学, 2021, 54(15): 3219-3231. DOI:10.3864/j.issn.0578-1752.2021.15.007 ZHANG X X, SUN T G, ZHANG Y C, CHEN L H, ZHANG X Y, LI Y J, SUN J. ldentification of xylosidase genes from verticillium dahliae and functional analysis based on HIGS technology[J]. Scientia Agricultura Sinica, 2021, 54(15): 3219-3231. DOI:10.3864/j.issn.0578-1752.2021.15.007 |
| [83] |
刘文德, 代玉立, 邵小龙, 张昊, 陈华民, 靳怀冰, 刘文文, 彭焕, 张丹丹, 李智强, 钱国良, 刘太国, 陈捷胤. 我国主要农作物病害灾变机制与综合防控研究进展: 2018—2022年[J]. 植物保护, 2023, 49(5): 1-31. DOI:10.16688/j.zwbh.2023400 LIU W D, DAI Y L, SHAO X L, ZHANG H, CHEN H M, JIN H B, LIU W W, PENG H, ZHANG D D, LI Z Q, QIAN G L, LIU T G, CHEN J Y. Research progresses on the disaster mechanism and integrated management of major crop diseases in China: 2018—2022[J]. Plant Protection, 2023, 49(5): 1-31. DOI:10.16688/j.zwbh.2023400 |
| [84] |
郑向, 段左平, 张杰, 潘素君, 戴良英, 刘世名, 李魏. 大豆疫霉菌效应子研究进展[J]. 生物技术通报, 2022, 38(11): 10-20. DOI:10.13560/j.cnki.biotech.bull.1985.2022-0097 ZHENG X, DUAN Z P, ZHANG J, PAN S J, DAI L Y, LIU S M, LI W. Research progress on effector of Phytophthora sojae[J]. Biotechnology Bulletin, 2022, 38(11): 10-20. DOI:10.13560/j.cnki.biotech.bull.1985.2022-0097 |
(责任编辑 张辉玲)
 2024, Vol. 51
2024, Vol. 51