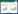文章信息
基金项目
- 河南省科技攻关项目(232102110260)
作者简介
- 程相杰(1995—),男,硕士,研究实习员,研究方向为蔬菜分子育种与栽培技术,E-mail:747314948@qq.com.
通讯作者
- 任福森(1970—),男,研究员,研究方向为蔬菜分子育种与栽培技术,E-mail:3077048@163.com.
文章历史
- 收稿日期:2023-12-11
2. 东北农业大学园艺园林学院,黑龙江 哈尔滨 150030
2. College of Horticulture and Landscape Architecture, Northeast Agricultural University, Harbin 150030, China
【研究意义】硫是植物生长和发育所必需的元素之一,参与多种生物化学过程,如蛋白质合成、酶活性调节及维持细胞结构等[1]。缺硫时,辣椒幼嫩叶片呈现均匀的褪绿、变黄,且不容易枯干,老叶的叶脉也呈现黄色;辣椒植株矮小,叶片细小、向上蜷曲,叶片变硬、手握时易碎且提前脱落,开花迟缓,导致结果少或不结果,进而影响辣椒的产量和品质[2]。作为世界上辣椒第一生产国和消费国,我国辣椒产业的健康发展对于保障辣椒常年稳健供应和农户增收意义重大。对辣椒硫酸盐转运蛋白(Sulfate transporter,SULTR)基因家族的功能和调控机制进行研究,有助于深入理解其调控网络,为提高辣椒的抗逆性和农业生产的改良提供理论基础和应用价值。【前人研究进展】硫以硫酸盐离子(SO42-)的形式存在于水分和土壤之中,高等植物通过SULTR获取土壤与水分中的SO42-并在植物体内分配和调控SO42-。迄今为止,研究人员已对拟南芥[3]、玉米[4]、小麦[5]、黄瓜[6]、水稻[7]、谷子[8]、茶树[9]等植物中的SULTR进行了研究。拟南芥中,SULTR3亚家族中的5个成员(SULTR3;1、3;2、3;3、3;4、3;5)均能在叶绿体膜上参与SO42-的吸收,表明SULTR3在植物叶绿体SO42-转运的调控过程中存在功能冗余。在盐胁迫条件下,拟南芥sultr3五重突变体的种子萌发对盐胁迫更为敏感,外源补充硫化物可提高其耐盐性,表明AtSULTR3蛋白可能参与盐胁迫响应过程[3]。拟南芥中AtSULTR1;1和AtSULTR1;2编码高亲和力的SO42-转运蛋白,集中在根的表皮和皮层细胞中表达,主要负责从土壤中吸收硫酸盐,但目前对该蛋白的功能研究尚不透彻[10-11]。大豆在受到根瘤菌侵染时,体内GmSULTR2;3、GmSULTR3;4a、GmSULTR3;5a的表达量均明显上调,表明GmSULTR3可能参与植物响应生物胁迫的过程[12]。在硫供应不足时,苹果MdSultr3;1a的表达量显著上调,其愈伤组织的鲜重增加,表明MdSULTR3蛋白可能参与非生物胁迫响应过程[13]。【本研究切入点】探索辣椒CaSULTR基因家族的生物学功能,有助于深入了解其调控机制和信号通路,以及与其他逆境胁迫响应途径的交叉调控关系,可为辣椒的逆境适应机制和农业生产的可持续发展提供理论支持,但目前尚未有对辣椒CaSULTR基因家族成员的报道。【拟解决的关键问题】本研究通过生物信息学手段对辣椒CaSULTR基因家族进行全基因组水平鉴定,分析其进化关系、蛋白理化性质、基因结构、启动子区域顺式作用元件及激素处理后的表达模式,并对差异表达基因进行克隆,为后续研究其具体功能奠定基础。
1 材料与方法 1.1 CaSULTR家族成员鉴定与系统进化分析从拟南芥数据库Tair(http://www.Arabidopsis.org/)中获取SULTR家族蛋白序列。在茄科基因组数据库网站Sol Genomics Network(https://solgenomics.net)下载辣椒‘Zunla-1’的gDNA、cDNA和gff3文件。从PFAM数据库(http://pfam.xfam.org/)获取SULTR家族的隐马氏模型文件(PF00916),并使用BLASTp和hummer search 2种方法对辣椒CaSULTR家族候选基因进行鉴定,排除不含SULTR结构域的候选序列并去除冗余序列后,获得候选CaSULTR基因。利用CDD(https://www.ncbi.nlm.nih.gov/cdd)和PFAM(http://pfam.xfam.org)数据库对候选基因的蛋白序列进行分析,排除不含有Sulfate transp结构域和STAS结构域的候选蛋白,最终确定辣椒CaSULTR家族成员。利用MAGA7软件中的序列比对工具Clustal W对拟南芥与辣椒SULTR家族的蛋白序列进行分析,并构建系统进化树(邻接法,1000次重复)。
1.2 CaSULTR家族成员的理化性质分析使用ExPASy(http://web.expasy.org/protparam/)在线网站预测CaSULTR蛋白的氨基酸长度、分子量、理论等电点(pI)及总亲水性平均值。在Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)网站对CaSULTR蛋白进行亚细胞定位预测。使用MapChart 2.32软件绘制CaSULTR基因在染色体上的分布图。利用在线软件SOPM(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_sopma.html)对CaSULTR蛋白序列进行分析,预测其二级结构。
1.3 CaSULTR家族成员的保守基序与基因结构分析将CaSULTR家族成员的蛋白序列上传至在线网站MEME(https://meme-suite.org/meme/tools/meme),对其Motif进行分析(最大检索值为10)。将CaSULTR家族成员的gff3文件上传到在线网站GSDS2.0(http://gsds.gaolab.org/),对辣椒CaSULTR基因家族成员内含子、外显子进行分析。
1.4 CaSULTR家族成员启动子区域的顺式作用元件分析利用Tbtools软件提取CaSULTR家族成员ATG上游2 Kb序列,通过PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对其启动子区域的顺式作用元件进行分析。
1.5 CaSULTR家族成员的组织表达模式与激素胁迫响应分析通过Pepper hub数据库(https://www.ncbi.nlm.nih.gov/)获取辣椒骨干自交系‘6421’的转录组数据,本地分析后制作CaSULTR在叶、根、茎组织中及激素胁迫下的表达热图。
辣椒品种‘6421’种植于新乡市农科院实验中心光照培养箱中(昼夜温度25℃/18℃、16 h黑暗/8 h光照的光周期、相对湿度60%~70%、光照强度6 000 Lux),在40 d苗龄时向营养液施加终浓度为2 μmol/L的IAA与30 μmol/L ABA进行处理,于0、6、24 h后取其根系置于液氮速冻,保存至-80℃冰箱中备用。采用Trizol法提取总RNA,每个处理3次重复。反转录试剂盒HiScript Ⅱ 1st Strand cDNA Synthesis Kit与荧光定量试剂盒AceQ qPCR SYBR Green Master Mix均购于诺唯赞公司,以上操作均按照试剂盒说明书进行。反转录体系为10 μL体系,荧光定量PCR采用50 μL体系。PCR反应程序:预变性95℃ 30 s;95℃ 15 s,60℃ 30 s,40个循环;使用罗氏380默认溶解曲线,每个样品3次重复。采用2-ΔΔCt法计算基因的相对表达量[14]。采用Graph pad 8.0处理数据并绘制柱状图。荧光定量PCR引物信息如表 1所示。
1.6 CaSULTR1;1与CaSULTR3;4基因的克隆以CaSULTR1;1与CaSULTR3;4的CDS序列为模板设计带接头的特异性引物,以‘6421’根部cDNA为模板扩增目的基因(表 1)。对目的片段胶回收后连接至pNC-Cam1304-SubN载体,将连接后的重组载体转入感受态细胞Trans5α后,挑选阳性克隆送生工生物工程(上海)股份有限公司测序。
2 结果与分析 2.1 CaSULTR基因家族的鉴定与理化性质分析
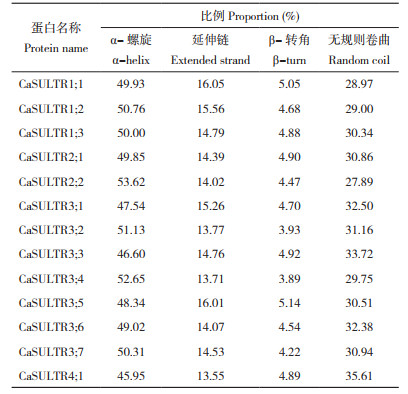
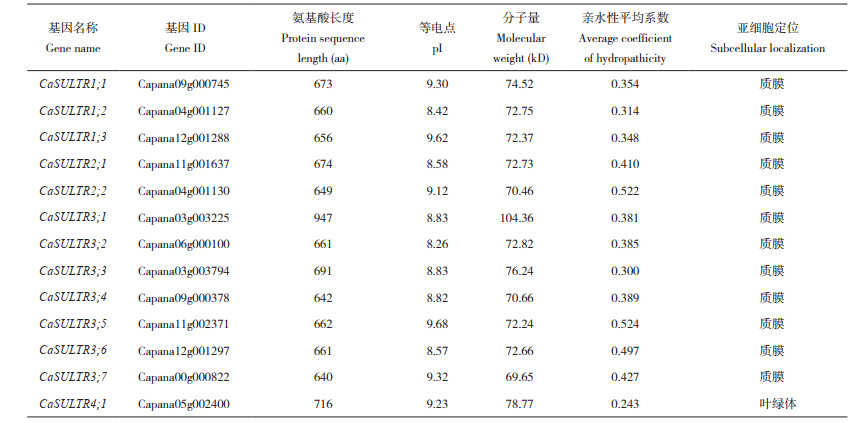
本研究共鉴定到13个CaSULTR(表 2)。已有报道指出,拟南芥SULTR可划分成4个亚组,分别为AtSULTR1、AtSULTR2、AtSULTR3、AtSULTR4[3],为了解CaSULTR的系统发育关系,对辣椒与拟南芥中的SULTR构建系统进化发育树,并对鉴定的CaSULTR进行命名与分类(图 1)。辣椒SULTR分别被命名为CaSULTR1;1、CaSULTR1;2、CaSULTR1;3、CaSULTR2;1、CaSULTR2;2、CaSULTR3;1、CaSULTR3;2、CaSULTR3;3、CaSULTR3;4、CaSULTR3;5、CaSULTR3;6、CaSULTR3;7、CaSULTR4;1。CaSULTR也被分为4组(Ⅰ~Ⅳ),其中,Ⅲ组含有CaSULTR成员数最多、有7个;Ⅳ组中CaSULTR成员最少,仅含有1个。
|
| 图 1 辣椒与拟南芥SULTR成员的系统发育进化树 Fig. 1 Phylogenetic tree of SULTR members in pepper and Arabidopsis thaliana |
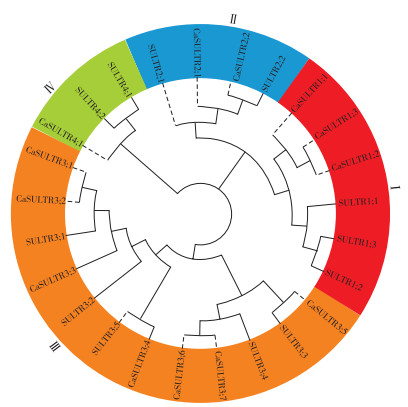
对CaSULTR进行理化性质分析发现(表 2),CaSULTR的氨基酸长度在641(CaSULTR3;4)~947 aa(CaSULTR3;1),分子量在69.65(CaSULTR3;7)~ 104.36 kD(CaSULTR3;1);等电点在8.42(CaSULTR1;2)~9.62(CaSULTR1;3)。除Ⅳ组成员CaSULTR4;1被预测到其亚细胞定位在叶绿体外,其他12个CaSULTR蛋白均可能定位在质膜上,这与前人在拟南芥中的研究结果一致[3]。
|
对CaSULTR蛋白进行二级结构预测后显示(表 3),所有成员均含有α-螺旋、延伸链、β-转角、无规则卷曲这4种结构元件,且四者的占比分别为45.95%(CaSULTR4;1)~53.62%(CaSULTR2;2)、13.55%(CaSULTR4;1)~ 16.05%(CaSULTR1;1)、3.89%(CaSULTR3;4)~ 5.14%(CaSULTR3;5)、27.89%(CaSULTR2;2)~ 35.61%(CaSULTR4;1)。
2.2 CaSULTR家族成员的保守基序与基因结构分析
保守基序的存在对于基因的功能和特性具有重要的指示作用[15]。通过对CaSULTR进行Motif分析(图 2),可以更好地理解这些成员在辣椒中的功能和调控机制。不同的Motif可能与特定的信号通路或调控因子相关联,它们的存在与否直接影响基因的表达和功能。在MEME网站对CaSULTR的保守基序(Motif)进行分析后,发现CaSULTR含有10个保守的Motif,并按照Motif 5-Motif 2-Motif 3-Motif 8-Motif 10-Motif 1-Motif 4-Motif 7-Motif 6-Motif 9的顺序排列。其中,Motif 6与Motif 9构成了C端的STAS结构域,其他Motif构成了Sulfate_transp结构域。此外,同一亚组的CaSULTR含有相同的Motif,说明同一亚组中的不同蛋白可能发挥着类似的功能。CaSULTR2;1和CaSULTR2;2不包含Motif 5,意味着它们在功能上可能与其他成员存在一些差异。此外,CaSULTR4;1不仅无Motif 5,还未含有Motif 8和Motif 10,暗示CaSULTR4;1在功能上与其他CaSULTR存在更为显著的差异,可能具有独特的功能或特性。
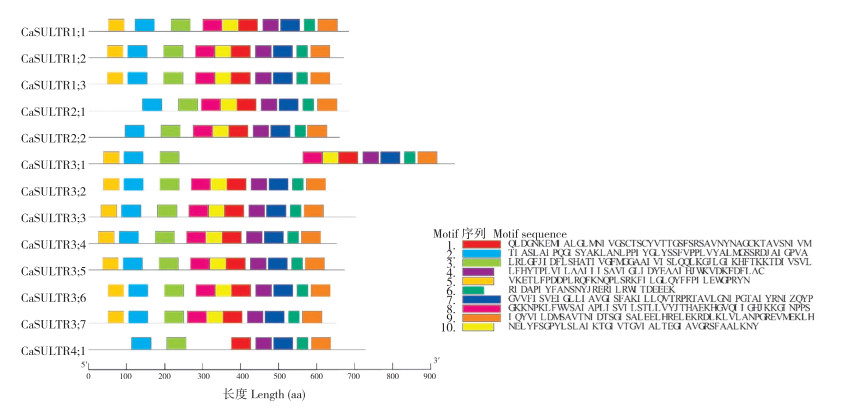
|
| 图 2 CaSULTR蛋白保守基序预测 Fig. 2 Prediction of conserved motifs of CaSULTR proteins |
对CaSULTR的基因结构分析发现(图 3),同一亚组中的CaSULTR内含子长度与外显子数量基本相同。其中,CaSULTR3;1含有的外显子数目最多、有17个,而CaSULTR2;1、CaSULTR2;2、CaSULTR3;7含有的外显子数目最少、有11个;CaSULTR2;1还含有最长20 Kb的内含子序列,而CaSULTR1;2的内含子序列最短,仅有3 Kb左右。
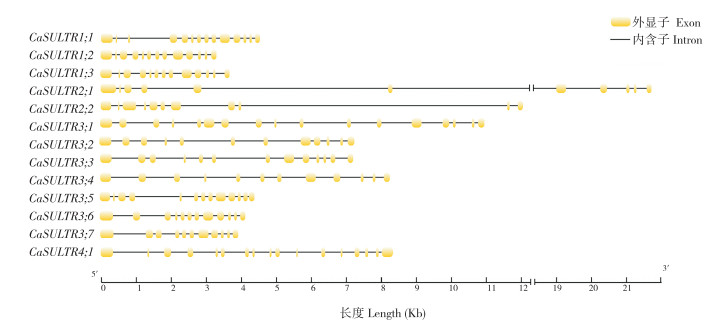
|
| 图 3 CaSULTR基因结构 Fig. 3 Gene structure of CaSULTR genes |
2.3 CaSULTR基因家族的染色体定位分析
对染色体定位图进行分析发现(图 4),辣椒CaSULTR成员分布在3、4、5、6、9、11、12这7条染色体上,且都分布在染色体的两端。除5号与6号染色体上各有1个CaSULTR外,3、4、9、11、12染色体上都有2个CaSULTR。值得注意的是,由于基因组测序质量的原因,CaSULTR3;7并未被定位到任一条染色体上。
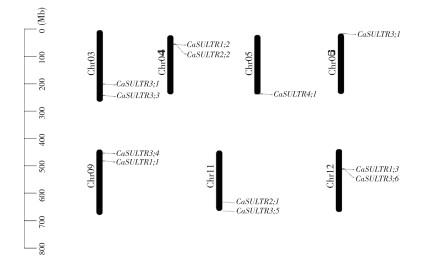
|
| 图 4 CaSULTR基因的染色体定位 Fig. 4 Chromosomal localization of CaSULTR genes |
2.4 CaSULTR基因启动子区域顺式作用元件分析
启动子是基因的调控区域,位于基因的上游区域,靠近起始转录位点。启动子区域顺式作用元件是一类特定的DNA序列,能够与转录因子结合,从而调控基因的转录活性[16]。辣椒CaSULTR启动子区域共有9种顺式作用元件,所有CaSULTR均含有大量的光响应原件,除光响应元件外,还包括4种激素(赤霉素、生长素、水杨酸、茉莉酸)响应元件与干旱、低温、防御与胁迫响应元件(图 5)。其中,11个基因(CaSULTR1;2、CaSULTR1;3、CaSULTR2;1、CaSULTR2;2、CaSULTR3;1、CaSULTR3;2、CaSULTR3;3、CaSULTR3;4、CaSULTR3;5、CaSULTR3;6、CaSULTR3;7、CaSULTR4;1)含有1~6个脱落酸响应元件,推测其功能可能与脱落酸通路相关。5个基因(CaSULTR1;1、CaSULTR1;2、CaSULTR2;1、CaSULTR3;6、CaSULTR4;1)含有1~3个生长素响应元件,推测其功能可能与生长素通路相关。
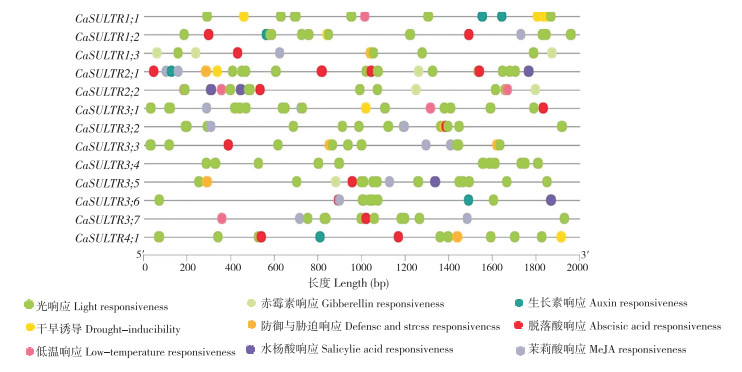
|
| 图 5 CaSULTR基因启动子区域顺式作用元件分析 Fig. 5 Analysis of cis-acting elements in promoter regions of CaSULTR genes |
2.5 CaSULTR在辣椒不同组织中的表达模式
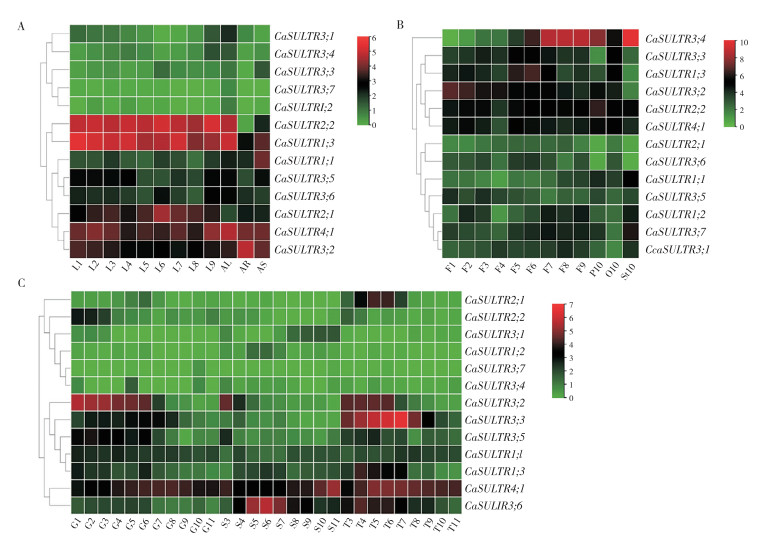
本研究通过对辣椒品种‘6421’的转录组进行分析[17],探究了CaSULTR在辣椒果皮、叶片和花中不同发育阶段的相对表达情况[17]。结果(图 6)显示,在果皮、叶片和花的发育过程中均检测到CaSULTR基因的表达,表明CaSULTR在辣椒发育过程中扮演着重要角色。
|
|
A:L为叶片,1~9为新叶出现后的2、5、10、15、20、25、30、40、50 d,AL、AR、AS分别为成熟的叶、根、茎; B:F为花蕾,1~10为花蕾出现后的2、5、10、15、20、25、30、40、50、60 d,P、O、ST分别为花瓣、子房、雌蕊; C:G为果肉、S为种子、T为胎座;1~11为开花后的10、15、20、25、30、35、40、45、50、55、60 d A: L, leaf, 1-9: 2, 5, 10, 15, 20, 25, 30, 40 and 50 days after the appearance of new leaves, AL, AR and AS are adult leaves, roots and stems, respectively; B: F, flower bud; 1-10: 2, 5, 10, 15, 20, 25, 30, 40, 50 and 60 days after the appearance of flower bud; P, O and ST are petal, ovary, and pistil, respectively; C: G, pulp, S: seed, T: placenta, and 1-11: 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 and 60 days after flowering 图 6 CaSULTR基因在不同组织及果实发育中的表达情况 Fig. 6 Expression of CaSULTR genes in different tissues and fruit development |
在叶片中,CaSULTR1;3/2;2/4;1在新叶出现后的2~50 d内均持续高表达,CaSULTR4;1在成熟的叶、根、茎中同样持续高表达(图 6A)。在花蕾中,仅CaSULTR3;4在F6~F9时期内高表达,花蕾出现后60 d的花瓣、子房、雌蕊中也仅有CaSULTR3;4的表达量较高,表明CaSULTR3;4在花的发育过程中可能发挥着重要的作用(图 6B)。在果肉形成过程中,CaSULTR3;2的表达量较高;CaSULTR3;6在种第6期程相杰等:辣椒CaSULTR基因家族的鉴定、表达与克隆67子的发育过程中高表达;CaSULTR3;3在胎座的发育过程中的表达量较高。CaSULTR3;2、CaSULTR3;6、CaSULTR3;3这3个基因在辣椒果皮、叶片、花的发育过程中的表达水平相对较高,表明三者在辣椒果肉、种子、胎座的发育过程中可能发挥着重要的作用(图 6C)。
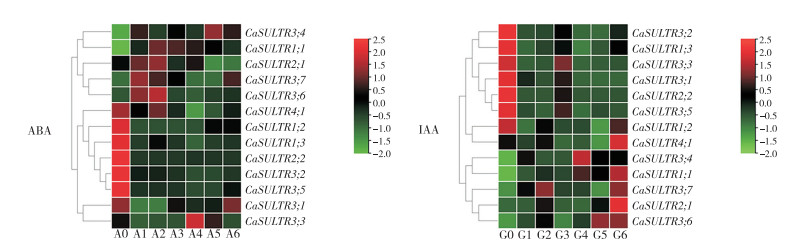
2.6 CaSULTR对外源激素胁迫响应的分析为探究辣椒CaSULTR对外源激素ABA、IAA的响应情况,本研究利用已报道的转录组数据分析了激素处理前后根部CaSULTR的表达情况[17](图 7)。在未处理时,CaSULTR1;2/1;3/2;2/3;2/3;5/4;1的表达量最高,随着外源ABA处理时间的增加,这6个基因的表达量持续降低;CaSULTR1;1/2;1/3;3/3;4/3;6/3;7分别在外源ABA处理1/1/3/12/1/0.5 h后表达水平最高。在外源IAA未处理时,CaSULTR1; 3/2;2/3;1/3;2/3;3/3;5的表达量最高,且随着处理时间的增加,这6个基因的表达水平持续下调;CaSULTR1;1/2;1/3;4/3;6/3;7/4;1分别在外源IAA处理24/24/6/24/24/24 h后表达量最高。以上结果说明,ABA、IAA可能诱导CaSULTR在根系中的表达。
|
| 0、1、2、3、4、5、6分别代表激素处理后的0、0.5、1、3、6、12、24 h; A、G:ABA、IAA处理 0, 1, 2, 3, 4, 5 and 6 represent 0, 0.5, 1, 3, 6, 12, and 24 hours after hormone treatment; A, G: ABA, IAA treatment 图 7 辣椒根系中CaSULTR对不同激素的响应分析 Fig. 7 Response of CaSULTR genes in pepper roots to different hormones |
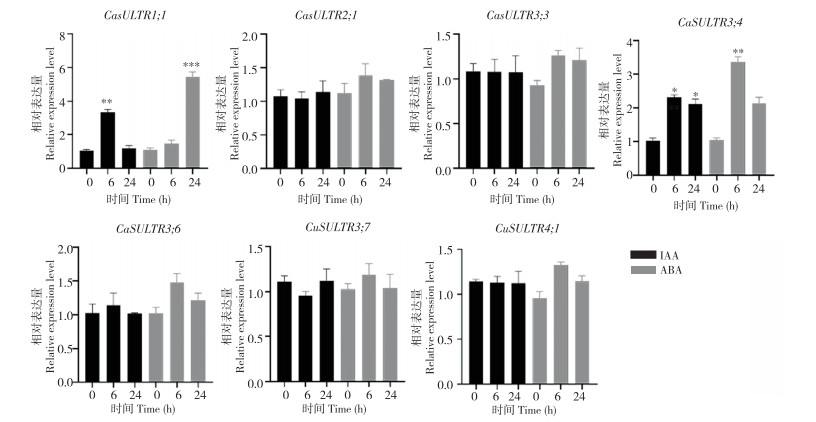
为筛选激素响应的CaSULTR基因,本研究使用荧光定量PCR检测了激素处理后转录组中表达上调的7个CaSULTR的表达量。结果(图 8)显示,除CaSULTR1;1与CaSULTR3;4的表达水平上调外,其他CaSULTR的表达量与未处理时并无显著差异。因此本研究对这2个基因进行克隆,待下一步对其具体功能进行验证。
|
| * 表示显著相关(P < 0.05),** 表示极显著相关(P < 0.01) * represents significant correlation (P < 0.05), **represents extremely significant correlation (P < 0.01) 图 8 辣椒根系中CaSULTR基因对激素胁迫的响应 Fig. 8 Response of CaSULTR genes in pepper root system to hormone stress |
根据CaSULTR1;1/3;4的CDS序列设计特异性引物,并进行PCR扩增,成功扩增出目标基因(图 9)。对目标片段胶回收后连接至pNCCam1304-SubN载体,并将连接后的重组载体转入感受态细胞。通过挑选阳性克隆送测序,并比对所得序列与目标参考序列,结果显示,CaSULTR1;1与CaSULTR3;4克隆序列与模板序列完全一致。

|
| 图 9 CaSULTR1;1与CaSULTR3;4的扩增结果 Fig. 9 Amplification result of CaSULTR1;1 and CaSULTR3;4 |
3 讨论
硫是植物生长发育和逆境响应所必需的大量营养物质,SULTR家族介导高等植物对硫酸盐的吸收和转运。SULTR基因家族成员已在多种植物中被鉴定出来,但对辣椒CaSULTR基因家族的了解极少[9]。本研究对CaSULTR基因进行了全基因组生物信息学分析,并进一步研究了该家族基因的组织表达模式及其对激素胁迫的响应。本研究共鉴定出13个CaSULTR基因,它们随机分布在7条染色体上。亚细胞定位预测分析显示,12个CaSULTR蛋白定位于细胞质膜,暗示它们为转运蛋白,与离子转运有关。随着现代生物技术的飞速发展,前人已经在诸如水稻、花生、茄子等农作物中重要性状相关基因鉴定方面取得了显著的成果[18-20]。深入了解CaSULTR的具体的生物学功能可以为快速、高效地创新种质与培育高产多抗的辣椒品种奠定理论基础。
系统进化树分析表明,辣椒与拟南芥的SULTR成员比对后可以划分为4个亚家族[3],均具有Sulfate_transp和STAS结构域,表明SULTR家族蛋白结构高度保守。结构域是蛋白质中在进化中保持相对不变的功能性区域,说明不同作物之间的基因同源性较高,在功能上具有相似性[21],在拟南芥等植物中,Group Ⅰ和Group Ⅱ亚家族成员可能主要负责根对SO42-的吸收及将其从根到茎的转运[22],Group Ⅲ亚家族成员可能主要负责促进植物对SO42-的吸收,Group Ⅳ亚家族成员可能主要负责将储存的SO42-释放到细胞质中,可通过与拟南芥等物种间SULTR基因功能的比对,来探究辣椒中CaSULTR基因可能发挥的生物学功能及不同之处。
植物生长发育所需的硫主要来源于土壤中的SO42-,植株摄取SO42-依赖于根系硫转运蛋白。在拟南芥SULTR3;1缺失突变体中,内源ABA的含量降低到野生型的一半,醛脱氢酶的活性也相应降低,进而影响到植物的萌发和根系生长及其对外源ABA的响应,暗示了硫对于ABA的生物合成存在重要影响[3],表明植物激素在调节植物生长和提高植物对非生物胁迫的耐受性方面起到至关重要的作用[23]。此外,CaSULTR的表达受多种激素的调控。转录组数据显示,在ABA处理后,CaSULTR1;1/2;1/3;3/3;4/3;6/3;7的表达量均升高,但仅在CaSULTR2;1/3;3/3;4/3;6/3;7的启动子中发现了ABA响应元件ABRE,这可能与ABA作为一种胁迫激素参与反应有关。CaSULTR对IAA也呈现出差异性响应,在IAA处理后,CaSULTR1;1/2;1/3;4/3;6/3;7/4;1的表达水平均呈上调趋势,但仅在CaSULTR1;1/2;1/3;6/4;1的启动子区域中发现了IAA响应元件,这与土豆SULTR的研究结果相符合[24]。以上结果表明,激素可能通过调节CaSULTR的表达来影响辣椒发育过程。由于转录组所提供的数据是定量参考,本研究通过荧光定量PCR筛选了激素处理后在根系中表达量上调的CaSULTR基因,发现ABA与IAA能够在转录水平上激活CaSULTR1;1与CaSULTR3;4的表达,这暗示外源激素和硫代谢之间存在调节机制[3]。下一步研究中,可通过构建辣椒VIGS株系探索激素作为信号分子在调控根系生长中的作用,以期为培育硫高效利用辣椒新品种提供重要的基因资源。
4 结论本研究在辣椒全基因组水平上鉴定到13个CaSULTR基因,对CaSULTR家族基因的理化性质、系统进化关系、基因结构等进行了详细的分析,并克隆出2个响应激素胁迫的基因CaSULTR1;1与CaSULTR3;4。结果表明,CaSULTR3亚组主要参与辣椒发育的过程,如CaSULTR3;4在花的发育过程中可能发挥着重要的作用,CaSULTR3;2、CaSULTR3;6、CaSULTR3;3这3个基因可能主要参与辣椒种子、果肉、胎座的发育过程。激素胁迫下,CaSULTR1;1与CaSULTR3;4的表达量在转录组与荧光定量PCR的数据中均表现为显著升高,表明二者可能参与了激素和硫代谢之间的调节机制。
| [1] |
WANG L, CHEN K, ZHOU M. Structure and function of an Arabidopsis thaliana sulfate transporter[J]. Nature Communications, 2021, 12(1): 4455-4462. DOI:10.1038/s41467-021-24778-2 |
| [2] |
SACCHI G A, NOCITO F F. Plant sulfate transporters in the low phytic acid network: Some educated guesses[J]. Plants, 2019, 8(12): 616-625. DOI:10.3390/plants8120616 |
| [3] |
CHEN Z, ZHAO P X, MIAO Z Q, QI G F, WANG Z, YUAN Y, AHMAD N, CAO M J, HELL R, WIRTZ M, XIANG C B. SULTR3s function in chloroplast sulfate uptake and affect ABA biosynthesis and the stress response[J]. Plant Physiology, 2019, 180(1): 593-604. DOI:10.1104/pp.18.01439 |
| [4] |
HUANG Q, WANG M, XIA Z. The SULTR gene family in maize (Zea mays L.): Gene cloning and expression analyses under sulfate starvation and abiotic stress[J]. Journal of Plant Physiology, 2018, 220: 24-33. DOI:10.1016/j.jplph.2017.10.010 |
| [5] |
BUCHNER P P S, KRIEGEL A, CARPENTIER M, HAWKESFORD M J. The sulfate transporter family in wheat: Tissue-specific gene expression in relation to nutrition[J]. Molecular Plant, 2010, 3(2): 374-389. DOI:10.1093/mp/ssp119 |
| [6] |
赵闻, 廖伟民, 赵金栋, 刁慧贞, 江孟涛, 蒋伦伟. 黄瓜硫酸盐转运蛋白家族成员的鉴定与表达分析[J]. 激光生物学报, 2022, 31(4): 353-360. DOI:10.3969/j.issn.1007-7146.2022.04.009 ZHAO W, LIAO W M, ZHAO J D, DIAO H Z, JIANG M T, JIANG L W. Identification and expression analysis of sulfate transporter family members in cucumber[J]. Acta Laser Biology Sinica, 2022, 31(4): 353-360. DOI:10.3969/j.issn.1007-7146.2022.04.009 |
| [7] |
ZHAO H, FRANK T, TAN Y, ZHOU C, JABNOUNE M, ARPAT A B, CUI H, HUANG J, HE Z, POIRIER Y, ENGEL K H, SHU Q. Disruption of OsSULTR3;3 reduces phytate and phosphorus concentrations and alters the metabolite profile in rice grains[J]. New Phytologist, 2016, 211(3): 926-939. DOI:10.1111/nph.13969 |
| [8] |
石尧, 尹美强, 温银元, 李露露, 孙敏, 高志强. 谷子SiSULTR2.1 基因的生物信息学分析及其对硒、硫的响应[J]. 激光生物学报, 2022, 31(2): 157-164. DOI:10.3969/j.issn.1007-7146.2022.02.009 SHI Y, YIN M Q, WEN Y Y, LI L L, SUN M, GAO Z Q. Bioinformatics of SiSULTR2.1 gene in millet and its response to selenium and sulfur[J]. Acta Laser Biology Sinica, 2022, 31(2): 157-164. DOI:10.3969/j.issn.1007-7146.2022.02.009 |
| [9] |
ZHANG H, HAO X, ZHANG J, WANG L, WANG Y, LI N, GUO L, REN H, ZENG J. Genome-wide identification of SULTR genes in tea plant and analysis of their expression in response to sulfur and selenium[J]. Protoplasma, 2022, 259(1): 127-140. DOI:10.1007/s00709-021-01643-z |
| [10] |
NISHIDA S, DUAN G, OHKAMA OHTSU N, URAGUCHI S, FUJIWARA T. Enhanced arsenic sensitivity with excess phytochelatin accumulation in shoots of a SULTR1;2 knockout mutant of Arabidopsis thaliana (L.) Heynh[J]. Plant Nutrition, 2016, 62(4): 367-372. DOI:10.1080/00380768.2016.1150790 |
| [11] |
KORALEWSKA A, STUIVER C E E, POSTHUMUS F S, KOPRIVA S, HAWKESFORD M J, DE-KOK L J. Regulation of sulfate uptake, expression of the sulfate transporters Sultr1;1 and Sultr1;2, and APS reductase in Chinese cabbage (Brassica pekinensis) as affected by atmospheric H2S nutrition and sulfate deprivation[J]. Functional Plant Biology, 2008, 35(4): 318-327. DOI:10.1071/FP07283 |
| [12] |
丁一琼. 大豆SULTR 基因家族的鉴定及GmSULTR1;2b 基因的功能分析[D]. 南京: 南京农业大学, 2014. DING Y Q. Identification of sulfate transporter gene family in soybean and functional analysis of GmSULTR1;2b[D]. Nanjing: Nanjing Agricultural University, 2014. |
| [13] |
XUN M, SONG J, SHI J, LI J, SHI Y, YAN J, ZHANG W, YANG H. Genome-wide identification of sultr genes in Malus domestica and low sulfur-induced MhSultr3;1a to increase cysteine-improving growth[J]. Frontiers in Plant Science, 2021, 12: 748242. DOI:10.3389/fpls.2021.748242 |
| [14] |
CHENG Z K, LIU Z G, MA L L, CHEN J Y, GOU J Y, SU L W, WU W T, YU W J, WANG P, XU Y C, CHEN Y. Fine mapping and identification of the candidate gene BFS for fruit shape in wax gourd (Benincasa hispida)[J]. Theoretical and Applied Genetics, 2021, 134: 3983-3995. DOI:10.1007/s00122-021-03942-8 |
| [15] |
BAILEY T L, MIKAEL B, BUSKE F A, MARTIN F, GRANT C E, LUCA C, JINGYUAN R, LI W W, NOBLE W S. MEME Suite: Tools for motif discovery and searching[J]. Nucleic Acids Research, 2009, 37: W202-W208. DOI:10.1093/nar/gkp335 |
| [16] |
LESCOT M, DÉHAIS P, THIJS G, MARCHAL K, MOREAU Y, VAN DE PEER Y, ROUZÉ P, ROMBAUTS S. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327. DOI:10.1093/nar/30.1.325 |
| [17] |
LIU F, YU H, DENG Y, ZHENG J, LIU M, OU L, YANG B, DAI X, MA Y, FENG S. PepperHub, a pepper informatics hub for the chili pepper research community[J]. Molecular Plant, 2017, 10(8): 1129-1132. DOI:10.1016/j.molp.2017.03.005 |
| [18] |
刘斌. 紧跟世界科技发展前沿, 水稻分子育种初见成效——广东省农业科学院水稻分子育种进展[J]. 广东农业科学, 2020, 47(12): 12-23. DOI:10.16768/j.issn.1004-874X.2020.12.002 LIU B. Following the frontier of scientific and technological development, significant progress has been made in molecular rice breeding ─ A brief introduction to the work in molecular rice breeding of Rice Research Institute of Guangdong Academy of Agricultural Sciences[J]. Guangdong Agricultural Sciences, 2020, 47(12): 12-23. DOI:10.16768/j.issn.1004-874X.2020.12.002 |
| [19] |
李涛, 孙保娟, 李植良, 黎振兴, 罗少波, 徐小万, 衡周, 宫超, 游倩. 茄子对青枯病的抗性机制研究现状与展望[J]. 广东农业科学, 2021, 48(9): 40-50. DOI:10.16768/j.issn.1004-874X.2021.09.005 LI T, SUN B J, LI Z L, LI Z X, LUO S B, XU X W, HENG Z, GONG C, YOU Q. Research status and prospects of resistance mechanism of eggplant to bacterial wilt[J]. Guangdong Agricultural Sciences, 2021, 48(9): 40-50. DOI:10.16768/j.issn.1004-874X.2021.09.005 |
| [20] |
董景芳, 李学忠, 张少红, 刘斌, 赵均良, 杨梯丰. 水稻籼粳性特异分子标记的筛选与判别体系的建立[J]. 广东农业科学, 2022, 49(9): 10-19. DOI:10.16768/j.issn.1004-874X.2022.09.002 DONG J F, LI X Z, ZHANG S H, LIU B, ZHAO J L, YANG T F. Screening of indica-japonica specific molecular markersand establishment of discrimination system[J]. Guangdong Agricultural Sciences, 2022, 49(9): 10-19. DOI:10.16768/j.issn.1004-874X.2022.09.002 |
| [21] |
LETUNIC I, DOERKS T, BORK P. SMART: Recent updates, new developments and status in 2015[J]. Nucleic Acids Research, 2014, 43: D257-D260. DOI:10.1093/nar/gku949 |
| [22] |
ROUACHED H, WIRTZ M, ALARY R, HELL R, ARPAT A B, DAVIDIAN J C, FOURCROY P, BERTHOMIEU P. Differential regulation of the expression of two high-affinity sulfate transporters, SULTR1.1 and SULTR1.2, in Arabidopsis[J]. Plant Physiology, 2008, 147(2): 897-911. DOI:10.1104/pp.108.118612 |
| [23] |
CHEN K, LI G J, BRESSAN R A, SONG C P, ZHU J K, ZHAO Y. Abscisic acid dynamics, signaling, and functions in plants[J]. Journal of Integrative Plant Biology, 2020, 62(1): 25-54. DOI:10.1111/jipb.12899 |
| [24] |
VATANSEVER R, KOC I, OZYIGIT I I, SEN U, URAS M E, ANJUM N A, PEREIRA E, FILIZ E. Genome-wide identification and expression analysis of sulfate transporter (SULTR) genes in potato (Solanum tuberosum L.)[J]. Planta, 2016, 244(6): 1167-1183. DOI:10.1007/s00425-016-2575-6 |
(责任编辑 马春敏)
 2024, Vol. 51
2024, Vol. 51