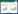文章信息
基金项目
- 海南碧凯药业有限公司科技项目(H20220886)
作者简介
- 管艳辉(1999—),女,在读硕士生,研究方向为植物病原细菌学,E-mail:guan9917@126.com.
通讯作者
- 王波(1992—),男,博士,副教授,研究方向为植物病原细菌学,E-mail:wangboxs@scau.edu.cn; 刘琼光(1964—),男,博士,教授,研究方向为植物病原细菌学,E-mail:qgliu@scau.edu.cn.
文章历史
- 收稿日期:2024-04-11
2. 海南渊源农业科技有限公司,海南 海口 5702161;
3. 海南回元堂药业有限公司,海南 海口 570311
2. Hainan Yuanyuan Agricultural Science and Technology Co., Ltd., Haikou 570216, China;
3. Hainan Huiyuantang Pharmaceutical Co., Ltd., Haikou 570311, China
【研究意义】温郁金(Curcuma wenyujin Y. H. Chen et C. Ling)为姜科姜黄属植物,是我国浙江、海南、贵州等地栽培的药用植物之一,其根茎具有预防和控制肿瘤的药用作用[1]。1997年海南省积极推广温郁金种植,在海口市、澄迈县及临高县建立多个温郁金栽培基地[2],然而,长期的栽培活动导致连作问题日益突出,病虫害屡禁不止,给温郁金产业发展带来极大的挑战。明确土壤中微生物种群结构及其多样性差异,解析连作障碍机制,将为利用土壤微生物改良剂、缓减作物连作障碍奠定基础。【前人研究进展】目前,作物连作障碍已成为农业生产上一大难题。一些根茎类入药的植物在栽培过程中广泛存在连作障碍[2],并导致土壤酸化、微生物群落结构失衡、植物生长不良甚至大量死亡[3-4],严重影响植物健康和制药业的可持续发展[4]。植物-土壤-微生物之间受耕作的影响,连作使中药作物根际土壤微生物结构及微生物次级代谢产物组成发生变化,根际微生态失衡[5],影响植物的健康生长和病原微生物繁殖,同时也影响植物药用成分的含量[6]。研究表明,微生物群落结构变化所导致的土传病害,是药用植物连作障碍的直接原因[4],因此,必须采取有效措施来消减连作障碍,维护土壤微生态平衡。土壤熏蒸消毒和微生物菌剂施用是防控土传病害、缓解连作障碍的有效途径。土壤熏蒸消毒是指在作物种植前,将土壤熏蒸剂施用于土壤中,覆盖塑料薄膜,密闭熏蒸15 d以上,使熏蒸剂气体扩散至不同深度的土壤中,从而达到防治土传病、虫、草等危害的一种土壤处理技术[7],其可有效改善土壤物理性状,促进土壤养分有效化,增加产量,可缓解草莓[8]和三七[9]等作物连作障碍。棉隆是一种广谱性的土壤熏蒸剂,可产生异硫氰酸甲酯气体,迅速扩散至土壤团粒间,对土壤中病原真菌、线虫等土传病原物及杂草均有较好的杀灭作用和防控效果[10]。【本研究切入点】对温郁金连作土壤进行棉隆熏蒸处理是否能够改善温郁金生长、减少病害发生及死苗现象的相关研究,迄今未见报道。温郁金连作及土壤熏蒸处理影响哪些土壤微生物尚不清楚。探究棉隆熏蒸对土壤微生物种群和数量的的影响,以期分析温郁金连作障碍的主要原因。【拟解决的关键问题】本研究对温郁金连作土壤进行棉隆熏蒸处理,观察植物的生长状况,进一步通过PacBio Sequel微生物3代测序手段,比较分析温郁金连作及熏蒸土壤根际真菌和细菌种群结构差异,从土壤微生物的角度出发,解析温郁金连作障碍机制。
1 材料与方法 1.1 供试材料供试温郁金品种为‘温莪术’。
棉隆(Dazomet),中文别名为3, 5-二甲基-1,3,5-噻二嗪烷-2-硫酮。
1.2 试验地概况田间试验于2023年1—10月在海南省临高县皇桐镇透滩村的海南碧凯药业有限公司温郁金种植915基地(19° 50' 52''N,109° 45' 7''E)进行。该地地形平坦,每年相对湿度为85%,年均降雨量约1 804 mm,降雨量充沛,处于热带季风海洋性气候,夏季高温多雨,其土壤质地为砖红壤酸性土,粒径0.002~0.05 mm的粉粒约占51%。
1.3 试验方法1.3.1 试验设计 为探究土壤施用棉隆熏蒸对土壤微生物种群和数量的的影响,试验共设置3个处理:连续种植3年温郁金的连作地土壤(连作)、连续种植3年的温郁金土壤经棉隆熏蒸后继续栽培温郁金的土壤(熏蒸)、未种植温郁金的土壤(未种植)。每个处理取3块地,每块地面积约1 334 m2。
1.3.2 土壤熏蒸 选择连作温郁金3年的土壤,面积30 hmm2,于温郁金播种前1个月,用棉隆进行土壤熏蒸处理,具体方法:清理前茬温郁金残体,打水浇地,使土壤表层35 cm潮湿均匀,湿度达到60%~70%。使用棉隆施药一体机,使棉隆和土壤充分均匀混合。每667 m2棉隆施用量为40 kg,旋耕深度达35 cm左右,地膜覆盖密封不漏气,熏蒸20~25 d。
1.3.3 温郁金种植 熏蒸处理的土壤,移去地膜,透气约7 d,深耕机旋耕1遍。将土壤中棉隆残余气体充分排除后,施用有机肥,温郁金种姜经药剂浸种消毒处理,晾干,于2023年3月播种,常规种植管理。
1.3.4 土壤样品采集 由于连作障碍导致土壤病原微生物的大量积累,温郁金种植过程在海南夏秋高温高湿季节发病严重,待田间病情稳定后,于2023年10月采集田间土壤样本。各处理采用五点取样法,取表土以下20 cm范围内的根际和根围土壤200 g,同一处理的土壤混匀,-80℃保存备用,用于土壤微生物群落测序分析。
1.3.5 土壤DNA提取与PCR扩增 取0.25 g土壤样品,按试剂盒(PowerSoil® DNA Isolation kit)操作流程,提取土壤总DNA,细菌用引物27F(5'-AGRGTTTGATYNTGGCTCAG-3')、1492R(5'-TASGG HTACCTTGTTASGACTT-3')PCR扩增16S rRNA序列,真菌用引物ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3')、ITS4(5'-TCCTCCGCTTATTGATATGC-3'),PCR扩增ITS序列。PCR反应体系:10 μL KOD FX Neo Buffer(2×),4 μL dNTP(2 mmol/L),0.4 μL KOD FX Neo(TOYOBO公司),5 ng DNA模版,1 μL正向引物(10 μmol/L),1 μL反向引物(10 μmol/L),用双蒸水补至10 μL。PCR反应程序为:95℃预变性5 min;95℃变性30 s,50 ℃退火30 s,72 ℃ 1 min,35个循环;72 ℃延伸5 min。PCR产物经2% 琼脂糖凝胶电泳检测,用Nano Drop 2000 UV-Vis Spectrophotometer(Thermo Fisher Scientific, USA)测定浓度。1.3.6文库构建与测序上述PCR产物进行纯化、定量和均一化形成测序文库(SMRT Bell),经质检合格的文库用PacBio Sequel进行测序。
1.4 数据分析使用SMRT Link v 8.0软件对原始下机subreads进行校正,得到环形一致性序列(Circular consensus sequencing,CCS),使用lima(v1.7.0)软件,通过barcode序列识别不同样品的CCS序列并去除嵌合体,得到高质量的CCS序列,使用cutadapt v2.7(错误率0.2)识别正向引物与反向引物,丢弃不包含引物的CCS序列,并对CCS长度进行过滤,在相似性97% 的水平上对序列进行聚类(USEARCH,version 10.0),以测序所得序列数的0.005% 作为阈值滤过OTU。使用Usearch软件对Tags在97% 的相似度水平下进行聚类、获得OTU,并基于Silva(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释。采用ACE和Shannon多样性指数,第6期管艳辉等:温郁金连作和熏蒸处理土壤微生物种群数量分析99以及各样品序列间的系统进化关系、序列相对丰度等,分别进行α多样性、β多样性分析、主成分分析(PCA)。
2 结果与分析 2.1 连作和土壤熏蒸对温郁金植株田间长势的影响同一地块连续种植温郁金2年以上会出现严重的连作障碍。如图 1所示,连作3年种植的温郁金长势极差,前期出苗慢,早期出现死苗现象。随着时间的推移,温郁金叶片逐渐变黄,分蘖少或不分蘖,植株矮小,发病严重时干枯死亡。造成连作障碍的原因很多,如单一连作使得土壤有害菌增多、土壤养分分布不均以及植物根际分泌的自毒物质等。本研究对连作3年温郁金土壤进行熏蒸处理,发现连作土壤经熏蒸后,种植的温郁金长势良好,叶片浓绿,分蘖正常,叶片干枯和死亡的现象极少(图 2),表明熏蒸处理可显著改善温郁金的连作障碍。

|
| 图 1 连作土壤种植温郁金植株田间长势 Fig. 1 Growth status of Curcuma wenyujin plants in continuous cropping soil |

|
| 图 2 棉隆熏蒸土壤种植温郁金植株田间长势 Fig. 2 Growth status of Curcuma wenyujin plants in soil fumigated with dazomet |
2.2 连作和土壤熏蒸对温郁金根际土壤细菌群落的影响
土壤熏蒸处理后,种植的温郁金生长7个月时,其田间长势趋于稳定。此时,采集未种植土壤、连作土壤、熏蒸土壤样品进行微生物基因组测序,采用Silva数据库对细菌OTU序列进行相似性比对和分类,共得到1 100个细菌OUT(弃去总reads数<5的低丰度的OTU),其中分类学地位明确的细菌有23门55纲125目178科294属519种。
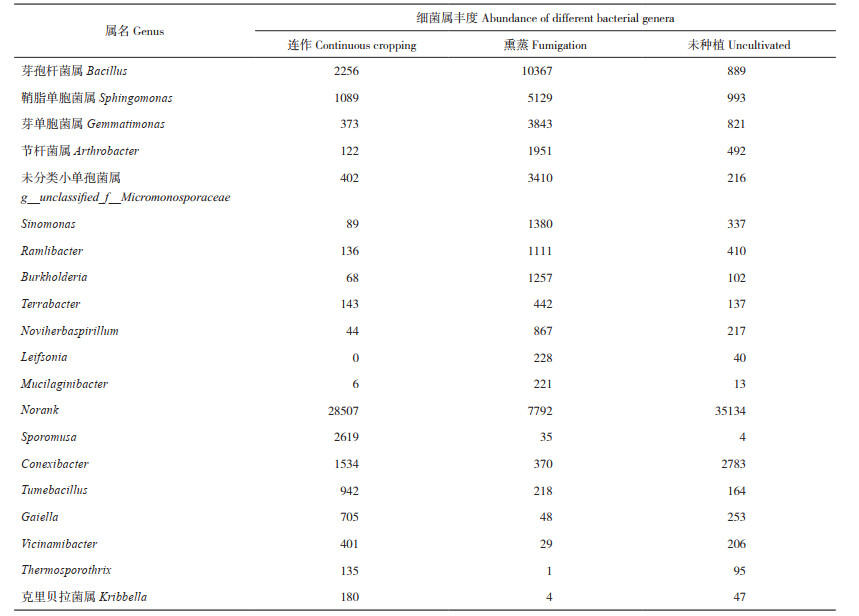
2.2.1 根际土壤细菌α多样性分析 为评估单一样本的物种丰度及物种多样性,本研究对3个样品进行了α多样性分析。群落丰度指数(即ACE指数)显示,与连作和未种植土壤相比,熏蒸土壤中根际细菌群落的ACE指数较低,其中连作土壤中细菌群落的ACE指数最高(图 3A),表明物种丰度较高,说明连作使温郁金根际土壤细菌物种丰度增加。此外,连作土壤中,群落多样性指数(即Shannon指数)也表现为增加(图 3B),表明该土壤的物种较丰富,其种类更多。以上结果表明温郁金连作可增加根际土壤细菌物种的丰度和多样性。
|
| 图 3 连作与熏蒸温郁金根际土壤细菌群落丰度(A)和多样性指数(B) Fig. 3 Abundance (A) and diversity index (B) of soil bacterial communities in the rhizosphere of Curcuma wenyujin planted in continuous cropping plots or fumigated plots |
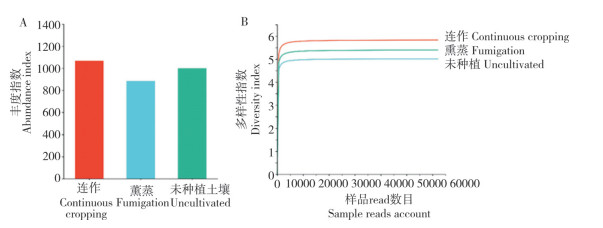
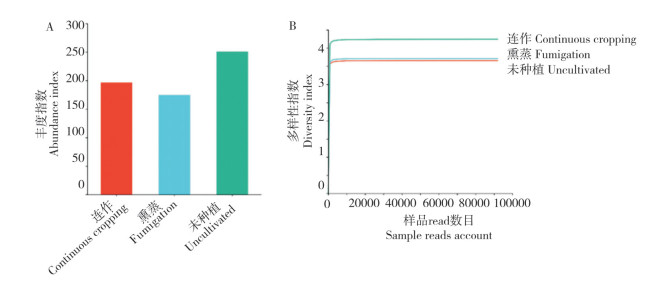
2.2.2 根际土壤细菌β多样性分析 细菌OTU聚类结果(图 4A)表明,连作与未种植的土壤聚为一类,熏蒸土壤与连作和未种植土壤相似性较小,表明土壤熏蒸处理改变了土壤中细菌群落的结构;通过对连作、熏蒸和未种植土壤中细菌的PCA分析(图 4B)发现,三者之间细菌群落差异性较大(距离较远),表明三者中细菌主成分不同。
|
| 图 4 连作与熏蒸温郁金根际土壤细菌UPGMA聚类树(A)和PCA分析图(B) Fig. 4 UPGMA clustering tree (A) and PCA analysis diagram (B) of soil bacteria in the rhizosphere of Curcuma wenyujin planted in continuous cropping plots or fumigated plots |
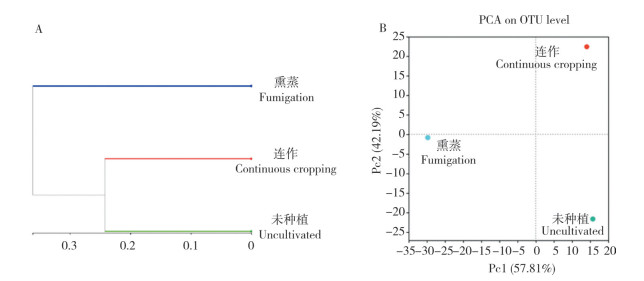
2.2.3 根际土壤细菌组成分析 由图 5A可知,连作、熏蒸和未种植土壤中相对丰度最高的10个细菌门相同,分别为绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)、WPS-2、髌骨细菌门(Patescibacteria)、(GAL15)和浮霉菌门(Planctomycetota)。
|
| 图 5 连作与熏蒸温郁金根际土壤中细菌门(A)和属(B)数量变化 Fig. 5 Changes in the abundance of soil bacteria at the phylum (A) and genus (B) levels in the rhizosphere of Curcuma wenyujin planted in continuous cropping plots or fumigated plots |
细菌群落属水平的分析结果(图 5B)表明,与未种植土壤相比,连作土壤中AD3、TK10和WPS-2的丰度降低。土壤经熏蒸后,土壤微生物重新建立平衡,种植温郁金7个月后,发现芽孢杆菌属(Bacillus)和鞘脂单胞菌属(Sphingomonas)丰度较未种植土壤丰度增加,二者与芽单胞菌属(Gemmatimonas)、节杆菌属(Arthrobacter)、未分类小单孢菌属(g_unclassified_f_Micromonosporaceae)、Sinomonas、Ramlibacter、伯克氏菌属(Burkholderia)、Noviherbaspirillum等属在熏蒸土壤中的丰度明显高于连作土壤(表 1),表明土壤熏蒸后,这些细菌的数量极大增加。然而,Norank、鼠孢菌属(Sporomusa)、Conexibacter、Tumebacillus、Gaiella等属的丰度则表现为连作大于熏蒸土壤(表 1)。由此表明,连作土壤经熏蒸处理后,极大地改变了一些细菌种群结构和数量变化。
|
2.3 连作和土壤熏蒸对温郁金根际土壤真菌群落的影响
对未种植、连作及熏蒸的3种土壤进行真菌测序,根据所得到的高质量OTU序列,在UNITE数据库中进行97% 的相似性比对及聚类分析,结果发现,在总共452个高质量OTU中,其分类学地位明确的涉及10个门,分布于真菌的30纲61目118科188属259种。
2.3.1 根际土壤真菌α多样性分析 由图 6A可知,与未种植土壤比较,连作土壤的ACE指数较低,表明连作使根际土壤真菌物种丰度减少。如图 6B所示,相较于未种植土壤,连作土壤与熏蒸土壤的Shannon指数较低,表明连作使土壤真菌物种多样性减少。综上所述,温郁金连作可减少根际土壤真菌物种的丰度和多样性。
|
| 图 6 连作与熏蒸温郁金根际土壤真菌群落丰度(A)和多样性指数(B) Fig. 6 Abundance (A) and diversity index (B) of soil fungal communities in the rhizosphere of Curcuma wenyujin planted in continuous cropping plots or fumigated plots |
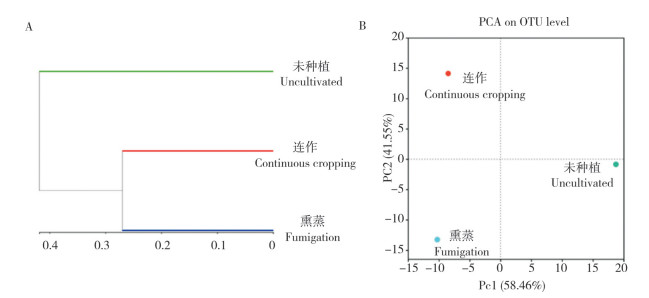
2.3.2 根际土壤真菌β多样性分析 真菌OTU聚类结果(7A)表明,连作与熏蒸土壤聚为一类,连作和熏蒸土壤与未种植土壤相似性较小,说明植物的生长会改变土壤中微生物的结构;通过对连作、熏蒸和未种植土壤中真菌PCA分析(图 7B)发现,三者之间真菌群落差异性较大(距离较远),表明三者中真菌主成分不同。
|
| 图 7 连作与熏蒸温郁金根际土壤真菌UPGMA聚类树(A)和PCA分析图(B) Fig. 7 UPGMA clustering tree (A) and PCA analysis diagram (B) of soil fungi in the rhizosphere of Curcuma wenyujin planted in continuous cropping plots or fumigated plots |
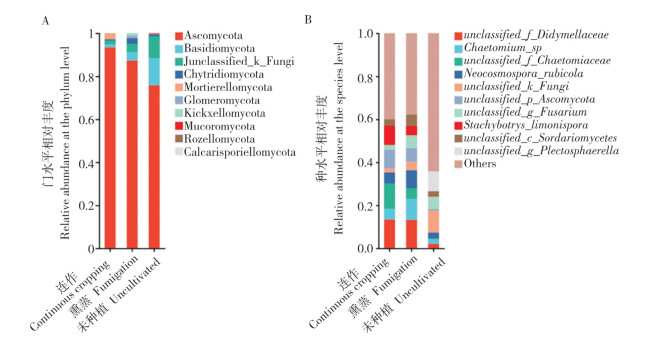
2.3.3 根际土壤真菌组成分析 图 8显示,在连作、熏蒸和未种植土壤中,有5个真菌门类的丰度均较高,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、被孢菌门(Mortierellomycota)以及未分类真菌门(unclassified_k__Fungi)。其中子囊菌门真菌的丰度在未种植土壤中最低,连作会使子囊菌门真菌的丰度显著升高。担子菌门真菌的丰度变化趋势与子囊菌相反,即在未种植土壤中丰度最高,连作使担子菌门真菌的丰度显著降低。
|
| 图 8 连作与熏蒸的温郁金根际土壤中真菌门(A)和属(B)水平数量变化 Fig. 8 Changes in the abundance of soil fungi at the phylum (A) and genus (B) levels in the rhizosphere of Curcuma wenyujin planted in continuous cropping plots or fumigated plots |
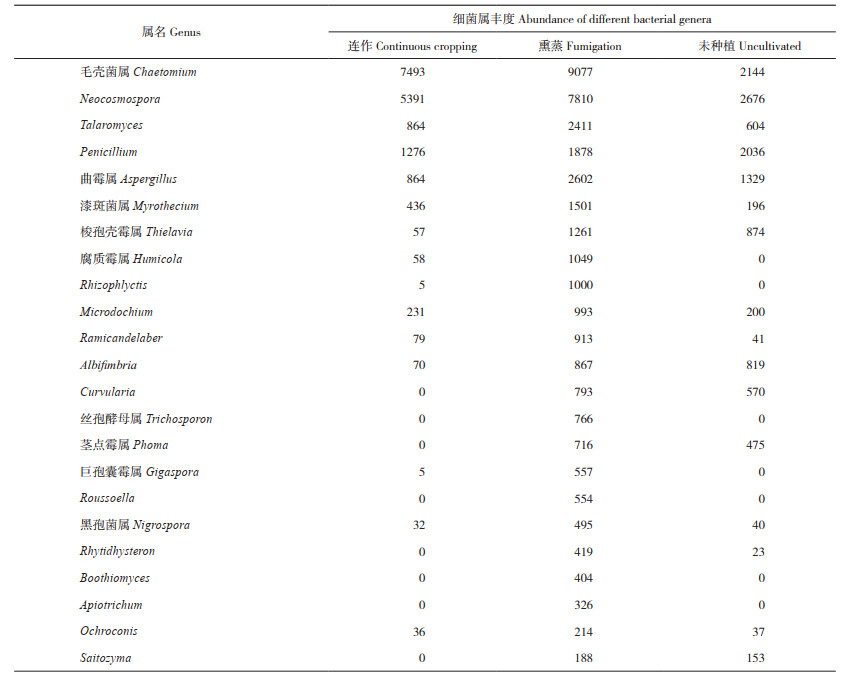
大量的真菌属,如毛壳菌属(Chaetomium)、Neocosmospora、Talaromyces、青霉属(Penicillium)、曲霉属(Aspergillus)、漆斑菌属(Myrothecium)、梭孢壳霉属(Thielavia)、腐质霉属(Humicola)、Rhizophlyctis、Microdochium、Ramicandelaber、Albifi mbria、Curvularia、巨孢囊霉属(Gigaspora)、Roussoella、黑孢菌属(Nigrospora)、Rhytidhysteron、Boothiomyces、Apiotrichum、Ochroconis、Saitozyma、丝孢酵母属(Trichosporon)、茎点霉属(Phoma)等在熏蒸的土壤中其丰度明显高于连作土壤,而有些真菌仅在熏蒸土壤中存在(表 2)。然而,一些未分类鉴定的真菌属,如g_unclassified_f_Chaetomiaceae、g_unclassified_ f_Didymellaceae、g_unclassifi ed_o_Chaetothyriales,以及葡萄穗霉属(Stachybotrys)、聚孢霉属(Clonostachys)、Rectifusarium、头束霉属(Cephalotrichum)、被孢霉属(Mortierella)、节丛孢属(Arthrobotrys)、Paracremonium、拟暗球腔菌属(Phaeosphaeriopsis)、假阿利什霉属(Pseudallescheria)、毁丝霉属(Myceliophthora)、油脂酵母属(Lipomyces)、小黑盘孢属(Melanconiella)、锥盖伞属(Conocybe)、Geminibasidium和Apiosordaria等的丰度则表现为连作大于熏蒸,其中一些真菌属仅存在于连作土壤中(表 2)。上述结果表明,连作和熏蒸的两种土壤中,真菌的种群结构和数量差异非常大。
|
3 讨论
稳定和功能多样的根际土壤微生物群落结构对维持土壤健康具有至关重要的作用,然而土壤微生物结构的稳定性又取决于根际微生物的多样性[11],微生物群落之间相互影响,相互协调通过产生不同的次级代谢产物维系着根际微生态系统的稳定。土壤经熏蒸消毒,可影响土壤养分循环,促进养分有效化[12],使得一些原本不能重茬的作物不仅可重茬种植,且产量大幅超过新地种植,在增产的同时还显著提高农产品品质[13],缓解作物土壤连作障碍[8]。
基于高通量测序技术,本研究发现在温郁金连作、熏蒸及未种植的3种土壤中至少存在8个细菌门。与连作土壤相比,棉隆熏蒸土壤中的芽孢杆菌属(Bacillus)、鞘脂单胞菌属(Sphingomonas)、芽单胞菌属(Gemmatimonas)、节杆菌属(Arthrobacter)、Sinomonas、伯克氏菌属(Burkholderia)等的细菌数量增加,它们在缓解连作障碍方面可能起作用。例如,芽孢杆菌具有促进植物生长、增强植物抗病能力、改善土壤质量和防治植物病害等作用[14-16]。鞘脂单胞菌属可以维持土壤的氮平衡,促进植物生长及具有生物防治功能[17]。小单孢菌科中有很多成员产生的抗生素和其他生物活性物质被广泛应用于医疗和农业的多个领域[18-19]。Sinomonas能产生各种功能酶和植物促生物质[20]。伯克氏菌可产生对不同植物病害具有抑制作用的多种次生代谢产物[21-22]。以上有益细菌在熏蒸后的土壤中数量显著增加,它们对减轻温郁金土传病害可能发挥重要作用,但还需要进一步验证。
在连作、熏蒸及未种植温郁金土壤中存在5个真菌门类群,进一步分析表明,大量真菌的种属,如毛壳菌属(Chaetomium)、Talaromyces、青霉属(Penicillium)、曲霉属(Aspergillus)、漆斑菌属(Myrothecium)、梭孢壳霉属(Thielavia)、腐质霉(Humicola)、黑孢菌属(Nigrospora)、Boothiomyces等在熏蒸土壤中的丰度明显高于连作土壤,而有些真菌仅在熏蒸土壤中存在。毛壳菌属可有效降解纤维素和有机物,对土壤中的其他微生物有拮抗作用[23],可作为植物病害的生物防治菌。嗜松篮状菌(Talaromyces pinophilus)具有拮抗禾谷镰孢菌(Fusarium graminearum)引起的玉米茎腐病作用[24]。一些曲霉属真菌对赤霉病菌(Fusarium graminearum)和大丽轮枝菌(Verticillium dahliae)有拮抗作用[25],其次级代谢产物对多种病原细菌具有抑菌作用[26]。漆斑菌属一些菌株不但具有防治植物寄生线虫的潜力,还能够产生广泛应用于工业的漆酶[27]。梭孢壳霉可合成并分泌种类丰富的木质纤维素降解酶类[28]。棕黑腐质霉(Humicola)中的H. fuscoatra产生多种抗菌肽,对一些植物病原细菌有抑菌作用[29]。土壤微生物Rhizophlyctis属分泌多种生物降解酶[30],黑孢菌属(Nigrospora)具有多种拮抗细菌的活性物质[31]。大量的有益真菌在熏蒸土壤中的数量显著高于连作土壤,以上分析结果表明,这些真菌种群结构和数量的差异可能在抑制温郁金土传病害的发生,消减温郁金连作障碍。然而,在连作的土壤中则存在另外一些真菌种群数量明显高于熏蒸土壤,如Rectifusarium、头束霉属(Cephalotrichum)、被孢霉属(Mortierella)、拟暗球腔菌属(Phaeosphaeriopsis)、小黑盘孢属(Melanconiella)等,其丰度则表现为连作土壤大于熏蒸土壤,其中有不少真菌属仅存在于连作土壤中。在这些真菌中,有一些是植物病原菌,如Rectifusarium(F. ventricosum的复合株)[32]、部分头束霉属真菌是某些动、植物病害的致病菌或次生致病菌[33]。一些被孢霉种类能引起动、植物病害,在生产上造成一定损失[34-35]。拟暗球腔菌属引起水稻穗部病害[36-37],小黑盘孢属的一些种可为害山茱萸科的灯台树与胡桃科的核桃[38]。
本研究还发现,采用棉隆熏蒸剂处理土壤,部分有益微生物,如葡萄穗霉属(Stachybotrys)、节丛孢属(Arthrobotrys)等在熏蒸后的土壤中,其数量明显减少或者被杀死。葡萄穗霉属真菌广泛存在于土壤、植物内,所产生的次级代谢产物结构类型丰富,在抗肿瘤、抗菌、抗病毒和抗炎等方面表现出显著的生物学活性[39],然而,更多的病原微生物,在熏蒸后的土壤中检测不到,如镰刀菌,头束霉,被孢霉等,可能已被杀死。相反,在熏蒸后的土壤中大量有益微生物,包括细菌和真菌,种群数量显著增加,其原因可能是土壤经过熏蒸剂处理,土壤理化性质改变,影响土壤养分循环[40],原有的微生物种群结构被打破,并且熏蒸过程中,土壤多次翻耕,打碎,其土壤理化性质有利于微生物生长繁殖。在播种前土壤施用有机肥,温郁金块茎消毒处理,使得温郁金生长过程中的土壤微生物种群建立新的平衡,其中连作种植土壤中由于致病微生物的大量累积,导致温郁金播种后早期缺苗断垄,后期植株大量枯死,存在严重的连作障碍现象。熏蒸土壤中温郁金的植物长势情况明显优于连作种植,且植株的死苗现象发生少。
综上,本研究认为土壤熏蒸可消减温郁金连作障碍,其作用机理可能为由于连作土壤中病原微生物种群的大量累积,而熏蒸土壤中病原微生物种群数量大幅度减少,且具有生防作用的功能性微生物,如芽孢杆菌等种群数量增加,从而抑制温郁金土传病害的发生,促进植物的健康生长。同时,研究温郁金-微生物群落结构-土壤系统的相互联系,可为其他作物连作障碍机制的研究提供可行的思路。
4 结论温郁金连作栽培导致植株长势差、死苗现象严重。连作土壤施用棉隆熏蒸后再种植温郁金,植株长势良好、病害发生少。连作土壤中AD3、TK10和WPS-2等属的丰度降低,而熏蒸土壤中,芽孢杆菌属(Bacillus)和鞘脂单胞菌属(Sphingomonas)等一些具有生防功能的细菌丰度增加。连作使子囊菌门真菌的丰度显著升高,担子菌门真菌的丰度显著降低。毛壳菌属(Chaetomium)、Neocosmospora、Talaromyces_、青霉属(Penicillium)、曲霉属(Aspergillus)、漆斑菌属(Myrothecium)、梭孢壳霉(Thielavia)、腐质霉属(Humicola)、Rhizophlyctis、Microdochium、Ramicandelaber、Albifi mbria、Curvularia、巨孢囊霉属(Gigaspora)、Roussoella、黑孢菌属(Nigrospora)、Rhytidhysteron、Boothiomyces、Apiotrichum、Ochroconis、Saitozyma、丝孢酵母属(Trichosporon)、茎点霉属(Phoma)等大量有益真菌,在熏蒸土壤中其丰度明显高于连作土壤。表明连作土壤中有较多的致病微生物累积,棉隆熏蒸处理可杀灭土壤中病原菌的数量,增加有益微生物种群数量,可消减温郁金连作障碍。
| [1] |
刘梅, 郭小红, 孙全, 陈娟, 吴文辉, 张小琼. 温郁金的化学成分和药理作用研究进展[J]. 现代药物与临床, 2021, 36(1): 204-208. DOI:10.7501/j.issn.1674-5515.2021.01.041 LIU M, GUO X H, SUN Q, CHEN J, WU W H, ZHANG X Q. Research proaress on chemical constituents and pharmacological activity of Curcuma wenyujin[J]. Drugs & Clinic, 2021, 36(1): 204-208. DOI:10.7501/j.issn.1674-5515.2021.01.041 |
| [2] |
马瑞, 徐刚, 郑樊, 郑妃庆, 谢昌平. 温郁金白绢病菌的生物学特性及药剂毒力测定[J]. 热带作物学报, 2018, 39(7): 1410-1415. DOI:10.3969/j.issn.1000-2561.2018.07.022 MA R, XU G, ZHENG F, ZHENG F Q, XIE C P. Biological characteristics of Sclerotium rolfsii causing Curcuma wenyujin southern blight and toxicity test of different fungicides in laboratory[J]. Chinese journal of Tropical Crops, 2018, 39(7): 1410-1415. DOI:10.3969/j.issn.1000-2561.2018.07.022 |
| [3] |
胡双, 孙文静, 高林怡, 郭龙妹, 王莉莉, 黎万奎. 药用植物连作障碍研究进展[J]. 江苏农业科学, 2021, 49(16): 38-48. DOI:10.15889/j.issn.1002-1302.2021.16.007 HU S, SUN W J, GAO L Y, GUO L M, WANG L L, LI W K. Research progress of countinous cropping obstacles of medicinal plants[J]. Jiangsu Agricultural Sciences, 2021, 49(16): 38-48. DOI:10.15889/j.issn.1002-1302.2021.16.007 |
| [4] |
吴红淼, 林文雄. 药用植物连作障碍研究评述和发展透视[J]. 中国生态农业学报, 2020, 28(6): 775-793. DOI:10.13930/j.cnki.cjea.190760 WU H M, LIN W X. A commentary and development perspective on the consecutive monoculture problems of medicinal plants[J]. Chinese Journal of Eco-Agriculture, 2020, 28(6): 775-793. DOI:10.13930/j.cnki.cjea.190760 |
| [5] |
ZAHIDA H P, JAVED I, ZHANG Q M, CHEN D M, WEI H, SALEEM M. Continuous cropping alters multiple biotic and abiotic indicators of soil health[J]. Soil Systems, 2020, 4(4): 58-59. DOI:10.3390/soilsystems4040059 |
| [6] |
TRIVEDI P, LEACH J E, TRINGE S G, TONGMIN S, SINGH B K. Plant-microbiome interactions: From community assembly to plant health[J]. Nature Reviews Microbiology, 2020, 18(11): 607-621. DOI:10.1038/s41579-020-0412-1 |
| [7] |
方文生, 王秋霞, 颜冬冬, 李园, 曹兵伟, 徐进, 靳茜, 曹坳程. 土壤熏蒸剂棉隆防治土传病害研究进展及未来发展趋势[J]. 植物保护学报, 2023, 50(1): 40-49. DOI:10.13802/j.cnki.zwbhxb.2023.2021089 FANG W S, WANG Q X, YAN D D, LI Y, CAO B W, XU J, JIN X, CAO A C. Research progresses and future development trends of soil fumigant dazomet in control of soil-borne diseases[J]. Journal of Plant Protection, 2023, 50(1): 40-49. DOI:10.13802/j.cnki.zwbhxb.2023.2021089 |
| [8] |
杨馥霞, 汤玲, 贺欢, 唐小刚, 王卫成. 不同熏蒸剂处理对土壤理化特性及草莓生长发育的影响[J]. 中国果树, 2023, 60(11): 50-55. DOI:10.16626/j.cnki.issn1000-8047.2023.11.009 YANG F X, TANG L, HE H, TANG X G, WANG W C. Effects of different fumigants on soil physical and chemical properties and strawberry growth and development[J]. China Fruits, 2023, 60(11): 50-55. DOI:10.16626/j.cnki.issn1000-8047.2023.11.009 |
| [9] |
王豪吉, 陈鹏崟, 王勇, 魏富刚, 杨绍周, 官会林, 徐武美. 土壤熏蒸对三七连作土壤微生物群落的影响[J]. 云南师范大学学报(自然科学版), 2024, 44(1): 51-58. DOI:10.7699/j.ynnu.ns-2024-01 WANG H J, CHEN P Y, WANG Y, WEI F G, YANG S Z, GUAN H L, XU W M. Effects of soil fumigation on microbial community under continuous cropping of Panax notoginseng[J]. Journal of Yunnan Normal University (Natural Sciences Edition), 2024, 44(1): 51-58. DOI:10.7699/j.ynnu.ns-2024-01 |
| [10] |
JAMES P, GILREATH BIELINSKI M, SANTOS, TIMOTHY N, MOTIS, JOSEPH W, NOLING, JOHN M, MIRUSSO. Methylbromide alternatives for nematode and cyperus control in bell pepper (Capsium annuum)[J]. Crop Protection, 2005, 24(10): 903-908. DOI:10.1016/j.cropro.2005.01.016 |
| [11] |
付丽娜, 汪娅婷, 王星, 姬广海, 魏兰芳. 三七连作根际微生物多样性研究[J]. 云南农业大学学报: 自然科学, 2018, 33(2): 198-207. DOI:10.12101/j.issn.1004-390X(n).201703036 FU L N, WANG Y T, WANG X, JI G H, WEI L F. The study on microbial diversity of rhizospherein continuous cropping system of Panax notoginseng[J]. Journal of YunnanAgricultural University (Natural Science), 2018, 33(2): 198-207. DOI:10.12101/j.issn.1004-390X(n).201703036 |
| [12] |
YAN D D, WANG Q X, MAO L G, LI W, XIE H W, GUO M X, CAO A H. Quantification of the effects of various soil fumigation treatments on nitrogen mineralization and nitrification in laboratory incubation and field studies[J]. Chemosphere, 2013, 90: 1210-1215. DOI:10.1016/j.chemosphere.2012.09.041 |
| [13] |
曹坳程, 方文生, 李园, 颜冬冬, 王秋霞, 郭美霞, 黄斌, 宋兆欣, 靳茜. 我国土壤熏蒸消毒60年回顾[J]. 植物保护学报, 2022, 49(1): 325-335. DOI:10.13802/j.cnki.zwbhxb.2022.2022822 CAO A C, FANG W S, LI Y, YAN D D, WANG Q X, GUO M X, HUANG B, SONG Z X, JIN X. Review on 60 years of soil fumigation and disinfestation in China[J]. Journal of Plant Protection, 2022, 49(1): 325-335. DOI:10.13802/j.cnki.zwbhxb.2022.2022822 |
| [14] |
佘小漫, 姚挺, 黄真珍, 何自福. 香葱伴生番茄对青枯病及根际微生态特征的影响[J]. 广东农业科学, 2024, 51(1): 10-20. DOI:10.16768/j.issn.1004-874X.2024.01.002 SHE X M, YAO T, HUANG Z Z, HE Z F. Effects of companion chives on bacterial wilt and the micro-ecological characteristics of tomato rhizosphere[J]. Guangdong Agricultural Sciences, 2024, 51(1): 10-20. DOI:10.16768/j.issn.1004-874X.2024.01.002 |
| [15] |
毛敏, 叶田会, 石松柏, 冯文龙, 白加林, 王雪峰, 刘钰彤, 王程栋, 况帅, 许娜. 微生物菌剂对成苗期及伸根期烟苗生长发育的影响[J]. 广东农业科学, 2023, 50(8): 11-20. DOI:10.16768/j.issn.1004-874X.2023.08.002 MAO M, YE T H, SHI S B, FENG W L, BAI J L, WANG X F, LIU Y T, WANG C D, KUANG S, XU N. Effects of microbial agents on growth and development of tobacco seedlings at seedling and root extending stages[J]. Guangdong Agricultural Sciences, 2023, 50(8): 11-20. DOI:10.16768/j.issn.1004-874X.2023.08.002 |
| [16] |
LIEN B, IRENE D B, SASKIA G, ROB M, LORE V L, LIEVE W, BART V C, ANNELEEN P, STEFAN V K, RENÉ D M, JEF R, HANS R, JOS M R, BART L. Potential for biocontrol of hairy root disease by a Paenibacillus clade[J]. Frontiers in Microbiology, 2017, 8: 447. DOI:10.3389/fmicb.2017.00447 |
| [17] |
姜琴芳, 伏云珍, 李倩, 马琨. 间作作物种间相互作用对土壤细菌群落的影响[J]. 西北农业学报, 2024, 33(5): 1-10. DOI:10.7606/j.issn.1004-1389.2024.03.016 JIANG Q F, FU Y Z, Ll Q, MA K. Effects of intercropping crop interactions on soil bacterial community structure and function[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2024, 33(5): 1-10. DOI:10.7606/j.issn.1004-1389.2024.03.016 |
| [18] |
邓阳, 余利岩, 张玉琴. 小单孢菌科放线菌的研究进展[J]. 生物资源, 2021, 43(6): 583-596. DOI:10.14188/j.ajsh.2021.06.007 DENG Y, YU L Y, ZHANG Y Q. Research progress on the family Micromonosporaceae[J]. Biotic Resource, 2021, 43(6): 583-596. DOI:10.14188/j.ajsh.2021.06.007 |
| [19] |
宫超, 黎振兴, 麦培婷, 孙保娟, 李植良, 李涛. 番茄青枯病抗性相关根际微生物的研究进展[J]. 广东农业科学, 2021, 48(9): 51-61. DOI:10.16768/j.issn.1004-874X.2021.09.006 GONG C, LI Z X, MAI P T, SUN B J, LI Z L, LI T. Research progress of rhizosphere microorganisms related to tomato bacterial wilt resistance[J]. Guangdong Agricultural Sciences, 2021, 48(9): 51-61. DOI:10.16768/j.issn.1004-874X.2021.09.006 |
| [20] |
YAMAMOTO T, HASEGAWA Y, LAU P C K, IWAKI H. Identification and characterization of a chc gene cluster responsible for the aromatization pathway of cyclohexanecarboxylate degradation in Sinomonas cyclohexanicum ATCC 51369[J]. Journal of Bioscience and Bioengineering, 2021, 132(6): 621-629. DOI:10.1016/J.JBIOSC.2021.08.013 |
| [21] |
VIAL L, GROLEAU M C, DEKIMPE V. Burkholderia diversity and versatility: An inventory of the extracellular products[J]. Journal of Microbiology and Biotechnology, 2007, 17(9): 1407-1429. |
| [22] |
许萌杏, 李凤芳, 袁高庆, 黎起秦, 吴小刚. 洋葱伯克霍尔德氏菌JX-1防治番茄青枯病机理的初步分析[J]. 中国生物防治学报, 2021, 37(2): 304-314. DOI:10.16409/j.cnki.2095-039x.2021.02.003 XU M X, LI F F, YUAN G Q, LI Q Q, WU X G. Identification and characterization of Burkholderia cepacia JX-1 against the tomato bacterial wilt[J]. Chinese Journal of Biological Control, 2021, 37(2): 304-314. DOI:10.16409/j.cnki.2095-039x.2021.02.003 |
| [23] |
叶丽丹, 劳佳萍, 卢建平, 林福呈. 球毛壳菌荧光标记与重寄生现象研究[J]. 浙江大学学报(农业与生命科学版), 2007, 33(2): 119-124. YE L D, LAO J P, LU J P, LIN F C. Study on GFP-labeling and mycoparasitism in Chaetomium globosum[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2007, 33(2): 119-124. |
| [24] |
赵子健, 王瑶, 张逸凡, 邓颖, 张丹, 王晓梅. 玉米茎腐病病原菌Fusarium graminearum拮抗菌株的筛选与鉴定[J]. 吉林农业大学学报, 2024, 46(1): 34-39. DOI:10.13327/j.jjlau.2020.5574 ZHAO Z J, WANG Y, ZHANG Y F, DENG Y, ZHANG D, WANG X M. Screening and identification of antagonistic fungi against Fusarium graminearum, a pathogen of corn stalk rot[J]. Journal of Jilin Agricultural University, 2024, 46(1): 34-39. DOI:10.13327/j.jjlau.2020.5574 |
| [25] |
于欣茹. 棉花根际真菌中拮抗菌的筛选鉴定[J]. 安徽农学通报, 2024, 30(4): 13-17. DOI:10.16377/j.cnki.issn1007-7731.2024.04.032 YU X R. Screening and identification of antagonistic bacteria in cotton rhizosphere fungi[J]. Anhui Agricultural Science Bulletin, 2024, 30(4): 13-17. DOI:10.16377/j.cnki.issn1007-7731.2024.04.032 |
| [26] |
安凡, 姜悦, 王宇, 曹广萍, 高程海, 刘永宏, 易湘茜, 白猛. 红树老鼠簕内生真菌Aspergillus terreus GXIMD 03158次级代谢产物研究[J/OL]. 热带海洋学报, 2023-12-18. AN F, JIANG Y, WANG Y, CAO G P, GAO C H, LIU Y H, YI X X, BAI M. Studies on secondary metabolites of endophytic fungus Aspergillus terreus GXIMD 03158 isolated from mangroves Acanthus ilicifolius[J/OL]. Journal of Tropical Oceanography, 2023-12-18. |
| [27] |
张露源. 疣孢漆斑菌(Myrothecium verrucaria)ZW-2对大豆孢囊线虫毒杀作用及其发酵液活性物质分析[D]. 南宁: 广西大学, 2020. YHANG L Y. Study on the toxicity of Myrothecium verrucaria strain zw-2 to soybean cyst nematode and isolation of active substances in Fermentation fi ltrat[D]. Nanning: Guangxi University, 2020. |
| [28] |
LANGSTON J M, BROWN K, XU F, BORCH K, GARNER A. Cloning, expression, and characterization of a cellobiose dehydrogenase from Thielavia terrestris induced under cellulose growth conditions[J]. Biochimica et Biophysica Acta, 2012, 1824: 802-812. DOI:10.1016/j.bbapap.2012.03.009 |
| [29] |
王洁玉, 半夏内生菌的分离鉴定及Humicola fuscoatra抗菌肽的筛选[D]. 武汉: 华中农业大学, 2022. WANG Y J. Isolation of pinellia endophyte and screening of Humicola fuscoatra antibacterial peptides[D]. Wuhan: Huazhong Agricultural University, 2022. |
| [30] |
LANGE L, PILGAARD B, HERBST F A, BUSK P K, GLEASON F, PEDERSEN A G. Origin of fungal biomass degrading enzymes: Evolution, diversity and function of enzymes of early lineage fungi[J]. Fungal Biology Reviews, 2019, 33(1): 82-97. DOI:10.1016/j.fbr.2018.09.001 |
| [31] |
童佳颖, 张鑫, 李娇, 张凤玲. Nigrospora属真菌化学成分及生物活性研究进展[J]. 天然产物研究与开发, 2022, 34(9): 1618-1631. DOI:10.16333/j.1001-6880.2022.9.019 TONG J Y, ZHANG X, LI J, ZHANG F L. Advances in chemical constituents and bioactivities of Nigrospora sp. fung[J]. Natural Product Research, 2022, 34(9): 1618-1631. DOI:10.16333/j.1001-6880.2022.9.019 |
| [32] |
LOMBARD L, VAN DER MERWE N A, GROENEWALD J Z, CROUS P W. Generic concepts in Nectriaceae[J]. Studies in Mycology, 2014, 80: 189-245. DOI:10.1016/j.simyco.2014.12.002 |
| [33] |
耿月华, 钱乐, 李跃, 李朋华, 高巍. 头束霉属及其近似属真菌的分类研究进展[J]. 菌物研究, 2014, 12(2): 119-122. DOI:10.13341/j.jfr.2014.1005 GENG Y H, QIAN L, LI Y, LI P H, GAO W. Advancement on the study of taxonomy of Cephalotrichum and its related genera[J]. Journal of Fungal Research, 2014, 12(2): 119-122. DOI:10.13341/j.jfr.2014.1005 |
| [34] |
CHEN F J. Mortierella species in China[J]. Mycosystema, 1992, 5: 23-64. |
| [35] |
MUNDAY J S, WOLFE A G, LAWRENCE K E, PANDEY S K. Disseminated Mortierella wolfi i infection in a neonatal calf[J]. New Zealand Veterinary Journal, 2010, 58(1): 62-63. DOI:10.1080/00480169.2010.65062 |
| [36] |
殷辉. 福建省水稻穗部病害真菌鉴定与分析[D]. 福州: 福建农林大学, 2018. YIN H. Identification and analysis fungal diseases of rice panicle disease in Fujian Province[D]. Fuzhou: Fujian Agriculture and Forestry University, 2018. |
| [37] |
THAMBUGALA K M, CAMPORESI E, ARIYAWANSA H A, PHOOKAMSAK R, LIU Z Y, HYDE K D. Phylogeny and morphology of Phaeosphaeriopsis triseptata sp. nov., and Phaeosphaeriopsis glaucopunctata[J]. Phytotaxa, 2014, 176: 238-250. DOI:10.11646/phytotaxa.176.1.23 |
| [38] |
DU Z, FAN X L, YANG Q, TIAN C M. Host and geographic range extensions of Melanconiella, with a new species M. cornuta in China[J]. Phytotaxa, 2017, 372: 252-260. DOI:10.11646/phytotaxa.327.3.4 |
| [39] |
ZHANG P, LI Y, JIA C, LANG J, NIAZ SI, LI J, YUAN J, YU J, CHEN S, LIU L. Antiviral and anti-inflammatory meroterpenoids: Stachybonoids A-F from the crinoid derived fungus Stachybotrys chartarum 952[J]. RSC Advances, 2017, 7: 49910-49916. DOI:10.1039/c7ra09859f |
| [40] |
李青杰, 张大琪, 任立瑞, 颜冬冬, 李园, 王秋霞, 曹坳程. 氯化苦和棉隆对草莓土壤养分、病原菌及微生物群落的影响[J]. 河北农业大学学报, 2021, 44(6): 24-29. DOI:10.13320/j.cnki.jauh.2021.0097 LI Q J, ZHANG D Q, REN L R, YAN D D, LI Y, WANG Q X, CAO A C. Effects of chloropicrin and dazomet on strawberry soil nutrients, pathogenic bacteria and microbial communities[J]. Journal of Hebei Agricultural University, 2021, 44(6): 24-29. DOI:10.13320/j.cnki.jauh.2021.0097 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51