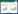文章信息
基金项目
- 国家自然科学基金(32073006,32002426,U20A2065)
作者简介
- 邵新飞(1997—),男,在读硕士生,研究方向为水生动植物疫病防控,E-mail:sxf983427252@163.com.
通讯作者
- 简纪常(1964—),男,博士,教授,研究方向为水生动物医学,E-mail:jianjc@gdou.edu.cn.
文章历史
- 收稿日期:2023-12-04
【研究意义】溶藻弧菌(Vibrio alginolyticus)属弧菌科(Vibrionaceae)弧菌属(Vibrio),是一种无荚膜、无芽孢、嗜盐性、兼性厌氧的革兰氏阴性短杆菌,可感染多种贝类、鱼类和虾类,其广泛分布于世界各地海洋及河口处,是常见的海洋条件致病菌[1-3]。在微生物研究领域,菌种是国家重要种质资源,不管是基础科研工作还是生物技术应用研究,均需对菌种进行科学、高效的保藏,以保证菌种质量和活力[4]。真空冷冻干燥是最有效的菌种保藏方法之一,其原理是将预冻菌液置于真空及低温环境下升华成干粉或结晶状态,可以抑制菌株生长、繁殖,使菌株处于不活泼的代谢状态,并保持菌株原本的生理生化特性,与其他保藏菌种方法相比,真空冷冻干燥在储藏和运输上具有显著优势,有利于菌种的研究应用[5-8]。【前人研究进展】冻干技术最早出现于1811年,由于水在真空条件容易气化,导致其温度降低,当时多用于生物体的脱水[9]。1911年,Harris等[10]初次将冻干技术运用于菌种、病毒和血清,以冷冻干燥的方式来保藏生物材料,取得较好的效果。随着冷冻干燥技术的发展,研究发现菌种在冻干过程中受到多方面的胁迫,存在微生物活性损伤及活性含量低等问题[11-12]。因此,冻干保护剂及工艺条件的适配,可减少极端条件对菌体的损伤。相关研究表明,合适的保护剂及冻干条件可抵抗预冻损伤及提高菌体活性[13]。保护剂的选择很大程度上取决于微生物的种类,而不同种类保护剂的保护机理也有所差别,目前常用的冻干细菌保护剂主要有海藻糖、谷氨酸钠、蔗糖、麦芽糖等[14]。Wessman等[15]研究表明,不同的冻干配方对恶臭假单胞菌(Pseudomonas putida)和氯酚节杆菌(Arthrobacter chlorophenolicus)活性存在不同程度的影响。周雷进雨等[16]研究表明,优化后的冻干复合配方可提升干酪乳杆菌的存活率至90%,冻干保护效果显著。Poymanov等[17]研究报道,优化后的冻干工艺可提升细菌的冻干效果,降低菌体的损伤。【本研究切入点】合理可行的菌种冷冻干燥制备工艺,对溶藻弧菌的长期储藏具有重要作用。本实验室利用冷冻法保藏溶藻弧菌,存在部分菌种长期储藏后活性丧失的问题[18]。利用冷冻干燥法保藏菌种具有长期性及稳定性,但冷冻干燥法对溶藻弧菌的保藏效果及冻干工艺优化还有待探究。【拟解决的关键问题】本研究选用溶藻弧菌HY9901[19],研究单一及复配保护剂对菌种活性的影响,优化冻干工艺,并探究冻干菌种的储藏稳定性及毒力、药敏性的影响,为菌种在冷冻干燥保藏上的应用提供理论依据。
1 材料与方法 1.1 供试材料试验于2023年6—9月在广东省水产动物病害防控与健康养殖重点实验室及广东海洋大学东海岛生物研究基地进行。
供试菌株溶藻弧菌HY9901采自湛江海域患病的红笛鲷鱼(Lutjanus sanguineus),由广东省水产动物病害防控与健康养殖重点实验室保存。
试验用鱼为健康的珍珠龙胆石斑鱼(体长8±0.5 cm),购自广东省湛江市东海岛某养殖场。选择体表无损伤、活力强的珍珠龙胆石斑鱼进行试验,并通过平板实验随机检测鱼体的脾肝肾是否含细菌,确定为健康状态后,运至广东海洋大学东海岛生物研究基地车间暂养,养殖水温为28 ℃,暂养7 d并确定为健康状态后,用于后续试验。
1.2 主要试剂及仪器脱脂乳、L-谷氨酸钠、葡萄糖购自北京索莱宝科技有限公司;海藻糖、甘露醇、甘氨酸购自上海碧云天生物技术有限公司;药敏试纸购自杭州滨和微生物试剂有限公司;-80 ℃超低温冰箱和台式高速离心机购自赛默飞世尔科技公司;台式压盖型真空冷冻干燥机(型号SCIENTZ-10N/D)购自宁波新芝生物科技股份有限公司;恒温生化培养箱购自上海博讯医疗生物仪器股份有限公司;恒温震荡培养箱购自苏州培英实验设备有限公司。
1.3 试验方法1.3.1 菌悬液的制备 将-80 ℃超低温冰箱中保存的溶藻弧菌HY9901平板画线于TSA固体平板,28 ℃生化培养箱中培养20 h;挑取单菌落于TSB液体培养基中,28 ℃、150 r/min恒温震荡培养16 h后,将菌液分装于50 mL无菌离心管,20 ℃、4 000 r/min离心5 min,弃上清液,用PBS缓冲液洗涤后离心2次,并以PBS缓冲溶液重悬,调整菌悬液浓度约为1×109 CFU/mL,用于后续试验。
1.3.2 冻干保护剂的制备 单因素试验时,分别选取海藻糖、葡萄糖、脱脂乳、甘氨酸、L-谷氨酸钠、甘露醇作为冷冻干燥保护剂,以灭菌的ddH2O为溶剂,设置保护剂质量浓度为0、50、100、150 g/L,将配好的保护剂溶液于106 ℃灭菌20 min(预实验发现该灭菌条件的效果较好且不破坏保护剂)。基于单因素试验结果,选取3种保护率较高的保护剂进行L9(33)正交试验(表 1),以灭菌的ddH2O为溶剂,将配置好的溶液于106 ℃灭菌20 min备用。
1.3.3 冻干工艺条件优化 取0.5 mL菌液与冻干保护剂混合液(1∶1)置于5 mL西林瓶中,盖上胶塞并振荡均匀,按照真空冷冻干燥机冻干样品的要求,迅速置于-80 ℃超低温冰箱预冻3 h。预冻后将样品放入真空冷冻干燥机中冷冻干燥16 h,设置冻干工艺参数为-55 ℃、8 Pa、0.08 mbar,3次重复。使用PBS缓冲溶液复水冻干菌株样品后,进行稀释涂布,于28 ℃培养24~48 h,采用平板计数法计数菌落数。存活率(%)=冻干后菌落数/冻干前菌落数×100
在最佳复配冷冻保护剂配方基础上,结合冻干工艺步骤,优化冻干工艺条件,除特定优化因素外,其他冻干条件均设置为菌液浓度1×109 CFU/mL、预冻时间3 h、预冻温度-80 ℃,复水介质为PBS缓冲溶液,具体优化因素如下:
菌液浓度:将菌液按梯度稀释制备成1×105~1×109 CFU/mL共5个浓度。不同浓度菌液与保护剂混匀后冻干,测定各梯度的菌株存活率。
预冻时间:将菌液与保护剂混匀后预冻,设置预冻时间为1、2、3、4、5、6 h。测定各预冻时间下的菌株存活率。
预冻温度:将菌液与保护剂混匀后预冻,设置预冻温度为-80 ℃、-40 ℃、-20 ℃。测定各预冻温度下的菌株存活率。
复水介质:选取PBS缓冲溶液、TSB液体培养基、ddH2O、质量浓度均为50 g/L的海藻糖、葡萄糖、脱脂乳、甘氨酸、L-谷氨酸钠、甘露醇为复水介质。测定不同复水介质复水冻干菌株后其存活率。
1.3.4 储藏试验 根据最佳复配冷冻保护剂及冻干工艺条件,制备溶藻弧菌冻干菌株样品,储藏温度为-20 ℃,储藏周期为60 d,每15 d测定菌株存活率(计算公式同1.3.3)。复水不同储藏时间的冻干菌株样品后,进行稀释涂布,于28 ℃培养24~48 h,采用平板计数法计数菌落数,3次重复。
1.3.5 半数致死量(LD50)测定 根据最佳复配冷冻保护剂及冻干工艺条件,将冻干前后的溶藻弧菌平板活化后,挑取单菌落制备菌悬液,调整菌悬液浓度至1.5×105~1.5×109 CFU/mL。将健康的珍珠龙胆石斑鱼暂养7 d后,随机分为12组,冻干前后菌株LD50的测定均设置5组试验组和1组对照组,于胸鳍基部的无鳞凹陷处进行注射,试验组注射不同浓度梯度(1.5×109、1.5×108、1.5×107、1.5×106、1.5×105 CFU/mL)的菌悬液,每尾注射100 μL;对照组注射等量的PBS缓冲液,注射结束后放入正常养殖环境中,观察和记录14 d死亡数。取死鱼的头肾部在TSA平板划线,鉴定珍珠龙胆石斑鱼是否由溶藻弧菌感染致死。用改良寇氏法[20]计算LD50。
1.3.6 药敏试验 根据最佳复配冷冻保护剂及冻干工艺条件,将冻干前后的溶藻弧菌平板活化后,挑取单菌落制备菌液,用PBS缓冲溶液调成0.5麦氏浊度菌悬液,在超净工作台中用移液枪吸取100 μL,用涂布棒在TSA平板上涂布均匀。将待测的药敏试纸以无菌镊子贴于琼脂表面,于28 ℃恒温生化培养箱倒置培养48 h。用游标卡尺测定药敏试纸的抑菌直径(mm),3次重复,最后根据药敏试纸的抗菌解释标准,判定菌种的药物敏感性。
1.3.7 数据统计与分析 试验数据采用SPSS 26.0软件的方差分析法分析,采用Excel软件作图。
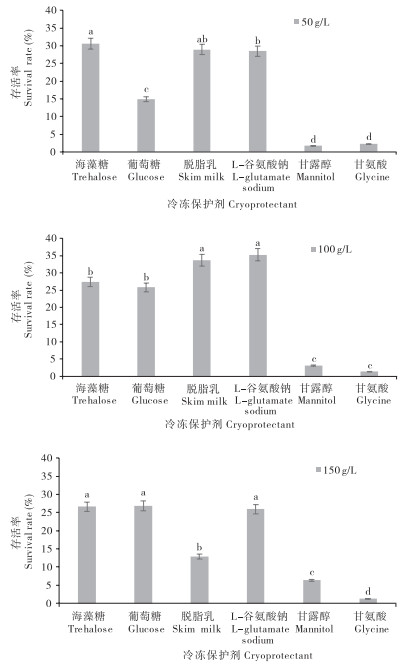
2 结果与分析 2.1 溶藻弧菌冷冻保护剂筛选2.1.1 单因素试验结果 在无保护剂的情况下,溶藻弧菌冻存后的存活率为0%,添加不同冷冻保护剂后,菌株存活率(即保护效果)提高。由 图 1可知,质量浓度为50 g/L时,海藻糖、脱脂乳和L-谷氨酸钠对溶藻弧菌的保护效果无显著差异,且均显著高于葡萄糖、甘氨酸和甘露醇;质量浓度为100 g/L时,海藻糖、脱脂乳的保护效果无显著差异,且均显著高于海藻糖、葡萄糖、甘露醇及甘氨酸质量浓度为150 g/L时,海藻糖、葡萄糖和L-谷氨酸钠的保护效果显著高于脱脂乳、甘氨酸、甘露醇,且前3者的保护效果无显著差异;3种不同质量浓度下,甘露醇、甘氨酸的保护效果均较差;
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 1 溶藻弧菌在不同质量浓度冷冻保护剂下的存活率 Fig. 1 Survival rates of Vibrio alginolyticus at different concentrations of cryoprotectants |
从整体上看,6种保护剂中L-谷氨酸钠保护效果最佳,其次为海藻糖、脱脂乳和葡萄糖,甘露醇和甘氨酸的保护效果较差。
2.1.2 正交试验结果 由图 2可知,不同组合保护剂的保护效果存在显著差异。组合5(海藻糖50 g/L + L-谷氨酸钠50 g/L +脱脂乳50 g/L)的保护效果最佳、存活率为62.12%;组合7的保护效果次之、存活率为58.18%;其他组的保护率均介于30%~50%;从整体上看,复配保护剂的保护效果优于单一保护剂,两者差异显著。
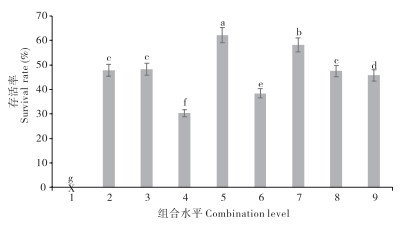
|
| 小写英文字母不同者表示差异显著;X表示存活率为0% Different lowercase letters represent significant differences; X indicates a survival rate of 0% 图 2 溶藻弧菌在不同组合冷冻保护剂下的存活率 Fig. 2 Survival rates of Vibrio alginolyticus under different combinations of cryoprotectants |
多因素方差分析结果(表 2)表明,海藻糖、L-谷氨酸钠和脱脂乳对溶藻弧菌存活率的差异关系,其拟合优度为0.916,表示海藻糖、L-谷氨酸钠和脱脂乳均对菌株存活率存在影响,且差异显著。由F值可知,其显著性差异顺序为脱脂乳>L-谷氨酸钠>海藻糖。因此,选取海藻糖50 g/L + L-谷氨酸钠50 g/L +脱脂乳50 g/L为溶藻弧菌HY9901的最佳保护剂复配配方,通过重复验证,其存活率均为62.00(±2.00)%,处于稳定状态。
2.2 溶藻弧菌冷冻保护剂冻干工艺优化
2.2.1 菌液浓度的影响 由图 3可知,菌液的浓度水平为1×109、1×108 CFU/mL时,溶藻弧菌的存活率最佳,分别为63.41%、62.20%,两者无显著差异;当菌液浓度为1×107、1×106、1×105 CFU/mL时,存活率随浓度的降低而显著降低。
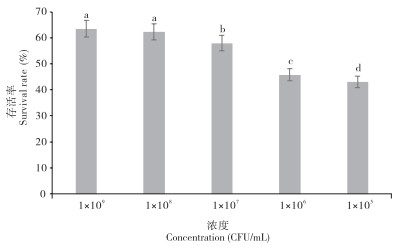
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 3 溶藻弧菌在不同浓度水平的存活率 Fig. 3 Survival rates of Vibrio alginolyticus at different concentration levels |
2.2.2 预冻时间的影响 由图 4可知,不同预冻时间对溶藻弧菌的存活率的影响存在显著差异。预冻时间从1 h到3 h时,存活率呈现显著升高趋势,当预冻时间为3 h时溶藻弧菌的存活率最高、为63.72%;预冻时间从3 h到6 h时,存活率显著降低,其中预冻6 h时存活率最低、为37.50%。
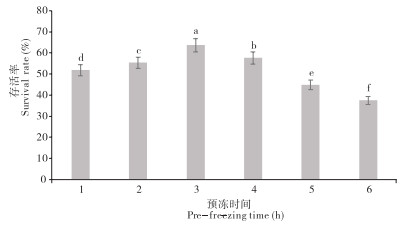
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 4 溶藻弧菌在不同预冻时间的存活率 Fig. 4 Survival rates of Vibrio alginolyticus at different pre-freezing times |
2.2.3 预冻温度的影响 由图 5可知,不同预冻温度对溶藻弧菌存活率的影响存在显著差异。预冻温度-80 ℃时溶藻弧菌的存活率最佳、为63.11%;-40 ℃时存活率显著降低;-20 ℃时存活率最差、为44.05%。3个冻存温度下的存活率存在显著差异。
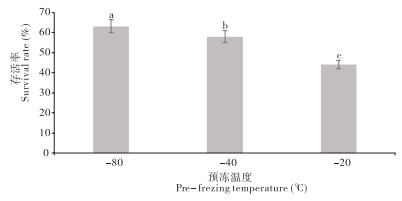
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 5 溶藻弧菌在不同预冻温度的存活率 Fig. 5 Survival rates of Vibrio alginolyticus at different pre-freezing temperatures |
2.2.4 复水介质的影响 由图 6可知,不同复水介质对冻干菌株存活率(即复水效果)存在显著差异。PBS缓冲液和脱脂乳复水效果最佳,存活率均大于60%,且两者无显著差异;L-谷氨酸钠、海藻糖和甘露醇的复水效果次之,存活率为50%~60%;甘氨酸、葡萄糖、ddH2O和TSB的复水效果最差,存活率均小于50%,且无显著差异。
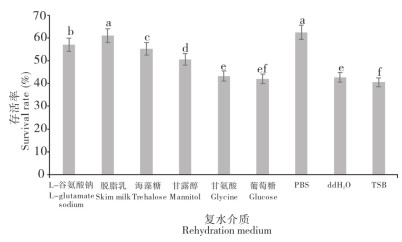
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 6 溶藻弧菌在不同复水介质的存活率 Fig. 6 Survival rate of Vibrio alginolyticus on different rehydration media |
2.3 溶藻弧菌冻干后储藏时间的影响
由图 7可知,储藏时间为1、15、30、45、60 d时,对冻干菌种的影响无显著差异。冻干后的溶藻弧菌在60 d储藏周期的存活率存在小幅度降低,但整体存活率均大于60%,处理间无显著差异,菌株活性处于稳定状态。
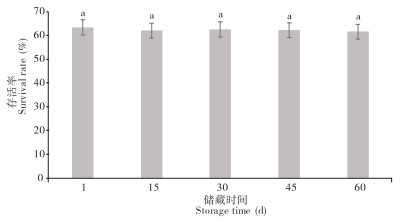
|
| 小写英文字母不同者表示差异显著 Different lowercase letters represent significant differences 图 7 溶藻弧菌在不同贮藏时间的存活率 Fig. 7 Survival rates of Vibrio alginolyticus at different storage times |
2.4 溶藻弧菌冻干前后对LD50的影响
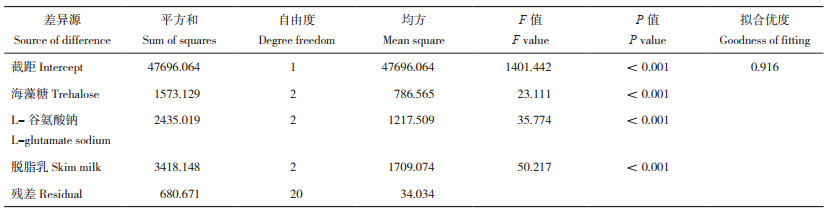
由表 3可知,溶藻弧菌在冻干前后的LD50分别为1.22×108、1.20×108 CFU/mL,最佳冻干配方和冻干条件下,冻干后的溶藻弧菌毒力无显著变化,毒力保持稳定。使用已患病珍珠龙胆石斑鱼的头肾部平板划线,均鉴定到溶藻弧菌。注射溶藻弧菌14 d后,对照组珍珠龙胆石斑鱼无死亡、无患病情况,均处于正常状态;试验组出现游动缓慢、胸腹鳍充血、肛门发红等症状。
2.5 溶藻弧菌冻干前后药物敏感性的影响
由表 4可知,冻干前后菌株的药物敏感性均保持一致,无显著差异,均对氟苯尼考、氯霉素、庆大霉素、环丙沙星、诺氟沙星、呋喃唑酮、多西环素、四环素、头孢哌酮、头孢曲松、多粘菌素B表现敏感;均对新霉素、卡那霉素表现中度敏感;均对丁胺卡那、头孢氨苄、哌拉西林、青霉素、氨苄西林、红霉素、麦迪霉素、万古霉素表现耐药。结果表明,此菌株经冷冻干燥后,药物敏感性无显著差异,为稳定状态。
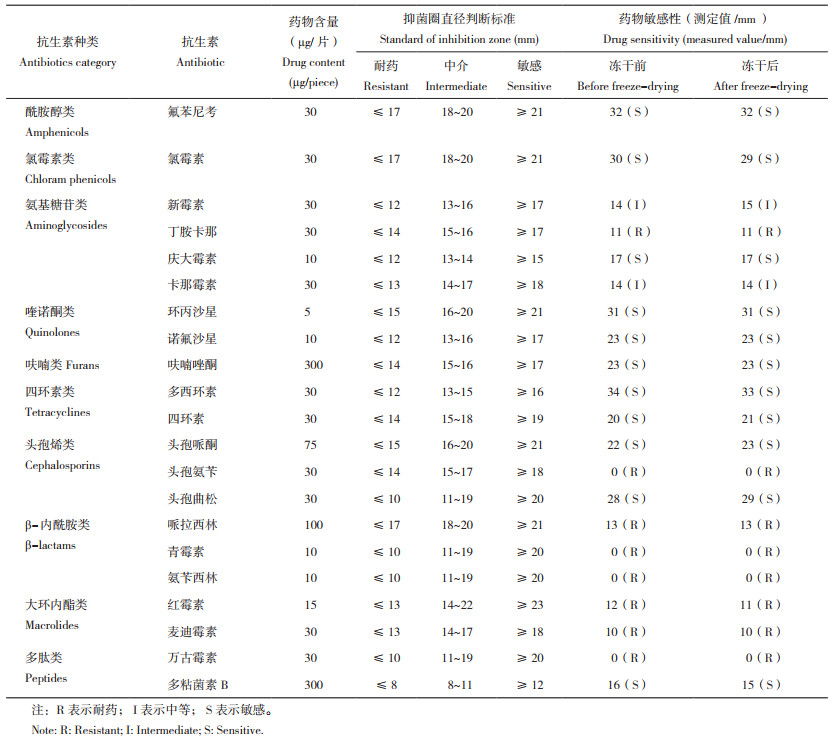
|
3 讨论
真空冷冻干燥细菌的基本原理是将含有水分子的细菌悬液快速冻结成固态,在真空条件下使冻结的水分子直接升华成水蒸汽而溢出,除去冰晶的细菌则与冻干物料结合,进入休眠状态。其对菌株有多方面的胁迫,包括菌体在冻结时细胞质损伤、机械损伤、细胞膜损伤等,影响菌体存活率及冻干后活性[21-23]。因此,需要加入保护剂来调节细菌在冷冻干燥中物理及化学变化,替代水分子与细菌结合,使细菌的损伤程度降低,来稳定细菌的各种生理、生化特性和生物活性[24-26]。真空冷冻干燥常用的保护剂根据化学性质分为糖类、醇类、氨基酸类、蛋白质类等[27]。研究表明,不同保护剂对菌株的保护效果存在差异,这可能与保护剂的保护机制存在关联。糖类物质含有多个羟基,当水分子缺少时,其与菌体表面自由基及蛋白质结合形成氢键,从而维持菌株在冷冻干燥过程中细胞膜和蛋白质结构与功能的完整性[28]。海藻糖是极其稳定的非还原性双糖,含有大量的自由羟基,能在细胞处于极端环境时形成菌体保护膜[29],本研究结果表明,质量浓度为50、100、150 g/L的海藻糖对菌株的保护效果无显著差异,菌体均处于稳定状态。目前,海藻糖的相关研究,常以玻璃态假说和水替代假说进行解释,但具体的保护机制还有待研究[30-31]。氨基酸类物质含有碱性氨基和酸性羧基,可抑制溶液的pH值变化,从而维持菌体活性,郝一楠等[32]研究显示,10% 的谷氨酸钠对菌体的保护率可达到50.06%,本研究中,L-谷氨酸钠也为最佳单一保护剂,与其他5种保护剂存在显著差异,具有良好的保护效果。蛋白质类保护剂一般成本较高,成本较低的脱脂乳是一种含有蛋白质的混合物,可对菌体膜蛋白及细胞内起代谢调节作用的酶类形成保护,同时菌体表面形成一层蛋白膜,从而防止菌种冻干损伤。张凤华等[33]研究表明,11% 的脱脂乳对嗜酸乳杆菌的保护率在35% 以上,显示良好保护效果,这与本研究结果相似,但150 g/L的脱脂乳保护效果大幅降低。
单一保护剂往往难以满足实验需求,因此,探索复合保护剂十分必要。脱脂乳常用作复合保护剂的成分之一,郝一楠等[32]研究显示,含脱脂乳的复合保护剂对肺炎链球菌的保护效果可达到78%以上。同样,本研究含有50 g/L脱脂乳的最佳复配配方下溶藻弧菌存活率提升至62%及以上,与单一保护剂的保护效果存在显著差异,可更好地应用于溶藻弧菌的保藏。但除了保护剂对菌种冷冻干燥的影响,冻干过程的条件变化也影响菌体活性。张菊等[34]研究报道,采用最佳冻干保护剂和优化的冻干工艺,植物乳杆菌的存活率达到80%以上。本研究中,复合配方可提高菌体保护效果,当冻干工艺条件改变时,保护效果或多或少产生变化,最佳配方及冻干工艺条件下可对菌种形成显著保护作用。细菌冷冻干燥保藏所需最适保护剂及冻干条件不同,对菌株活性影响也不同,因此,合理选用保护剂及优化冻干条件可降低菌种生物活性的损伤[35-36]。
细菌冷冻干燥保藏时,其生物学特性的稳定对细菌保藏有着重要意义。郝一楠等[32]研究表明,肺炎链球菌生长特性的观察,验证了菌株在冻干前后的生长特性均保持一致;叶姜瑜等[37]研究显示,冻干后的费氏弧菌缩短了复苏时间,同时对金属的毒性检测无影响,有利于费氏弧菌的应用;Scheyla等[38]研究报道,采用冷冻干燥技术对AmB胶束体系理化及生物学性质并未产生影响。本研究发现,冷冻干燥对溶藻弧菌的毒力和药物敏感性未产生显著影响,同时储藏周期内菌种活性保持稳定状态。由此可知,菌株在冷冻干燥后一些生物学特性的稳定,可满足于相关实验需求,但细菌冷冻干燥保藏是一个长期的过程,需要长时间对存活率、生长特性等方面进行综合的观察与探究。
4 结论本研究筛选得到溶藻弧菌最佳冷冻干燥复配配方为海藻糖50 g/L + L-谷氨酸钠50 g/L +脱脂乳50 g/L,对菌种冻存具有良好的保护效果、存活率达62.12%,复配配方与6种单一保护剂的保护效果存在显著差异;优化的冻干条件为菌液浓度为1×108~109 CFU/mL、预冻时间3 h、预冻温度-80 ℃、复水介质PBS或50 g/L脱脂乳溶液。当冻干工艺条件改变时,菌种活性均受到影响。同时,本工艺条件下的冻干菌种在储藏、毒力、药敏性、稳定性等方面与冻干前均无显著差异,表明该复配配方和冻干条件可应用于溶藻弧菌保藏,为菌种冷冻干燥技术的应用提供参考。
| [1] |
FU J Y, LI Y, ZHAO L H, WU C G, HE Z G. Characterization and genomic analysis of a bacteriophage with potential in Vibrio alginolyticus[J]. Viruses, 2022, 15(1): 135-135. DOI:10.3390/V15010135 |
| [2] |
郑玉东, 张翔, 姚梦丽, 谷莉, 黄博闻, 辛鲁生, 白昌明, 王崇明, 唐小千. 养殖环境及贝源溶藻弧菌MLST分型及其毒力基因、耐药性分析[J]. 渔业科学进展, 2024, 45(1): 211-223. DOI:10.19663/j.issn2095-9869.20221025001 ZHENG Y D, ZHANG X, YAO M L, GU L, HUANG B W, XIN L S, BAI C M, WANG C M, TANG X Q. Study on multi-locus sequence typing, virulence genes, and drug resistance of Vibrio alginolyticus from shellfish and culture environment[J]. Progress in Fishery Sciences, 2024, 45(1): 211-223. DOI:10.19663/j.issn2095-9869.20221025001 |
| [3] |
叶明彬, 陈华灵, 冯国清, 梁志凌, 端金霞, 刘振兴, 观玉安. 绿海龟源溶藻弧菌的分离鉴定及药敏分析[J]. 广东农业科学, 2020, 47(6): 97-105. DOI:10.16768/j.issn.1004-874X.2020.06.014 YE M B, CHEN H L, FENG G Q, LIANG Z L, DUAN J X, LIU Z X, GUAN Y A. Isolation and identification and drug susceptibility of Vibrio alginolyticus from green sea turtle[J]. Guangdong Agricultural Sciences, 2020, 47(6): 97-105. DOI:10.16768/j.issn.1004-874X.2020.06.014 |
| [4] |
郭玲玲. 微生物菌种保藏方法及关键技术[J]. 微生物学杂志, 2019, 39(3): 105-108. DOI:10.3969/j.issn.1005-7021.2019.03.014 GUO L L. Preservation method and preservation key technology of microbial strain seed[J]. Journal of Microbiology, 2019, 39(3): 105-108. DOI:10.3969/j.issn.1005-7021.2019.03.014 |
| [5] |
LUCILA M E, ELIZABETH E T, ÁNGELES L D M S, PAULA C. Freeze-drying of enterococcus durans: Effect on their probiotics and biopreservative properties[J]. Food Science and Technology, 2020, 137: 110496. DOI:10.1016/j.lwt.2020.110496 |
| [6] |
CHEN H, CHEN S W, LI C N, SHU G W. Response surface optimization of lyoprotectant for Lactobacillus bulgaricus during vacuum freeze-drying[J]. Preparative Biochemistry and Biotechnology, 2015, 45(5): 463-475. DOI:10.1080/10826068.2014.923451 |
| [7] |
JINDRICH P, JOKE B, PAUL V D, EIKE L, DOMINIQUE C, SYLVIANE H, EVELYNE B, CHANTAL B, JAVIER P, MARIA A R, CARMEN M M, DAVID R A. Improving survival and storage stability of bacteria recalcitrant to freeze-drying: A coordinated study by European culture collections[J]. Applied Microbiology and Biotechnology, 2015, 99(8): 3559-3571. DOI:10.1007/s00253-015-6476-6 |
| [8] |
VELLY H, BOUIX M, PASSOT S, PENICAUD C, BEINSTEINER H, GHORBAL S, LIEBEN P, FONSECA F. Cyclopropanation of unsaturated fatty acids and membrane rigidification improve the freeze-drying resistance of Lactococcus lactis subsp. lactis TOMSC161[J]. Applied Microbiology and Biotechnology, 2015, 99(2): 907-918. DOI:10.1007/s00253-014-6152-2 |
| [9] |
徐成海, 张世伟, 彭润玲, 张志军. 真空冷冻干燥的现状与展望(一)[J]. 真空, 2008(2): 1-11. DOI:10.13385/j.cnki.vacuum.2008.02.016 XU C H, ZHANG S W, PENG R L, ZHANG Z J. Today and tomorrow of vacuum freeze-drying technology[J]. Vacuum, 2008(2): 1-11. DOI:10.13385/j.cnki.vacuum.2008.02.016 |
| [10] |
HARRIS D L, SHACKELL L F. The effect of vacuum dessication upon the virus of rabies with remarks upon a new method[J]. American Public Health Association, 1911, 1(1): 52-53. DOI:10.2105/AJPH.1.1.52 |
| [11] |
于平, 胡淳玉, 黄星星, 刘航, 杨柳贞, 贺敏, 马健. 产肌醇的植物乳杆菌ZJ2868菌粉制备工艺[J]. 中国食品学报, 2021, 21(9): 142-149. DOI:10.16429/j.1009-7848.2021.09.015 YU P, HU C Y, HUANG X X, LIU H, YANG L Z, HE M, MA J. Preparation process of inositol-producing Lactobacillus plantarum ZJ2868 powder[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(9): 142-149. DOI:10.16429/j.1009-7848.2021.09.015 |
| [12] |
杜晗笑, 冉军舰, 孙俊良, 邓艳文, 李瑞雪, 庞帅. 鼠李糖乳杆菌zrx01冻干菌粉的制备及工艺优化[J]. 河南科技学院学报(自然科学版), 2023, 51(6): 14-25. DOI:10.3969/j.issn.2096-9473.2023.06.003 DU H X, RAN J J, SUN J L, DENG Y W, LI R X, PANG S. Preparation and process optimization of freeze-dried powder of Lactobacillus rhamnosus zrx01[J]. Journal of Henan Institute of Science and Technology (Natural Science Edition), 2023, 51(6): 14-25. DOI:10.3969/j.issn.2096-9473.2023.06.003 |
| [13] |
CHEN H, TIAN M Q, CHEN L, CUI X X, MENG J P, SHU G W. Optimization of composite cryoprotectant for freeze-drying Bifi dobacterium bifi dum BB01 by response surface methodology[J]. Artifi cial Cells, Nanomedicine and Biotechnology, 2019, 47(1): 1559-1569. DOI:10.1080/21691401.2019.1603157 |
| [14] |
牛晓影, 邓丽莉, 曾凯芳. 保护剂在微生物真空冷冻干燥中的应用[J]. 食品工业科技, 2015, 36(1): 390-394, 399. DOI:10.13386/j.issn1002-0306.2015.01.074 NIU X Y, DENG L L, ZENG K F. Application of protectants in freeze-dried microorganism[J]. Science and Technology of Food Industry, 2015, 36(1): 390-394, 399. DOI:10.13386/j.issn1002-0306.2015.01.074 |
| [15] |
WESSMAN P, SEBASTIAN H, KLAUS L, STEFANO R. Formulations for freeze-drying of bacteria and their influence on cell survival[J]. Journal of Visualized Experiment, 2013(78): 4058-4058. DOI:10.3791/4058-v |
| [16] |
周雷进雨, 马精阳, 袁月明, 李锦生, 冯伟志, 周丽娜. 干酪乳杆菌复合冻干保护剂工艺优化[J]. 饲料工业, 2023, 44(22): 86-93. DOI:10.13302/j.cnki.fi.2023.22.014 ZHOU L J Y, MA J Y, YUAN Y M, LI J S, FENG W Z, ZHOU L N. Optimization of complex lyophilized protective agent for Lactobacillus casei[J]. Feed Industry, 2023, 44(22): 86-93. DOI:10.13302/j.cnki.fi.2023.22.014 |
| [17] |
POYMANOV V V, NAZAROV S A, TOROPTSEV V V, USTINOV N Y, KOZYRENKO E V, KRYLOV K V. Study of freeze-drying process of bacterial concentrates in the apparatus using thermoelectric modules[J]. Iop Conference Series: Earth and Environmental Science, 2021, 640(7): 2027. DOI:10.1088/1755-1315/640/7/072027 |
| [18] |
孙葳. 浅谈微生物菌种保藏方法[J]. 轻工标准与质量, 2021(1): 95-96. DOI:10.19541/j.cnki.issn1004-4108.2021.01.018 SUN W. Talking about the preservation methods of microbial strains[J]. Standard & Quality of Light Industry, 2021(1): 95-96. DOI:10.19541/j.cnki.issn1004-4108.2021.01.018 |
| [19] |
CAI S H, WU Z H, JIAN J C, LU Y S. Cloning and expression of gene encoding the thermostable direct hemolysin from Vibrio alginolyticus strain HY9901, the causative agent of vibriosis of crimson snapper (Lutjanus erythopterus)[J]. Journal of Applied Microbiology, 2007, 103(2): 289-296. DOI:10.1111/j.1365-2672.2006.03250.x |
| [20] |
黄瑞, 徐丰恺. 鱼藤酮对花鲈、矛尾虾虎鱼的急性毒性研究[J]. 海洋湖沼通报, 2017(1): 96-101. DOI:10.13984/j.cnki.cn37-1141.2017.01.013 HUANG R, XU F K. Study on the acute toxicity of rotenone to Lateolabrax japonicas and Chaeturichthys stigmatias richardson[J]. Transactions of Oceanology and Limnology, 2017(1): 96-101. DOI:10.13984/j.cnki.cn37-1141.2017.01.013 |
| [21] |
黄刚, 金刚. 真空冷冻干燥乳酸菌的研究进展[J]. 食品安全导刊, 2022(16): 148-150. DOI:10.16043/j.cnki.cfs.2022.16.035 HUANG G, JIN G. Research progress of vacuum freeze-drying lactic acid bacteria[J]. China Food Safety Magazine, 2022(16): 148-150. DOI:10.16043/j.cnki.cfs.2022.16.035 |
| [22] |
MELANIE J B, RINOSH M, KENNETH D C. Lyophilization of Bdellovibrio bacteriovorus 109J for long-term storage[J]. Current Protocols in Microbiology, 2017, 45(1): 1-5. DOI:10.1002/cpmc.29 |
| [23] |
DI A NAWAT I D, V I JAY M, NAGEN DR A P S. Sur viva l of microencapsulated probiotic bacteria after processing and during storage: A review[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(10): 1685-1716. DOI:10.1080/10408398.2013.798779 |
| [24] |
REN H, ZENTEK J, VAHJEN W. Optimization of production parameters for probiotic Lactobacillus strains as feed additive[J]. Molecules, 2019, 24(18): 3286. DOI:10.3390/molecules24183286 |
| [25] |
CHEN H, CHEN S W, LI C N, SHU G W. Response surface optimization of lyoprotectant for Lactobacillus bulgaricus during vacuum freeze-drying[J]. Preparative Biochemistry & Biotechnology, 2015, 45(5): 463-475. DOI:10.1080/10826068.2014.923451 |
| [26] |
TIOMNO O T, FERNANDA C, THALES A P G, ENRIQUE J C R, SIDORENKO T C O D, PIERRE B, VERANES Y P, CARLOS A G. Preparation of scaffolds of amorphous calcium phosphate and bacterial cellulose for use in tissue regeneration by freeze-drying process[J]. Biointerface Research in Applied Chemistry, 2021, 11(1): 7357-7367. DOI:10.33263/BRIAC111.73577367 |
| [27] |
NGUYEN T H, KIM J S, KWON H J, KANG C H. The effect of a glutathione (GSH)-containing cryo-protectant on the viability of probiotic cells using a freeze-drying process[J]. Fermentation, 2023, 9(2): 187. DOI:10.3390/FERMENTATION9020187 |
| [28] |
毕雨星, 张香美, 卢涵, 赵晶晶, 魏兴芳, 卢音音. 肉类发酵菌种真空冷冻干燥保护剂研究进展[J]. 肉类工业, 2021(6): 47-50. BI Y X, ZHANG X M, LU H, ZHAO J J, WEI X F, LU Y Y. Research progress on vacuum freeze-drying protective agentsfor meat fermentation strains[J]. Meat Industry, 2021(6): 47-50. |
| [29] |
BROECKX G, VANDENHEUVEL D, J.J. CLAES I, LEBEER S, KIEKENS F. Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics[J]. International Journal of Pharmaceutics, 2016, 505(1/2): 303-318. DOI:10.1016/j.ijpharm.2016.04.002 |
| [30] |
张敬如, 黄复生, 王昆. 蛋白质药品的真空冷冻干燥技术及研究进展[J]. 中国药业, 2006(13): 25-27. ZHANG J R, HUANG F S, WANG K. Lyophilization and development of protein pharmaceuticals[J]. China Pharmaceuticals, 2006(13): 25-27. |
| [31] |
刘玉章, 姜岩, 黄迪. 冻干细菌保护剂研究进展[J]. 应用化工, 2023, 52(6): 1865-1869, 1883. DOI:10.16581/j.cnki.issn1671-3206.20230413.010 LIU Y Z, JIANG Y, HUANG D. Research progress of bacterial lyoprotectants[J]. Applied Chemical Industry, 2023, 52(6): 1865-1869, 1883. DOI:10.16581/j.cnki.issn1671-3206.20230413.010 |
| [32] |
郝一楠, 张静静, 郭冰峰, 王明华, 王亚萍, 王斌. 肺炎链球菌4型菌株冷冻真空干燥工艺保护剂配方的筛选[J]. 中国当代医药, 2021, 28(14): 22-26, 277. HAO Y N, ZHANG J J, GUO B F, WANG M H, WANG Y P, WANG B. Screening of protective agent formula for freezing and vacuum drying process of Streptococcus pneumoniae type 4 strain[J]. China Modern Medicine, 2021, 28(14): 22-26, 277. |
| [33] |
张风华, 黄俊逸, 李新福, 李聪, 徐宝才. 嗜酸乳杆菌冻干保护剂及其直投式复合发酵剂的开发[J]. 现代食品科技, 2019, 35(9): 248-257. DOI:10.13982/j.mfst.1673-9078.2019.9.032 ZHANG F H, HUANG J Y, LI X F, LI C, XU B C. The development of lyoprotectant for Lactobacillus acidophilus and derived direct-vat-set composite culture[J]. Modern Food Science and Technology, 2019, 35(9): 248-257. DOI:10.13982/j.mfst.1673-9078.2019.9.032 |
| [34] |
张菊, 苏成文, 亓鹏, 陈焱, 孙得发. 植物乳杆菌冻干保护剂的筛选及冻干工艺的研究[J]. 中国饲料, 2020(17): 53-57. DOI:10.15906/j.cnki.cn11-2975/s.20201711 ZHANG J, SU C W, QI P, CHEN Y, SUN D F. The research of protectants and freeze-drying process for Lactobacillus plantarum[J]. China Feed, 2020(17): 53-57. DOI:10.15906/j.cnki.cn11-2975/s.20201711 |
| [35] |
STEFANELLO F R, NABESHIMA H E, LAMANAKA T B, LUDWIG A, FRIES M L L, BERNARDI O A, COPETTI V M. Survival and stability of Lactobacillus fermentum and Wickerhamomyces anomalus strains upon lyophilisation with different cryoprotectant agents[J]. Food Research International, 2019(115): 90-94. DOI:10.1016/j.foodres.2018.07.044 |
| [36] |
PER W, SEBASTIAN H, KLAUS L. Formulations for freeze-drying of bacteria and their influence on cell survival[J]. Journal of Visualized Experiments, 2013(78): 11-17. DOI:10.3791/4058 |
| [37] |
叶姜瑜, 王琳, 李书钺, 翟俊, 何强. 保护剂对费氏弧菌冻干粉复苏及毒性检测的影响[J]. 安全与环境学报, 2011, 11(3): 5-8. DOI:10.3969/j.issn.1009-6094.2011.03.002 YE J Y, WANG L, LI S Y, ZHAI J, HE Q. Influence of cryoprotectants on resuscitation and toxicity test of Vibrio fischeri freeze-dried powder[J]. Journal of Safety and Environment, 2011, 11(3): 5-8. DOI:10.3969/j.issn.1009-6094.2011.03.002 |
| [38] |
SCHEYLA D V S S, MIGUEL A F S, CHRISTIAN A S, LVONETE B A, ACARILIA E S, MATHEUS F P F, ANSELMO G O, SOCRATES T E E. Influence of the freeze-drying process on the physicochemical and biological properties of pre-heated amphotericin B micellar systems[J]. Aaps Pharmscitech, 2014, 15(3): 612-619. DOI:10.1208/s12249-014-0085-z |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51