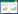文章信息
基金项目
- 国家自然科学基金(32073006);国家科技部“一带一路”创新人才交流外国专家项目(DL2023030009)
作者简介
- 陈杨慧(1998—),女,在读硕士生,研究方向为水生动物疫病防控,E-mail:chenyanghui1022@163.com; 王蓓,博士,教授,博士生导师,广东海洋大学研究生院副院长,英国阿伯丁大学(University of Aberdeen)访问学者,主要从事水生动物细菌病病原致病机理、硬骨鱼类免疫学研究及渔用生物制品开发及应用推广。主持国家自然科学基金、国家科技部外国专家项目、广东省科技计划、广东省国际合作领域项目等,参与国家“十三五”科技支撑计划项目、国家自然科学基金联合基金等,以第一或通信作者在《 Molecular Biology and Evolution》《 Reviews in Aquaculture》《 Fish & Shellfi sh Immunology》《 Journal of Bacteriology》等期刊发表SCI论文50余篇;获广东省科学技术二等奖2项;获授权国家发明专利7件。为2020年广东省百名博士博士后创新人物、广东水产学会专业委员会青年工作委员会委员、广东省水产动物病害防控与健康养殖重点实验室秘书、全国科协第十次代表大会广东省代表团代表;《广东农业科学》青年编委并担任本期“鱼类病害防控”专栏客座主编.
通讯作者
- 王蓓(1982—),女,博士,教授,研究方向为水生动物医学,E-mail:wong19820204@126.com.
文章历史
- 收稿日期:2024-02-06
【研究意义】尼罗罗非鱼(Oreochromis niloticus)属于广盐性热带鱼类,环境适应能力极强,是我国淡水养殖的优势品种,养殖产量、产值和出口量均位列前茅。但近年无乳链球菌病的暴发对罗非鱼养殖业造成重大的经济损失[1-2]。无乳链球菌(Streptococcus agalactiae),又称为B组链球菌,可引起包括罗非鱼在内的多种鱼类败血症和脑膜炎[3],一旦发病,死亡率极高,严重威胁全球罗非鱼养殖业的健康发展[4]。本研究克隆尼罗罗非鱼紧密连接蛋白5(claudin-5)基因并分析其在无乳链球菌刺激后的表达情况,探究其在尼罗罗非鱼抗感染过程中的作用。【前人研究进展】屏障结构的存在是生物维持正常运转、抵抗外来有害物质的重要因素。紧密连接蛋白是构成生物屏障的主要成分,其特殊和复杂的跨膜结构可将细胞紧密连接起来,形成特殊的屏障结构,以此阻止外来有害物质的入侵,维护内部环境的稳定[5-6]。健康的生物体往往拥有多种屏障结构,如脊椎动物的皮肤屏障,血脑屏障等[7-8]。而屏障是否完整有效往往取决于其屏障上的紧密连接蛋白[9-10]。claudins膜蛋白家族是脊椎动物上皮或内皮细胞紧密连接结构的跨膜蛋白,在很大程度上决定屏障的通透性[11]。目前,已发现超过63种硬骨鱼claudins,其在硬骨鱼抵抗病原体入侵过程中发挥至关重要的作用[11-12]。此外,在哺乳动物中,claudins家族由27种四跨膜结构蛋白组成,不同的claudin亚型有其独特的功能,其中claudin-1主要表达于肝脏、肾脏、皮肤等组织[13],而在呼吸道中则主要由claudin-4、7、18发挥屏障作用[14]。claudin-5是维持血脑屏障紧密连接结构最重要的蛋白[15],对血脑屏障结构和功能的稳定具有重要作用[16],但相关研究主要集中在哺乳动物,而在硬骨鱼中鲜有报道。【本研究切入点】目前,哺乳动物claudin-5的结构与功能已被充分研究,其与血脑屏障的相关研究也在有条不紊地开展,但在硬骨鱼中尚未见详细报道。【拟解决的关键问题】本研究选取重要经济物种尼罗罗非鱼,对其claudin-5基因进行克隆,并分析该基因的编码序列及其特征,对其生物结构和功能进行预测,研究其在尼罗罗非鱼不同组织中以及无乳链球菌刺激后的表达模式,探究claudin-5在尼罗罗非鱼抵抗无乳链球菌感染中的作用。
1 材料与方法 1.1 试验材料供试尼罗罗非鱼于2022年9月从广东省湛江市某养殖场购得,健康无伤且体重匀称50(±5)g。试验鱼于广东省水产动物病害防控与健康养殖重点实验室养殖条件恒定的情况下暂养1周,在经过广东海洋大学动物护理和使用委员会批准后进行试验。无乳链球菌(Streptococcus agalctiae,ZQ0910)由上述实验室保存并提供。RNA提取试剂盒、cDNA反转录试剂盒、qPCR试剂盒、rTaq DNA聚合酶、DNA marker、克隆质粒pMD19-T载体、大肠杆菌DH5α感受态细胞等均购自宝生物工程(大连)有限公司,PCR产物纯化试剂盒购自Thermo公司,引物由生工生物工程(广州)股份有限公司合成。
1.2 试验设计为分析尼罗罗非鱼claudin-5基因的组织表达模式,按文献[17]的方法采集其皮肤、鳃、脑、心脏、肝脏、脾脏、头肾、肠道等组织,置于液氮中保存备用。
为探究无乳链球菌感染对尼罗罗非鱼claudin-5基因表达的影响,设感染组和对照组,30尾/ 组,3次重复。对感染组尼罗罗非鱼注射1.0×107 CFU/mL无乳链球菌菌液200 μL/ 尾,对照组尼罗罗非鱼注射等量的无菌PBS[17]。在注射后的0、6、12、24、48、72 h对感染组和对照组进行组织取样,每组随机选取3尾,采集脑、肝脏、头肾、肠道,置于液氮中保存备用。
1.3 总RNA提取及cDNA合成将不同组织样本置于2.0 mL RNase-free离心管中,并用TransZol试剂盒在无RNA酶条件下提取各组织总RNA。将提取的RNA样本进行凝胶电泳检测,在确定RNA样品未降解的条件下根据反转录试剂盒说明书进行反转录合成cDNA。
1.4 claudin-5基因克隆和测序根据NCBI已公布的尼罗罗非鱼claudin-5基因组预测序列(XM_005473513.4),利用Primer Premier 5.0设计扩增引物claudin-5-F(5'CCGC TCGAGCGGATGGTGTCGGCCGGACTGGA3')和claudin-5-R(5'CCGGAATTCCGGCTACACA TAATTCCTCTTGTCATA3'),并委托生物工程(广州)股份有限公司合成。以反转录合成的cDNA为模板,对尼罗罗非鱼claudin-5基因编码序列进行PCR扩增。PCR反应体系:上、下游引物及模板各1 μL、rTaq Mix 10 μL,用灭菌蒸馏水补至20 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s、60 ℃退火30 s、72℃延伸70 s,共36个循环;72 ℃再延伸10 min。PCR扩增产物经1.0% 琼脂糖凝胶电泳检测合格后,将目标条带切下,使用切胶回收试剂盒进行纯化回收。将纯化后的产物与PMD19-T载体在16 ℃下连接4 h,将其转化至DH5α感受态细胞,筛选阳性克隆,委托生物工程(广州)股份有限公司进行测序。
1.5 序列和生物信息分析将测序所得序列使用NCBI ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)查找开放读码框(ORF),并推导氨基酸序列;同源性比对和相似性分析使用NCBI(http://blast.ncbi.nih.gov/Blast.cgi)进行Blast;理论等电点(pI)及分子量预测使用Protparam tool(http://web.expasy.org/protparam/);氨基酸序列中的功能位点分布通过SoftBerry(http://linux1.softberry.com/berry.phtml?topic=psite&group=programs&subgroup=proloc)预测;进化树(Neighbor-joining,NJ)采用MEGA 5.0构建;利用DNAMAN进行多重序列比对;使用SMART(http://smart.embl-heidelberg.de/)进行结构域预测;使用InterProScan Sequence Search(http://www.ebi. ac.uk/Tools/InterProScan)分析蛋白质结构功能域。
1.6 组织表达分析采用实时荧光定量PCR,以各组织反转录合成的cDNA为模板、β-actin为内参基因,测定claudin-5在尼罗罗非鱼皮肤、鳃、脑、心脏、肝脏、脾脏、头肾、肠道等组织的表达,引物如下:qRT-Onclaudin-5-F(5'TAATTGGC TCGCTCCTGGTG3')、qRT-Onclaudin-5-R(5'CTGCACAACACACGACATCC3');β-actin-F(5'AACAACCACACACCACACATTTC3')、β-actin-R(5'ATGTTGGCGAACCAGCAG3')。qPCR反应体系:Green qPCR Super Mix 5 μL,ddH2O 2 μL,cDNA 1 μL,qRT-Onclaudin-5-F 1 μL,qRT-Onclaudin-5-R 1 μL。每个样本设置3个平行复孔,采用2-ΔΔCt法计算claudin-5的相对表达量。反应程序和计算方式参照文献[18]。
1.7 无乳链球菌刺激后claudin-5基因的表达模式将无乳链球菌刺激后的组织样本进行RNA提取,并利用反转录试剂盒合成cDNA,以cDNA作为模板,使用PerfectStart® Green qPCR SuperMix(TRANS)试剂盒并按照说明书进行实时荧光定量检测。以上述相对表达量的计算方式分析尼罗罗非鱼经无乳链球菌刺激后claudin-5基因的表达模式。
采用SPSS 17.0对试验数据进行单因素方差分析(One-way ANOVA)。
2 结果与分析 2.1 尼罗罗非鱼claudin-5基因的扩增对尼罗罗非鱼claudin-5进行PCR扩增,PCR扩增产物经1% 琼脂糖凝胶电泳检测,结果(图 1)显示,在约700 bp附近有1条特异性扩增条带。回收片段进行测序,得到尼罗罗非鱼claudin-5基因的ORF,长度为651 bp。
|
| M:DL2000 DNA Marker;1:claudin-5扩增产物 M: DL2000 DNA Marker; 1: Amplification product of claudin-5 图 1 尼罗罗非鱼claudin-5基因克隆 Fig. 1 Cloning of claudin-5 gene of Oreochromis niloticus |
2.2 尼罗罗非鱼claudin-5基因的序列特征
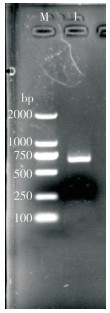
克隆获得尼罗罗非鱼claudin-5基因的ORF序列(GenBank登录号:XM_005473513.4)为651 bp,可编码216个氨基酸(图 2)。SoftBerry-Psite程序预测发现,该氨基酸序列含有3个蛋白激酶C磷酸化位点、1个酪蛋白激酶Ⅱ磷酸化位点、5个N- 端豆蔻酰基化位点(图 2)。利用SignalP 4.1 Server程序对claudin-5氨基酸序列进行N端信号肽结构预测,发现无明显的信号肽切割位点,不存在信号肽(图 3)。利用PSIPRED进行二级结构分析,结果表明该蛋白具有8个α螺旋和多个无规则卷曲。利用ExPASy软件对claudin-5蛋白进行分析,理论分子量为23.00421 kD,理论pI值为8.53。通过TMHMM Server 2.0程序预测发现,该蛋白存在4个跨膜结构域(图 4)。
|
| *:终止子;蓝色:N-端豆蔻酰基化位点;黄色:蛋白激酶C磷酸化位点;绿色:酪蛋白激酶Ⅱ磷酸化位点;深蓝色矩形:戊烯基结合位点(CAAX box);红色椭圆:微体C-末端定位信号位点;黑色下划线:原核膜脂蛋白脂质附着位点 *: Termination codon; Blue: N-myristoylation site; Yellow: PKC phosphorylation site; Green: Casein kinase Ⅱ phosphorylation site; Dark blue rectangle: Pentenyl group binding site (CAAX box); Red oval part: Microbodies C-terminal targeting signal; Black underline: Prokaryotic membrane lipoprotein lipid attachment site 图 2 尼罗罗非鱼claudin-5 ORF的核苷酸序列及预测氨基酸序列 Fig. 2 Nucleotide sequence and predicted amino acid sequences of claudin-5 ORF in Oreochromis niloticus |

|
| 图 3 尼罗罗非鱼Claudin-5蛋白信号肽预测 Fig. 3 Prediction of claudin-5 protein signal peptide in Oreochromis niloticus |

|
| 图 4 尼罗罗非鱼claudin-5蛋白跨膜结构域预测 Fig. 4 Prediction for the transmembrane domains of claudin-5 protein in Oreochromis niloticus |
2.3 尼罗罗非鱼claudin-5氨基酸序列的多重对比和系统进化树分析
根据氨基酸序列比对,发现尼罗罗非鱼claudin-5氨基酸序列与其他硬骨鱼相似度较高,其中与奥利亚罗非鱼claudin-5的同源性最高(97.55%),序列相似性比较表明claudin-5保守性较强(图 5)。将推导的claudin-5氨基酸序列与其他物种构建系统进化树,结果(图 6)显示,尼罗罗非鱼claudin-5蛋白与黄鳍棘鲷(Acanthopagrus latus)、豹纹鳃棘鲈(Plectropomus leopardus)亲缘关系较远。与奥尼罗非鱼(O. aureus)、剑鱼(Xiphias gladius)、细纹凤鳚(Salarias fasciatus)、眼斑双锯鱼(Amphiprion ocellaris)聚为一个大支,其中与奥利亚罗非鱼聚为同一亚族,表明它们之间有较近的亲缘关系。进一步验证claudin-5基因在鱼类进化过程中具有高度保守性,这与传统的形态学和生化特征分类结果一致。

|
| 尼罗罗非鱼Oreochromis niloticus,奥尼罗非鱼Oreochromis aureus,剑鱼Xiphias gladius,细纹凤鳚Salarias fasciatus,眼斑双锯鱼Amphiprion ocellaris,黄鳍棘鲷Acanthopagrus latus,豹纹鳃棘鲈Plectropomus leopardus 图 5 尼罗罗非鱼claudin-5氨基酸序列与其他物种的多重比对 Fig. 5 Multiple alignment of amino acid sequences of claudin-5 among Oreochromis niloticus and other species |

|
| 图 6 基于claudin-5氨基酸序列构建的系统进化树 Fig. 6 Phylogenetic tree based on amino acid sequences of claudin-5 |
2.4 尼罗罗非鱼claudin-5的组织表达分析
利用实时荧光定量PCR技术分析claudin-5在尼罗罗非鱼各组织中的表达情况,结果(图 7)显示,claudin-5在尼罗罗非鱼脑的表达量最高,鳃和皮肤次之,而在其他组织的表达量微乎其微,在脑的表达量是在血细胞表达量的300倍以上,表明claudin-5的表达具有组织差异性。
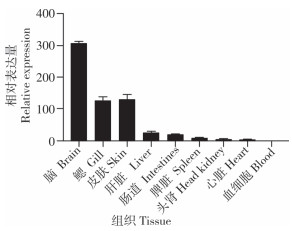
|
| 图 7 claudin-5基因在尼罗罗非鱼各组织中的相对表达量 Fig. 7 Relative expression of claudin-5 gene in various tissues of Oreochromis niloticus |
2.5 无乳链球菌刺激后尼罗罗非鱼claudin-5基因的表达变化
由图 8可知,与0 h相比,无乳链球菌刺激12 h时,尼罗罗非鱼脑和头肾中claudin-5表达量达到最高值,在24 h表达量有所下调,其中在脑部的表达量于48 h时最低,但仍高于0 h,而在头肾的表达量在48~96 h时出现明显上调后下降;肠中claudin-5表达量在无乳链球菌刺激后6~12 h时上升缓慢,在48 h表达量大幅度上调,并达到最高值,之后在48~96 h时出现下调,但低于0 h;肝脏中claudin-5表达量在无乳链球菌刺激后出现明显下调,在24 h略有回升然后继续下调。
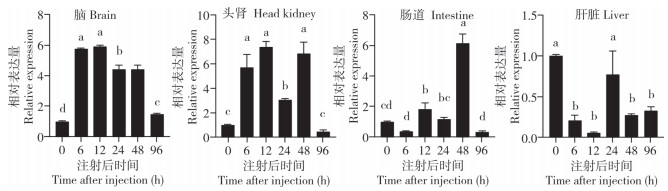
|
| 柱上小写英文字母不同者表示显著差异(P < 0.05) Different lowercase letters on the column indicate significant difference (P < 0.05) 图 8 无乳链球菌刺激后claudin-5基因在尼罗罗非鱼脑、头肾、肠和肝脏的表达分析 Fig. 8 Analysis of expression of claudin-5 gene in brain, head kidney, intestine and liver of Oreachromis niloticus after stimulation by Streptococcus agalactiae |
3 讨论
尼罗罗非鱼作为一种抗病能力和适应能力极强的重要经济鱼类,对世界淡水养殖产业具有重要意义[19-20]。然而,随着养殖环境恶化,无乳链球菌感染已成为尼罗罗非鱼养殖产业蓬勃发展的重要威胁因素。脑膜炎作为无乳链球菌感染的重要临床症状之一[21],主要由无乳链球菌突破机体血脑屏障进入神经中枢引起过度炎症反应所致。血脑屏障作为一种选择性扩散屏障,主要由脑微血管内皮细胞、星形胶质细胞和周细胞等构成,其屏障上的紧密连接结构是决定屏障功能性的关键元素[22]。血脑屏障的存在使得中枢神经系统能够隔绝绝大多数病原体。常见的脑膜炎致病菌可通过跨细胞途径、细胞旁途径和“特洛伊木马”途径突破血脑屏障引起脑膜炎,但无乳链球菌是以何种方式突破血脑屏障引起尼罗罗非鱼脑膜炎仍未知,有关无乳链球菌感染后的血脑屏障反应也未见报道。
紧密连接是控制细胞通透性的重要结构,claudins具有庞大的家族成员,可镶嵌在脂膜上形成独有的“栅栏”结构[23]。研究发现,哺乳动物中claudin-5与血脑屏障息息相关,是其紧密连接结构最关键的构成蛋白。本研究克隆获得尼罗罗非鱼claudin-5基因,通过测序发现其ORF为651 bp,编码216个氨基酸。预测其氨基酸序列发现,尼罗罗非鱼claudin-5具有4个跨膜结构域,与哺乳动物claudin-5所报道的一致[16]。尼罗罗非鱼claudin-5的N- 端和C- 端均位于胞内,相关研究表明,claudin-5的PDZ结构域可与紧密连接胞浆蛋白直接相连,如ZO-1、ZO-2或ZO-3[15, 24]。此外,尼罗罗非鱼claudin-5还具有3个蛋白激酶C(PKC)磷酸化位点,表明该蛋白具有抗原结合位点,这对于抗原信息的传递至关重要。与其他硬骨鱼进行序列比对发现,尼罗罗非鱼claudin-5的同源性极高,说明其序列保守,结构和功能可能相似。
研究表明,大鼠claudin-5在脑微血管内皮细胞中的mRNA表达水平是claudin-12的约751倍;敲降小鼠脑血管内皮细胞系bEnd.3的 claudin-5基因,其跨内皮细胞电阻会明显降低;此外小鼠的claudin-5基因被敲除后会在10 h内死亡[25]。本研究发现,claudin-5在尼罗罗非鱼脑部的表达水平极高,是血细胞等组织的300倍左右,充分说明其在尼罗罗非鱼的表达具有组织特异性。证明claudin-5主要在尼罗罗非鱼脑部发挥作用,参与构成血脑屏障,并维持血脑屏障功能的稳定。研究表明,猪链球菌可通过高表达溶血素激活NLRP3炎性小体,进而激活IL-1β和IL-18,并进一步诱导IL-17A表达,而IL-17A则可进一步破坏机体组织屏障系统以增强屏障通透性,达到细菌易位的目的[26]。
经无乳链球菌感染的罗非鱼,其内脏器官(尤其是脾、肾、脑等)组织会出现明显的病理学变化[27]。本研究中,无乳链球菌刺激下的尼罗罗非鱼claudin-5表达水平发生明显变化,尤其集中表现在脑、头肾和肠道等组织。在脑组织中,无乳链球菌刺激后claudin-5表达水平出现显著上调并在12 h时达到最大值,这可能是血脑屏障抵抗无乳链球菌感染的结果;而后claudin-5的表达水平却出现明显下降并在48 h时达到最低值,此时可能是无乳链球菌突破血脑屏障的关键时机。以上结果均表明,claudin-5在宿主抵抗无乳链球菌入侵的过程中发挥重要作用,尤其体现在血脑屏障上。研究结果可为无乳链球菌感染硬骨鱼导致脑膜炎致病机制的研究提供重要的理论依据。
4 结论本研究成功克隆尼罗罗非鱼claudin-5基因,预测其蛋白具有4个跨膜结构域和3个蛋白激酶C(PKC)磷酸化位点,在不同物种间序列的保守性极高。尼罗罗非鱼claudin-5在各个组织中均有表达,但在脑组织的表达量极高,是血细胞等组织的300倍左右,其表达具有明显的组织特异性,证明其主要在脑部发挥作用,可能用于维持血脑屏障的完整性和功能性,以此来保护中枢神经系统免受外来有害物质的影响。但是在经过无乳链球菌刺激后,claudin-5在尼罗罗非鱼脑、头肾和肠道等组织的表达水平呈现为先显著上升后下降的趋势,说明其在宿主抵抗无乳链球菌入侵的过程中发挥重要作用,尤其是利用血脑屏障抵抗无乳链球菌。而claudin-5在脑的表达显著下降暗示无乳链球菌通过调控紧密连接蛋白的表达从而进入中枢神经系统引起脑膜炎。
| [1] |
杨观健, 汪志文, 黎源, 李炳喜, 鲁义善. 尼罗罗非鱼marco基因克隆、亚细胞定位及表达分析[J]. 广东海洋大学学报, 2022, 42(5): 27-37. DOI:10.3969/j.issn.1673-9159.2022.05.004 YANG G J, WANG Z W, LI Y, LI B X, LU Y S. Molecular cloning, subcellular localization and expression analysis of marco gene in nile tilapia(Oreochromis niloticus)[J]. Journal of Guangdong Ocean University, 2022, 42(5): 27-37. DOI:10.3969/j.issn.1673-9159.2022.05.004 |
| [2] |
周远扬, 王玉梅, 曹俊明, 万忠, 李思发. 2015年广东罗非鱼产业发展形势与对策建议[J]. 广东农业科学, 2016, 43(6): 23-27. DOI:10.16768/j.issn.1004-874X.2016.06.005 ZHOU Y Y, WANG Y M, CAO J M, WAN Z, LI S F. Development situation and countermeasures of Guangdong tilapia industry in 2015[J]. Guangdong Agricultural Sciences, 2016, 43(6): 23-27. DOI:10.16768/j.issn.1004-874X.2016.06.005 |
| [3] |
崔淼, 吴敏, 刘茹, 黎晶晶, 张辉杰, 许德麟, 张其中. 无乳链球菌和海豚链球菌早期预警分子检测[J]. 水产科学, 2021, 40(4): 589-595. DOI:10.16378/j.cnki.1003-1111.19191 CUI M, WU M, LIU R, LI J J, ZHANG H J, XU D L, ZHANG Q Z. Molecular detection and early warning of Streptococcus agalactiae and S. iniae[J]. Fisheries Science, 2021, 40(5): 589-595. DOI:10.16378/j.cnki.1003-1111.19191 |
| [4] |
郭长明, 陈怀君, 袁橙, 袁圣, 贾国华, 王义仁, 朱善元. 广东罗非鱼无乳链球菌分离鉴定及生物学特性分析[J]. 中国动物传染病学报, 2024, 32(3): 1-13. DOI:10.19958/j.cnki.cn31-2031/s.20220324.002 GUO C M, CHEN H J, YUAN C, YUAN S, JIA G H, WANG Y R, ZHU S Y. Isolation, identification and characterization of Streptococcus agalactiae from tilapia in Guangdong[J]. Chinese Journal of Animal Infectious Diseases, 2024, 32(3): 1-13. DOI:10.19958/j.cnki.cn31-2031/s.20220324.002 |
| [5] |
GONG Y, HOU J. Claudins in barrier and transport function-the kidney[J]. Pfl ugers Archiv-European Journal of Physiology, 2017, 469(1): 105-113. DOI:10.1007/s00424-016-1906-6 |
| [6] |
王晓艳, 李宝山, 孙永智, 王成强, 黄炳山. 植物蛋白源诱发鱼类肠炎及修复的研究进展[J]. 广东海洋大学学报, 2023, 43(6): 37-46. DOI:10.3969/j.issn.1673-9159.2023.06.005 WANG X Y, LI B S, SUN Y Z, WANG C Q, HUANG B S. Research progress of plant protein-induced enteritis of fish and its repair[J]. Journal of Guangdong Ocean University, 2023, 43(6): 37-46. DOI:10.3969/j.issn.1673-9159.2023.06.005 |
| [7] |
王治方, 徐引弟, 朱文豪, 焦文强, 张青娴, 李海利, 许峰, 王克领. 副猪格拉菌血清2型毒力及耐药性分析[J]. 广东农业科学, 2023, 50(5): 112-120. DOI:10.16768/j.issn.1004-874X.2023.05.013 WANG Z F, XU Y D, ZHU W H, JIAO W Q, ZHANG Q Y, LI H L, XU F, WANG K L. Analysis of virulence and drug resistance of Glaesserella parasuis serotype 2[J]. Guangdong Agricultural Sciences, 2023, 50(5): 112-120. DOI:10.16768/j.issn.1004-874X.2023.05.013 |
| [8] |
BEN-ZVI A, LACOSTE B, KUR E, ANDREONE B J, MAYSHAR Y, YAN H, GU C H. MFSD2A is critical for the formation and function of the blood–brain barrier[J]. Nature, 2014, 509(7501): 507-511. DOI:10.1038/nature13324 |
| [9] |
LI Y Y, LIU B W, ZHAO T T, QUAN X P, HAN Y, CHENG Y X, CHEN Y L, SHEN X, ZHENG Y, ZHAO Y H. Comparative study of extracellular vesicles derived from mesenchymal stem cells and brain endothelial cells attenuating blood–brain barrier permeability via regulating Caveolin-1-dependent ZO-1 and Claudin-5 endocytosis in acute ischemic stroke[J]. Journal of Nanobiotechnology, 2023, 21(1): 70. DOI:10.1186/s12951-023-01828-z |
| [10] |
李春玲, 柯海意, 徐民生, 卞志标, 张昆丽, 李艳, 翟少伦. 革兰氏阴性病原菌外膜囊泡的生物学作用与机制研究进展[J]. 广东农业科学, 2023, 50(7): 1-10. DOI:10.16768/j.issn.1004-874X.2023.07.001 LI C L, KE H Y, XU M S, BIAN Z B, ZHANG K L, LI Y, ZHAI S L. Research progress on biological roles and mechanisms of outer membrane vesicles derived from gram-negative pathogenic bacteria[J]. Guangdong Agricultural Sciences, 2023, 50(7): 1-10. DOI:10.16768/j.issn.1004-874X.2023.07.001 |
| [11] |
KOLOSOV D, BUI P, CHASIOTIS H, KELLY S P. Claudins in teleost fishes[J]. Tissue Barriers, 2013(3): e25391. DOI:10.4161/tisb.25391 |
| [12] |
LOH Y H, CHRISTOFFELS A, BRENNER S, HUNZIKER W, VENKATESH B. Extensive expansion of the claudin gene family in the teleost fish, Fugu rubripes[J]. Genome Research, 2004, 14(7): 1248-1257. DOI:10.1101/gr.2400004 |
| [13] |
季蓉, 朱小娟, 郭海莲, 尹磊淼, 黄丽强. 紧密连接蛋白-1功能研究进展[J]. 中国细胞生物学学报, 2020, 42(9): 1617-1623. DOI:10.11844/cjcb.2020.09.0014 JI R, ZHU X J, GUO H L, LIN L M, HUANG L Q. Research advances in the function of Claudin-l[J]. Chinese Journal of Cell Biology, 2020, 42(9): 1617-1623. DOI:10.11844/cjcb.2020.09.0014 |
| [14] |
SCHLINGMANN B, MOLINA S A, KOVAL M. Claudins: Gatekeepers of lung epithelial function[J]. Seminars in Cell & Developmental Biology, 2015, 42: 47-57. DOI:10.1016/j.semcdb.2015.04.009 |
| [15] |
HASHIMOTO Y, CAMPBELL M. Tight junction modulation at the blood-brain barrier: Current and future perspectives[J]. Biochimica et Biophysica Acta-Biomembranes, 2020, 1862(9): 183298. DOI:10.1016/j.bbamem.2020.183298 |
| [16] |
JIA W, LU R, MARTIN T A, JIANG W G. The role of claudin-5 in blood-brain barrier (BBB) and brain metastases (review)[J]. Molecular Medicine Reports, 2014, 9(3): 779-785. DOI:10.3892/mmr.2013.1875 |
| [17] |
黄瑜, 马嘉霖, 周棉鑫, 陈敏琪, 蔡佳, 简纪常, 汤菊芬. 罗非鱼干扰素诱导蛋白35基因克隆及表达分析[J]. 广东海洋大学学报, 2020, 40(2): 13-19. DOI:10.3969/j.issn.1673-9159.2020.02.003 HUANG Y, MA J L, ZHOU M X, CHEN M Q, CAI J, JIAN J C, TANG J F. Cloning and expression analysis of ifi35 in nile tilapia (Oreochromis niloticus)[J]. Journal of Guangdong Ocean University, 2020, 40(2): 13-19. DOI:10.3969/j.issn.1673-9159.2020.02.003 |
| [18] |
黄子威, 汪志文, 黎源, 夏洪丽, 简纪常, 鲁义善. 罗非鱼SRA4基因重组表达、亚细胞定位及组织分布[J]. 广东海洋大学学报, 2021, 41(5): 19-27. DOI:10.3969/j.issn.1673-9159.2021.05.003 HUANG Z W, WANG Z W, LI Y, XIA H L, JIAN J C, LU Y S. Molecular cloning, subcellular localization and expression characterization of SRA4 gene in nile tilapia (Oreochromis niloticus)[J]. Journal of Guangdong Ocean University, 2021, 41(5): 19-27. DOI:10.3969/j.issn.1673-9159.2021.05.003 |
| [19] |
WANG B, THOMPSON K D, WANGKAHART E, YAMKASEM J, BONDAD-REANTASO M G, TATTIYAPONG P, JIAN J C, SURACHETPONG W. Strategies to enhance tilapia immunity to improve their health in aquaculture[J]. Reviews in Aquaculture, 2023, 15(S1): 41-56. DOI:10.1111/raq.12731 |
| [20] |
张志强, 刘鑫潮, 牛金中, 黄瑜, 王蓓, 简纪常. 尼罗罗非鱼Galectin-4基因的原核表达及诱导条件优化[J]. 广东海洋大学学报, 2020, 40(5): 118-123. DOI:10.3969/j.issn.1673-9159.2020.05.015 ZHANG Z Q, LIU X C, NIU J Z, HUANG Y, WANG B, JIAN J C. Prokaryotic expression and optimization of Galectin- 4 gene from nile tilapia (Oreochromis niloticus)[J]. Journal of Guangdong Ocean University, 2020, 40(5): 118-123. DOI:10.3969/j.issn.1673-9159.2020.05.015 |
| [21] |
张祥, 黄瑜, 蔡佳, 简纪常, 王蓓. miRNA-155靶向SOCS5对无乳链球菌诱导罗非鱼脑星形胶质细胞炎症的影响[J]. 广东海洋大学学报, 2023, 43(2): 1-10. DOI:10.3969/j.issn.1673-9159.2023.02.001 ZHANG X, HUANG Y, CAI J, JIAN J C, WANG B. Effect of MiRNA-155-targeted SOCS5 gene on inflammatory response of brain astrocytes of Oreochromis niloticus induced by Streptococcus agalactiae[J]. Journal of Guangdong Ocean University, 2023, 43(2): 1-10. DOI:10.3969/j.issn.1673-9159.2023.02.001 |
| [22] |
ARMULIK A, GENOVÈ G, MÄE M, NISANCIOGLU M H, WALLGARD E, NIAUDET C, HE L Q, NORLIN J, LINDBLOM P, STRITTMATTER, K JOHANSSON B R, BETSHOLTZ C. Pericytes regulate the blood–brain barrier[J]. Nature, 2010, 468(7323): 557-561. DOI:10.1038/nature09522 |
| [23] |
张楠, 王思迪, 涂盼春, 岳英芳, 杨智航. 紧密连接相关蛋白对血脑屏障通透性影响的研究进展[J]. 沈阳医学院学报, 2017, 19(1): 72-75. DOI:10.16753/j.cnki.1008-2344.2017.01.023 ZHANG N, WANG S D, TU P C, YUE Y F, YANG Z H. Research progress of roles of tight junction proteins involved in the permeability of blood-brain barrier[J]. Journal of Shenyang Medical College, 2017, 19(1): 72-75. DOI:10.16753/j.cnki.1008-2344.2017.01.023 |
| [24] |
VAN ITALLIE C M, TIETGENS A J, ANDERSON J M. Visualizing the dynamic coupling of claudin strands to the actin cytoskeleton through ZO-1[J]. Molecular Biology of the Cell, 2017, 28(4): 524-534. DOI:10.1091/mbc.e16-10-0698 |
| [25] |
张嘉昕, 杨雪媛, 丛馨. 血管内皮细胞间紧密连接的研究进展[J]. 生理科学进展, 2021, 52(3): 187-192. DOI:10.3969/j.issn.0559-7765.2 ZHANG J X, YANG X Y, CONG X. Research progress of tight junction in vascular endothelial cells[J]. Progress in Physiological Sciences, 2021, 52(3): 187-192. DOI:10.3969/j.issn.0559-7765.2 |
| [26] |
徐磊. IL-17A在猪链球菌感染中的作用和机制研究[D]. 武汉: 华中农业大学, 2023. DOI: 10.27158/d.cnki.ghznu.2022.000333. XU L. Research on the effect and mechanism of IL -17A in Streptococcus suis infection[D]. Wuhan: Huazhong Agricultural University, 2023. DOI: 10.27158/d.cnki.ghznu.2022.000333. |
| [27] |
祝璟琳, 杨弘. 鱼源无乳链球菌致病机理研究进展[J]. 广东海洋大学学报, 2013, 33(6): 92-96. DOI:10.3969/j.issn.1673-9159.2013.06.017 ZHU J L, YANG H. Review on pathogenesis of Streptococcus agalactiae from fish[J]. Journal of Guangdong Ocean University, 2013, 33(6): 92-96. DOI:10.3969/j.issn.1673-9159.2013.06.017 |
(责任编辑 马春敏)
 2024, Vol. 51
2024, Vol. 51