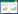文章信息
基金项目
- 国家自然科学基金(31972818,31472302)
作者简介
- 莫金凤(1990—),女,博士,实验师,研究方向为水产动物免疫与健康养殖,E-mail:2018010164@m.scnu.edu.cn.
通讯作者
- 叶剑敏(1975—),男,博士,教授,研究方向为水产动物免疫与健康养殖,E-mail:jmye@m.scnu.edu.cn.
文章历史
- 收稿日期:2024-02-22
2. 华南师范大学生命科学学院/广东省水产优质环保养殖工程技术研究中心,广东 广州 510631
2. School of Life Sciences, South China Normal University/Guangdong Engineering Technology Research Center for Environmentally-Friendly Aquaculture, Guangzhou 510631, China
【研究意义】罗非鱼是联合国粮农组织指定认可的21世纪世界养殖优良品种,罗非鱼养殖是助推农村经济发展、助力农民增收、提供稳定优质蛋白的重要产业[1]。2023年我国罗非鱼养殖产量近182万t,其中广东省罗非鱼养殖产量近78万t,位居全国第一[2]。罗非鱼的养殖模式多种多样,包括单养、混养、立体养殖等[3]。罗非鱼与鹅混合养殖是一种常见的水禽饲养与渔业综合经营的立体化养殖模式,该养殖模式可利用水禽粪料饲喂鱼类,且充分利用水面和土地,可节省养殖成本、提高养殖效益和社会效益[4],是南方地区罗非鱼养殖主要模式之一。近年来,本团队发现鹅-鱼混合养殖池塘的罗非鱼疾病高发,体质量约20 g的罗非鱼仔鱼在每年6—7月开始出现体色发黑、不进食或食量减少、游动缓慢或离群独游、打转等症状;通过肉眼观察,可发现患病罗非鱼的鳃盖部红肿充血、部分罗非鱼单眼或双眼凸起、死亡的罗非鱼嘴巴和鳃张开。该症状与罗非鱼链球菌病的症状相似,且具有发病时间长、传染性强、死亡率高等特点,主要流行于夏季,发病高峰期在每年5—9月,7—8月高温季节发病最为凶猛[5-6]。鹅-鱼养殖模式下罗非鱼病害频发,进一步引起水质恶化,直接影响鱼类生长,并间接影响鹅的健康养殖、产蛋和繁殖性能[7],给罗非鱼养殖业和水禽养殖业带来重大的经济损失,探明其病因对罗非鱼疾病防控具有重要意义。【前人研究进展】无乳链球菌(Streptococcus agalactiae)为革兰氏阳性菌,是一种人、畜及水产动物共患的致病菌,也是罗非鱼链球菌病的主要病原之一[8-9]。近年来,在广东、海南、广西、福建等罗非鱼主要养殖地区采集的病样分析发现,造成罗非鱼疾病爆发的病原多为无乳链球菌[10-14]。无乳链球菌可引起罗非鱼败血症和脑膜炎,一旦发病,死亡率极高,严重威胁我国罗非鱼养殖业的健康发展[15]。郭长明等[13]研究发现,广西多地罗非鱼养殖场在高温季节的患病罗非鱼无乳链球菌检出率达68%,且无乳链球菌在罗非鱼养殖场内分布广泛,与水体环境密切相关。陈怀君等[11]分离出的15株海南罗非鱼无乳链球菌对大部分磺胺类及氨基糖胺类药物具有较强的耐药性,对磺胺异恶唑、复方新诺明、链霉素、强大霉素的耐药率达90% 以上,且均具有不同程度的多重耐药性。因此,实际生产中应严格规范地使用抗生素。【本研究切入点】目前对鹅-鱼混合养殖环境下罗非鱼病的病原菌鉴定报道较少,病原菌生物学特性与鱼病防治之间的联系尚不明晰。【拟解决的关键问题】本研究对鹅-鱼养殖环境下罗非鱼病原菌进行分离鉴定,并研究病原菌的生长特性、致病性、药物敏感性等,可为罗非鱼病的精准防治提供参考,促进罗非鱼养殖业的可持续健康发展。
1 材料与方法 1.1 试验材料供试菌株分离纯化自广东省阳江市某鹅-鱼立体养殖模式下的患病罗非鱼。
患病罗非鱼于2016年7月采集自上述养殖场,体质量约20(±10)g,表现出游动缓慢、体色变黑、打转、翻肚子、眼球凸起、尾鳍背鳍溃烂、死亡时嘴巴张大等症状。养殖场池塘面积约2 668 m2,水深1.8~2.3 m,池壁和底质为泥质,混合养殖罗非鱼、鲢鱼、鲮鱼、草鱼、鳙鱼等,其中罗非鱼约4 000尾,每天早晚投喂颗粒配合饲料,日投喂量约为养殖鱼总体质量的1%。池塘岸边养殖阳江灰鹅约6 000只,鹅粪便未经处理,可直接随雨水流入池塘。
健康罗非鱼购自广东省罗非鱼良种场,体质量为20(±5)g和50(±5)g,置于实验室鱼类养殖系统暂养2周后,用于回归感染试验。
1.2 试剂及仪器设备5% 绵羊血平板、脑心浸萃(BHI)液体培养基、BHI固体培养基、大豆酪蛋白(TSA)固体培养基等试验培养基购自广东环凯微生物科技有限公司;链球菌细菌生化编码鉴定管、细菌药敏试纸片等试剂和抗菌药物购自杭州滨和微生物试剂有限公司。
仪器设备:麦氏比浊仪(法国Biomerieux公司)、基因扩增仪(杭州博日有限公司)、超净工作台(苏州净化设备有限公司)、恒温振荡培养箱(上海南荣实验室设备有限公司)、智能生化培养箱(广州恒创实验仪器有限公司)、光学显微镜(重庆奥特光学仪器有限责任公司)、离心机(杭州奥盛仪器有限公司)。
1.3 病原菌的分离培养无菌操作下采集患病罗非鱼的肝、脾、肾和脑组织,分别在5% 绵羊血平板上通过划线的方法进行接种,在30 ℃恒温培养箱中培养24 h,然后观察各接种组织的菌落形态和生长情况,挑取优势单菌落进行革兰氏染色,通过光学显微镜对分离株进行形态学观察。挑取各组织的优势菌落进行PCR检测。选取脑组织的优势菌株(编号为SAYJN)用于细菌生理生化鉴定、生长特性、致病性和药物敏感性等试验。
1.4 回归感染试验病原菌培养:在超净工作台内将SAYJN菌株接种至灭菌的BHI液体培养基,30 ℃、200 r/min培养8 h,利用麦氏比浊仪测定菌株SAYJN的菌液浓度,再使用0.65% 无菌生理盐水将菌液浓度稀释至3×108 CFU/mL。
回归感染:使用上述准备好的SAYJN菌液,通过腹腔注射的方式感染体质量为50(±5)g健康罗非鱼,每尾注射0.2 mL。以注射等量的0.65% 无菌生理盐水作为对照组。试验期间水温28~30 ℃,每天观察试验鱼的症状及记录死亡情况,连续观察7 d。从发病试验鱼中再次分离病原菌并重新进行回归感染试验。
1.5 病原菌的生理生化鉴定生化鉴定根据链球菌细菌生化编码鉴定管说明书的方法进行,接触酶试验根据水产行业标准(SC/T 7014-2006)的方法进行,即将1 mL 3% H2O2倾注于被检菌落上,若有气泡则为阳性;溶血试验根据地方标准(DB46/T 280-2014)进行,即用无菌接种环将细菌接种于新鲜的5% 绵羊血平板上,28 ℃倒置培养24 h,在血平板上形成明显的透明环则为β溶血,形成狭窄的灰绿色溶血环则为α溶血,不形成溶血环则为γ溶血。
1.6 病原菌的16S rRNA基因序列分析采用Bacterial DNA Kit试剂盒提取SAYJN菌的基因组DNA,16S rRNA基因的扩增引物参照文献[16]合成;PCR反应条件:95℃预变性5 min;95 ℃ 30 s,55 ℃退火30 s,72 ℃延伸60 s,30个循环;72 ℃延伸10 min。通过琼脂糖凝胶电泳检测后的阳性PCR产物交由上海生工生物工程有限公司进行测序,并将测序结果上传到NCBI网站的BLAST检索系统进行基因序列分析。系统发育树采用MEGA 7.0软件的邻接(Neighbor-joining,NJ)法构建。
1.7 病原菌的生长特性1.7.1 生长曲线 参考文献[16]的方法制备种子菌液,将SAYJN菌株接种在无菌BHI液体培养基中180 r/min振荡培养8 h,用0.65% 无菌生理盐水将菌液浓度调整至3×108 CFU/mL。提前准备好无菌BHI液体培养基,按照1∶100的比例接种种子菌液,每管的终体积为5 mL,共计120管,放置于37 ℃恒温震荡培养箱中以200 r/min的转速振荡培养,每隔0.5~2 h,分别随机取5管培养液测定其菌液浓度。SAYJN菌株生长曲线的绘制以时间为横坐标、菌液的平均浓度为纵坐标。
1.7.2 温度对菌株生长的影响 参考Zhao等[17]的方法,按照1∶100的比例将SAYJN菌株种子菌液接种于BHI液体培养基中,每管终体积为5 mL,每个温度重复6管,分别于12、17、22、27、32、37、42、47 ℃静置培养,静置培养8 h后用麦氏比浊仪测定各管的菌液浓度。同时,为检测细菌的存活情况,分别在静置培养前后取100 μL SAYJN菌株的细菌培养液均匀涂布在无菌BHI平板上,37 ℃恒温培养箱中静置培养24 h,观察并记录细菌的存活情况。
1.7.3 pH对菌株生长的影响 参照谭爱萍等[18]的方法,分别配置pH为4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、10的BHI液体培养基,按照1:100的比例接种SAYJN菌株种子菌液,每管终体积为5 mL,每个pH重复6管,于37 ℃静置培养,8 h后测定各管的菌液浓度。细菌存活情况的检测同1.7.2。
1.7.4 盐度对菌株生长的影响 将BHI液体培养基分别配制成盐度为0‰、5‰、10‰、15‰、20‰、25‰、30‰、35‰、40‰、45‰、50‰、55‰、60‰,高压灭菌处理,然后按照1:100的比例接种SAYJN菌株种子菌液,每管终体积为5 mL,每个盐度重复6管,于37 ℃静置培养,8 h后测定各管的菌液浓度。细菌存活情况的检测同1.7.2。
1.8 病原菌的致病性1.8.1 腹腔注射病原菌对罗非鱼的致病性 将SAYJN菌株接种于无菌BHI液体培养基中,30 ℃、200 r/min振荡培养12 h后,12 000 r/min离心收集菌体,然后分别用0.65% 无菌生理盐水调整SAYJN菌液浓度为3×109、3×108、3×107、3×106、3×105 CFU/mL,共5个浓度。将50(±5)g健康罗非鱼随机分为6组,每组10尾,分别腹腔注射上述准备好的细菌菌液感染罗非鱼,每尾注射量为0.2 mL。其他操作同文献[16],每天记录试验鱼的死亡情况并观察其症状,连续观察7 d。SAYJN菌株的半数致死浓度(LC50)使用SPSS 22.0 for Windows软件辅助计算。
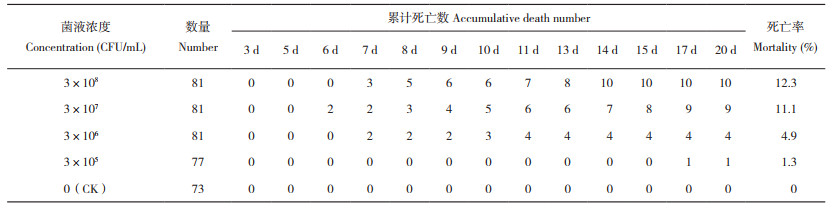
1.8.2 拌料口服病原菌对罗非鱼的致病性 参考1.8.1的方法分别制备浓度为3×108、3×107、3×106、3×105 CFU/mL的SAYJN菌液。然后分别按量加入相应饲料中混匀,每50 g鱼加0.1 mL菌液,每天饲喂量约为试验鱼体重的3%。每组3缸鱼,每缸27尾,共计81尾/组。投喂时,每次投喂量确保试验鱼可以快速吃完,尽量减少带有菌液的饲料在水体中悬浮的时间,连续观察20 d,每天记录其发病情况及记录死亡数,计算罗非鱼的感染死亡率。
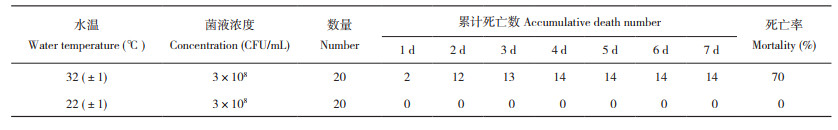
1.8.3 水温对病原菌致病性的影响 调整SAYJN菌液浓度为3×108 CFU/mL,参照文献[16]的方法,通过腹腔注射的方式感染健康罗非鱼,每尾的注射量为0.1 mL,试验鱼分为2组,每组20尾。将感染后的罗非鱼分别放入温度为32(±1)℃和22(±1)℃的水中,每天记录试验鱼的死亡情况,并观察其症状,连续观察7 d,统计并计算不同水温下试验鱼的死亡率。
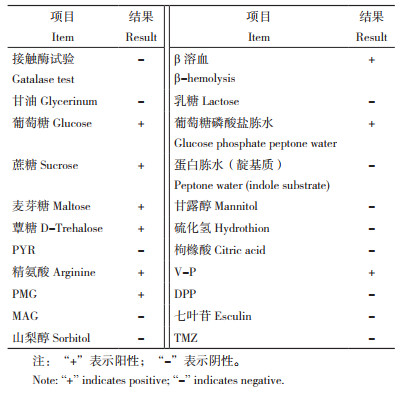
1.9 药物敏感试验选取11大类26种广谱抗菌药物,其中氨基糖苷类4种、β- 内酰胺类3种、四环素类3种、喹诺酮类3种、头孢类6种、磺胺类2种、酰胺醇类1种、大环内酯类1种、利福霉素类1种、林可胺类1种和多肽类1种。参照药敏纸片产品说明书,测定SAYJN菌株的抑菌圈直径,参照美国国家临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)标准[19]判断菌株的药物敏感性,药敏试验结果可判定为敏感(Sensitive,S)、耐药(Resistant,R)或中度敏感(Intermediate sensitives,I)。
1.10 数据统计分析试验数据表示为平均值±标准差(SD),使用GraphPad Prism 9软件绘制图表。
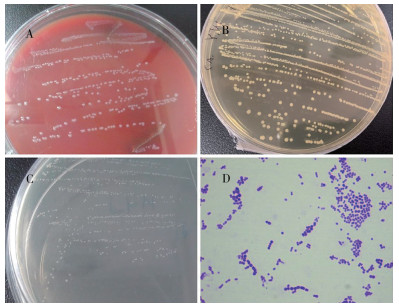
2 结果与分析 2.1 病原菌分离与鉴定从患病罗非鱼的肝脏、肾脏、脾脏和脑等组织中进行病原菌的分离培养,30 ℃恒温培养24h后,各组织在血平板上均有生长出形态一致、表面光滑、边缘整齐的乳白色菌落;从脑组织中分离纯化获得1株菌株,编号为SAYJN,该菌株在血平板和BHI平板上细菌生长较快、菌落较大(图 1A、1B),而在TSA营养培养基上则生长较慢、菌落较小(图 1C);革兰氏染色及光学显微镜观察显示,分离菌株为革兰氏阳性菌,菌体呈球形、排列成链状(图 1D)。
|
| A:5% 绵羊血平板;B:BHI固体培养基;C:TSA固体培养基; D:革兰氏染色结果(×1000) A: 5% sheep blood plate; B: BHI solid medium; C: TSA solid medium; D: Gram staining results (×1000) 图 1 病原菌的生长形态及革兰氏染色结果 Fig. 1 Growth morphology and Gram staining results of pathogenic bacteria |
2.2 病原菌的生理生化特性
SAYJN菌株接触酶试验结果为阴性,呈β溶血,非好氧条件下不发酵甘油,在蔗糖、麦芽糖、葡萄糖中产酸,不发酵乳糖、甘露醇,蛋白胨水(靛基质)、硫化氢、枸橼酸为阴性,蕈糖、葡萄糖磷酸盐胨水、V-P试验为阳性(表 1)。根据链球菌细菌生化编码鉴定试剂盒编码册判定标准以及结合伯杰细菌鉴定手册分析结果,初步判定SAYJN菌株为无乳链球菌。
2.3 16S rRNA基因序列分析和系统发育进化树构建
通过PCR扩增SAYJN菌株的16S rRNA基因,获得的片段长度为899 bp,经BLAST比对,发现与其无乳链球菌的同源性最高、达99.89%。系统进化树结果(图 2)显示SAYJN菌株与无乳链球菌聚为一类,进一步确定SAYJN菌株为无乳链球菌。
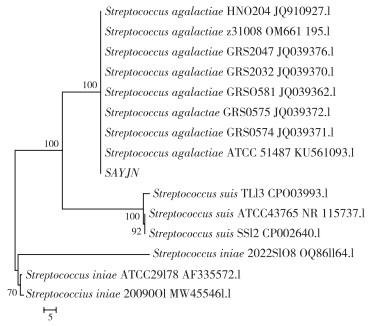
|
| 图 2 SAYJN菌株的系统发育进化树 Fig. 2 Phylogenetic tree constructed of SAYJN strain |
2.4 人工回归感染试验结果
自然发病的罗非鱼在池塘中表现出游动缓慢、体色变黑、打转、翻转(图 3A)、尾部和鳍部变色溃烂(图 3B)、单眼或双眼凸起(图 3C)、鳃盖充血(图 3D)等症状,解剖发现患病罗非鱼腹水较多(图 3E)、肝脏充血、胆囊肿大(图 3F)。通过腹腔注射SAYJN菌液的方式人工回归感染健康罗非鱼,感染后的罗非鱼表现出游姿平衡失调、翻滚、转圈、体色变黑、烂尾(图 3H)、腮盖充血(图 3G)、眼球凸起(图 3H)、肝脏充血、胆囊肿大(图 3I)等与自然发病罗非鱼相同的症状。从人工回归感染患病罗非鱼脑组织中分离出优势菌株,通过鉴定后确定该菌株是无乳链球菌,再次人工感染结果类似,证实此次罗非鱼发病的病原菌为无乳链球菌。

|
| A~F: 自然发病罗非鱼,表现为在池塘打转、体色变黑、呼吸急促、翻肚子(A);死亡后嘴巴扩张,尾巴、鱼鳍等部位出现变色溃烂状态(B);单眼或双眼凸起(C);腮盖充血(D);有腹水(E);胆囊肿大、肝脏充血(F);G~I:人工回归感染发病罗非鱼,表现为游动缓慢、体色变黑、打转、呼吸急促、翻肚子、眼球凸起(H);鳃盖充血(G);有腹水、胆囊肿大、肝脏充血(I) A-F: Naturally diseased tilapia, with symptoms of swirling in the pond, blackened body color, shortness of breath, stomach turning (A); Mouth expansion after death, discoloration and ulceration in the tail, fins and other parts (B); Bulging in one or both eyes (C); Congestion in gills (D); Ascites (E); Gall bladder enlargement and liver congestion (F); G-I: Artificially infected tilapia, with symptoms of slow swimming, blackened body color, spinning, rapid breathing, stomach rolling and eyeballs bulging (H); Gill cover congestion (G); Ascites, gall bladder enlargement and liver congestion (I) 图 3 自然发病与回归感染SAYJN菌株的罗非鱼症状 Fig. 3 Symptoms of tilapia with natural and artificial strain SAYJN |
2.5 SAYJN菌株的生长特性
2.5.1 生长曲线 SAYJN菌株的生长曲线如图 4所示。当培养温度为37 ℃时,SAYJN菌株生长良好,从结果中可看出该菌株的迟缓期为0~5 h,对数生长期为5~12 h。
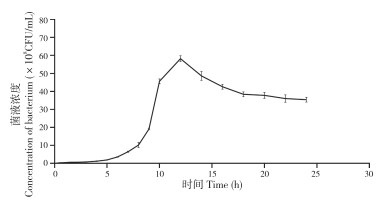
|
| 图 4 37℃时SAYJN菌株的生长曲线 Fig. 4 Growth curve of strain SAYJN at 37℃ |
2.5.2 温度、pH、盐度对SAYJN菌株生长的影响 如图 5A所示,SAYJN菌株在12~42 ℃的范围内均可生长,最适生长温度为37 ℃。培养8 h后,12~42 ℃条件下的BHI平板上均可培养出相似的单一菌落,47 ℃时不长出菌落,表明该菌株在47 ℃条件下时不生长。
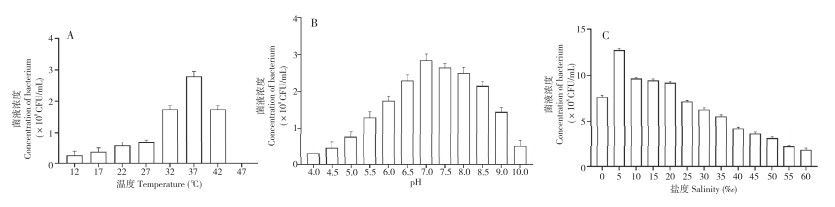
|
| 图 5 温度、pH、盐度对SAYJN菌株生长的影响 Fig. 5 Effects of temperature, pH and salinity on the growth of strain SAYJN |
SAYJN菌株在不同pH值的BHI平板上均可生长(图 5B),培养8h后也均可培养出相似的单一菌落,但pH值为10时,菌落形态明显较小。以上结果表明SAYJN菌株在pH 4.0~10.0的范围内均可生长,最适生长pH值为7.0。
SAYJN菌株在盐度为0‰~60‰ BHI液体培养基中均可生长,最适生长盐度为5‰,盐度高于40‰时生长较缓慢(图 5C)。
2.6 SAYJN菌株对罗非鱼的致病性由表 2可知,水温为29(±1)℃时,通过腹腔注射方式感染高浓度SAYJN菌液(3×109 CFU/mL)的罗非鱼在12 h内即出现死亡情况,7 d累计死亡率达100%;注射菌液浓度为3×108、3×107、3×106、3×105 CFU/mL的罗非鱼累计死亡率分别为60%、30%、10% 和10%,LC50为2.4×108 CFU/mL;对照组无死亡且无发病症状。
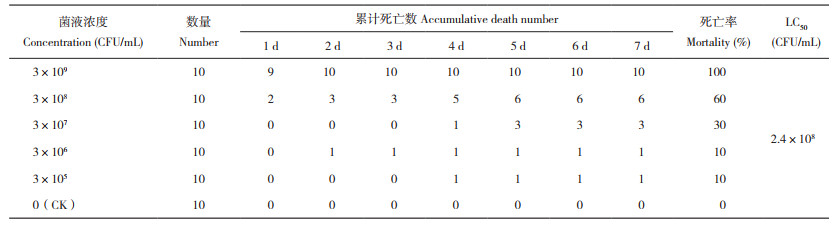
|
饲拌料口服菌液浓度为3×108、3×107、3×106、3×105 CFU/mL的罗非鱼累计死亡率分别为12.3%、11.1%、4.9% 和1.3%;连续投喂3 d,罗非鱼陆续出现体色变黑、游动缓慢、侧身翻转、眼球凸起等症状,对照组无死亡且无发病症状(表 3)。解剖发病鱼,可发现其胆囊肿大;从发病罗非鱼肝脏、脾脏、脑等组织中分离出优势菌株,经鉴定,各组织优势菌株均为无乳链球菌。
|
腹腔注射浓度为3×108 CFU/mL的SAYJN菌液感染健康罗非鱼,水温为32(±1)℃时,罗非鱼的死亡率达70%;而水温为22(±1)℃时,罗非鱼暂未出现死亡情况(表 4)。试验结束后解剖水温22(±1)℃组的罗非鱼,肝、脾等内脏未发现十分明显的病变症状,但从组织中能够分离到无乳链球菌。
|
2.7 SAYJN菌株的药物敏感性
药敏试验结果(表 5)显示,SAYJN菌株对氨基糖苷类(卡那霉素、庆大霉素、新霉素)、磺胺类(甲氧嘧啶、磺胺异噁唑)及多粘菌素B这6种药物具有耐药性,对喹诺酮类的恩诺沙星、环丙沙星、萘啶酸和氨基糖苷类的阿米卡星4种药物中度敏感,对β- 内酰胺类(阿莫西林、氨苄西林、青霉素)、四环素类(米诺环素、多西环素、四环素、)、头孢类(头孢氨苄、头孢曲松、头孢呋辛、头孢他啶、头孢西丁、头孢哌酮)、酰胺醇类(氟苯尼考)、大环内酯类(红霉素)、利福霉素类(利福平)及林可胺类(克林霉素)等16种药物敏感。
3 讨论
本研究从鹅-鱼立体养殖环境的患病罗非鱼中分离到SAYJN菌株,通过鉴定分析确定其为无乳链球菌,回归感染试验证明其是该养殖场罗非鱼发病的主要病原菌。无乳链球菌是一种人-畜-鱼共患的条件致病菌[20],可感染多种水生动物[21-23],对多种鱼类造成严重危害[24-27],其最敏感的宿主为罗非鱼。无乳链球菌感染罗非鱼的临床症状主要包括离群慢游、间歇性打转、食欲不振、体色发黑、眼球突起、出血、角膜白浊,且鳃盖下缘、胸鳍基部、体表呈现充血或斑块出血[28],这与本研究罗非鱼发病症状有共性。但本研究罗非鱼发病初期未见有突眼等典型症状,具有潜伏期长、发病急的特点,5—6月可持续发现个别罗非鱼离群,7—8月高温季节整个池塘的罗非鱼可在2~3 d内全部死亡,这与罗非鱼无乳链球菌病高温高发、传染性与暴发性强、死亡率高的特点相符[29]。在立体养殖模式中,畜禽的排泄物、残饵、废水会排放进养殖水体中,其携带多种病原菌、高浓度有机物和无机物,一旦超过水体的自净能力,会造成水产养殖动物的应激,使罗非鱼对病原菌的易感性增强。因此,在罗非鱼养殖过程中要加强水质、微生态环境的监测与预警,可通过建立化粪池等方式合理处理畜禽的粪便与残饵,避免引起病害爆发。
本研究中,无乳链球菌SAYJN菌株的生长特性与已报道的鱼源无乳链球菌的生长特性相似[30]。有研究表明,罗非鱼无乳链球菌病在水温低于26 ℃时几乎不发病;水温高于28 ℃时开始发病;当水温高于32 ℃时,极易暴发链球菌病[31],杂交鳢的研究中也发现相似情况[16],郭富强等[32]的研究结果也表明,养殖水温越高,无乳链球菌在罗非鱼体内的增殖速度越快,这与本研究结果相符。罗非鱼是温水性鱼类,最适生长水温为29~31 ℃,当水温超过其最适生长温度后会降低其免疫力,增加对病原菌的易感性[33-34]。因此,在高温季节,应提前预防无乳链球菌感染引起罗非鱼链球菌病。但菌株毒力涉及的影响因素诸多,如菌株的生长、代谢、毒力基因的表达等,SAYJN菌株在高温时毒力较强的详细机制仍有待进一步研究。
腹腔注射和拌料口服无乳链球菌SAYJN均能使罗非鱼感染发病,发病症状与自然发病罗非鱼的症状相似。在养殖场中,罗非鱼病的暴发一般在投喂饲料15 d左右后发生,推测养殖的罗非鱼可能通过口腔摄食携带有无乳链球菌的饲料或池塘里其他食物而被感染。无乳链球菌的主要致病机制是躲避吞噬细胞的免疫防御,部分细菌被粘附吞噬后可在巨噬细胞内存活、生长和繁殖,随巨噬细胞在体内游走、释放,扩散感染其他组织,并透过血-脑屏障,进一步损坏脑-神经系统[31]。Su等[35]研究也发现,无乳链球菌可在罗非鱼胃肠管腔内定植,并侵入宿主体内发展为全身感染。因此,在罗非鱼养殖过程,要注意饲料的质量,避免饲料被病原菌污染。
药物敏感性试验结果显示,无乳链球菌SAYJN菌株对磺胺类(甲氧苄啶和磺胺异恶唑)、氨基糖苷类(卡那霉素、庆大霉素、新霉素)和多粘菌素B产生耐药性,这可能与上述药物在水产养殖中使用普遍且时间较长有关。Liu等[36]发现广东地区罗非鱼养殖场分离的75株无乳链球菌均存在多重耐药性。郭长明等[10]认为在鱼禽混养特别是多种鱼共患细菌病时可能投入更多种类的抗菌药,使无乳链球菌多重耐药现象更严重。在鹅养殖中,通常会使用大环内酯类(红霉素)、氟喹诺酮类(氧氟沙星)阿莫西林、头孢克肟等药物治疗鹅链球菌病[37]。但SAYJN菌株对多西环素、四环素、氟苯尼考、红霉素、阿莫西林等药物仍具有较强敏感性,这可能与该养殖场的用药种类和频次相关。此外,周萌等[4]研究表明立体养殖池塘中不同样品的菌群组成在属水平差异较大。因此在水产养殖高温季节可使用多西环素、四环素、氟苯尼考、红霉素等进行罗非鱼链球菌病防控;在实际用药时可根据需要,选择合适的抗生素进行防治。
4 结论本研究通过生理生化、分子鉴定和回归感染等方法确定无乳链球菌SAYJN菌株是鹅-鱼立体养殖环境下罗非鱼病的主要病原菌。该菌株的最适生长温度为37 ℃,最适生长pH为7.0,最适生长盐度为5 ‰。回归感染试验发现,腹腔注射和拌料口服SAYJN菌株的方式均能使健康罗非鱼患病,32(±1)℃时SAYJN菌株可使健康罗非鱼感染发病死亡,而22(±1)℃下感染的健康罗非鱼未见发病情况;高浓度(3×108 CFU/mL)菌液对健康罗非鱼的致死率远高于低浓度(3×105 CFU/mL)菌液,表明SAYJN菌株的致病性与其生长特性、养殖水温、菌液浓度等密切相关。药物敏感性试验结果表明该菌株对氨基糖胺类、磺胺类药物产生耐药性,对喹诺酮类药物中度敏感,对氟苯尼考、多西环素、新霉素等抗菌药敏感。
| [1] |
王祖峰, 张博远, 黄太寿, 周玲, 刘天密. 我国罗非鱼养殖的主要模式及发展前景浅析[J]. 中国水产, 2022(5): 50-53. WANG Z F, ZHANG B Y, HUANG T S, ZHOU L, LIU T M. Analysis of main models and development prospects of tilapia culture in China[J]. China Fisheries, 2022(5): 50-53. |
| [2] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2024中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2024. Ministry of Agriculture and Rural Affairs of the People's Republic of China, Fisheries Administration, National Fisheries Technology Extension Center, China Society of Fisheries. 2024 China fishery statistical yearbook[M]. Beijing: China Agriculture Press, 2024. |
| [3] |
袁媛, 袁永明, 代云云, 龚赟翀. 2011—2015年我国罗非鱼池塘养殖模式生产成本变动分析[J]. 广东农业科学, 2016, 43(11): 184-192. DOI:10.16768/j.issn.1004-874X.2016.11.027 YUAN Y, YUAN Y M, DAI Y Y, GONG Y C. Variation analysis on production cost of tilapia pond culture in China during 2011—2015[J]. Guangdong Agricultural Sciences, 2016, 43(11): 184-192. DOI:10.16768/j.issn.1004-874X.2016.11.027 |
| [4] |
周萌, 莫金凤, 林蠡, 黄运茂, 吴灶和, 蓝中东, 陈愿, 刘家志. 鹅-鱼立体养殖环境的菌群特征研究[J]. 仲恺农业工程学院学报, 2019, 32(2): 41-48, 70. DOI:10.3969/j.issn.1674-5663.2019.02.009 ZHOU M, MO J F, LIN L, HUANG Y M, WU Z H, LAN Z D, CHEN Y, LIU J Z. Bacterial features in goose-tilapia polyculture environments[J]. Journal of Zhongkai University of Agriculture and Engineering, 2019, 32(2): 41-48, 70. DOI:10.3969/j.issn.1674-5663.2019.02.009 |
| [5] |
YE X, LI J, LU M X, LU M X, DENG G C, JIANG X Y, TIAN Y Y, QUAN Y C, JIAN Q. Identification and molecular typing of Streptococcus agalactiae isolated from pond-cultured tilapia in China[J]. Fisheries Science, 2011, 77(4): 623-632. DOI:10.1007/s12562-011-0365-4 |
| [6] |
ZHANG F L, YANG L, HE W H, XIE L J, YANG F, WANG Y H, HUANG A G. In vivo antibacterial activity of medicinal plant Sophora flavescens against Streptococcus agalactiae infection[J]. Journal of Fish Diseases, 2023, 46(9): 977-986. DOI:10.1111/JFD.13818 |
| [7] |
马渭青, 赵旦华, 程皇座, 崔红霞, 李满雨, 赵秀华, 刘国君, 许丽. 营养及环境对母鹅繁殖性能影响的研究进展[J]. 中国家禽, 2018, 40(12): 43-47. DOI:10.16372/j.issn.1004-6364.2018.12.010 MA W Q, ZHAO D H, CHENG H Z, CUI H X, LI M Y, ZHAO X H, LIU G J, XU L. Effects of nutrition and environment on reproductive performance of geese[J]. China Poultry, 2018, 40(12): 43-47. DOI:10.16372/j.issn.1004-6364.2018.12.010 |
| [8] |
张祥, 黄瑜, 蔡佳, 简纪常, 王蓓. miRNA-155靶向SOCS5对无乳链球菌诱导罗非鱼脑星形胶质细胞炎症的影响[J]. 广东海洋大学学报, 2023, 43(2): 1-10. DOI:10.3969/j.issn.1673-9159.2023.02.001 ZHANG X, HUANG Y, CAI J, JIAN J C, WANG B. Effect of miRNA-155-targeted SOCS5 gene on inflammatory response of brain astrocytes of Oreochromis niloticus induced by Streptococcus agalactiae[J]. Journal of Guangdong Ocean University, 2023, 43(2): 1-10. DOI:10.3969/j.issn.1673-9159.2023.02.001 |
| [9] |
BARKHAM T, ZADOKS R N, AZMAI M N A, BAKER S, BICH V T N, CHALKER V, CHAU M L, DANCE D, DEEPAK R N, DOORN H R C, GUTIERREZ R A, HOLMES M A, HUONG L N P, KOH T H, MARTINS E, MEHERSHAHI K, NEWTON P, HG L C, PHUOC N N, SANGWICHIAN O, SAWATWONG P, SURIN U, TAN T Y, TANG W Y, THUY N V, TURNER P, VONGSOUVATH M, ZHANG D F, WHISTLER T, CHEN S L. One hypervirulent clone, sequence type 283, accounts for a large proportion of invasive Streptococcus agalactiae isolated from humans and diseased tilapia in Southeast Asia[J]. PLoS Neglected Tropical Diseases, 2019, 31(6): e0007421. DOI:10.1371/journal.pntd.0007421 |
| [10] |
郭长明, 陈怀君, 袁橙, 袁圣, 贾国华, 王义仁, 朱善元. 广东罗非鱼无乳链球菌分离鉴定及生物学特性分析[J]. 中国动物传染病学报, 2024, 32(2): 73-82. DOI: 10.19958/j.cnki.cn31-2031/s.20220324.002. GUO C M, CHEN H J, YUAN C, JIA G H, WANG Y R, ZHU S Y. Isolation, identification and characterization of Streptococcus Agalactiae from tilapia in Guangdong[J]. Chinese Journal of Animal Infectious Diseases, 2024, 32(2): 73-82. DOI: 10.19958/j.cnki.cn31-2031/s.20220324.002. |
| [11] |
陈怀君, 郭长明, 朱善元, 吴植, 袁圣, 王永娟, 袁橙, 潘勇, 王晓晔. 海南罗非鱼源无乳链球菌的分离鉴定及生物学特性研究[J]. 中国畜牧兽医, 2021, 48(8): 3058-3068. DOI:10.16431/j.cnki.1671-7236.2021.08.039 CHEN H J, GUO C M, ZHU S Y, WU Z, YUAN S, WANG Y J, YUAN C, PAN Y, WANG X Y. Isolation, identification and biological characteristics of Streptococcus agalactiae from tilapia in Hainan[J]. China Animal Husbandr y & Veterinary Medicine, 2021, 48(8): 3058-3068. DOI:10.16431/j.cnki.1671-7236.2021.08.039 |
| [12] |
王爱媛, 郑立新, 蒲文渊, 杨诺, 曾纪锋, 郭桂英, 李迁, 郑继平. 海南无乳链球菌的毒力基因与耐药特性分析[J]. 水产科学, 2020, 39(1): 117-123. DOI:10.16378/j.cnki.1003-1111.2020.01.015 WANG A Y, ZHENG L X, PU W Y, YANG N, ZENG J F, GUO G Y, LI Q, ZHENG J P. Virulence genes and drug resistance of pathogen Streptococcus agalactiae in Hainan[J]. Fisheries Science, 2020, 39(1): 117-123. DOI:10.16378/j.cnki.1003-1111.2020.01.015 |
| [13] |
郭长明, 陈怀君, 袁橙, 罗福广, 黄德生, 贾国华, 袁圣, 朱善元. 广西罗非鱼无乳链球菌的分离鉴定、毒力基因及耐药性研究[J]. 中国畜牧兽医, 2021, 48(7): 2607-2616. DOI:10.16431/j.cnki.1671-7236.2021.07.037 GUO C M, CHEN H J, YUAN C, LUO F G, HUANG D S, JIA G H, YUAN S, ZHU S Y. Isolation, identification, virulence genes and antibiotic resistance analysis of Streptococcus agalactiae from tilapia in Guangxi[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(7): 2607-2616. DOI:10.16431/j.cnki.1671-7236.2021.07.037 |
| [14] |
袁橙, 陈怀君, 袁圣, 温华茂, 陈智怡, 董洪燕, 封琦, 郭长明. 福建省漳州市罗非鱼无乳链球菌分离鉴定及毒力基因和耐药性研究[J]. 中国畜牧兽医, 2022, 49(9): 3655-3664. DOI:10.16431/j.cnki.1671-7236.2022.09.039 YUAN C, CHEN H J, YUAN S, WEN H M, CHEN Z Y, DONG H Y, FENG Q, GUO C M. Isolation, identification and study on virulence gene and drug resistance of Streptococcus agalactiae from tilapia in Zhangzhou City, Fujian Province[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(9): 3655-3664. DOI:10.16431/j.cnki.1671-7236.2022.09.039 |
| [15] |
陈杨慧, 张素莹, 黄永雄, 张子瑞, 王蓓. 尼罗罗非鱼claudin-5基因克隆及其在无乳链球菌胁迫下的表达分析[J/OL]. 广东农业科学, 1-11[2024-08-14]. https://link.cnki.net/urlid/44.1267.S.20240222.1625.018. CHEN Y H, ZHANG S Y, HUANG Y W, ZHANG Z R, WANG B. Cloning of claudin-5 gene from Oreochromis niloticus and expression analysis under Streptococcus agalactiae[J]. Guangdong Agricultural Sciences, 1-11[2024-08-14]. https://link.cnki.net/urlid/44.1267.S.20240222.1625.018. |
| [16] |
莫金凤, 姜兰, 吴灶和. 乌鳢源舒伯特气单胞菌生物学特性及其药物敏感性分析[J]. 水产学报, 2016, 40(3): 484-494. DOI:10.11964/jfc.20160110250 MO J F, JIANG L, WU Z H. Biological characteristics and drug susceptibility of Aeromonas schubertii WL-4 isolated from snakehead[J]. Journal of Fisheries of China, 2016, 40(3): 484-494. DOI:10.11964/jfc.20160110250 |
| [17] |
ZHAO F, HE S, TAN A P, GUO X Z, JIANG L, LIU F C, DENG Y T, ZHANG R Q. Isolation, identification and character analysis of Streptococcus dysgalactiae from Megalobrama terminalis[J]. Journal of Fish Diseases, 2020, 43(2): 239-252. DOI:10.1111/jfd.13119 |
| [18] |
谭爱萍, 赵飞, 郭忠宝, 邓玉婷, 张瑞泉, 戴迎迢, 黄志斌, 姜兰. 大口黑鲈白皮病病原菌的分离鉴定及药物敏感性试验[J]. 微生物学通报, 2022, 49(5): 1741-1758. DOI:10.13344/j.microbiol.china.210866 TAN A P, ZHAO F, GUO Z B, DENG Y T, ZHANG R Q, LAI Y S, HUANG Z B, JIANG L. Isolation, identification, and antimicrobial susceptibility test of the pathogen from largemouth bass (Micropterus salmoides) with white skin disease[J]. Microbiology China, 2022, 49(5): 1741-1758. DOI:10.13344/j.microbiol.china.210866 |
| [19] |
Clinical and Laboratory Standards Institute. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria: M2-A7[M]. Wayne, Pennsylvania, USA: Clinical and Laboratory Standards Institute, 2010.
|
| [20] |
黎源, 王蓓, 汪志文, 蔡小辉, 汤菊芬, 鲁义善, 简纪常. 罗非鱼无乳链球菌传播途径与逃避宿主免疫防御策略[J]. 广东农业科学, 2017, 44(7): 132-140. DOI:10.16768/j.issn.1004-874X.2017.07.021 LI Y, WANG B, WANG Z W, CAI X H, TANG J F, LU Y S, JIAN J C. Transmission routes of Streptococcus agalactiae and the strategy of immune evasion in tilapia[J]. Guangdong Agricultural Sciences, 2017, 44(7): 132-140. DOI:10.16768/j.issn.1004-874X.2017.07.021 |
| [21] |
GIRIJAN S K, KRISHNAN R, MANIYAPPAN K, PILLAI D. Isolation and identification of Streptococcus agalactiae in cage-cultured green chromide Etroplus suratensis in Kerala, India[J]. Diseases of Aquatic Organisms, 2023(5): 154. DOI:10.3354/DAO03726 |
| [22] |
CAI X H, PENG Y H, WANG Z C, HUANG T, XIONG X Y, HUANG Y C, WANG B, XU L W, WU Z H. Characterization and identification of streptococci from golden pompano in China[J]. Diseases of Aquatic Organisms, 2016, 119(3): 207-217. DOI:10.3354/dao02998 |
| [23] |
袁橙, 陈怀君, 袁圣, 温华茂, 陈智怡, 董洪燕, 封琦, 郭长明. 福建省漳州市罗非鱼无乳链球菌分离鉴定及毒力基因和耐药性研究[J]. 中国畜牧兽医, 2022, 49(9): 3655-3664. DOI:10.16431/j.cnki.1671-7236.2022.09.039 YUAN C, CHEN H J, YUAN S, WEN H M, CHEN Z Y, DONG H Y, FENG Q, GUO C M. Isolation, identification and study on virulence gene and drug resistance of Streptococcus agalactiae from tilapia in Zhangzhou City, Fujian Province[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(9): 3655-3664. DOI:10.16431/j.cnki.1671-7236.2022.09.039 |
| [24] |
蔺凌云, 潘晓艺, 姚嘉赟, 尹文林, 曹铮, 刘忆瀚, 沈锦玉. 光唇鱼源无乳链球菌的分离鉴定及遗传特征[J]. 微生物学报, 2021, 61(10): 3159-3172. DOI:10.13343/j.cnki.wsxb.20200758 LAN L Y, PAN X Y, YAO J Y, YIN W L, CAO Z, LIU Y H, SHEN J Y. Identification and genetic characterization of Streptococcus agalactiae isolated from Acrossocheilus fasciatus cultured in Zhejiang[J]. Acta Microbiologica Sinica, 2021, 61(10): 3159-3172. DOI:10.13343/j.cnki.wsxb.20200758 |
| [25] |
RAHMAN M M, RAHMAN M A, MONIR M S, HAQUE M E, SIDDIQUE P S, KHASRUZZAMAN A K M, RAHMAN M T, ISLAM M A. Isolation and molecular detection of Streptococcus agalactiae from popped eye disease of cultured tilapia and Vietnamese koi fishes in Bangladesh[J]. Journal of Advanced Veterinary and Animal Research, 2021, 8(1): 14-23. DOI:10.5455/javar.2021.h480 |
| [26] |
赵长臣, 江小燕, 刘春花, 张德峰, 罗霞, 曾伟伟, 陈总会, 黄志斌. 一株梭鲈源无乳链球菌的分离、鉴定及分子分型分析[J]. 淡水渔业, 2018, 48(3): 61-67. DOI:10.13721/j.cnki.dsyy.2018.03.009 ZHAO C C, JIANG X Y, LIU C H, ZHANG D F, LUO X, ZENG W W, CHEN Z H, HUANG Z B. Identification, characterizations and molecular subtyping analysis of a Streptococcus agalactiae isolated from Lucioperca lucioperca[J]. Freshwater Fisheries, 2018, 48(3): 61-67. DOI:10.13721/j.cnki.dsyy.2018.03.009 |
| [27] |
刘礼辉, 张德锋, 李宁求, 石存斌, 颜曦, 付小哲, 林强. 鲮鱼源无乳链球菌的鉴定、血清型分析及药敏试验[J]. 南方农业学报, 2015, 46(11): 2053-2058. DOI:10.3969/j.issn.2095-1191.2015.11.2053 LIU L H, ZHANG D F, LI N Q, SHI C B, YAN X, FU X Z, LIN Q. Identification, serotype analysis and drug sensitivity test of Streptococcus agalactiae from Cirrhinus molitorella[J]. Journal of Southern Agriculture, 2015, 46(11): 2053-2058. DOI:10.3969/j.issn.2095-1191.2015.11.2053 |
| [28] |
苏友禄, 刘婵, 邓益琴, 郭志勋, 冯娟. 罗非鱼无乳链球菌病的研究进展[J]. 大连海洋大学学报, 2019, 34(5): 757-766. DOI:10.16535/j.cnki.dlhyxb.2018-231 SU Y L, LIU C, DENG Y Q, GUO Z X, FENG J. Research on Streptococcus agalactiae disease in tilapia: A review[J]. Journal of Dalian Ocean University, 2019, 34(5): 757-766. DOI:10.16535/j.cnki.dlhyxb.2018-231 |
| [29] |
施金谷, 黄珊珊, 黄基伟, 陈坤海, 胡大胜, 朱志雄, 韩书煜. 高温胁迫下罗非鱼源无乳链球菌的比较转录组分析[J]. 中国畜牧兽医, 2023, 50(6): 2207-2216. DOI:10.16431/j.cnki.1671-7236.2023.06.004 SHI J G, HUANG S S, HUANG J W, CHEN K H, HU D S, ZHU Z X, HAN S Y. Comparative transcriptome analysis of Streptococcus agalactiae from tilapia under high temperature stress[J]. China Animal Husbandry and Veterinary Medicine, 2023, 50(6): 2207-2216. DOI:10.16431/j.cnki.1671-7236.2023.06.004 |
| [30] |
陈贺, 吴灶和, 王蓓, 黄郁葱, 鲁义善, 简纪常. 罗非鱼源无乳链球菌培养基及培养条件的优化[J]. 广东海洋大学学报, 2012, 32(3): 49-54. CHEN H, WU Z H, WANG B, HUANG Y C, LU Y S, JIAN J C. Optimal culture conditions and medium of Streptococcus agalactiae isolated from tilapia[J]. Journal of Guangdong Ocean University, 2012, 32(3): 49-54. |
| [31] |
RODKHUM C, KAYANSAMRUAJ P, PIRARAT N. Effect of water temperature on susceptibility to Streptococcus agalactiae serotype Ⅰ infection in Nile tilapia (Oreochromis niloticus)[J]. Thai Journal of Veterinary Medicine, 2011, 41(3): 309-314. DOI:10.56808/2985-1130.2314 |
| [32] |
郭富强. 温度对罗非鱼无乳链球菌致病机制影响的研究[D]. 上海: 上海海洋大学, 2018. GUO F Q. The mechanism of influence of different water temperature on Streptococcus agalactiae infection in tilapia[D]. Shanghai: Shanghai Ocean University, 2018. |
| [33] |
ZHAO X L, HAN Y, REN S T, MA Y M, LI H, PENG X X. L-proline increases survival of tilapias infected by Streptococcus agalactiae in higher water temperature[J]. Fish & Shellfish Immunology, 2015, 44(1): 33-42. DOI:10.1016/j.fsi.2015.01.025 |
| [34] |
SEPAHI A, HEIDARIEH M, MIRVAGHEFI A, RAFIEE G R, FARID M, SHEIKHZADEH N. Effects of water temperature on the susceptibility of Rainbow Trout to Streptococcus agalactiae[J]. Acta Scientiae Veterinariae, 2013, 41(1): 741-744. |
| [35] |
SU Y L, FENG J, LIU C, LI W, XIE Y D, LI A X. Dynamic bacterial colonization and microscopic lesions in multiple organs of tilapia infected with low and high pathogenic Streptococcus agalactiae strains[J]. Aquaculture, 2017, 471: 190-203. DOI:10.1016/j.aquaculture.2017.01.013 |
| [36] |
LIU C, FENG J, ZHANG D F, XIE Y D, LI A X, WANG J Y, SU Y L. Clustering analysis of antibiograms and antibiogram types of Streptococcus agalactiae strains from tilapia in China[J]. Microbial Drug Resistance, 2018, 24(9): 1431-1439. DOI:10.1089/mdr.2017.0350 |
| [37] |
严梦羽, 丁晓, 林钟鸣, 唐悦. 鸭、鹅链球菌病和念珠菌病的分析、诊断和防治方案[J]. 现代畜牧科技, 2019(2): 117-118. DOI:10.19369/j.cnki.2095-9737.2019.02.061 YAN M YM, DING X, LIN Z M, TANG Y. Analysis, diagnosis and control of streptococcal disease and candidiasis in ducks and geese[J]. Modern Animal Husbandry Science and Technology, 2019(2): 117-118. DOI:10.19369/j.cnki.2095-9737.2019.02.061 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51