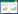文章信息
基金项目
- 国家重点研发计划项目(2020YFD0900201);中山市社会公益与基础研究项目(2021B2056)
作者简介
- 何雪雯(1998—),女,在读硕士生,研究方向为水生动物疫病防控,E-mail:578001229@qq.com.
通讯作者
- 鲁义善(1974—),男,博士,教授,研究方向为水生动物病害防控,E-mail:fishdis@163.com; 喻大鹏(1992—),男,博士,工程师,研究方向为水生动物病害防控,E-mail:994137672@qq.com.
文章历史
- 收稿日期:2024-05-27
2. 广东海洋大学深圳研究院,广东 深圳 518120
2. Shenzhen Institute of Guangdong Ocean University, Shenzhen 518120, China
【研究意义】大口黑鲈(Micropterus salmoides)又名加州鲈,是一种广温性、肉食性淡水鱼类[1],属太阳鱼科(Centrachidae)、黑鲈属(Micropterus),原产自北美,20世纪80年代引入中国后,因其肉质鲜美、营养丰富等优点,市场需求量不断增加,从而成为国内主流养殖品种之一[2-3],并逐渐形成一系列较为完善的产业链。据《中国渔业年鉴》统计,2009年全国的大口黑鲈年产量约17.5万t[4],到2023年该产量约24.69万t,涨幅达41%。而随着养殖密度的不断增加、水体环境的恶化及病原微生物的滋生传播,有关大口黑鲈疾病的研究日益增多。【前人研究进展】大口黑鲈易患多种细菌性、病毒性、寄生虫疾病。目前,常见可危害大口黑鲈的细菌病原菌包括鰤诺卡氏菌(Nocardia seriolae)、维氏气单胞菌(Aeromonas veronii)等[5];病毒包括虹彩病毒科蛙病毒(Ranavirus,Rana)、肿大细胞病毒(Megalocytivirus,Mega)及弹状病毒科弹状病毒(Rhabdovirus,Rhab)等[6];寄生虫疾病主要由小瓜虫(Ichthyophthirius multifiliis)、车轮虫(Trichodinid)[7]、杯体虫(Apiosoma)、斜管虫(Chilodonella)等引起。近年来,大口黑鲈疾病频发,2022年广东珠三角地区的大口黑鲈因感染杀鱼爱德华氏菌(Edwardsiella piscicida)而产生大规模死亡[8];2023年湖南省醴陵市某大口黑鲈工厂化养殖场中的大口黑鲈因细菌感染引发烂身病[9]。因此,加强对该病的防控研究,是目前迫切解决的一大课题。
维氏气单胞菌隶属于气单胞菌科(Aeromonadaceae)、气单胞菌属(Aeromonas),该菌于1983年确定为气单胞菌属的一个新种,后为纪念法国微生物学家Veron而命名为维氏气单胞菌[10]。维氏气单胞菌广泛分布于自然界各处,包括淡水、海洋、土壤和淤泥等环境,并已被证实为人- 兽共患菌[11]。近年来,水产经济动物感染维氏气单胞菌的报道逐渐增多,包括鱼、虾、蟹、龟等种类,严重时还会发生集体死亡的情况[12]。康元环等[12]和邓龙君[13]发现,凡纳滨对虾(Litopenaeus vannamei)、中华绒螯蟹(Eriocheir sinensis)等动物均会被维氏气单胞菌感染而引起出血或体表溃疡等病症。郝成森等[14]发现在水生动物中,大口黑鲈、锦鲤(Cyprinus carpio)、草鱼(Ctenopharyngodon idella)、中华鳖(Pelodiscus sinensis)、中华绒鳌蟹、中国大鲵(Andrias davidianus)等均有被维氏气单胞菌感染的报道,受感染鱼类的临床症状通常包括溃疡、腹胀、眼球突出和出血。人一旦食用被维氏气单胞菌污染的水产品后,可引起胃肠炎和败血症等疾病[15],甚至可能导致免疫力低下者死亡[13]。
【本研究切入点】目前,已有维氏气单胞菌感染大口黑鲈患病致死的研究[16],尚未见大口黑鲈致病性维氏气单胞菌菌株毒力基因和耐药基因分析的报道。【拟解决的关键问题】本文对患病大口黑鲈进行病原菌分离鉴定,通过对相关毒力基因和耐药基因检测以及抗生素药物敏感性的测定,以期查明大口黑鲈中维氏气单胞菌毒力基因携带和耐药特性,为其养殖生产中防控维氏气单胞菌提供参考。
1 材料与方法 1.1 试验材料2023年12月,在广东湛江市某大口黑鲈养殖渔厂收集体表红肿、患病濒死的大口黑鲈样品,取样个体体长为7~10 cm,体重约100 g,用样品袋带回实验室鉴定。
1.2 试验方法1.2.1 病原菌分离纯化 参考赵浩航等[3]方法,将患病濒死的大口黑鲈解剖,无菌操作从病鱼显著病变肠道、肝脏等部位取样,划线接种于LB琼脂平板上,28 ℃恒温培养18~24 h后,挑取单菌落纯化培养,观察菌落生长形态特质,然后挑取形状、大小、颜色均匀一致的优势单个菌落再次接种于LB培养基进行纯化培养,暂命名为MSB-2,并观察菌落与细菌形态特征。纯化后的菌株于4 ℃下保存备用。
1.2.2 病原菌形态观察及生理生化特征测定 根据革兰氏染色试剂盒操作说明书对分离菌进行染色。先在平板上挑取单菌落于载玻片上固定,滴加A液(草酸铵结晶紫染色液)静置1 min,水洗;滴加B液(碘液)静置1 min,水洗;滴加95% 酒精脱色,该过程约45 s,水洗,吸干水分;最后滴加D液(蕃红)静置1 min,水洗,自然晾干。将载玻片放置在100倍油镜下观察细菌形态及染色特征,并拍照保存。
将纯化后的病原菌在LB琼脂平板上划线,28 ℃过夜培养,参考《常见细菌系统鉴定手册》,使用杭州滨和微生物试剂有限公司的细菌微量生化反应管,进行各项生理生化指标的测定。
1.2.3 病原菌16S rRNA基因序列测定及系统发育学分析 取新鲜菌液,采用通用引物进行PCR扩增。PCR反应程序:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共30次循环;最后,72 ℃延伸10 min。取5 μL产物经1.5% 的琼脂糖凝胶电泳检测,检验出明显条带后,将PCR产物送至生工生物工程(上海)股份有限公司测序。将分离菌株的16S rRNA基因序列与GenBank数据库中已有气单胞菌属的序列进行BLAST比对,使用MEGA 11软件构建系统发育树。
1.2.4 病原菌药敏试验 根据K-B纸片扩散法,将分离菌株MSB-2制成菌悬液,取100 μL滴在LB琼脂培养基上,用一次性涂布棒均匀抹开,然后用无菌镊子分别将24种抗菌药物的药敏纸片放置在培养基表面,于28 ℃下倒置培养12~18 h后测量各药敏纸片对应的抑菌圈直径。每种药物平行重复3次,确定分离菌株对药物的敏感性。
1.2.5 病原菌毒力基因及耐药基因检测 以MSB-2菌液DNA为模板,对10种维氏气单胞菌毒力基因(act、ast、aer、alt、hlyA、lip、aexT、ser、ahyB、exu)和10种维氏气单胞菌的耐药基因(tem、ctxM、tetC、tetA、linA、sull、qnrA、qnrS、catA2和ermB)进行PCR扩增,引物序列见表 1。
1.2.6 病原菌回归感染 将若干健康大口黑鲈分为试验组和空白组,试验组设置3个重复。各组在相同的塑料桶中随机放养10尾试验鱼,每日投喂1次饲料。试验鱼经7 d暂养后,以注射方式进行人工感染。试验组的每尾大口黑鲈注射0.1 mL活菌液(浓度为1×108 CFU/mL),空白组则注射接种相同剂量的无菌PBS。人工感染后连续观察7 d,记录试验鱼的发病症状及死亡情况,并对死亡的大口黑鲈进行解剖和病原菌的再分离,验证其死亡是否由人工感染菌株引起。
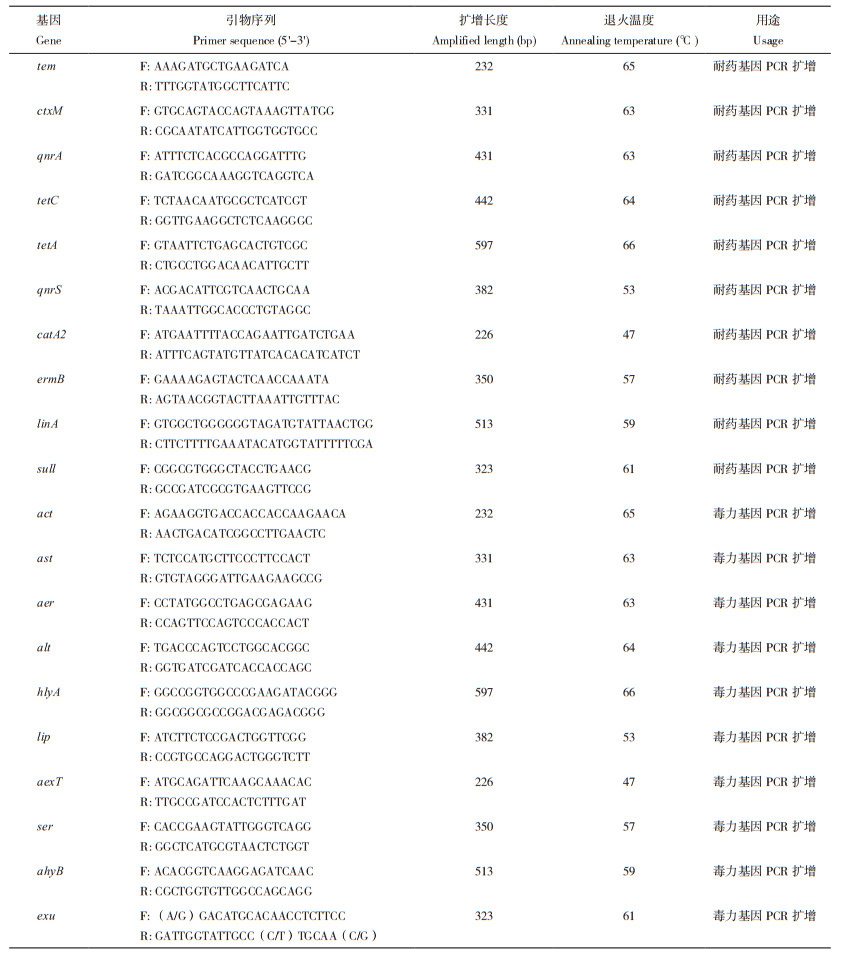
2 结果与分析 2.1 患病大口黑鲈中病原菌的形态及生理生化等特征由图 1可知,MSB-2菌落为圆形、表面光滑呈乳白色、不透明、微隆起。经细菌革兰氏染色染色后,发现该菌呈红色杆状(图 1A),初步判定其为革兰氏阴性菌。
|
| 图 1 MSB-2的革兰氏染色(A)形态及纯化平板结果(B) Fig. 1 Gram staining morphology (A) and purified plate results (B) of MSB-2 |
从表 2可以看出,该菌能分解色氨酸,能利用葡萄糖产酸,对赖氨酸脱羧酶生化反应结果为阳性,但对苯丙氨酸、鸟氨酸脱羧酶、西蒙氏枸橼酸盐、尿素、硫化氢、β- 半乳糖苷酶、棉子糖、阿拉伯糖、山梨醇、侧金盏花醇生化反应结果为阴性。由此,结合《常见细菌系统鉴定手册》,可初步确定分离菌株为气单胞菌属。
2.2 患病大口黑鲈中病原菌的分子生物学鉴定分析
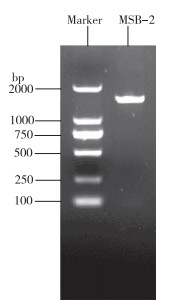
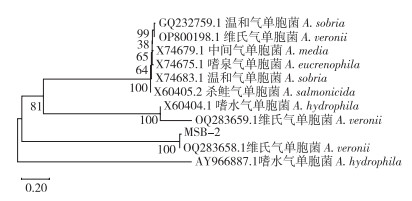
从图 2可以看出,菌株MSB-2的16S rRNA基因经PCR扩增和电泳检测可知序列长度约为1 500 bp,将获得的序列进行BLAST同源性比对,发现MSB-2的16S rRNA序列与维氏气单胞菌菌株等序列的相似性均为99.93%。进一步构建系统发育进化树,结果(图 3)显示,菌株MSB-2与维氏气单胞菌的亲缘关系最近,可判断出病原菌MSB-2为维氏气单胞菌。
|
| 图 2 菌株MSB-2 16S rRNA基因PCR扩增结果 Fig. 2 16S rRNA gene PCR amplification result of MSB-2 |
|
| 图 3 MSB-2 16S rRNA基因序列的系统发育树 Fig. 3 Phylogenetic tree of 16S rRNA gene sequences of MSB-2 |
2.3 患病大口黑鲈中病原菌的药敏特性分析
根据药敏纸片测定的抑制圈直径评估分离菌株MSB-2对24种抗菌药物的敏感性,结果如表 3所示,MSB-2对氨苄西林、苯唑西林、红霉素、青霉素、妥布霉素、卡那霉素、万古霉素、丁胺卡那、链霉素、四环素、氯霉素具有耐药性,对羧苄西林、多西环素、头孢氨苄、新霉素、庆大霉素、头孢拉定、米诺环素、头孢唑林中度敏感,对头孢哌酮、哌拉西林、头孢曲松、头孢他啶、头孢呋辛高度敏感。
2.4 患病大口黑鲈中病原菌毒力基因及耐药基因检测结果
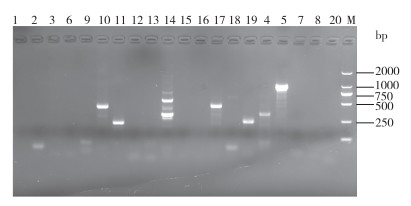
毒力基因检测结果如图 4显示,在10种毒力基因中,有3种(act、aer、aexT)可从菌株MSB-2中扩增到单一的阳性条带,且与预期片段长度相符,有7种(ast、alt、hlyA、lip、ser、ahyB、exu)未检测到阳性条带。
|
| 1-3: tem, ctxM, qnrA; 6: qnrS; 9-19: linA, sull, aexT, lip, ser, ahyB, exu, ast, aer, alt, act; 4-5: tetC, tetA; 7-8: catA2, ermB; 20: hlyA; M: Marker 图 4 MSB-2毒力及耐药基因检测 Fig. 4 Virulence and resistance gene test of MSB-2 |
耐药基因检测结果如图 4显示,在10种耐药基因中,有3种(tetC、tetA、sull)可从菌株MSB-2中扩增到单一的阳性条带,且与预期片段长度相符,有7种(tem、ctxM、qnrA、qnrS、catA2、ermB、linA)未检测到阳性条带。
2.5 人工回归感染试验分析人工回归感染试验显示,对照组未见异常,试验组出现死亡情况,感染后发病的大口黑鲈出现呆滞且游泳缓慢、体色加深、腹鳍及胸鳍基部充血、肛门红肿、腹部明显膨大等临床表现,解剖发现腹腔有大量积液,与健康大口黑鲈相比,发病鱼肝脏明显肿大,发病症状与自然感染的情况一致(图 5)。从感染发病大口黑鲈中再次分离病原菌,经鉴定为维氏气单胞菌。

|
| A:腹鳍及胸鳍基部充血、肛门红肿;B:腹部明显膨大;C:腹腔积液;D:肝脏肿大;E:健康大口黑鲈 A: Congestion of the ventral and pectoral fin bases, redness and swelling of the anus; B: Obvious enlargement of abdomen; C: Abdominal fluid; D: Hepatomegaly; E: Healthy Micropterus salmoides 图 5 患病大口黑鲈的症状 Fig. 5 Symptoms of diseased Micropterus salmoides |
3 讨论
气单胞菌严重威胁我国水产养殖业,且会通过水和水生食物从环境传播给人类,导致人类感染的状况频发。本研究从发病大口黑鲈的患病组织中分离到菌株MSB-2,对该细菌进行培养分离,通过革兰氏染色对细菌的形态进行观察,并经生理生化特征测定初步鉴定为气单胞菌属。为进一步对菌株进行种的鉴定,扩增16S rRNA基因进行同源性分析,结果显示与维氏气单胞菌的同源性达99% 以上,构建的系统发育树显示与维氏气单胞菌的序列聚为一簇。综上,确定菌株MSB-2为维氏气单胞菌。
毒力因子是病原微生物与宿主相互作用的关键因素,通常用于评估细菌是否具有毒性。本研究检测了维氏气单胞菌的10种毒力相关基因,菌株MSB-2具有细胞毒性肠毒素基因act、气溶素基因aer、aexT等3种毒力相关基因。其中,act、aer具有溶血性、细胞毒性和肠毒性,可诱导细胞产生炎症和全身脏器广泛出血,引起感染动物的死亡[17];aexT属于Ⅲ型分泌系统,是双功能毒素,具有诱导细胞凋亡、诱导靶细胞中毒的功能[12]。龙波等[16]和雷宁等[2]均在患病大口黑鲈中检测出维氏气单胞菌菌株携带有act、aer、aerA基因,说明这些基因是大口黑鲈源维氏气单胞菌的常见毒力基因。而针对不同养殖种类,庞月等[18]综合统计发现维氏气单胞菌均携带的毒力基因为aerA。综合而言,本研究检测出的3种毒力基因皆属常见类型,且引起的病症也符合其特性,如发病鱼皆有充血、红肿等现象。这些毒力基因的存在可增强维氏气单胞菌的致病性,在温度突变、溶氧不足、水质恶化等恶劣环境中,易诱发大口黑鲈产生疾病。
维氏气单胞菌在大自然水体中普遍存在,且被认为是水产养殖源细菌耐药性监测的指示菌[19],检测其耐药情况,可为水产动物细菌性病害防控提供参考依据。本研究中,大口黑鲈源维氏气单胞菌携带四环素类tetC、tetA和抗叶酸类sull等耐药基因。马辰婕[20]在研究水产养殖源气单胞菌耐药基因的特征时发现,sull和tetC的检出率高于其他类型耐药基因。韩语等[17]从20株维氏气单胞菌检测出tetA和sull的概率较高,其中sull基因检出率高达100%。关于国内外水产源气单胞菌耐药基因的调查研究显示[20],耐药基因类型主要集中于四环素类、抗叶酸类、喹诺酮类、氯霉素类,推测与上述几类药物的广泛应用有关。
本研究中,大口黑鲈源维氏气单胞菌对氨苄西林、苯唑西林、红霉素、青霉素、妥布霉素、卡那霉素、万古霉素、丁胺卡那、链霉素、四环素、氯霉素均具有耐药性。不同地区的大口黑鲈源维氏气单胞菌的耐药性有一定差异,雷宁等[2]分离的病原菌对四环素、氯霉素、链霉素敏感,对青霉素耐药;邓龙君[13]研究发现,病原菌对四环素、卡那霉素、妥布霉素、万古霉素具有耐药性。不同来源的维氏气单胞菌耐药性也不尽相同,综合陆梦莹等[21]、高彩霞等[22]、高通等[23]的研究结果可知,大部分维氏气单胞菌均对氨苄西林、四环素等具有耐药性,这与本研究结果相吻合。因此,为掌握患病水产动物对常用治疗药物的耐药性变化,应加强水产动物细菌耐药性研究,以此评估水产品质量安全,且对指导临床科学用药具有重要意义。
4 结论从大口黑鲈患病组织中分离所得的维氏气单胞菌MSB-2携带多种毒力基因和耐药基因。其中,包括细胞毒性肠毒素基因act、气溶素基因aer、aexT等毒力基因和四环素类tetC、tetA、抗叶酸类sull等耐药基因,对比其他学者的研究结果可发现这几种基因的检出率均处于较高水平,属于常见致病性基因,在防治方面有一定难度。通过药敏试验为临床用药提供可选择的药物,为大口黑鲈细菌性疾病防治提供理论依据,如在养殖过程中可选用新霉素、多西环素等批准渔用药物进行防治。
| [1] |
邓国成, 白俊杰, 李胜杰, 马冬梅, 江小燕, 杨小静. 大口黑鲈池塘养殖常见病害及其防治[J]. 广东农业科学, 2011, 38(18): 102-103, 137. DOI:10.16768/j.issn.1004-874X.2011.18.073 DENG G C, BAI J J, LI S J, MA D M, JIANG X Y, YANG X J. Common diseases and their prevention and control in Micropterus salmoides pond aquaculture[J]. Guangdong Agricultural Sciences, 2011, 38(18): 102-103, 137. DOI:10.16768/j.issn.1004-874X.2011.18.073 |
| [2] |
雷宁, 郝贵杰, 黄爱霞, 王雨辰, 林锋, 沈小明, 朱俊杰. 大口黑鲈(Micropterus salmoides) 致病性维氏气单胞菌的分离鉴定及其特性分析[J]. 海洋与湖沼, 2022, 53(5): 1180-1188. DOI:10.11693/hyhz20220200045 LEI N, HAO G J, HUANG A X, WANG Y C, LIN F, SHEN X M, ZHU J J. Isolation and identification of pathogenic Aeromonas veronii in Micropterus salmoides[J]. Oceanologia et Limnologia Sinica, 2022, 53(5): 1180-1188. DOI:10.11693/hyhz20220200045 |
| [3] |
赵浩航, 康旭, 黄子威, 温依铭, 汪志文, 喻大鹏, 甘桢, 夏洪丽, 夏立群, 鲁义善. 大口黑鲈肠道益生菌的分离与鉴定[J]. 广东海洋大学学报, 2023, 43(4): 62-68. DOI:10.3969/j.issn.1673-9159.2023.04.008 ZHAO H H, KANG X, HUANG Z W, WEN Y M, WANG Z W, YU D P, GAN Z, XIA H L, XIA L Q, LU Y S. Isolation and identification of intestinal probiotics from Micropterus salmoides[J]. Journal of Guangdong Ocean University, 2023, 43(4): 62-68. DOI:10.3969/j.issn.1673-9159.2023.04.008 |
| [4] |
蔡磊, 白俊杰, 全迎春, 李胜杰, 陈昆慈. 大口黑鲈遗传育种研究进展[J]. 广东农业科学, 2011, 38(17): 96-99. DOI:10.16768/j.issn.1004-874X.2011.17.079 CAI L, BAI J J, QUAN Y C, LI S J, CHEN K C. Advances in genetics and breeding of largemouth bass[J]. Guangdong Agricultural Sciences, 2011, 38(17): 96-99. DOI:10.16768/j.issn.1004-874X.2011.17.079 |
| [5] |
荆鹏华, 赵飞, 谭爱萍, 邓玉婷, 邵蓬, 朱雪晴, 赖迎迢, 巩华, 黄志斌. 大口黑鲈IRF3的分子特征及其免疫表达[J]. 广东海洋大学学报, 2023, 43(4): 76-83. DOI:10.3969/j.issn.1673-9159.2023.04.010 JING P H, ZHAO F, TAN A P, DENG Y T, SHAO P, ZHU X Q, LAI Y T, GONG H, HUANG Z B. Molecular characteristics of IRF3 gene in largemouth bass(Micropterus salmoides) and its immune expression[J]. Journal of Guangdong Ocean University, 2023, 43(4): 76-83. DOI:10.3969/j.issn.1673-9159.2023.04.010 |
| [6] |
林而舒. 大口黑鲈重要病原三重PCR检测方法的建立[J]. 福建农林大学学报(自然科学版), 2024, 53(4): 517-521. DOI:10.13323/i.cnki.i.fafu(nat.sci.).202308013 LIN E S. Establishment of triple PCR detection method for important pathogens in largemouth bass[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2024, 53(4): 517-521. DOI:10.13323/i.cnki.i.fafu(nat.sci.).202308013 |
| [7] |
陈鹏, 张咏, 刘苏, 杨宇晴, 袁凯, 张海发, 丁雪娟. 大亚湾养殖鱼类寄生车轮虫的种类组成与季节动态[J]. 水生生物学报, 2020, 44(6): 1256-1262. DOI:10.7541/2020.146 CHENG P, ZHANG Y, LIU S, YANG Y Q, YUAN K, ZHANG H F, DING X J. Species composition and seasonal dynamics of parasitic rotifers in cultured fish in Daya Bay[J]. Acta Hydrobiologica Sinica, 2020, 44(6): 1256-1262. DOI:10.7541/2020.146 |
| [8] |
郭文杰, 韩锐, 许为镇, 李言伟, 但学明. 大口黑鲈杀鱼爱德华氏菌的分离鉴定及耐药性分析[J]. 水产学杂志, 2023, 36(6): 47-51, 68. GUO W J, HAN R, XU W Z, LI Y W, DAN X M. Isolation, identification and drug resistance analysis of Edwardsiella piscicida from largemouth bass[J]. Chinese Journal of Fisheries, 2023, 36(6): 47-51, 68. |
| [9] |
冯兴浪, 丁戈野, 张秋实, 侯金亮, 刘智明, 陈中元, 向建国, 肖调义, 李军华. 大口黑鲈烂身病病原菌的分离鉴定及其药物敏感性[J/OL]. 湖南农业大学学报(自然科学版), 1-7[2024-07-28]. https://kns.cnki.net/kcms2/detail/43.1257.S.20230724.1849.002.html. FENG X L, DING G Y, ZHANG Q S, HOU J L, LIU Z M, CHEN Z Y, XIANG J G, XIAO T Y, LI J H. Isolation, identification, and analysis of a strain of pathogenic bacteria from Micropterus salmoides [J/OL]. Journal Hunan Agricultural University(Natural Sciences), 1-7[2024-07-28]. https://kns.cnki.net/kcms2/detail/43.1257.S.20230724.1849.002.html. |
| [10] |
HICKMAN-BRENNER F W, MACDONALD K L, STEIGERWALT A G, FANNING G R, BRENNER D J, FARMER J J. Aeromonas veronii, a new ornithine decarboxylase-positive species that may cause diarrhea[J]. Journal of Clinical Microbiology, 1987, 25(5): 900-906. DOI:10.1128/jcm.25.5.900-906.1987 |
| [11] |
杨超. 大口黑鲈源维氏气单胞菌的分离鉴定及其对宿主免疫应答的影响[D]. 上海: 上海海洋大学, 2022. YANG C. Isolation and identification of Aeromonas veronii from diseased Micropterus salmoides and its effect on host immune[D]. Shanghai: Shanghai Ocean University, 2022. |
| [12] |
康元环, 张冬星, 杨滨僮, 张贺亮, 孙武文, 单晓枫, 钱爱东. 维氏气单胞菌最新研究进展[J]. 中国人兽共患病学报, 2018, 34(5): 452-459, 465. DOI:10.3969/i.issn.1002-2694.2018.00.064 KANG Y H, ZHANG D X, YANG B T, ZHANG H L, SUN W W, SHAN X F, QIAN A D. Latest research progress on Aeromonas veronii[J]. Chinese Journal of Zoonoses, 2018, 34(5): 452-459, 465. DOI:10.3969/i.issn.1002-2694.2018.00.064 |
| [13] |
邓龙君. 大口黑鲈维氏气单胞菌的分离鉴定及其感染的病理损伤[J]. 河南农业科学, 2021, 50(1): 164-171. DOI:10.15933/j.cnki.1004-3268.2021.01.021 DENG L J. Isolation and identification of Aeromonas veronii from Micropterus salmoides and pathological lesions of its infection[J]. Journal of Henan Agricultural Sciences, 2021, 50(1): 164-171. DOI:10.15933/j.cnki.1004-3268.2021.01.021 |
| [14] |
郝成森, 刘佳, 王艳, 骆泽礼, 宋振辉, 张立武, 杨晓伟, 赵光伟. 1株大貌源多重耐药维氏气单胞菌全基因组解析及其致病性[J]. 中国兽医学报, 2023, 43(8): 1677-1683. DOI:10.16303/j.cnki.1005-4545.2023.08.13 HAO C S, LIU J, WANG Y, LUO Z L, SONG Z H, ZHANG L W, YANG X W, ZHAO G W. Analysis of whole genomeand pathogenicity of a strain of multi-drug resistant A. veronii isolated from Chinese giant salamander[J]. Chinese Journal of Veterinary Science, 2023, 43(8): 1677-1683. DOI:10.16303/j.cnki.1005-4545.2023.08.13 |
| [15] |
HASSAN M A, NOURELDIN E A, MAHMOUD M A, FITA N A. Molecular identification and epizootiology of Aeromonas veronii infection among farmed Oreochromis niloticus in Eastern Province, KSA[J]. Egyptian Journal of Aquatic Research, 2017, 43(2): 161-167. DOI:10.1016/j.ejar.2017.06.001 |
| [16] |
龙波, 王均, 贺扬, 赵敏, 王二龙, 崔静雯, 邓绿洲, 刘韬, 曾宇鲲, 汪开毓, 陈德芳. 加州鲈源维氏气单胞菌的分离、鉴定及致病性[J]. 中国兽医学报, 2016, 36(1): 48-55. DOI:10.16303/i.cnki.1005-4545.2016.01.09 LONG B, WANG J, HE Y, ZHAO M, WANG E L, CUI J W, DENG L Z, LIU T, ZENG Y K, WANG K Y, CHEN D F. Isolation, identification and pathogenicity of Aeromonas veronii isolated from Micropterus salmoides[J]. Chinese Journal of Veterinary Science, 2016, 36(1): 48-55. DOI:10.16303/i.cnki.1005-4545.2016.01.09 |
| [17] |
韩语, 潘纪汶, 王昕, 杨诺, 郭桂英, 李迁, 曾纪锋, 郑继平. 泥鳅维氏气单胞菌的毒力基因与耐药特性分析[J]. 水产科学, 2022, 41(4): 564-572. DOI:10.16378/i.cnki.1003-1111.20180 HAN Y, PAN J W, WANG X, YANG N, GUO G Y, LI Q, ZENG J F, ZHENG J P. Virulence genes and antibiotic resistance characteristics of pathogenic Aeromonas veronii lsolated from loach Misgurnus anguillicaudatus[J]. Fisheries Science, 2022, 41(4): 564-572. DOI:10.16378/i.cnki.1003-1111.20180 |
| [18] |
庞月, 郭美玲, 刘芯睿, 薛淑霞, 孙金生. 锦鲤源维氏气单胞菌的鉴定及致病性分析[J]. 天津农学院学报, 2022, 29(4): 36-42. DOI:10.19640/j.cnki.jtau.2022.04.008 PANG Y, GUO M L, LIU X R, XUE S X, SUN J S. Identification and var. koi[J]. Journal of Tianjin Agricultural University, 2022, 29(4): 36-42. DOI:10.19640/j.cnki.jtau.2022.04.008 |
| [19] |
邓玉婷, 谭爱萍, 张瑞泉, 赵飞, 姜兰. 广东主要水产养殖地区气单胞菌耐药状况的调查分析[J]. 南方农业学报, 2019, 50(11): 2375-2383. DOI:10.3969/i.issn.2095-1191.2019.11.01 DENG Y T, TAN A P, ZHANG R Q, ZHAO F, JIANG L. Antimicrobial resistance of Aeromonas isolates from aquaculture areas in Guangdong[J]. Journal of Southern Agriculture, 2019, 50(11): 2375-2383. DOI:10.3969/i.issn.2095-1191.2019.11.01 |
| [20] |
马辰婕. 水产养殖源气单胞菌耐药基因的分布特征和传播机制[D]. 厦门: 集美大学, 2017. MA C J. Distribution and transmission mechanisms of antimicrobial-resistance genes in Aeromonas spp. isolated from aquaculture[D]. Xiamen: Jimei University, 2017. |
| [21] |
陆梦莹, 胡秀彩, 吕爱军, 孙敬锋, 陈成勋, 王晓梅, YEONG Y, 宋亚娇. 鲶源维氏气单胞菌的分离鉴定及药敏特性[J]. 大连海洋大学学报, 2017, 32(5): 563-567. DOI:10.16535/j.cnki.dlhyxb.2017.05.010 LU M Y, HU X C, LYU A J, SUN J F, CHEN C X, WANG X M, YEONG Y, SONG Y J. Isolation, identification and susceptibility of Aeromonas veronii from diseased northern sheatfish Silurus soldatovi[J]. Journal of Dalian Ocean University, 2017, 32(5): 563-567. DOI:10.16535/j.cnki.dlhyxb.2017.05.010 |
| [22] |
高彩霞, 任燕, 王庆, 曾伟伟, 李莹莹, 王英英, 常藕琴, 石存斌, 张德锋, 方珍珍. 草鱼源致病性维氏气单胞菌的分离鉴定及药物敏感性分析[J]. 安徽农业大学学报, 2018, 45(3): 409-415. DOI:10.13610/j.cnki.1672-352x.20180620.019 GAO C X, REN Y, WANG Q, ZENG W W, LI Y Y, WANG Y Y, CHANG O Q, SHI C B, ZHANG D F, FANG Z Z. Isolation, identification and antimicrobial susceptibility of pathogenic Aeromonas veronii isolated from grass carp[J]. Journal of Anhui Agricultural University, 2018, 45(3): 409-415. DOI:10.13610/j.cnki.1672-352x.20180620.019 |
| [23] |
高通, 王均, 汪开毓, 贺扬, 樊威, 谢碧文, 王永明, 朱婷, 代小惠, 张敏燕. 花斑副沙鳅源致病性维氏气单胞菌的分离、鉴定及药物敏感性分析[J]. 中国预防兽医学报, 2020, 42(3): 239-244. DOI:10.3969/j.issn.1008-0589.201905014 GAO T, WANG J, WANG K Y, HE Y, FAN W, XIE B W, WANG Y M, ZHU T, DAI X H, ZHANG M Y. Isolation, identification and drug sensitivity analysis of pathogenic Aeromonas veronii from diseased Parabotia fasciata Dabry[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(3): 239-244. DOI:10.3969/j.issn.1008-0589.201905014 |
(责任编辑 马春敏)
 2024, Vol. 51
2024, Vol. 51