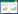文章信息
基金项目
- 国家自然科学基金(32073006);中山市社会公益与基础研究项目(2021B2058)
作者简介
- 罗伟杰(1997—),男,硕士,研究方向为水生动物病害防控,E-mail:juhua952703@163.com.
通讯作者
- 简纪常(1964—),男,博士,教授,研究方向为水生动物医学,E-mail:jianjc@gdou.edu.cn; 黄浦江(1984—),男,硕士,高级工程师,研究方向为水产动物疫病防控,E-mail:huang851122@126.com.
文章历史
- 收稿日期:2024-05-10
2. 深圳市渔业发展研究中心,广东 深圳 518067;
3. 广东海洋大学深圳研究院,广东 深圳 518120
2. Shenzhen Fisheries Development Research Center, Shenzhen 518067, China;
3. Shenzhen Institute of Guangdong Ocean University, Shenzhen 518120, China
【研究意义】大口黑鲈(Micropterus salmoides)属鲈形目棘臀鱼科黑鲈属,是我国重要的淡水养殖经济鱼类,1983年从我国台湾省引进并成功人工繁育,首先引入广东等沿海城市。大口黑鲈具有抗病力强、病害少、可单养或鱼塘中混养、适宜在网箱中高密度养殖、经济效益高等优点,在我国深圳、江苏、浙江、上海、山东等地广泛养殖[1]。2023年《中国渔业统计年鉴》显示,我国大口黑鲈年养殖产量已突破80.2万t。近年来,大口黑鲈需求旺盛,但相关产业(苗种、设施、专用饲料、检测技术等)升级缓慢[2],水环境污染等问题突出,使其在养殖过程中易感染各种细菌、病毒及寄生虫,严重制约其产业的可持续发展。【前人研究进展】大口黑鲈养殖过程中常见的病原有3种,主要为寄生虫(斜管虫、杯体虫、锚头鳋)、病毒(大口黑鲈虹彩病毒、蛙病毒、弹状病毒)和细菌(柱状黄杆菌、气单胞菌、诺卡氏菌)[3],其中细菌性病原常会引起宿主肠炎、出血和溃疡等症状。龙波等[4]发现维氏气单胞菌(Aeromonas veronii)可感染大口黑鲈,引发大量死亡。但有关豚鼠气单胞菌(A. caviae)感染大口黑鲈的研究鲜有报道,豚鼠气单胞菌和维氏气单胞菌同属于弧菌科气单胞菌属,嗜温、有运动性,广泛分布于淡水、污水、养殖用水和城市饮用水或鱼体。豚鼠气单胞菌可感染哺乳类(人类、肉猪、山羊等[5])、两栖类(蛙[6])和鱼类(鲟、红鲫等[7])动物,感染范围广,是一种人畜共患病原体,具有条件致病性,极易感染腹泻病人[8]。【本研究切入点】2023年8月,深汕特别合作区某鲈鱼养殖基地发生大口黑鲈突发性死亡,表现出鱼体表溃烂、肛门肿涨、肠道红肿和肝脏充血等症状。为查明原因,从患病濒死大口黑鲈病灶组织中分离纯化得到病原菌,并对其进行分析。【拟解决的关键问题】本研究从患病濒死大口黑鲈病灶组织中分离纯化得到一株病原菌,对其进行鉴定并筛选出对该菌具有明显抑菌作用的中草药,以期为大口黑鲈致病性豚鼠气单胞菌的细菌性疾病治疗提供参考依据。
1 材料与方法 1.1 供试材料试验于2023年9月至2024年4月在深圳市渔业发展研究中心水生动物防疫检疫实验室进行。
患病大口黑鲈和回归感染试验所用的健康大口黑鲈均取自深汕特别合作区某鲈鱼养殖场,体长12.0(±2)cm,暂养水温14(±2)℃。
1.2 病原菌分离参考黄雪敏等[9]方法,于超净工作台中对患病大口黑鲈肝脏、脾、肠及明显病灶组织进行分离,使用平板划线法将组织匀浆液接种于脑心浸液(BHI)固体培养基,28 ℃培养16 h后,挑取优势单菌落重新划线接种,纯化2代后,挑取单菌落接种于BHI液体培养基中,28 ℃振荡培养12 h,12 000 r/min离心2 min,收集菌体,再于超净工作台中加入已灭菌的50% 甘油,振荡混匀后封膜,保存于-80 ℃冰箱备用。
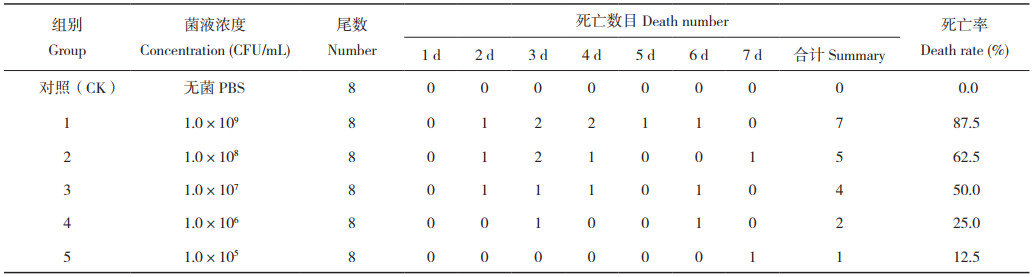
1.3 回归感染试验试验前,将养殖用水提前进行消毒杀菌处理,取部分养殖用水进行BHI涂板检测确定无菌后,将60条健康大口黑鲈暂于循环淡水系统中暂养15 d。早晚定时投喂,及时处理残饵和粪便,每天记录大口黑鲈健康状态。暂养15 d后随机分为6组(1组为对照,5组为试验组),每组8尾鱼。参照黄郁葱等[10]方法,活化上述分离菌株,配置成浓度梯度为1.0×109、1.0×108、1.0×107、1.0×106、1.0×105 CFU/mL的菌悬液,采用腹腔注射,剂量为0.1 mL/ 尾,对照组注射相同剂量的无菌PBS,观察7 d,每天记录大口黑鲈死亡情况,根据改良寇氏法计算LC 50。取经回归感染的大口黑鲈病灶组织再次进行病原菌分离鉴定,验证是否为分离菌株感染致死。
1.4 病原菌鉴定1.4.1 生化鉴定 采用细菌微量生化鉴定管(广东环凯生物科技有限公司)对分离得到的菌株进行专项生化指标的检测鉴定,每组3个重复。将分离菌株于BHI固体培养基划线培养,28 ℃过夜培养,次日将单菌落挑取接种于各类生化反应管中,30 ℃培养24 h,读取反应结果。根据《伯杰氏细菌学鉴定手册》和《常见细菌系统鉴定手册》对分离菌株进行生理生化鉴定。
1.4.2 分子鉴定 根据OMEGA DNA提取试剂盒〔天根生化科技(北京)公司〕说明书提取分离菌株的DNA。采用细菌16S rRNA通用引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-TACGGCTACCTTGTTACGACTT-3')扩增分离菌株的16S rRNA保守基因序列。PCR反应体系为25 μL,反应程序参照试剂盒说明书进行。吸取5 μL PCR产物进行1.5% 凝胶电泳检测,剩余PCR产物送至北京华大基因股份有限公司测序。使用DNAMAN软件拼接测序结果,并进行BLAST序列比对,保存相近同源性的序列。使用MEGA 11软件中的邻接法(NJ)构建系统进化发育树。
1.5 药物敏感性试验参考陆文浩等[11]方法,利用K-B纸片扩散法对分离菌株进行耐药敏感性分析。选取30种抗生素耐药纸片将分离菌株均匀涂布接种在水解酪蛋白(MH)培养基中,28 ℃培养24 h,使用游标卡尺读取结果。以分离菌株的DNA为模板,选取β- 内酰胺酶、氨基糖苷类、四环素类、喹诺酮类、氯霉素类、磺胺类和大环内酯类等30种耐药基因进行PCR检测。所用引物和退火温度见表 1。
1.6 毒力基因检测
选取6种毒力基因进行PCR检测,包括溶血素(hly)、气溶素(aer)、细胞毒性肠毒素(act)、脂肪酶(lip)、丝氨酸蛋白酶(ser)、鞭毛蛋白(fla)基因。PCR反应体系为25 μL,反应程序:94 ℃ 10 min;94 ℃ 1 min,退火30 s(具体退火温度见表 2),72℃ 40 s,38个循环;72 ℃延伸7 min。毒力基因引物序列见表 2。
1.7 组织病理分析
分别取健康和人工感染后濒死大口黑鲈的肝脏、脾、肠道和头肾组织,用4% 多聚甲醛于常温固定24 h后,4 ℃保存。将组织送至武汉塞尔维生物有限公司进行普通包埋和石蜡切片,使用显微镜镜检拍照,并进行组织病理分析。
1.8 体外抑菌试验1.8.1 中草药制备液最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定 选择三黄、大黄、连翘、金银花、苦参、五倍子、侧柏叶、辛夷花、苍术共9种中草药药材进行体外抑菌试验,分别制备生药质量浓度为1 g/mL的各药材制备液,4 ℃保存备用。取已灭菌的EP管,将已灭菌MH液体培养基100 μL分别加入第1~9管,随后取100 μL待测中草药制备液加入第1管中,从第1管开始依次倍比稀释到第9管,即第1~9管中的中草药制备液质量浓度分别为1 000、500、250、125、62.5、31.25、15.63、7.8、3.9 mg/mL;再在1~9管中分别加入100 μL菌液。第10管为MH培养基对照,第11管为中草药制备液对照,第12管为菌液对照,每管各100 uL,每组3次重复,32 ℃培养24 h后取出。从每管取100 μL液体涂布于MH固体培养基,32 ℃培养16~20 h后观察结果。根据菌落分散生长程度判定其抑菌效果,最低浓度试验组为其MIC值,且MIC<7.8 mg/ mL为敏感,7.8 mg/mL ≤ MIC ≤ 250.00 mg/mL为中度敏感,MIC>250.00 mg/mL为不敏感;同理,无菌生长则判定为具有灭菌效果,最低浓度试验组为其MBC值。
1.8.2 中草药耐药性试验 在无菌状态下吸取100 μL菌液于MH琼脂培养基进行涂布,采用琼脂平板打孔法,用直径为6 mm的无菌打孔器在平板上打孔,除去琼脂,吸取含生药质量浓度1 g/mL的中草药制备液加入孔中,每孔注满。每种中草药3次重复,32 ℃培养24 h后,使用游标卡尺测定抑菌圈直径,判定标准:抑菌直径≥ 20 mm为极度敏感,20 mm>抑菌直径≥ 15 mm为敏感;15 mm>抑菌直径≥ 10 mm为中度敏感;抑菌直径<10 mm为耐药。
2 结果与分析 2.1 病原菌分离患病大口黑鲈的肝脏、脾、肠及明显病灶组织接种于BHI固体培养皿中,28 ℃培养16 h后,从病灶组织接种的培养皿菌落数目最多,且大部分菌落形态相似。选取形态相似的单菌落进行革兰氏染色并用显微镜观察,确定该菌为革兰氏阴性菌。
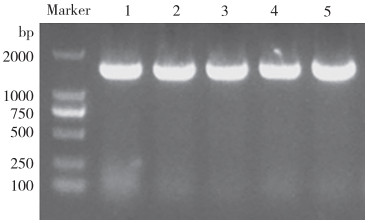
2.2 病原菌鉴定将分离得到的单菌落于无菌BHI平板划线,经两次分离纯化后随机挑取5个单菌落进行扩大培养,提取病原菌DNA扩增其16S rRNA保守序列,得到5条约1 500 bp的明亮条带(图 1)。测序结果显示5个单菌落的16S rRNA序列完全一致,为同一菌株,命名为SZNH-S20230817。
|
| 1~5:菌株S2NH-S20230817 1-5: stain S2NH-S20230817 图 1 菌株SZNH-S20230817的16S rRNA基因PCR产物电泳凝胶图 Fig. 1 Electrophoresis gel of PCR product of 16S rRNA gene of the strain SZNH-S20230817 |
菌株SZNH-S20230817生化鉴定结果(表 3)显示,该菌可以水解明胶,葡萄糖产酸、甘露、醇蔗糖、精氨酸双水解酶、氧化酶、吲哚、木糖、苯丙氨酸和阿拉伯糖反应呈阳性;侧金盏花醇、硫化氢、赖氨酸脱羧酶、肌醇、鸟氨酸脱羧酶、西蒙氏枸橼酸盐、山梨醇、V-P试验、丙二酸盐和鼠李糖反应呈阴性;该菌在0% NaCl胨水和3% NaCl胨水中均能存活。将以上结果与《伯杰氏细菌学鉴定手册》和《常见细菌系统鉴定手册》提供的豚鼠气单胞菌各项反应标准对比,除棉子糖、尿素外,其余结果均一致,符合率为91.7%,初步确定菌株SZNH-S20230817为豚鼠气单胞菌。

|
2.3 菌株SZNH-S20230817系统发育树分析
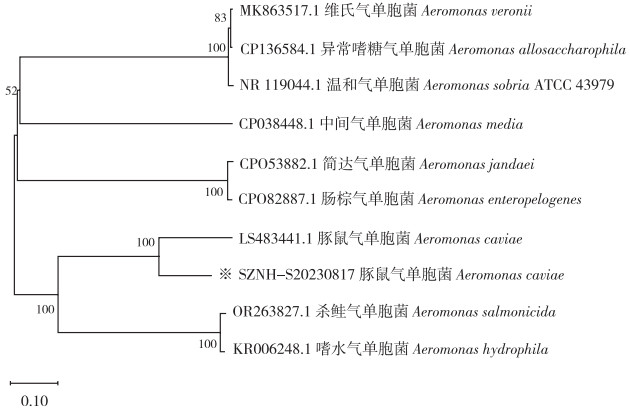
将菌株SZNH-S20230817的16S rRNA保守序列在NCBI网站进行比对,Blast序列比对结果显示该分离菌株与豚鼠气单胞菌AP019195具有极高相似度、同源性达99.38%。随后用MEGA11软件构建系统发育进化树,结果(图 2)表明菌株SZNH-S20230817与豚鼠气单胞菌LS483441.1聚为一个分支。综合该菌株16S rRNA测序、系统发育进化树、生理生化特性及形态学特征分析结果,确定菌株SZNH-S20230817为豚鼠气单胞菌。
|
| “※”为本次试验菌株,无登录基因号 "※" represents the strain in this experiment, no GenBank registered 图 2 菌株SZNH-S20230817系统发育树分析 Fig. 2 Phylogenetic tree analysis of the strain SZNH-S20230817 |
2.4 菌株SZNH-S20230817药物敏感性试验
菌株SZNH-S20230817对30种抗生素药敏试验结果(表 4)显示,其对15种抗生素高度敏感,对3种抗生素中度敏感,对6种抗生素耐药。其中,在β-内酰胺类抗生素中,对头孢他啶、亚胺培南、头孢哌酮、头孢曲松和哌拉西林5种抗生素高度敏感,对头孢呋辛呐中度敏感,对头孢唑林、氨苄西林、苯唑西林、头孢氨苄和青霉素5种抗生素耐药;在氨基糖苷类抗生素中,对庆大霉素和阿米卡星2种抗生素高度敏感,对链霉素中度敏感,对卡那霉素耐药;在喹诺酮类抗生素中,对诺氟沙星、环丙沙星和左氟沙星3种抗生素高度敏感;在四环素类抗生素中,对四环素、米诺环素和强力霉素耐药;在大环内酯类抗生素中,对阿奇霉素高度敏感,对红霉素中度敏感;在糖肽类抗生素中,对多粘菌素B高度敏感,对万古霉素耐药;在氯霉素类抗生素中,对氯霉素和氟苯尼考高度敏感;在林可酰胺类抗生素中,对克林霉素耐药;在磺胺类抗生素中,对复方新诺明高度敏感;在林可胺类抗生素中,对林可霉素耐药。
2.5 菌株SZNH-S20230817耐药基因与毒力基因检测
30种耐药基因检测结果(图 3)显示,菌株SZNH-S20230817携带qnrA、qnrB、qepA、qnrS、catI、emrB、Sul1、rmtB、aacA、StrB、aadA、aac(6’’)-Ib和SHV等13种耐药基因。图 4显示,6种毒力基因检测结果(图 4)显示菌株SZNH-S20230817携带aer、act、lip和fla 4个毒力基因。
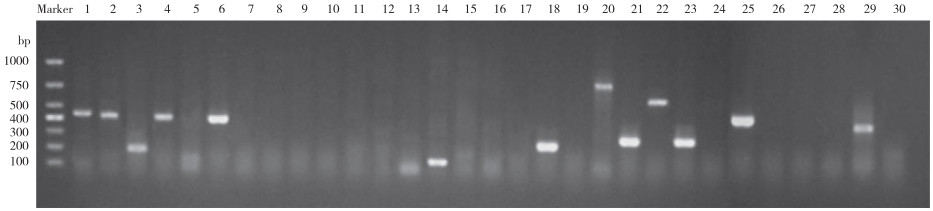
|
| 1-30: qnrA, qnrB, qepA, qnrS, fl oR, catI, tetC, tetM, tetO, tetX, qnrD, gyrA, SulA, emrB, mefC, Sul3, Sul2, Sul1, tetA, rmtB, aacA, StrB, aadA, IMP, aac(6'')-Ib, AmpC, TEM, CARB, SHV, Oxa-24 图 3 菌株SZNH-S20230817耐药基因凝胶检测结果 Fig. 3 Results of gel detection of drug resistance genes of the strain SZNH-S20230817 |
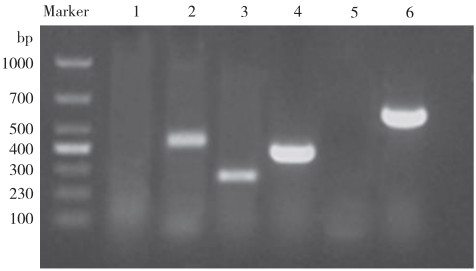
|
| 1-6: hly, aer, act, lip, ser, fla 图 4 菌株SZNH-S20230817毒力基因凝胶检测结果 Fig. 4 Results of virulence gene gel assay of the strain SZNH-S20230817 |
2.6 菌株SZNH-S20230817回归感染试验
健康大口黑鲈腹腔分别注射不同浓度的菌液,攻毒7 d后记录死亡数据。结果(表 5)显示,第1 d均无死亡,第2~3 d,菌液浓度1.0×109 CFU/ mL和1.0 ×108 CFU/ mL处理大口黑鲈出现明显死亡,低菌液浓度试验组正常。攻毒7 d后,各试验组均发生死亡,其中最高浓度组死亡7尾、死亡率为87.5%;最低浓度组死亡1尾、死亡率为12.5%。对照组大口黑鲈无死亡。根据改良寇氏法计算得到该分离菌株的LC50为1.39×107 CFU/mL。5个试验组各随机选取1尾死亡大口黑鲈进行病原菌分离鉴定,结果表明5个分离菌均与菌株SZNH-S20230817属同一菌株,进一步确认菌株SZNH-S20230817为引起此次大口黑鲈突发性死亡的病原菌。
|
2.7 组织病理分析
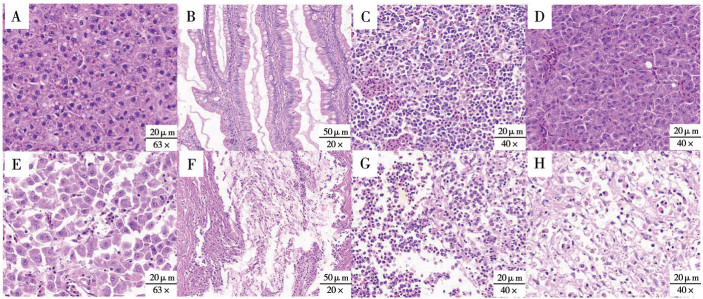
观察经人工感染后的大口黑鲈,病鱼体表出现表皮溃疡,肝脏、鱼鳍等多部位充血的临床症状(图 5)。与健康大口黑鲈(CK)内脏组织切片(图 6A~D)相比,人工感染患病大口黑鲈的内脏(肝、肾及脾脏和肠道)组织均出现明显的病理变化(图 6E~H)。从图 6可以看出,患病鱼染鱼表现出明显的病理损伤。患病鱼大量炎症细胞浸润肝脏,肝细胞肿胀实质结构遭到明显破坏,伴随局部细胞坏死,同时呈现脂肪变性和空泡化(图 6H);脾脏细胞出现少量坏死,细胞间质变性,细胞肿胀,细胞之间不黏着,呈游离状态,髓窦内含铁血黄素沉积(图 6E);肾脏细胞变性、坏死,肾间质疏松,造血组织细胞减少,巨噬细胞与中性白细胞浸润(图 6G);在患病鱼的肠道中,绒毛结构有相当大的破坏和异常改变(图 6F)。
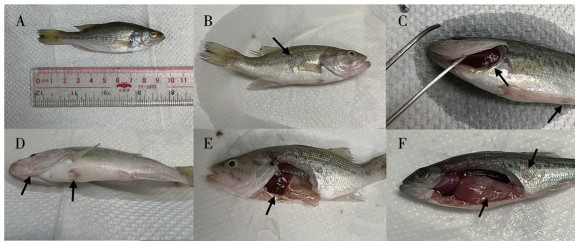
|
| A:鱼体(长度10 cm);B:体侧溃疡;C:鳃丝充血与肛门肿胀;D:底鳍和鱼嘴充血;E:肝脏充血及肠炎;F:内脏充血和体表溃疡 A: Fish body (length 10 cm); B: Body side ulcer; C: Gill congestion and anal swelling; D: Congestion of bottom fin and mouth; E: Hepatic congestion and enteritis; F: Visceral hyperemia and surface ulcer 图 5 人工感染大口黑鲈的临床症状 Fig. 5 Clinical symptoms of artificially infected Micropterus salmoides |
|
| A:正常脾脏组织;B:正常肠道组织;C:正常肾组织;D:正常肝组织;E:患病鱼脾脏组织细胞坏死,细胞间质变性、不黏着;F:患病鱼肠道组织、肠绒毛损伤;G:患病鱼肾组织炎性细胞浸润,细胞变性、坏死;H:患病鱼肝细胞坏死,肝板结构紊乱、呈空泡化 A: Normal spleen tissue; B: Normal intestinal tissue; C: Normal renal tissue; D: Normal liver tissue; E: Spleen tissue of diseased largemouth bass, necrotic cells, with intercellular substance degeneration and non-adhesion; F: Intestinal tissue of diseased largemouth bass with intestinal villus damage; G: Renal tissue of diseased largemouth bass, inflammatory cell infiltration, cell degeneration and necrosis; H: In the liver tissue of the affected largemouth bass, hepatocytes were necrotic, and the structure of the hepatic plate was disordered and vacuolated 图 6 健康和患病大口黑鲈的组织学观察 Fig. 6 Histological observation of tissues from healthy and diseased Micropterus salmoides |
2.8 9种中草药对菌株SZNH-S20230817的体外抑菌作用
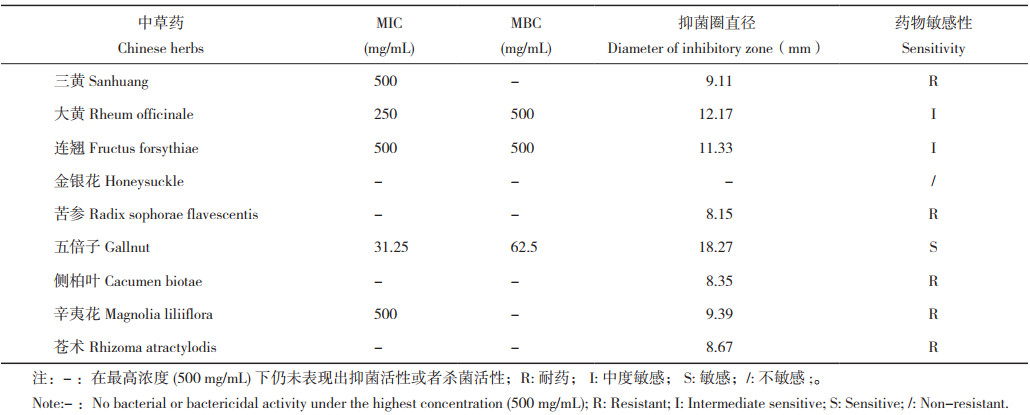
9种中草药对菌株SZNH-S20230817的MIC、MBC测定结果如表 6所示。根据MIC判定标准,发现菌株SZNH-S20230817对大黄和五倍子表现为中度敏感,对三黄、连翘、金银花、苦参、侧柏叶、辛夷花和苍术等表现为不敏感。
|
根据中草药抑菌圈判定标准,发现菌株SZNH-S20230817对五倍子敏感,对大黄、连翘中度敏感,对三黄、金银花、苦参、侧柏叶、辛夷花和苍术表现为耐药。抑菌圈测定结果与MIC、MBC测定结果高度吻合。
3 讨论豚鼠气单胞菌(A. caviae)广泛分布于自然界中,主要生活在土壤、水体和植物根际等环境[12]。近年来,由A. caviae污染(羊[5]、鸡[13]、鱼[14]等)生、熟食引发多起公共安全事件,对人类健康和公共安全卫生是一种极大的考验和威胁。水产养殖常见的气单胞菌(包括嗜水气单胞菌、维氏气单胞菌、豚鼠气单胞菌、杀鲑气单胞菌、温和气单胞菌[15-16]等)均为条件致病菌,一般不会致病。但有研究发现,当鱼体出现损伤或免疫力较低时,极易被感染。近年来,由A. caviae感染水生生物(中华鳖、中华绒螯蟹、鲢、匙吻鲟、南方鲇、红鲫等)引发死亡的报道逐渐增多,日益引起研究学者们的重视。进一步研究发现,A. caviae感染人类主要引起腹泻和呼吸道疾病[17],感染鱼类主要引起败血症和体表溃疡等症状[18],而感染牲畜会使动物机体肌肉组织溃疡和溶解症状[19-20],发病时间多集中在高温季节,与本文发现A. caviae暴发时间相符。本研究回归感染结果显示,A. caviae对大口黑鲈具有较强致病性,其LC50为1.39×107 CFU/mL。
研究表明,病原菌自身携带的毒力基因与其致病性密切相关,是检测病原菌毒力的重要指标。本研究中菌株SZNH-S20230817携带气溶素基因aer、细胞毒性肠毒素基因act、脂肪酶基因lip和鞭毛蛋白基因fla 4个毒力基因,这与罗氏沼虾[21]、红鲫[7]和加州鲈中A. caviae携带的毒力基因不同且产生的症状也有所不同,这可能是由于感染不同宿主引发的差异性。以往研究表明,引发肠炎的A. caviae极易被检出act和lip毒力基因,这两个基因可能与肠炎发生密切相关,符合本次患病大口黑鲈肠炎症状。而fla基因是细菌的重要毒力因子,参与细菌的吸附、侵袭与定植,进而引起肠炎和体表溃疡。
抗生素被作为传统治疗细菌性疾病的重要手段之一在水产养殖中经常使用,但长期使用某一种或多种抗生素极易导致细菌产生耐药性,甚至会出现多重耐药[22],相同病原菌在不同地区、不同宿主中耐药性具有一定差异。本研究表明,菌株SZNH-S20230817含有qnrA、qnrB、qepA、qnrS、catI、emrB、Sul1、rmtB、aadA、StrB、aacA、aac(6’’)-Ib和SHV等13种耐药基因,K-B试纸测试中显示对β- 内酰胺酶类、氨基糖苷类、四环素类耐药。耐药基因与药敏试验结果并非完全一致,表明耐药基因会对相关的抗生素耐药表型产生影响,但并非直接影响。这可能是多种原因引起,如抗性基因发生变异引起作用衰减或作用丧失、耐药基因在细菌受到相应抗生素影响时表达受到抑制等。因此,细菌耐药基因的表达与耐药表型、耐药程度的关系值得进一步研究。另外,本研究与其他研究结果相似,但有一定差异。周丽颖等[12]研究表明A. Caviae对头孢类、青霉素类等抗生素耐药;张建等[7]研究发现A. caviae对头孢类抗生素敏感,对氨基糖苷类、四环素类、喹诺酮类抗生素耐药;郭莹等[23]研究结果表明A. caviae菌对喹诺酮类、大环内脂类等抗生素耐药。以上结果表明,A. caviae耐药性可能由于水环境、菌株宿主以及养殖过程中的用药习惯等有关。菌株SZNH-S20230817药敏试纸结果表明,其对头孢他啶、亚胺培南、头孢哌酮、头孢曲松、哌拉西林、庆大霉素、阿米卡星、诺氟沙星、环丙沙星、左氟沙星、阿奇霉素、多粘菌素B、氯霉素、氟苯尼考、复方新诺明高度敏感,临床针对急性诊治可适当选择上述药物进行治疗。然而,目前使用抗生素药物频率过高,平时预防和治疗工作建议偏向选择中草药。有研究表明,诃子、五倍子、石榴皮、大黄对豚鼠气单胞菌有强抑菌作用[24-25],本研究对9种中草药的体外抑菌测试结果显示,该菌对五倍子敏感度高,对大黄敏感度次之,对其余7种中草药敏感度低;MIC与MBC结果进一步表明利用单一中草药进行抑菌需要更高浓度,即需要养殖户投入更高成本。因此,单一中草药不是预防和治疗的最优选择,而应进一步了解中草药之间的协同作用和拮抗作用,中草药合理配伍更能提高体外抑菌作用,且对养殖环境和养殖动物造成的不利影响更小。
4 结论本研究确定引起深汕合作区大口黑鲈爆发性死亡的致病菌为豚鼠气单胞菌,分析该菌的生理生化性质、耐药性和病理性,同时针对该菌的防控与治疗提出用药建议。结果表明,菌株SZNH-S20230817携带aer、act、lip和fla4个毒力基因,并携带大量耐药基因;药敏试验显示,该菌对β- 内酰胺类、氯霉素类、喹诺酮类和大环内酯类等抗生素药物具有敏感性,可选用头孢曲松、左氟沙星或氟苯尼考治疗由其引起的大口黑鲈疾病。本研究证实五倍子和大黄对菌株SZNH-S20230817的抑菌效果良好,且中草药具有成本低、绿色、副作用小等优点,可作为防控豚鼠气单胞菌的优选药物。
| [1] |
黄太寿, 白俊杰, 李胜杰, 姜兰. 我国加州鲈养殖现状和绿色发展问题探讨[J]. 中国水产, 2017(12): 44-47. HUANG T S, BAI J J, LI S J, JIANG L. Aquaculture status and green development of California perch in China[J]. China Fisheries, 2017(12): 44-47. |
| [2] |
李镕, 白俊杰, 李胜杰, 卢建峰, 李小慧, 刘楚吾. 大口黑鲈选育群体遗传结构的微卫星分析[J]. 广东海洋大学学报, 2010, 30(3): 11-15. DOI:10.3969/j.issn.1673-9159.2010.03.003 LI Y, BAI J J, LI S J, LU J F, LI X H, LIU C W. Analysis on genetic structure of selected population of Largemouth bass by microsatellite DNA markers[J]. Journal of Guangdong Ocean University, 2010, 30(3): 11-15. DOI:10.3969/j.issn.1673-9159.2010.03.003 |
| [3] |
夏焱春, 曹铮, 蔺凌云, 潘晓艺, 姚嘉赟, 刘忆瀚, 尹文林, 沈锦玉. 大口黑鲈主要病害研究进展[J]. 中国动物检疫, 2018, 35(9): 72-76. DOI:10.3969/j.issn.1005-944X.2018.09.019 XIA Y C, CAO Z, LIN L Y, PAN X Y, YAO J Y, LIU Y H, YI W L, SHEN J Y. Research progress on main diseases of Largemouth bass (Micropterus salmoides)[J]. China Animal Health Inspection, 2018, 35(9): 72-76. DOI:10.3969/j.issn.1005-944X.2018.09.019 |
| [4] |
龙波, 王均, 贺扬, 赵敏, 王二龙, 崔静雯, 邓绿洲, 刘韬, 曾宇鲲, 汪开毓, 陈德芳. 加州鲈源维氏气单胞菌的分离、鉴定及致病性[J]. 中国兽医学报, 2016, 36(1): 48-55. DOI:10.16303/j.cnki.1005-4545.2016.01.09 LONG B, WANG J, HE Y, ZHAO M, WANG E L, CUI J W, DENG L Z, LIU T, ZENG Y K, WANG K Y, CHEN D F. Isolation, identification and pathogenicity of Aeromonas welsoni isolated from Micropterus salmoides[J]. Chinese Journal of Veterinary Science, 2016, 36(1): 48-55. DOI:10.16303/j.cnki.1005-4545.2016.01.09 |
| [5] |
黄紫贝, 管飘萍, 郭鑫, 王海燕, 焦库华, 刘文博. 豚鼠气单胞菌引起山羊猝死的鉴定[J]. 中国动物检疫, 2021, 38(12): 121-125, 132. DOI:10.3969/j.issn.1005-944X.2021.12.023 HUANG Z B, GUAN P P, GUO X, WANG H Y, JIAO K H, LIU W B. Identification of sudden death in goats caused by Aeromonas caviae[J]. China Animal Health Inspection, 2021, 38(12): 121-125, 132. DOI:10.3969/j.issn.1005-944X.2021.12.023 |
| [6] |
郭秀平, 林明辉, 何有根, 彭勇鳌, 曹少卫, 石存斌, 黄志斌. 虎纹蛙蝌蚪致病菌株鉴定及药物敏感性分析[J]. 广东农业科学, 2012, 39(9): 114-115. DOI:10.16768/j.issn.1004-874X.2012.09.070 GUO X P, LIN M H, HE Y G, PENG Y A, CAO S W, SHI C B, HUANG Z B. Tiger frog tadpole pathogenic strain identification and drug sensitivity analysis[J]. Guangdong Agricultural Sciences, 2012, 39(9): 114-115. DOI:10.16768/j.issn.1004-874X.2012.09.070 |
| [7] |
张建, 李若铭, 刘俊彤, 单晓枫. 红鲫豚鼠气单胞菌的分离鉴定与毒力、耐药特性分析[J]. 畜牧与兽医, 2023, 55(1): 101-106. ZHANG J, LI R M, LIU J T, SHAN X F. Isolation and identification of Aeromonas caviae from Red crucian carp and analysis of its virulence and drug resistance[J]. Animal Husbandry & Veterinary Medicine, 2023, 55(1): 101-106. |
| [8] |
王意银, 李刚山, 邓波, 朱姝媛, 朱琼媛, 赵丽芝, 王惠萱, 张朝雄, 周丽华, 张富强, 黄留玉, 熊鸿燕, 范泉水. 云南边防部队腹泻患者中8株豚鼠气单胞菌的分离鉴定及致病性研究[J]. 中国卫生检验杂志, 2011, 21(10): 2439-2440. WANG Y Y, LI G S, DENG B, ZHU S Y, ZHU Q Y, ZHAO L Z, WANG H X, ZHANG Z X, ZHOU L H, ZHANG F Q, HUANG L Y, XIONG H Y, FAN Q S. Research on isolation, identification and pathogenicity of 8 strains of Aeromonas caviae in soldiers with diarrhea in border forces of Yunnan[J]. Chinese Journal of Health Laboratory, 2011, 21(10): 2439-2440. |
| [9] |
黄雪敏, 梁华芳, 薛明, 余文智, 李成聪, 陈耀, 温崇庆. 凡纳滨对虾烂尾病病原的分离鉴定及药敏分析[J]. 广东海洋大学学报, 2019, 39(4): 42-48. DOI:10.3969/j.issn.1673-9159.2019.04.007 HUANG X M, LIANG H F, XUE M, YU W Z, LI C C, CHEN Y, WEN C Q. Identification and drug sensitivity test of pathogen isolated from Litopenaeus vannamei associated with tail-rotted disease[J]. Journal of Guangdong Ocean University, 2019, 39(4): 42-48. DOI:10.3969/j.issn.1673-9159.2019.04.007 |
| [10] |
黄郁葱, 简纪常, 吴灶和, 鲁义善, 余坦健. 卵形鲳鲹结节病病原的分离与鉴定[J]. 广东海洋大学学报, 2008(4): 49-53. DOI:10.3969/j.issn.1673-9159.2008.04.011 HUANG Y C, JIAN J C, WU Z H, LU Y S, YU T J. Isolation and identification of the pathogen causing sarcoidosis of Trachinotus ovatus[J]. Journal of Guangdong Ocean University, 2008(4): 49-53. DOI:10.3969/j.issn.1673-9159.2008.04.011 |
| [11] |
陆文浩, 陈辉, 黄春贵. 异育银鲫气单胞菌病原菌鉴定和药敏试验[J]. 广东海洋大学学报, 2009, 29(1): 26-30. DOI:10.3969/j.issn.1673-9159.2009.01.006 LU W H, CHEN H, HUANG C G. Identification and drug sensitive test of the pathogen of Aeromonas disease from Hybridized Prussian Carp (Carassius auratus gibelio ♀×Cyprinus carpio ♂)[J]. Journal of Guangdong Ocean University, 2009, 29(1): 26-30. DOI:10.3969/j.issn.1673-9159.2009.01.006 |
| [12] |
周丽颖, 姜姿妍, 钱且奇, 陈圳, 顾舒文, 李杰, 纪鹏, 高晓建, 姜群, 张晓君. 中华绒螯蟹病原豚鼠气单胞菌的鉴定及其致病性分析[J]. 淡水渔业, 2022, 52(1): 58-65. DOI:10.13721/j.cnki.dsyy.2022.01.006 ZHOU L Y, JIANG Z Y, QIAN Q Q, CHEN Z, GU S W, LI J, JI P, GAO X J, JIANG Q, ZHANG X J. Identification and pathogenicity of pathogenic Aeromonas caviae isolated from Eriocheir sinensis[J]. Freshwater Fisheries, 2022, 52(1): 58-65. DOI:10.13721/j.cnki.dsyy.2022.01.006 |
| [13] |
赵桂新, 张闫, 白和平, 陶勇, 刘畅, 张志强, 吴同垒, 史秋梅. 鸡源豚鼠气单胞菌的分离鉴定及药敏试验[J]. 黑龙江畜牧兽医, 2023(10): 96-101, 140. DOI:10.13881/j.cnki.hljxmsy.2022.05.0280 ZHAO G X, ZHANG Y, BAI H P, TAO Y, LIU C, ZHANG Z Q, WU T L, SHI Q M. Isolation, identification and drug susceptibilty test of chicken-derived Aeromonas caviae[J]. Heilongjiang Animal Science and Veterinary, 2023(10): 96-101, 140. DOI:10.13881/j.cnki.hljxmsy.2022.05.0280 |
| [14] |
刘长宇, 田佳鑫, 张洋, 徐雪彬, 钱爱东, 单晓枫, 刘艳辉. 查干湖鲢源豚鼠气单胞菌分离鉴定及生物学特性研究[J]. 动物医学进展, 2022, 43(2): 41-47. DOI:10.16437/j.cnki.1007-5038.2022.02.006 LIU C Y, TIAN J X, ZHANG Y, XU X B, QIAN A D, SHAN X F, LIU Y H. Isolation, identification and biological characteristics of Aeromonas caviae from Silver Carp in Chagan Lake[J]. Progress in Veterinary Medicine, 2022, 43(2): 41-47. DOI:10.16437/j.cnki.1007-5038.2022.02.006 |
| [15] |
麦耀宝, 陈智光, 陈灼均, 李本旺, 林强. 云斑尖塘鳢烂身病病原分离鉴定及药敏试验[J]. 广东农业科学, 2018, 45(6): 116-119. DOI:10.16768/j.issn.1004-874X.2018.06.019 MAI Y B, CHEN Z G, CHEN Q J, LI B W, LIN Q. Isolation, identification and drug susceptibility of Aeromonas veronii isolated from Oxyeleotris marmoratus[J]. Guangdong Agricultural Sciences, 2018, 45(6): 116-119. DOI:10.16768/j.issn.1004-874X.2018.06.019 |
| [16] |
何恺轩, 温彬, 高建忠, 陈再忠. 七彩神仙鱼BTN1A1基因克隆及其在嗜水气单胞菌胁迫下的表达分析[J]. 广东农业科学, 2024, 51(4): 45-53. DOI:10.16768/j.issn.1004-874X.2024.04.004 HE K X, WEN B, GAO J Z, CHEN Z Z. Cloning of BTN1A1 genes from Symphysodon aequifasciatus and analysis of its expression under Aeromonas hydrophila stress[J]. Guangdong Agricultural Sciences, 2024, 51(4): 45-53. DOI:10.16768/j.issn.1004-874X.2024.04.004 |
| [17] |
蒋花叶, 黄勋, 刘佩君, 吴安华, 刘瑶, 伍亚云. 62例豚鼠气单胞菌感染病例的临床特征和耐药性分析[J]. 中华医院感染学杂志, 2018, 28(24): 3730-3733. DOI:10.11816/cn.ni.2018-183070 JIANG H Y, HUANG X, LIU P J, WU A H, LIU Y, WU Y Y. Clinical characteristics and drug resistance analysis of 62 cases of Aeromonas caviae infection[J]. Chinese Journal of Nosocomiolog y, 2018, 28(24): 3730-3733. DOI:10.11816/cn.ni.2018-183070 |
| [18] |
THOMAS J, MADAN N, NAMBI K S N, ABDUL M S, NAZEER B A, SAHUL H A S. Studies on ulcerative disease caused by Aeromonas caviae-like bacterium in Indian catfish, Clarias batrachus (Linn)[J]. Aquaculture, 2013(2): 376-379146. DOI:10.1016/j.aquaculture.2012.11.015 |
| [19] |
LI R C, CHAN W E, CHEN S. Characterisation of a chromosomally-encoded extended-spectrum β-lactamase gene bla PER-3 in Aeromonas caviae of chicken origin[J]. International Journal of Antimicrobial Agents, 2016, 47(1): 103-105. DOI:10.1016/j.ijantimicag.2015.10.018 |
| [20] |
NONZEE H, PRAMOTE C, TEERASAK K E. Effect of conditioned media from Aeromonas caviae on the transcriptomic changes of the porcine isolates of Pasteurella multocida[J]. BMC Microbiology, 2022, 22(1): 272. DOI:10.1186/S12866-022-02683-Y |
| [21] |
王雨辰, 雷宁, 郝贵杰, 周冬仁, 王锋, 黄爱霞, 崔雁娜, 孙博怿, 林锋. 罗氏沼虾(Macrobrachium rosenbergii) 致病性豚鼠气单胞菌(Aeromonas caviae) 的分离鉴定及其特性分析[J]. 海洋与湖沼, 2023, 54(3): 866-874. DOI:10.11693/hyhz20220900247 WANG Y C, LEI L, HAO G J, ZHOU D R, WANG F, HUANG A X, CUI Y N, SUN B H, LIN F. Isolation, identification, and characterization of pathogenic Aeromonas caviae in Macrobrachium rosenbergii[J]. Oceano logiaet Limnologia Sinica, 2023, 54(3): 866-874. DOI:10.11693/hyhz20220900247 |
| [22] |
李丹怡, 王许诺, 张广桔, 王增焕, 黄珂. 水产养殖环境中抗生素抗性基因(ARGs) 研究进展[J]. 南方水产科学, 2012, 18(5): 166-176. DOI:10.12131/20210207 LI D Y, WANG X N, ZHANG G J, WANG Z H, HUANG K. Advances on antibiotic resistance genes (ARGs) in aquaculture environment[J]. South China Fisheries Science, 2012, 18(5): 166-176. DOI:10.12131/20210207 |
| [23] |
郭莹, 周淼, 李艳和, 王卫民. 罗氏沼虾豚鼠气单胞菌的分离鉴定[J]. 中国农学通报, 2020, 36(33): 147-153. DOI:10.11924/j.issn.1000-6850.casb20191200924 GUO Y, ZHOU M, LI Y H, WANG W M. Aeromonas caviae from Macrobrachium rosenbergii: Isolation and identification[J]. Chinese Agricultural Science Bulletin, 2020, 36(33): 147-153. DOI:10.11924/j.issn.1000-6850.casb20191200924 |
| [24] |
凌空, 王涵, 丁诗华, 吴兴镇. 十六种中草药及其复方对大鲵致病性豚鼠气单胞菌的体外抑制作用[J]. 淡水渔业, 2015, 45(1): 73-78. DOI:10.13721/j.cnki.dsyy.2015.01.013 LIN K, WANG H, DING S H, WU X Z. Inhibitory effects of sixteen kinds of Chinese herbal medicine and their compounds on pathogenic Aeromonas caviae from cultured Andrias davidianus in vitro[J]. Freshwater Fisheries, 2015, 45(1): 73-78. DOI:10.13721/j.cnki.dsyy.2015.01.013 |
| [25] |
JESICA P S, MARIA F P R, MARIA E C, MELINA V M, MARIA D L. Characterization of Pseudomonas syringae strains associated with soybean bacterial blight and in vitro inhibitory effect of oregano and thyme essential oils[J]. Physiological and Molecular Plant Pathology, 2023, 128: 178-192. DOI:10.1016/J.PMPP.2023.102133 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51