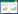文章信息
基金项目
- 国家现代农业产业技术体系专项(CARS-45);中央级公益性科研院所基本科研业务费专项(2023TD49)
作者简介
- 刘丽娟(1995—),女,硕士,研究方向为水产动物病害防治,E-mail:liulijuan918@126.com.
通讯作者
- 张德锋(1985—),男,博士,副研究员,研究方向为水产动物病害防治,E-mail:zhangdefeng08@126.com.
文章历史
- 收稿日期:2023-11-14
2. 华南农业大学海洋学院,广东 广州 510642
2. College of Marine Sciences, South China Agricultural University, Guangzhou 510642, China
【研究意义】鲮(Cirrhinus molitorella)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鲮属(Cirrhinus),是一种亚热带杂食性底层鱼类,因其具有生长速度快、产量高、病害少、养殖周期短等诸多优点,是我国华南地区重要的淡水养殖品种,同时也是我国食品产业的重要原料之一[1-2]。鲮作为中下层鱼类,饵料来源丰富,主要摄食浮游动植物、残饵粪便和有机碎屑等。鲮鱼苗作为鳜和笋壳鱼的优质鲜活饵料,其市场需求量大,已在珠三角地区广泛养殖。随着近年来养殖技术水平的提高,鲮养殖密度也逐年增加,伴随而来的病害发生风险也在不断上升。鲮的养殖过程中,主要有车轮虫、斜管虫、锚头鳋、碘泡虫等感染引起的寄生虫病,也时常暴发细菌性败血症、链球菌病和爱德华氏菌病等细菌性疾病[3-5]。嗜水气单胞菌(Aeromonas hydrophila)是一种重要的人-畜-鱼共患病病原菌,该菌感染宿主范围非常广泛,例如草鱼、鲫、鳙、鳊、团头鲂、罗非鱼和石斑鱼等经济鱼类,可引起运动性气单胞菌败血症和烂尾病等疾病[6]。且由其引起的细菌性败血症流行范围广、流行时间长、发病率和死亡率高,导致嗜水气单胞菌成为水产养殖中的重大威胁。然而抗生素的大量使用造成气单胞菌的耐药性增加[7],不仅危害养殖水环境还加剧疾病治疗难度。因此,深入研究嗜水气单胞菌的流行情况和药物敏感性,对科学防治鲮鱼气单胞菌败血症尤为重要。【前人研究进展】嗜水气单胞为革兰氏阴性杆菌,在水产动物中主要引发细菌性败血症、肠炎等,且具有传染性[8]。嗜水气单胞菌是一种条件致病菌,该菌的致病性与其毒力因子密切相关,主要有溶血素、气溶素、黏附素、肠毒素和一些胞外蛋白酶等[9]。嗜水气单胞菌的毒力强弱取决于其携带的毒力基因数量和毒力基因型。刘杰等[10]研究发现,可将携带溶血素基因hly和细胞毒性肠毒素基因act且同时携带气溶素基因aer、细胞兴奋性肠毒素基因alt、黏附素基因ahal、丝氨酸蛋白酶基因ahp中的2种或2种以上毒力基因作为强毒株的鉴定标准。此外,嗜水气单胞菌的耐药性问题日益凸显,其耐药性阻碍细菌性败血症的治疗,对人类健康亦具有潜在威胁[11-12]。目前,治疗嗜水气单胞菌感染引起的细菌性败血症大多采用抗生素类药物。然而,不科学不规范地使用抗生素造成大量耐药菌株的产生[13]。【本研究切入点】近两年来,广东省养殖场养殖的鲮鱼因患气单胞菌败血症而造成大批死亡,经济损失严重。目前有关鲮鱼感染气单胞菌的报道较少,缺乏对鲮源气单胞菌分类地位、致病力、菌株耐药性及绿色防控药物的研究,且关于鱼源气单胞菌败血症的研究主要围绕维氏气单胞菌展开,对嗜水气单胞菌的研究较少。【拟解决的关键问题】本研究以自然发病的鲮鱼为试验材料,采集不同养殖场患病鲮鱼的病变组织进行病原分离,分离纯化得到10株优势菌,根据其形态特征、生理生化特性和16S rRNA、gyrB基因测序结果对其进行鉴定,并开展分离菌株毒力基因PCR检测、人工感染试验、耐药性分析和中草药药物敏感性试验以及拮抗菌抑菌试验等,旨在分析分离菌株的分类地位、致病力并筛选防控药物,以期为鲮嗜水气单胞菌败血症的有效预防和精准治疗提供科学依据。
1 材料与方法 1.1 试验材料试验于2019年11月至2023年12月在中国水产科学研究院珠江水产研究所水产动物免疫与绿色养殖重点实验室进行。
患病鲮鱼样品采集自广东省江门市、茂名市和肇庆市等地区的4个养殖场。患病鲮鱼的主要症状为鳞片脱落、体表出血溃烂、眼眶周围充血,解剖后可见脾脏肿大发黑、肾脏肿大、腹水等。健康斑马鱼由中国水产科学研究院珠江水产研究所水生实验动物中心提供。
LB肉汤培养基和水解酪蛋白胨(MH)肉汤培养基购自广东环凯微生物有限公司。脱脂绵羊血琼脂平板购自广州市迪景微生物科技有限公司。药敏纸片购自杭州微生物试剂有限公司。黄连素、原儿茶酸和莽草酸购自北京华越洋生物科技有限公司;姜黄素、大黄素和芦荟大黄素购自大连美仑生物技术有限公司;槲皮素和黄岑素购自上海阿拉丁生化科技有限公司;连翘精油、诃子、乌梅和猴耳环购自四川省维克奇生物科技有限公司。PCR实验所用相关试剂购自宝生物工程(大连)有限公司。细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。引物合成和测序服务由广州艾基生物技术有限公司提供。
1.2 试验方法1.2.1 细菌的分离与纯化 在无菌条件下取患病鲮鱼的脾脏和肾脏组织划线接种于脱脂绵羊血琼脂平板,置于28℃培养过夜,挑取优势菌落接种至脱脂绵羊血琼脂平板进行纯化培养,重复1次,挑取单克隆菌落接种至LB液体培养基,28℃培养过夜,收集菌体,加入新鲜培养基和无菌甘油,保藏于-80℃冰箱。
1.2.2 分离菌株的生理生化鉴定 分离菌株接种于LB液体培养基中培养至对数生长期,采用BD Phoenix PID和全自动微生物鉴定及药敏分析系统Phoenix M50(均购自美国BD公司)进行菌株生理生化鉴定,根据仪器判定结果分析分离菌株的种属分类地位。
1.2.3 分离菌株的分子生物学鉴定 采用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA。以基因组DNA为模板,分别使用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')和1492r(5'-GGTTACCTT GTTACGACTT-3'),引物gyrB-F(5'-TCCGGCGGTCTGCACGGCGT-3')和gyrB-R(5'-TTGTCCGGGTTGTACTCGTC-3')通过PCR扩增分离菌株的16S rRNA和gyrB基因,阳性PCR产物送至广州艾基生物技术有限公司进行测序。分离菌株16S rRNA和gyrB基因序列分别通过Blastn在线比对分析,选取代表菌种相应基因序列,采用MEGA7.0软件分别构建系统发育树。
1.2.4 毒力基因检测 参考刘小芳等[9]的方法并作修改,分别通过PCR检测act、aer、alt、弹性蛋白酶基因(ahyB)、温度敏感性蛋白酶基因(eprCAI)、鞭毛蛋白基因(fla)、甘油磷脂胆固醇酰基转移酶基因(gcaT)、热稳定性细胞兴奋性肠毒素基因(ast)、脂肪酶基因(lip)和脱氧核糖核酸酶基因(exu)等10个毒力基因的分布情况,其中ahyB的PCR扩增引物为ahyB-F:5'-TTCAAGCTGAAGATGCGGGT-3' 和ahyB-R:5'-GTCGGATCCTCGAAGTAGCG-3'。PCR扩增产物经1% 琼脂糖凝胶电泳检测,阳性PCR产物进行测序。
1.2.5 回归感染试验 从不同养殖场患病鲮鱼分离的菌株中选取代表菌株Cm1901、Cm2001、Cm2003和Cm2301分别接种于LB培养基,28℃培养至对数生长期,5 000 r/min离心5 min收集菌体,使用0.65% 生理盐水悬浮菌体,并调整菌液浓度为1.67×107 CFU/mL。
健康斑马鱼(100尾)随机分为4个试验组和1个对照组,每组20尾。试验组1~4分别腹腔注射10 μL浓度为1.67×107 CFU/mL的Cm1901、Cm2001、Cm2003和Cm2301菌液;对照组分别腹腔注射10 μL的无菌0.65% 生理盐水。试验过程中水温为29(±0.5)℃,观察并记录试验组的发病和死亡情况,并及时从死亡鱼内脏再分离鉴定病原菌。
1.2.6 贝莱斯芽孢杆菌拮抗抑菌试验 贝莱斯芽孢杆菌作为常见的拮抗益生菌被广泛应用于农作物和水产动物的病害防控[14],本研究采用平板打孔对峙法检测鱼源贝莱斯芽孢杆菌CYS06(GenBank序列号CP137015)、WLYS23[15]和LF01[16]菌株对4株分离菌株Cm901、Cm2001、Cm2003和Cm2301的拮抗抑菌活性,以分析其潜在的生防作用。收集新鲜培养的上述4株分离菌株的菌液,调整其浓度为1.0×107 CFU/mL,分别吸取200 μL菌液均匀涂布于LB琼脂平板上,再用无菌打孔器(直径6 mm)均匀打3个孔,每孔中加入50 μL培养至对数生长期的拮抗菌菌液。置于28℃恒温培养箱培养24 h,观察并测量、记录抑菌圈直径。
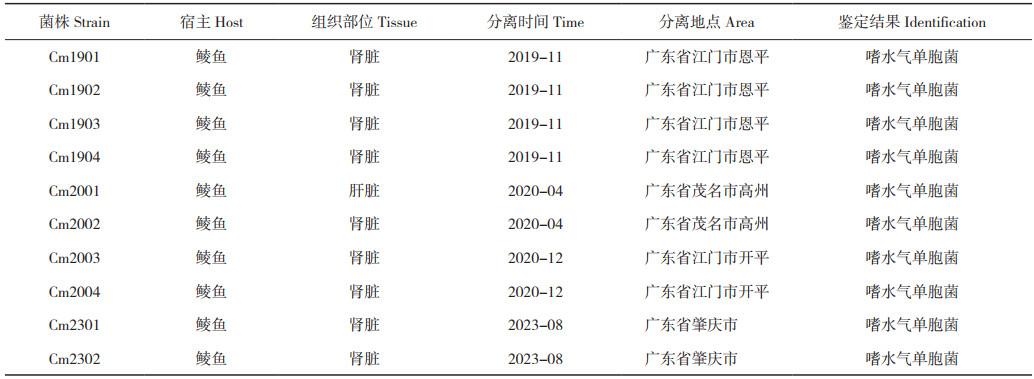
1.2.7 药物敏感性试验 参照美国临床和实验室标准化协会(CLSI)公布的抗菌药物敏感试验执行标准及相关文献[17],采用K-B药敏纸片扩散法检测分离菌株对15种抗菌药物的敏感性。首先,将分离菌株接种于新鲜的LB液体培养基中,培养至对数生长期,涂布于MH琼脂平板。然后分别贴上药敏纸片,置于28℃培养24 h,测量并记录抑菌圈直径。根据药敏纸片说明书并参考CLSI相关标准,判定分离菌株的药物敏感性。
1.2.8 中草药抑菌试验 中草药溶液制备:连翘精油以无水乙醇稀释至51.2 mg/mL后用无菌水稀释至4 096.0 μg/mL;原儿茶酸、黄连素、槲皮素、大黄素、芦荟大黄素和黄岑素以DMSO溶解至51.2 mg/mL,用无菌水稀释至4 096.0 μg/mL;姜黄素先用冰醋酸溶解再用无菌水稀释至4 096.0 μg/mL;莽草酸、诃子、乌梅和猴耳环用无菌水溶解稀释至4 096.0 μg/mL;上述溶液分别用0.22 μm滤膜过滤除菌后备用。
参考陶莎等[18]的方法测定中草药对分离菌株的最小抑菌浓度(MIC),以确定其抑菌效果。调整新鲜培养的4株分离菌株Cm1901、Cm2001、Cm2003和Cm2301的菌液浓度为1.0×106 CFU/mL,在96孔板中每孔加入50.0 µL MH液体培养基后,在首列孔中分别加入稀释好的中草药溶液,以二倍稀释法进行系列梯度稀释,最后加入50.0 µL菌液,使每孔中的菌液浓度均为5.00×105 CFU/mL。阳性对照组仅加入与试验组终浓度相同的菌液,但不加药物;阴性对照组仅加入与试验组终浓度相同的药物,但不加菌液;空白对照仅加入等体积培养基。28℃静置培养24 h后,观察药敏结果,重复3次。通过观察判断分离菌株的培养液是否明显变浑浊,确定每种药物对应的MIC。根据MIC试验结果,分别测定中草药对分离菌株的最小杀菌浓度(MBC),以确定药物的杀菌作用效果。选取MIC对应小孔前的5个孔,分别吸取孔中的培养液100.0 µL,均匀涂布于LB固体培养基上,置于28℃恒温培养箱培养24 h,观察是否有菌落生长。在平板上无菌落生长对应的最低药物浓度即为该药对分离菌株的MBC。
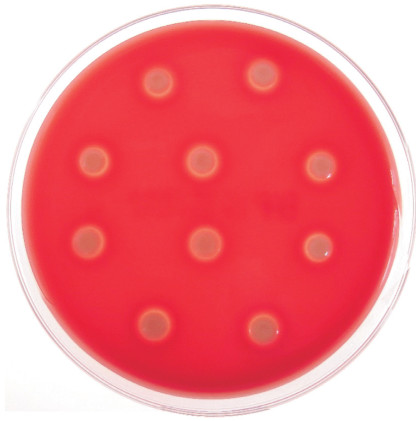
2 结果与分析 2.1 菌株的分离培养从4个养殖场患病鲮鱼体内分离纯化得到Cm1901、Cm1902、Cm1903、Cm1904、Cm2001、Cm2002、Cm2003、Cm2004、Cm2301和Cm2302共计10株细菌(表 1),革兰氏染色及镜检结果显示均为阴性杆状细菌。10株分离菌株在脱脂绵羊血琼脂平板上均具有β溶血活性(图 1),初步表明其为嗜水气单胞菌。
|
| 图 1 10株分离菌株的溶血活性 Fig. 1 Hemolytic activities of ten isolates |
2.2 分离菌株的鉴定结果
2.2.1 生理生化特征 分离菌株采用全自动微生物鉴定及药敏分析系统,10株分离菌株侧金盏花醇、毗咯烷基芳胺酶、L-阿拉伯醇、D-纤维二糖、V-谷氨酷芳胺酶、B-葡萄糖昔酶、B-木糖昔酶、B-丙氨酸芳胺酶、古老糖、尿素酶、D-山梨醇、D-塔格糖、柠檬酸盐(钠)、丙二酸盐、5-酮-葡萄糖昔、α-葡萄糖柠檬酸盐、N-乙酷-B-半乳糖氨酶、α-半乳糖昔酶、磷酸酶、氨基乙酸芳胺酶、鸟氨酸脱羚酶、赖氨酸脱羚酶、组氨酸同化、B-葡萄糖昔酸酶、谷氨酸-甘氨酸-精氨酸芳胺酶、L-苹果酸盐同化和L-乳酸盐同化等均阴性;B-半乳糖首酶、硫化氢、B-N-乙酷葡萄糖、D-葡萄糖、葡萄糖发酵、D-麦芽糖、D-甘露醇、D-甘露糖、L-脯氨酸芳胺酶、脂酶、蔗糖、D-海藻糖、乳酸盐产碱、琥珀酸盐产碱、酪氨酸芳胺酶、CMT、O/129耐受和ELLMAN等均呈阳性。其鉴定的结果显示10株分离菌株均为嗜水气单胞菌,置信度为极好。
2.2.2 分子生物学鉴定 10株分离菌株的16S rRNA基因序列的比对分析结果(图 2A)显示,其与嗜水气单胞菌(GenBank序列号KF413419.1)相似性为100%,与部分维氏气单胞菌的序列相似性≧ 99%;进一步通过系统发育树分析可知,分离菌株与嗜水气单胞菌的亲缘关系最近。此外,基于分离菌株gyrB基因序列的系统发育树可知,分离菌株与嗜水气单胞菌聚为一支(图 2B)。基于分离菌株的生理生化特征和16S rRNA、gyrB基因进化分析,10株分离菌株被鉴定为嗜水气单胞菌。
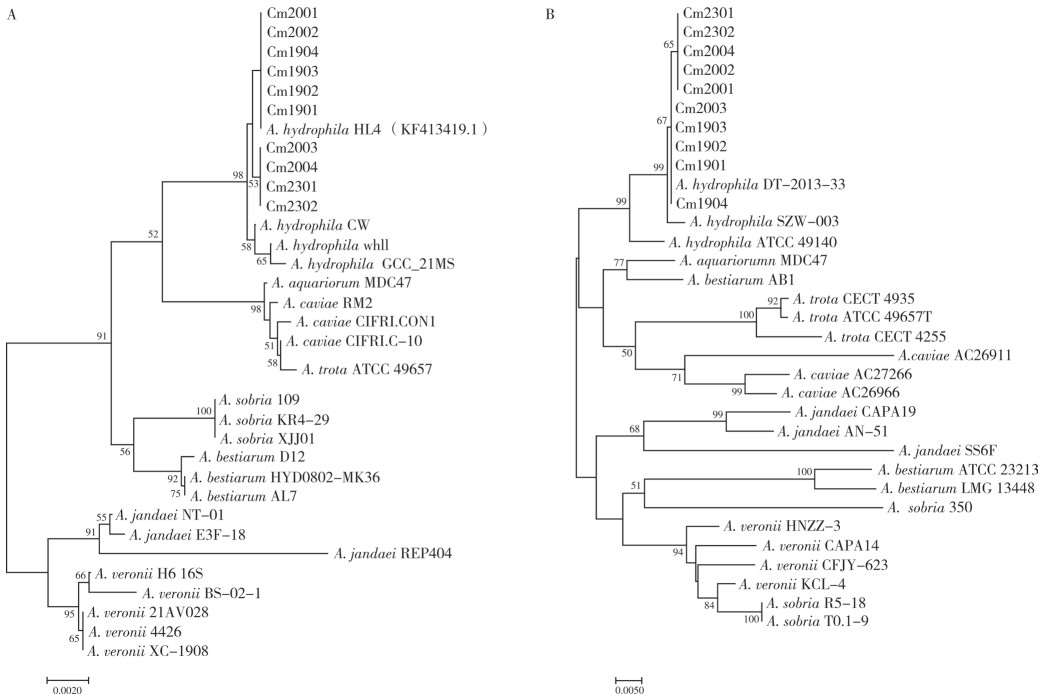
|
| 图 2 基于16S rRNA(A)和gyrB(B)基因序列分别构建的系统发育树 Fig. 2 Phylogenetic trees were constructed based on 16S rRNA (A) and gyrB (B) gene sequences |
2.3 分离菌株毒力基因及分型
分离菌株的毒力基因检测结果显示,10株分离菌株均含有包括aer、alt、ast、act、lip、exu、gcaT、ahyB、fla和eprCAI等常见的10种毒力相关基因(图 3),其毒力基因携带率高且毒力基因型均为aer+-act+-fla+-lip+-gcaT+-exu+-ast+-alt+-eprCAI+-ahyB+,属于广泛流行的毒力基因Ⅰ型。

|
| M: DL2000 Marker; 1: Cm1901;2: Cm1902; 3: Cm1903;4: Cm1904;5: Cm2001;6: Cm2002; 7: Cm2003;8: Cm2004;9: Cm2301;10: Cm2302 图 3 分离菌株毒力基因PCR扩增结果 Fig. 3 PCR detection of the virulence related genes in the isolates |
2.4 分离菌株的回归感染试验
斑马鱼作为模式动物,常用于开展水产动物病原菌感染试验[19-20]。采用斑马鱼进行致病性试验,结果显示分离菌株Cm1901、Cm2001、Cm2003和Cm2301感染斑马鱼后的累积死亡率分别为100%、60%、100% 和55%,表明分离菌株对斑马鱼具有较强的致病性。
分离菌株回归感染斑马鱼后出现急性死亡,24 h内死亡率高达累计死亡数量的80%,发病鱼体表和鳍条基部充血,解剖后可见腹水、脾脏和肾脏明显肿大。从死亡试验鱼中再次分离的病原菌与分离菌株形态、生理生化特性均一致。以上结果表明,分离菌株为患病鲮鱼的致病菌。
2.5 分离菌株的药物敏感性分离菌株Cm1901、Cm2001、Cm2003和Cm2301除对阿莫西林和青霉素天然耐药外,对其他大多数药物敏感(表 2),如氨基糖苷类(Aminoglycosides)的大观霉素、庆大霉素;四环素类(Tetracyclines)的多西环素、四环素;喹诺酮类(Quinolones)的氟罗沙星、诺氟沙星、恩诺沙星;磺胺类(Sulfonamides)的磺胺异噁唑、复方新诺明和氯霉素类(Chloramphenicols)的氟苯尼考、氯霉素等药物敏感,表明分离菌株携带相关耐药基因的可能性较小。
2.6 贝莱斯芽孢杆菌与分离菌株的拮抗作用
拮抗抑菌试验结果显示,贝莱斯芽孢杆菌WLYS23、CYS06和LF01菌株分别对分离菌株Cm1901、Cm2001、Cm2003和Cm2301具有较强的抑菌活性,其抑菌圈直径均为19.8~25.4 mm(图 4)。

|
| 图 4 3株贝莱斯芽孢杆菌对分离菌株的抑菌圈 Fig. 4 Bacteriostatic circles of three Bacillus velezensis strains against the isolates |
2.7 中草药抑菌试验
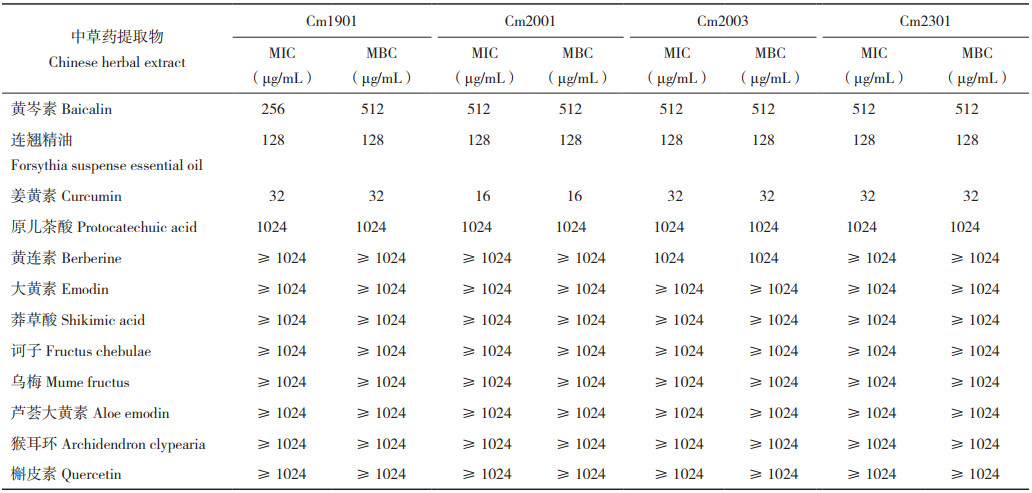
中草药抑菌试验结果显示,不同中草药对分离菌株的MIC和MBC存在明显差异(表 3)。其中,姜黄素对4株代表菌株的MIC为16.0~ 32.0 μg/mL,MBC为16.0~32.0 μg/mL;连翘精油对分离菌株的MIC和MBC均为128.0 μg/mL;黄岑素对代表菌株的MIC为256.0~512.0 μg/mL,MBC为512.0 μg/mL;原儿茶酸、黄连素、槲皮素、大黄素、芦荟大黄素、莽草酸、诃子、乌梅和猴耳环对分离菌株的MIC和MBC均≥ 1 024.0 μg/mL。可见,姜黄素对分离菌株抑菌和杀菌效果最好,连翘精油和黄岑素次之,其余药物的抑菌和杀菌效果较弱。
|
3 讨论
鲮鱼在我国华南地区养殖规模大、养殖密度高,但是,近年来鲮鱼感染细菌性病原的报道越来越多,主要有迟缓爱德华氏菌(Edwardsiella tarda)[5]、嗜水气单胞菌[3]、维氏气单胞菌(Aeromonas veronii)[21]、无乳链球菌(Streptococcus agalactiae)[4]、霍乱弧菌(Vibrio cholerae)[22]等。嗜水气单胞菌引起的淡水鱼细菌性败血症在我国广泛流行,鲮鱼细菌性败血症的病原主要是嗜水气单胞菌与温和气单胞菌,均为革兰氏阴性短杆菌;两种病原菌的生长繁殖温度范围较广,主要危害小规格鲮鱼,具有高发病率和致死率等特点。
本研究发现,在2019年、2020年和2023年广东省江门市、茂名市和肇庆市养殖的鲮鱼暴发性疾病的病原为嗜水气单胞菌。分离菌株对斑马鱼具有较强的致病性,表明嗜水气单胞菌对鲮鱼能够造成较大规模的死亡,生产中应及时采取相应的防治措施。付强等[3]发现从患病鲮鱼体内分离的嗜水气单胞菌致病力较强;邓时铭等[21]从湘华鲮(Sinilabeo tungting)体内分离的嗜水气单胞菌和维氏气单胞菌均具有较高的致病性,其中嗜水气单胞菌的致病性更强,这也暗示嗜水气单胞菌对鲮的危害更大。本研究在不同年份4个养殖场的患病鲮鱼体内均分离到嗜水气单胞菌,表明嗜水气单胞菌是鲮鱼养殖中非常重要的致病菌,这为今后鲮鱼气单胞菌败血症的科学防控提供参考。
毒力基因检测结果显示这些分离菌株具有产生10种相关毒力因子的能力。气单胞菌的气溶素(Aer)具有溶血活性和细胞毒性,破坏细胞膜,引起宿主细胞坏死;肠毒素(Act、Ast、Alt)具有裂解细胞和破坏组织的能力;脂酶可以通过与白细胞相互作用或通过解脂活性产生的脂肪酸影响宿主免疫功能[23];鞭毛和菌毛在气单胞菌肠道定殖起到重要作用[25]。气单胞菌携带的毒力基因与其致病性密切相关,Zhang等[24]发现携带aer、act、ser、exu、lip、luxS和aha基因的菌株致病性强于毒力基因少的菌株。根据毒力基因检测结果可知分离菌株可能具有强致病性,根据刘小芳等[9]研究毒力基因型分型的结果显示,所有菌株均为毒力基因I型,该型嗜水气单胞菌能够引起鱼类24 h内的急性死亡。此外,本研究表明广东省鲮源嗜水气单胞菌的毒力基因型比较单一,暗示该基因型菌株是危害鲮鱼的重要流行株型,这可为今后流行株的疫苗研发提供科学依据。
因气单胞菌含有β-内酰胺酶,故分离菌株对青霉素、阿莫西林耐药可能属于固有耐药[25],这与陈善真等[26]、薛慧娟等[27]研究结果一致。一些分离菌株对罗红霉素和头孢氨苄中度敏感,推测可能携带相关的耐药基因。分离菌株对水产常用药物如氟苯尼考、恩诺沙星、多西环素和磺胺类药物均敏感,表明分离菌株携带相关耐药基因或者相关耐药基因突变的可能性小,在病害预防中可以选用如恩诺沙星、氟苯尼考和多西环素等药物进行精准防控。此外,考虑到鲮鱼是中下层鱼类,养殖池塘底质恶化容易造成病害发生,建议从生态防控角度进行预防。本研究证实贝莱斯芽孢杆菌对鲮源嗜水气单胞菌具有良好的抑菌活性。贝莱斯芽孢杆菌具有蛋白酶、淀粉酶、纤维素酶和脂肪酶等胞外酶活性,其不仅能够降低养殖水体中、鲮鱼肠道中的气单胞菌丰度,还具有改善养殖水体的作用,是一种重要的生态防控益生菌制剂,为今后鲮鱼气单胞菌败血症的防控提供了一种选择。本研究还发现嗜水气单胞菌对姜黄素较敏感,对连翘精油和黄岑素次之,对原儿茶酸不敏感。这与黄东宇[28]、蒋长军等[29]研究结果相似,故推荐姜黄素作为防控嗜水气单胞菌的绿色候选药物。
张旭杰等[30]研究发现,嗜水气单胞菌的毒力大小与菌株含有的毒力基因数量呈正相关,其致病力强弱取决于毒力基因的种类组成。嗜水气单胞菌的毒力基因已被广泛用来研究其潜在的毒力及致病性[31-32],aerA、hlyA、alt、ast、ahpB、lip和fla等基因已被证明在嗜水气单胞菌暴发株中的流行率皆为100%。任燕等[33]研究表明嗜水气单胞菌毒力因子之间表现出协同作用,aer+hlyA+epa+act+毒力基因型的毒力最强,对剑尾鱼的致死率最高。本研究中分离菌株对斑马鱼具有较强的致病性,其人工感染试验死亡率均高于55%,甚至高达100%,攻毒后48 h内斑马鱼出现集中性急性死亡。因此,分离菌株均为强毒株,且其对斑马鱼的强致病力可能是多个毒力基因协同作用的结果。
4 结论本研究通过对患病鲮鱼的病原菌进行鉴定,确定嗜水气单胞菌为引起本研究中鲮暴发性死亡的重要病原菌,且属于广泛流行的毒力基因I型,携带aer、act、fl a、lip、gcaT、exu、ast、alt、eprCAI和ahyB等大量的毒力相关基因,具有较强的致病性。药物敏感性试验结果显示分离菌株对氨基糖苷类、四环素类、喹诺酮类、磺胺类和氯霉素类等抗生素药物敏感,可选用多西环素、恩诺沙星或氟苯尼考科学防治由其引起的气单胞菌败血症。此外,本研究证实贝莱斯芽孢杆菌WLYS23、CYS06和LF01对分离菌株具有较强的抑菌活性,中草药单体姜黄素的抑菌效果较好,这些菌株和中草药具有绿色、安全及无耐药性等优点,故推荐其作为防控嗜水气单胞菌的候选药物,以期促进鲮鱼养殖业的绿色可持续发展。
| [1] |
陈德荫. 中国南方野生鲮鱼(Cirrhinus molitorella)遗传多样性研究[D]. 广州: 暨南大学, 2013. CHEN D Y. The genetic diversity study of wild populations of Cirrhinus molitorella in southern China[D]. Guangzhou: Jinan University, 2013. |
| [2] |
卢天和, 黄光华, 马华威, 吕敏, 黄黎明, 闭显达, 黎灿宁. 鲮体内组织和养殖水体中重金属分布及相关性研究[J]. 水生态学杂志, 2018, 39(2): 64-69. DOI:10.15928/j.1674-3075.2018.02.009 LU T H, HUANG G H, MA H W, LYU M, HUANG L M, BI X D, LI C N. Distribution and correlation of heavy metals in tissues of Cirrhinus molitorella and in culture pond suspended solids and sediment[J]. Journal of Hydroecology, 2018, 39(2): 64-69. DOI:10.15928/j.1674-3075.2018.02.009 |
| [3] |
付强, 王超, 于辉, 郑宗正, 陈言峰. 鲮鱼嗜水气单胞菌病病原的鉴定及药敏试验[J]. 水产科技情报, 2016, 43(6): 308-312, 317. DOI:10.16446/j.cnki.1001-1994.2016.06.006 FY Q, WANG C, YU H, ZHENG Z Z, CHEN Y F. Identification of the pathogen of Aeromonas hydrophila in Cirrhinus molitorella and drug sensitivity test[J]. Fisheries Science & Technology Infor mat ion, 2016, 43(6): 308-312, 317. DOI:10.16446/j.cnki.1001-1994.2016.06.006 |
| [4] |
刘礼辉, 张德锋, 李宁求, 石存斌, 颜曦, 付小哲, 林强. 鲮鱼源无乳链球菌的鉴定、血清型分析及药敏试验[J]. 南方农业学报, 2015, 46(11): 2053-2058. DOI:10.3969/j:issn.2095-1191.2015.11.2053 LIU L H, ZHANG D F, LI N Q, SHI C B, YAN X, FU X Z, LIN Q. ldentification, serotype analysis and drug sensitivity test of Streptococcus agalactiae from Cirrhinus molitorella[J]. Journal of Southern Agriculture, 2015, 46(11): 2053-2058. DOI:10.3969/j:issn.2095-1191.2015.11.2053 |
| [5] |
陈言峰, 卓孝磊, 王超, 郑宗正, 付强. 鲮鱼致病性迟钝爱德华氏菌的鉴定及药敏分析[J]. 水产科学, 2017, 36(1): 48-53. DOI:10.16378/j.cnki.1003-1111.2017.01.008 CHEN Y F, ZHUO X L, WANG C, ZHENG Z Z, FU Q. Identification and analysis of antibiotic sensitivity of pathogenic bacterium Edwardsiella tarda from cultured mud carp(Cirrhinus molitorella)[J]. Fisheries Science, 2017, 36(1): 48-53. DOI:10.16378/j.cnki.1003-1111.2017.01.008 |
| [6] |
沈锦玉. 嗜水气单胞菌的研究进展[J]. 浙江海洋学院学报(自然科学版), 2008, 27(1): 9. DOI:10.3969/j.issn.1008-830X.2008.01.017 SHEN J Y. Research progresss on Aeromonas hydrophila[J]. Journal of Zhejiang Ocean University (Natural Science), 2008, 27(1): 9. DOI:10.3969/j.issn.1008-830X.2008.01.017 |
| [7] |
邓玉婷, 谭爱萍, 张瑞泉, 赵飞, 姜兰. 广东主要水产养殖地区气单胞菌耐药状况的调查分析[J]. 南方农业学报, 2019, 50(11): 2375-2383. DOI:10.3969/j.issn.2095-1191.2019.11.01 DENG Y T, TAN A P, ZHANG R Q, ZHAO F, JIANG L. Antimicrobial resistance of Aeromonas isolates from aquaculture areas in Guangdong[J]. Journal of Southern Agriculture, 2019, 50(11): 2375-2383. DOI:10.3969/j.issn.2095-1191.2019.11.01 |
| [8] |
LIU J, GAO S S, DONG Y H, LU C P, LIU Y J. Isolation and characterization of bacteriophages against virulent Aeromonas hydrophila[J]. BMC Microbiology, 2020, 20(1): 141. DOI:10.1186/s12866-020-01811-w |
| [9] |
刘小芳, 任燕, 张德锋, 巩华, 石存斌, 常藕琴, 潘厚军. 鱼源气单胞菌的毒力基因检测、分型及致病力[J]. 水产学报, 2021, 45(3): 462-471. DOI:10.11964/jfc.20200312180 LIU X F, REN Y, ZHANG D F, GONG H, SHI C B, CHANG O Q, PAN H J. Detection, genotyping an pathogenicity of virulence genes in Aeromonas species isolated from disease freshwater fish[J]. 水产学报, 2021, 45(3): 462-471. DOI:10.11964/jfc.20200312180 |
| [10] |
刘杰, 黄艳华, 黄钧, 胡大胜, 梁静真, 彭亚, 龙苏, 牛志伟, 韩书煜, 植淇业. 黄沙鳖源嗜水气单胞菌的致病力与毒力基因型相关性[J]. 中国水产科学, 2015, 22(4): 698-706. DOI:10.3724/SP.J.1118.2015.140508 LIU J, HUANG Y H, HUANG J, HU D S, LIANG J Z, PENG Y, LONG S, NIU Z W, HAN S Y, ZHI Q Y. Studies on the correlation with pathogenicity and virulence genes of Aeromonas hydrophila by Truogx sinensis[J]. Journal of Fishery Sciences of China, 2015, 22(4): 698-706. DOI:10.3724/SP.J.1118.2015.140508 |
| [11] |
ZHU W, ZHOU S X, CHU W H. Comparative proteomic analysis of sensitive and multi-drug resistant Aeromonas hydrophila isolated from diseased fish[J]. Microbial Pathogenesis, 2020, 139: 103930. DOI:10.1016/j.micpath.2019.103930 |
| [12] |
ROGES E M, GON ALVES V D, CARDOSO M D, FESTIVO M L, SICILIANO S, BERTO L H, PEREIRA V L A, RODRIGUES D D P, AQUINO M H C. Virulence-associated genes and antimicrobial resistance of Aeromonas hydrophila isolates from animal, food, and human sources in Brazil[J]. BioMed Research International, 2020, 2020: 1052607. DOI:10.1155/2020/1052607 |
| [13] |
芦运超, 邱军强, 胡鲲. 药敏试验与比较基因组揭示嗜水气单胞菌耐药潜力[J]. 上海海洋大学学报, 2023, 32(6): 1216-1223. DOI:10.12024/jsou.20220603885 LU Y C, QIU J Q, HU K. Drug sensitivity test and comparative genome revealed the drug resistance potential of Aeromonas hydrophila[J]. Journal of Shanghai Ocean University, 2023, 32(6): 1216-1223. DOI:10.12024/jsou.20220603885 |
| [14] |
张德锋, 高艳侠, 王亚军, 刘春, 石存斌. 贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J]. 微生物学通报, 2020, 47(11): 3634-3649. DOI:10.13344/j.microbiol.china.190947 ZHANG D F, GAO Y X, WANG Y J, LIU C, SHI C B. Advances in taxonomy, antagonistic function and application of Bacillus velezensis[J]. Microbiology China, 2020, 47(11): 3634-3649. DOI:10.13344/j.microbiol.china.190947 |
| [15] |
ZHANG D F, XIONG X L, WANG Y J, GAO Y X, REN Y, WANG Q, SHI C B. Bacillus velezensis WLYS23 strain possesses antagonistic activity against hybrid snakehead bacterial pathogens[J]. Journal of Applied Microbiology, 2021, 131(6): 3056-3068. DOI:10.1111/jam.15162 |
| [16] |
ZHANG D F, GAO Y X, KE X, YI M M, LIU Z G, HAN X Q, SHI C B, LU M X. Bacillus velezensis LF01: In vitro antimicrobial activity against fish pathogens, growth performance enhancement, and disease resistance against streptococcosis in Nile tilapia (Oreochromis niloticus)[J]. Applied Microbiology and Biotechnology, 2019, 103(21/22): 9023-9035. DOI:10.1007/s00253-019-10176-8 |
| [17] |
罗土炎, 饶秋华, 刘洋, 张志灯, 罗钦, 陈美珍, 任丽花, 黄敏敏, 翁伯琦. 澳洲龙纹斑源致病菌嗜水气单胞菌TPF-2的分离鉴定及药敏特性研究[J]. 中国预防兽医学报, 2018, 40(11): 1009-1014. DOI:10.3969/j.issn.1008-0589.201804002 LUO S Y, RAO Q H, LIU Y, ZHANG Z D, LUO Q, CHEN M Z, REN L H, HUANG M M, WENG B Q. Isolation and identification of Aeromonas hydrophila strain T PF-2 from mur ray cod (Maccullochella peelii peelii) and its antibiotic sensitivity[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(11): 1009-1014. DOI:10.3969/j.issn.1008-0589.201804002 |
| [18] |
陶莎, 张效平, 商宝娣, 李小义, 姚俊杰. 中草药及复方对嗜水气单胞菌体外抑菌作用研究[J]. 水产科学, 2022, 41(5): 883-890. DOI:10.16378/j.cnki.1003-1111.20069 TAO S, ZHANG X P, SHANG B D, LI X Y, YAO J J. In vitro effect of single and compound Chinese herbal medicines on bacteriostasis of Aeromonas hydrophila[J]. Fisheries Science, 2022, 41(5): 883-890. DOI:10.16378/j.cnki.1003-1111.20069 |
| [19] |
SARACENI P R, ROMERO A, FIGUERAS A, FIGUERAS A, NOVO A. Establishment of infection models in zebrafish larvae (Danio rerio) to study the pathogenesis of Aeromonas hydrophila[J]. Frontiers in Microbiology, 2016, 7: 1219. DOI:10.3389/fmicb.2016.01219 |
| [20] |
LI J, NI X D, LIU Y J, LU C P. Detection of three virulence genes alt, ahp and aerA in Aeromonas hydrophila and their relationship with actual virulence to zebrafish[J]. Journal of Applied Microbiology, 2011, 110(3): 823-830. DOI:10.1111/j.1365-2672.2011.04944.x |
| [21] |
邓时铭, 程小飞, 刘丽, 邹利, 李传武, 蒋国民. 湘华鲮暴发性死亡病原菌的分离与鉴定[J]. 云南农业大学学报(自然科学), 2020, 35(3): 443-449. DOI:10.12101/j.issn.1004-390X(n).201909005 DENG S M, CHENG X F, LIU L, ZOU L, LI C W, JIANG G M. Isolation and identification of pathogens from an outbreak deaths of Sinilabeo decorus tungting[J]. Journal of Yunnan Agricultural University (Natural Science), 2020, 35(3): 443-449. DOI:10.12101/j.issn.1004-390X(n).201909005 |
| [22] |
蒋国民, 邓时铭, 邹利, 程小飞, 李传武, 刘丽. 湘华鲮一种急性细菌性肠炎的病原分离及组织病理研究[J]. 中国预防兽医学报, 2019, 41(9): 906-910. DOI:10.3969/j.issn.1008-0589.201903021 JIANG G M, DENG M S, ZOU L, CHENG X F, LI C W, LIU L. Identification of a bacterial pathogen isolated from Sinilabeo decorus tung ting with acute bacteria lenter it is and its histopathology observations[J]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(9): 906-910. DOI:10.3969/j.issn.1008-0589.201903021 |
| [23] |
MARTINO M E, FASOLATO L, CARDAZZO B. Aeromonas[J]. Encyclopedia of Food & Health, 2015, 61-67. DOI:10.1016/B978-0-12-384947-2.00013-1 |
| [24] |
ZHANG D X, KANG Y H, SONG M F, SHU H P, GUO S N, JIA J P, TAO L T, ZHAO Z L, ZHANG L, WANG C F, WANG G, QIAN A D, SHAN X F. Identity and virulence properties of Aeromonas isolates from healthy Northern snakehead (Channa argus) in China[J]. Letters in applied microbiology, 2019, 69(2): 100-109. DOI:10.1111/lam.13172 |
| [25] |
陈梦竹. 四川部分地区水生动物源嗜水气单胞菌的分子分型及耐药性调查[D]. 雅安: 四川农业大学, 2022. DOI: 10.27345/d.cnki.gsnyu.2022.000369. CHEN M Z. Study on molecular typing and antimicrobial resistance of Aeromonas hydrophila from aquatic animals in Sichuan province[D]. Yaan: Sichuan Agricultural University, 2022. DOI: 10.27345/d.cnki.gsnyu.2022.000369. |
| [26] |
陈善真, 潘忠超, 段元慧, 王志花, 刘春红, 石和荣, 李其昌, 王贵平. 一株尼罗罗非鱼致病性嗜水气单胞菌的分离鉴定及药敏试验[J]. 广东农业科学, 2014, 41(7): 158-161. DOI:10.16768/j.issn.1004-874X.2014.07.048 CHEN S Z, PAN Z C, DUAN Y H, WANG Z H, LIU C H, SHI H R, LI Q C, WANG G P. Isolation, identification and drug sensitivity test of pathogenic Aeromonas hydrophila from Oreochromis niloticus[J]. Guangdong Agricultural Sciences, 2014, 41(7): 158-161. DOI:10.16768/j.issn.1004-874X.2014.07.048 |
| [27] |
薛慧娟, 邓玉婷, 姜兰, 吴雅丽, 谭爱萍, 王伟利, 罗理, 赵飞. 水产动物源嗜水气单胞菌药物敏感性及QRDR基因突变分析[J]. 广东农业科学, 2012, 39(23): 149-153. DOI:10.16768/j.issn.1004-874X.2012.23.072 XUE H J, DENG Y T, JIANG L, WU Y L, TAN A P, WANG W L, LUO L, ZHAO F. Antimicrobial susceptibility and mutations of QRDR in Aeromonas hydrophila isolated from aquatic animals[J]. Guangdong Agricultural Sciences, 2012, 39(23): 149-153. DOI:10.16768/j.issn.1004-874X.2012.23.072 |
| [28] |
黄东宇. 3种中草药提取物对异育银鲫抗嗜水气单胞菌感染作用研究[D]. 南京: 南京农业大学, 2021. DOI: 10.27244/d.cnki.gnjnu.2019.000075. HUANG D Y. Effects of three kinds of medical herb extraction on non-specific immunology and disease resistance of gibel carp against Aeromonas hydrophila infection[D]. Nanjing: Nanjing Agricultural University, 2021. DOI: 10.27244/d.cnki.gnjnu.2019.000075. |
| [29] |
蒋长军, 管翠翠, 胡小敏, 姚伦广, 阚云超, 邱礽. 黄芩苷对嗜水气单胞菌生物膜形成的影响及体内外的抑菌作用[J]. 微生物学报, 2021, 61(7): 2112-2120. DOI:10.13343/j.cnki.wsxb.20200649 JIANG C J, GUAN C C, HU X M, YAO L G, KAN Y C, QIU R. Bacteriostatic and antibiofilm effects of baicalin on Aeromonas hydrophila: In vitro and in vivo evaluation[J]. Acta Microbiologica Sinica, 2021, 61(7): 2112-2120. DOI:10.13343/j.cnki.wsxb.20200649 |
| [30] |
张旭杰, 杨五名, 李彤彤, 李爱华. 湖北地区暴发病池塘中嗜水气单胞菌的遗传多样性和毒力特征研究[J]. 水生生物学报, 2013, 37(3): 9-15. DOI:10.7541/2013.44 ZHANG X J, YANG W M, LI T T, LI A H. The genetic diversity and virulence characteristics of Aeromonas hydrophila isolated from fishponds with disease outbreaks in Hubei Province[J]. Acta Microbiologica Sinica, 2013, 37(3): 9-15. DOI:10.7541/2013.44 |
| [31] |
陆承平. 致病性嗜水气单胞菌及其所致鱼病综述[J]. 水产学报, 1992, 16(3): 7-16. LU C P. Pathogenic Aeromonas hydrophila and the fish diseases caused by it[J]. Journal of Fisheries of China, 1992, 16(3): 7-16. |
| [32] |
RABAAN A A, GRYLLOS I, TOMAS J M, SHAW J G. Motility and the polar flagellum are required for Aeromonas caviae adherence to HEp-2 cells[J]. Infection and Immunity, 2001, 69(7): 4257-4267. DOI:10.1128/IAI.69.7.4257-4267.2001 |
| [33] |
任燕, 孙承文, 石存斌, 潘厚军, 陶家发, 吴淑勤. 嗜水气单胞菌毒力因子检测及不同毒力基因型菌株对剑尾鱼的致病性研究[J]. 广东农业科学, 2015, 42(7): 113-117. DOI:10.16768/j.issn.1004-874X.2015.17.027 REN Y, SUN C W, SHI C B, PAN H J, TAO J F, WU S Q. Detection of virulence genes in Aeromonas hydrophila and the pathogenicity of different genotype isolates to swordtail[J]. Guangdong Agricultural Sciences, 2015, 42(7): 113-117. DOI:10.16768/j.issn.1004-874X.2015.17.027 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51