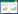文章信息
基金项目
- 国家自然科学基金(U20A2065)
作者简介
- 史磊(1996—),男,在读硕士生,研究方向为水生动物病害防控,E-mail:13619572279@163.com.
通讯作者
- 简纪常(1964—),男,博士,教授,研究方向为水生动物医学,E-mail:jianjc@gdou.edu.cn; 黄浦江(1984—),男,硕士,高级工程师,研究方向为水产动物疫病防控,E-mail:huang851122@126.com.
文章历史
- 收稿日期:2024-05-12
2. 深圳市渔业发展研究中心,广东 深圳 518067;
3. 广东海洋大学深圳研究院,广东 深圳 518120
2. Shenzhen Fisheries Development Research Center, Shenzhen 518067, China;
3. Shenzhen Institute of Guangdong Ocean University, Shenzhen 518120, China
【研究意义】斜带石斑鱼(Epinephelus coioides)属鲈形目(Perciformes)鳍科(Serranidae)石斑鱼属(Epinephelus),主要分布于热带和亚热带海域,具有生长速度快、个体大和肉质鲜美等特点[1]。随着人工养殖和育苗技术蓬勃发展,斜带石斑鱼逐渐成为我国重要的养殖经济鱼类之一,在我国南方沿海地区广泛养殖[2]。2022年我国石斑鱼类养殖总产量为20.58万t,其中广东、海南和福建的石斑鱼养殖产量位居全国前三[3]。因其经济价值高,沿海地区斜带石斑鱼集约化养殖盛行,而高密度养殖易导致病害频发,且全球变暖导致海水温度上升、海洋微生物繁殖旺盛,使海洋中病原菌丰度越来越高、突变频率越来越快。其中,弧菌感染斜带石斑鱼尤为严重,斜带石斑鱼一旦发病,将出现大面积死亡,给斜带石斑鱼养殖产业造成严重损失。【前人研究进展】弧菌属革兰氏阴性菌,广泛分布于自然界中,目前已被发现并鉴定的病原菌包括溶藻弧菌(Vibrio alginolyticus)、创伤弧菌(V. vulnificus)、副溶血弧菌(V. parahaemolyticus)和霍乱弧菌(V. cholerae)等[4]。溶藻弧菌是一种常见的无芽孢、无荚膜、嗜盐、嗜温、厌氧型革兰氏阴性菌[5],也是南方沿海地区海水养殖鱼类常见病原菌之一,具有发病迅速、死亡率高、流行面广等特点[6]。有研究表明,溶藻弧菌与副溶血弧菌特性相似,一旦误食感染该菌的食物,常会引发腹泻[7-10]。此外,溶藻弧菌还能引发多种疾病,例如皮肤表面伤口感染和溃疡、蜂窝组织炎、坏死性筋膜炎、耳部中耳炎、外耳炎、眼部结膜炎、骨髓炎、脑膜炎及败血症等,严重威胁人类健康[11]。【本研究切入点】2023年10月,深圳某石斑鱼养殖基地出现斜带石斑鱼突发性死亡,患病斜带石斑鱼体表皮肤溃烂、皮下出血、内脏器官病变。为确定引起本次斜带石斑鱼突发性死亡的主要病原菌及其生理生化特性,对其进行分析。【拟解决的关键问题】本研究从患病斜带石斑鱼中分离纯化到一株病原菌,并进行生理生化和分子生物学鉴定以确定其种类。通过研究其是否携带耐药基因和毒力基因,并检测其对不同抗生素和不同消毒剂的敏感性,以期为斜带石斑鱼溶藻弧菌感染防控提供参考依据。
1 材料与方法 1.1 试验材料试验于2023年10月在广东海洋大学水产学院实验室开展。供试患病濒死斜带石斑鱼采集自深圳市某石斑鱼养殖基地,体表溃烂、体长10~18 cm、体重200~350 g,用无菌样品袋带回实验室鉴定。健康斜带石斑鱼购自深圳大鹏新区某养殖基地,体长8~18 cm、体重200~350 g。
硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基、生化鉴定试剂盒购自广东环凯生物科技有限公司,药敏纸片购自常德比克曼生物科技有限公司,细菌基因组DNA快速提取试剂盒购自自天根生化科技(北京)公司,Premix TaqTM(Ex TaqTM Version2. 0 plus dye)购自Takara公司。
参考Rahman等[12]和Sawabe等[13]的报道,选取16S rRNA基因和2个管家基因(recA、topA)对不同组织来源的溶藻弧菌做多位点序列分析(Multilocus sequence analysis,MLSA),选取7个毒力基因和30个耐药基因进行毒力基因和耐药基因检测。引物(表 1)由深圳华大基因股份有限公司合成。
1.2 病原菌分离与培养
参考符德佳等[14]的方法,取5条患病死亡石斑鱼进行解剖,剪取鳃丝、鳍条及溃疡处组织部位制成水浸片,镜检观察是否有寄生虫。在超净台上对鱼体进行解剖,取出肝脏、脾脏和肠道组织,分别用生理盐水清洗后,用匀浆器研磨成匀浆。使用一次性接种环分别将上述3种匀浆液接种至TCBS平板,30 ℃培养12 h,观察菌落生长状况。选择形态大小相近且颜色一致的单菌落重新平板划线培养,经2次纯化后,挑取单菌落接种于TSB液体培养基中,28 ℃恒温振荡过夜培养,12 000 r/min离心2 min,收集菌体,加入已灭菌20% 甘油,混匀,保存于-80 ℃冰箱备用。
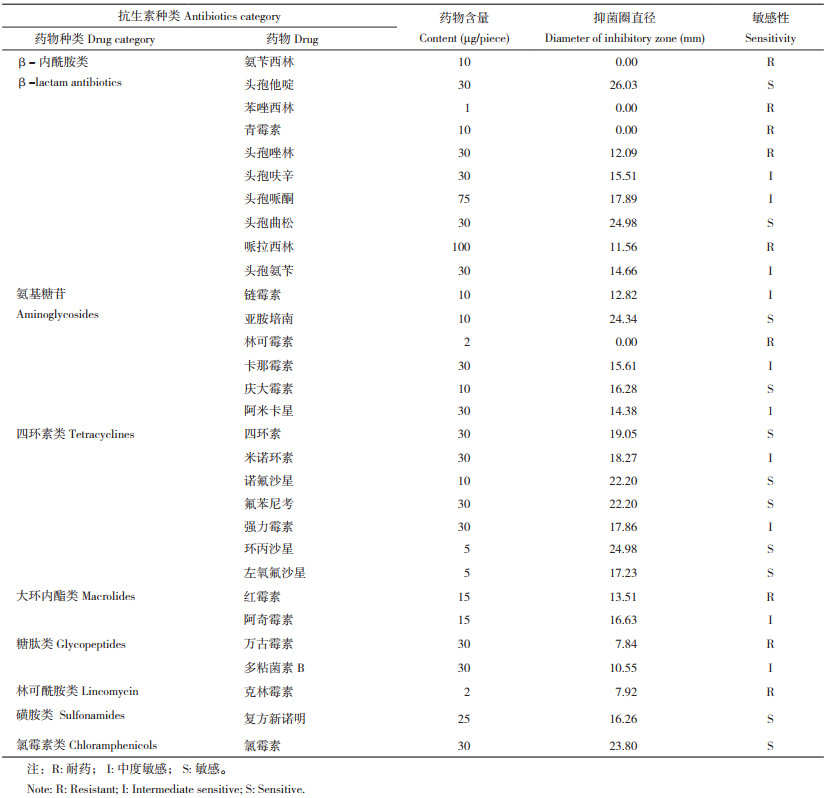
1.3 病原菌鉴定1.3.1 生理生化鉴定 使用细菌微量生化反应管鉴定病原菌的生化性质。挑取单菌落接种于反应管中,28 ℃恒温培养24~48 h,记录生化反应管变化,参照《伯杰氏细菌鉴定手册》 [15]及《水产养殖动物病原细菌学》 [16]进行生理生化鉴定。
1.3.2 分子鉴定 使用基因组DNA快速提取试剂盒提取病原菌的基因组DNA,扩增其16S rRNA基因和管家基因,反应体系为50 μL,PCR程序参照试剂盒说明书进行。取5 μL PCR产物进行1.5% 琼脂糖凝胶电泳检测,阳性PCR产物送至深圳华大基因股份有限公司进行测序。使用DNAMAN软件拼接测序结果,并在NCBI中进行BLAST比对。使用ClustX软件分别进行16S rRNA基因和recA、topA 2种管家基因的多序列比对,利用MEGA11软件采用邻接法(NJ)构建系统发育树。
1.4 回归感染试验参照黄郁葱等[17]的方法,将60条健康斜带石斑鱼于实验室循环水系统暂养2周,水温28.0(±1.0)℃,早晚定时投喂,及时处理循环水系统中残饵,并记录斜带石斑鱼活力状态。暂养2周后,取48尾健康斜带石斑鱼随机分为6组,每组8尾,其中5组为处理组、1组为对照组。将活化后的病原菌接种于TSB液体培养基,28℃振荡培养12 h,调节菌液浓度至1.0×109、1.0×108、1.0×107、1.0×106、1.0×105 CFU/mL。处理组分别从鱼体腹腔注射200 μL上述不同浓度菌液,对照组注射等量无菌PBS溶液。每天记录发病死亡状况,并计算LD50。从患病斜带石斑鱼病灶部位,再次分离病原菌用于后续检测。
于无菌超净台解剖处理组濒死的病鱼和对照组正常鱼体,分离肝脏、肾脏、脾脏及肠道等组织,用4% 多聚甲醛组织固定液固定后,送于深圳赛维尔生物科技有限公司进行包埋、石蜡切片和显微镜镜检拍照分析。
1.5 毒力基因与耐药基因检测溶血素基因(tdh、tlh、trh)、毒力调控基因(toxS)以及其他相关毒力基因(cstA、sto、vpi)共7种毒力基因和30个耐药基因引物序列见表 1。以病原菌的基因组DNA为模板,PCR反应体系20.0 μL:PCR Premix 7 μL,上、下游引物各1.0 μL,DNA模板1.0 μL,无菌ddH2O补足至20.0 μL。PCR反应程序:95 ℃预变性5 min,95 ℃ 30 s,退火30 s(具体退火温度见表 2),72 ℃ 60 s,35个循环;72 ℃延伸10 min。PCR扩增产物经1.5% 琼脂糖凝胶电泳检测,并进行测序和比对。
|
1.6 耐药性分析
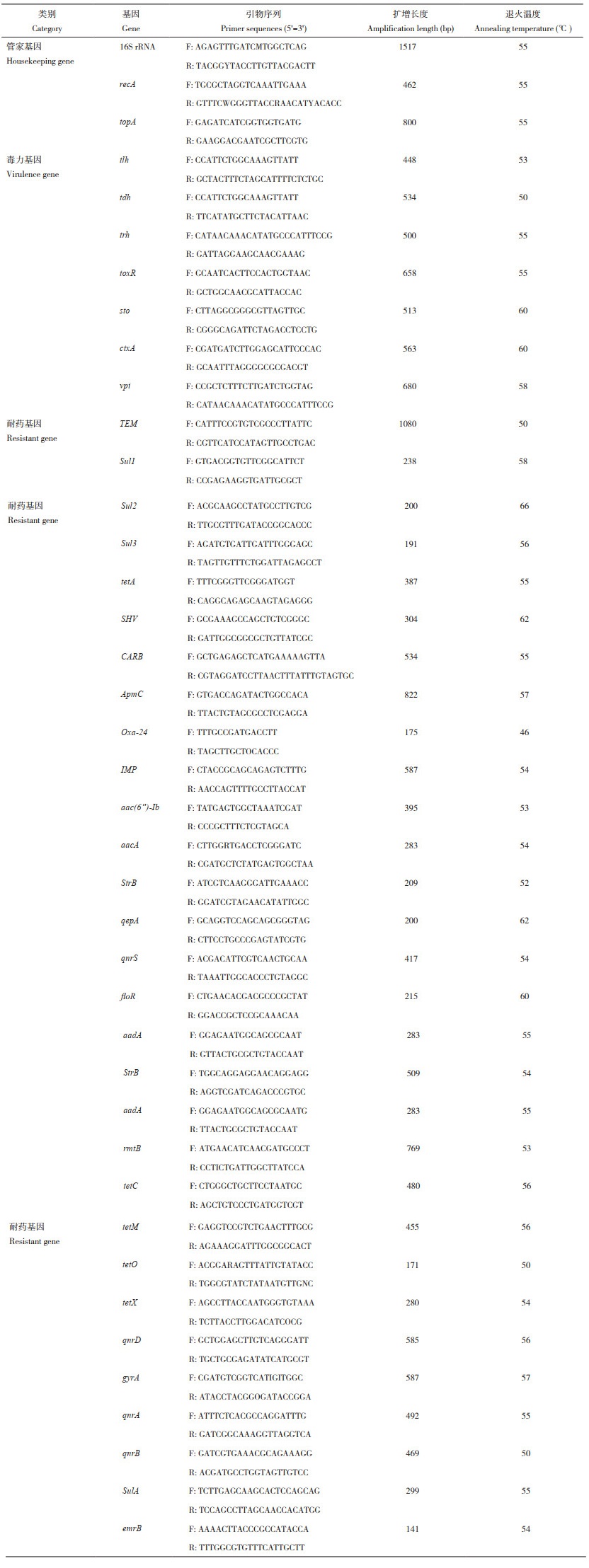
使用K-B药敏纸片扩散法检测病原菌的耐药性。使用药物包括青霉素、头孢唑林、头孢呋辛、头孢哌酮、头孢曲松、氨苄西林、头孢他啶、苯唑西林、哌拉西林、头孢氨苄、链霉素、阿米卡星、四环素、米诺环素、诺氟沙星、亚胺培南、林可霉素、卡那霉素、庆大霉素、氟苯尼考、强力霉素、红霉素、阿奇霉素、万古霉素、环丙沙星、左氧氟沙星、多粘菌素B、克林霉素和复方新诺明氯霉素。
1.7 消毒剂体外抑菌试验使用5种常见消毒液(氢氧化钠、聚维酮碘、次氯酸钠、苯扎溴铵和碘伏)进行体外抑菌试验。根据每种消毒剂的使用说明将其稀释至工作浓度,梯度加入备好的菌液中,37 ℃培养8~9 h,计算消毒剂的最小抑菌浓度(Minimal inhibition concentration, MIC)。
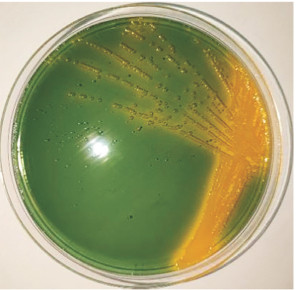
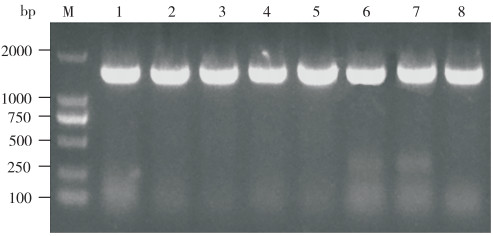
2 结果与分析 2.1 病原菌的分离与鉴定患病斜带石斑鱼病变组织的TCBS平板培养结果(图 1)显示,病原菌的菌落呈黄色、圆形、略微隆起、具有光泽和黏性且边缘光滑。挑选形态大小相近且颜色一致的单菌落进行革兰氏染色,确定其为革兰氏阴性菌。病原菌经过2次纯化后,随机挑选8个单菌落,PCR扩增其16S rRNA基因,结果(图 2)显示8个菌落的条带一致。测序结果表明8个菌落属于同一菌株,将其命名为菌株SZGP226。
|
| 图 1 病原菌的菌落形态 Fig. 1 Colony morphology of pathogenic bacteria |
|
| M:Marker;1~8:菌株SZGP226 M: Marker; 1-8: Stain SZGP226 图 2 病原菌16S rRNA基因PCR产物电泳凝胶图 Fig. 2 Electrophoresis gel images for PCR products of 16S rRNA gene of pathogenic bacteria |
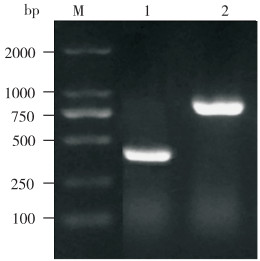
2.1.1 系统发育树分析 PCR扩增菌株SZGP226的16S rRNA、recA、topA基因(图 2、图 3),并在NCBI网站进行比对,结果表明其与溶藻弧菌属成员相应序列相似性高。其中该菌16S rRNA与3株溶藻弧菌(HH101307、IB1、Xmb015)序列相似性达99.72%,recA、topA基因与溶藻弧菌2014V-1072株相应序列相似性达100%。多序列的系统发育树结果(图 4)显示,菌株SZGP226与溶藻弧菌HH101307、IB1和NIOT A聚成一支,鉴定菌株SZGP226为溶藻弧菌。
|
| M: Marker; 1: recA; 2: topA 图 3 菌株SZGP226管家基因recA、topA PCR产物电泳凝胶图 Fig. 3 Electrophoresis gel images for PCR products of the housekeeping genes recA and topA of strain SZGP226 |

|
| 图 4 基于16S rRNA(A)、recA(B)和topA(C)基因序列构建的菌株SZGP226系统发育树 Fig. 4 Phylogenetic tree of strain SZGP226 constructed based on 16S rRNA (A), recA (B) and topA (C) gene sequences |
2.1.2 生理生化鉴定 菌株SZGP226的生化鉴定结果(表 2)显示,该菌可以分解蔗糖、葡萄糖、甘露醇、尿素,V-P检测反应为阳性;乳糖和β-半乳糖苷酶检测反应为阴性。菌株SZGP226可在6%~10% NaCl胨水下生存,无法在0% NaCl胨水中存活。将以上结果与《伯杰氏细菌鉴定手册》 [15]、《水产养殖动物病原细菌学》 [16]和GB/ T4789.7-2013中有关溶藻弧菌鉴定结果对比,发现菌株SZGP226符合溶藻弧菌特性。
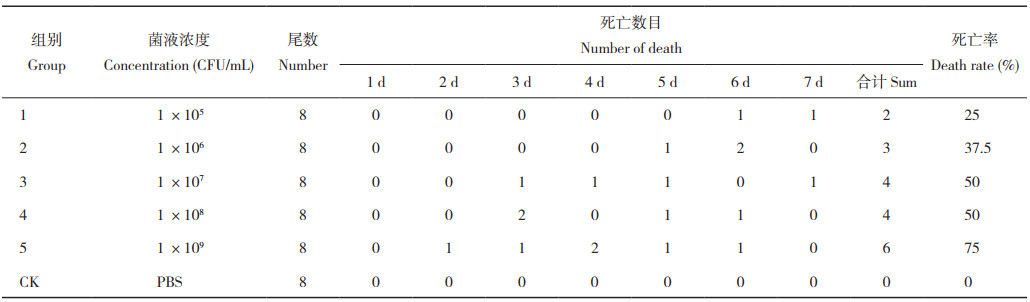
2.2 斜带石斑鱼回归感染试验健康斜带石斑鱼注射不同浓度菌液攻毒7 d后,各组死亡情况如表 3所示。回归感染3 d内,菌液浓度为1.0×109 、1.0×108 CFU/mL的两个处理组开始出现死亡,其他处理组无死亡;感染7 d后,不同浓度菌液对斜带石斑鱼致死率不同,最高浓度处理组(1.0×109 CFU/mL)致死率达75%,最低浓度处理组(1.0×105 CFU/mL)致死率为25%,LC50为1.63×107 CFU/mL,对照组无死亡。回归感染试验的患病斜带石斑鱼发病症状与自然患病的斜带石斑鱼状态一致(图 5)。从回归感染试验的患病濒死斜带石斑鱼病灶部位,重新分离鉴定病原菌菌株,测序结果表明其与菌株SZGP226属同一菌株。表明菌株SZGP226是引起本次斜带石斑鱼发病的病原菌。
|
|
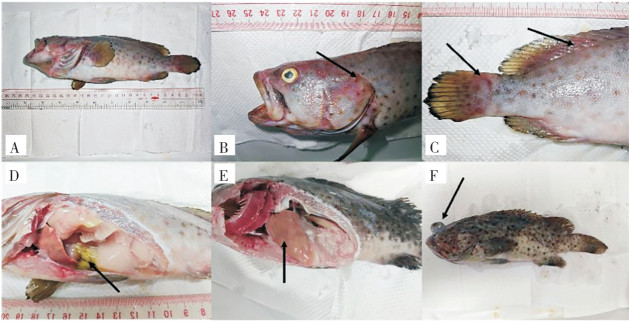
| A: 患病鱼体;B:头部明显出血点;C:尾鳍背鳍出血点;D:腹腔黄色积水;E:肝脏胀大;F:眼球突出 A: The diseased fish; B: The diseased fish with obvious bleeding points on the head; C: Bleeding points found on the caudal and dorsal fins; D: Yellow hydrops in the abdominal cavity; E: Swollen liver; F: Exophthalmos 图 5 回归感染的患病斜带石斑鱼组织切片 Fig. 5 Tissue slice of a diseased Epinephelus coioides with regression infection |
解剖观察发现,回归感染后的斜带石斑鱼鱼体头部、背鳍和尾鳍表面出现出血点、腹部肿大、内部有黄色积液、肝部肿大,部分鱼类出现眼球突出并且伴有溃烂现象(图 5)。处理组与对照组斜带石斑鱼内脏组织切片(图 6)对比发现,处理组斜带石斑鱼的肝脏肝细胞肿大、细胞核浓缩破碎、细胞实质结构遭到明显破坏,呈现脂肪化和空泡化(图 6E);脾脏淋巴细胞坏死、大量炎性细胞浸润(图 6F);肠绒毛结构受到破损以及肠粘膜出血(图 6G);部分肾细胞内线粒体高度扩张呈空泡状,大量巨噬细胞和中性粒细胞浸润、出血(图 6H)。
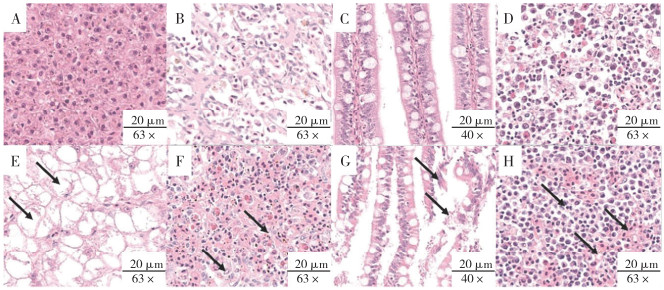
|
| A~D分别为正常斜带石斑鱼肝脏、脾脏、肠道和头肾组织;E: 患病斜带石斑鱼的肝脏细胞核浓缩破碎、细胞实质结构遭到明显破坏,呈脂肪化和空泡化;F:脾脏淋巴细胞坏死、炎性细胞浸润;G:肠绒毛破损和肠粘膜出血;H:肾细胞线粒体扩张成泡状、肾间质大量炎性细胞浸润、出血 A-D were liver, spleen, intestine and head kidney tissues of normal Epinephelus coioides, respectively; E: In the liver of infected Epinephelus coioides shown by arrow, the nucleus was condensed and broken, and the structure of cell parenchyma was obviously damaged, showing fatty degeneration and vacuolization; F: Splenic lymphocyte necrosis and inflammatory cell infiltration; G: Intestinal villus damage and intestinal mucosal bleeding; H: The mitochondria of renal cells were dilated into bubbles, and a large number of inflammatory cells infiltrated the renal interstitium, with hemorrhage 图 6 回归感染的患病斜带石斑鱼肝脏、脾脏、肠道和头肾组织病理变化 Fig. 6 Pathological changes in liver, spleen, intestine and head kidney of diseased Epinephelus coioides with regression infection |
2.3 菌株SZGP226毒力基因和耐药基因检测
选择tlh、tdh、trh、toxR、ctsA、sto和vpi作为溶藻弧菌的毒力基因进行检测[18]。结果(图 7)显示,菌株SZGP226携带tlh、toxR、ctsA、sto、vpi基因,其中tlh、toxR在大多数菌株中存在;ctsA、sto、vpi出现在少数菌株中。其原因可能是不同地区或同一地区不同来源的溶藻弧菌携带毒力基因的种类与数量均存在个别差异。

|
| 1: tlh; 2: tdh; 3: trh; 4: toxR; 5: ctsA; 6; sto; 7: vpi 图 7 菌株SZGP226毒力基因电泳图谱 Fig. 7 Electrophoresis profile of virulence genes of strain SZGP2266 |
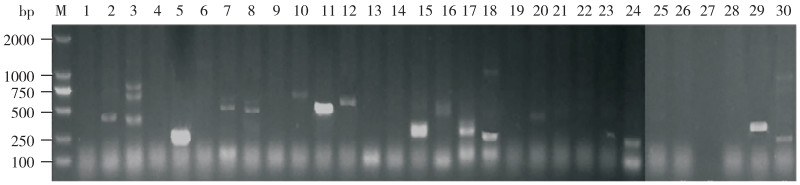
对病原菌进行30种耐药基因检测,结果(图 8)显示该溶藻弧菌携带有9种耐药基因,包括:qnrB、floR、tetC、tetM、qnrD、gyrA、Sul1、SHV、Oxa-24,未检测到其他21种耐药基因。
|
| 1: qnrA; 2: qnrB; 3: qepA; 4: qnrS; 5: floR; 6: catI; 7: tetC; 8: tetM; 9: tetO; 10: tetX; 11: qnrD; 12: gyrA; 13: SulA; 14: emrB; 15: mefC; 16: Sul3; 17: Sul2; 18: Sul1; 19: tetA; 20: rmtB; 21: aacA; 22: StrB; 23: aadA; 24: IMP; 25: aac(6'')-Ib; 26: AmpC; 27: TEM; 28: CARB; 29: SHV; 30: Oxa-24 图 8 菌株SZGP226耐药基因电泳图谱 Fig. 8 Electrophoresis profile of drug resistance genes of strain SZGP226 |
2.4 菌株SZGP226药敏感性试验
30种抗生素药敏试验结果(表 4)显示,菌株SZGP226对β-内酰胺类的氨苄西林、苯唑西林、青霉素、头孢唑林和哌拉西林;氨基糖苷类的林可霉素;大环内酯类的红霉素;糖肽类的万古霉素;林可酰胺类的克林霉素表现出高度耐药性。而对β-内酰胺类的头孢他啶和头孢曲松;氨基糖苷类的亚胺培南和庆大霉素;四环素类的四环素、诺氟沙星、氟苯尼考、环丙沙星和左氧氟沙星、磺胺类的复方新诺明氯霉素类的氯霉素则表现出100% 敏感。对其他药物中度敏感。
2.5 菌株SZGP226消毒剂筛选试验
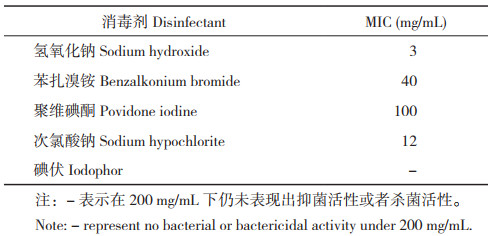
5种消毒剂对菌株SZGP226的MIC测定结果(表 5)表明,杀菌效果最好的消毒液为氢氧化钠、其MIC最低(3 mg/mL),其次为次氯酸钠、苯扎溴铵,聚维酮碘的MIC相对较高(100 mg/mL),碘伏的MIC超过200 mg/mL,其数据不具备参考价值。
|
3 讨论
研究表明,弧菌主要是通过皮肤及消化道来感染人类与水生生物,从而引起体表溃疡、出血性败血症及肠胃炎等。其中,溶藻弧菌(V. alginolyticus)最为典型,是一种海水中常见的嗜盐性革兰氏阴性菌,广泛分布于沿海地区海水环境以及海洋动物体内,可引起对虾类、牙鲆(Paralichthys olivaceus)、日本鳗鲡(Anguillajaponica)与大黄鱼(Larimichthys crocea)等多种水生生物发病,并且在冰鲜海产品中频繁检出,是食源性疾病主要病原菌之一[19]。致病性溶藻弧菌感染人时,常会引起身体软组织、眼睛及耳朵的感染发炎;一旦误食,还会引发食物中毒,引发胃肠道的感染,导致急性肠胃炎[20]。进一步研究发现溶藻弧菌属于人畜共患菌,既可感染鱼类,也能感染牲畜。牲畜感染溶藻弧菌后,其肝脏和脾脏会出现急性炎性损伤。而感染鱼类后,主要症状为体表出现出血性溃疡、反应迟钝、脾脏与肝脏器官充血肿大[21]。早在2002年,有研究者从深圳盐田石斑鱼养殖基地发现并鉴定出强致病性溶藻弧菌[22]。综合以上分离鉴定溶藻弧菌时间,发现发病时间多集中在夏季高温季节,与本文发现溶藻弧菌爆发时间相符,而石斑鱼在夏季节时最为活跃、生长最为迅速,养殖密度增加的同时,溶藻弧菌患病几率也随之增加。且回归感染结果表明本次分离的溶藻弧菌对斜带石斑鱼具有强致病性。
本研究从患病斜带石斑鱼中成功分离到的一株优势菌,通过生理生化和分子生物学鉴定,确定该菌株为溶藻弧菌。随后检测该菌株对30种抗生素的敏感性,发现其对β-内酰胺类与糖肽类部分抗生素出现耐药性,但对头孢他啶、头孢曲松、庆大霉素、四环素、诺氟沙星、氟苯尼考、环丙沙星、左氧氟沙星、复方新诺明和氯霉素表现出敏感。与当地之前的研究对比,发现在原有耐药性基础上新增7种新的抗生素耐药性,表明当地养殖户可能使用新型抗生素替代原有的抗生素,使得当地溶藻弧菌产生多重耐药性。叶明彬等[23]自广东惠东海龟国家级自然保护区,在人工繁育过程中死亡绿海龟稚龟四肢病灶中分离纯化得到溶藻弧菌CMRT91026出现多重耐药性,与本次试验结果较为一致。近年来弧菌耐药性逐渐增强,建议使用化学消毒剂进行预防和治疗。有研究表明部分消毒剂对溶藻弧菌具有强抑制作用[24],本研究发现氢氧化钠消毒剂对溶藻弧菌体外抑菌效果最好、MIC最低,其次为次氯酸钠、苯扎溴铵、聚维酮碘,表明当地溶藻弧菌对部分消毒剂也产生耐药性。建议在实际养殖过程中参考谢明权等[25]的消毒剂使用季节,使用低敏性消毒剂时,先进行预实验,根据预实验效果调整使用剂量,从而降低养殖成本。
本研究发现溶藻弧菌携带9种耐药基因,包括qnrB、fl oR、tetC、tetM、qnrD、gyrA、Sul1、SHV和Oxa-24。酰胺醇类耐药基因fl oR主要与细菌主动外排泵系统有关,细菌能够自主将体内药物排出,从而导致细菌体内药物浓度降低,使得酰胺醇类药物达不到消灭细菌浓度[26]。其中qnr基因编码的Qnr蛋白可能会与喹诺酮类抗生素形成竞争特异性靶点的现象,从而减少喹诺酮-拓扑异构酶-DNA复合物的数量,使其产生耐药性[27]。DNA旋转酶基因gyrA则通常与氟喹若酮类耐药有关[28],此外还检测出酰胺醇类SHV和Oxa-24基因、喹诺酮类Sul1基因、磺胺耐药Sul1基因和四环素类tetC和tetM基因。本研究表明,菌株SZGP226所携带的9种耐药基因与K-B试纸测试中结果显示对β-内酰胺酶类、氨基糖苷类与四环素类耐药,耐药基因与药敏试验结果并非完全一致。细菌产生耐药性的原因种类繁多,其与细菌本身特性、耐药性基因传播和当地养殖户药物使用情况等因素有关,也可能与环境的选择压力有关,还可能因为这些基因本身是沉默基因,而一些耐药菌株不携带耐药基因而是存在其他耐药机制[29]。
本研究在前人溶藻弧菌相关研究基础上,新增毒力基因检测,补充当地溶藻弧菌毒力基因研究数据,溶藻弧菌tlh、toxR、ctsA、sto和vpi基因均为阳性。其中tlh基因与人类弧菌性胃肠炎感染密切相关[30],在环境或临床分离的弧菌中均能检测出该基因,具有种属特异性。有关溶藻弧菌tlh的功能和致病机制尚不清楚[31],但在Jia等[32]研究发现,溶藻弧菌tlh对斑马鱼具有较强的毒性,其LD50为0.8 mg/g。本次病原菌中检测出的ToxR基因与溶血相关,而本次养殖场发病鱼表现出明显的出血症状,可能与该基因有一定关系。研究表明,toxr基因作为调控因子在弧菌中广泛存在,通过复杂的调控机制,使得主要的毒力基因和蛋白在弧菌中得到加强[33]。未在病原菌中检测到tdh和trh基因,这可能与弧菌分裂繁殖过程中针对环境变化而进行进化,导致部分基因出现丢失有关[34]。
目前,在斜带石斑鱼养殖过程中,弧菌病的防控主要以抗生素治疗为主。尽管红霉素、环丙沙星和氯霉素等多种抗生素类药物杀菌效果显著,但其中多数属于水生动物禁用抗生素[3]。然而,滥用抗生素药物易导致细菌产生耐药性、破坏生态平衡[35]。免疫防控是水产病害防控未来的必然趋势。本研究结果表明,菌株SZGP226中存在tlh、toxR、ctsA、sto和vpi等毒力基因和qnrB、floR、tetC、tetM、qnrD、gyrA、Sul1、SHV和Oxa-24等耐药基因,未来对这些基因进行深入研究,有望为当地溶藻弧菌的减活性疫苗的研发提供一定数据支撑。
4 结论本研究鉴定了引起本次斜带石斑鱼大量死亡的病原菌为溶藻弧菌,命名为菌株SZGP226。耐药基因和毒力基因鉴定发现,菌株SZGP226中存在tlh、toxR、ctsA、sto和vpi等5种毒力基因和qnrB、fl oR、tetC、tetM、qnrD、gyrA、Sul1、SHV和Oxa-24等9种耐药基因;对氨苄西林、苯唑西林、青霉素、万古霉素和克林霉素等9种抗生素类药物耐药;对头孢他啶、头孢曲松和四环素等11种抗生素类药物敏感。氢氧化钠消毒剂对溶藻弧菌具有较好的杀菌效果,在养殖前期可提前使用氢氧化钠进行防控,降低溶藻弧菌感染风险。
| [1] |
王大鹏, 曹占旺, 谢达祥, 甘西. 石斑鱼的研究进展[J]. 南方农业学报, 2012, 43(7): 1058-1065. DOI:10.3969/j:issn.2095-1191.2012.07.1058 WANG D Y, CAO Z W, XIE D X, GAN X. Research progress of Grouper[J]. Acta Agricultura Sinica, 2012, 43(7): 1058-1065. DOI:10.3969/j:issn.2095-1191.2012.07.1058 |
| [2] |
袁禹惠, 龚埜, 黄岩, 李松林. 饲料DHA与EPA质量比对斜带石斑鱼稚鱼生长性能、体组成及消化酶活力的影响[J]. 广东海洋大学学报, 2019, 43(6): 1-8. DOI:10.3969/j:issn.2095-1191.2012.07.1058 YUAN Y H, GONG Y, HUANG Y, LI S L. Effects of dietary DHA/ EPA mass ratio on g performance, body composition and digestive enzyme activity of juvenile Grouper with oblique zone[J]. Journal of Guangdong Ocean University, 2019, 43(6): 1-8. DOI:10.3969/j:issn.2095-1191.2012.07.1058 |
| [3] |
农业农村部渔业渔政管理局. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023: 21-23. Fishery administration bureau of the ministry of agriculture. China fisheries statistical yearbook 2023[M]. Beijing: China Agriculture Press, 2023: 21-23. |
| [4] |
张依琳, 吴凡, 简纪常, 蔡双虎. 海水养殖病原弧菌对鱼类宿主定植机制研究进展[J]. 广东海洋大学学报, 2021, 41(6): 138-146. DOI:10.3969/j.issn.1673-9159.2021.06.017 ZHANG Y L, WU F, JIAN J C, CAI S H. Research progress of host colonization mechanism of pathogenic Vibrio in mariculture on fish[J]. Journal of Guangdong Ocean University, 2021, 41(6): 138-146. DOI:10.3969/j.issn.1673-9159.2021.06.017 |
| [5] |
余庆, 李菲, 王一兵, 覃仙玲, 陈宪云, 吴柳莹, 李鹏飞. 广西北部湾大宗海水养殖鱼类卵形鲳鲹感染溶藻弧菌及其致病性研究[J]. 广西科学, 2018, 25(1): 68-73. DOI:10.13656/j.cnki.gxkx.20180208.001 YU Q, LI F, WANG Y B, TAN X L, CHEN X Y, WU L Q, LI P F. Study on infection of Vibrio alginolyticus and its pathogenicity in large mariculture fish pomfret ovoid in beibu gulf of Guangxi[J]. Guangxi Science, 2018, 25(1): 68-73. DOI:10.13656/j.cnki.gxkx.20180208.001 |
| [6] |
丁淑妍, 侯丽艳, 于成勇, 张剑, 解洁, 黄忠义, 曲业敏, 李文晓, 王明义. 海洋性弧菌致病机制研究进展[J]. 职业与健康, 2019, 35(7): 984-989. DOI:10.13329/j.cnki.zyyjk.2019.0261 DING S Y, HOU L Y, YU C Y, ZHANG J, XIE J, HUANG Z Y, QU Y M, LI W X, WANG M Y. Marine Vibrio pathogenic mechanism research progress[J]. Journal of Occupational and Health, 2019, 35(7): 984-989. DOI:10.13329/j.cnki.zyyjk.2019.0261 |
| [7] |
LARSEN J L, FARID A F, DALSGAARD I. Occurrence of Vibrio parahaemolyticus and Vibrio alginolyticus in marine and estuarine bathing areas in danish coast[J]. Zentralblatt fur Bakteriologie, Mikrobiologie und Hygiene, 1981, 338-345. |
| [8] |
侯霄煜. 由溶藻弧菌引起的一起食物中毒[J]. 中国卫生检验杂志, 2005(9): 11-23. DOI:10.3969/j.issn.1004-8685.2005.09.051 HOU X Y. A food poisoning caused by Vibrio alginolyticus[J]. Chinese Journal of Health Laboratory Technology, 2005(9): 11-23. DOI:10.3969/j.issn.1004-8685.2005.09.051 |
| [9] |
龚玲芬, 郁祝新. 副溶血弧菌和溶藻弧菌混合污染引起食物中毒的调查[J]. 职业与健康, 2008(4): 343-344. DOI:10.3969/j.issn.1004-1257.2008.04.022 GONG L F, YU Z X. Investigation on food poisoning caused by mixed contamination of Vibrio paraholyticus and Vibrio alginolyticus[J]. Occupational Health, 2008(4): 343-344. DOI:10.3969/j.issn.1004-1257.2008.04.022 |
| [10] |
黄妙芬, 刘坚基, 连宪强, 刘国栋, 范秋华, 骆文博, 李镇涛. 2021—2022年广东省深圳市大鹏新区海水及海产品溶藻弧菌的污染状况、毒力基因分布和耐药性研究[J/OL]. 疾病监测, 1-7[2024-05-20]. http://kns.cnki.net/kcms/detail/11.2928.R.20240318.1616.004.html. HUANG M F, LIU J J, LIAN X Q, LIU G D, FAN Q H, LUO W B, LI Z T. Pollution status, virulence gene distribution and drug resistance of Vibrio alginolyticus in seawater and marine products, Shenzhen, Guangdong Province[J/OL]. Disease Surveillance, 1-7[2024-05-20]. http://kns.cnki.net/kcms/detail/11.2928.R.20240318.1616.004.html. |
| [11] |
林燕, 郑双来. 一起由溶藻弧菌引起食源性疾病疫情的调查分析[J]. 中国农村卫生事业管理, 2017, 37(1): 59-60. DOI:10.19955/j.cnki.1005-5916.2017.01.022 LIN Y, ZHENG S L. Investigation and analysis of a food-borne disease outbreak caused by Vibrio alginolyticus[J]. Chinese Rural Health Service Administration, 2017, 37(1): 59-60. DOI:10.19955/j.cnki.1005-5916.2017.01.022 |
| [12] |
RAHMAN M S, MARTINO M E, CARDAZZO B, FACCO P, BORDIN P, MIONI R, NOVELLI E, FASOLATO L. Vibrio trends in the ecology of the Venice lagoon[J]. Applied and Environmental Microbiology, 2014, 80(8): 2372-2380. DOI:10.1128/AEM.04133-13 |
| [13] |
SAWABE T, KITA-TSUKAMOTO K, THOMPSON F L. Inferring the evolutionary history of vibrios by means of multilocus sequence analysis[J]. Journal of Bacteriology, 2007, 189(21): 7932-7936. DOI:10.1128/JB.00693-07 |
| [14] |
符德佳, 康桦华, 曾宪军, 樊志红, 陈杰, 黄炜乾, 蒋顺进, 彭新宇. 鸡场饮水中肺炎克雷伯氏菌的分离鉴定及耐药性研究[J]. 广东农业科学, 2024, 51(2): 124-138. DOI:10.16768/j.issn.1004-874X.2024.02.012 FU D J, KANG H H, ZENG X J, Fan Z H, CHEN J, HUANG W Q, JIANG S J, PENG X Y. Isolation, identification and drug resistance of Klebsiella pneumoniae in drinking water of chicken farm[J]. Guangdong Agricultural Sciences, 2024, 51(2): 124-138. DOI:10.16768/j.issn.1004-874X.2024.02.012 |
| [15] |
HOLT J G, KRIEG N R, SNEATH P H A, STALEY JT, WILLIAMS S T. Bergey's manual of determinative bacteriology[M]. Maryland: Lippincott, Williams & Wilkins, 1994: 565-786.
|
| [16] |
房海, 陈翠珍, 张晓君. 水产养殖动物病原细菌学[M]. 北京: 中国农业出版社, 2010. FANG H, CHEN C Z, ZHANG X J. Pathogenic bacteriology of aquaculture animals[M]. Beijing: China Agriculture Press, 2010. |
| [17] |
黄郁葱, 简纪常, 吴灶和, 鲁义善, 余坦健. 卵形鲳鲹结节病病原的分离与鉴定[J]. 广东海洋大学学报, 2008(4): 49-53. DOI:10.3969/j.issn.1673-9159.2008.04.011 HUANG Y C, JIAN J C, WU Z H, LU Y S, YU T J. Isolation and identification of the pathogen of sarcoidosis of pomfret ovale[J]. Journal of Guangdong Ocean University, 2008(4): 49-53. DOI:10.3969/j.issn.1673-9159.2008.04.011 |
| [18] |
邬长祥. 我国南方养殖海域溶藻弧菌的遗传多样性及部分毒力基因的分布特征研究[D]. 湛江: 广东海洋大学, 2012. DOI: 10.7666/d.Y2215274. WU C X. Study on genetic diversity and distribution characteristics of some virulence genes of Vibrio alginolyticus in culture waters of southern China[D]. Zhanjiang: Guangdong Ocean University, 2012. DOI: 10.7666/d.Y2215274. |
| [19] |
HORⅡ T, MORITA M, MURAMATSU H, MONJI A, MIYAGISHIMA D, KANNO T, MAEFAWA M. Antibiotic resistance in aeromonas hydrophila and Vibrio alginolyticus isolated from a wound infection: A case report[J]. Journal of Trauma Injury Infection & Critical Care, 2005, 58(1): 196-200. DOI:10.1097/01.ta.0000066381.33339.c0 |
| [20] |
CHEN Z, YAO Z, LIN M, CHANG J. Isolation and identification of Vibrio rotiferianus from diseased half-smooth tongue sole (Cynoglossus semilaevis Günther)[C]// International Conference on Biomedical Engineering & Informatics, 2011. DOI: 10.1109/BMEI.2011.6098731.
|
| [21] |
雷美华, 喻大鹏, 邓国华, 时少坤, 黄浦江, 鲁义善, 冯卫权. 线纹海马源溶藻弧菌的分离、鉴定及药敏分析[J]. 基因组学与应用生物学, 2021, 40(4): 1679-1686. DOI:10.13417/j.gab.040.001679 LEI M H, YU D P, DENG G H, SHI S K, HUANG P J, LU Y S, FENG W Q. Isolation, identification and drug susceptibility analysis of Vibrio alginolyticus from hippocampi lineatus[J]. Journal of Genomics and Applied Biology, 2021, 40(4): 1679-1686. DOI:10.13417/j.gab.040.001679 |
| [22] |
胡学峰, 石存斌, 潘厚军, 李宁求, 吴淑勤. 海水养殖斜带石斑鱼溃疡病病原菌(溶藻弧菌) 的初步研究[J]. 中国海洋大学学报(自然科学版), 2005(2): 232-236. DOI:10.16441/j.cnki.hdxb.2005.02.011 HU X F, SHI C B, PAN H J, LI N Q, WU S Q. Preliminary study on the pathogenic bacteria (Vibrio alginolyticus) of the canker disease of Epinephelus obliquus in mariculture[J]. Journal of Ocean University of China (Natural Science Edition), 2005(2): 232-236. DOI:10.16441/j.cnki.hdxb.2005.02.011 |
| [23] |
叶明彬, 陈华灵, 冯国清, 梁志凌, 端金霞, 刘振兴, 观玉安. 绿海龟源溶藻弧菌的分离鉴定及药敏分析[J]. 广东农业科学, 2020, 47(6): 97-105. DOI:10.16768/j.issn.1004-874X.2020.06.014 YE M B, CHEN H L, FENG G Q, LIANG Z L, DUAN J X, LIU Z X, GUAN Y A. Isolation, identification and drug sensitivity analysis of Vibrio alginolyticus from green sea turtle[J]. Guangdong Agricultural Sciences, 2020, 47(6): 97-105. DOI:10.16768/j.issn.1004-874X.2020.06.014 |
| [24] |
谷桂英, 王欣, 付强. 三种消毒剂对大黄鱼致病性弧菌的体外杀灭作用研究[J]. 工业微生物, 2019, 49(3): 19-26. DOI:10.3969/j.issn.1001-6678.2019.03.004 GU G Y, WANG X, FU Q. Effect of three disinfectants on pathogenic Vibrio of large yellow croaker in vitro[J]. Industrial Microbiology, 2019, 49(3): 19-26. DOI:10.3969/j.issn.1001-6678.2019.03.004 |
| [25] |
谢明权, 吴惠贤, 彭新宇, 谢宏料, 魏文康, 温列娜. 消毒剂在不同季节的消毒效果研究[J]. 广东农业科学, 1998(2): 43-44. DOI:10.16768/j.issn.1004-874X.1998.02.018 XIE M Q, WU H X, PENG X Y, XIE H L, WEI W K, WEN L N. Study on disinfection effect of disinfectants in different seasons[J]. Guangdong Agricultural Sciences, 1998(2): 43-44. DOI:10.16768/j.issn.1004-874X.1998.02.018 |
| [26] |
沈飞, 翟玉菲, 王浩, 吕利群. 大菱鲆弧菌耐药谱, 耐药基因检测和ERIC-PCR分型分析[J]. 南方水产科学, 2002, 18(1): 118-127. DOI:10.12131/20210138 SHEN F, ZHAI Y F, WANG H, LYU L Q. Detection of drug resistance spectrum, drug resistance gene and ERIC-PCR typing of Vibrio turbot[J]. Southern Fisheries Science, 2002, 18(1): 118-127. DOI:10.12131/20210138 |
| [27] |
王晓璐, 樊英, 王友红, 许拉, 王淑娴, 于晓清, 盖春蕾, 刘吉丹, 叶海斌, 刘洪军, 刁菁, 郭萍萍, 吴松波. 斑节对虾(非洲群体) 肠道细菌抗生素耐药性及耐药基因分布特征[J]. 微生物学报, 2022, 62(9): 3399-3409. DOI:10.13343/j.cnki.wsxb.20220005 WANG X L, FAN Y, WANG Y H, XU L, WANG S X, YU X Q, GAI C L, LIU J D, YE H B, LIU H J, DIAO J, GUO P B, WU S B. Distribution characteristics of antibiotic resistance and resistance genes in intestinal bacteria of Penaeus maculatus (African population)[J]. Journal of Microbiology, 2022, 62(9): 3399-3409. DOI:10.13343/j.cnki.wsxb.20220005 |
| [28] |
LIU M, WONG M H Y, CHEN S. Mechanisms of fluoroquinolone resistance in Vibrio parahaemolyticus[J]. International Journal of Antimicrobial Agents, 2013, 42(2): 187-188. DOI:10.1016/j.ijantimicag.2013.04.024 |
| [29] |
魏文娟, 赵姝, 王元, 周俊芳, 李新苍, 房文红. 副溶血弧菌养殖对虾分离株耐药性及耐药基因分析[J]. 南方水产科学, 2019, 16(1): 9-16. DOI:10.12131/20190165 WEI W J, ZHAO S, WANG Y, ZHOU J F, LI X C, FANG W H. Analysis of drug resistance and drug resistance genes of cultured Vibrio parahaemolyticus shrimp isolates[J]. Southern Fisheries Science, 2019, 16(1): 9-16. DOI:10.12131/20190165 |
| [30] |
SH IRAIH, NAKABAYA SHIN, KUMAGA I K. Molecula r epidemiologic evidence for association of thermostable direct hemolysin (TDH) and TDH-related hemolysin of Vibrio parahaemolyticus with gastroenteritis[J]. Infection and Immunity, 1990, 58(11): 3568-3573. DOI:10.1007/BF01646419 |
| [31] |
郑玉东, 张翔, 姚梦丽, 谷莉, 黄博闻, 辛鲁生, 白昌明, 王崇明, 唐小千. 养殖环境及贝源溶藻弧菌MLST分型及其毒力基因、耐药性分析[J]. 渔业科学进展, 2024, 45(1): 211-223. DOI:10.19663/j.issn2095-9869.20221025001 ZHENG Y D, ZHANG X, YAO M L, GU L, HUANN B W, XIN L S, BAI C M, WANG C M, TANG X Q. MLST typing, virulence gene and drug resistance analysis of Vibrio alginolyticus from culture environment and shellfish[J]. Progress in Fisheries Science, 2024, 45(1): 211-223. DOI:10.19663/j.issn2095-9869.20221025001 |
| [32] |
JIA A, WOO N Y S, ZHANG X H. Expression, purification, and characterization of thermolabile hemolysin (TLH) from Vibrio alginolyticus[J]. Diseases of Aquatic Organisms, 2010, 90(2): 121-127. DOI:10.1038/79664 |
| [33] |
胡梦华, 马立才, 赵姝, 刘旭, 周俊芳, 房文红. 一株致病性溶藻弧菌的多重耐药与毒力基因分子分析[J]. 海洋渔业, 2015, 37(6): 557-564. DOI:10.13233/j.cnki.mar.fish.2015.06.010 HU M H, MA L C, ZHAO S, LIU X, ZHOU J F, GANG W H. Molecular analysis of multiple drug resistance and virulence genes of a pathogenic Vibrio alginolyticus[J]. Journal of Marine Fishery, 2015, 37(6): 557-564. DOI:10.13233/j.cnki.mar.fish.2015.06.010 |
| [34] |
PARK K S, ⅡDA T, YAMAICHI Y, OYAGI, YAMAMOTO K. Genetic characterization of DNA region containing the trh and ure genes of Vibrio parahaemolyticus[J]. Infection and Immunity, 2000, 68(10): 5742-5748. DOI:10.1128/IAI.68.10.5742-5748.2000 |
| [35] |
肖倩. 水产养殖中抗生素滥用问题研究[J]. 养殖与饲料, 2020, 19(10): 46-48. DOI:10.13300/j.cnki.cn42-1648/s.2020.10.021 XIAO Q. Abuse of antibiotics in aquaculture research[J]. Journal of Breed and Feed, 2020, 19(10): 46-48. DOI:10.13300/j.cnki.cn42-1648/s.2020.10.021 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51