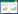文章信息
基金项目
- 广东省科学院建设国内一流研究机构行动专项(2018GDASCX-0926);广东省科学院分支机构专项;湛江市科技计划项目(2021B01057)
作者简介
- 陈梦仪(1994—),女,硕士,研究方向为生物技术,E-mail:404074368@qq.com.
通讯作者
- 张逸飞(1989—),男,博士,助理研究员,研究方向为生物技术,E-mail:yifeicr7@163.com.
文章历史
- 收稿日期:2024-04-10
2. 广东省科学院南繁种业研究所湛江研究中心,广东 湛江 524300;
3. 广东省科学院湛江研究院,广东 湛江 524000
2. Zhanjiang Research Center, Institute of Nanfan & Seed Industry, Guangdong Academy of Sciences, Zhanjiang 524300, China;
3. Zhanjiang Research Institute, Guangdong Academy of Sciences, Zhanjiang 524000, China
【研究意义】彩叶芋(Caladium bicolor)又名五彩芋,是一种色彩斑斓的天南星科观叶植物。彩叶芋具有较高的观赏价值,深受年轻人喜欢,其中已有50多个品种投入大规模生产[1];此外,彩叶芋的叶片含有丰富的次级代谢产物,相关提取物具有一定的药用价值[2]。【前人研究进展】彩叶芋的繁殖方式有种子繁殖、块茎繁殖及组培快繁[3]。种子繁殖主要用于杂交育种,后代性状常具有明显的分化,并且周期较长;块茎繁殖可用于规模化生产,但操作过程中容易积累病毒,影响标准化生产[4-5]。组培快繁技术是更加适用于现代化生产的扩繁技术,在保持性状相对稳定的同时可减少病毒病的发生,因此受到许多公司和苗圃的青睐[6-7]。在植物组培快繁过程中,组培苗常置于人工环境中培养,移栽后环境的差异导致其根系吸收能力及抗逆性较弱,次生代谢物积累较低[8-10],其中花青素等物质的积累可影响组培苗性状的稳定性。不同生长阶段、环境因素及表观遗传变化影响观赏植物花青素的积累,导致组培再生植株出现色彩图案变异的现象[11-12],降低组培苗向商品苗转变的效率。光质影响植物次生代谢物的积累,是决定叶片颜色和形状的重要因子[13-14]。单色的红光或蓝光比白光更有利于次生代谢产物的合成[15],蓝光照射能够显著增加多种作物的花青素苷含量[16],也有利于初级代谢物的积累,组合光有利于酚类等次级代谢物的积累[17]。因此,通过优化组培苗生长所需的光质配比,加速幼苗形态建成和代谢物质积累[14, 18],可以提高彩叶芋成苗品质。【本研究切入点】本研究以彩叶芋品种Caladium bicolor (Ait.) Vent为试验对象,探究不同光质配比对彩叶芋组培再生植株形态建成和色素积累水平的影响,促进彩叶芋组培苗向商品苗的转变。【拟解决的关键问题】目前,彩叶芋组培苗生长通常依赖于自然光照,成苗质量和效率受限于天气情况,难以保障生产效率和标准化。本研究拟确定适宜彩叶芋组培苗栽培过程的光质配比,为提高彩叶芋商品苗生产的效率提供理论参考。
1 材料与方法 1.1 试验材料供试材料为彩叶芋Caladium bicolor (Ait.) Vent,叶脉绿色,脉间红色,采自广东省科学院南繁种业研究所湛江研究中心花卉种质资源圃,参照吴雅露等[19]方法诱导彩叶芋再生植株。
1.2 试验设计彩叶芋组培苗根系洗干净后移栽到泥炭土:蛭石体积比为1︰1的基质中。盆苗室内放置1 d,再置于光照强度均为35(± 1)μmol/m2·s的7种光质下开展试验,测定仪器使用Asensetek照明护照标准版Pro。7种光质设计如下:LED白光、LED红光(660 nm)、LED蓝光(447 nm)、LED红蓝白光比例为1︰1︰1、LED红蓝绿光比例为1︰1︰1、LED红蓝白绿光比例为1︰1︰1︰1及白色荧光灯(CK),7种光质处理分别表示为LED白光、LED红光、LED蓝光、LED红蓝白1︰1︰1、LED红蓝绿1︰1︰1、LED红蓝白绿1︰1︰1︰1和白色荧光灯。培养温度为26(±2)℃。每个处理27盆,每盆种植1株彩叶芋再生植株。
1.3 测定指标及方法1.3.1 不同光质下植株形态指标 不同光质下培养60 d的彩叶芋盆苗,对其外围4层完全展开的成熟叶片进行拍照记录,对其所有根系数量和叶片数量进行记录,使用尺子测量植株基部到植株顶端的垂直距离为株高,测量植株基部以下长度为根长;利用Imagin Pro软件测定叶面中部位置的叶片宽,叶柄与叶片连接处至叶片尖端距离为叶片长,叶面范围内面积为叶面积;使用多功能植物测量仪Multispe Q直接测定叶片厚度,直接测定光照下的实际光化学效率及暗处理30 min后的最大光化学效率;使用游标卡尺测定叶柄粗;根系冲洗后吸干多余水分,使用千分之一电子天平测定根系的鲜质量,转入信封使用烘箱105℃杀青15 min,85℃烘干至恒重后用天平称量干质量,根系含水量(%)=(鲜质量- 干质量)/ 鲜质量×100。各处理随机抽取9株测定上述指标。
1.3.2 不同光质下叶片色素的积累 使用酸性提取1% HCl测定彩叶芋叶片的相对花青素含量[20],在0.1的光密度下花青素的浓度被称为1单位(U),上清液在530 nm处记录OD值,每克材料花青素的相对浓度单位U=OD530×10/g Fw。根据候福林主编的《植物生理学实验教程》测定不同光质条件培养下的彩叶芋叶片的叶绿素含量:将叶片鲜样0.2 g浸泡在10 mL丙酮/ 无水乙醇(1︰1,V︰V)溶液中,浸泡叶片至完全白色,测定OD645、OD663和OD440的数值。各处理随机抽取4株测定上述指标。
1.3.3 数据处理 采用Microsoft Excel 2019整理数据,采用SPSS 24软件ANOVA检验进行统计分析,Duncan检验法检验不同光质下彩叶芋数据处理间差异显著性(P<0.05)。
2 结果与分析 2.1 不同光质处理对彩叶芋叶片的影响从图 1可以看出,不同光质处理影响彩叶芋的叶面生长。从叶面大小来看,LED红蓝白绿1︰1︰1︰1处理后彩叶芋叶面宽度显著大于其他处理,叶面积最大(98.8 cm2)且显著高于其他处理;LED红光处理彩叶芋叶面积最小,仅为58.8 cm2(图 2)。LED白光处理的彩叶芋叶片最长,长宽比显著高于其他处理。白色荧光灯对照处理的彩叶芋叶片厚度为0.925 mm、显著高于LED白光和LED红蓝绿1︰1︰1处理。从叶片数量来看,LED红光处理的彩叶芋叶片数显著低于其他处理,平均每株5.3片。与白色荧光灯对于整改相比,LED红光不利于彩叶芋叶片数增多,LED白光和LED红蓝绿1︰1︰1不利于叶片增厚,LED红蓝白绿1︰1︰1︰1处理有利于叶面积增加。

|
| 每个黑或白小方格边长为1 cm Side length of each black aor white square: 1 cm 图 1 不同光质处理下的彩叶芋叶片 Fig. 1 Leaves of Caladium bicolor under different light treatments |
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the bar charts indicate significant differences 图 2 不同光质处理对彩叶芋叶片大小和数量的影响 Fig. 2 Effects of different light treatments on leaf size and number of Caladium bicolor |
2.2 不同光质处理对彩叶株高和叶柄的影响
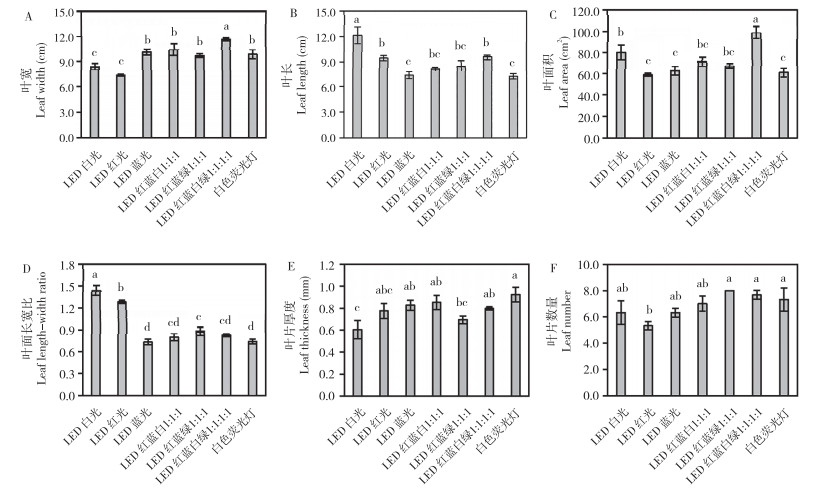
不同光质影响彩叶芋株高、株型、叶柄粗及叶柄颜色。如图 3所示,LED蓝光和LED白光处理的彩叶芋株高和叶柄粗显著高于其他处理,其中蓝光处理的彩叶芋株高达到21 cm,LED红光处理的彩叶芋叶柄粗显著低于其他处理。从图 4可以看出,LED红光处理下的彩叶芋叶柄角度大、株型分散;LED蓝光处理下彩叶芋叶柄有黑色花纹;与白色荧光灯对照相比,LED红蓝绿1︰1︰1处理不利于彩叶芋株高生长,LED红光和LED红蓝绿1︰1︰1处理均不利于彩叶芋叶柄生长。
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the bar charts indicate significant differences 图 3 不同光质处理对彩叶芋株高和叶柄粗的影响 Fig. 3 Effects of different light treatments on plant height and stem thickness of Caladium bicolor |

|
| A:植株整体形态;B:叶柄角度形态;C:叶柄颜色;每个黑或白小方格边长为1 cm A: The overall morphology of the plant; B: Petiole angle morphology; C: Petiole color; the side length of each black or white square: 1 cm 图 4 不同光质处理下的彩叶芋叶柄 Fig. 4 Petiole of Caladium bicolor under different light treatments |
2.3 不同光质处理对彩叶芋根系生长的影响
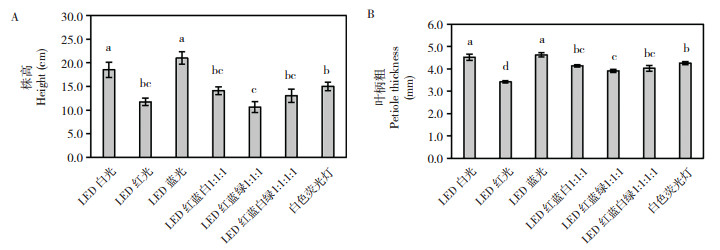
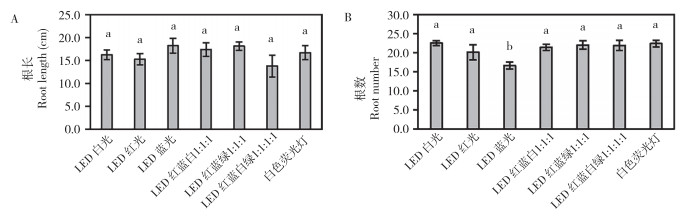
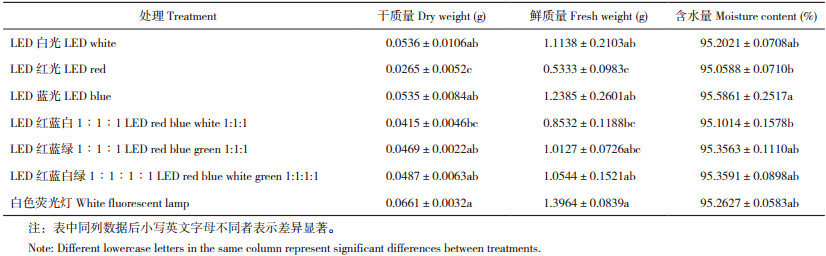
如图 5所示,不同光质影响彩叶芋地下部的生长。由图 6可知,不同光质处理间彩叶芋根系长度无显著性差异。从根系数量来看,LED蓝光下的彩叶芋根系数量显著低于其他处理,其他几个处理之间无显著差异(图 6B)。表 1显示,白色荧光灯处理的彩叶芋根系干质量和鲜质量显著高于LED红光和LED红蓝白1︰1︰1处理,LED红光处理下的根系干质量和鲜质量最低、分别为0.027 g和0.533 g,其他几个处理之间无显著差异。LED蓝光处理的彩叶芋根系含水量显著高于LED红光和LED红蓝白1︰1︰1;与白色荧光灯对照相比,LED蓝光不利于彩叶芋根系数量的增加,LED红光和LED红蓝白1︰1︰1不利于彩叶芋根系生物量的积累。
|
| 每个黑或白小方格边长为1 cm Side length of each black or white square: 1 cm 图 5 不同光质处理下的彩叶芋根系 Fig. 5 Roots of Caladium bicolor under different light treatments |
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the bar charts indicate significant differences 图 6 不同光质处理对彩叶芋根长和根数的影响 Fig. 6 Effects of different light treatments on root length and root number of Caladium bicolor |
|
2.4 不同光质处理对彩叶芋色素积累的影响
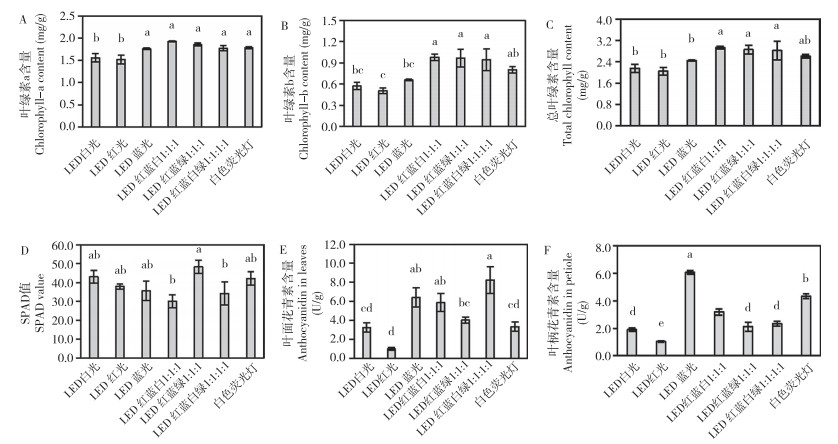
不同光质影响彩叶芋叶片的色素积累,LED红蓝绿1︰1︰1处理的彩叶芋叶面颜色暗沉(图 7)。如图 8所示,LED红蓝白1︰1︰1、LED红蓝绿1︰1︰1、LED红蓝白绿1︰1︰1︰1处理后彩叶芋的叶绿素a、叶绿素b、总叶绿素含量均显著高于LED白光处理,其中总叶绿素含量分别为2.93、2.85、2.82 mg/g,显著高于LED白光、LED红光和LED蓝光处理。由于彩叶芋的叶脉和叶肉色彩影响,各处理下SPAD值和叶绿素总含量趋势不一致。此外,LED蓝光、LED红蓝白1︰1︰1及LED红蓝白绿1︰1︰1︰1处理后彩叶芋的叶面相对花青素含量显著高于LED白光、LED红光及白色荧光灯,分别为6.4、5.9和8.2 U/g。LED蓝光处理的彩叶芋叶柄相对花青素含量为6.1 U/g、显著高于其他处理。与白色荧光灯对照相比,LED红光处理不利于彩叶芋叶绿素a、叶绿素b及花青素的积累,LED蓝光处理有利于叶柄和叶面的花青素积累。

|
| 图 7 不同光质处理下的彩叶芋叶面 Fig. 7 Leaf surface under of Caladium bicolor different light treatments |
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the bar charts indicate significant differences 图 8 不同光质处理对彩叶芋光合色素和相对花青素含量的影响 Fig. 8 Effects of different light treatments on photosynthetic pigments and relative anthocyanin content in Caladium bicolor |
2.5 不同光质处理对彩叶芋叶绿素荧光参数的影响
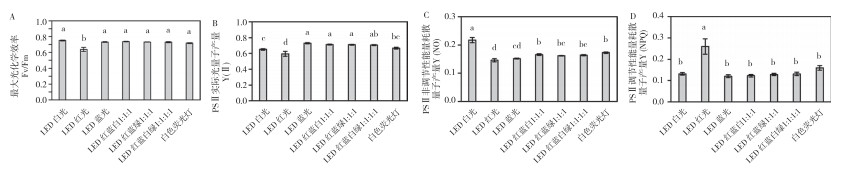
通过测定彩叶芋叶面的叶绿素荧光参数可以了解其光合生理状况。如图 9所示,LED红光处理的彩叶芋叶面PS Ⅱ最大光化学效率Fv/Fm和实际光量子产量Y(Ⅱ)分别为0.64和0.60、均显著低于其他处理,调节性能量耗散的量子产量Y(NPQ)为0.26、显著高于其他处理。除LED红光处理外,彩叶芋其他几个处理之间的Fv/Fm和Y(NPQ)均无显著差异。LED白光处理的彩叶芋叶面Y(Ⅱ)显著低于LED蓝光、LED红蓝白1︰1︰1、LED红蓝绿1︰1︰1及红蓝白绿1︰1︰1︰1处理,为0.65;PS Ⅱ非调节性能量耗散量子产量Y(NO)为0.22、显著高于其他处理。与白色荧光灯处理相比,LED红光处理不利于彩叶芋叶面的Fv/Fm、Y(Ⅱ)及Y(NO),有利于Y(NPQ)升高。
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the bar charts indicate significant differences 图 9 不同光质处理对彩叶芋叶片叶绿素荧光参数的影响 Fig. 9 Effects of different light treatments on chlorophyll fluorescence parameters of Caladium bicolor leaves |
3 讨论
彩叶芋组培苗生长于水分充足的环境,再生植株适应外部环境能力较弱[21]。光不仅是光合作用的能量来源,也是调节植物光形态发生等生理活动的信号,参与调节植物整个生命周期的生长发育[22]。通过光质可以调控彩叶芋的生长,形成抗逆性状以更好地适应自然环境。太阳光照下植物具有更厚的叶片[23],叶片越厚,保水能力越强,是抗旱性的典型指标[24]。提高彩叶芋的叶片厚度,具有提高耐阳光照射、抗水分胁迫的潜力。有研究发现LED蓝光或蓝光补光处理的植物叶片厚度显著高于LED白光处理[25-26],本试验中LED蓝光处理下彩叶芋叶片厚度显著显著高于LED白光(图 2E),与上述研究结果相似。
周瑶等[27]发现与白光相比,蓝光不利于辣椒株高的形成,与本研究结果相反(图 3),是由于形成彩叶芋株高的主要部位是叶柄而非茎部。许安[28]研究发现,LED蓝光处理不利于植物茎长,而有利于‘森林草莓’的叶柄增长,这与本研究结果相似。但对于拟南芥,LED蓝光不利于叶柄的伸长生长,而有利于叶片的伸长生长[29]。因此,不同物种及不同部位对LED蓝光的响应存在差异。
红光处理下生长的多种植物通常具有“红光综合征”,即光合作用功能障碍,表现为光合碳同化产物不足、生长受限等[30-31]。在本研究中,LED红光处理下的彩叶芋生长受限,Fv/Fm及Y(Ⅱ)显著降低(图 9),光合作用受限,与上述研究结果相似。
根系发挥固定、吸收、储存和转运矿物质和水的能力[32]。植物含水量可以反映植物体生理状况,直接影响植株生长发育和胁迫适应机制[33]。根数及根系的含水量与植株抵抗外力能力的重要指标密切相关[34-36]。在本研究中,与白色荧光灯处理相比,LED蓝光处理显著降低了彩叶芋根系的数量(图 6B),这与许安[28]的研究结果相似,该处理下的根系含水量显著高于LED红光和LED红蓝白1︰1︰1处理;这种LED蓝光处理下显著低于其他处理的彩叶芋根系数量能够支撑LED蓝光处理下显著大于其他处理的株高和叶柄粗(图 3),是否与LED蓝光处理下的彩叶芋根系含水量较高有关仍然未知。
光照能够加快观赏性组培苗花青素积累的速度、缩短观赏等待时间[37],罗红辉等[38]通过添加一定比例的蓝光,能够明显促进‘乒乓菊’头状花序着色、花色品质提升、花色更稳定。许安综合相关文章结果发现,与白色荧光灯处理相比,LED蓝光有利于植株花青素含量的积累[28]。从彩叶芋叶柄的相对花青素含量来看,本试验中LED蓝光处理可显著提高叶柄的相对花青素含量(图 8F),且有黑色斑点纹路(图 4C),其叶面相对花青素含量仅次于LED红蓝白绿1︰1︰1︰1处理(图 8E),均显著高于白色荧光灯对照,与上述研究结果相似。
不同的光受体吸收特定波长的光线[39],植物在适应环境季节性变化的过程中,其光合色素的生理活动会发生相应改变[40]。本试验中,两种不同白光光谱处理的彩叶芋叶面积、叶片厚度、株高、叶柄粗及叶面相对花青素含量的结果均存在显著差异。因此,同是白光但光质组合不同对叶片生长的影响较大,可能是彩叶芋商品苗品质季节性变化的原因。但关于季节性光质变化对彩叶芋生长的影响研究较少,彩叶芋适应自然光质季节性变化发生的生理活动变化仍需进一步研究。综上所述,在彩叶芋种苗的实际生产中,可开展不同阶段光质处理或补光处理,提高彩叶芋商品苗的品质。
4 结论通过不同光质和光质配比对彩叶芋再生植株生长发育和色素积累的对比分析,明确不同光质影响彩叶芋不同部位生长和色素积累。从叶面来看,LED红蓝白绿1︰1︰1︰1处理后彩叶芋具有最大的叶面积和相对花青素含量的积累,分别为98.8 cm2和8.2 U/g;LED红光处理彩叶芋叶面积最小、为58.8 cm2,叶片数最少、平均每株5.3片,且总叶绿素含量和相对花青素含量最低、为2.0 mg/g和1.0 U/g。从叶柄来看,LED蓝光处理的彩叶芋具有最长的叶柄,株高最大为21 cm,且叶柄相对花青素含量显著高于其他处理、达到6.1 U/g,具有黑色斑点纹路。从根系来看,LED蓝光处理可显著降低根系数量,平均每株仅16.6根。从株型来看,LED红光处理后彩叶芋株型较松散,LED红蓝绿1︰1︰1处理下株型较紧凑。
| [1] |
YE Y, LIU J, ZHOU Y, ZHU G, TAN J, XU Y. Complete chloroplast genome sequences of four species in the Caladium genus: Comparative and phylogenetic analyses[J]. Genes, 2022, 13(12): 2180. DOI:10.3390/genes13122180 |
| [2] |
AKHIGBEMEN A M, OZOLUA R I, BAFOR E E, OKWUOFU E O. Evaluation of some neuropharmacological effects of Caladium bicolor aiton (araceae) leaf extracts in mice[J]. Metabolic Brain Disease, 2019, 34(2): 537-544. DOI:10.1007/s11011-019-0390-z |
| [3] |
王颖, 陆国权. 彩叶芋研究进展[J]. 中国园艺文摘, 2012, 28(5): 37-38. WANG Y, LU G Q. Research advances of Caladium bicolor[J]. Chinese Horticulture Abstract, 2012, 28(5): 37-38. |
| [4] |
刘金梅, CAO Z, 尤毅, 钟荣辉, DENG Z. 花叶芋育种研究进展[J]. 园艺学报, 2018, 45(9): 1791-1801. DOI:10.16420/j.issn.0513-353x.2018-0214 LIU J M, CAO Z, YOU Y, ZHONG R H, DENG Z. Recent progress in Caladium breeding and genetic research[J]. Acta Horticulturae Sinica, 2018, 45(9): 1791-1801. DOI:10.16420/j.issn.0513-353x.2018-0214 |
| [5] |
王颖, 陆国权. 彩叶芋组织培养研究进展[J]. 北方园艺, 2012(12): 196-198. WANG Y, LU G Q. Research advances on the tissue culture of Caladium bicolor[J]. Northern Horticulture, 2012(12): 196-198. |
| [6] |
王颖. 彩叶芋的组培扩繁及其抗寒性研究[D]. 杭州: 浙江农林大学, 2013. WANG Y. Study on tissue culture, propagation and cold resistance of Caladium bicolor cultivars[D]. Hangzhou: Zhejiang A & F University, 2013. |
| [7] |
MEHBUB H, AKTER A, AKTER M A, MANDAL M S H, HOQUE M A, TULEJA M, MEHRAJ H. Tissue culture in ornamentals: Cultivation factors, propagation techniques, and its application[J]. Plants-Basel, 2022, 11(23): 3208. DOI:10.3390/plants11233208 |
| [8] |
桂意云, 吴杨, 李海碧, 韦金菊, 刘昔辉, 祝开, 周会, 赵培方, 张荣华. 轻型基质网袋在甘蔗组培苗上的应用[J]. 中国糖料, 2022, 44(4): 25-29. DOI:10.13570/j.cnki.scc.2022.04.005 GUI Y Y, WU Y, LI H B, WEI J J, LIU X H, ZHU K, ZHOU H, ZHAO P F, ZHANG R H. Application of lightweight substrate mesh bag on sugarcane tissue culture seedlings[J]. Sugar Crop of China, 2022, 44(4): 25-29. DOI:10.13570/j.cnki.scc.2022.04.005 |
| [9] |
徐盼盼. 金钻蔓绿绒组培苗离体保存技术研究[D]. 银川: 宁夏大学, 2020. XU P P. Study on in vitro preservation technology of tissue culture seedlings of Philodendron 'con-go'[D]. Yinchuan: Ningxia University, 2020. |
| [10] |
黄秋良, 张国防, 谢亚兵, 张春, 丁力朋, 林必青, 杨阳. 无性繁殖方式对芳樟叶精油及主成分的影响[J]. 福建林业科技, 2016, 43(2): 156-159. DOI:10.13428/j.cnki.fjlk.2016.02.030 HUANG Q L, ZHANG G F, XIE Y B, ZHANG C, DING L P, LIN B Q, YANG Y. Effect of asexual reproduction of Aromatic Camphor leaves essential oil and principal component[J]. Journal of Fujian Forestry Sciences and Technology, 2016, 43(2): 156-159. DOI:10.13428/j.cnki.fjlk.2016.02.030 |
| [11] |
BELWAL T, SINGH G, JEANDET P, PANDEY A, GIRI L, RAMOLA S, BHATT I D, VENSKUTONIS P R, GEORGIEV M I, CLÉMENT C, LUO Z. Anthocyanins, multi-functional natural products of industrial relevance: Recent biotechnological advances[J]. Biotechnology Advances, 2020, 43: 107600. DOI:10.1016/j.biotechadv.2020.107600 |
| [12] |
SATO M, KAWABE T, HOSOKAWA M, TATSUZAWA F, DOI M. Tissue culture-induced flower-color changes in Saintpaulia caused by excision of the transposon inserted in the flavonoid 3', 5' hydroxylase (F3'5'H) promoter[J]. Plant Cell Reports, 2011, 30(5): 929-939. DOI:10.1007/s00299-011-1016-z |
| [13] |
张栋. LED光对蓝莓组培苗生长及生理特性的影响[D]. 武汉: 华中农业大学, 2022. ZHANG D. Effects of LED light on the growth and physiological characteristics of buleberry tissue culture seedings[D]. Wuhan: Huazhong Agricultural University, 2022. |
| [14] |
谷艾素. 光调控对花烛组织培养及试管苗光合特性的影响[D]. 南京: 南京农业大学, 2011. GU A S. Effects of light control on tissue culture and photosynthesis characteristics of Anthurium Andraeanumlind[D]. Nanjing: Nanjing Agricultural University, 2011. |
| [15] |
YE S, SHAO Q, XU M, LI S, WU M, TAN X, SU L. Effects of light quality on morphology, enzyme activities, and bioactive compound contents in Anoectochilus roxburghii[J]. Frontiers in Plant Science, 2017, 8: 857. DOI:10.3389/fpls.2017.00857 |
| [16] |
洪艳, 武宇薇, 宋想, 李梦灵, 戴思兰. 光照调控园艺作物花青素苷生物合成的分子机制[J]. 园艺学报, 2021, 48(10): 1983-2000. DOI:10.16420/j.issn.0513-353x.2021-0497 HONG Y, WU Y W, SONG X, LI M L, DAI S L. Molecular mechanism of light-induced anthocyanin biosynthesis in horticultural crops[J]. Acta Horticulturae Sinica, 2021, 48(10): 1983-2000. DOI:10.16420/j.issn.0513-353x.2021-0497 |
| [17] |
田凯莉. 基于代谢组学研究光质对铁皮石斛组培苗的影响[D]. 南昌: 南昌大学, 2022. TIAN K L. The effect of light quality on tissue-cultured seedling of Dendrobium officinale based on metabonomics[D]. Nanchang: Nanchang University, 2022. |
| [18] |
FAN C, MANIVANNAN A, WEI H. Light quality-mediated influence of morphogenesis in micropropagated horticultural crops: A comprehensive overview[J]. Biomed Research International, 2022, 1-11. DOI:10.1155/2022/4615079 |
| [19] |
吴雅露, 王颖, 陈梦涛, 应鹏飞, 蒋玉蓉, 陆国权. 彩叶芋组织快速繁殖技术研究[J]. 广东农业科学, 2019, 46(3): 31-36. DOI:10.16768/j.issn.1004-874X.2019.03.005 WU Y L, WANG Y, CHEN M T, YING P F, JIANG Y R, LU G Q. Study on rapid propagation technology for Caladium bicolor tissue[J]. Guangdong Agricultural Sciences, 2019, 46(3): 31-36. DOI:10.16768/j.issn.1004-874X.2019.03.005 |
| [20] |
赵霞, 刘然方. 黑米灌浆特性对花青素积累的影响[J]. 西北农林科技大学学报(自然科学版), 2021, 49(8): 51-58. DOI:10.13207/j.cnki.jnwafu.2021.08.007 ZHAO X, LIU R F. Effect of grain filling characteristics on anthocyaninaccumulation in black rice[J]. Journal of Northwest A & F University (Natural Science Edition), 2021, 49(8): 51-58. DOI:10.13207/j.cnki.jnwafu.2021.08.007 |
| [21] |
李雨晴. 白及组织培养及组培苗生长营养调控研究[D]. 南京: 南京农业大学, 2015. LI Y Q. Tissue culture of Bletilla strlata (THUNB. ) REICHB. F and plantlet nutrition regulation[D]. Nanjing: Nanjing Agricultural University, 2015. |
| [22] |
MORADI S, KAFI M, ALINIAEIFARD S, SALAMI S A, SHOKRPOUR M, PEDERSEN C, MOOSAVI-NEZHAD M, WROBEL J, KALAJI H M. Blue light improves photosynthetic performance and biomass partitioning toward harvestable organs in Saffron (Crocus sativus L.)[J]. Cells, 2021, 10(8). DOI:10.3390/cells10081994 |
| [23] |
GOTOH E, SUETSUGU N, HIGA T, MATSUSHITA T, TSUKAYA H, WADA M. Palisade cell shape affects the light-induced chloroplast movements and leaf photosynthesis[J]. Scientific Reports, 2018, 8(1): 1472. DOI:10.1038/s41598-018-19896-9 |
| [24] |
鲍文武, 陈健男, 刘占德. 不同猕猴桃叶片形态、解剖结构及其抗旱性评价[J]. 西北农业学报, 2024, 33(7): 1329-1336. DOI:10.7606/j.issn.1004-1389.2024.07.015 BAO W W, CHEN J N, LIU Z D. Leaf morpholog, anatomical structure of different germplasm resources of kiwifruit and their evaluation for drought resistance[J]. Acta Agriculturae Borealioccidentalis Sinica, 2024, 33(7): 1329-1336. DOI:10.7606/j.issn.1004-1389.2024.07.015 |
| [25] |
孟畅. 不同光质及光强对皂荚幼苗生长发育的影响[D]. 贵阳: 贵州大学, 2022. MENG C. Effects of different light quality and light intensity on growth and development of Gleditsia sinensis seedlings[D]. Guiyang: Guizhou University, 2022. |
| [26] |
陈思肜. 红蓝光对茶树生长及其代谢产物的影响[D]. 福州: 福建农林大学, 2020. CHEN S R. Effects of red and blue light on the growth and metabolites of tea[D]. Fuzhou: Fujian Agriculture and Forestry University, 2020. |
| [27] |
周瑶, 毛莲珍, 孙颖, 沈逸雨, 邬伟盛, 刘周斌. 连续红、蓝光照对辣椒幼苗生长及生理特性的影响[J]. 广东农业科学, 2023, 50(11): 78-88. DOI:10.16768/j.issn.1004-874X.2023.11.008 ZHOU Y, MAO L Z, SUN Y, SHEN Y Y, WU W S, LIU Z B. Effects of continuous red and blue light on growth and physiological characteristies of pepper seedlings[J]. Guangdong Agricultural Sciences, 2023, 50(11): 78-88. DOI:10.16768/j.issn.1004-874X.2023.11.008 |
| [28] |
许安. LED不同光质对植物生长特性的Meta分析以及对森林草莓生长指标的影响[D]. 南京: 南京农业大学, 2020. XU A. Meta analysis of different LED light quality on plant groawth characteristics and its effect on woodland strawberry growth index[D]. Nanjing: Nanjing Agricultural University, 2020. |
| [29] |
吴冰. LED光照对拟南芥生长特性的研究[D]. 福州: 福建农林大学, 2017. WU B. Effects of LED illumination on characteristics of Arabidopsis thaliana's growth[D]. Fuzhou: Fujian Agriculture and Forestry University, 2017. |
| [30] |
谭杰挥, 刘厚诚. 植物工厂蔬菜育苗光调控技术研究进展[J]. 农业工程技术, 2022, 42(1): 24-29. DOI:10.16815/j.cnki.11-5436/s.2022.01.002 TAN J H, LIU H C. Advances in light regulation technology for vegetable seedling cultivation in plant factories[J]. Agricultural Engineering Technology, 2022, 42(1): 24-29. DOI:10.16815/j.cnki.11-5436/s.2022.01.002 |
| [31] |
杨颜萌, 张家兴, 李亚茹, 马靖然, 王铎, 靳占才, 谢路路, 邓娇娇, 叶吉, 于大炮, 王庆伟. 光质对黄芩生长与生理生化特征的影响[J]. 应用生态学报, 2024, 35(2): 424-430. DOI:10.13287/j.1001-9332.202402.004 YANG Y M, ZHANG J X, LI Y R, MA J R, WANG D, JIN Z C, XIE L L, DENG J J, YE J, YU D P, WANG Q W. Effects of light qualities on growth and physiological-biochemical traits of Scutellaria baicalensis[J]. Chinese Journal of Applied Ecology, 2024, 35(2): 424-430. DOI:10.13287/j.1001-9332.202402.004 |
| [32] |
KARLOVA R, BOER D, HAYES S, TESTERINK C. Root plasticity under abiotic stress[J]. Plant Physiology, 2021, 187(3): 1057-1070. DOI:10.1093/plphys/kiab392 |
| [33] |
王锐, 马守臣, 张合兵, 许传阳, 郭增长. 干旱区高强度开采地表裂缝对土壤微生物学特性和植物群落的影响[J]. 环境科学研究, 2016, 29(9): 1249-1255. DOI:10.13198/j.issn.1001-6929.2016.09.01 WANG R, MA S C, ZHANG H B, XU C Y, GUO Z Z. Effects of surface cracks caused by high intensity coal mining on soil microbial characteristics and plant communities in arid regions[J]. Research of Environmental Sciences, 2016, 29(9): 1249-1255. DOI:10.13198/j.issn.1001-6929.2016.09.01 |
| [34] |
YANG Y, CHEN L, LI N, ZHANG Q. Effect of root moisture content and diameter on root tensile properties[J]. PLoS One, 2016, 11(3): e0151791. DOI:10.1371/journal.pone.0151791 |
| [35] |
李宁. 四种乔木根系抗拉特性的影响因素研究[D]. 北京: 北京林业大学, 2016. LI N. Study on influence factors of root tensile properties by four arbor root system[D]. Beijing: Beijing Forestry University, 2016. |
| [36] |
FR ESCHET G T, PAGES L, IVERSEN C M, COMAS L H, REWALD B, ROUMET C, KLIMESOVA J, ZADWORNY M, POORTER H, POSTMA J A, ADAMS T S, BAGNIEWSKAZADWORNA A, BENGOUGH A G, BLANCAFLOR E B, BRUNNER I, CORNELISSEN J, GARNIER E, GESSLER A, HOBBIE S E, MEIER I C, MOMMER L, PICON-COCHARD C, ROSE L, RYSER P, SCHERER-LORENZEN M, SOUDZILOVSKAIA N A, STOKES A, SUN T, VALVERDE-BARRANTES O J, WEEMSTRA M, WEIGELT A, WURZBURGER N, YORK L M, BATTERMAN S A, GOMES D M M, JANECEK S, LAMBERS H, SALMON V, THARAYIL N, MCCORMACK M L. A starting guide to root ecology: Strengthening ecological concepts and standardising root classification, sampling, processing and trait measurements[J]. New Phytologist, 2021, 232(3): 973-1122. DOI:10.1111/nph.17572 |
| [37] |
张慧宁. 紫叶稠李组织培养体系的建立及组培苗色素含量变化的研究[D]. 沈阳: 沈阳农业大学, 2020. ZHANG H N. Establishment of tissue culture system of Padus virginiana study on the change of pigment content in leaves and plantlets[D]. Shenyang: Shenyang Agricultural University, 2020. |
| [38] |
罗红辉, 伍青, 侯军晓, 李泽余, 李景文, 王凤兰, 周厚高. 不同LED光质对乒乓菊植株生长和开花性状的影响[J]. 广东农业科学, 2022, 49(12): 44-54. DOI:10.16768/j.issn.1004-874X.2022.12.005 LUO H H, WU Q, HOU J X, LI Z Y, LI J W, WANG F L, ZHOU H G. Effects of different LED light qualities on plant growth and flower traits of Chrysanthemum ping pong[J]. Guangdong Agricultural Sciences, 2022, 49(12): 44-54. DOI:10.16768/j.issn.1004-874X.2022.12.005 |
| [39] |
林荣呈, 刘宏涛, 李继刚, 孔凡江, 刘斌, 王海洋, 杨洪全, 钟上威, 朱丹萌, 淮俊玲, 李洪, 刘双荣, 王璠, 王文秀, 茅志磊, 邓兴旺. 植物光信号转导研究领域近十年重要研究进展[J]. 植物生理学报, 2024, 60(3): 399-429. DOI:10.13592/j.cnki.ppj.600004 LIN R C, LIU H T, LI J G, KONG F J, LIU B, WANG H Y, YANG H Q, ZHONG S W, ZHU D M, HUAI J L, LI H, LIU S R, WANG F, WANG W X, MAO Z L, DENG X W. Research advances in plant light signaling transduction during the past ten years[J]. Plant Physiology Journal, 2024, 60(3): 399-429. DOI:10.13592/j.cnki.ppj.600004 |
| [40] |
金贇, 朱栗琼, 招礼军, 化彬, 权佳惠, 刘金炽. 滨海沙地植物厚藤叶片生理特征的季节变化[J]. 广西植物, 2022, 42(8): 1284-1293. DOI:10.11931/guihaia.gxzw202104012 JIN Y, ZHU L Q, ZHAO L J, HUA B, QUAN J H, LIU J C. Seasonal changes of leaf physiological characteristics of Ipomoea pes-caprae in coastal sand[J]. Guihaia, 2022, 42(8): 1284-1293. DOI:10.11931/guihaia.gxzw202104012 |
(责任编辑 张辉玲)
 2024, Vol. 51
2024, Vol. 51