文章信息
基金项目
- 贵州省教育厅青年科技人才成长项目(黔教合KY字〔2019〕098);广东省农业科学院高水平农科院建设人才项目(R2021YJ-YB2004,R2023PY-JX007);贵阳学院博士科研启动基金项目(0221001002010133);贵州省国家级大学生创新创业训练计划项目(S202310976018)
作者简介
- 张钰玉(1988—),女,博士,讲师,研究方向为作物栽培学与耕作学,E-mail:northwestzhang@163.com.
通讯作者
- 闫晋强(1988—),男,博士,副研究员,研究方向为蔬菜育种与分子生物学,E-mail:yanjinqiang@gdaas.cn.
文章历史
- 收稿日期:2023-12-29
2. 广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室,广东 广州 510640;
3. 宝鸡市农业科学研究院,陕西 宝鸡 722499
2. Vegetable Research Institute, Guangdong Academy of Agricultural Sciences / Guangdong Key Laboratory for New Technology Research of Vegetables, Guangzhou 510640, China;
3. Baoji Academy of Agricultural Science, Baoji 722499, China
【研究意义】辣椒是全球最重要的蔬菜之一[1-2],据统计,2001—2022年,全球干辣椒和新鲜辣椒的产量均大幅增长。但集约化种植的发展导致土壤结构破坏、土壤微生物群落结构失衡、土壤质量退化,进而引发严重的土传病害,给辣椒生产造成巨大损失[3]。土传病害是制约农业生产的重要瓶颈[4],其致病菌栖息于土壤中,多为不同致病菌复合侵染,致病机理复杂,难以根治[5],目前常用的控制方法为化学防治,但化学防治尚未取得理想效果,且存在一定的安全性问题[6]。因此,研究土传病原菌致病机理、探索绿色有效的防控方法具有重要意义。【前人研究进展】根际微生物与土壤- 根系共同构成土壤- 根系- 微生物互作的关键微区,是参与植物根际活动的主要成员,直接影响植物的生长发育、有益与有害微生物的定殖、侵染等过程,与植物生长密切相关[7],被视为植物的第二基因组,也是实现农业绿色防控的关键调控区域[8-9]。前人研究表明,镰刀菌属(Fusarium)[10-11]、轮枝菌属(Verticillium)[12]等真菌可广泛引起植物维管束萎蔫病,给农业生产造成极大损失;枝顶孢属(Acremonium)等真菌主要浸染植物的根部和茎基部,造成植物根腐和茎腐病;枝孢属(Cladosporium)等真菌可引起植物叶部病害;葡萄孢属(Botrytis)[13]等真菌可引起多种蔬菜的灰霉病。植物根际土壤中也有许多有益性微生物,如木霉属(Trichoderma)、踝节菌属(Talaromyces)等真菌、芽孢杆菌属(Bacillus)、链霉菌属(Streptomyces)、假单胞菌属(Pseudomonas)等[14-15]细菌均被证实在提高土壤的抑病效果、促进植物生长方面起着重要作用。不少研究尝试将生防菌大量引入到植物根际,但目前还存在稳定性差、针对性不强的问题,尚未取得理想的抑病效果。进一步研究发现,相较于单个优势菌,混合菌群的引入可能在土传病害防治中取得更好的效果[16],增加土壤微生物多样性对控制土传病害发生具有重要意义[17]。刘洪等[3]表明,抑病土壤具有募集有益微生物的特征,使得抑病土壤根际微生物的群落多样性较高,有益微生物较多,可为土传病害的防治提供有效的方法。郑明子等[18]表明,病原物的侵染会触发植物自身的防御并募集有益性微生物来改善根际微生物的结构与组成,研究轻微发病植株的根际土壤有利于发现丰度更高的生防菌资源。【本研究切入点】根际微生物决定根际的功能核心,与植物生长、土传病害防治效果密切相关,但目前关于不同抗性辣椒品种根际土壤微生物的研究较少。【拟解决的关键问题】本研究以辣椒感病品种‘海澜99’(Hailan 99,HL99)和抗病品种‘三峡青’(Sanxiaqing,SSQ)为试验材料,分析比较感病土壤和非感病土壤条件下不同辣椒品种土壤根际细菌及真菌的群落分布特征、物种组成及相关性的差异,进一步讨论抗病辣椒品种根际群落结构特征,土壤根际细菌及真菌的相关关系,以期为定向优化根际微生物群落结构的研究提供重要参考。
1 材料与方法 1.1 试验材料供试土壤样品于2022年7月2日采自贵州省修文县小箐蔬菜保供基地马场坝片区(26.85°N、106.72°E,海拔1 400 m),其中感病土壤采自由多种病原导致的有严重土传病害史的辣椒种植地,非感病土壤(空白土壤)采自无土传病害史的辣椒种植地。土样均采集最上层土壤(0.5~20 cm),使用五点采样法,每5个相同来源的土样混成1个样品。土壤样品取回后迅速置于-80℃中冷冻保存备用。
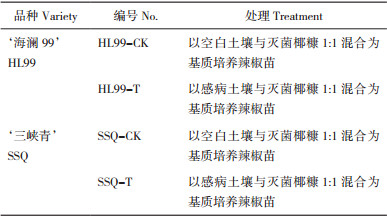
供试辣椒为前期试验筛选出的感病辣椒品种‘海澜99’(HL99)和抗病品种‘三峡青’(SSQ),试验处理见表 1。
1.2 试验设计
将感病土壤和空白土壤分别与灭菌椰糠1∶1混合,装入穴孔盘。用2.5%(V/V)次氯酸钠溶液浸泡辣椒种子30 s(期间不断搅拌),然后用无菌蒸馏水仔细冲洗,重复3次,对辣椒种子进行消毒[19]。将30粒消毒后的种子直接播种于装有待试土样的穴孔盘,在光照培养箱中(光照16 h / 黑暗8 h,湿度70%,温度25℃)培养,统计辣椒出苗率,3次重复。
另一部分消毒后的种子置于28℃培养箱中保湿催芽,初步培养5 d,挑取30粒萌发种子移栽至装有待试土样的穴孔盘。在上述光照培养箱中培养45 d(期间定期浇水)后,随机采集同一处理的3株辣椒植株根际土壤形成1个复合样品,每个处理3次重复,分别装于50 mL离心管中,液氮速冻后置于-80℃中冷冻保存,送至广州基迪奥公司进行土壤微生态测定。用于16S rRNA测定的样品对应相应的处理分别命名为HL99-BCK、HL99-B-T、SSQ-B-CK、SSQ-B-T,用于ITS测定的样品分别命名为HL99-F-CK、HL99-F-T、SSQ-F-CK、SSQ-F-T。采样当天分别测定辣椒苗期株高、茎粗、地上部分干质量,5次重复。
1.3 样品检测及数据分析采用HiPure Soil DNA Kits试剂盒提取土壤微生物DNA,利用Nanodrop 2000对DNA进行定量。以提取的DNA作为模板,以相应的通用引物分别对16Sr RNA的V3~V4区和ITS的V1区进行扩增。使用AMPure XP Beads对扩增产物进行二轮纯化,用ABI StepOnePlus Real-Time PCR System进行定量,根据Novaseq 6000的PE250模式pooling上机测序。对raw data进行质量过滤、去噪、拼接和去嵌合体等处理后,按100% 的序列相似度进行归并,形成ASVs并对其丰度、多样性等进行分析。主坐标分析则基于weighted_unifrac降维进行非度量多维排列(Non-metric multidimensional scaling,NMDS)分析,以百分比评估各坐标轴对菌群结构总体差异的解释度。
1.4 数据处理基于物种丰度表,在属水平分别筛选相对丰度值Top50的真菌物种和Top100的细菌物种,采用R语言计算细菌和真菌群落的组内相关系数;并以Top 50的真菌物种和Top 50的细菌物种计算真菌和细菌物种组间的Spearman相关系数,以P < 0.05为阈值,筛选关系对,利用Cytoscape 3.7.1进行可视化。基于Spearman相关系数,在属水平筛选表达丰度Top15的细菌和真菌与辣椒生长相关指标(出苗率、株高、茎粗、地上部分干质量)进行相关性分析。
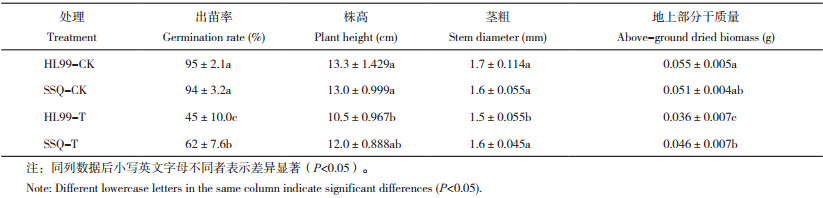
2 结果与分析 2.1 不同土壤条件下辣椒出苗率及苗期生长情况不同土壤条件下辣椒的出苗率及苗期生长情况不同(表 2)。在感病土壤条件下,感病品种与抗病品种的出苗率、株高、茎粗及地上部分干质量均低于其对照组,在感病品种中,降幅分别为52.6%、21.1%、11.8%、34.5%;在抗病品种中,降幅分别为34.0%、7.7%、0%、9.8%。感病土壤条件下抗病品种的出苗率、株高、茎粗及地上部分干质量均高于感病品种,其中出苗率、茎粗及地上部分干质量均达到差异显著水平,较感病品种高出37.8%、14.3%、6.7%、27.8%。以上结果表明,不同健康程度土壤对辣椒出苗率及苗期生长情况产生显著影响,抗病品种生长情况优于感病品种,进一步说明筛选的品种结果可靠,可用于后续分析研究。
|
2.2 土壤样品测序质量分析
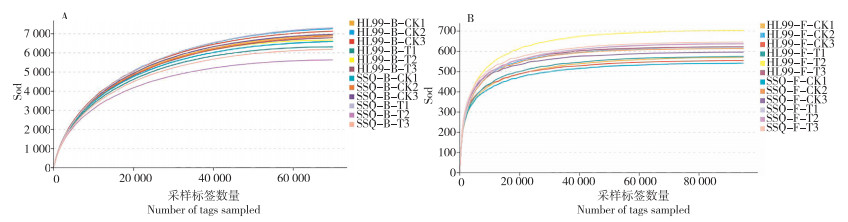
对不同土壤条件下12个辣椒根际土壤样品进行高通量测序,共获得1 556 915个16S rRNA原始序列(Raw reads),平均每个样品129 743个;共获得1 544 760个ITS原始序列,平均每个样品1 28 730个。去除嵌合体和短序列后共获得1 481 973个16S rRNA高质量序列(Clean reads),平均每个样品1 234 98个;共获得1 363 398个ITS高质量序列,平均每个样品113 17个。绘制稀释曲线来评价测序量及物种的丰富程度,由图 1可知,当测序数据达50 000时,12个样品的曲线趋于平坦,表明样品测序数据量合理,获得的高质量序列数量足以反映不同土壤条件下样品中绝大多数的微生物信息。
|
| A:细菌样品;B:真菌样品 A : Bacterial samples; B : Fungal samples 图 1 不同土壤条件下辣椒根际土壤样品ASVs统计图 Fig. 1 Statistical graph of ASVs of rhizosphere soil samples under different soil conditions |
2.3 不同土壤条件对辣椒根际土壤微生物群落的影响
以100% 的序列相似度进行聚类,12个样品中细菌序列共获得66 617个OTUs,真菌序列共获得2 948个OTUs,细菌丰富度显著高于真菌。基于16S rRNA和ITS测序结果,相比于空白土壤,感病土壤中的细菌OTUs数量明显减少,HL99中降低7.8%,SSQ中降低6.5%,细菌的Shannon、Chao1、Ace、Pielou、PD指数也有所降低。相反,感病土壤中的真菌OTUs数量有所增加,HL99中增加8.8%,SSQ中增加9.8%,真菌的Sobs、Shannon、Simpson、Chao1、Ace、Pielou、PD指数也有所增加(表 3)。表明感病土壤可导致辣椒根际土壤细菌群落的多样性降低,真菌群落的多样性增加,但不同品种间α多样性指数差异不显著。
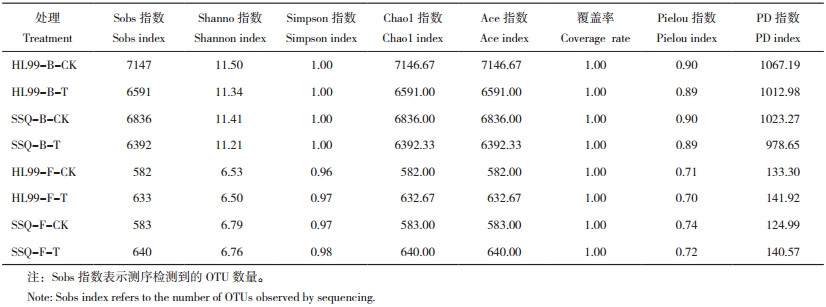
|
基于weighted_unifrac矩阵进行NMDS分析,Stress值< 0.2,表明NMDS分析结果较可靠。由图 2A可知,对同一品种而言,相同条件下样本间直线距离较近,不同土壤条件下样本间直线距离较远,表明不同土壤条件下同一品种内根际细菌群落组成结构差异较大;在正常土壤条件下,品种内3个样本间直线距离较近,感病品种与抗病品种间样本直线距离较远,表明正常土壤条件下,不同抗病品种间根际细菌群落组成结构差异较大;但在感病土壤条件下,不同抗病品种间样本间直线距离较近,未出现较好的分离,表明在感病土壤条件下,不同抗病品种间根际细菌群落组成结构差异较小。由图 2B可知,在正常土壤条件下,同一品种内样本间直线距离较远;在感病土壤条件下,同一品种内样本间直线距离较近,而感病品种与抗病品种间样本直线距离较远。结果表明,相较于正常土壤条件,细菌群落对感病土壤条件有较明显响应,但感病土壤条件下不同抗病品种间细菌群落结构差异不大;在感病土壤条件下,不同抗病品种间根际真菌群落结构有明显差异。因此,不同品种间根际真菌群落的差异分析可为感病土壤条件下定向优化根际微生物群落结构提供重要信息。
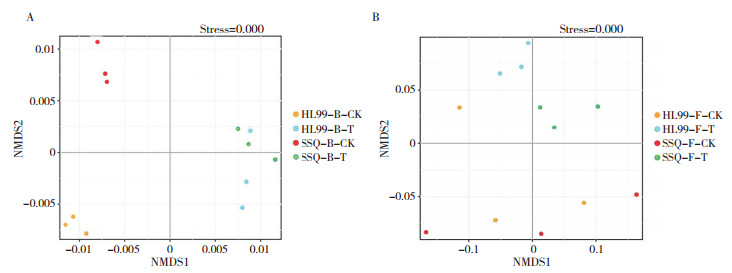
|
| 图 2 不同土壤条件下细菌(A)和真菌(B)群落主坐标分析 Fig. 2 Communities of bacterial (A) and fungal (B) samples under different soil conditions assessed by principal coordinate analysis |
2.4 不同土壤条件对辣椒根际土壤微生物物种组成的影响
从整体上看,在不同土壤条件下,土壤细菌中优势菌门均主要为变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),其相对丰度约为40.1% 和15.3%(图 3A);土壤真菌中优势菌门均为子囊菌门(Ascomycota),在不同样品中平均相对丰度约为47.8%。相较于对照组,感病土壤中不同抗病品种根际土壤样本中,分属于子囊菌门的真菌相对丰度均呈下降趋势,感病品种中分属于子囊菌门真菌的丰度均值下降约17.5%,抗病品种中分属于子囊菌门真菌的丰度均值下降约7.5%(图 3B)。在属水平,土壤细菌中黄杆菌属(3.5%~6.4%)和鞘氨醇单胞菌属(3.8%~4.3%)相对丰度值较高;土壤真菌中被孢菌属(1.4%~5.7%)和镰刀菌属(1.6%~5.0%)相对丰度值较高。镰刀菌属真菌是本试验感病土壤中的主要植物病原菌之一,在不同抗性辣椒品种中均呈现出感病土壤条件下(4.8%~5.0%)相对丰度高于对照组(1.6%~1.7%)的趋势(图 4)。综上,辣椒种植前的不同土壤微生物环境可能是造成不同抗病品种间真菌群落结构差异的原因。
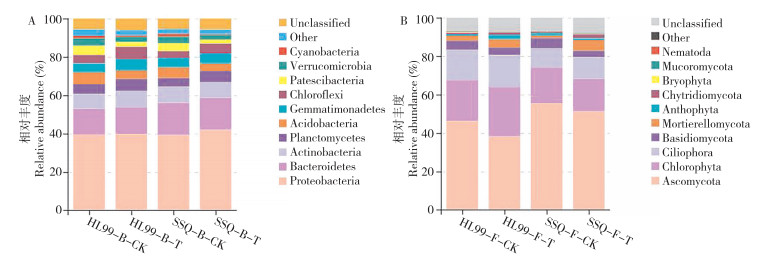
|
| 图 3 不同土壤条件下根际细菌(A)和真菌(B)在门水平的相对丰度 Fig. 3 Relative abundance of rhizospheric bacteria (A) and fungi (B) at phylum level under different soil conditions |
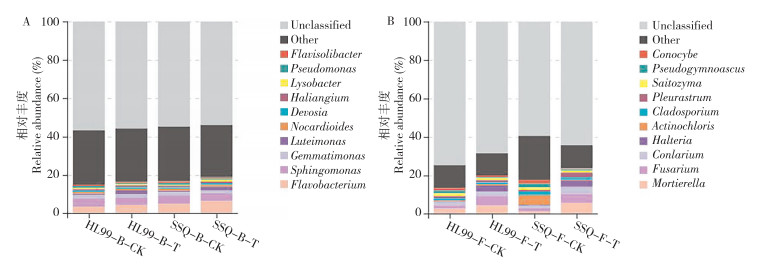
|
| 图 4 不同土壤条件下根际细菌(A)和真菌(B)在属水平的相对丰度 Fig. 4 Relative abundance of rhizospheric bacteria (A) and fungi (B) at genus level under different soil conditions |
进一步分析发现,在属水平上,感病土壤条件下一些有益微生物(包括拮抗、促生真菌或细菌)丰度在不同抗病品种间存在明显差异,整体呈现抗病品种根际有益微生物丰度高于感病品种的趋势(表 4)。与对照组相比,感病土壤条件下,不同品种根际踝节菌属真菌和假单胞菌属细菌均有所下降,抗病品种降幅分别为12.9% 和28.4%,感病品种降幅分别为51.5% 和45.7%;而被孢菌属真菌、芽孢杆菌属细菌均有所增加,抗病品种增幅分别为320% 和155.7%,感病品种增幅分别为57.6% 和96.2%;不同抗病品种根际木霉菌属和节丛孢属真菌丰度变化趋势不一致,抗病品种表现为下降趋势,降幅分别为11.0% 和36.6%,感病品种表现为上升趋势,增幅分别为13.6% 和72.4%。上述结果表明,不同抗病品种根际微生物结构组成不同,抗病品种在感病土壤条件下募集有益性微生物的能力更强。
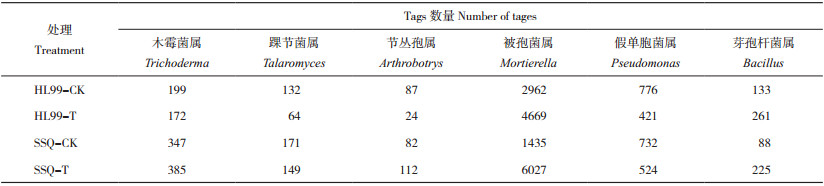
|
2.5 辣椒根际微生物与辣椒生长情况的相关性
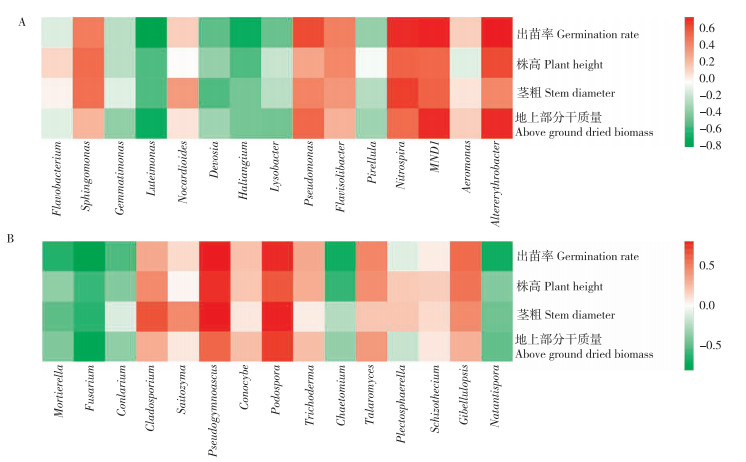
在属水平,筛选表达丰度Top 15的细菌和真菌与辣椒出苗率、株高、茎粗和地上部分干质量这4个生长相关指标进行相关性分析。由图 5可知,辣椒出苗率、株高、茎粗和地上部分干质量均与镰刀菌属真菌丰度负相关,相关系数分别为0.81、0.57、0.62、0.74;辣椒出苗率、地上部分干质量与假单胞菌属细菌丰度正相关,相关系数分别为0.61和0.50。进一步表明不同土壤条件下镰刀属、假单胞菌属等的丰度差可为根际微生物群落结构优化提供重要信息。
|
| A:细菌样品;B:真菌样品 A : Bacterial samples; B: Fungal samples 图 5 不同土壤条件下属水平根际微生物群落与辣椒生长的spearman相关性分析 Fig. 5 Spearman correlation analysis between rhizospheric community at genus level and the growth of peppers |
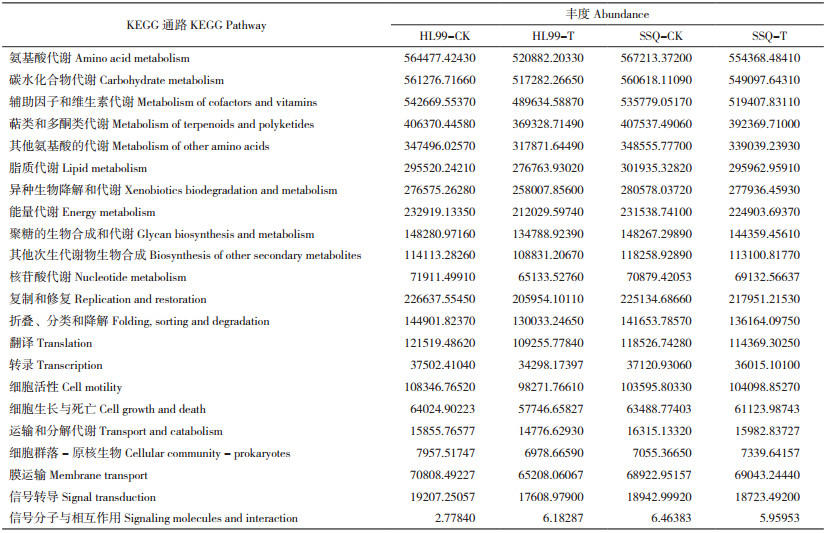
由表 5可知,土壤根际细菌显著富集到的与代谢相关的通路,包括氨基酸代谢、碳水化合物代谢、辅助因子和维生素代谢、萜类化合物和聚酮代谢、其他氨基酸代谢、脂类代谢、异生菌生物降解和代谢、能量代谢、聚糖生物合成和代谢、其他次生代谢物的生物合成、核苷酸代谢通路,均在对照组中的丰度更高,且抗病品种中丰度高于感病品种。其他通路,如与遗传信息处理相关的通路,包括复制和修复、折叠、分类和降解、译本和转录通路;与细胞过程相关的通路,包括细胞运动、细胞生长和死亡、运输和分解代谢、细胞群落与原核生物互作的通路;与环境信息处理相关的通路,包括膜运输、信号转导的通路,均呈现出类似的变化趋势,即均在对照组中的丰度更高,且抗病品种中丰度高于感病品种。表明抗病品种根际微生态环境可能对辣椒生长更有利。
|
2.6 辣椒根际土壤微生物相关关系
为进一步了解影响土壤病原菌和有益菌与根际微生物间的相互作用,根据物种丰度表,在属水平分别计算真菌- 真菌、真菌- 细菌和细菌- 细菌物种的相关关系,构建相关性网络图。由图 6A可知,辣椒根际土壤真菌生态网络较复杂,呈现出较高的共现性(正相关百分比约为55.2%),表明辣椒根际真菌群落合作关系大于竞争关系。其中镰刀菌属、轮枝菌属和木霉菌属在群落中表现出更复杂的网络关系(具有更多的边)。镰刀菌属与真菌组内的13个属具有显著相关性,其中与毛霉属等7个属真菌呈正相关,与轮枝菌属等6个属真菌呈负相关;轮枝菌属与真菌组内的11个属具有显著相关性,其中与枝顶孢属、木霉菌属、踝节菌属和节丛孢属等10个属真菌呈正相关。木霉菌属与真菌组内的10个属具有显著相关性,其中与踝节菌属和节丛孢属等9个属真菌呈正相关,与Saitozyma属真菌呈负相关。

|
| A: 真菌-真菌;B: 真菌-细菌;C: 细菌-细菌;图中每个节点代表一个真菌或细菌物种,每个节点颜色的由深到浅代表该物种在相关关系网络图中相关关系从复杂到简单;红色实线表示两个物种间呈正相关关系,蓝色虚线表示两个物种间呈负相关关系;黑色实线方框标出的节点为相关病原菌,绿色虚线框标出的节点为相关有益性微生物 A: Fungi-fungi; B: Fungi-bacteria; C: Bacteria-bacteria; Each node in the figure represents a fungal or bacterial species; The color depth of each node represents the complexity of the species' relationship in the correlation network diagram, ranging from dark to light; The solid red line in the figure indicates a positive correlation between two species, while the dashed blue line indicates a negative correlation between two species; The nodes outlined with solid black lines represent pathogenic microorganisms, while those outlined with dashed green lines represent beneficial microorganisms 图 6 辣椒根际微生物物种相关性网络 Fig. 6 Species correlation network of rhizospheric microbial species in peppers |
由图 6B可知,辣椒根际土壤真菌和细菌群落也构成较复杂生态网络,且呈现出较高的共现性(正相关百分比约为51.2%),表明辣椒根际真菌和细菌群落存在较强的合作关系。其中镰刀菌属与细菌群落的20个属具有显著相关性,与芽孢杆菌属等7个属细菌呈正相关关系,与假单胞菌属等13个属细菌呈负相关关系;轮枝菌属与假单胞菌属和中慢生根瘤菌属细菌均呈正相关关系,与芽孢杆菌属等5个细菌属呈负相关关系。木霉菌属与中生根瘤菌属和Pedobacter属细菌具有显著正相关关系。芽孢杆菌属与真菌群落的17个属具有显著相关性,其中7个正相关、10个负相关;链霉菌属与Schizothecium属等3个属真菌均为正相关;假单胞菌属与真菌群落的5个属具有显著相关性,2个正相关、3个负相关。
由图 6C可知,相较而言,辣椒根际土壤细菌群落间形成更为复杂的网络结构,细菌群落间同时存在合作和竞争关系,正相关百分比约为49.9%。其中芽孢杆菌属在群落中表现出更复杂的网络关系,与细菌组内的39个属具有显著相关性,其中21个负相关、18个正相关;此外,链霉菌属与细菌组内的4个属具有显著相关性,3个负相关、1个正相关;假单胞菌属与细菌组内的13个属具有显著相关性,11个负相关、2个正相关。
3 讨论近年来,土传病害严重制约农业发展,微生物防治一直是研究的热点。研究表明,植物抗病品种会募集特定的微生物类群,形成特定的土壤- 根系- 微生物形成的互作微区,改善根际微生态环境,提高植物抵御病害的能力[12, 18]。根际微生物可通过群体多样性强化微生物物种间的相互作用,形成更稳定的互作网络、更优的微生态环境,其防治效果优于单个微生物种群。为此,本研究利用前期筛选的辣椒抗病和感病品种,探究正常和感病土壤条件下辣椒品种根际微生物群落结构特征、物种间的相关关系,以期为优化根际微生物群落结构提供重要参考。
本研究发现,具有土传病害史的土壤环境可导致辣椒根际土壤细菌群落的多样性降低、真菌群落的多样性增加,但不同品种间α多样性指数差异不显著,这与刘来等[20]、杨雪贞等[21]的研究结果相似。康捷等[22]研究表明,连作后的土壤呈现出细菌型向真菌型转变的趋势。通过NMDS分析可知,正常土壤条件下,不同品种间细菌群落结构差异较大,但感病土壤条件下不同抗病品种间细菌群落结构差异不大;而土壤真菌群落表现出相反的趋势。因此,深入研究不同品种间根际真菌群落的差异,可为抗病品种抵御土传病害的微生态机制提供重要信息。
进一步分析不同品种根际微生物物种组成可知,在门水平上,感病土壤的不同辣椒品种根际子囊菌门丰度均呈下降趋势,且感病品种的下降趋势更明显,明显低于抗病品种。在属水平,感病土壤的不同辣椒品种根际镰刀菌属相对丰度高于对照组,且感病品种也明显高于抗病品种;在不同土壤条件下,一些代表性有益微生物(如木霉属、踝节菌属、芽孢杆菌属等)的丰度在不同抗病品种间存在明显差异,但整体上均呈现感病土壤条件下抗病品种根际有益真菌和细菌属丰度高于感病品种的规律。结果表明,抗病品种在感病土壤条件下募集有益性微生物的能力更强,病原菌和有益菌数量的差异是引起不同品种根际微生物群落结构差异、导致土传病害程度不同的原因,这与康捷等[22]的研究结果一致。
不同根际微生态环境对植物生长产生不同的影响[23],细菌丰度对土壤条件变化具有更明显的响应[24]。在本研究中,不同健康程度土壤对辣椒出苗率及苗期生长情况产生显著影响,抗病品种生长情况优于感病品种,通过分析表达丰度Top15的细菌和真菌与辣椒生长情况的相关性及细菌功能预测,进一步验证抗病品种根际微生态环境可能对辣椒生长更有利。但单一细菌或真菌属的相对丰度与辣椒生长间的相关性未达到显著水平。这可能也是引入拮抗微生物在大田防治中效果并不理想的原因。Berendsen等[9]在研究中指出,通常单一的拮抗微生物需要达到足够数量才能有效拮抗病原菌,发挥防治作用。而在根际互作微区,由于多样的微生物类群相互作用,单一的拮抗微生物种群很难成功定殖[25]。杨珍等[12]、Niu等[26]的研究均表明利用混合菌群进行病害防治具有更大的优势。因此,研究更应从单一物种扩展到类型多样的组合菌群及群落水平,这与赵榕江等[27]的观点一致。
植物根际微生物相关性网络分析可为病害防治和生防菌筛选提供重要信息[28]。不同土壤条件下,细菌物种间、真菌物种间、细菌与真菌物种间均存在相互作用,形成相关性网络,使得物种间的联系更为紧密,从而对外界有更强的承受力[29]。本研究进一步分析根际微生物物种间相关关系,构建相关性网络图发现,镰刀菌属与毛霉属等7个属真菌呈显著正相关;与轮枝菌属等6个属真菌呈负相关;与芽孢杆菌属等7个属细菌呈显著正相关;与假单胞菌属等13个属细菌呈负相关关系。轮枝菌属与假单胞菌属和中慢生根瘤菌属细菌均呈正相关;与芽孢杆菌属等5个细菌属呈负相关。木霉菌属与中生根瘤菌属和Pedobacter属细菌具有显著正相关,这为有益菌有效定殖、组合菌群的利用提供重要信息。土壤病原菌与拮抗菌间均有各自的关系网络,产生密切的相互作用,后续应加强组合菌群的研究,利用混合菌群进行土传病害防治,但受限于16S rRNA和ITS测序的分辨率,微生物属、种水平的信息有待进一步挖掘。
4 结论在不同土壤条件下,不同抗病品种辣椒根际微生物群落结构具有明显差异。在感病土壤条件下,镰刀菌属真菌在感病品种中的相对丰度明显高于抗病品种,一些有益微生物(包括拮抗、促生真菌或细菌)的丰度整体呈现在抗病品种根际土壤中高于感病品种的趋势,且抗病品种辣椒生长情况明显优于感病品种。但不同品种辣椒在不同土壤条件下,单一细菌或真菌属的相对丰度与辣椒生长相关指标间未显示出显著的相关性。辣椒根际真菌- 真菌、真菌- 细菌、细菌- 细菌的相互作用,形成复杂的根际土壤微生物生态网络结构。在根际真菌- 真菌、真菌- 细菌网络中,互惠作用大于竞争作用;细菌- 细菌网络中竞争关系略大于合作关系。本研究还鉴定出与镰刀菌属、轮枝菌属、枝顶孢属、枝孢属、葡萄孢属,木霉属、踝节菌属、节丛孢属等微生物的相关关键类群,可为根际微生物群落结构的定向优化、根际微生物生态网络维持方面提供重要信息。
| [1] |
HERATH H M S N, RAFII M Y, ISMAIL S I, NAKASHA J J, RAMLEE S I. Improvement of important economic traits in chilli through heterosis breeding: A review[J]. The Journal of Horticultural Science and Biotechnology, 2021, 96(1): 14-23. DOI:10.1080/14620316.2020.1780162 |
| [2] |
ZHANG Y Y, CHEN Z X, CHEN F, YAN J Q, WU J Y, WANG J, GE S M. Transcriptome analyses reveal distinct defense strategies in chili plants under soilborne disease intervention[J]. Horticulturae, 2023, 9(12): 1267. DOI:10.3390/horticulturae9121267 |
| [3] |
刘洪, 彭俊伟, 孙阳, 胡洋, 李建刚, 董元华. 抑病土与感病土对番茄根际微生物性质的影响[J]. 土壤, 2023, 55(1): 122-131. DOI:10.13758/j.cnki.tr.2023.01.015 LIU H, PENG J W, SUN Y, HU Y, LI J G, DONG Y H. Effects of disease-suppressive and -conductive soils on tomato rhizosphere microbial properties[J]. Soils, 2023, 55(1): 122-131. DOI:10.13758/j.cnki.tr.2023.01.015 |
| [4] |
李兴龙, 李彦忠. 土传病害生物防治研究进展[J]. 草业学报, 2015, 24(3): 204-212. DOI:10.11686/cyxb20150321 LI X L, LI Y Z. Research advances in biological control of soil-borne disease[J]. Acta Prataculturae Sinica, 2015, 24(3): 204-212. DOI:10.11686/cyxb20150321 |
| [5] |
SANTHANAM R, LUU V T, WEINHOLD A, GOLDBERG J, OH Y, BALDWIN I T. Native root-associated bacteria rescue a plant from a sudden-wilt disease that emerged during continuous cropping[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(36): e5013. DOI:10.1073/pnas.1505765112 |
| [6] |
苏琴. 化学防治与生物防治的优缺点浅析[J]. 内蒙古农业科技, 2011(6): 84-85, 132. DOI:10.3969/j.jssn.1007-0907.2011.06.042 SU Q. An overview of the pros and cons of chemical and biological pest control[J]. Inner Mongolia Agricultural Science And Technology, 2011(6): 84-85, 132. DOI:10.3969/j.jssn.1007-0907.2011.06.042 |
| [7] |
祝蕾, 严辉, 刘培, 张振宇, 张森, 郭盛, 江曙, 段金廒. 药用植物根际微生物对其品质形成的影响及其作用机制的研究进展[J]. 中草药, 2021, 52(13): 4064-4073. DOI:10.7501/j.issn.0253-2670.2021.13.030 ZHU L, YAN H, LIU P, ZHANG Z Y, ZHANG S, GUO S, JIANG S, DUAN J A. Research progress on effects of rhizosphere microorganisms on qua lity for mation of medicinal plants and their interaction mechanisms[J]. Chinese Traditional and Herbal Drugs, 2021, 52(13): 4064-4073. DOI:10.7501/j.issn.0253-2670.2021.13.030 |
| [8] |
张瑞福. 根际微生物: 农业绿色发展中大有作为的植物第二基因组[J]. 生物技术通报, 2020, 36(9): 1-2. ZHANG R F. The rhizosphere microbiome: The plant's second genome with great potential for sustainable agricultural development[J]. Biotechnology Bulletin, 2020, 36(9): 1-2. |
| [9] |
BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486. DOI:10.1016/j.tplants.2012.04.001 |
| [10] |
张卫娜, 贾谏, 陆晓宇, 陈中健, 孔谦, 陈庄. 镰刀菌属真菌毒素的研究进展[J]. 广东农业科学, 2013, 40(15): 130-133. DOI:10.16768/j.issn.1004-874X.2013.15.031 ZHANG W N, JIA J, LU X Y, CHEN Z J, KONG Q, CHEN Z. Research advance on Fusarium mycotoxins[J]. Guangdong Agricultural Sciences, 2013, 40(15): 130-133. DOI:10.16768/j.issn.1004-874X.2013.15.031 |
| [11] |
卓梦霞, 刘思文, 李春雨, 胡位荣. 镰刀菌属真菌毒素在植物和病原菌互作中的研究进展[J]. 广东农业科学, 2024, 51(3): 56-69. DOI:10.16768/j.issn.1004-874X.2024.03.006 ZHUO M X, LIU S W, LI C Y, HU W R. Research progress on Fusarium mycotoxins in plant pathogen interactions[J]. Guangdong Agricultural Sciences, 2024, 51(3): 56-69. DOI:10.16768/j.issn.1004-874X.2024.03.006 |
| [12] |
杨珍, 戴传超, 王兴祥, 李孝刚. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22. DOI:10.11766/trxb201803260058 YANG Z, DAI C C, WANG X X, LI X G. Advance in research on rhizosphere microbial mechanisms of crop soil-borne fungal diseases[J]. Acta pedologica sinica, 2019, 56(1): 12-22. DOI:10.11766/trxb201803260058 |
| [13] |
GEORGE N A. 植物病理学[M]. 第5版. 北京: 中国农业大学出版社, 2007: 285-290. GEORGE N A. Plant pathology[M]. 5th Edition. Beijing: China Agricultural University Press, 2007: 285-290. |
| [14] |
顾艳, 梅瑜, 徐世强, 孙铭阳, 张闻婷, 周芳, 李静宇, 王继华. 药用植物连作障碍研究进展[J]. 广东农业科学, 2021, 48(12): 162-173. DOI:10.16768/j.issn.1004-874X.2021.12.018 GU Y, MEI Y, XU S Q, SUN M Y, ZHANG W T, ZHOU F, LI J Y, WANG J H. Research progress on continuous cropping obstacles of medicinal plants[J]. Guangdong Agricultural Sciences, 2021, 48(12): 162-173. DOI:10.16768/j.issn.1004-874X.2021.12.018 |
| [15] |
周文杰, 吕德国, 秦嗣军. 植物与根际微生物相互作用关系研究进展[J]. 吉林农业大学学报, 2016, 38(3): 253-260. DOI:10.13327/j.jjlau.2016.3073 ZHOU W J, LYU D G, QIN S J. Research progress in interaction between plant and rhizosphere microorganism[J]. Journal of Jilin Agricultural University, 2016, 38(3): 253-260. DOI:10.13327/j.jjlau.2016.3073 |
| [16] |
柳少燕, 陈捷胤, 李蕾, 戴小枫. 拮抗菌与病原菌碳水化合物酶类比较分析[J]. 基因组学与应用生物学, 2013, 32(1): 97-104. DOI:10.3969/gab.032.000097 LIU S Y, CHEN J Y, LI L, DAI X F. Comparative analysis of the carbohydrate-active enzymes between antagonistic microorganism and plant pathogen[J]. Genomics Applied Biology, 2013, 32(1): 97-104. DOI:10.3969/gab.032.000097 |
| [17] |
韦中, 沈宗专, 杨天杰, 王孝芳, 李荣, 徐阳春, 沈其荣. 从抑病土壤到根际免疫: 概念提出与发展思考[J]. 土壤学报, 2021, 58(4): 814-824. DOI:10.11766/trxb202003230038 WEI Z, SHEN Z Z, YANG T J, WANG X F, LI R, XU Y C, SHEN Q R. From suppressive soil to rhizosphere immunity: Towards an ecosystem thinking for soil-borne pathogen control[J]. Acta Pedologica Sinica, 2021, 58(4): 814-824. DOI:10.11766/trxb202003230038 |
| [18] |
郑明子, 杨丙烨, 杨晶晶, 俞仪阳, 姚协丰, 徐锦华, 郭坚华, 蒋春号. 土壤微生态在西瓜枯萎病发病过程中的变化研究[J]. 土壤, 2022, 54(6): 1185-1192. DOI:10.13758/j.cnki.tr.2022.06.012 ZHENG M Z, YANG B Y, YANG J J, YU Y Y, YAO X F, XU J H, GUO J H, JIANG C H. Study on pathogenesis of watermelon fusarium wilt from perspective of soil[J]. Soils, 2022, 54(6): 1185-1192. DOI:10.13758/j.cnki.tr.2022.06.012 |
| [19] |
MARTINEZ L, POUVREAU J B, MONTIEL G, JESTIN C, DELAVAULT P, SIMIER P, POULIN L. Soil microbiota promotes early developmental stages of phelipanche ramosa l (Pomel) during plant parasitism on Brassica napus L.[J]. Plant Soil, 2023, 483: 667-691. DOI:10.1007/s11104-022-05822-6 |
| [20] |
刘来, 黄保健, 孙锦, 郭世荣, 李恋卿, 郭红伟. 大棚辣椒连作土壤微生物数量、酶活性与土壤肥力的关系[J]. 中国土壤与肥料, 2013(2): 5-10. LIU L, HUANG B J, SUN J, GUO S R, LI L Q, GUO H W. Relationship between soil microbial quantity, enzyme activity and soil fertility in hot pepper greenhouse soils of different continuous cropping years[J]. Soil and Fertilizer Sciences in China, 2013(2): 5-10. |
| [21] |
杨雪贞, 罗同阳, 赵雪萍, 章淑艳, 许华森, 孙志梅. 山药田土壤微生物群落分布特征及间作豆科植物的改良效果[J]. 中国土壤与肥料, 2023(4): 54-60. DOI:10.11838/sfsc.1673-6257.22147 YANG X Z, LUO T Y, ZHAO X P, ZHANG S Y, XU H S, SUN Z M. Distribution characteristics of soil microbial community in yam field and improvement effect of intercropping Legumes[J]. Soil and Fertilizer Sciences in China, 2023(4): 54-60. DOI:10.11838/sfsc.1673-6257.22147 |
| [22] |
康捷, 章淑艳, 韩韬, 孙志梅, 罗同阳. 两种麻山药典型病害根际土壤微生物多样性的研究[J]. 生物技术通报, 2017, 33(7): 107-113. DOI:10.13560/j.cnki.biotech.bull.1985.2017-0067 KANG J, ZHANG S Y, GUO T, SUN Z M, LUO T Y. Research on rhizosphere soil microbial diversity of two typical kinds of disease in yam[J]. Biotechnology Bulletin, 2017, 33(7): 107-113. DOI:10.13560/j.cnki.biotech.bull.1985.2017-0067 |
| [23] |
连文慧, 董雷, 李文均. 土壤环境下的根际微生物和植物互作关系研究进展[J]. 微生物学杂志, 2021, 41(4): 74-83. DOI:10.3969/j.issn.1005-7021.2021.04.009 LIAN W H, DONG L, LI W J. Advances in rhizosphere microorganism and plant interaction in soil environment[J]. Journal of microbiology, 2021, 41(4): 74-83. DOI:10.3969/j.issn.1005-7021.2021.04.009 |
| [24] |
ZHANG X, ZHANG Q, ZHAN L, XU X, BI R, XIONG Z. Biochar addition stabilized soil carbon sequestration by reducing temperature sensitivity of mineralization and altering the microbial community in a greenhouse vegetable field[J]. Journal of Environmental Management, 2022, 313: 114972. DOI:10.1016/j.jenvman.2022.114972 |
| [25] |
柳焕章, 刘建钗, 周敬霄. 微生物间拮抗的研究方法与农业应用[J]. 安徽农业科学, 2011(3): 62-66, 84. DOI:10.13989/j.cnki.0517-6611.2011.03.080 LIU H Z, LIU J C, ZHOU J X. Research methods and agricultural application of microbial antagonism[J]. Journal of Anhui Agricultural Sciences, 2011(3): 62-66, 84. DOI:10.13989/j.cnki.0517-6611.2011.03.080 |
| [26] |
NIU B, PAULSON J N, ZHENG X, KOLTER R. Simplified and representative bacterial community of maize roots[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(12): 2450-2459. DOI:10.1073/pnas.1616148114 |
| [27] |
赵志祥, 凌斌, 严婉荣, 曾向萍, 肖敏, 陈圆. 辣椒枯萎病菌的分离鉴定与进化分析[J]. 分子植物育种, 2019, 17(19): 6383-6389. DOI:10.13271/j.mpb.017.006383 ZHAO Z X, LING B, YAN W R, ZENG X P, XIAO M, CHEN Y. Isolation, identification and phylogenetic analysis of pepper wilt[J]. Molecular Plant Breeding, 2019, 17(19): 6383-6389. DOI:10.13271/j.mpb.017.006383 |
| [28] |
XIE T, SHEN S, HAO Y, LI W, WANG J. Comparative analysis of microbial community diversity and dynamics on diseased tubers during potato storage in different regions of Qinghai, China[J]. Frontiers in Genetics, 2022, 13: 818940. DOI:10.3389/fgene.2022.818940 |
| [29] |
桂莎, 刘芳, 张立丹, 樊小林. 复合菌剂防控香蕉枯萎病的效果及其微生物学机制[J]. 土壤学报, 2020, 57(4): 995-1007. DOI:10.11766/trxb201904180111 GUI S, LIU F, ZHANG L D, FAN X L. Effects of complex anti-fungal agents biocontrolling fusarium wilt on banana and its microbiological mechanism[J]. Acta Pedologica Sinica, 2020, 57(4): 995-1007. DOI:10.11766/trxb201904180111 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51