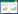文章信息
基金项目
- 国家自然科学基金(32102691,31902272);广东省科技计划项目(2021B1212030015);广东省“十四五”农业科技创新十大主攻方向“揭榜挂帅”项目(2022SDZG02);广东省现代农业产业技术体系创新团队项目(2023KJ137)
作者简介
- 黄允真(1992—),男,博士,助理研究员,研究方向为禽病防治,E-mail:huangyunzhen110@hotmail.com.
通讯作者
- 孙敏华(1984—),男,博士,研究员,研究方向为禽病防治,E-mail:smh2002smh@163.com.
文章历史
- 收稿日期:2024-01-05
【研究意义】坦布苏病毒病,是由黄病毒科、黄病毒属中的坦布苏病毒(Tembusu virus,TMUV)感染引起的禽病[1-3]。该病于2010年在我国华东地区首次被发现[3],随即迅速在我国传播开来[4-6]。该病毒的感染范围呈扩大趋势,从最初感染蛋鸭,到感染肉鸭[7]、鹅[8],乃至鸡[9]、麻雀[10]等禽类。目前,临床上以鸭和鹅发病最为严重,可造成产蛋下降、瘫痪甚至死亡,并导致细菌继发感染[11-13],给水禽养殖业带来巨大的经济损失。【前人研究进展】天然抗病毒免疫反应是宿主抵御病毒入侵特异性免疫的基础,自病毒入侵伊始,宿主的免疫系统就能识别“非己”,产生抗病毒反应。黄病毒可以被宿主模式识别受体(Pattern recognition receptors,PRRs)识别,从而激活Ⅰ型干扰素(Interferon,IFN)免疫信号通路。目前,已有3种主要的PRRs被鉴定出来,即Toll样受体(Toll-like receptors,TLRs)、RIG-Ⅰ样受体(RIG-Ⅰ like receptors,RLRs)和NOD样受体。病毒也由此进化出一系列应对宿主抗病毒机制的手段,例如,黄病毒属病毒非结构蛋白(Non-structural protein,NS protein)能通过阻断RIG-Ⅰ信号通路的方式抑制IFN-β的表达,进而降低宿主的抗病毒免疫反应,并提高病毒在宿主中的复制效率[14-17]。已有研究表明,TMUV NS1在哺乳动物细胞中能与线粒体抗病毒信号蛋白(Mitochondrial antiviral signaling protein,MAVS)结合,从而破坏MAVS与下游分子的相互作用,进而抑制RIG-Ⅰ信号通路诱导的IFN-β的表达[18]。【本研究切入点】我国及东南亚水禽群中流行的TMUV主要以基因2群为主,自2020年以来,陆续有3群TMUV感染鸡群和鸭群的报道,但2群TMUV仍是水禽感染的主要基因型。研究表明,2群TMUV在鸭体内的复制能力强于3群TMUV[9]。然而,TMUV作为鸭群中的一个重要病原,却尚未有TMUV NS1蛋白抑制鸭天然抗病毒免疫反应的分子机制研究。【拟解决的关键问题】本研究选取2群TMUV-JM株和3群TMUV-GX株为研究对象,通过比较DEF细胞中TMUV-JM NS1与TMUV-GX NS1对RIG-Ⅰ信号通路影响的差异,明确NS1蛋白的关键活性区域及作用的通路节点分子,为不同亚型TMUV对鸭的致病性差异研究提供研究方向,也为进一步研究TMUV抵抗宿主天然免疫提供借鉴。
1 材料与方法 1.1 试验材料供试病毒及细胞:TMUV-JM株和TMUV-GX株均由广东省农业科学院动物卫生研究所禽病研究室分离鉴定。DF1细胞由广东省农业科学院动物卫生研究所禽病研究室保存。鸭胚购自新兴大华农禽蛋有限公司,制备的鸭胚成纤维细胞(DEF)在含10% FBS的DMEM完全培养基中培养。
质粒和试剂:pcDNA3.1、pGL3-Basic、p-TK质粒为课题组实验室保存。TMUV-JM和TMUV-GX的NS蛋白表达质粒、RIG-Ⅰ信号通路节点分子表达质粒、duIFN-β-luc/duIRF7-luc和p-TK等相关质粒由广东省农业科学院动物卫生研究所禽病研究室构建。其中,NS蛋白表达质粒是在提取TMUV-JM株和GX株病毒RNA后,RT-PCR扩增TMUV NS蛋白基因,并通过PCR在基因C端添加HA标签,将NS蛋白基因克隆至pcDNA3.1质粒中;RIG-Ⅰ信号通路节点分子表达质粒是通过提取TMUV感染的DEF细胞总RNA,反转录后PCR扩增鸭RIG-I、MAVS、干扰素基因刺激因子(Stimulator of interferon genes,STING)、TNF受体相关因子3(TNF Receptor Associated Factor 3,TRAF3)、TBK1、干扰素调节因子7(Interferon regulatory factor 7,IRF7)基因,并通过PCR在基因C端添加flag标签,将RIG-Ⅰ信号通路基因分别克隆至pcDNA3.1质粒中。双荧光素酶报告系统中报告质粒duIFN-β-luc、duIRF7-luc(提取DEF细胞基因组DNA,PCR扩增鸭IFN-β和IRF7启动子区域,并分别克隆至pGL3-Basic质粒中)。以上质粒构建均采用无缝克隆方法。ClonExpress Ⅱ One Step Cloning Kit和One Step qRT-PCR SYBR Green kit试剂盒购自南京诺唯赞生物科技股份有限公司。anti-HA-tag、anti-flag-tag、anti-GAPDH、anti-TBK1、anti-pTBK1抗体、IP裂解液、HA标签蛋白免疫沉淀试剂盒和Lipo8000转染试剂等购自上海碧云天生物技术公司。
1.2 试验方法1.2.1 2群TMUV对IFN-β和IRF7启动子活性的抑制 在DEF细胞中过表达鸭STING,将pcDNA-STING、duIFN-β-luc/duIRF7-luc、p-TK质粒共转染生长良好的DEF细胞,4 h后,分别以0.01 MOI和1 MOI的TMUV-JM感染细胞;24 h后,使用Dual-Glo®双荧光素酶检测系统检测IFN-β和IRF7启动子的激活情况。
1.2.2 抑制IFN-β启动子激活的TMUV NS蛋白的筛选 分别将TMUV-JM和TMUV-GX的NS蛋白表达质粒(pcDNA-JM-NS1、pcDNA-JM-NS2A、pcDNA-JM-NS2B、pcDNA-JM-NS3、pcDNA-JM-NS4A、pcDNA-JM-NS4B、pcDNA-JM-NS5、pcDNA-GX-NS1、pcDNA-GX-NS2A、pcDNA-GX-NS2B、pcDNA-GX-NS3、pcDNA-GX-NS4A、pcDNA-GX-NS4B、pcDNA-GX-NS5)和pcDNA-RIG-Ⅰ、duIFN-β-luc、p-TK质粒共转染生长良好的DEF细胞,每个转染组3次重复。转染24 h后,去除细胞上清,提取细胞总RNA,使用DNase Ⅰ去除残留DNA。以p-TK质粒的萤火虫荧光素酶基因为内参,qRT-PCR检测duIFN-β-luc质粒IFN-β启动子下海肾荧光素酶基因的转录水平。通过qRT-PCR结果确定IFN-β启动子的激活情况,筛选能抑制RIG-Ⅰ信号通路的TMUV NS蛋白。
1.2.3 2群TMUV NS1抑制RIG-Ⅰ信号通路的靶向分子 分别将RIG-Ⅰ通路节点分子表达质粒pcDNA-MAVS、pcDNA-STING、pcDNA-TRAF3、pcDNA-TBK1、pcDNA-IRF7和pcDNA-GX-NS1/pcDNA-JM-NS1、duIFN-β-luc、p-TK质粒共转染生长良好的DEF细胞,每个转染组3次重复。参照1.2.2所述方法检测IFN-β启动子的激活情况,筛选出2群TMUV NS1抑制RIG-Ⅰ信号通路的靶向分子。
1.2.4 2群TMUV NS1抑制RIG-Ⅰ信号通路的关键活性区域 使用PCR和融合PCR将pcDNA-JM-NS1质粒上NS1基因编码1~156 aa、157~254 aa、255~352 aa区域分别替换为GX株NS1蛋白对应区域的核苷酸,构建NS1重组表达质粒pcDNA-JMNS1/GX1-156、pcDNA-JMNS1/GX157-254、pcDNA-JMNS1/GX255-352。分别将这3种质粒与pcDNA-TBK1、duIFN-β-luc、p-TK质粒共转染生长良好的DEF细胞,每个转染组3次重复。参照1.2.2所述方法检测IFN-β启动子的激活情况,筛选出2群TMUV NS1抑制RIG-Ⅰ信号通路的关键活性区域。
1.2.5 2群TMUV NS1与TBK1的互作 激光共聚焦:为研究2群TMUV NS1与TBK1在细胞水平是否存在共定位,将TMUV-JM NS1和TMUV-GX NS1分别克隆至绿色荧光蛋白质粒pCA-EGFP,得到pCA-EGFP-JMNS1、pCA-EGFP-GXNS1质粒。将TBK1克隆至红色荧光蛋白质粒pAsRed2,得到pAsRed2-TBK1质粒。分别将pCA-EGFP-JMNS1或pCA-EGFP-GXNS1和pAsRed2-TBK1共转染DF1细胞,同时设置空载体转染对照,转染24 h后,使用多聚甲醛固定细胞,使用DAPI染色并封片。于激光共聚焦显微镜下观察蛋白的共定位情况。
免疫共沉淀(co-IP)和Western Blotting:为进一步研究2群TMUV NS1与TBK1是否存在互作,分别将pcDNA-GX-NS1、pcDNA-JM-NS1、pcDNA-JMNS1/GX1-156、pcDNA-JMNS1/GX157-254、pcDNA-JMNS1/GX255-352与pcDNA-TBK1共转染DF1细胞,同时设置空载体转染对照。转染24 h后,除去细胞上清,加入适量IP裂解液和蛋白酶抑制剂混合物。根据产品说明书,使用HA标签蛋白免疫沉淀试剂盒进行免疫共沉淀。所制蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,并转印至PVDF膜。随后进行封闭、一抗孵育、HRP标记二抗孵育,使用ECL化学发光试剂盒进行显影。
1.2.6 NS1重组病毒感染性克隆构建 反向遗传操作系统载体构建:分别从pCI-neo质粒和TVT7R(0.0)载体扩增CMV启动子及丁型肝炎核酶(HDV Rz)基因,利用融合PCR和无缝克隆技术,以pACYC质粒为骨架,构建正链RNA病毒反向遗传操作的质粒载体pACYC-CMV-Rz,其中CMV启动子和HDV Rz之间为病毒DNA插入位点。
亲本株TMUV-JM株全长克隆:以TMUV-JM cDNA为模板利用RT-PCR基因组分为3段进行扩增,相邻片段之间保留约300 bp重叠区域。并克隆至载体质粒,获得重组质粒pJM1-4697、pJM4330-6517、pJM6253-10993。利用融合PCR获得TMUV病毒全长cDNA,利用无缝克隆将JM株全长cDNA插入载体pACYC-CMV-Rz,获得重组质粒pACYC-CMV-JM-Rz。
重组病毒TMUV-JM/GXNS1全长克隆:以TMUV-GX cDNA为模板获得TMUV-GX NS1片段,利用无缝克隆技术将pACYC-CMV-JM-Rz NS1区域替换为TMUV-GX NS1,获得重组病毒全长质粒pACYC-CMV-JM/GXNS1-Rz。
将pACYC-CMV-JM-Rz和pACYC-CMV-JM/GXNS1-Rz分别转染至生长旺盛的DF1细胞,待细胞出现病变,收获重组病毒。
1.2.7 NS1在病毒感染中对IFN-β转录水平的影响 分别将拯救获得的重组病毒rTMUV-JM和rTMUV-JM/GXNS1以0.5 MOI感染DEF细胞。在感染后第6、12、24、48 h分别收集细胞样品,每个时间点3次重复。提取细胞总RNA,使用DNase Ⅰ去除残留DNA。利用qRT-PCR检测IFN-β的mRNA水平。分析2群TMUV NS1在病毒感染DEF细胞时对IFN-β转录水平的影响。
所有数据均在GraphPad Prism 8.0软件中进行分析及作图。
2 结果与分析 2.1 2群TMUV对IFN-β和IRF7启动子活性的抑制萤光素酶报告基因系统检测发现,低剂量(0.01 MOI)和高剂量(1 MOI)的TMUV均能显著抑制鸭STING下游IRF7启动子的活性(P<0.05),并且高剂量TMUV的抑制效果更为明显(P<0.01)(图 1A)。低病毒量刺激不能抑制IFN-β启动子的活性(P > 0.05);而高剂量刺激后的DEF细胞中,IFN-β启动子的活性显著下调(图 1B,P<0.05)。
|
| 图 1 不同剂量的TMUV对IRF7(A)和IFN-β(B)启动子活性的影响 Fig. 1 Effects of different doses of TMUV on the activity of IRF7 (A) and IFN-β (B) promoters |
2.2 TMUV NS蛋白对IFN-β启动子活性的抑制
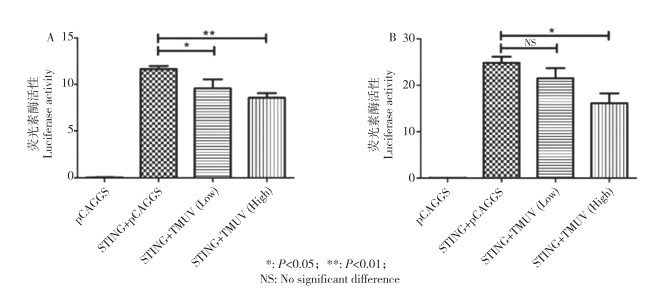
为探究引起2.1中差异的原因,本研究利用鸭IFN-β启动子-荧光素酶报告质粒系统研究TMUV-JM和TMUV-GX NS蛋白对IFN-β启动子激活抑制的作用。将TMUV-JM和TMUV-GX的NS蛋白基因分别克隆至真核表达载体pCDNA3.1。然后将报告质粒duIFN-β-luc、内参质粒p-TK、pcDNA3.1-RIG-Ⅰ、pcDNA3.1-NS共转染DEF细胞,qPCR检测IFN-β启动子的转录水平。结果(图 2)显示,在DEF细胞中,TMUV-JM株的NS1(P<0.01)、NS2B(P<0.01)和NS4B(P<0.05)均能显著抑制RIG-Ⅰ介导的IFN-β启动子激活;与此相反,TMUV-GX株的NS蛋白对RIG-Ⅰ介导的IFN-β启动子激活无显著抑制作用。
|
| 图 2 TMUV NS蛋白对IFN-β启动子活性的影响 Fig. 2 Effects of TMUV NS proteins on the activity of IFN-β promoter |
2.3 2群TMUV NS1蛋白对抑制RIG-Ⅰ信号通路的靶向分子分析
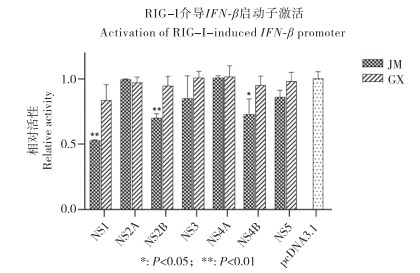
将报告质粒duIFN-β-luc、内参质粒p-TK、pcDNA3.1-RIG-Ⅰ/MAVS/STING/TRAF3/TBK1/IRF7、pcDNA3.1-JM/GXNS1共转染DEF细胞,qPCR检测IFN-β启动子的转录水平。结果(图 3)显示,对比空载体(Vector)对照组,TMUV-JM NS1蛋白能显著抑制MAVS(P<0.01)、STING(P<0.05)、TRAF3(P<0.05)、TBK1(P<0.01)介导的IFN-β启动子激活,但不能抑制IRF7介导的IFN-β启动子激活;TMUV-GX NS1蛋白对MAVS、STING、TRAF3、TBK1、IRF7介导的IFN-β启动子激活均无显著抑制作用。综上,TMUV-JM NS1蛋白抑制RIGG-Ⅰ介导的IFN-β启动子激活的关键节点分子为TBK1或其下游分子。
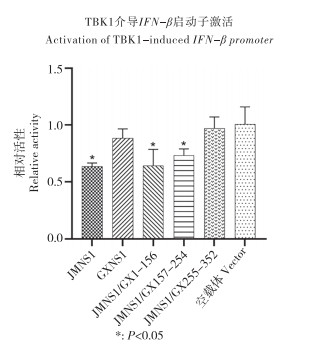
2.4 2群TMUV NS1蛋白抑制IFN-β启动子活性关键区域的确定将重组NS1蛋白表达质粒、报告质粒duIFN-β-luc、内参质粒p-TK、pcDNA3.1-TBK1共转染DEF细胞,qRT-PCR检测IFN-β启动子的转录水平。结果(图 4)显示,重组蛋白JMNS1/GX255-352不能抑制TBK1介导的IFN-β启动子激活,表明255~352 aa是TMUV-JM NS1蛋白抑制IFN-β启动子活性的关键区域。
|
| 图 3 TMUV NS1蛋白对抑制RIG-Ⅰ信号通路的靶向分子分析 Fig. 3 Targeted molecular analysis of TMUV NS1 proteins inhibiting RIG-Ⅰ signaling pathway |
|
| 图 4 2群TMUV NS1蛋白抑制IFN-β启动子活性的关键区域 Fig. 4 Key region of group 2 TMUV NS1 proteins inhibiting the activity of IFN-β promoter |
2.5 2群TMUV NS1蛋白对TBK1磷酸化的影响
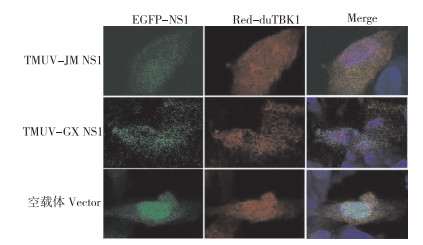
分别将pCA-EGFP-JMNS1、pCA-EGFP-GXNS1、pCA-EGFP与pAsRed2-TBK1共转染DF1细胞,转染24 h固定细胞,用激光共聚焦观察NS1蛋白与TBK1是否存在共定位。结果(图 5)显示,TMUV-JM NS1蛋白和TMUV-GX NS1蛋白与TBK1在DF1细胞中的表达不存在共定位。
|
| 图 5 TMUV NS1和TBK1共定位 Fig. 5 Co-localization of TMUV NS1 and TBK1 |
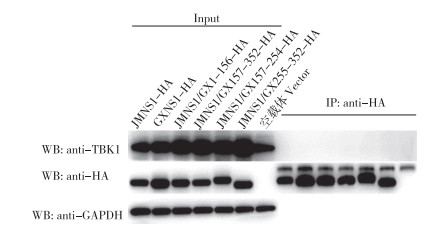
为进一步确定2群TMUV NS1蛋白与TBK1的互作关系,分别将pcDNA3.1-JMNS1、pcDNA3.1-GXNS1、pcDNA3.1-JMNS1/GX1-156、pcDNA3.1-JMNS1/GX157-254、pcDNA3.1-JMNS1/GX255-352与pcDNA-TBK1共转染DF1细胞,co-IP试验及Western Blotting试验检测NS1与TBK1的互作。结果(图 6)显示,2群TMUV NS1蛋白及其他重组NS1蛋白与TBK1不存在互作。
|
| 图 6 TMUV NS1和TBK1免疫共沉淀 Fig. 6 Co-immunoprecipitation of TMUV NS1 and TBK1 |
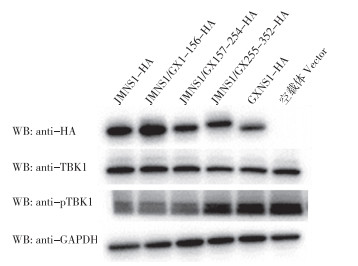
为研究2群TMUV NS1蛋白是否通过间接影响TBK1磷酸化从而起到抑制IFN-β启动子激活活性,分别将pcDNA3.1-JMNS1、pcDNA3.1-GXNS1、pcDNA3.1-JMNS1/GX1-156、pcDNA3.1-JMNS1/GX157-254、pcDNA3.1-JMNS1/GX255-352与pcDNA-TBK1共转染DF1细胞,通过Western Blotting试验检测TBK1磷酸化。结果(图 7)显示,TMUV-JM NS1蛋白及其重组蛋白JMNS1/GX1-156、JMNS1/GX157-254在DF1细胞中降低了外源TBK1磷酸化水平,GXNS1、JMNS1/GX255-352在DF1细胞中不影响外源TBK1磷酸化水平。以上结果表明,TMUV-JM NS1通过间接作用影响TBK1磷酸化水平从而起到抑制IFN-β启动子激活的作用,TMUV-JM NS1抑制TBK1磷酸化的关键活性区域为255~352 aa。
|
| 图 7 TWUV NS1蛋白对TBK1磷酸化水平的影响 Fig. 7 Effects of TMUV NS1 proteins on the phosphorylation level of TBK1 |
2.6 重组病毒rTMUV-JM/GXNS1感染DEF细胞诱导IFN-β转录水平研究
将构建的pACYC-CMV-JM-Rz和pACYC-CMV-JM/GXNS1-Rz分别转染至DF1细胞,转染后72 h收获上清液。上清于DF1细胞中继续传代,接种细胞在接种后48~72 h可出现细胞病变(图 8),表明两种重组病毒拯救成功。

|
| 图 8 DF1细胞感染重组病毒后的致细胞病变效应 Fig. 8 CPE of DF1 cells infected with recombinant virus |
将拯救获得的重组病毒rTMUV-JM和rTMUV-JM/GXNS1以0.5 MOI分别感染DEF细胞。在感染后第6、12、24、48 h分别收集细胞样品,利用qRT-PCR检测IFN-β的mRNA水平。结果(图 9)显示,用重组病毒rTMUV-JM和rTMUV-JM/GXNS1感染DEF细胞后第6、12、48 h诱导的IFN-β的mRNA水平无显著差异,但在感染后24 h,rTMUV-JM感染细胞的IFN-β的mRNA水平显著低于rTMUV-JM/GXNS1感染细胞的IFN-β的mRNA水平。结果表明,2群TMUV NS1蛋白能调节病毒感染引起的Ⅰ型干扰素通路。
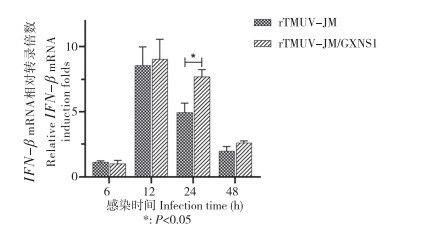
|
| 图 9 重组TMUV感染DEF细胞诱导IFN-β的mRNA水平 Fig. 9 IFN-β mRNA level induced by recombinant TMUV in DEF cells |
3 讨论
坦布苏病毒病是重要的水禽传染病,自该病在东南亚流行以来,偶有3群TMUV感染水禽的报道,但当前水禽中流行的TMUV仍以2群毒株为主[19]。研究表明,在感染早期,2群TMUV在肝、肾、脑等组织中的病毒拷贝数显著高于3群TMUV。本研究检验了一种假设,即2群TMUV相比3群TMUV对鸭的天然免疫反应具有更强的抑制作用,导致2群TMUV在鸭体能具有更强的复制能力,在水禽中有更强的传播能力。
目前为止,已有研究的所有黄病毒都被证明可以通过不同方式抑制宿主的免疫反应,从而促进病毒的增殖和传播。本研究结果也表明,TMUV-JM株在DEF中能够抑制STING诱导的IRF7和IFN-β启动子激活。黄病毒的NS蛋白主要参与病毒的复制和对宿主先天免疫的逃逸。然而,不同黄病毒NS蛋白抑制宿主天然免疫反应的方式不尽相同:登革热病毒(Dengue virus,DENV)NS2B3可靶向IκB激酶ε(IκB kinase ε,IKKε)阻断IRF3磷酸化和核位移,从而抑制IFN-β表达[20];DENV NS2A和NS4B被证明可以抑制TBK1磷酸化进而抑制IFN-β表达[21];寨卡病毒(Zika virus,ZIKV)和DENV NS5蛋白可以用过蛋白酶体结合降解信号转导子和转录激活子2(Signal transducer and activator of transcription 2,STAT2)抑制IFN信号通路[22]。本研究选取2群TMUV-JM株和3群TMUV-GX株为研究对象,对TMUV-JM株和TMUV-GX株NS蛋白对RIG-Ⅰ诱导的IFN-β通路的抑制作用进行研究,相比TMUV-GX株,TMUV-JM株NS1、NS2B和NS4B能抑制RIG-Ⅰ诱导的IFN-β启动子激活。
黄病毒NS1是一个多功能蛋白,参与病毒的复制、介导组织损伤及免疫逃逸等[16, 23-24]。ZIKA病毒NS1和NS4B可靶向RIG-Ⅰ通路节点分子TBK1,从而抑制IFN-β的产生[25]。此外,研究人员通过对比流行前毒株,发现ZIKV NS1 A188V单氨基酸残基突变,使ZIKV NS1能抑制TBK1磷酸化,进而抑制IFN-β产生[16]。乙型脑炎病毒(Japanese encephalitis virus,JEV)NS1则通过靶向RIG-Ⅰ通路节点分子MAVS抑制IFN-β和干扰素刺激基因(Interferon-stimulated genes,ISGs)的产生并促进病毒复制[26-27]。进一步研究表明,JEV NS1通过上调microRNA-22的产生,拮抗宿主MAVS,从而抑制IFN-Ⅰ的产生并促进病毒复制。此外,Li等[28]研究发现,JEV NS1还可与CDK1蛋白互作,抑制CDK1去磷酸化,进而抑制MAVS介导的IFN-β的产生。Wilson等[29]研究表明,西尼罗病毒(West Nile virus,WNV)NS1可抑制TRL3信号通路介导的IFN-β和核因子κB(Nuclear factor kappa-B,NF-κB)表达。WNV NS1也可以通过靶向RIG-Ⅰ和黑色素瘤分化相关蛋白5(Melanoma differentiation-associated protein 5,MDA5)抑制IFN-β的产生,作用机理是NS1靶向RIG-Ⅰ和MDA5并介导其被蛋白酶体降解[30]。在关于TMUV NS1抑制天然免疫的研究中,研究者发现在HEK293T细胞中,TMUV NS1可以通过靶向MAVS抑制IFN-β的产生[18]。本研究发现,在DEF细胞中,2群TMUV NS1可以通过降低TBK1的磷酸化水平从而抑制IFN-β的产生,而不是靶向MAVS,其原因可能是毒株或作用宿主细胞的差异。进一步对2群TMUV NS1与TBK1互作关系进行验证,本研究得知与ZIKV NS1通过结合TBK1抑制后者磷酸化不同,TMUV NS1与TBK1不存在直接互作或共定位,且鉴定出TMUV-JM NS1 255~352 aa是抑制RIG-Ⅰ信号通路的关键区域。
4 结论2群TMUV NS1具有抑制RIG-Ⅰ信号通路的活性,且2群TMUV NS1抑制RIG-Ⅰ信号通路的节点分子为TBK1。通过对TMUV-JM NS1和TMUV-GX NS1比较研究,确定2群TMUV NS1抑制RIG-Ⅰ信号通路的关键活性区域为255~352 aa。进一步研究发现,TMUV-JM NS1与TBK1不存在直接相互作用,而是间接降低TBK1磷酸化水平从而降低IFN-β表达水平。通过构建2群TMUV NS1蛋白重组毒株rTMUV-JM/GXNS1,明确TMUV-JM NS1能在病毒感染中抑制鸭IFN-β表达水平。本项研究为不同亚群TMUV对鸭的致病性差异研究提供借鉴;也为不同亚群TMUV在水禽中传播水平差异的研究提供科学参考。
| [1] |
苏敬良, 李爽, 胡旭东, 遇秀玲, 王勇月, 张国中, 胡薛英, 苏文良, 田克恭, 高福. 引起鸭产蛋量下降的坦布苏病毒相关黄病毒研究[C]//中国畜牧兽医学会. 2011. DOI: 10.26914/c.cnkihy.2011.001626. SU J L, LI S, HU X D, YU X L, WANG Y Y, ZHANG G Z, HU X Y, SU W L, TIAN K G, GAO F. Study on the flavivirus associated with the decline in duck egg production caused by Tambusou virus [C]//Chinese Association of Animal and Veterinary Sciences. 2011. DOI: 10.26914/c.cnkihy.2011.001626. |
| [2] |
李泽君. 鸭坦布苏病毒病病原的分离鉴定及生物学特性研究[J]. 中国家禽, 2011, 33(17): 34-35. DOI:10.16372/j.issn.1004-6364.2011.17.037 LI Z J. Isolation, identification and biological characteristics of the pathogen of duck Tembusu virus disease[J]. China Poultry, 2011, 33(17): 34-35. DOI:10.16372/j.issn.1004-6364.2011.17.037 |
| [3] |
万春和, 施少华, 程龙飞, 陈红梅, 傅光华, 张大丙, 林芳, 林建生, 黄瑜. 一种引起种(蛋) 鸭产蛋骤降新病毒的分离与初步鉴定[J]. 福建农业学报, 2010, 25(6): 663-666. DOI:10.19303/j.issn.1008-0384.2010.06.001 WANG C H, SHI S H, CHENG L F, CHEN H M, FU G H, ZHANG D B, LIN F, LIN J S, HUANG Y. A newly identified Flavivirus virus causing abrupt egg-laying reduction in ducks[J]. Fujian Journal of Agricultural Sciences, 2010, 25(6): 663-666. DOI:10.19303/j.issn.1008-0384.2010.06.001 |
| [4] |
YAN P, ZHAO Y, ZHANG X, XU D, DAI X, TENG Q, YAN L, ZHOU J, JI X, ZHANG S, LIU G, ZHOU Y, KAWAOKA Y, TONG G, LI Z. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J]. Virology, 2011, 417(1): 1-8. DOI:10.1016/j.virol.2011.06.003 |
| [5] |
LI L, AN H, SUN M, DONG J, YUAN J, HU Q. Identification and genomic analysis of two duck-origin Tembusu virus strains in southern China[J]. Virus Genes, 2012, 45(1): 105-112. DOI:10.1007/s11262-012-0753-6 |
| [6] |
黄允真, 孙敏华, 廖明. 鸭坦布苏病毒病的研究进展[J]. 广东农业科学, 2020, 47(11): 182-190. DOI:10.16768/j.issn.1004-874X.2020.11.020 HUANG Y Z, SUN M H, LIAO M. Research progress in duck Tembusu virus disease[J]. Guangdong Agricultural Sciences, 2020, 47(11): 182-190. DOI:10.16768/j.issn.1004-874X.2020.11.020 |
| [7] |
黄瑜, 苏荣茂, 傅光华, 万春和, 陈红梅, 傅秋玲, 陈珍, 施少华, 程龙飞. 禽坦布苏病毒感染的宿主及临床表现[J]. 中国兽医杂志, 2014, 50(11): 50-52. DOI:10.3969/j.issn.0529-6005.2014.11.016 HUANG Y, SU R M, FU G H, WAN C H, CHEN H M, FU Q L, CHEN Z, SHI S H, CHENG L F. Hosts and clinical manifestations of avian Tembusu virus infection[J]. Chinese Journal of Veter inar y Medicine, 2014, 50(11): 50-52. DOI:10.3969/j.issn.0529-6005.2014.11.016 |
| [8] |
TI J, ZHANG L, LI Z, ZHAO D, ZHANG Y, LI F, DIAO Y. Effect of age and inoculation route on the infection of duck Tembusu virus in goslings[J]. Veterinary Microbiology, 2015, 181(3): 190-197. DOI:10.1016/j.vetmic.2015.10.001 |
| [9] |
HUANG Y, HU Z, DONG J, LI L, ZHANG J, KUANG R, GAO S, SUN M, LIAO M. Chicken-origin cluster 3.2 Tembusu virus exhibits higher infectivity than duck-origin cluster 2 Tembusu virus in chicks[J]. Frontiers in Veterinary Science, 2023, 10: 1152802. DOI:10.3389/fvets.2023.1152802 |
| [10] |
TANG Y, DIAO Y, YU C, GAO X, JU X, XUE C, LIU X, GE P, QU J, ZHANG D. Characterization of a Tembusu virus isolated from naturally infected house sparrows (Passer domesticus) in Northern China[J]. Transboundary and Emerging Diseases, 2013, 60(2): 152-158. DOI:10.1111/j.1865-1682.2012.01328.x |
| [11] |
LIU C, DIAO Y, WANG D, CHEN H, TANG Y, DIAO Y. Duck viral infection escalated the incidence of avian pathogenic Escherichia coli in China[J]. Transboundary and Emerging Diseases, 2019, 66(2): 929-938. DOI:10.1111/tbed.13107 |
| [12] |
张光洁, 全秀振, 李小敏, 谭军. 蛋鸭坦布苏病毒和鸭疫里默氏菌混合感染的诊断[J]. 养殖与饲料, 2023, 22(8): 85-87. DOI:10.3969/j.issn.1671-427X.2023.08.026 ZHANG G J, QUAN X Z, LI X M, TAN J. Diagnosis of mixed infection of laying duck Tembusu virus and Riemerella anatipestifer[J]. Animals Breeding and Feed, 2023, 22(8): 85-87. DOI:10.3969/j.issn.1671-427X.2023.08.026 |
| [13] |
魏雨欣. 一起疑似肉鸭坦布苏病毒与沙门氏菌混合感染诊疗体会[J]. 山东畜牧兽医, 2023, 44(10): 41-43. DOI:10.3969/j.issn.1007-1733.2023.10.015 WEI Y X. Diagnosis and treatment experience of a suspected mixed infection of duck Tembusu virus and Salmonella[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2023, 44(10): 41-43. DOI:10.3969/j.issn.1007-1733.2023.10.015 |
| [14] |
FANUNZA E, CARLETTI F, QUARTU M, GRANDI N, ERMELLINO L, MILIA J, CORONA A, CAPOBIANCHI M R, IPPOLITO G, TRAMONTANO E. Zika virus NS2A inhibits interferon signaling by degradation of STAT1 and STAT2[J]. Virulence, 2021, 12(1): 1580-1596. DOI:10.1080/21505594.2021.1935613 |
| [15] |
ZHANG W, JIANG B, ZENG M, LU T, HU T, GUO J, WANG M, JIA R, ZHU D, LIU M, ZHAO X, YANG Q, WU Y, ZHANG S, LIU Y, ZHANG L, YU Y, PAN L, CHENG A, CHEN S. Decreased virulence of duck Tembusu virus harboring a mutant NS2A with impaired interaction with STING and IFN-β induction[J]. Veterinary Microbiology, 2022, 265: 109312. DOI:10.1016/j.vetmic.2021.109312 |
| [16] |
XIA H, LUO H, SHAN C, MURUATO A E, NUNES B, MEDEIROS D, ZOU J, XIE X, GIRALDO M I, VASCONCELOS P, WEAVER S C, WANG T, RAJSBAUM R, SHI P Y. An evolutionary NS1 mutation enhances Zika virus evasion of host interferon induction[J]. Nature Communications, 2018, 9(1): 414. DOI:10.1038/s41467-017-02816-2 |
| [17] |
YU C Y, CHANG T H, LIANG J J, CHIANG R L, LEE Y L, LIAO C L, LIN Y L. P122 Dengue virus targets the adaptor protein MITA to subvert host innate immunity[J]. Cytokine, 2012, 59(3): 558. DOI:10.1016/j.cyto.2012.06.214 |
| [18] |
WANG J, LEI C Q, JI Y, ZHOU H, REN Y, PENG Q, ZENG Y, JIA Y, GE J, ZHONG B, LI Y, WEI J, SHU H B, ZHU Q. Duck Tembusu virus nonstructural protein 1 antagonizes IFN-β signaling pathways by targeting VISA[J]. Journal of Immunology, 2016, 197(12): 4704-4713. DOI:10.4049/jimmunol.1502317 |
| [19] |
NINVILAI P, TUNTERAK W, ORAVEERAKUL K, AMONSIN A, THONTIRAVONG A. Genetic characterization of duck Tembusu virus in Thailand, 2015-2017: Identification of a novel cluster[J]. Transboundary and Emerging Diseases, 2019, 66(5): 1982-1992. DOI:10.1111/tbed.13230 |
| [20] |
ANGLERO-RODRIGUEZ Y I, PANTOJA P, SARIOL C A. Dengue virus subverts the interferon induction pathway via NS2B/3 protease-IkB kinase epsilon interaction[J]. Clinical and Vaccine Immunology, 2014, 21(1): 29-38. DOI:10.1128/CVI.00500-13 |
| [21] |
DALRYMPLE N A, CIMICA V, MACKOW E R, BUCHMEIER M J. Dengue virus NS proteins inhibit RIG-Ⅰ/MAVS signaling by blocking TBK1/IRF3 phosphorylation: Dengue virus serotype 1 NS4A is a unique interferon-regulating virulence determinant[J]. mBio, 2015, 6(3): e00553-15. DOI:10.1128/mBio.00553-15 |
| [22] |
GRANT A, PONIA S S, TRIPATHI S, BALASUBRAMANIAM V, MIORIN L, SOURISSEAU M, SCHWARZ M C, SANCHEZ-SECO M P, EVANS M J, BEST S M, GARCIA-SASTRE A. Zika virus targets human STAT2 to inhibit type Ⅰ interferon signaling[J]. Cell Host & Microbe, 2016, 19(6): 882-890. DOI:10.1016/j.chom.2016.05.009 |
| [23] |
BIERING S B, AKEY D L, WONG M P, BROWN W C, LO N, PUERTA-GUARDO H, TRAMONTINI G D S F, WANG C, KONWERSKI J R, ESPINOSA D A, BOCKHAUS N J, GLASNER D R, LI J, BLANC S F, JUAN E Y, ELLEDGE S J, MINA M J, BEATTY P R, SMITH J L, HARRIS E. Structural basis for antibody inhibition of flavivirus NS1-triggered endothelial dysfunction[J]. Science, 2021, 371(6525): 194-200. DOI:10.1126/science.abc0476 |
| [24] |
PUERTA-GUARDO H, GLASNER D R, ESPINOSA D A, BIERING S B, PATANA M, RATNASIRI K, WANG C, BEATTY P R, HARRIS E. Flavivirus NS1 triggers tissue-specific vascular endothelial dysfunction reflecting disease tropism[J]. Cell Reports, 2019, 26(6): 1598-1613. DOI:10.1016/j.celrep.2019.01.036 |
| [25] |
WU Y, LIU Q, ZHOU J, XIE W, CHEN C, WANG Z, YANG H, CUI J. Zika virus evades interferon-mediated antiviral response through the co-operation of multiple nonstructural proteins in vitro[J]. Cell Discovery, 2017, 3: 17006. DOI:10.1038/celldisc.2017.6 |
| [26] |
ZHOU D, JIA F, LI Q, ZHANG L, CHEN Z, ZHAO Z, CUI M, SONG Y, CHEN H, CAO S, YE J. Japanese encephalitis virus NS1 protein antagonizes interferon beta production[J]. Virologica Sinica, 2018, 33(6): 515-523. DOI:10.1007/s12250-018-0067-5 |
| [27] |
ZHOU D, LI Q, JIA F, ZHANG L, WAN S, LI Y, SONG Y, CHEN H, CAO S, YE J. The Japanese encephalitis virus NS1 protein inhibits type Ⅰ IFN production by targeting MAVS[J]. Journal of Immunology, 2020, 204(5): 1287-1298. DOI:10.4049/jimmunol.1900946 |
| [28] |
LI Q, ZHOU D, JIA F, ZHANG L, ASHRAF U, LI Y, DUAN H, SONG Y, CHEN H, CAO S, YE J. Japanese encephalitis virus NS1 protein interacts with host CDK1 protein to regulate antiviral response[J]. Microbiology Spectrum, 2021, 9(3): e166121. DOI:10.1128/Spectrum.01661-21 |
| [29] |
WILSON J R, FLOREZ DE SESSIONS P, LEON M A, SCHOLLE F. West Nile virus nonstructural protein 1 inhibits TLR3 signal transduction[J]. Journal of Virology, 2008, 82(17): 8262-8271. DOI:10.1128/JVI.00226-08 |
| [30] |
ZHANG H L, YE H Q, LIU S Q, DENG C L, LI X D, SHI P Y, ZHANG B. West Nile virus NS1 antagonizes interferon beta production by targeting RIG-Ⅰ and MDA5[J]. Journal of Virology, 2017, 91(18): e02396-16. DOI:10.1128/JVI.02396-16 |
(责任编辑 马春敏)
 2024, Vol. 51
2024, Vol. 51