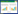文章信息
基金项目
- 河南省科技攻关农业领域项目(202102110035)
作者简介
- 胡根海(1966—),男,博士,副教授,研究方向为植物细胞工程,E-mail:hgh1013@126.com.
文章历史
- 收稿日期:2021-05-09
【研究意义】紫薯〔Ipomoea batatas(L.)Lam〕又称紫心甘薯、黑薯,为1年生旋花科类草本植物,因薯肉常呈紫色或紫黑色而得名。紫薯不仅可以直接食用,而且还可以用于色素提取、饮品开发,具有更广应用价值[1]。越南紫薯与一般的紫薯相比,淀粉和维生素含量更高,口感特别粉糯。和普通国产紫薯相比,越南紫薯果肉皮薄细嫩,薯香浓郁,肉质细腻,但薯块较小。目前紫薯的薯块均较小,平均每667 m2产量在2 000 kg左右[2],如审定品种宁紫薯1号2年平均为1 805.6 kg,远低于普通甘薯3 000 kg以上的产量。因此改良越南紫薯提高产量稳定品质成为当前研究热点。【前人研究进展】生产上常用茎尖培养生产脱毒苗[3]。在薯苗培育过程中要消耗大量的薯块,这直接导致栽培种苗无法满足人们的需求[4-5]。组织培养可以诱导形成胚性愈伤,胚性愈伤进一步发育形成体细胞胚胎,体细胞胚胎发育为植株,在体细胞胚胎分化扩繁过程中可以显著提高繁殖系数。甘薯是种性退化速率较高的作物,无性繁殖几代后薯块品质即下降,体细胞胚是相对稳定的繁殖方式,有利于种苗繁育的遗传稳定。有研究报道甘薯的块根组织培养已获得愈伤组织,但未获得胚性愈伤[6],通过茎尖、叶片培养易获得愈伤组织,同时可获得少量胚性愈伤[7-8]。已有研究认为胚性愈伤组织的诱导率可能与甘薯基因型有关,不同基因型的甘薯诱导率差异极大[9]。目前紫薯多见诱导愈伤的报道[10-11]和茎尖培养直接成苗技术[12-14],而且这些材料是20世纪90年代最初引进的紫肉甘薯品种日本农家种山川紫的后代。【本研究切入点】越南紫薯是紫薯一个新引进种,其组织培养还未见报道,试验拟以越南紫薯为材料,以叶片和茎段作外植体,分析6-BA和NAA在愈伤组织诱导中的作用,2, 4-D和6-BA在愈伤组织转变为胚性愈伤组织、ABA在胚性愈伤形成体细胞胚胎中的作用,探讨在MS培养基中附加植物生长调节物诱导胚性愈伤并分化为体细胞胚的有效方案。【拟解决的关键问题】筛选适合越南小紫薯基因型的外植体诱导愈伤组织、胚性愈伤和体细胞胚的适宜培养基,为越南紫薯的工厂化育苗和遗传改良提供途径。
1 材料与方法 1.1 试验材料供试越南紫薯于2020年3月6日购自超市蔬菜区。
1.2 试验方法1.2.1 紫薯催芽育苗 2020年3月8日培养盒中排列紫薯,用细沙覆盖,浇水保持湿润,置于25~30 ℃培养箱中暗培养,约10 d左右出芽,待芽长到20 cm时备用。
1.2.2 外植体获得 挑选幼嫩正在生长的叶片和茎段,流水冲洗后,在超净工作台上,先用体积分数70% 乙醇消毒30 s,无菌水冲洗1~2次,再用质量分数0.1% HgCl2消毒2~3 min,无菌水冲洗4~6次,无菌滤纸吸干表面水分,无菌剪刀将叶片剪成0.5 cm×0.5 cm的小方块,茎段剪成1 cm,接种到30 mL固体MS培养基上,25(±0.5)℃黑暗培养3周后,转至培养室25(±0.5)℃光照培养,光照条件2 000~3 000 μmol/(m2·s),光照时间16 h/d,诱导获得的愈伤组织。
1.2.3 激素组合 激素组合见表 1,其中A、B、C、D分别代表6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA)、萘乙酸(1-naphthaleneacetic acid,NAA)、2, 4-二氯苯氧乙酸(2, 4-dichlorophenoxyacetic acid, 2, 4-D)和脱落酸(abscisic acid, ABA)的浓度,与编号对应的为浓度,如A1表示6-BA的浓度为0.1 mg/L,B2表示NAA浓度为0.6 mg/L,A1B2表示在培养基中添加的6-BA浓度为0.1 mg/L,NAA浓度为0.6 mg/L。对紫薯叶片、茎段进行愈伤组织诱导时仅使用A、B激素组合,胚性愈伤组织诱导使用A、C激素组合,体细胞胚胎诱导使用A、B、D激素组合。
1.2.4 愈伤组织诱导 愈伤组织诱导的基础培养基为MS培养基,添加蔗糖30 g/L、植物凝胶2.6 g/L及不同浓度的6-BA和NAA,调节pH至5.8,高压蒸汽灭菌锅中121 ℃灭菌15~20 min。将紫薯茎段和叶片外植体,分别接种至诱导培养基,每瓶5个外植体,3次重复。在诱导起始阶段进行7 d的黑暗处理,接着转至光照下培养,培养温度25(±0.5)℃,光照强度为1 200 μmol/(m2·s),光照时间16 h/d,培养30 d后统计并记录愈伤组织产生情况。
1.2.5 胚性愈伤组织诱导 分化培养基为MS基础培养基,添加蔗糖40 g/L、植物凝胶2.6 g/L及不同浓度的6-BA和2, 4-D,调节pH至5.8,高压蒸汽灭菌锅中121 ℃灭菌15~20 min。将1.2.4诱导的愈伤组织接种至分化培养基中,每瓶3块,培养温度25(±0.5)℃,光照强度1 200 μmol/(m2·s),光照时间16 h/d,培养60~80 d后统计并记录胚性愈伤组织诱导率、出胚率。
1.2.6 体细胞胚胎诱导 体胚诱导培养基为MS基础培养基,添加蔗糖30 g/L、植物凝胶2.6 g/L及不同浓度的6-BA、NAA和ABA,调节pH至5.8,高压蒸汽灭菌锅中121 ℃灭菌15~20 min。将1.2.5诱导获得的胚性愈伤放置于体胚诱导培养基上进行出胚诱导,继代2周后可见产生体胚,每个培养基10瓶,每瓶3个愈伤块,培养温度28(±0.5)℃,光照强度1 200 μmol/(m2·s),光照时间16 h/d,出胚后统计并记录出胚率。
1.2.7 体细胞胚植株再生及炼苗移栽 将成熟的体胚转移至MS培养基上,培养发育成正常小植株时,逐渐打开瓶口,7 d后移栽至基质中。

|
试验数据采用SPSS17.0统计分析软件进行显著性分析。
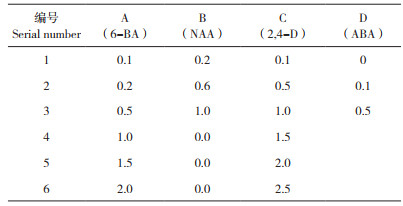
2 结果与分析 2.1 激素对越南紫薯不同外植体愈伤组织诱导的影响试验对越南紫薯嫩叶和茎段同时进行愈伤组织诱导,结果显示暗培养7 d后,外植体的切口处均出现愈伤组织,茎段更为明显,切口处可见黄白色愈伤组织。随后,愈伤组织继续生长,在叶片的四周切口处均出现愈伤组织,茎段外植体两端形成愈伤组织块,逐渐呈哑铃状(图 1A)。A、B两种激素不同浓度组合对叶片和茎段愈伤组织诱导率的影响无显著差异(表 2),两种外植体愈伤诱导率在所有激素浓度组合均达到100%,且愈伤组织颜色、质地和生长状况均良好,说明6-BA和NAA组合有利于紫薯愈伤组织的诱导;但不同浓度和组合愈伤组织生长量存在差异,愈伤组织状态也不同,当NAA浓度相同时,随着6-BA浓度的升高,愈伤组织生长量逐渐增高,最佳6-BA浓度为1.0 mg/L,过高的6-BA浓度也会抑制愈伤组织生长量;NAA浓度较低时诱导的愈伤组织呈黄绿色疏松,高浓度诱导的愈伤组织较致密,NAA浓度为0.2 mg/L、6-BA浓度为1.0 mg/L时,诱导效果优于较高激素浓度。

|
| A:叶片愈伤组织;B:胚性愈伤组织;C:绿色球形胚;D:体细胞胚胎;E:体细胞胚胎生芽;F:胚胎发育成苗 A: Leaf callus; B: Embryogenic callus; C: Green globular embryo; D: Somatic embryo; E: Somatic embryo shoots; F: Embryo develops into a seedling 图 1 不同阶段的紫薯组织培养诱导 Fig. 1 Tissue culture induction of purple sweet potato at different stages |
2.2 激素对越南紫薯胚性愈伤组织诱导的影响
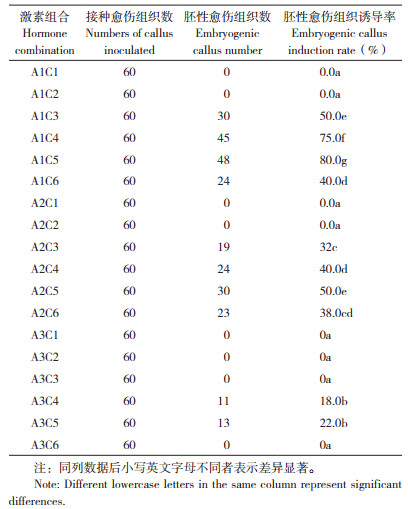
将叶片或茎段诱导的愈伤组织,转接至胚性愈伤组织诱导培养基中,进行胚性愈伤组织诱导。诱导8周左右,结果显示胚性愈伤组织与普通愈伤组织有明显形态差异(图 1B)。不同激素配比胚性愈伤组织形成效果差异明显,由表 3可知,在愈伤组织向胚性愈伤组织转化过程中,2, 4-D起着重要作用,2, 4-D浓度过低过高均不利于胚性愈伤组织的形成,2.0 mg/L为最佳胚性愈伤组织诱导浓度;不同6-BA浓度对胚性愈伤出愈率影响不同,其中0.1 mg/L有利于增加胚性愈伤组织出愈率,较高6-BA浓度不利于胚性愈伤组织的形成,且浓度越高出愈率降低。
|
2.3 激素对越南紫薯体细胞胚诱导的影响
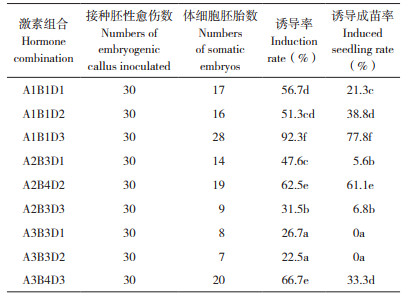
胚性愈伤组织转移至体细胞胚诱导培养基上培养2周后,开始体胚分化,逐渐出现绿色的胚(图 1C),随着时间延长,体细胞胚越来越大,直至发育成成熟胚(图 1D)。培养30 d后统计体细胞胚胎个数,由表 4可知,不同激素组合诱导所得体细胞胚胎有较大的差异,最高为A1B1D3组合(MS+6-BA 0.1 mg/L+NAA 0.2 mg/L+ABA 0.5 mg/L),综合分析3种激素水平体细胞胚胎的获得及其后续进一步成长情况可知,当NAA处于较高水平时,出胚率较低,且随6-BA浓度水平提高也呈现出胚率降低的趋势。
|
2.4 体细胞胚胎诱导成苗及移栽驯化
将不同激素组合培养基诱导获得的体细胞胚转入MS +蔗糖3% 的培养基上,使其进一步发育生长成苗(图 1E、F)。由表 4可知,不同来源体细胞胚胎后续生长表现有差异,由A1B1D3培养基诱导的体细胞胚的成苗率最高为77.8%,其次为A2B4D2、成苗率61.1%,其余培养基诱导的体细胞胚成苗率均较低,部分未能发育成植株,且其体细胞胚发育过程中有白化干枯死亡现象。
3 讨论 3.1 不同外植体对愈伤组织形成的影响不同甘薯品种其愈伤组织形成能力也不同[14-15],而且外植体不同其形成愈伤组织的难易程度也不同[16-18]。本试验发现越南紫薯叶片和茎段在相同激素组合处理下,形成愈伤的能力基本一致,但愈伤生长量略有差异,叶片形成的愈伤量略高,这与周丽艳等[19]的研究结果一致,而且由于叶片易采集数量多,形成愈伤组织量较高,因此适宜作细胞工程初始培养的外植体。紫薯外植体愈伤组织形成的决定因素是激素组合,如6-BA的使用量直接影响愈伤生长量,较低和过高的6-BA浓度均导致愈伤生长量偏低,较低的NAA浓度有利于增加愈伤组织生长量。越南紫薯诱导愈伤组织的最佳培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA。
3.2 愈伤组织诱导产生胚性愈伤组织甘薯诱导愈伤组织可以分为非胚性愈伤组织和胚性愈伤组织2类,一般直接由外植体诱导产生的愈伤组织为非胚性愈伤组织,这种愈伤呈水乳状,乳白色,结构疏松,且生长旺盛,但不能直接产生体细胞胚胎,从而再生成植株[19-20]。紫薯工厂化种苗生产需要大量体细胞胚胎,这需要通过改变培养条件将非胚性愈伤组织转变为胚性愈伤组织,从而形成大量体细胞胚胎,培育所需的再生苗。已有研究认为胚性愈伤组织的形成与激素和品种有关[10],对单一品种而言,主要是激素影响胚性愈伤组织的形成。本试验发现越南紫薯胚性愈伤组织的形成起主要作用的是2, 4D,较低或过高的2, 4-D直接影响胚性愈伤组织的形成和数量,这与杨强强等[21]、崔红等[22]的结论一致,6-BA对胚性愈伤组形成有辅助作用,适宜的6-BA浓度可以使胚性愈伤组织量达到最大。
3.3 胚性愈伤组织诱导产生体细胞胚胎胚性愈伤组织进一步发展的方向与培养基的成分和激素有关,只有适宜的培养基和激素浓度才能获得较多的体细胞胚胎。ABA对胚性愈伤组织诱导发育为体细胞胚胎起着重要的作用[23-24],对刺槐的研究发现诱导产生胚性愈伤组织后继续在高浓度激素下继代,胚性愈伤组织会持续脱分化,不能产生体细胞胚胎[25]。本试验将胚性愈伤组织转移至体细胞胚诱导培养基上,不同继代培养基表现出不同诱导效果,在低6-BA和NAA浓度下,胚胎率诱导与ABA有关,在0.5 mg/L浓度体细胞胚胎有较高发生率;较高的6-BA和NAA浓度都会导致体细胞胚胎发生率降低,而高NAA浓度体细胞胚胎发生率为零。说明在较低浓度6-BA和NAA下,培养基再附加一定浓度的ABA有利于紫薯体细胞胚胎发生,本试验的最佳组合为MS+6-BA 0.1 mg/L+NAA 0.2 mg/L+ABA 0.5 mg/L。
4 结论本研究结果表明,越南紫薯叶片和茎两种外植体接种在普通愈伤组织诱导培养基上,黑暗处理1周后转至光照下继续培养,叶片具有略高的愈伤组织形成能力,其诱导培养基为MS+6-BA 1.0 mg/L + NAA 0.2 mg/L;愈伤组织必须转化为胚性愈伤组织才能进一步发育形成体细胞胚胎,由愈伤组织到胚性愈伤组织转化需要高浓度的2, 4-D诱导和低浓度6-BA辅助,其最佳培养基为MS+6-BA 0.1 mg/L +2, 4-D 2.0 mg/L。胚性愈伤出现后,需要撤掉2, 4-D,改用MS+6-BA 0.1 mg/L+NAA 0.2 mg/L+ABA 0.5 mg/L才能诱导形成体细胞胚胎。在胚性愈伤进一步发育为体细胞胚胎过程中,低6-BA和NAA浓度下诱导胚胎率与ABA有关,体细胞胚胎可在MS +蔗糖3% 培养基上生长成苗。
| [1] |
邹波, 吴继军, 徐玉娟, 唐道邦, 房伯平, 余元善, 肖更生. 不同紫肉甘薯品种饮料加工特性评价[J]. 广东农业科学, 2017, 44(4): 118-124. DOI:10.16768/j.issn.1004-874X.2017.04.018 ZOU B, WU J J, XU Y J, TANG D B, FANG B P, YU Y S, XIAO G S. Evaluation of processing characteristics of beverageby different purplefleshed sweetpotato(Ipomoea batatas L.)varieties[J]. Guangdong Agricultural Sciences, 2017, 44(4): 118-124. DOI:10.16768/j.issn.1004-874X.2017.04.018 |
| [2] |
颜晓晖. 紫甘薯新品种比较试验结果分析[J]. 湖北农业科学, 2020, 59(13): 19-21. DOI:10.14088/j.cnki.issn0439-8114.2020.13.004 YAN X H. Comparative test of new purple sweet potato varieties[J]. Hubei Agricultural Sciences, 2020, 59(13): 19-21. DOI:10.14088/j.cnki.issn0439-8114.2020.13.004 |
| [3] |
林丛发, 潘祥华, 翁琳琳, 卓敏, 钟爱清. 宁薯10号茎尖离体培养及种薯生产[J]. 广东农业科学, 2013, 40(10): 14-16. DOI:10.16768/j.issn.1004-874X.2013.10.005 LIN C F, PAN X H, WENG L L, ZHUO M, ZHONG A Q. In vitro micropropagatiing of apical meristem and seed breeding to the 10th Ningde-sweet potato[J]. Guangdong Agricultural Sciences, 2013, 40(10): 14-16. DOI:10.16768/j.issn.1004-874X.2013.10.005 |
| [4] |
张雄坚, 房伯平, 陈景益, 安康. 甘薯脱毒苗不同繁殖方式生产比较试验[J]. 广东农业科学, 2004(2): 11-13. DOI:10.16768/j.issn.1004874X.2004.02.006 ZHANG X J, FANG B P, CHEN J Y, AN K. Comparison of sweet-potato virus-free by using different reproductive modes[J]. Guangdong Agricultural Sciences, 2004(2): 11-13. DOI:10.16768/j.issn.1004874X.2004.02.006 |
| [5] |
曲艺姣, 周清, 孙佳, 徐娜, 姜长阳. 美国紫薯试管苗微型繁殖的研究[J]. 黑龙江农业科学, 2013(7): 10-12. DOI:10.3969/j.issn.1002-2767.2013.07.004 QU Y J, ZHOU Q, SUN J, XU N, JIANG C Y. Study on micro propagation of tube seedlings of the Ipomoea batatas L[J]. Heilongjiang Agricultural Sciences, 2013(7): 10-12. DOI:10.3969/j.issn.1002-2767.2013.07.004 |
| [6] |
吕芝香, 王曼丝, 董建国. 不同碳源对甘薯(Ipomoea batatas L.Lam.)块根愈伤组织的形成和生长的影响[J]. 植物生理学报, 1981, 17(2): 105-111. LYU Z X, WANG M S, DONG J G. The influence of carbon sources on formation and growth of root-tuber callus of sweet potato(Ipomoea batatas L. LAM)[J]. Journal of Plant Physiology, 1981, 17(2): 105-111. |
| [7] |
邱鹏飞, 侯夫云, 王庆美, 张立明, 田霄. 不同激素对甘薯胚性细胞悬浮系植株再生的影响[J]. 山东农业科学, 2009, 41(6): 15. DOI:10.3969/j.issn.1001-4942.2009.06.005 QIU P F, HOU F Y, WANG Q M, ZHANG L M, TIAN X. Effect of different hormones on Plant Regeneration from embryogenic cell suspension system of sweet p otato[J]. Shandong Agricultural Sciences, 2009, 41(6): 15. DOI:10.3969/j.issn.1001-4942.2009.06.005 |
| [8] |
张玲, 许宏宣, 秦白富, 廖志华, 陈敏, 杨春贤, 傅玉凡, 张启堂. 甘薯不同外植体体细胞胚的发生及植株再生[J]. 安徽农业科学, 2012, 40(19): 10011-10014. DOI:10.3969/j.issn.0517-6611.2012.19.015 ZHANG L, XU H X, QIN B F, LIAO Z H, CHEN M, YANG C X, FU Y F, ZHANG Q T. Plant regeneration of Ipomoea batatas via somatic embryogenesis from different explants[J]. Journal of Anhui Agricultural Sciences, 2012, 40(19): 10011-10014. DOI:10.3969/j.issn.0517-6611.2012.19.015 |
| [9] |
马佩勇, 贾赵东, 谢一芝, 郭小丁. 不同甘薯材料胚性愈伤组织的诱导与再生[J]. 江苏农业科学, 2012, 40(2): 28-29. DOI:10.3969/j.issn.1002-1302.2012.02.010 MA P Y, JIA Z D, XIE Y Z, GUO X D. Induction and regeneration of embryogenic callus from different sweet potato materials[J]. Jiangsu Agricultural Sciences, 2012, 40(2): 28-29. DOI:10.3969/j.issn.1002-1302.2012.02.010 |
| [10] |
刘明明, 杨继红, 刘蓁, 胡久梅. 紫薯组织培养初探[J]. 安徽农学通报, 2009, 15(17): 30-31. DOI:10.3969/j.issn.1007-7731.2009.17.018 LIU M M, YANG J H, LIU Q, HU J M. Preliminary study on tissue culture for Solanum tuberosum L.cv[J]. Anhui Agricultural Science Bulletin, 2009, 15(17): 30-31. DOI:10.3969/j.issn.1007-7731.2009.17.018 |
| [11] |
张清兰, 上官新晨, 尹忠平, 蒋艳, 吴少福, 陈继光, 裴阿淼. 紫薯愈伤组织诱导和培养条件优化及绿原酸类化合物的积累[J]. 食品工业科技, 2015, 36(24): 169-174. DOI:10.13386/j.issn1002-0306.2015.24.028 ZHANG Q L, SHANGGUAN X C, YIN Z P, JIANG Y, WU S F, CHEN J G, PEI A M. Induction of Ipomoea batatas L. callus and optimization of culture conditions and accumulation of chlorogenic acid compounds[J]. Science and Technology of Food Industry, 2015, 36(24): 169-174. DOI:10.13386/j.issn1002-0306.2015.24.028 |
| [12] |
张军云, 张钟, 张建康, 陈桂芬. 紫甘薯组织培养快繁技术研究[J]. 中国农学通报, 2014, 30(4): 96-100. DOI:10.3969/j.issn.1000-6850.2014.04.030 ZHANG J Y, ZHANG Z, ZHANG J K, CHEN G F. Study on technology of rapid propagation in tissue culture of purple sweet potato[J]. Chinese Agricultural Science Bulletin, 2014, 30(4): 96-100. DOI:10.3969/j.issn.1000-6850.2014.04.030 |
| [13] |
孙言博, 祝志欣, 黄婷, 李思明, 朱国鹏. 海南甘薯主栽品种再生体系的优化[J]. 热带作物学报, 2020, 41(2): 244-251. DOI:10.3969/j.issn.1000-2561.2020.02.006 SUN Y B, ZHU Z X, HUANG T, LI S M, ZHU G P. Optimization of regeneration system of main sweet patato cultivars in Hainan, China[J]. Chinese Journal of Tropical Crops, 2020, 41(2): 244-251. DOI:10.3969/j.issn.1000-2561.2020.02.006 |
| [14] |
周志林, 唐君, 张允刚, 赵冬兰. 不同基因型甘薯愈伤组织诱导及植株再生[J]. 西北农业学报, 2010, 19(9): 203-206. DOI:10.3969/j.issn.1004-1389.2010.09.040 ZHOU Z L, TANG J, ZHANG Y G, ZHAO D L. Induction of the callus and plantlet regeneration of sweetpotato with different genotypes[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2010, 19(9): 203-206. DOI:10.3969/j.issn.1004-1389.2010.09.040 |
| [15] |
周丽艳, 高书国, 毕艳娟, 秦素平, 杨文利. 甘薯愈伤组织诱导及植株再生的研究[J]. 中国农学通报, 2003, 19(3): 61-64, 68. DOI:10.3969/j.issn.1000-6850.2003.03.019 ZHOU L Y, GAO S G, BI Y J, QIN S P, YANG W L. Study on callus induction and plant regeneration of sweet potato[J]. Chinese agricultural science bulletin, 2003, 19(3): 61-64, 68. DOI:10.3969/j.issn.1000-6850.2003.03.019 |
| [16] |
刘良勇, 周伟, 张兴春, 郭威, 高峰. 紫色甘薯液体培养体系的建立[J]. 河南农业科学, 2008, 37(5): 30-33. DOI:10.3969/j.issn.1004-3268.2008.05.008 LIU L Y, ZHOU W, ZHANG X C, GUO W, GAO F. Establishment of Liquid Culture System for Purple Sweet Potato[J]. Journal of Henan Agricultural Sciences, 2008, 37(5): 30-33. DOI:10.3969/j.issn.1004-3268.2008.05.008 |
| [17] |
张伟龙, 张超, 杨静慧, 刘艳军, 李瑞祥, 刘杉, 王芝学. 不同外植体与激素对北美海棠松散型愈伤组织诱导的影响[J]. 天津农学院学报, 2020, 27(2): 31-34. DOI:10.19640/j.cnki.jtau.2020.02.007.jtau.2020.02.007 ZHANG W L, ZHANG C, YANG J H, LIU Y J, LI R X, LIU B, WANG Z X. Effects of different explants and hormones on the induction of loose callus of North American begonia[J]. Journal of Tianjin Agricultural University, 2020, 27(2): 31-34. DOI:10.19640/j.cnki.jtau.2020.02.007.jtau.2020.02.007 |
| [18] |
吴丽芳, 魏晓梅, 陆伟东. 白刺花胚性愈伤组织诱导和植株再生体系建立[J]. 植物生理学报, 2019, 55(2): 218-224. DOI:10.13592/j.cnki.ppj.2018.041.ppj.2018.041 WU L F, WEI X M, LU W D. Embryogenic callus induction and establishment of plant regeneration system of Sophora davidii[J]. Plant Physiology Journal, 2019, 55(2): 218-224. DOI:10.13592/j.cnki.ppj.2018.041.ppj.2018.041 |
| [19] |
周丽艳, 高书国, 杨文利, 王翠花. 甘薯愈伤组织的诱导[J]. 河北职业技术师范学院学报, 2002, 16(4): 26-29, 36. DOI:10.3969/j.issn.1672-7983.2002.04.006 ZHOU L Y, GAO S G, YANG W L, WANG C H. Callus induction of sweet potato[J]. Journal of Hebei Vocation-technical Teachers College, 2002, 16(4): 26-29, 36. DOI:10.3969/j.issn.1672-7983.2002.04.006 |
| [20] |
崔红, 王伟亮, 沈明山, 陈睦传. 甘薯不同类型愈伤组织的比较[J]. 厦门大学学报(自然科学版), 2000, 39(1): 116-121. DOI:10.3321/j.issn:0438-0479.2000.01.022 CUI H, WANG W L, SHEN M S, CHEN M C. Comparative study on different type callus in sweet potato[J]. Journal of Xiamen University(Natural Science), 2000, 39(1): 116-121. DOI:10.3321/j.issn:0438-0479.2000.01.022 |
| [21] |
杨强强, 闫会, 谢昊, 后猛, 唐维, 李强, 张允刚, 王欣, 刘亚菊. 徐紫薯8号胚性愈伤组织的诱导与体细胞胚发生[J]. 江苏师范大学学报(自然科学版), 2019, 37(1): 25-29. DOI:10.3969/j.issn.2095-4298.2019.01.006 YANG Q Q, YAN H, XIE H, HOU M, TANG W, LI Q, ZHANG Y G, WANG X, LIU Y J. Embryogenic callus induction and somatic embryogenesis of sweetpotato cultivar Xuzishu No.8[J]. Journal of Jiangsu Normal University(Natural Science Edition), 2019, 37(1): 25-29. DOI:10.3969/j.issn.2095-4298.2019.01.006 |
| [22] |
崔红, 丁群星, 桂耀林, 郭仲琛. 2, 4-D对甘薯体细胞胚胎发生的调控[J]. 植物学通报, 1999, 16(4): 411-415. DOI:10.3969/j.issn.1674-3466.1999.04.014 CUI H, DING Q X, GUI Y L, GUO Z C. 2, 4-D regulated somatic embryogenesis of sweet potato[J]. Chinese Bulletin of Botany, 1999, 16(4): 411-415. DOI:10.3969/j.issn.1674-3466.1999.04.014 |
| [23] |
GAO S, YU B, YUAN L, ZHAI H, HE S Z, LIU Q C. Production of transgenic sweetpotato plants resistant to stem nematodes using oryzacystatin-I gene[J]. Scientia Horticulturae, 2011, 128(4): 408-414. DOI:10.1016/j.scienta.2011.02.015 |
| [24] |
闫会, 王欣, 李强, 张允刚, 马代夫. ABA对甘薯体细胞胚分化及再生的影响[J]. 江苏农业科学, 2012, 40(8): 58-59. DOI:10.3969/j.issn.1002-1302.2012.08.022 YAN H, WANG X, LI Q, ZHANG Y G, MA D F. Effects of ABA on somatic embryo differentiation and regeneration of sweet potato[J]. Jiangsu Agricultural Sciences, 2012, 40(8): 58-59. DOI:10.3969/j.issn.1002-1302.2012.08.022 |
| [25] |
习洋, 胡瑞阳, 王欢, 孙鹏, 袁存权, 李允菲, 戴丽, 李云. 刺槐未成熟合子胚的体细胞胚胎发生和植株再生[J]. 林业科学, 2012, 48(1): 60-69. DOI:10.11707/j.1001-7488.20120111 XI Y, HU R Y, WANG H, SUN P, YUAN C Q, LI Y F, DAI LI, LI Y. Somatic embryogenesis and plant regeneration from immature zygotic embryos of black locust(Robinia pseudoacacia)[J]. Scientia Silvae Sinicae, 2012, 48(1): 60-69. DOI:10.11707/j.1001-7488.20120111 |
(责任编辑 邹移光)
 2021, Vol. 48
2021, Vol. 48