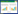文章信息
基金项目
- 广东省现代农业产业技术体系创新团队项目(2021KJ112)
作者简介
- 沈会芳(1973—),女,硕士,研究员,研究方向为植物病害及其防治,E-mail:951781658@qq.com.
通讯作者
- 林壁润(1963—),男,博士,研究员,研究方向为植物病害及其防治,E-mail:linbr@126.com.
文章历史
- 收稿日期:2021-09-10
【研究意义】剑兰(Gladiolus hybridus)又名唐菖蒲,鸢尾科多年生草本植物,其花形别致、花色丰富、观赏价值高,是世界著名的四大切花之一,在我国主要分布在广东、四川、福建、吉林、辽宁、云南、上海、甘肃、江苏和河北等省份。广东省台山市海晏镇永和村自1983年开始引进剑兰,种植总面积86.7 hm2,一季收益约2万元/667m2,远高于种植水稻的效益,是当地的支柱产业。但在台山剑兰栽培过程中,叶斑病严重影响剑兰的产量和质量,因此明确台山剑兰叶斑病菌及其生物学特性,对制定病害防治策略和筛选防治药剂具有重要意义。【前人研究进展】剑兰病害主要有根茎病害和叶斑类病害。球茎腐烂、干腐、褐腐等根茎病害为害严重,表现为根茎部腐烂、易折断,其病原种类较多,有尖孢镰刀菌(Fusarium oxyspoyum)、唐菖蒲青霉(Penicillium gladioli)、灰葡萄孢(Botrytis cinerea)、细链格孢(Alternaria tenuis)、粉红聚端孢(Trichothecium roseum)和拟青霉(Paecilomyces sp.)等,表现为多种病菌复合侵染[1-3]。唐菖蒲尖镰孢(F. xyspoyum f. sp. gladioli)主要为害球茎,也可侵染叶片和花,引起干腐病[4-6]。唐菖蒲褐腐病由球腐葡萄孢菌(B. gladiolorum)侵染所致,可为害叶片、茎秆、花瓣和球茎[7-8]。剑兰叶斑病一般局部为害、经济损失较小,研究相对较少,且集中在病原菌鉴定方面。现报道有荧光假单孢(Pseudomonas fluoresoens)引起的疮痂病、野油菜黄单孢菌(Xanthomonas campestris Pv. gummisadans)引起的疫病和菊欧文氏杆菌(Erwinia chrysanthemi)引起的细菌性叶斑病[9]。真菌病害仅报道有葡萄壳小圆孢菌(Coniothyrium vitivorum)引起的叶斑病[10]。导致生产上一些为害较重的叶斑病菌不明确,给病害防治带来较大难度。【本研究切入点】2020年8—12月在台山市海晏镇永和村调研时,发现该村66.7 hm2剑兰叶斑病发生严重,病株率高达40%~50%,严重达90%,部分田块植株稀疏,损失率高达30%以上。当地技术人员认为是炭疽病,但使用防治炭疽病化学药剂后,效果很不理想。【拟解决的关键问题】为有效防治该病害,本研究对其病原菌进行分离鉴定,研究其生物学特性,测定其对杀菌剂的敏感性,旨在为该剑兰叶斑病的防治提供指导。
1 材料与方法 1.1 试验材料病害样本:剑兰叶斑病样本采自广东省台山市海晏镇永和村。培养基:马铃薯葡萄糖琼脂(PDA)和查氏琼脂(Czapek)培养基,配方参照方中达《植病研究方法》[11]。杀菌剂:15%咪鲜胺(Prochloraz)微乳剂,海南博士威农用化学有限公司;80% 代森锰锌(Mancozeb)可湿性粉剂,印度联合磷化物有限公司;75% 百菌清(Chlorothalonil)可湿性粉剂、10% 苯醚甲环唑(Difenoconazole)水分散粒剂、250 g/L嘧菌酯(Azoxystrobin)悬浮剂,先正达(南通)作物保护有限公司;430 g/L戊唑醇(Tebuconazole)悬浮剂,拜耳股份公司;80% 多菌灵(Carbendazim)可湿性粉剂,陕西先农生物科技有限公司。
1.2 试验方法1.2.1 病害样品采集及病原菌分离 2020年8—12月在台山市永和村调查剑兰叶斑病的发生为害情况,记录其田间病状,采集病叶样本,在叶片病斑病健交界处剪取小块组织样本(2 mm×2 mm),参照方中达[11]的常规组织分离方法,经表面消毒后接到PDA平板,26 ℃黑暗培养5 d,将分离得到的真菌进行单孢分离,接种到PDA平板上培养成熟后,4℃保存备用。
1.2.2 致病性测定 选取剑兰中上部叶片,用75% 乙醇将叶片擦拭一遍后晾干。4株纯化菌株在26 ℃培养8 d后,切取菌丝块,将菌丝面贴在健康剑兰叶片上,以无菌琼脂块贴在叶片上作对照,每个处理3次重复,每个重复10片叶,在26 ℃、90% 相对湿度条件下培养,每隔24 h观察叶片发病情况,待出现明显病害症状后进行病原菌分离、纯化。
1.2.3 病原菌形态观察 将致病菌株接种到PDA平板上,26 ℃黑暗培养,每隔24 h观察记录菌落形态和颜色变化,培养8 d后制片,在光学显微镜下观察菌丝以及孢子、分生孢子梗的颜色、形态,测量孢子、分生孢子梗大小(n=50)。
1.2.4 病原菌rDNA-ITS序列分析 采用CTAB法提取代表菌株Cg TS的基因组DNA,用真菌rDNA-ITS通用引物ITS4/ITS5(ITS4:5 ’-TCCTCCGCTTATTGATATGC-3’;ITS5:5’-GGAAGTAAAAGTCGTAACAAGG-3’)对病原菌ITS区进行PCR扩增以及Sanger测序。将测序的rDNA-ITS序列在NCBI网站上作BLAST比对,提取GenBank中相同种、属的rDNA-ITS序列,使用DNAMAN和Mega 7.0软件进行序列比对和进化树分析。
1.2.5 温度对叶斑病菌菌丝生长和产孢的影响 将PDA倒入直径9 cm培养皿中,制成平板。在PDA上培养8 d的代表菌株Cg TS菌落外围切取直径8 mm菌丝块,接入平板中央,设置10、15、20、22、24、26、28、30、32、35 ℃ 10个温度处理。每个处理3次重复,每个重复5个培养皿。黑暗培养8 d后,十字交叉法测量菌落直径后,每皿加10 mL清水,用涂布棒刮掉菌落孢子,混匀后,采用血球计数板镜检孢子量。
1.2.6 pH对叶斑病菌菌丝生长和产孢的影响 用NaOH和HCl溶液在无菌条件将PDA培养基的pH调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0后,制成平板,接入菌株Cg TS菌丝块,每个处理3次重复,每个重复5个培养皿。26 ℃黑暗培养8 d后,按1.2.5方法测量菌落直径和产孢量。
1.2.7 光照对叶斑病菌菌丝生长和产孢的影响 制备PDA平板,接入菌株Cg TS菌丝块,设置全光照、全黑暗及12 h光暗交替3个处理。每个处理3次重复,每个重复5个培养皿。26 ℃培养8d后,按1.2.5方法测量菌落直径和产孢量。
1.2.8 碳源对叶斑病菌菌丝生长和产孢的影响 以Czapek为基础培养基,将蔗糖分别用葡萄糖、蔗糖、木糖、可溶性淀粉、麦芽糖、山梨醇、甘露醇和甘油替代,配制培养基,以无碳源为对照,灭菌制成平板,接入菌株Cg TS菌丝块。每个处理3次重复,每个重复5个培养皿。26 ℃黑暗培养10 d后,按1.2.5方法测量菌落直径和产孢量。
1.2.9 氮源对叶斑病菌菌丝生长和产孢的影响 以Czapek为基础培养基,将硝酸钠分别硫酸铵、尿素、硝酸钠、天门冬酰胺、牛肉浸膏、蛋白胨、酪氨酸替代,配制培养基,以无氮源为对照,灭菌制成平板,接入菌株Cg TS菌丝块。每个处理3次重复,每个重复5个培养皿。26 ℃黑暗培养10 d后,按1.2.5方法测量菌落直径和产孢量。
1.2.10 杀菌剂对叶斑病菌菌丝生长和产孢的影响 将供试杀菌剂用无菌水梯度稀释,取1 mL药液加入99 mL PDA培养基(45 ℃)中,混合均匀,使杀菌剂浓度为实验所需系列浓度,平均倒入5个平皿,制成含药平板,接入菌株Cg TS菌丝块,以加无菌水为对照。3次重复,26 ℃培养8 d后,用十字交叉法测量菌落直径,计算药剂抑制率和线性回归方程及相关参数。
用Excel 2007对试验数据进行整理和绘图,数据统计用DPS软件,采用邓肯氏新复极差多重比较法(DMRT)进行差异显著性分析。
2 结果与分析 2.1 病原菌鉴定2.1.1 病害田间症状 初始发病时,剑兰叶片上出现白色针状小点,后变为红褐色或红棕色小点。环境适宜时,病斑扩大,呈梭形、纺锤形或不规则形病斑,病健交界处有明显红棕或红褐色线纹,外围有黄色晕圈,内部浅红棕或浅红褐色(图 1A)。湿度较大时,病斑可见黑色霉层。老叶和嫩叶均可发病,多个病斑可连合成长条斑(图 1B),后期叶片上密布病斑,造成叶片部分或整片枯死。病害发生严重时整块田剑兰植株发病,在图 1C中,与右边发病轻的田块相比,左边发病重田块剑兰植株稀疏,损失较大。

|
| A、B、C:田间自然发病症状;D:人工接种症状 A, B, C: Natural symptoms in the field; D: Inoculation symptoms 图 1 剑兰叶斑病田间及接种症状 Fig. 1 Field and inoculation symptoms of leaf spot on gladiolus |
2.1.2 病原菌分离及致病性测定 对病害样本进行组织分离,得到4个菌株,单孢分离纯化,接入PDA,26 ℃培养8 d,切取菌丝块无伤接种在剑兰叶片上,测定各菌株对剑兰的致病性,接种3~5 d后,叶片均出现病斑(图 1D),与田间症状相似,接种发病率达100%,无菌琼脂块接种叶片不发病。从接种后病斑再分离获得的菌株与接种菌株形态一致,符合柯赫氏法则,表明4个菌株均是剑兰叶斑病的致病菌。
2.1.3 病原菌形态特征 4株菌株在PDA上菌落致密,气生菌丝茂盛,绒状,菌落墨黑色(图 2A),背面黑色。分生孢子梗褐色,多单生,具隔膜,顶端屈膝状,顶部产孢区颜色逐渐变淡,大小为51.0~80.0 µm×4.0~7.6 µm,顶生或侧生分生孢子(图 2B、C)。分生孢子褐色、弓形、光滑、中间宽两端窄,常向一侧弯曲,多为4个细胞,3个隔膜,中间2个细胞颜色较深,两端2个细胞色淡,大小为23.5~32.0 µm×11.5~16.0 µm(图 2D)。4个菌株形态特征一致,根据菌株培养性状、分孢梗和分生孢子的形态和大小,参照陆家云《植物病原真菌学》[12],将4个菌株初步鉴定为弯孢属(Curvularia Boedin)真菌。

|
| A:PDA培养基上菌落正面形态;B、C:分生孢子梗;D:分生孢子 A: Frontal view of the colony on PDA medium; B, C: Conidiophores; D: Conidia 图 2 剑兰叶斑病菌在PDA培养基上的菌落、分孢梗和分生孢子形态 Fig. 2 Colony, conidiophore and conidial morphology of the pathogen of leaf spot on gladiolus on PDA medium |
2.1.4 病原菌rDNA-ITS的序列分析及同源性 用真菌rDNA- ITS通用引物扩增出代表菌株Cg TS的rDNA-ITS序列,长度为610 bp,提交至GenBank,获得登录号MW426196.1。利用rDNA-ITS序列在NCBI数据库进行同源性比对,结果显示菌株Cg TS的rDNA-ITS序列与唐菖蒲弯孢霉C. gladioli序列(LT631345.1)的同源性为99.49%。进一步进行系统进化分析(图 3),Cg TS与唐菖蒲弯孢霉(C. gladioli)聚类到一起,形成明显分支,而车轴草弯孢霉(C. trifolii)则聚类到另一分支,表明病原菌与车轴草弯孢霉亲缘关系相对较远。综合菌株培养性状、形态特征和ITS序列比对结果,将剑兰叶斑病菌鉴定为唐菖蒲弯孢霉(C. gladioli Boerema & Hamers)。
|
| 图 3 基于菌株Cg TS的rDNA-ITS序列构建的系统发育树 Fig. 3 Phylogenetic tree based on rDNA-ITS sequences of Gg TS strain |
2.2 病原菌生物学特性及对杀菌剂敏感性测定
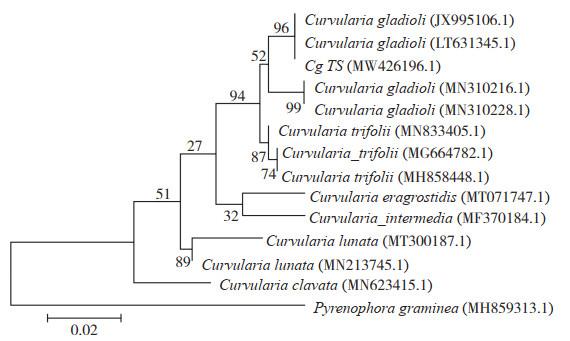
2.2.1 温度对病原菌菌丝生长和产孢量的影响 病原菌在10~35 ℃范围内均可生长,但在10 ℃和35 ℃时生长量极少。最适菌丝生长温度为26~30 ℃,28 ℃时菌落直径最大。在供试温度范围内,病原菌产孢量变化与菌丝生长趋势基本一致,但在26 ℃时产孢量最大,达3.054×106个/ 皿(图 4)。
|
| 图 4 温度对剑兰叶斑病菌菌丝生长和产孢的影响 Fig. 4 Effect of temperature on mycelia growth and spore production of Curvularia gladioli from gladiolus |
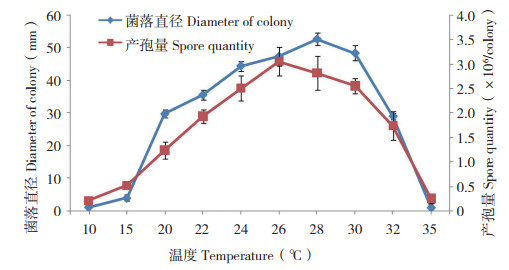
2.2.2 pH对病菌原菌丝生长和产孢量的影响 pH为3~10范围内病菌均能生长和产孢,在5~7偏酸范围内菌丝生长和产孢量较好,当pH趋于碱性时,菌丝生长量及产孢量迅速降低。在pH值为7时,菌落直径和产孢量最大,分别为65.20mm和2.736×106个/ 皿(图 5)。表明偏酸至中性环境适于病菌生长和产孢。
|
| 图 5 pH对剑兰叶斑病菌菌丝生长和产孢的影响 Fig. 5 Effect of pH on mycelia growth and spore production of Curvularia gladioli from gladiolus |
2.2.3 光照对病原菌菌丝生长和产孢量的影响 全光照处理时,病菌气生菌丝旺盛,菌落直径为58.5 mm,显箸大于12 h光暗交替和全黑暗处理。但全黑暗条件下的产孢量为2.58×106个/ 皿,显著高于12 h光暗交替和全光照处理的产孢量。可见光照利于该病菌菌丝生长,而黑暗刺激病菌产孢。
2.2.4 碳源对病原菌原菌丝生长和产孢量的影响 病菌在无碳培养基上可生长,但菌落极稀薄,不产孢。以可溶性淀粉为碳源时,菌丝生长速度最快,菌落直径达到52.00 mm,菌落浓密,其次为木糖、葡萄糖和麦芽糖。山梨醇利于病菌产孢,产孢量为0.77×106个/ 皿,其次是葡萄糖和木糖(表 1)。可见,木糖和葡萄糖利于病菌生长和孢子产生,可溶性淀粉利于菌丝生长,山梨醇利于产孢。
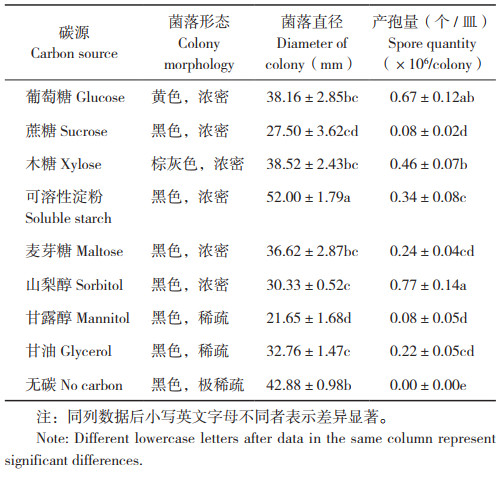
|
2.2.5 氮源对病原菌菌丝生长和产孢量的影响 在无氮培养基上,病菌可生长,菌落极稀薄,不产孢。有机氮源牛肉膏利于菌丝生长,菌落直径达64.25 mm,菌落致密浓厚,其次是蛋白胨、天门冬酰胺和硫酸铵。牛肉膏作为氮源时,病原菌产孢量最大、为2.37×106个/ 皿,其次为酪氨酸,而以硫酸铵和尿素为氮源时不产孢(表 2)。可见,有机氮源牛肉膏利于病菌菌丝生长和产孢。
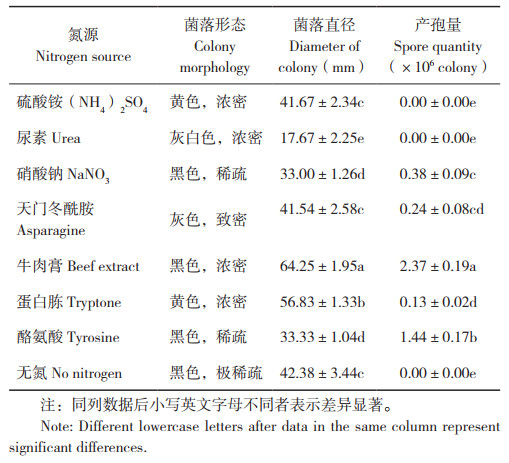
|
2.2.6 不同杀菌剂对病原菌菌丝生长的毒力测定 抑菌中浓度EC50是衡量杀菌剂毒力的可靠标准,数值越小表明杀菌剂抑菌效果越好。由表 3可知,7种杀菌剂对病菌菌丝生长均有抑制作用,其中咪鲜胺和代森锰锌的抑菌作用最强、EC50分别为1.23和2.81 µg/mL,戊唑醇的抑菌作用次之、EC50为6.63 µg/mL。传统的广谱杀菌剂百菌清和多菌灵对病菌的抑制效果相对较差,尤其是多菌灵,EC50高达1 518.00 µg/mL,表明其对剑兰叶斑病菌菌丝生长的抑制效果极差。

|
3 讨论
2020年在广东台山永和村发现剑兰叶斑病发生严重,分离病原菌后鉴定为唐菖蒲弯孢霉(C.gladioli Boerema & Hamers)。弯孢属真菌可寄生多种植物,如玉米、大麦、燕麦、水稻、黑麦、高粱、甘蔗、小麦、三叶草、唐菖蒲、草坪草等,引起叶斑、种子变色和苗枯等症状。文献记载,美国1947年曾有剑兰弯孢霉叶斑病发生的报道,先在佛罗里达州发现此病,严重威胁当地的剑兰切花生产,毁掉数百英苗剑兰,随后又在亚拉巴马州发现此病。波兰[13]、印度[14]及巴西[15-16][17]也相继报道了该病的发生,给当地剑兰产业造成严重损失。基于分生孢子大小和侵染寄主的方式,该病菌在1956年被命名为车轴草弯孢唐菖蒲变种(C. trifolii f. sp. gladioli)[18],1989年根据分生孢子第3个细胞的明显弯曲及孢子长宽比较小,将病菌与车轴草弯孢霉(C. trifolii)区分开来,修订为唐菖蒲弯孢霉(C. gladioli)[19]。据报道,在弯孢属中,新月弯孢霉(C. lunata)、苍白弯孢霉(C. pallescens)和唐菖蒲弯孢霉(C. gladioli)均可侵染引起剑兰叶斑病[20-21]。在我国,深圳动植物检疫所剑兰花枯萎叶斑病调查组(1986)报道,深圳平湖区发生剑兰花枯萎病,鉴定病原菌为新月弯孢霉(C. lunata)[22]。张猛等[23]报道了弯孢属3个中国新记录种,其中车轴草弯孢唐菖蒲变种分离自唐菖蒲植株,记录了菌株的培养和形态特征,但在田间病害症状、病菌致病性等方面均无相关描述。本研究首次在国内明确鉴定广东台山永和村剑兰叶斑病病原菌为唐菖蒲弯孢霉(C. gladioli Boerema & Hamers)。
该病在台山永和村发生严重,大部分田块发病率达40%~50%,严重田块发病率达90%,病害损失率大于30%,成为制约剑兰产业的重要因素。致病力测定显示该病菌致病力较强,无需伤口,可直接侵入植株,造成病斑,表明病菌孢子可通过雨水溅射、灌溉水漫灌传播到健康植株,连片为害。生物学特性研究显示,在26~30 ℃范围内和pH 5.0~7.0偏酸范围内病菌菌丝生长和产孢量较好,光照利于菌丝生长,黑暗利于产孢。广东省常年高温高湿,光照时间长,台山市永和村剑兰种植区土壤经检测偏酸性,当地适宜的环境因素利于病菌传播为害。常佳迎等[24]也报道黑暗利于新月弯孢霉(C. lunata)孢子产生,李晓宇等[25]对玉米弯孢叶斑病菌画眉草弯孢霉(C.eragrostidis)、新月弯孢霉(C. lunata)、棒状弯孢霉(C. clavato)和中隔弯孢霉(C. intermedia)的生物学特性进行比较, 4种弯孢霉生长适温为25~30 ℃, 产孢适温为25~35 ℃, 最适pH为6.0~7.0,光照促进菌丝生长。本研究显示唐草蒲弯孢霉与以上4个弯孢霉种的生物学特性相似。
测定7种常用杀菌剂对病原菌菌丝生长的毒力,发现咪鲜胺和代森锰锌抑菌作用最强,EC50分别为1.23和2.81 µg/mL。Pawar[26]报道代森锰锌对剑兰叶斑病菌新月弯孢霉(C. lunata)和苍白弯孢霉(C. pallescens)有较强的抑制作用。贺春萍等[27]测定9种杀菌剂对西瓜叶枯病菌新月弯孢霉(C. lunata)的毒力,咪鲜胺和代森锰锌的EC50分别为1.17、4.02 µg/mL,抑菌效果最好。桑利伟等[28]报道25% 咪鲜胺水乳剂对香蕉新月弯孢霉叶斑病菌(C. lunata)菌丝生长有较好的抑制效果。黄娴等[29]报道80% 代森锰锌可湿性粉剂和50% 咪鲜胺锰盐可湿性粉剂对温郁金叶枯病菌棒状弯孢霉(C. clavata)有明显抑制作用。苏勇等[30]报道对柚木弯孢霉叶斑病菌(C. lunata)抑菌效果最好的杀菌剂是咪鲜胺乳油。可见,咪鲜胺和代森锰锌对多种作物弯孢霉叶斑病菌有较好的抑制作用。百菌清和多菌灵是广谱型杀菌剂,用于多种真菌叶斑病的防治,但唐草蒲弯孢霉对两种药剂不敏感,尤其是多菌灵对病菌的EC50高达1 518.00 µg/mL,抑菌效果极差。调研发现,农户多使用多菌灵、百菌清等广谱性杀菌剂防治病害,可能是病害防治效果差的重要原因之一。剑兰叶斑病菌对咪鲜胺和代森锰锌敏感,其中代森锰锌价格相对便宜、成本较低,下一步将进行田间药效试验来验证咪鲜胺和代森锰锌的防治效果,以期为该病害防控推荐有效药剂。
4 结论广东台山永和村剑兰叶斑病发生严重,病原菌为唐菖蒲弯孢霉(C. gladioli),该菌致病力较强,无需伤口,可直接侵入植株。病菌适宜生长温度为26~30 ℃,适宜生长pH为5.0~7.0,广东台山4~11月的平均气温均在26℃以上,且剑兰种植区的土壤偏酸性,环境条件均有利于病害发展,造成剑兰叶斑病发生严重,因此需加强剑兰叶斑病的预报和防治工作。病菌对咪鲜胺和代森锰锌敏感,EC50分别为1.17、4.02 µg/mL,可用于病害防治;广谱型杀菌剂百菌清、多菌灵抑菌效果极差,不建议用于病害防治。
| [1] |
刘翠珍, 吕小瑞, 赵宗文, 李诚德, 石生岳, 李世煌. 唐菖蒲根腐病发生与防治技术研究[J]. 甘肃农业科技, 1995(4): 33-35. LIU C Z, LYU X R, ZHAO Z W, LI C D, SHI S Y, LI S H. Occurrence and control technology of gladiolus root rot[J]. Gansu Agricultural Science and Technology, 1995(4): 33-35. |
| [2] |
赵宏. 唐菖蒲球茎腐烂病原鉴定及其致病力[J]. 甘肃农业大学学报, 1997(2): 163-166. ZHAO H. Identification and pathogenicity of pathogens isolated from rotted gladiola bulbs[J]. Journal of Gansu Agricultural University, 1997(2): 163-166. |
| [3] |
雷玉明. 唐菖蒲腐烂病侵染规律和发病因子研究[J]. 植物保护, 2002, 28(3): 36-38. DOI:10.3969/j.issn.0529-1542.2002.03.012 LEI Y M. Study on infection regularity and pathogenic factors of gladiolus canker[J]. Plant Protection, 2002, 28(3): 36-38. DOI:10.3969/j.issn.0529-1542.2002.03.012 |
| [4] |
杨文成. 唐菖蒲干腐病综合防治研究[J]. 江西农业科技, 2001(6): 36-37. YANG W C. Study on comprehensive control of gladiolus dry rot[J]. Jiangxi Agricultural Science and Technology, 2001(6): 36-37. |
| [5] |
李晓琴, 黄云, 陈捷, 刘力行. 唐菖蒲干腐病病原生物学特性[J]. 上海交通大学学报(农业科学版), 2008, 26(4): 308-312. DOI:10.3969/j.issn.1671-9964.2008.04.012 LI X Q, HUANG Y, CHEN J, LIU L X. Biological characteristics of the pathogen in gladiola dry rot[J]. Journal of Shanghai Jiaotong University(Agriculture Science), 2008, 26(4): 308-312. DOI:10.3969/j.issn.1671-9964.2008.04.012 |
| [6] |
杨涛, 陶洪波, 王立荣, 龚束芳. 不同唐菖蒲品种对根腐病抗性的研究[J]. 中国植保导刊, 2015, 28(8): 5-8. DOI:10.3969/j.issn.1672-6820.2015.08.001 YANG T, TAO H B, WANG L R, GONG S F. Study on the resistance of different varieties of Gladiolus hybridus hort against root rot disease[J]. China Plant Protectiton, 2015, 28(8): 5-8. DOI:10.3969/j.issn.1672-6820.2015.08.001 |
| [7] |
徐运清, 杨文成, 张清良. 唐菖蒲褐腐病的发生与综合防治[J]. 湖北农业科学, 2006, 45(6): 759-760. DOI:10.3969/j.issn.0439-8114.2006.06.029 XU Y Q, YANG W C, ZHANG Q L. Occurrence and prevention of the brown rottend disease in Gladiolus gradarensis[J]. Hubei Agricultural Sciences, 2006, 45(6): 759-760. DOI:10.3969/j.issn.0439-8114.2006.06.029 |
| [8] |
王玉兰. 唐菖蒲病虫害综合防治技术[J]. 甘肃农业科技, 2005(6): 48-49. DOI:10.3969/j.issn.1001-1463.2005.06.024 WAN Y L. Integrated pest control technology of gladiolus[J]. Gansu Agricultural Science and Technology, 2005(6): 48-49. DOI:10.3969/j.issn.1001-1463.2005.06.024 |
| [9] |
高洁, 李亚, 袁美丽. 唐菖蒲细菌病害鉴定[J]. 吉林农业大学学报, 1991, 13(4): 19-22. DOI:10.13327/j.jjlau.1991.04.005 GAO J, LI Y, YUAN M L. Identification of bacterial leaf disease on Gladiolus gradarensis[J]. Journal of Jilin Agricultural University, 1991, 13(4): 19-22. DOI:10.13327/j.jjlau.1991.04.005 |
| [10] |
钟文文, 葛朝晖, 许俊杰. 剑兰叶斑病病原菌的分离与鉴定[J]. 江苏农业科学, 2020, 48(14): 131-138. DOI:10.15889/j.issn.1002-1302.2020.14.022 ZHONG W W, GE Z H, XU J J. Isolation and identification of pathogen of leaf spot of gladiolus[J]. Jiangsu Agricultural Sciences, 2020, 48(14): 131-138. DOI:10.15889/j.issn.1002-1302.2020.14.022 |
| [11] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 46-50. FANG Z D. Methods used in plant pathology[M]. Beijing: China Agriculture Press, 1998: 46-50. |
| [12] |
陆家云. 植物病原真菌学[M]. 北京: 中国农业出版社, 2000: 408-409. LU J Y. Plant pathogenic mycology[M]. Beijing: China Agricultural Press, 2000: 408-409. |
| [13] |
TORRES D P, SILVA M A, FURTADO G Q. Infection process of Curvularia gladioli on gladiolus leaves[J]. Tropical Plant Pathology, 2015, 40(6): 382-387. DOI:10.1007/s40858-015-0045-5 |
| [14] |
ZAMORSHI C, BIELSKA E. Curvularia trifolii a new for Poland pathogen of gladiolus[J]. Acta Agrobotanica, 2013, 36(1/2): 135-144. DOI:10.5586/aa.1983.011 |
| [15] |
SINGH H, SINGH P J. Screening of varieties of gladiolus under artificial epiphytotic conditions against Curvularia trifolii f. sp. gladioli[J]. Plant Disease Research, 2013, 28(2): 152-156. |
| [16] |
GUPTA K N. First report of Curvularia gladioli causing a leaf spot on Gladiolus grandiflorus in India[J]. Bioinfolet - A Quarterly Journal of Life Sciences, 2015, 12(3b): 745. |
| [17] |
TORRES D P, SILVA M A, PINHO D B, PEREIRA O L, FURTADO G Q. First report of Curvularia gladioli causing a leaf spot on Gladiolus grandiflorus in Brazil[J]. Plant Disease, 2013, 97(6): 847. DOI:10.1094/PDIS-12-12-1118-PDN |
| [18] |
PARMELEE J A. The identification of the Curvularia parasite of gladiolus[J]. Mycologia, 1956, 48: 558-567. DOI:10.1080/00275514.1956.12024566 |
| [19] |
BOEREMA G H, HAMERS M E. Check-list for scientific names of common parasitic fungi. Series 3b: Fungi on bulbs: Amaryllidaceae and Iridaceae[J]. Netherlands Journal of Plant Pathology, 1989, 95: 1-32. DOI:10.1007/BF01981520 |
| [20] |
KOLSE S, DEVKAR C, SAWANT D M. Diseases of gladiolus and their control[J]. Kisanshakti, 2000, 2(8): 42-43. |
| [21] |
PAWAR D M. Curvularia lunata and Curvularia pallescens the potential pathogens causing leaf blight of gladiolus caused by Curvularia spp[J]. International Jourmal of Plant Protection, 2012, 5(2): 448. |
| [22] |
深圳动植物检疫所剑兰花枯萎叶斑病调查组. 平湖区剑兰花枯萎叶斑病的初步观察[J]. 植物检疫, 1986, 3(1): 49-52. Investigation Team of Gladiolus Wilted Leaf Spot of Shenzhen Animal and Plant Quarantine Institute. Preliminary observation on wilt leaf spot of gladiolus in Pinghu[J]. Plant Quarantine, 1986, 3(1): 49-52. |
| [23] |
张猛, 武海燕, 田志强, 张天宇. 弯孢属3个中国新记录种[J]. 河南农业大学学报, 2006, 40(5): 524-526. DOI:10.16445/j.cnki.1000-2340.2006.05.017 ZHANG M, WU H Y, TIAN Z Q, ZHANG T Y. Three new records of Curvularia in China[J]. Journal of Henan Agricultural University, 2006, 40(5): 524-526. DOI:10.16445/j.cnki.1000-2340.2006.05.017 |
| [24] |
常佳迎, 田兰芝, 刘树森, 石洁, 杨文香, 郭宁. 新月弯孢变种的生物学特性及其对药剂的敏感性[J]. 植物保护学报, 2020, 47(5): 1038-1047. DOI:10.13802/j.cnki.zwbhxb.2020.2019149 CHANG J Y, TIAN L Z, LIU S S, SHI J, YANG W X, GUO N. Biological characteristics of fungal pathogen Curvularia lunata varieties and its sensitivity to fungicides[J]. Journal of Plant Protection, 2020, 47(5): 1038-1047. DOI:10.13802/j.cnki.zwbhxb.2020.2019149 |
| [25] |
李晓宇, 石洁, 董金皋. 几种玉米弯孢霉叶斑病菌生物学特性的比较[J]. 河北农业大学学报, 2002, 25(3): 61-69. DOI:10.3969/j.issn.1000-1573.2002.03.015 LI X Y, SHI J, HUANG J G. The comparison on biological characteristics of four kinds of Curvularia species[J]. Journal of Hebei Agricultural University, 2002, 25(3): 61-69. DOI:10.3969/j.issn.1000-1573.2002.03.015 |
| [26] |
PAWAR D M. In vitro evaluation of fungicides and organics against Curvularia lunata and Curvularia pallescens causing leaf blight in gladiolus[J]. International Journal of Plant Protection, 2012, 25(2): 442. |
| [27] |
贺春萍, 付相芹, 张荣, 郑服丛, 文衍堂. 西瓜弯孢霉叶枯病的初步研究[J]. 热带农业科学, 2000(1): 11-20. HE C P, FU X Q, ZHANG R, ZHENG F C, WEN Y T. Preliminary study of Curvularia leaf blight on watermelon[J]. Tropical Agricultural Science, 2000(1): 11-20. |
| [28] |
桑利伟, 刘爱勤, 吴伟怀, 孙世伟, 郑服丛. 香蕉弯孢霉叶斑病菌生物学特性及对杀菌剂的敏感性[J]. 植物保护, 2008, 34(2): 71-75. DOI:10.3969/j.issn.0529-1542.2008.02.019 SANG L W, LIU A Q, WU W H, SUN S W, ZHENG F C. Studies on the biological characteristics of Curvularia lunata and its sensitivity to fungicides[J]. Plant Protecion, 2008, 34(2): 71-75. DOI:10.3969/j.issn.0529-1542.2008.02.019 |
| [29] |
黄娴, 陈旭玉. 温郁金弯孢霉叶枯病病原菌的药剂筛选[J]. 安徽农业科学, 2014, 42(8): 2345-2346. DOI:10.13989/j.cnki.0517-6611.2014.08.046.j.cnki.0517-6611.2014.08.046 HUANG X, CHEN X Y. Screening fungicides for pathogen of Curvularia leaf blight on Curcuma wenyujin[J]. Journal of Anhui Agricultural Science, 2014, 42(8): 2345-2346. DOI:10.13989/j.cnki.0517-6611.2014.08.046.j.cnki.0517-6611.2014.08.046 |
| [30] |
苏勇, 张艳明, 廖克波, 韦继光, 王磊, 谢红辉, 周颖, 汪筱雪. 柚木弯孢霉叶斑病菌生物学特性研究及对杀菌剂的敏感性测定[J]. 广东农业科学, 2015, 42(21): 91-96. DOI:10.16768/j.issn.1004-874X.2015.21.014 SU Y, ZHANG Y M, LIAO K B, WEI J G, WANG L, XIE H H, ZHOU Y, WANG X X. Biological characteristics of pathogen of Tectona grandis curvalaria leaf spot and its sensitivity to fungicides[J]. Guangdong Agricultural Sciences, 2015, 42(21): 91-96. DOI:10.16768/j.issn.1004-874X.2015.21.014 |
(责任编辑 杨贤智)
 2021, Vol. 48
2021, Vol. 48