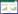文章信息
基金项目
- 广东省现代农业产业技术体系创新团队项目(2020KJ106,2021KJ106);广东省农业科学院农业优势产业学科团队建设项目(202115TD)
作者简介
- 张惠惠(1995—),女,在读硕士生,研究方向为甜玉米品质育种,E-mail:1937430262@qq.com; 李余良,博士,三级研究员,硕士研究生导师,主要从事甜糯玉米种质资源鉴定与评价,育种材料创新,甜糯玉米新品种试验、高产优质抗逆品种选育等研究工作。主持或参与科技部“863”计划项目、农业农村部“948”项目、国家玉米产业技术体系、广东省自然科学基金、广东省产业技术创新联盟、农业重点科技攻关、现代种业提升工程等研究项目30余项,2016年入选广东省现代农业种业关键技术专题专家,国家“十三五”“十四五”重点研发计划项目评审专家,省级科学技术奖评审专家,现聘任为2家省级企业技术咨询顾问。获得省部级科技成果奖8项,广东省农业技术推广奖一等奖4项,国家发明专利5项,植物新品种保护权6项,通过国家及省级审定品种30多个,发表学术论文30篇.
通讯作者
- 李余良(1969—),男,博士,研究员,研究方向为甜糯玉米遗传育种,E-mail:yl.lee@126.com.
文章历史
- 收稿日期:2021-10-31
【研究意义】近20年来,甜糯玉米在我国华南地区发展快速。opaque2(o2)基因突变影响玉米籽粒胚乳中蛋白体形成、淀粉含量及氨基酸组成,其中,赖氨酸含量提高可使营养品质大幅度提升[1]。因此,利用o2突变基因提高甜糯玉米籽粒的赖氨酸含量,对于提高和改良甜糯玉米营养价值具有重要意义[2]。【前人研究进展】 1960年科学家发现o2突变玉米中赖氨酸和色氨酸含量大幅提高。Mertz等证实o2突变玉米胚乳的赖氨酸含量比普通玉米提高69%[3]。研究认为,o2突变导致玉米转录功能受到抑制,使醇溶蛋白合成减少,非醇溶蛋白含量相应增加,从而使玉米籽粒的赖氨酸含量增加[4-6]。近年来,育种家通过不断积累修饰因子,成功培育出优质蛋白玉米,主要是利用o2和基因协同作用提高玉米赖氨酸含量,籽粒胚乳呈现透明硬质状态[7]。目前将o2基因导入糯玉米的研究表明,籽粒赖氨酸含量会有不同程度的提高[8-9]。但关于胚乳修饰的机制仍未被充分挖掘,o2基因在不同基因型背景下调控籽粒赖氨酸的积累研究还不多见。【本研究切入点】甜玉米是由于o2基因突变所致,而糯玉米因Waxy基因突变所致,糯玉米缺乏赖氨酸等人体必需氨基酸,因此营养价值受到极大限制[10]。优质蛋白鲜食玉米分子标记辅助育种过程中,o2突变体材料是最常用的高赖氨酸玉米供体[11]。近20年来华南地区甜玉米产业进入高速发展阶段,作为特色优势作物,在农业生产和效益农业中发挥重要作用。通过分子标记辅助选择把含o2突变基因的高赖氨酸玉米转育甜玉米或糯玉米自交系,可创制高赖氨酸玉米材料,不仅能提高玉米的营养价值,而且能获得优质蛋白甜玉米种质资源,目前相关研究未见报道。【拟解决的关键问题】本研究以含o2突变基因的高赖氨酸玉米转育9个甜玉米和1个糯玉米自交系,以期后续研究利用后代籽粒表现及分子标记辅助选择构建甜/糯玉米o2近等基因系,为开展甜/糯玉米高赖氨酸育种研究提供借鉴。
1 材料与方法 1.1 试验材料优质蛋白玉米HP3(o2/o2wx/wx)作为o2基因的供体亲本,来源于普通玉米自交系5026,属于黄改系类型,由陕西杨凌智种农作物科学研究所张学信老师惠赠。9个甜玉米受体材料分别为F1、F3、F4、F5、F7、F8、F9、F10、F11,基因型均为O2/O2sh2/sh2;F1、F4、F5、F7为黄色优质甜玉米自交系,F3、F8、F9、F10、F11为白色优质甜玉米自交系。1个糯玉米受体材料为N13- 1,基因型为O2/O2wx/wx,为白色糯玉米自交系。以上材料品质优良、农艺性状稳定,均由广东省农业科学院作物研究所提供。
1.2 试验方法1.2.1 田间种植 2020—2021年在广东省农业科学院白云基地开展种植。供体材料种植2行,受体材料及杂交回交、自交后代材料种植1~2行,行长4 m,株距32 cm,行距60 cm。
1.2.2 甜/糯玉米o2近等基因系创制流程 以HP3作为o2基因的供体亲本,与10个甜/糯玉米自交系杂交,以受体材料作为轮回亲本回交或F1杂交种进行自交,根据籽粒表型及透射光观察籽粒透明程度进行子代初步筛选,然后利用SSR标记对回交或自交后代单株进行鉴定筛选。选择基因型为o2/_sh2/sh2或o2/_wx/wx且表型与受体亲本相似的杂合植株再进行回交或自交,最后自交多代选择o2基因纯合且稳定遗传的植株,直至成功创制o2/o2-NILs甜玉米或糯玉米(图 1)。
|
| 图 1 甜/糯玉米o2近等基因系创制流程 Fig. 1 Construction process of o2-NILs in sweet/waxy maize |
1.2.3 玉米籽粒表型观察 观察玉米籽粒的饱满情况和色泽,并通过透射光观察籽粒透明程度。
1.2.4 SSR标记检测 当植株生长到6~7片叶时进行单株挂牌,取约0.5 g幼嫩的叶片装入2.0 mL离心管,放入液氮冷冻后用研磨机将样品打磨成粉末状,采用改良CTAB法[12]提取叶片基因组DNA,用灭菌ddH2O将DNA沉淀溶解,并稀释到90 ng/μL左右。SSR引物序列来自MaizeGDB,由擎科(广州)生物科技有限公司合成(表 1)。PCR体系15 µL,含2.4 µL引物(20 µmol/L)、2.0 µL DNA模板、5.3 µL Taq PCR Master Mix(购自北京天根生化科技有限公司)和5.3 µL ddH2O。扩增产物进行6% 非变性聚丙烯酰胺凝胶电泳,采用5×TBE定容至800 mL,然后加200 mL 30% Acr Bis定容至1 L制成丙烯酰胺溶液,玻璃板制胶,插梳子静止1 h,待胶变干拔出梳子,放置在电泳槽,点样,电泳2 h,最后经染色得到清晰条带。
2 结果与分析 2.1 不同基因型玉米籽粒外观表型变化
从籽粒外观来看,供体亲本HP3(o2/o2 wx/ wx)籽粒不透明,背面有凹陷,存在一定程度的皱缩,甜玉米籽粒明显干瘪皱缩,而N13-1籽粒饱满有光泽,所有轮回亲本籽粒透光性好。当转入o2基因后,在杂交一代玉米穗上出现硬质、甜质不同类型的籽粒分离状态,即不同基因型背景下的突变体籽粒表型不一致,回交一代籽粒表现为不同程度的皱缩,表面凹陷。从图 2可以看出,大多数材料在o2基因突变后,籽粒饱满程度和胚乳透光度均不同程度降低,但也存在O2基因突变籽粒表型不明显的现象。整体来看,各组回交后代籽粒变小,呈现不同程度的不透光状态。

|
| 图 2 亲本玉米及后代籽粒透光性情况 Fig. 2 Light transmittance performance of grains of parental maize and its offspring |
2.2 供体与受体亲本多态性检测
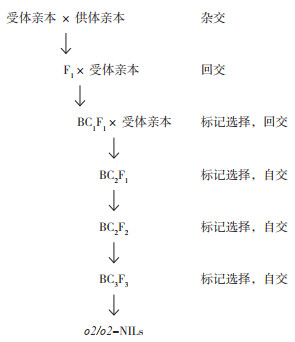
检测供体和受体亲本材料间的多态性是创制近等基因系首要的工作,本研究利用SSR标记phi057、phi112和umc1066检测受体甜/糯玉米自交系和供体HP3-o2/o2多态性,建立了分子标记筛选各组子代基因型的方法。从图 3可以看出,标记phi057能扩增出3种片段大小不同的特异性条带,供体HP3和各受体材料的多态性谱带不同,各受体材料之间也存在多态性,标记phi057在材料间多态性好,能够对它们进行鉴别,适合用于筛选3种不同基因型的植株;而phi112在供体HP3的带型与受体材料F3、F8、F9相同,与其他材料带型不同,不适合作为供体与所有受体材料鉴定的标记;从umc1066标记分析结果看出,仅F4、F7、N13-1带型不同于供体HP3,其他材料与供体条带相同,均不能区分供体和受体亲本材料。因此,可以选择phi057标记对下一步回交或自交后代o2基因进行追踪和鉴定。
|
| 图 3 SSR标记检测玉米o2供体自交系和受体自交系多态性 Fig. 3 Polymorphism of o2 donor and receptors inbred lines of maize detected by SSR markers |
2.3 回交1代群体的单株SSR标记检测
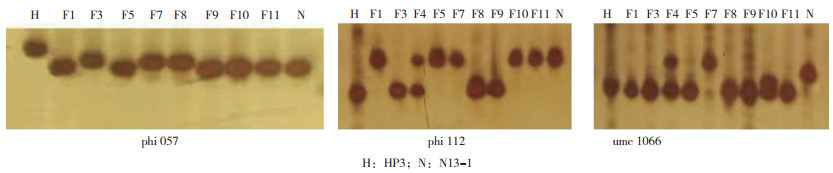
将供体材料HP3授粉予10个受体材料形成各杂交组合,以各受体作为轮回亲本进行回交,利用SSR标记phi057检测回交群体中表现皱缩的甜玉米单株多态性。从图 4A可知,在HP3与F4杂交组合的回交后代BC1F1群体基因型中,编号1、5、6、7、12、13、14等为杂合个体,基因型为O2/o2;编号2、3、4、8、9、10、11、15等带型与亲本F4一致,是纯合显性个体,基因型为O2/O2。同样,从图 4B可以看出,在HP3与F5杂交组合的回交后代BC 1F1群体基因型中,编号1、2、3、4、6、8、10、13、15、16等为杂合个体,基因型为O2/o2;编号5、7、9、11、12、14等带型与亲本F5一致,为纯合显性个体,基因型为O2/O2;在HP3与F7杂交组合的回交后代BC1F1群体基因型中,编号1、3、5、7、9、12、13、14、17、18等为杂合个体,基因型为O2/o2;编号2、4、6、8、10、11、15、16等带型与亲本F7一致,为纯合显性个体,基因型为O2/O2。图 4C显示,在HP3与N13-1杂交组合的回交后代BC1F1群体基因型中,编号1、2、3、4、5、7、10、12、13、18、21、22、25、26、27、28为杂合个体,基因型为O2/o2;编号6、8、9、11、14、15、16、17、19、20、23、24、29、30、31、32带型与亲本F5一致,为纯合显性个体,基因型为O2/O2。田间保留杂合个体继续进行回交筛选,去除显性纯合植株。其余6组材料经标记筛选也获得了一些杂合个体,表明o2基因已成功导入各受体材料,获得了供体的隐性突变基因。
|
| HP3、H均代表供体HP3,F4、F5、F7、N分别代表受体材料F4、F5、F7、N13-1 Both HP3 and H represent donor HP3; F4, F5, F7, N represent different receptors F4, F5, F7, N13-1, respectively 图 4 SSR标记phi057检测各BC1F1群体的基因型结果 Fig. 4 Genotypes of BC1F1 population detected by SSR molecular marker phi057 |
2.4 自交群体的单株SSR标记检测
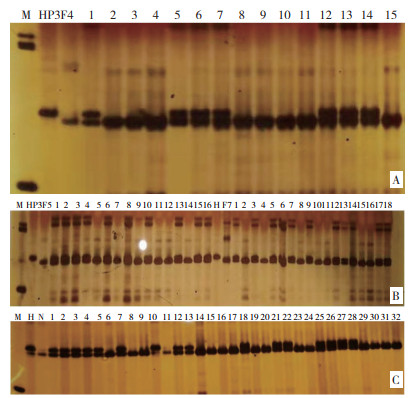
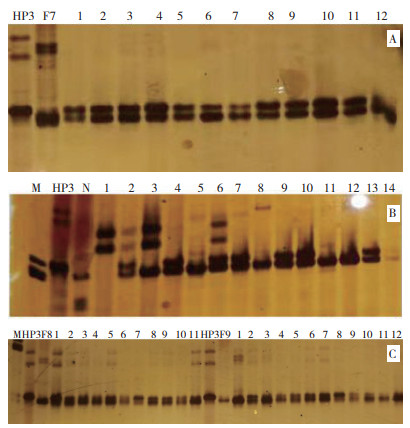
对各杂交组合采用自交的方法,利用SSR标记phi057检测F2群体中表现皱缩的甜玉米单株多态性。图 5A显示,在HP3与F7杂交组合的自交后代F2群体基因型中,编号1、2、3、4、5、6、7、8、9、10、11为杂合个体,基因型为O2/o2;编号12带型不清晰。图 5B显示,在HP3与N13-1杂交组合的自交后代F2群体基因型中,编号2、4、6、7、9、10、13为杂合个体,基因型为O2/o2;编号1、3、5、8、11、12、14带型与亲本N13-1一致,是纯合显性个体,基因型为O2/O2。同样,图 5C显示,在HP3与F8杂交组合的自交后代F2群体基因型中,检测的所有单株基因型均为杂合个体;在HP3与F9杂交组合的自交后代F2群体基因型中,编号为2、3、4、5、6、7、8、9、10为杂合个体,基因型为O2o2;编号1、11、12带型与亲本F9一致,是纯合显性个体,基因型为O2/O2。田间去除各组自交后代显性纯合植株,留下杂合基因型植株继续回交或自交。
|
| 图 5 SSR标记phi057检测的F2自交群体基因型结果 Fig. 5 Genotypes of F2 populations detected by SSR molecular marker phi057 |
3 讨论
甜糯玉米可作为鲜食玉米,对人体具有很高的营养价值,但是赖氨酸、蛋氨酸、色氨酸等必需氨基酸含量并不高。将含o2突变基因的高赖氨酸玉米导入到甜玉米自交系,通过分子标记辅助选择创制高赖氨酸甜玉米材料,对于提高甜玉米营养价值具有较好的遗传育种价值。研究发现,自交系多黄29、丹3130、9046等材料与CA335杂交的后代全为o2/o2隐性纯合个体[13],而它们与CA339用phi057标记无多态性。本研究SSR标记phi057发现,受体亲本与供体亲本均有多态性。有研究利用山东2548和齐205作为供体、11份玉米自交系作为受体,未能构建o2近等基因系[14],这说明亲本间有无多态性应值得考究。本研究拟利用HP3构建o2近等基因系。在利用phi057构建近等基因系时,必须检测供体与受体亲本之间的多态性,选择存在多态性的两个亲本杂交才能成功构建材料。本研究发现,phi057标记不仅在供体和受体之间存在多态性,而且利用phi057标记能够成功地检测将来源于供体的o2基因导入受体系。普通玉米胚乳蛋白质中由醇溶蛋白组成,且赖氨酸含量仅70%,o2突变体能显著增加非醇溶蛋白含量,从而极大提高籽粒中色氨酸和赖氨酸的含量[15-17]。但o2突变基因在不同玉米遗传背景中的作用具有很大差异,α-醇溶蛋白、赖氨酸含量变化幅度差异极大[18-21]。分子标记辅助选择虽然能够准确地筛选导入纯合o2/o2基因型的植株,但是转育后不同材料间的赖氨酸含量增加幅度变化较大,这给选育高赖氨酸玉米增加了难度[22-23]。
本研究通过SSR分子标记phi057筛选鉴定o2突变基因转入甜糯玉米在其子代中的传递,把o2基因导入到甜糯玉米自交系中,以期创制双隐性o2/sh2-NILs甜玉米近等基因系,建立一套在甜玉米中导入o2的分子标记辅助育种方法。通过此方法向不同遗传背景的甜糯玉米导入o2,选取赖氨酸含量提高较大、表型透光程度差异明显的o2/sh2或o2/wx-NILs,作为后代育种的基本材料。
本研究仅开展了2代筛选鉴定,材料还没有稳定,基因尚处于回复和纯合过程,需要继续开展选育和鉴定研究。而且成功构建o2近等基因系后还需要检测玉米赖氨酸含量,以验证导入o2基因对提高甜糯玉米赖氨酸营养的可行性。研究表明,o2突变后糯玉米籽粒表型同甜玉米表型变化基本一致,都是由蜡质表型变成不透明的粉质表型,可见糯玉米籽粒表型的变化与普通o2突变体一致,可能还会导致高赖氨酸糯玉米不易储存,易遭病虫害侵食,但该论点在本试验中未得到证实[24-25]。
4 结论本研究以1份优质蛋白玉米材料HP3为供体,将o2基因转入9份甜玉米和1份糯玉米自交系材料,SSR标记phi057在供体和受体自交系o2基因中呈现良好的多态性,在回交和自交后代中能够检测到供体的o2基因成功导入甜糯玉米受体自交系。供体亲本籽粒背面凹陷且皱缩,在投射光下籽粒不透明;甜玉米外观干瘪皱缩,糯玉米籽粒饱满且有光泽,且甜糯玉米透光性好;但o2基因转入后,F1代甜质玉米表现出硬质、皱缩不同类型的籽粒分离状态,BC1代则明显表现出透光性降低,与供体亲本特点相吻合。在回交和自交后代中通过籽粒表型与分子标记辅助选择相结合的方法,初步创制了10组优质甜/糯玉米早代群体系,研究建立了一个快速、有效的分子标记辅助选择改良鲜食玉米品质的方法。
| [1] |
张东民, 朱慧, 周昱婕, 韩洁楠, 李明顺. 玉米opaque2突变体子粒表型及营养成分分析[J]. 玉米科学, 2020, 28(4): 26-32. DOI:10.13597/j.cnki.maize.science.20200405 ZHANG D M, ZHU H, ZHOUY J, HAN J N, LI M S. Phenotype and nutritional composition analysis of opaque2 mutants in maize[J]. Journal of Maize Science, 2020, 28(4): 26-32. DOI:10.13597/j.cnki.maize.science.20200405 |
| [2] |
陈汁雯, 杨文鹏, 王明春, 柏光晓, 任洪, 张开武, 柯付文, 王伟. 玉米高赖氨酸和糯性基因聚合材料主要农艺性状配合力分析[J]. 山地农业生物学报, 2020, 39(2): 33-39. DOI:10.15958/j.cnki.sdnyswxb.2020.02.005 CHEN J W, YANG W P, WANG M C, BAI G X, REN H, ZHANG K W, KE F W, WANG W. Analysis of combining ability of main agronomic traits in high lysine and waxy gene polymeric materials of maize[J]. Journal of Mountain Agricultural Biology, 2020, 39(2): 33-39. DOI:10.15958/j.cnki.sdnyswxb.2020.02.005 |
| [3] |
Mertz E T, Bates L S, Nelson O E. Mutant gene that changes protein composition and increases lysine content of maize endosperm[J]. Science, 1964, 145(3629): 279-280. DOI:10.1126/science.145.3629.279 |
| [4] |
ZHANG Z Y, ZHENG X X, YANG J, JOACHIM M, WU Y R. Maize endosperm-specific transcription factors O2 and PBF network the regulation of protein and starch synthesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(39): 10842-10847. DOI:10.1073/pnas.1613721113 |
| [5] |
王伟, 王明春, 张开武, 任洪, 赵德刚, 杨文鹏. 玉米o2, o16和wx基因不同聚合类型近等基因系的选育[J]. 种子, 2019, 38(2): 1-6. DOI:10.16590/j.cnki.1001-4705.2019.02.001 WANG W, WANG M C, ZHANG K W, REN H, ZHAO D F, YANG W P. Breeding of near-isogenic lines with different polymeric types of o2, o16 and wx genes in Maize[J]. Seed, 2019, 38(2): 1-6. DOI:10.16590/j.cnki.1001-4705.2019.02.001 |
| [6] |
GIBBON B C, LARKINS B A. Molecular genetic approaches to developing quality protein maize[J]. Trends in Genetics, 2005, 21(4): 227-233. DOI:10.1016/j.tig.2005.02.009 |
| [7] |
周昱婕, 韩洁楠, 王美娟, 刘晓丽, 李明顺. Opaque2基因对糯玉米子粒品质的影响分析[J]. 玉米科学, 2021, 29(2): 29-34. DOI:10.13597/j.cnki.maize.science.20210205 ZHOU Y J, HAN J N, WANG M J, LIU X L, LI M S. Effect of Opaque2 gene on grain quality of waxy maize[J]. Journal of Maize Science, 2021, 29(2): 29-34. DOI:10.13597/j.cnki.maize.science.20210205 |
| [8] |
昂沃, 郝小琴, 吴子恺. Opaque2基因导入各类隐性纯合体玉米早代籽粒赖氨酸含量的效应研究[J]. 玉米科学, 2012, 20(2): 56-58. DOI:10.13597/j.cnki.maize.science.2012.02.011 ANG W, HAO X Q, WU Z K. Analysis of Opaque-2 gene effects on kernel lysine content into some early generations'homozygote recessive maize[J]. Journal Maize Science, 2012, 20(2): 56-58. DOI:10.13597/j.cnki.maize.science.2012.02.011 |
| [9] |
李坤, 李高科, 肖颖妮, 于永涛, 李余良, 谢利华, 朱文广, 胡建广. 甜玉米品质遗传改良研究进展[J]. 广东农业科学, 2020, 47(11): 70-77. DOI:10.16768/j.issn.1004-874X.2020.11.008 LI K, LI G K, XIAO Y N, YU Y T, LI Y L, XIE L H, ZHU W G, HU J G. Advances in genetic improvement of sweet maize quality[J]. Guangdong Agricultural Sciences, 2020, 47(11): 70-77. DOI:10.16768/j.issn.1004-874X.2020.11.008 |
| [10] |
韩小花, 鲁晓民, 周波, 魏良明, 王延召, 张前进, 朱卫红, 魏昕, 郭书磊, 刘康, 郭金生, 王振华, 张新. 郑58/opaque2近等基因系中opaque2基因突变位点分析与高效分子标记开发[J]. 玉米科学, 2019, 27(2): 61-68. DOI:10.13597/j.cnki.maize.science.20190209 HAN X H, LU X M, ZHOU B, WEI L M, WANG Y Z, ZHANG Q J, ZHU W H, WEI X, GUO S L, LIU K, GUO J S, WANG Z H, ZHANG X. Analysis of opaque2 mutation sites and development of efficient molecular markers in zheng 58/opaque2 isogenic line[J]. Journal of Maize Science, 2019, 27(2): 61-68. DOI:10.13597/j.cnki.maize.science.20190209 |
| [11] |
田佳源, 张思宇, 祁小旭, 杨殿林, 田秀平, 王慧. 施氮和黄顶菊混植对大喇叭口期玉米DNA甲基化变异的影响[J]. 玉米科学, 2020, 28(2): 169-177. DOI:10.13597/j.cnki.maize.science.20200225 TIAN J Y, ZHANG S Y, QI X X, YANG D L, TIAN X P, WANG H. Effects of nitrogen application and flax on DNA methylation variation in maize at bell-mouth stage[J]. Maize Science, 2020, 28(2): 169-177. DOI:10.13597/j.cnki.maize.science.20200225 |
| [12] |
关淑艳, 费建博, 刘智博, 金栋梁, 马义勇. 分子标记辅助选择(MAS)在玉米抗逆育种中的应用[J]. 吉林农业大学学报, 2018, 40(4): 399-407. DOI:10.13327/j.jjlau.2018.4306 GUAN S Y, FEI J B, LIU Z B, JIN D L, MA Y Y. Application of molecular marker-assisted selection(MAS)in maize resistance breeding[J]. Journal of Jilin Agricultural University, 2018, 40(4): 399-407. DOI:10.13327/j.jjlau.2018.4306 |
| [13] |
赵刚, 吴子恺, 陈亮, 张德贵, 张世煌, 卢振宇, 白丽, 李明顺. 多种供体自交系在优质蛋白玉米(QPM)近等基因系发育中的比较[J]. 玉米科学, 2010, 18(6): 11-14. ZHAO G, WU Z K, CHEN L, ZHANG D G, ZHANG S-H, LU Z-Y, BAI L, LI M-S. Comparison of several donor inbred lines on development of quality protein maize(QPM)near-isogenic lines[J]. Maize Science, 2010, 18(6): 11-14. |
| [14] |
张东民. Opaque2对玉米胚乳淀粉合成基因调控机制研究[D]. 北京: 中国农业科学院, 2019. ZHANG D M. Study on the regulation mechanism of Opaque2 on starch synthesis gene in maize endosperm[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. |
| [15] |
胡曦月. 玉米转录因子ZmEREB192、ZmEREB25参与胚乳淀粉合成的研究[D]. 成都: 四川农业大学, 2017. HU X Y. Study on maize transcription factors ZmEREB192 and ZmEREB25 involved in endosperm starch synthesis[D]. Chengdu: Sichuan Agricultural University, 2017. |
| [16] |
LI C B, QI W W, LIANG Z, YANG X, MA Z Y, SONG R T. A SnRK1-ZmRFWD3-Opaque2 signaling axis regulates diurnal nitrogen accumulation in maize seeds[J]. The Plant Cell, 2020, 32(9): 2823-2841. |
| [17] |
CICERI P, CASTELLI S, LAURIA M, LAZZARI B, GENGA A, BERNARD L, STURARO M, VIOTTI A. Specific combinations of zein genes and ge-netic backgrounds influence the transcription of the heavy-chain zein genes in maize opaque-2 endospermsl[J]. Plant Physio, 2000, 124(1): 451-460. DOI:10.1104/pp.124.1.451 |
| [18] |
MORO G L, HABBEN J E, HAMAKER B R, LARKINS B A. Characteri-zation of the variability in lysine content for normal and opaque 2 maize endosperm[J]. Crop Science, 1996, 36(6): 1651-1659. DOI:10.2135/cropsci1996.0011183X003600060039x |
| [19] |
JIA H, NETTLETON D, PETERSON J M, VAZQUEZ-CARRILLO G, JANNINK J L, SCOTT M P. Comparison of transcript profiles in wild-type and o2 maize endosperm in different genetic backgrounds[J]. Crop Science, 2007, 47(1): 45-59. DOI:10.2135/cropsci2006-0002tpg |
| [20] |
陈岩, 宋丽雅, 周志强, 张德贵, 颜娜, 张世煌, 李新海, 郝转芳, 翁建峰, 白丽, 李明顺. opaque-2玉米近等基因系的构建与赖氨酸含量快速检测[J]. 作物学报, 2013, 39(9): 1530-1537. CHEN Y, SONG L Y, ZHOU Z Q, ZHANG D G, YAN NA, ZHANG S H, LI X H, HAO Z F, WENG J F, BAI L, LI M S. Construction of Near-isogenic lines and rapid detection of Lysine content in Opaque-2 maize[J]. Acta Agronomica Sinica, 2013, 39(9): 1530-1537. |
| [21] |
WU Y R, MESSING J. Novel genetic selection system for quantitative trait loci of quality protein maize[J]. Genetics, 2011, 188(4): 1019-1022. DOI:10.1534/genetics.111.131078 |
| [22] |
Choosak J. Combining three grain mutants for improved‐quality sweet corn[J]. Agricultural & Environmental Letters, 2020, 5(1): 155-156. DOI:10.1002/ael2.20010 |
| [23] |
宁丽华, 王建晖, 时丕彪, 伍楚善, 董志诚, 赵涵. 基于DAP-Seq方法鉴定玉米胚乳特异表达转录因子o2在全基因组水平上的结合位点[J]. 科学通报, 2019, 64(24): 2537-2548. DOI:10.1360/N972019-00334 NING L H, WANG J H, SHI P B, WU C H, DONG Z C, ZHAO H. Identification of genome-wide binding sites of transcription factor o2 specifically expressed in maize endosperm based on DAP-Seq method[J]. Chinese Science Bulletin, 2019, 64(24): 2537-2548. DOI:10.1360/N972019-00334 |
| [24] |
WANG W, NIU S, DAI Y, WANG M, ZHAO D. The Zea mays mutants opaque2 and opaque16 disclose lysine change in waxy maize as revealed by RNA-Seq[J]. Scientific Reports, 2019, 9(1): 12265. DOI:10.1038/s41598-019-48478-6 |
| [25] |
张春霞. ZmGRAS20和ZmEREB26参与玉米淀粉合成的分子调控机制[D]. 成都: 四川农业大学, 2017. ZHANG C X. Molecular regulation mechanism of ZmGRAS20 and ZmEREB26 in maize starch synthesis[D]. Chengdu: Sichuan Agricultural University, 2017. |
(责任编辑 崔建勋)
 2021, Vol. 48
2021, Vol. 48