文章信息
基金项目
- 省部共建青稞和牦牛种质资源与遗传改良国家重点实验室自主课题(XZNKY-2020-C-007Z07)
作者简介
- 杨春葆(1985—),男,硕士,助理研究员,研究方向为青稞遗传育种,E-mail: 361503453@qq.com.
通讯作者
- 原红军(1981—),男,硕士,副研究员,研究方向为青稞遗传育种,E-mail: yuanzhenbin@126.com.
文章历史
- 收稿日期:2020-09-08
【研究意义】盐碱土在陆地生态系统上分布广泛,全世界盐渍土面积约l0亿hm2[1]。土壤中盐分过多,会对植物造成盐害[2]。因此,土壤盐碱化已经成为影响农作物生长及产量的重要因子之一,关于植物对盐逆境适应能力的研究已成为全球关注热点[3],如何提高植物耐盐性已成为植物抗逆性研究的重点[4]。高等植物对盐逆境的响应是一复杂综合的生物调节过程,需要植物体内多种生理生化过程共同作用,而非单一生物调节过程就能够抵御盐逆境响应[5]。青稞(裸大麦)是青藏高原农牧民主要的粮食作物,在西藏青稞种植面积占总耕地面积50%以上,同时也是牧区饲草的主要来源[6]。青稞具有较好的适应性和抗逆性,西藏边境农区及海拔4 700 m以上的高寒农区,这些地区农业生产水平低下,生态环境恶劣(气候严寒、多为盐碱土),青稞是唯一能正常收获的粮食作物[7]。青藏高原青稞系我国独有的植物种质资源,具有丰富的遗传变异和抗逆基因资源,发掘其耐盐资源可为大麦及作物耐盐改良提供优异种质[8]。【前人研究进展】盐逆境的直接危害表现为植物渗透胁迫、离子失调引起的毒害、营养元素的亏缺、氧化胁迫、生理生化代谢的紊乱、有毒物质的积累,进而引起植物生长发育和形态建成的改变[9]。大麦响应盐胁迫,根系Na含量呈先升高后降低趋势,P、S、Mg、K、Mn、Zn和B含量因盐处理而降低;叶片中,随盐胁迫程度的增加,Na含量上升,P、S、Mg、K、Mn、Zn和B含量降低[10]。大麦根系响应盐胁迫膜蛋白质组学研究发现,差异蛋白质响应机制主要涉及细胞膜稳定性、清除活性氧自由基和参与离子平衡的重建;叶片膜蛋白的主要响应机制是保护光合反应过程。大麦中脱水反应元件结合蛋白(DREB)、体细胞胚胎发生受体样激酶(SERKs)和水通道蛋白基因(AQP)已被验证功能[11]。盐胁迫野大麦,差异表达途径涉及蔗糖合成、脯氨酸合成、过氧化物酶体等,蔗糖合成酶(SuS)、鸟氨酸转氨酶(OAT)、谷氨酸激酶(ProB)、谷氨酸-5-半醛脱氢酶(ProA)、超氧化物歧化酶(SOD)等编码基因差异上调表达[12]。12-氧-植物二烯酸还原酶基因(OPR)、脂肪氧化酶基因(LOX)、L-半胱氨酸脱巯基酶基因(LCD)、PIN-formed蛋白基因(PIN)均参与植物非生物胁迫过程中,调控植物根系生长发育,促进植物适应非生物逆境响应。【本研究切入点】西藏耕地区多为高寒和干旱盐渍区,青稞是藏区主要的粮食作物,是具有适应性和抗逆性遗传种质资源。因此,筛选具有耐盐碱性青稞品种(系),不仅能提高粮食产量,更能改善土壤状况,促进土壤结构改良。【拟解决的关键问题】本试验采用不同浓度NaCl溶液胁迫青稞种子,筛选出半致死浓度(LC50),并研究青稞根系对NaCl的响应,以期了解盐胁迫对青稞根系形态的影响以及与耐盐性的关系,筛选出耐盐性青稞品种(系)。
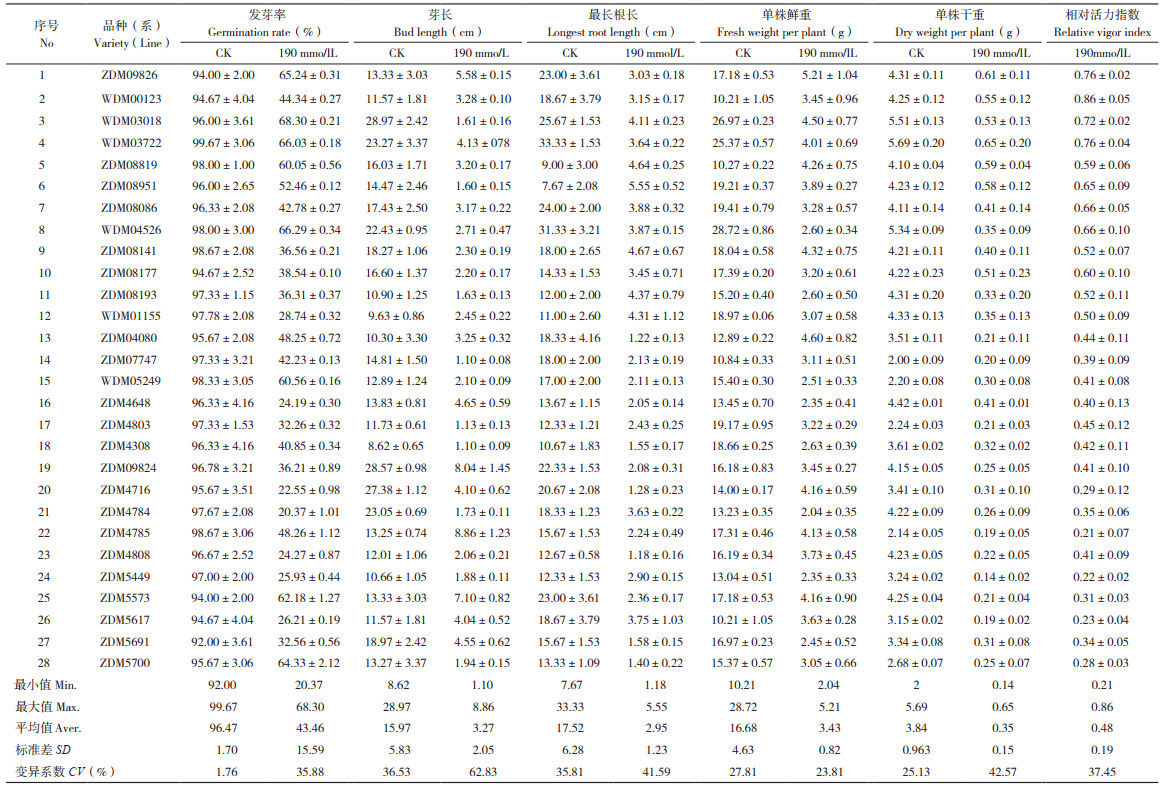
1 材料与方法 1.1 试验材料28份参试材料见表 1,均为西藏自治区农牧科学院农业研究所新育成品种(系)。
|
1.2 试验方法
1.2.1 NaCl胁迫青稞半致死浓度(LC50)测定 半致死浓度测定以ZDM09826、WDM00123、ZDM08086、WDM04526、ZDM04080、ZDM07747共6个品种(系)青稞材料为试材。选取大小均匀、饱满、无病虫害的青稞种子进行发芽试验,方法参考GB/T3543.4-1995,略有改进,以三层滤纸为芽床,置于25℃自然光下萌发,用蒸馏水保湿。待青稞种子胚根长至2 mm时,选取正常发芽、胚根长度基本一致的种子50粒分别转至50、100、150、200、250 mmol/L NaCl溶液为培养液的五层吸水纸一层滤纸的芽床继续培养,进行胁迫。对照除培养液为蒸馏水外,其他条件与处理一致。待青稞种子破壳胚根长约1~2 mm时,选取正常发芽、胚根长度基本一致的种子50粒转移至长30 cm、宽15 cm、高5 cm的发芽盒中继续培养(培养盒中含300 g石英砂,加入不同浓度NaCl溶液,对照加入等量蒸馏水,其他与处理一致,3次重复,置于智能人工气候箱中继续发芽,昼/ 夜温度为25 ℃/20 ℃(14 h/10 h),光照为6 000 lx,湿度65%,继续培养7 d,处理结束后测定存活幼苗数,计算成苗率,随机选取10株青稞幼苗测定苗高。
相对活力指数=(处理成苗率×处理苗高)/ (对照成苗率×对照苗高) [13];
以NaCl溶液浓度与相对活力指数进行回归分析,得到回归方程,并计算半致死浓度LC50。
1.2.2 青稞芽期幼苗生长特性测定 以回归分析所得半致死浓度为处理浓度,采用1.2.1方法处理28份参试青稞种子,3次重复,处理结束后,随机选取10株青稞幼苗分别测定芽长、最长根长、单株鲜重、单株干重,计算各品种(系)青稞材料相对活力指数。
数据统计应用Excel 2016处理作图,采用软件SPSS 19.0进行相关性及聚类分析。
2 结果分析 2.1 NaCl胁迫青稞萌发半致死浓度从图 1可以看出,不同浓度NaCl溶液处理6个青稞品种(系),幼苗相对活力指数随NaCl溶液浓度增加呈下降趋势。ZDM09826、WDM04526两个品种(系)青稞在不同NaCl溶液处理下相对活力指数在0.40~0.88、0.41~0.88,均高于其他4个品种(系)青稞,说明耐盐性强于其他4个品种(系),ZDM08086、ZDM07747两个品种(系) 在各浓度处理上均小于其他4个品种(系),ZDM04080、WDM00123两个品种(系)处于中间水平。6个品种(系)青稞耐盐性顺序为ZDM098 26≥WDM04526>ZDM04080>WDM00123>ZDM077 47≥ZDM08086。NaCl溶液浓度在150~200 mmol/ L时,6个品种(系)青稞相对活力指数在0.50左右,可将该浓度作为青稞耐盐研究的最适浓度。将NaCl胁迫浓度与相对活力指数回归分析,可得回归方程为:y=-0.0022x + 0.9107,R2=0.788**,即NaCl胁迫青稞耐盐性研究临界值为186.68 mmol/L。

|
| 图 1 NaCl胁迫对青稞相对活力指数影响 Fig. 1 Effect of NaCl stress on relative vigor index of highland barley |
2.2 NaCl胁迫对青稞芽期幼苗生长特性的影响
以190 mmol/L NaCl溶液胁迫28份青稞芽期幼苗,结果显示青稞根系生长受到不同程度的抑制(表 1),与CK相比各品种(系)青稞根系指标均受到影响,不同品种(系)间受到抑制程度差异较大。其中,芽长变化最大(1.10~ 8.86 cm),平均值为3.27 cm,变异系数(CV) 为62.83%;单株干重变化次之(0.35~0.65 g),平均值为0.35 g,CV为42.57%;根长CV(41.59%) 与单株干重相当,变化幅度为1.18 ~ 5.55 cm。单株鲜重变化最小(3.43~5.21 g),CV为23.81%。说明芽长对NaCl胁迫最敏感,单株干重及最长根长次之,单株鲜重最迟钝。NaCl胁迫后,4份(ZDM09826、WDM03018、WDM03722、WDM04526)青稞芽长均大于5.00 cm,同时单株干重均大于0.50 g,最长根长均大于4.00 cm,相对活力指数均大于0.50,表明这4份材料耐盐性最强。这可能是因为根系的伸长使得青稞更容易从土壤或基质中吸收水分及营养物质,促进了芽长及单株干重的增加。
综上所述,对于NaCl胁迫,青稞芽期幼苗根系特征差异较大,其中芽长、单株干重、最长根长可作为青稞耐盐性筛选指标。
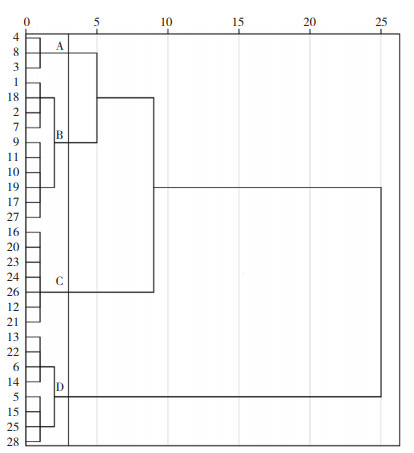
2.3 青稞耐盐性聚类分析以发芽率、芽长、单株干重、最长根长及单株鲜重为指标对28份青稞做层次聚类分析,在欧几里得距离3处可以将青稞分为4个大类(图 2)。其中,A类共有3份材料(WDM03018、WDM03722、WDM04526),平均发芽率为66.87%,平均芽长为8.00 cm,平均单株干重为0.59 g,平均最长根长为4.14 cm,平均单株鲜重为4.37 g;B类共有10份(ZDM09826、WDM00123、ZDM08086、ZDM0814 1、ZDM08177、ZDM08193、ZDM4803、ZDM4308、ZDM09824、ZDM5691),平均发芽率为40.57%,平均芽长为2.90 cm,平均单株干重为0.38 g,平均最长根长为3.07 cm,平均单株鲜重为3.38 g;C类共有7份(WDM01155、ZDM4648、ZDM4716、ZDM4784、ZDM4808、ZDM5449、ZDM5617),平均发芽率为24.60%,平均芽长为2.70 cm,平均单株干重为0.27 g,平均最长根长为2.73 cm,平均单株鲜重为3.05 g;D类共有8份(ZDM5573、ZDM08819、ZDM08951、ZDM04080、ZDM07747、WDM05249、ZDM4785、ZDM5700),平均发芽率为24.54%,平均芽长为2.19 cm,平均单株干重为0.25 g,平均最长根长为2.51 cm,平均单株鲜重为2.86 g;28材料抗旱性聚类分析结果与相对活力指数变化趋势相对吻合,即耐盐性相对较高材料的相对活力指数较高,反之,则相对活力指数较低。
|
| 图 2 28份青稞在NaCl胁迫下根系特征的聚类分析 Fig. 2 Cluster analysis of root characteristics of 28 highland barley under NaCl stress |
综合聚类分析及相对活力指数比较可知,3份材料(WDM03018、WDM03722、WDM04526) 平均相对活力指数为0.71,是耐盐性较强的青稞品种(系)。
2.4 青稞幼苗根系形态与耐盐性的相关性分析以相对活力指数作为青稞幼苗耐盐性的重要指标已应用于耐盐性材料的筛选工作,对青稞NaCl胁迫下根系形态与相对活力指数做相关性分析显示,青稞相对活力指数与相对发芽率呈显著正相关,与最长根长极显著正相关,与单株干重极显著正相关(表 2)。NaCl胁迫下,青稞发芽率高、根长较长、单株干重较大的材料其耐盐性相对较强,因此,可作为青稞耐盐性材料筛选的辅助指标。

|
3 讨论
植物种子萌发期是对外界胁迫最为敏感的阶段,因此,研究植物对逆境响应多选择种子萌发期[14]。植物根系是第一个感知逆境(干旱、盐等)的器官,根系生长状况发生变化可在较大程度上反映植物应对逆境的表现。植物根系越发达、扎根越深根系可吸收深层土壤水分,植物遭受逆境胁迫时供给地上部正常生理生化代谢所需水分[15]。同时,根系组织代谢低、吸水性好的优异基因型植物,具有更高的生产潜力[16]。根系是吸收水分、营养元素的主要器官,叶是进行光合作用的主要部位,盐胁迫对根和叶的影响直接反映植物在盐胁迫条件下的生长状况[17]。小麦遭受NaCl胁迫,随胁迫程度的增加,最大根长、根体积和根干重均降低,耐盐性强品种(系)下降程度较小[18]。研究显示,本试验结果显示,耐盐性越强的青稞品种(系)发芽率越高,根系发达程度越高。本研究结果显示,青稞根系生长受到不同程度的抑制,不同品种(系) 材料之间受到抑制程度差异较大。芽长对NaCl胁迫最敏感,单株干重及最长根长次之,单株鲜重最迟钝,与陈浩等[19]、李有芳等[20]研究结果类似。研究显示,青稞根系渗透调节是其耐盐的基本机制,多元醇在根系中起重要作用,根系中高水平的糖(蔗糖、海藻糖、棉子糖等)和能量以及叶片中活跃的光合作用对大麦耐盐起重要作用[21]。根和叶之间与渗透调节相关的相容溶质的种类存在差异,根中糖、脯氨酸和有机酸的合成显著增强,有利于提高活性氧解毒能力和耐盐性[22-23]。
植物耐盐性受基因型、生理生化等控制[24-25],采用任何一种单一的评价方法衡量作物耐盐性都是不全面的,采用综合指标评价耐盐性较准确[26]。本试验结果显示,发芽率、根长、单株干重与青稞相对活力指数呈极显著/显著正相关,可作为青稞耐盐性材料筛选的辅助指标。聚类分析方法常用来筛选抗逆性材料,本试验采用聚类分析方法筛选得到3份耐盐性青稞材料,为青稞育种工作奠定了基础。
4 结论本研究对28份青稞根系5个形态特征指标进行了分析,结果显示,NaCl胁迫对青稞幼苗根系形态指标影响较大,不同青稞对NaCl胁迫的敏感程度不同。采用聚类分析可以分为4类,耐盐性的聚类结果与青稞种子的相对活力指数的变化趋势基本一致,呈正相关关系,即耐盐性强的材料的相对活力指数越高,弱耐盐材料的相对活力指数相对较低。相关性分析显示,相对活力指数与相对发芽率、最长根长、单株干重呈显著/极显著正相关,可作为青稞耐盐性筛选的辅助指标。通过聚类分析获得了3份青稞(WDM03018、WDM03722、WDM04526)耐盐材料,为青稞耐盐遗传育种提供了材料。
| [1] |
张金林, 李惠茹, 郭姝媛, 王锁民, 施华中, 韩庆庆, 包爱科, 马清. 高等植物适应盐逆境研究进展[J]. 草业学报, 2015, 24(12): 220-236. DOI:10.11686/cyxb2015233.cyxb2015233 ZHANG J L, LI H R, GUO S Y, WANG S M, SHI H Z, HAN Q Q, BAO A K, MA Q. Research advances in higher plant adaptation to salt stress[J]. Acta Prataculturae Sinica, 2015, 24(12): 220-236. DOI:10.11686/cyxb2015233.cyxb2015233 |
| [2] |
张英虎, 沈会权, 周春霖, 栾海业, 臧慧, 乔海龙, 陈健, 陶红, 陈和. 大麦种质资源株高和耐盐性分析[J]. 江苏农业科学, 2018, 46(19): 56-58. DOI:10.15889/j.issn.1002-1302.2018.19.015 ZHANG Y H, SHEN H Q, ZHOU C L, LUAN H Y, ZANG H, QIAO H L, CHEN J, TAO H, CHEN H. Analysis of plant height and salt tolerance of barley germplasm resources[J]. Jiangsu Agricultural Sciences, 2018, 46(19): 56-58. DOI:10.15889/j.issn.1002-1302.2018.19.015 |
| [3] |
伦珠朗杰, 李慧慧, 郭刚刚, 其美旺姆, 高丽云, 唐亚伟, 尼玛扎西, 达瓦顿珠, 卓嘎. 西藏青稞冬春性鉴定及抽穗期多样性与稳定性分析[J]. 作物学报, 2019, 45(12): 1796-1805. DOI:10.3724/SP.J.1006.2019.91025 LUNZHU L J, LI H H, GUO G G, QIMEI W M, GAO L Y, TANG Y W, NIMA Z X, DAWA D Z, ZHUOGA. Growth habit identification and diversity and stability analysis of heading date in Tibetan barley (Hordeum vulgare L.)[J]. Atca Agronomica Sinca, 2019, 45(12): 1796-1805. DOI:10.3724/SP.J.1006.2019.91025 |
| [4] |
孙建, 徐晓芸, 马增科, 何建军, 汪军成, 姚立蓉, 李葆春, 马小乐, 司二静, 杨轲, 王化俊, 孟亚雄. 大麦发芽期耐盐性种质鉴定及其生理响应特征分析[J]. 干旱地区农业研究, 2019, 37(6): 16-23. DOI:10.7606/j.issn.1000-7601.2019.06.03 SUN J, XU X Y, MA Z K, HE J J, WANG J C, YAO L R, LI B C, MA X L, SI E J, YANG K, WANG H J, MENG Y X. Identification of salt- tolerant germplasm and analysis of its physiological response during barley germination[J]. Agricultural Research in the Arid Areas, 2019, 37(6): 16-23. DOI:10.7606/j.issn.1000-7601.2019.06.03 |
| [5] |
潘崇双, 刘青海, 李继荣, 黄利英, 邱城. 西藏地区土壤盐渍化研究进展[J]. 现代农业科技, 2020(17): 169-170, 173. PAN C S, LIU Q H, LI J R, HUANG L Y, QIU C. Research progress on soil salinization in Tibet area[J]. Modern Agricultural Technology, 2020(17): 169-170, 173. |
| [6] |
郭红玲. 盐胁迫下小麦幼苗生长的影响及机理研究[J]. 农业开发与装备, 2018(8): 120. GUO H L. Study on the effect and mechanism of wheat seedling growth under salt stress[J]. Agricultural Development and Equipment, 2018(8): 120, 124. |
| [7] |
EDWARD M, TEFERA T A, YONG H, CHENGDAO L. Salinity tolerance in barley during germination-homologs and potential genes[J]. Journal of Zhejiang University-Science B(Biomedicine & Biotechnology), 2020, 21(2): 93-124. DOI:10.1631/jzus.B1900400 |
| [8] |
白云, 张雨桐. 8份大麦种质材料种子萌发期的耐盐性比较[J]. 草原与草业, 2020, 32(2): 14-17. BAI Y, ZHANG Y T. Comparison of salt tolerance of 8 barley germplasm materials during seed germination[J]. Grassland and Prataculture, 2020, 32(2): 14-17. |
| [9] |
HE L, WANG X, FENG R, HE Q, WANG S W, LIANG C F, YAN L L, BI Y R. Alternative pathway is involved in nitric oxide-enhanced tolerance to cadmium stress in barley roots[J]. Plants(Basel), 2019, 8(12): 557. DOI:10.3390/plants8120557 |
| [10] |
FU L B, SHEN Q F, KUANG L H, YU J H, WU D Z, ZHANG G P. Metabolite profiling and gene expression of Na/K transporter analyses reveal mechanisms of the difference in salt tolerance between barley and rice[J]. Plant Physiol Biochem, 2018, 130: 248-257. DOI:10.1016/j.plaphy.2018.07.013 |
| [11] |
VYSOTSKAYA L, HEDLEYP E, SHARIPOVA GDMITRY V, GUZEL K, JENNIFER M, HAMLYN G J. Effect of salinity on water relations of wild barley plants differing in salt tolerance[J]. AoB Plants, 2010. DOI:10.1093/aobpla/plq006 |
| [12] |
宋士伟, 焦德志, 杨允菲. 东北草地野大麦对混合盐碱胁迫的生理响应及转录组分析[J]. 草业科学, 2019, 36(5): 1379-1388. DOI:10.11829/j.issn.1001-0629.2018-0446 SONG S W, JIAO D Z, YANG Y F. Physiological response and transcriptome analysis of Hordeum brevisubulatum under mixed salt and alkaline stress[J]. Pratacultural Science, 2019, 36(5): 1379-1388. DOI:10.11829/j.issn.1001-0629.2018-0446 |
| [13] |
米超, 赵艳宁, 刘自刚, 孙万仓, 刘海卿, 方彦, 李学才, 武军燕. PEG模拟水分胁迫下白菜型冬油菜芽期根系特征及抗旱性研究[J]. 干旱地区农业研究, 2017, 35(5): 229-235. DOI:10.7606/j.issn.1000-7601.2017.05.34 MI C, ZHAO Y N, LIU Z G, SUN W C, LIU H Q, FANG Y, LI X C, WU J Y. Research on root morphology characteristics and drought resistance of winter rapeseed(Brassica campestris L.)at bud stage under PEG simulated drought[J]. Agricultural Research in the Arid Areas, 2017, 35(5): 229-235. DOI:10.7606/j.issn.1000-7601.2017.05.34 |
| [14] |
WU H H, SHABALA L, ZHOU M X, SU N N, WU Q, TANVEER U, JUAN Z, STEFANO M, ELISA A, SERGEY S. Root vacuolar Na+ sequestration but not exclusion from uptake correlates with barley salt tolerance[J]. The Plant Journal, 2019, 100(1): 55-67. DOI:10.1111/tpj.14424 |
| [15] |
YU Y, ZHANG L, LIAN W R, XU F F, LI S T, XIANG J, ZHANG G Z, HU Z M, ZHAO B, REN S X, GUO Y D. Enhanced resistance to Botrytis cinerea and Rhizoctonia solani in transgenic broccoli with a trichoderma viride endochitinase gene[J]. Journal of Integrative Agriculture, 2015, 14(3): 430-437. DOI:10.1016/S2095-3119(14)60919-9 |
| [16] |
陈春舟, 马占军, 孟亚雄, 马小乐, 王化俊, 李葆春. 小麦种质资源抗旱耐盐性评价及种质筛选[J/OL]. 分子植物育种, 2020, 9(7): 1-28. CHEN C Z, MA Z J, MENG Y X, MA X L, WANG H J, LI B C.Evaluation and screening of wheat germplasm resources for drought and salt tolerance[J]. Molecular Plant Breeding, 2020, 9(7): 1-28. |
| [17] |
张军, 吴秀宁, 王新军. 盐胁迫对小麦幼苗根系生长的影响[J]. 商洛学院学报, 2016, 30(4): 52-55. DOI:10.13440/j.slxy.1674-0033.2016.04.014 ZHANG J, WU X N, WANG X J. Effects of salt stress on root growth of wheat at its seedling stage[J]. Journal of Shangluo University, 2016, 30(4): 52-55. DOI:10.13440/j.slxy.1674-0033.2016.04.014 |
| [18] |
刘艳丽, 刘桂珍, 茹德平, 崔党群. 盐胁迫下不同品种小麦苗期渗透调节物质含量的变化[J]. 山东农业科学, 2015, 47(4): 37-39. DOI:10.14083/j.issn.1001-4942.2015.04.009. LIU Y L, LIU G Z, RU D P, CUI D Q. Variation of osmotica content in seedling period of different wheat varieties under salt stress[J]. Shandong Agricultural Sciences, 2015, 47(4): 37-39. DOI:10.14083/j.issn.1001-4942.2015.04.009. |
| [19] |
陈浩, 冯蕾, 陈菲, 李青雁, 庞羽彤, 赵宇玮. 青稞和大麦对NaCl胁迫的差异生理响应[J]. 基因组学与应用生物学, 2012, 31(6): 609-616. DOI:10.3969/gab.031.000609 CHEN H, FENG L, CHEN F, LI Q Y, PANG Y T, ZHAO Y W. Differential physiological responses of hulless barley and barley to NaCl stress[J]. Genomics and Applied Biology, 2012, 31(6): 609-616. DOI:10.3969/gab.031.000609 |
| [20] |
李有芳, 王石平, 丁金金, 李卫华. 盐胁迫对小麦根系氧化损伤及细胞程序性死亡的影响[J]. 麦类作物学报, 2019, 39(11): 1326-1332. DOI:10.7606/j.issn.1009-1041.2019.11.08. LI Y F, WANG S P, DING J J, LI W H. Effect of salt stress on oxidative damage and programmed cell death in wheat root[J]. Journal of Triticeae Crops, 2019, 39(11): 1326-1332. DOI:10.7606/j.issn.1009-1041.2019.11.08. |
| [21] |
KARLOVA R, BOEREN S, RUSSINOVA E, AKER J, VERVOORT J, VRIES S. The Arabidopsis somatic embryogenesis receptor-like kinase1 protein complex includes brassinsteroid-insensitive 1[J]. Plant Cell, 2006, 18(3): 626-638. DOI:10.1105/tpc.105.039412 |
| [22] |
DELAUNEY A J, VERMA D P S. Proline biosy nt hesis a nd osmoregulation in plants[J]. The Plant Journal, 1993, 4: 215-223. DOI:10.1046/j.1365-313X.1993.04020215.x |
| [23] |
CHEN Z H, POTTOSIN H, CUIN T A, FUGLSANG A T, TESTER M. Rootplasma membrane transporters controlling K+/Na+homeostasis in salt-stressedbarley[J]. Plant Physiology, 2007, 145: 1714-1725. DOI:10.1104/pp.107.110262 |
| [24] |
SHI Y L, ZHANG R, WU X P, MENG Z G, GUO S D. Cloning and characterization of a somatic embryogenesis receptor-like kinase gene in cotton(Gossypium hirsutum)[J]. Journal of Integrative Agriculture, 2012, 11(6): 898-909. DOI:10.1016/S2095-3119(12)60080-X |
| [25] |
杨颖丽, 李翠祥, 滕玉瑾, 马婷, 许富强. NaCl胁迫下两种春小麦新品种渗透性调节反应的比较[J]. 西北师范大学学报(自然科学版), 2016, 52(1): 93-99. DOI:10.16783/j.cnki.nwnuz.2016.01.020 YANG Y L, LI C X, TENG Y J, MA T, XU F Q. Comparison osmotic adjustment in two new spring wheat varieties under NaCl stress[J]. Journal of Northwest Nornal University(Natural Science), 2016, 52(1): 93-99. DOI:10.16783/j.cnki.nwnuz.2016.01.020 |
| [26] |
MOSTEK A, BÖRNER A, BADOWIEC A, WEIDNER S. Alterations in root proteome of salt-sensitive and tolerant barley lines under salt stress conditions[J]. Journal of Plant Physiology, 2015, 174: 166-176. DOI:10.1016/j.jplph.2014.08.020 |
 2021, Vol. 48
2021, Vol. 48




