文章信息
基金项目
- 吉林省产业创新专项资金(201020334)
作者简介
- 张云(1993—),男,硕士,研究方向为蔬菜遗传育种,E-mail:1475765530@qq.com.
通讯作者
- 韩玉珠(1971—),女,博士,教授,研究方向为蔬菜遗传育种,E-mail:hanyzh2003@126.com.
文章历史
- 收稿日期:2019-08-31
【研究意义】马铃薯(Solanum tuberosum L.)是一种重要的粮食和蔬菜作物,氮对其生长发育具有重要意义。氮是作物生长发育所必需的重要元素,铵盐和硝酸盐是作物氮素吸收的主要来源。氮肥可显著影响马铃薯产量,氮素缺乏限制了马铃薯的生长[1],适宜的氮肥可有效提高收益率[2],过量的氮肥反而降低了经济和生态效益。因此,明确延薯4号马铃薯受氮素影响的生理生化变化以及氮代谢相关基因的表达情况,为其他马铃薯品种相关内容研究以及培育优质品种提供参考价值。【前人研究进展】氮肥严重影响作物生理生化响应,可溶性糖可为植物生长发育提供足够能量,同时也是植物体生理代谢的中间产物,通过代谢途径合成其他物质(如蛋白质等),是调节植物体生殖生长与基因表达的作用因子。可溶性蛋白作为植物体重要的生理指标,参与了多项生长过程中的物质代谢活动,是植物体内氮素的主要存在方式,根的生长情况和活力水平直接影响植物的营养状况以及产量水平,硝酸还原酶(NR)与作物吸收利用的氮素含量有关,施氮可显著提升作物的活性。谷氨酰胺合成酶(GS)是植物体内氨同化关键酶,是氮代谢的中心枢纽,从外界吸收的硝态氮、铵态氮,以及固氮和氨释放均需要经过GS的反应途径。然而氮肥对作物产量的影响远远小于作物氮素效率的影响,培育氮素高效新品种是降低成本、减少环境污染、提高作物产量的有效途径。氮代谢是植物重要的生理过程之一,是决定氮效率高低的重要生理代谢过程。作物通过硝酸盐转运蛋白从外部吸收氮,经硝酸盐和亚硝酸盐转运蛋白转化为铵盐,GS和谷氨酸合成酶(Glutamatesynthase, GOGAT)将转运蛋白转化为必需的氨基酸或蛋白质,谷氨酸脱氢酶(Glutamate dehydrogenase, GdH)对铵盐和谷氨酸有调节作用,这便是作物吸收氮素并进行同化利用的过程。【本研究切入点】近年来,对作物氮素胁迫的研究成为一个热点。对于小麦[3]、玉米[4]、高粱[5]、水稻[6]等作物在氮素胁迫下的差异表达早有研究,而对于马铃薯受氮素影响的关键生长发育时期以及此时期氮代谢基因的表达差异尚不明确。【拟解决的关键问题】延薯4号为马铃薯中晚熟品种,生长势强,根系发达,受氮素的影响较为明显,是氮高效品种,为了确定不同氮水平处理下马铃薯氮效率差异的生理生化响应以及氮代谢差异基因,我们以延薯4号马铃薯作为试验材料,我们对马铃薯在施氮处理和未氮处理下的产量、含氮量、氮效率、可溶性糖含量、可溶性蛋白含量、根系活力、NRA,GS活性进行测定,发现现蕾期为马铃薯生长发育过程中受到氮素影响最明显的时期,进而对马铃薯现蕾期的叶片和根进行转录组测序分析,确定了参与马铃薯氮代谢的相关基因以及表达水平的差异,研究结果为进一步研究氮素转运机理以及培育氮素高效品种提供了重要资源。
1 材料与方法 1.1 试验材料供试马铃薯品种为延薯4号,供试肥料为尿素(N≥46%)、过磷酸钙(P2O5≥18%)、硫酸钾(K2O≥50%);供试盆规格为盆底内径22 cm,高25 cm,盆口内径30 cm;土壤为含氮量1.56 g/kg的田园土,过筛、风干后每盆装8 kg。
1.2 试验方法试验在吉林农业大学蔬菜基地进行。2017年4月25日,采用随机区组的方式将种薯进行盆栽种植,种植深度6~8 cm,设置施氮(N、P、K)和不施氮(P、K)2个处理,每667 m2施肥量为纯N 22 kg、纯P 12 kg、纯K 18 kg,均一次性作底肥施入,每个处理30盆,共60盆。
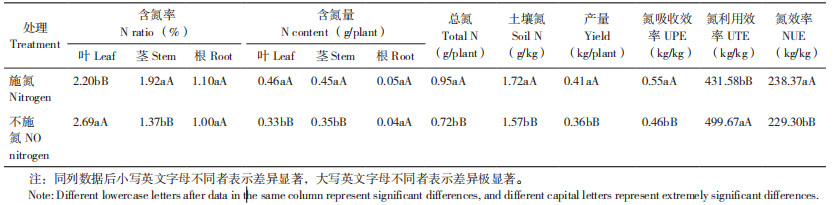
1.3 测定项目及方法1.3.1 马铃薯生理生化分析 在马铃薯整个生育期(苗期,现蕾期,块茎膨大期,淀粉积累期,成熟期),使用蒽酮法测量叶片可溶性糖含量,使用考马斯亮蓝G-250法测定叶片可溶性蛋白含量,使用TTC法测量根系活力,采用活体法测定叶片NR活性[7],根据田洵试验方法测量叶片GS活性[8]。在马铃薯成熟期选取3株长势一致的马铃薯整株,使用电子秤测量薯块重量;使用烘干箱将叶、茎、根在105 ℃下杀青30 min,85 ℃烘干至恒重,使用电子天平测量干重;使用粉碎机分别粉碎马铃薯叶、茎、根干样过0.150 mm筛,土壤经烘干后过0.150 mm筛,使用开氏消煮法消煮样品,使用全自动凯氏定氮仪测量含氮量。
氮效率(NUE)=植株成熟期产量/ 土壤供氮量
氮吸收效率(UPE)=植株含氮总量/ 土壤供氮量
氮利用效率(UTE)=植株成熟期产量/ 植株含氮总量
1.3.2 马铃薯转录组分析 在马铃薯现蕾期采集新鲜的叶和根组织,用DEPC水反复冲洗,选取≥ 500 mg的叶片(顶部开始第二叶)和根,用滤纸吸干水分后存放于2 mL冻存管中,经液氮处理后-80 ℃冰箱保存,随后送至Novogene公司进行转录组测序。
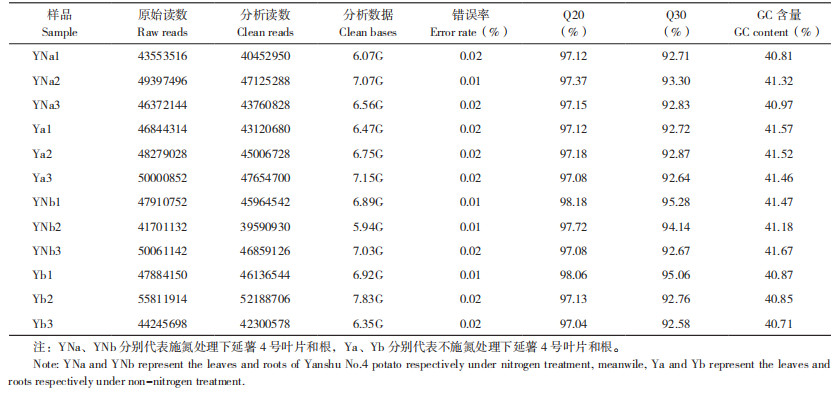
用Trizol总RNA提取试剂盒分离各样品的总RNA。RNA质量的初步检测采用琼脂糖凝胶电泳,使用Nanodrop检测RNA纯度(OD260/280比值),使用Qubit对RNA浓度进行精确定量,使用Agilent 2000精确检测RNA的完整性;同时,计算Q20、Q30和GC含量。采用FPKM计算方法,使用HTSeq软件对样品进行基因表达水平分析[9],使用DESeq R包对差异表达基因进行识别[10],使用GOseq软件进行GO富集分析[11],使用KOBAS(2.0)软件[12]进行Pathway富集分析,使用HemI软件进行聚类分析。
2 结果与分析 2.1 马铃薯产量及氮效率差异由表 1可知,马铃薯的含氮量以及氮效率受不同氮浓度影响。在施氮处理下,叶、茎、根的含氮量明显高于不施氮处理,分别为1.39倍、1.29倍、1.25倍,总氮含量为1.32倍。在施氮处理下,产量增加13.89%,氮吸收效率增加19.57%,氮利用效率降低15.78%,氮效率增加3.96%。
2.2 马铃薯生理生化差异
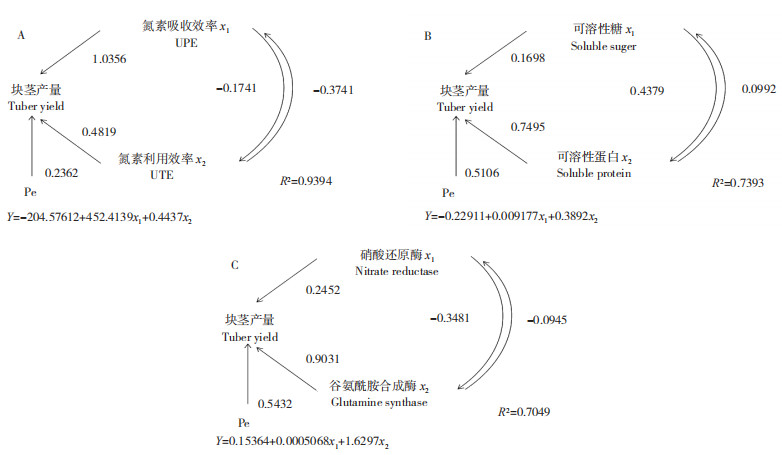
由图 1可知,马铃薯可溶性糖含量、可溶性蛋白含量、根系活力、硝酸还原酶活性、谷氨酰胺合成酶活性受不同氮浓度影响。在两种处理下,可溶性糖含量(图 1A)、根系活力(图 1C)、NRA(图 1D)、GS活性(图 1E)均呈单峰曲线变化;可溶性蛋白含量(图 1B)在施氮处理下表现为双峰曲线变化,在未施氮处理下呈现下降趋势。同时,由于这5个指标均在现蕾期出现了转折性变化,本试验以部分指标与马铃薯块茎之间进行通径分析,马铃薯块茎产量与成熟期的氮吸收效率和氮利用效率、现蕾期的可溶性糖含量和可溶性蛋白含量、现蕾期的NRA和GS活性呈显著正相关,相关系数分别为0.9692、0.8598和0.9396,决定系数分别为0.9394、0.7393和0.7049,直接通径系数分别为1.0356、0.4819、0.1698、0.7495、0.2452和0.9031。通径分析表明,块茎产量与马铃薯成熟期的氮吸收效率和氮利用效率呈显著正相关(图 2A),与马铃薯现蕾期的可溶性糖含量、可溶性蛋白含量、NRA和GS活性呈显著正相关(图 2B、C)。

|
| 图 1 氮素对马铃薯生理生化的影响 Fig. 1 Effects of nitrogen on physiology and biochemistry of potato |
|
| 图 2 氮素对马铃薯块茎产量的通径分析 Fig. 2 Path analysis of nitrogen on potato tuber yield |
2.3 马铃薯转录组数据质量
转录组测序分析了马铃薯在施氮和未施氮处理的叶和根,获得12个RNA-seq文库,利用Illumina/HiSeq TM 2000 RNA测序平台对其中的RNA- seq文库进行测序。转录组测序通过对raw reads进行过滤得到clean reads,占样品总读数的92% 以上,共产生约5 721万个raw reads以及约5 402万个clean reads,clean bases在6.75 G左右,Q20和Q30的百分比分别超过97% 和92%,GC含量超过40%(表 2),表明转录组测序数据可靠,可进行下一步的分析。
2.4 马铃薯基因差异表达分析
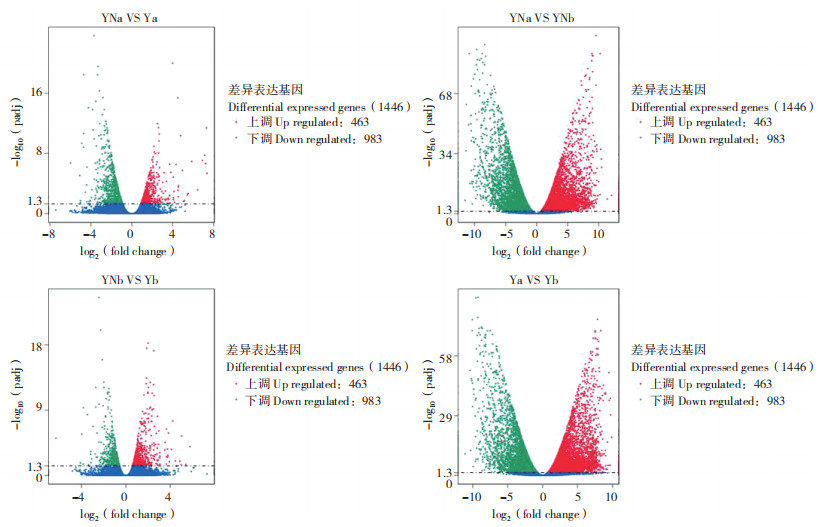
由图 3可知,马铃薯在施氮处理和不施氮处理下叶和根中均存在大量差异基因。施氮处理的马铃薯叶片中共有1 446个差异显著基因,其中463个上调基因,983个下调基因;根中共有1 009个差异显著基因,其中493个上调基因、516个下调基因。施氮处理的马铃薯叶片和根中共有12 996个差异显著基因,其中6 440个上调基因、6 556个下调基因;不施氮处理的马铃薯叶片和根中共有12 178个差异显著基因,其中6 268个上调基因、5 910个下调基因。表明氮素对马铃薯基因的表达水平有一定影响。
|
| 图 3 马铃薯叶片和根中差异表达基因分析 Fig. 3 Analysis of differentially expressed genes in potato leaves and roots YNa、YNb分别代表施氮处理下延薯4号叶片和根,Ya、Yb分别代表不施氮处理下延薯4号叶片和根。 YNa and YNb represent the leaves and roots of Yanshu No.4 potato respectively under nitrogen treatment, meanwile Ya and Yb represent the leaves and roots of respectively under non-nitrogen treatment. |
马铃薯氮代谢途径分析表明,植物通过NRT转运蛋白基因从外界吸收氮素,利用硝酸还原酶将硝酸盐转化成亚硝酸盐,随后经过亚硝酸还原酶转化成铵态氮,或者直接通过硝酸还原酶转换成铵态氮。铵态氮可通过GS/GOGAT循环途径合成谷氨酸供植物吸收,GdH通过α- 酮戊二酸和NH4+转化成谷氨酸,同时在铵态氮不足时可释放NH4+用以植物体生命活动(图 4)。
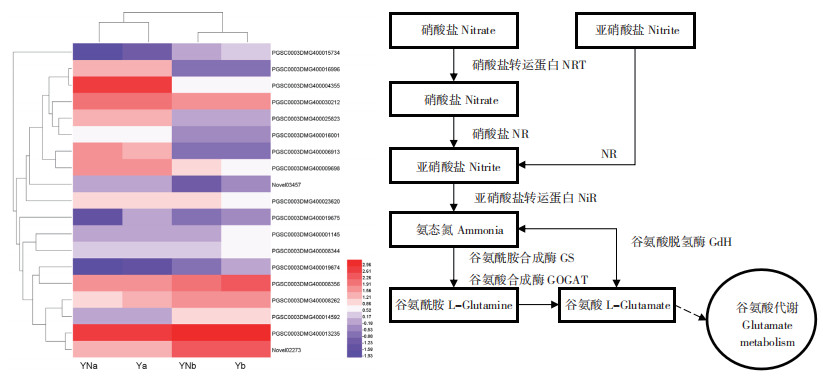
|
| 图 4 马铃薯氮代谢热图和通路分析 Fig. 4 Nitrogen metabolism heat map and pathway analysis of potato |
对马铃薯施氮与不施氮处理下叶片和根中氮代谢差异基因进行聚类分析(图 4),马铃薯叶片中差异基因聚为一类,根中差异基因聚为一类。同时19个差异基因在不同类别中存在显著性差异。由表 3可知,在不同处理下马铃薯叶片和根中均仅有1个下调表达基因。在施氮处理下马铃薯叶片和根中共有15个差异基因,其中8个上调表达基因,7个下调表达基因;在不施氮处理下叶片和根中共有19个差异基因,其中8个上调表达基因,11个下调表达基因。研究发现,在两种处理下,有7个差异基因在叶片中的表达量均高于根,分别为PGSC0003DMG400016996、PGSC0003DMG400006913、PGSC0003DMG400030212、PGSC0003DMG400025823、PGSC0003DMG400016001、PGSC0003DMG400004355、PGSC0003DMG400009698;同时,有7个差异基因均在根中的表达量高于叶片,分别为PGSC0003DMG400015734、PGSC0003DMG400001145、PGSC0003DMG400008262、PGSC0003DMG400008356、PGSC0003DMG400014592、PGSC0003DMG400013235、Novel02273。
3 讨论
氮是马铃薯生长发育中重要的营养元素,在生物体代谢和生化过程中起着关键作用。较低水平的氮肥会显著抑制马铃薯的可溶性糖含量、可溶性蛋白含量、根系活力、NRA、GS活性,降低马铃薯各部位的含氮量以及氮效率。Illumina Hiseq 2000测序现已成为植物转录组测序的一种有效手段,本试验表明现蕾期为马铃薯生长发育关键时期,进而对马铃薯现蕾期叶片和根进行转录组测序,探究马铃薯在施氮和不施氮下叶和根中氮代谢基因表达的差异。
3.1 马铃薯生理生化差异分析可溶性糖在植物的整个生长过程中占有重要的位置,可以为植物的生长发育提供足够的能量,同时也是植物体生理代谢的中间产物,是调节植物体生殖生长与基因表达的作用因子,其活性的高低直接影响到植物的氮代谢能力[13]。可溶性蛋白作为植物体重要的生理指标,参与了多项生长过程中的物质代谢活动,是植物体内氮素的主要存在方式,是限制马铃薯生长发育以及产量形成的主要因素之一。氮处理可显著增加叶片中可溶性糖和可溶性蛋白含量,在甜菜[14]、冬小麦[15]、马铃薯[16]等作物中均有所体现,与本试验结果一致。根系是植物最活跃的吸收器官和合成器官,根的生长情况和活力水平直接影响植物的营养状况以及产量水平。根系的发育与氮素吸收效率密切相关,而根系活力的强弱对氮素高效吸收有显著影响[17],高氮使马铃薯根系活力增加,且产量有所提升。NR是植物氮代谢途径中的一种限速酶,也是高等植物中氮同化的诱导酶或适应酶,催化了植物硝酸盐- 亚硝酸盐的还原过程,也就是将吸收的简单无机物在体内转换成复杂的有机物供植物吸收利用。研究发现,施用氮肥可明显提高马铃薯叶片的NRA,后期活性逐渐下降[18],同时氮素越高GS活性越强,并且提高氮利用效率[19],与本试验结果一致。同时本试验表明施氮处理可显著增加马铃薯各部位含氮量、氮效率以及产量,并且可溶性糖含量、可溶性蛋白含量、根系活力、NRA、GS活性均在现蕾期发生明显的转折性变化,通径分析表明,块茎产量与氮吸收效率和氮利用效率呈显著正相关,与现蕾期可溶性糖含量、可溶性蛋白含量、NRA、GS活性呈显著正相关。
综上所述施氮处理可显著提高延薯4号马铃薯各项生理生化指标,同时现蕾期为马铃薯生长发育关键时期。由此本试验以现蕾期的叶片和根进行转录组测序分析,寻找其氮代谢基因的差异表达水平,从分子生物学角度阐明延薯4号马铃薯对氮素的响应差异。
3.2 马铃薯差异表达基因分析本试验选取马铃薯在施氮和不施氮处理下现蕾期的叶片和根进行转录组测序分析,获得12个RNA-seq文库,利用Illumina/HiSeq TM 2000测序平台对其中的RNA- seq文库进行测序。施氮处理下叶片和根中共有12 996个差异表达基因,其中6 440个上调基因,6 556个下调基因,通过KEGG途径共鉴别出15个氮代谢差异基因,其中8个基因在叶片中表达量较高,7个基因在根中表达量较高。不施氮处理下叶片和根中共有12 178个差异表达基因,其中6 268个上调基因,5 910个下调基因,通过KEGG途径共鉴别出19个氮代谢差异基因,其中8个基因在叶片中表达量较高,11个基因在根中表达量较高。在相同处理下马铃薯叶片和根中共鉴别出19个氮代谢差异表达基因,其中7个基因在叶片中表达量较高,分别为PGSC0003DMG400016996(NRT2.5)、P G S C 0 0 0 3 D M G 4 0 0 0 0 6 9 1 3(NRT2.7)、P G S C 0 0 0 3 D M G 4 0 0 0 3 0 2 1 2(NR)、PGSC0003DMG400025823(NiR)、PGSC0003DMG400016001(GdH)、PGSC0003DMG400004355(G S)、PGSC0003DMG400009698(Fd-GOGAT);同时,有7个差异基因均在根中表达量较高,分别为PGSC0003DMG400015734(NRT2.4)、P G S C 0 0 0 3 D M G 4 0 0 0 0 1 1 4 5(NRT2.4)、P G S C 0 0 0 3 D M G 4 0 0 0 0 8 2 6 2(NiR)、PGSC0003DMG400008356(GdH)、PGSC0003DMG400014592(GS)、PGSC0003DMG400013235(GS)、Novel02273(NADH-GOGAT)。
在一定的氮浓度范围内,NRT2.4促进了作物对氮的吸收,同时在低氮条件下仍能提供植物所需的养分[20],NRT2.4在根表皮细胞中进行高亲和性NO3-N转运[21],本试验表明NRT2.4基因在根中的表达量高于叶片,结果一致。在低硝酸盐的情况下,NRT 2.5可以促进植物体内硝酸盐的流动,表明NRT 2.5在低氮条件下表达量较高,在过量氮浓度条件下表达量受到抑制[22],并且NRT2.5在不依赖NO3-N摄取的植物中起作用,而在植物NO3-N的分布中不起作用,优先在叶中表达的NRT2.5基因在植物生长中起到促进作用[23]。唐贤礼等[24]发现,PtNRT2.7基因主要在叶片中表达,并且在成熟叶片中表达量最高,可受NO3-N的诱导并增强作物根系的生长。本试验得出相似结论,即NRT2.5、NRT2.7基因在叶中表达量高于根。当外界硝酸盐含量过高时,NR、NiR停止工作,导致硝酸盐、亚硝酸盐大量累积。NRA随着施氮水平的增加,其活性会有所升高,适量増施氮肥能有效提高作物器官的NRA,但在氮含量达到一定程度时,NRA将会下降[25]。杜永成等[26]研究表明,増施一定量的氮肥,NR及NiR活性均有一定的提升,且呈现双峰曲线的变化。本试验表明,NR基因主要在叶片中表达,而NiR基因在叶片和根中均有所表达。NH4+经过GS/GOGAT作用下转变为有机态氮,是氮同化吸收的主要过程。李楚曦[27]研究表明,GS基因过表达可以提高玉米对低氮条件胁迫的适应能力。Glu+NH4++ATP → Gln+ADP+Pi硝态氮与铵态氮都能诱导GS表达,即吸收的氮含量越高,GS活性越高。在低氮、中氮、高氮下大麦GS活性有所变化,呈现出氮素越高GS活性越强的现象[28]。利用NO3-N、NH4+-N、混合氮对大豆诱导,随着氮含量不同程度的增加,GS活性也相对增加,表明GS与植株氮效率的吸收利用有重要作用[29]。余佳玲等[30]研究表明,在氮素供应不足时,植物体内GOGAT对氮素的积累以及分配、利用等方面发挥的作用较GS要高。GOGAT活性随氮素水平的增加而增加,可作为氮高效品种筛选的一项指标[31]。GdH在植株受到胁迫时发挥着重要作用,当植株缺乏氮素时,也可作用于谷氨酸使其氧化并释放出NH4 +[32]。GdH在外界NH4+-N增加时,GdH活性有所提升,而在外界NO3-N浓度逐步增加的条件下,GdH活性受到短期抑制之后活性有所增加,此时的NO3-N转变成NH4+-N使得植株GdH活性发生变化[33]。GdH主要分为NADH-GdH与NAD+-GdH,赵双双等[34]研究表明,当外界氮源充足时,植株NADH型GdH活性下降,NAD+型GdH活性上升,而在氮源不足时,NADH与NAD+ 型GdH活性明显下调,实现对N的吸收利用。本试验表明,GS和GdH基因在叶片和根中均有所表达,而Fd-GOGAT主要在叶中表达,NADH-GOGAT主要在根中表达。
4 结论本研究对施氮和不施氮处理下延薯4号马铃薯现蕾期叶和根进行转录组测序分析,氮代谢途径中鉴定出编码9种基因的19个DEGs,其中PGSC0003DMG400016996(NRT2.5)、PGSC0003DMG400006913(NRT2.7)、PGSC0003DMG400030212(N R)、PGSC0003DMG400025823(NiR)、PGSC0003DMG400016001(GdH)、PGSC0003DMG400004355(G S)、PGSC0003DMG400009698(Fd-GOGAT)等7个DEGs在叶片中的表达量较高,PGSC0003DMG400015734(NRT2.4)、PGSC0003DMG400001145(NRT2.4)、PGSC0003DMG400008262(NiR)、PGSC0003DMG400008356(GdH)、PGSC0003DMG400014592(G S)、PGSC0003DMG400013235(GS)、Novel02273(NADH-GOGAT)等7个DEGs在根中的表达量较高。本研究结果表明,NRT2.4、NRT2.5、NRT2.7、NR、NiR基因主要参与马铃薯氮素吸收功能,GdH、GS、GOGAT基因主要参与马铃薯氮素利用功能,这些基因的表达提高了马铃薯氮效率、产量,增加了植株各部位氮含量,同时使得马铃薯可溶性糖含量、可溶性蛋白含量、根系活力、NRA、GS活性提高,能够进行更好的生长发育。因此了解氮高效马铃薯延薯4号的氮素作用机理以及氮代谢基因表达情况,将会为今后马铃薯氮高效品种的培育以及相关作物氮效率的研究提供理论依据。
| [1] |
WEI S, WANG X, SHI D, LI Y, ZHANG J, LIU P, ZHAO B, DONG S. The mechanisms of low nitrogen induced weakened photosynthesis in summer maize(Zea mays L.)under field conditions[J]. Plant Physiol Biochem, 2016, 105: 118-128. DOI:10.1016/j.plaphy.2016.04.007 |
| [2] |
杨育峰, 张晓申, 王慧瑜, 段俊枝, 李君霞, 代小冬, 杨国红. 氮肥施用量对甘薯生长、含氮量及产量的影响[J]. 河南农业科学, 2015, 44(3): 52-55. DOI:10.15933/j.cnki.1004-3268.2015.03.013 YANG Y F, ZHANG X S, WANG H Y, DOAN J Z, LI J X, DAI X D, YANG G H. Effects of Nitrogen fertilizer application amount on growth, nitrogen content and yield of sweet potato[J]. Journal of Henan Agricultural Sciences, 2015, 44(3): 52-55. DOI:10.15933/j.cnki.1004-3268.2015.03.013 |
| [3] |
CHANDNA R, AHMAD A. Nitrogen stress-induced alterations in the leaf proteome of two wheat varieties grown at different nitrogen levels[J]. Physiol Mol Biol Plants, 2015, 21(1): 19-33. DOI:10.1007/s12298-014-0277-8 |
| [4] |
NAZIR M, PAANDEY R, SIDDIQI T O, IBRAHIM M M, QURESHI M I, ABRAHM G, VENGAVASI K, AHMAD A. Nitrogen-deficiency stress induces protein expression differentially in low-N tolerant and low-N sensitive maize genotypes[J]. Front Plant Sci, 2016, 7: 298. DOI:10.3389/fpls.2016.00298 |
| [5] |
GELLI M, DUO Y, KONDA AR, ZHANG C, HOLDING D, DWEIKAT I. Identification of differentially expressed genes between sorghum genotypes with contrasting nitrogen stress tolerance by genome-wide transcriptional profiling[J]. BMC Genomics, 2014, 15: 179. DOI:10.1186/1471-2164-15-179 |
| [6] |
HAKEEM K R, CHANDNA R, AHMAD A, QURESHI M I, IQBAL M. Proteomic analysis for low and high nitrogen-responsive proteins in the leaves of rice genotypes grown at three nitrogen levels[J]. Appl Biochem Biotechnol, 2012, 168(4): 834-850. DOI:10.1007/s12010-012-9823-4 |
| [7] |
张治安, 陈展宇. 植物生理学实验技术[M]. 长春: 吉林大学出版社, 2008. ZHANG Z A, CHEN Z Y. Experimental techniques of plant physiology[M]. Changchun: Jilin University Press, 2008. |
| [8] |
田洵. 施氮量对不同马铃薯品种生长发育及氮代谢的影响[D]. 哈尔滨: 东北农业大学, 2016. TIAN X. Effects of nitrogen application on growth and nitrogen metabolism of different potato varieties[D]. Harbin: Northeast agricultural university, 2016. |
| [9] |
ANDERS S, HUBER W. Differential expression of RNA-Seq data at the gene level-the DESeq package[J]. Embl, 2013, 8: 1-27. |
| [10] |
ANDER S, HUBER W. Differential expression analysis for sequence count data[J]. Genome Biol, 2010, 11(10): R106. DOI:10.1186/gb-2010-11-10-r106 |
| [11] |
YOUNG M D, WAKEFIELD M J, SMYTH G K, OSHLACK A. Gene ontology analysis for RNA-seq: accounting for selection bias[J]. Genome Biol, 2010, 11(2): R14. DOI:10.1186/gb-2010-11-2-r14 |
| [12] |
MAO X, AI T, OLYARCHUK JG, WEI L. Automated genome annotation and pathway identification using the KEGG Orthology (KO) as a controlled vocabulary[J]. Bioinformatics, 2005, 21(19): 3787-3793. DOI:10.1093/bioinformatics/bti430 |
| [13] |
王嘉佳, 唐中华. 可溶性糖对植物生长发育调控作用的研究进展[J]. 植物学研究, 2014, 3(3): 71-76. DOI:10.12677/BR.2014.33011 TANG Z H, WANG J J. Research progress of soluble sugar on the regulation of plant growth and development[J]. Botanical Research, 2014, 3(3): 71-76. DOI:10.12677/BR.2014.33011 |
| [14] |
刘娜, 宋柏权, 闫志山, 范有君, 杨骥. 氮肥施用量对甜菜蔗糖代谢关键酶和可溶性糖含量的影响[J]. 中国农学通报, 2015, 31(27): 183-189. LIU N, SONG B Q, YAN Z S, FAN Y J, YANG J. Effects of nitrogen fertilizer application on sucrose metabolic key enzyme and soluble sugar content in sugar beet[J]. Chinese Agricultural Bulletin, 2015, 31(27): 183-189. |
| [15] |
薛丽华, 赵连佳, 陈兴武, 孙诗仁, 张宏芝, 赛力汗, 雷钧杰, 张永强. 施氮量对滴灌冬小麦光合特性、产量及氮素利用效率的影响[J]. 中国农学通报, 2018, 34(10): 11-16. XUE L H, ZHAO L J, CHEN X W, SUN S R, ZHANG H Z, SAI L H, LEI J J, ZHANG Y Q. Effects of nitrogen application on photosynthetic characteristics, yield and nitrogen utilization efficiency of drip irrigation winter wheat[J]. Chinese Agronomy Bulletin, 2018, 34(10): 11-16. |
| [16] |
张婷婷. 不同施氮水平对马铃薯碳氮代谢及产质量的影响[D]. 呼和浩特: 内蒙古农业大学, 2015. ZHANG T T. Effects of different nitrogen application levels on potato carbon and nitrogen metabolism and production quality[D]. Hohhot: Inner Mongolia agricultural university, 2015. |
| [17] |
ZHANG S L, HONG C, LI P, YUAN J C. Root vigor and kinetic characteristics and nitrogen use efficiencies of different potato (Solanum tuberosum L.)cultivars[J]. Journal of Agricultural Science and Technology, 2016, 18(2): 399-410. |
| [18] |
胡新喜, 冯艳青, 雷艳, 刘明月, 熊兴耀. 不同施氮水平下秋马铃薯的生长以及StNR和StAT的表达[J]. 园艺学报, 2015, 42(10): 1974-1982. HU X X, FENG Y Q, LEI Y, LIU M Y, XIONG X Y. Growth of autumn potatoes and expression of StNR and StAT at different nitrogen levels[J]. Journal of Horticulture, 2015, 42(10): 1974-1982. |
| [19] |
THOMSEN H C, ERIKSSON D, MOLLER I S, SCHJOERRING J K. Cytosolic glutamine synthetase: a target for improvement of crop nitrogen use efficiency?[J]. Trends Plant Sci, 2014, 19(10): 656-663. DOI:10.1016/j.tplants.2014.06.002 |
| [20] |
XUAN H, WANG Y, WEI L. Transcription analysis of the genes encoding nitrate transporter NRT1 and NRT2 families in response to nitrogen starvation in wheat seedlings leaves[J]. Journal of Triticeae Crops, 2014, 2014, 34(8): 1019-1028. |
| [21] |
KIBA T, FERIABOURRELLIER A B, LAFOUGE F. The Arabidopsis nitrate transporter NRT2.4 plays a double role in roots and shoots of nitrogen-starved plants[J]. Plant Cell, 2012, 24(1): 245-258. |
| [22] |
冯素花. 茶树硝酸根转运蛋白NRT1.2、NRT1.5和NRT2.5基因的克隆与表达[D]. 北京: 中国农业科学院, 2014. FENG S H. Cloning and expression of nitrate transporters NRT1.2, NRT1.5 and NRT2.5 genes in tea tree[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. |
| [23] |
KECHID M, DESBROSSES G, ROKHSI W. The NRT2.5 and NRT2.6 genes are involved in growth promotion of Arabidopsis by the plant growth-promoting rhizobacterium(PGPR)strain Phyllobacterium brassicacearum STM196[J]. New Phytologist, 2013, 198(2): 514-524. DOI:10.1111/nph.12158 |
| [24] |
唐贤礼, 张月, 张盾. 毛果杨基因PtNRT2.7的功能初步鉴定与分析[J]. 北京林业大学学报, 2016, 38(8): 18-27. DOI:10.13332/j.1000-1522.20160041 TANG X L, ZHANG Y, ZHANG D. Functional identification and analysis of PtNRT2.7 gene from Populus trichocarpa[J]. Journal of Beijing Forestry University, 2016, 38(8): 18-27. DOI:10.13332/j.1000-1522.20160041 |
| [25] |
刘鹏, 焦晓燕, 丁玉川, 武爱莲, 王劲松, 董二伟, 郭珺, 王立革. 作物氮素高效利用研究进展[J]. 山西农业科学, 2017, 45(5): 855-860. LIU P, JIAO X Y, DING Y C, WU A L, WANG J S, DONG E W, GUO J, WANG L G. Research progress on efficient utilization of nitrogen in crops[J]. Shanxi Agricultural Science, 2017, 45(5): 855-860. |
| [26] |
杜永成, 王玉波, 范文婷. 不同氮素水平对甜菜硝酸还原酶和亚硝酸还原酶活性的影响[J]. 植物营养与肥料学报, 2012, 18(3): 717-723. DU Y C, WANG Y B, FAN W T. Effects of different nitrogen levels on nitrate reductase and nitrite reductase activity in sugar beet[J]. Journal of Plant Nutrition and Fertilizer, 2012, 18(3): 717-723. |
| [27] |
李楚曦. 转Glutamine SynthetaseⅠ基因耐低氮玉米分子特征分析与功能效率评价[D]. 北京: 中国农业科学院, 2016. LI C X. Turn Glutamine SynthetaseⅠlow nitrogen molecules of corn resistant gene characteristics analysis and function evaluation of efficiency[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. |
| [28] |
强欣. 大麦不同氮利用效率品种筛选及GS基因的生物信息学分析[D]. 兰州: 甘肃农业大学, 2015. QIANG X. Screening of barley varieties with different nitrogen utilization efficiency and bioinformatics analysis of GS gene[D]. Lanzhou: Gansu Agricultural University, 2015. |
| [29] |
陈煜, 朱保葛, 张敬, 梁宗锁. 不同氮源对大豆硝酸还原酶和谷氨酰胺合成酶活性及蛋白质含量的影响[J]. 大豆科学, 2004(2): 143-146. CHEN Y, ZHU B G, ZHANG J, LIANG Z S. Effects of different nitrogen sources on the activity and protein content of nitrate reductase and glutamine synthase in soybean[J]. Soybean Science, 2004(2): 143-146. |
| [30] |
余佳玲, 朱兆坤, 张振华, 舒佳宾, 杨春, 宋海星, 官春云. 不同供氮条件下谷氨酰胺合成酶与谷氨酸合成酶对油菜氮素再利用的影响[J]. 作物杂志, 2014(6): 81-85. DOI:10.16035/j.issn.1001-7283.2014.06.017 YU J L, ZHU Z K, ZHANG Z H, SHU J B, YANG C, SONG H X, GUAN C Y. Effects of glutamine synthase and glutamate synthase on nitrogen reuse in rapeseed under different nitrogen supply conditions[J]. Crop Journal, 2014(6): 81-85. DOI:10.16035/j.issn.1001-7283.2014.06.017 |
| [31] |
陈继康, 谭龙涛, 喻春明, 朱爱国, 陈平, 王延周, 朱涛涛, 熊和平. 不同氮素水平对饲用苎麻氮代谢关键酶的影响[J]. 草业学报, 2017(10): 207-218. CHEN J K, TAN L T, YU C M, ZHU A G, CHEN P, WANG Y Z, ZHU T T, XIONG H P. Effects of different nitrogen levels on key enzymes of nitrogen metabolism in ramie[J]. Acta Herba Sinica, 2017(10): 207-218. |
| [32] |
潘玲玲. 黄瓜CsNR基因的克隆、遗传转化及在硝酸盐胁迫下的功能分析[D]. 泰安: 山东农业大学, 2017. PAN L L. Cloning, genetic transformation and functional analysis of CsNR gene in cucumber under nitrate stress[D]. Taian: Shandong Agricultural University, 2017. |
| [33] |
张国英. 不同氮素水平处理对水稻碳氮代谢关键酶GS和GDH活性及表达的影响[D]. 福州: 福建农林大学, 2012. ZHANG G Y. Effects of different nitrogen levels on the activity and expression of GS and GDH, key enzymes of carbon and nitrogen metabolism in rice[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012. |
| [34] |
赵双双, 刘雷, 何永刚, 蔡海亚, 章志宏. 氮胁迫条件下水稻理想株型基因ipa1对氮代谢的影响[J]. 湖北农业科学, 2017, 56(8): 1427-1431. DOI:10.14088/j.cnki.issn0439-8114.2017.08.007 ZHAO S S, LIU L, HE Y G, CAI H Y, ZHANG Z H. Effects of ipa1 gene on nitrogen metabolism of rice under nitrogen stress[J]. Hubei Agricultural Science, 2017, 56(8): 1427-1431. DOI:10.14088/j.cnki.issn0439-8114.2017.08.007 |
 2021, Vol. 48
2021, Vol. 48