文章信息
基金项目
- 深圳职业技术学院博士后启动基金(6019330008K)
作者简介
- 徐丹丹(1988—),女,博士,研究方向为植物病害绿色防控,E-mail:xudandan@szpt.edu.cn.
通讯作者
- 乔方(1970—),女,硕士,教授,研究方向为农产品贮藏加工,E-mail:qiaofang@szpt.edu.cn.
文章历史
- 收稿日期:2020-11-10
2. 华南农业大学植物保护学院 / 广东省微生物信号与作物病害防控重点实验室,广东 广州 510642
2. College of Plant Protection, South China Agricultural University/Guangdong Key Laboratory of Microbial Signals and Disease Control, Guangzhou 5 10642, China
【研究意义】小粒咖啡(Coffea arabica)又称阿拉比卡咖啡,占世界咖啡总产量的70%,广泛分布于世界各大咖啡产区。作为世界三大饮料(咖啡、可可、茶)之首,咖啡在中国的引进试种已有100多年的历史,主要集中种植于我国的云南、海南、广东和台湾地区[1]。广东省最早种植的是雷州半岛,因咖啡经济效益显著,种植面积逐年扩大,现在粤东和粤西均有种植;但是咖啡种植中病虫害的侵袭已成为阻碍咖啡产业发展的一大瓶颈。
【前人研究进展】咖啡炭疽病是影响小粒咖啡质量和产量的重要病害之一,主要为害咖啡叶片、枝条、果实。高温条件下,叶片边缘出现黑色圆形病斑,病斑中央呈灰白色,病斑外缘有黄色晕圈,叶背有同心轮纹,上有黑色小点;新鲜浆果感病时在果实向阳面出现深褐色灼伤凹陷斑,斑痕扩展形成不规则凹陷灼伤区,最后果皮干褐挂于枝上;旱季小树和弱树易感病,出现大量落叶,并伴随有枯枝症状[2]。多种炭疽菌可以引起咖啡炭疽病,Cao等报道了海南地区咖啡炭疽病的8种炭疽菌,分别为胶孢炭疽菌复合种(Colletotrichum gloeosporioides complexes)中的C. endophytica、C. fructicola、C. ledongense、C. siamense和C. tropicale,博宁炭疽菌复合种(C. boninense complexes)中的C. karstii和长直孢炭疽菌复合种(C. gigasporums complexes)的C. gigasporum[3];Cristóbal-Martínez等通过分离墨西哥咖啡发病的叶片、枝条和浆果上的病原菌,鉴定了5种炭疽菌:C. gigasporum、C. gloeosporioides、C. karstii、C. siamense和C. theobromicola[4];C. boninense、C. coffeanu、C. gloeosporioides能引起巴西咖啡的叶片和果实炭疽病[5]。
【本研究切入点】长期以来,化学防治仍然是防治炭疽病的主要措施,而关于炭疽病菌对多种农药产生抗性的报道屡见不鲜。巩佳莉等[6]报道咖啡炭疽病菌对代森锰锌和百菌清表现为高水平抗性;Chechi等[7]报道引起苹果炭疽病的暹罗炭疽菌C. siamense对嘧菌酯和甲基硫菌灵表现为抗性;Piccirillo等[8]发现引起香橙炭疽病的C. gloeosporioides菌株对嘧菌酯存在不同程度的抗性。广东地区的咖啡栽培种植处于增长阶段,且尚未有该地区咖啡炭疽病的相关研究报道,因此,针对该地区炭疽病原的研究至关重要。【拟解决的关键问题】本试验对采自广东汕尾咖啡基地的炭疽病样本进行病原菌的分离鉴定及防治药剂的室内筛选测定,以期为当地咖啡炭疽病的有效防控提供科学依据。
1 材料与方法 1.1 试验材料2019年10月20日从广东海丰县湖畔咖啡种植基地(23°3′29″N,115°26′22″E)采集发病的咖啡样品。选用马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA)用于咖啡炭疽病菌的分离、纯化和培养。
1.2 病原菌的分离与纯化挑选典型发病的病叶,在病健交界处切取5 mm×5 mm的叶片组织块,于75% 乙醇(V/ V)中浸润10 s,随后用2% 的NaClO表面消毒2~3 min,然后用无菌蒸馏水冲洗3次,于无菌滤纸上晾干水分[9]。用无菌镊子将组织块转移至PDA平板上,于25 ℃黑暗条件下培养。待菌落产生橘红色粘孢团后,配制孢子悬浮液涂布于无菌的琼脂培养基上,于显微镜下挑取含有单一分生孢子的琼脂培养基于PDA培养基上培养获得单孢菌株,然后将纯化获得的菌株移至PDA斜面试管中保存。
1.3 形态学鉴定将单孢纯化后菌株接种于PDA培养基上,观察菌落性状,并定期测量各菌株在25 ℃下不同时间段的菌落直径,计算各菌株的生长速率;用Olympus BX41显微镜观察菌丝和分生孢子,随机选取60个分生孢子,测量分生孢子大小。
1.4 致病性测定将菌株接种于PDA培养基上25 ℃培养7 d后,挑取各菌株的橘红色粘孢团于无菌水中配制成浓度为105个/mL的孢子悬浮液。选取幼嫩的咖啡叶片,用无菌接种针刺伤后接种10 μL的孢子悬浮液,以接种无菌水作为对照,每个菌株接种15片咖啡叶片,3次重复。将所有处理的叶片置于保鲜盒中喷雾保湿,定期观察统计叶片的发病情况,并从病组织中再次分离病原菌,与原接种菌株进行比较。
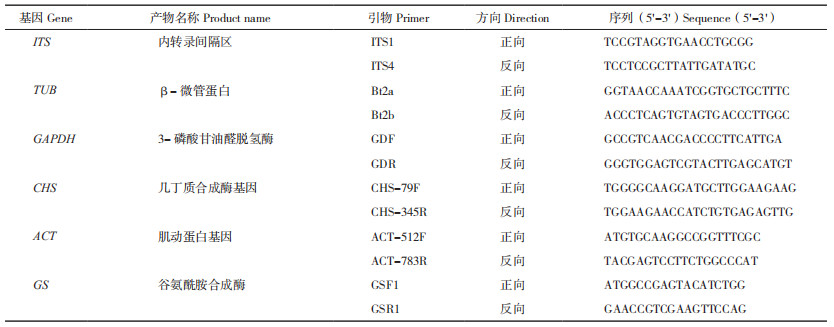
1.5 多基因系统学鉴定采用真菌基因组DNA提取试剂盒(Omega生物工程有限公司)提取菌丝DNA,用真菌通用引物ITS1/ITS4、特异引物Bt2a/Bt2b、GDF/GDR、CHS-79F/CHS-345R、ACT-512F/ACT-783R和GSF1/GSR1共6对引物分别对菌株的内转录间隔区(Internal Transcribed Spacer,ITS)[10]、β-微管蛋白基因(β-Tubulin,TUB2)[11]、3-磷酸甘油醛脱氢酶基因(Glyceraldehyde-3- phosphatedehydrogenase,GAPDH)[12]、几丁质合成酶基因(chitin synthase, CHS)[13]、肌动蛋白基因(Actin,ACT)和谷氨酰胺合成酶(Glutamine synthetase, GS)[14]进行PCR扩增,各序列扩增引物信息见表 1。PCR反应体系总体积为25 μL,包含DNA模板1 μL,正反向引物各1 μL(10 μmol/L),2×MasterMix 12.5 μL,以ddH2O补足至25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s,(ITS和TUB2:55 ℃;GAPDH:56 ℃;CHS和ACT:58 ℃;GS:54 ℃)退火30 s,72 ℃延伸45 s,共35个循环;最后72 ℃延伸7 min。
取5 μL上述PCR扩增产物于1% 琼脂糖凝胶电泳进行检测后将PCR产物送至北京六合华大基因科技有限公司广州分公司测序。将测得的基因序列与GenBank中的序列进行比对,下载相似性高的序列及其对应复合种的常见模式菌株序列,使用MEGA软件剪切后按照ITS-TUB2- GAPDH-CHS-ACT-GS的顺序首尾拼接,分析系统发育关系,采用邻接法(Neighbor-joining,NJ)构建系统进化树,以自展法(Bootstrap)进行检测,共循环1 000次。
1.6 杀菌剂抑菌活性测定供试药剂原药苯醚甲环唑(96.3%)、咪鲜胺(97%)、吡唑醚菌酯(98%)和甲基硫菌灵(97%)由华南农业大学植物细菌和杀菌研究室提供。将4种杀菌剂溶解于甲醇中配制得到原液,然后以倍比法加水稀释得到工作液,将各药剂工作液与PDA混合制成含有杀菌剂的PDA平板[15]。用孔径为5 mm的打孔器取菌丝块接种至PDA含药平板上,以加入等体积的甲醇作为对照,每个药剂浓度处理4次重复,25 ℃培养7 d后测量菌落直径,计算各杀菌剂菌丝生长抑制率和EC50值,绘制毒力回归方程。
2 结果与分析 2.1 病害症状炭疽病在咖啡各生长期均可发生,本研究主要采集发病的咖啡叶片。叶片感病多在叶尖和叶缘产生褐色病斑,随病斑的不断扩大,后期病斑中心呈灰褐色且具同心轮纹排列的黑色小点,边缘为暗褐色,其外缘有黄色晕圈;发病严重的则数个病斑交汇成大病斑,叶片干枯、脱落(图 1)。

|
| 图 1 田间咖啡叶片发病症状 Fig. 1 Diseased symptoms of Coffea arabica leaves in field A:叶尖;B:叶缘 A : Leat apex; B: Leaf margin |
2.2 形态学鉴定结果
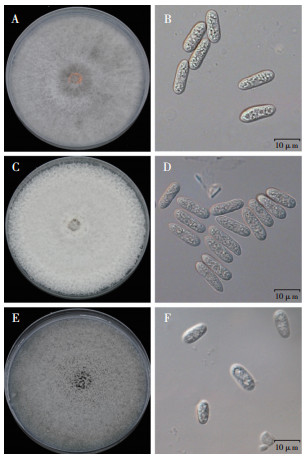
将分离得到的菌株单孢纯化后共计得到37株菌株,根据形态特征的相似性初筛得到9株炭疽病菌株,分别为CA-1、CA-2、CA-3、CA-6、CA-11、CA-12、CA-13、CA-16和CA- 22,其菌落性状分为3种不同类型。一种菌落正面产生灰白色的气生菌丝,菌丝平均生长速率为13.98 mm/d,在PDA培养基上培养7 d后可见橙色孢子堆产生(图 2A);分生孢子无色透明,一端钝圆,另一端钝圆或略细,一般具1~2个油球(图 2B);将CA-6选为代表菌株,其大小为14.46~17.88 μm×4.78~6.19 μm(av=16.2 μm×5.6 μm,n=60)。第二种菌落正面产生白色的气生菌丝,菌丝平均生长速率为15.12 mm/d(图 2C);分生孢子无色透明,一端钝圆,另一端钝圆或尖细,具2个油球(图 2D);将CA-16选为代表菌株,其大小为14.06~17.33 μm× 4.59~5.91 μm(av=15.9 μm×5.1 μm,n=60)。第三种菌落正面产生灰色的气生菌丝,菌丝致密,菌丝平均生长速率为14.23 mm/d(图 2E);分生孢子无色透明,两端钝圆,具2个油球(图 2F);将CA-3选为代表菌株,其大小为12.46~15.35 μm×5.13~7.25 μm(av=13.8 μm× 6.1 μm,n=60)。根据病原菌的形态特征,结合Weir等[16]和Damm等[17]的描述,菌株CA-6和CA-16与胶孢炭疽菌复合种(C. gloeosporioides complexes)相似,菌株CA-3与盘长孢状炭疽菌复合种(C. orchidearum complexes)相似。
|
|
图 2 代表菌株的菌落和分生孢子形态 Fig. 2 Colony and conidia morphology characteristics of representative strains A、B:菌株CA-6的菌落形态和分生孢子特征; C、D:菌株CA-16的菌落形态和分生孢子特征; E、F:菌株CA-3的菌落形态和分生孢子特征 A and B: the colony morphology and conidia characteristics of strain CA-6; C and D: the colony morphology and conidia characteristics of strain CA-16; E and F: the colony morphology and conidia characteristics of strain CA-3 |
2.3 致病性测定结果
将各菌株的分生孢子悬浮液回接至健康的咖啡叶片7 d后,各叶片穿刺处理点均呈现病斑直径不一的发病症状(图 3)。对照叶片不发病,仅在穿刺处理点有一褐色的氧化斑点,而9株炭疽菌接种处理的咖啡叶片均呈现褐色坏死性病斑;其中5株炭疽菌(CA-6、CA-12、CA-13、CA-16和CA- 22)的致病力强,病斑直径为19.2~25.5 mm;3株炭疽菌(CA-1、CA-2和CA-11)的致病力次之,病斑直径为6.8~9.5 mm;炭疽菌CA-3的致病力较弱,病斑直径为4.9~5.1 mm。

|
| 图 3 回接发病的咖啡叶片 Fig. 3 Diseased Coffea arabica leaves after inoculation |
2.4 菌株多基因系统进化树分析
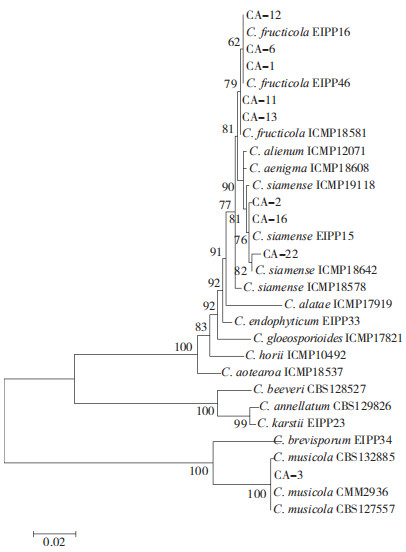
从构建的系统发育树(图 4)可以看出:5株菌(CA-1、CA-6、CA-11、CA-12和CA-13)与果生炭疽菌C. fructicola聚在一起,形成一个明显的分支;3株菌(CA-2、CA-16和CA-22)与暹罗炭疽菌C. siamense聚在一起,形成一个明显的分支;CA-3单独与芭蕉生炭疽菌C. musicola聚在一起;各分支间均有较高的支持率,因此确定测试的9株炭疽病菌分别为果生炭疽菌C. fructicola、暹罗炭疽菌C. siamense和芭蕉生炭疽菌C. musicola。
|
| 图 4 基于ITS、TUB2、GAPDH、CHS、ACT和GS基因的系统进化树分析 Fig. 4 Phylogenetic tree based on ITS, TUB2, GAPDH, CHS, ACT and GS genes |
2.5 不同杀菌剂对病原菌的毒力测定结果
2.5.1 不同杀菌剂对炭疽病菌菌丝生长的抑制效果 综合病原菌鉴定结果和致病力测定结果,分别选取致病性强的2株炭疽病菌C. fructicola CA-13和C. siamense CA-16进行杀菌剂毒力测定试验。利用生产上常用的4种杀菌剂进行菌丝生长的抑制试验,结果(表 2)表明:4种杀菌剂对2株待测炭疽病菌的菌丝生长抑制效果差异显著。咪鲜胺、吡唑醚菌酯和甲基硫菌灵3种杀菌剂抑菌效果显著,当其浓度为0.125 mg/L时对两株炭疽病菌的菌丝生长抑制率超过50%,是防治咖啡炭疽病的理想药剂。苯醚甲环唑对两株炭疽病菌的抑制作用次之,当其浓度为0.25 mg/L时对菌株CA-13和CA-16的菌丝生长抑制率分别为58.6% 和51.2%。

|
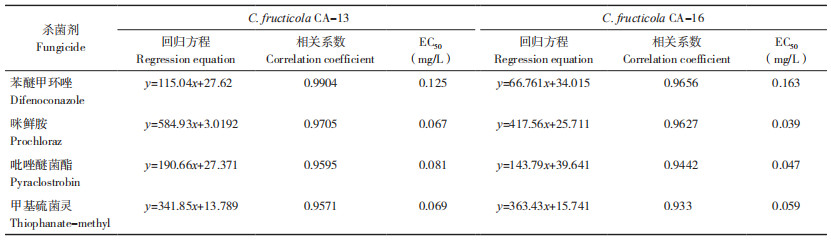
2.5.2 不同杀菌剂对病原菌的毒力 由表 3可知,4种杀菌剂均对两株强致病性咖啡炭疽病菌具有显著的抑制活性,从药剂的EC50值分析可知,咪鲜胺、吡唑醚菌酯和甲基硫菌灵的抑制作用极强,其对两株炭疽病菌菌株的EC50均小于0.1 mg/L,以咪鲜胺的毒力最强,对CA-13和CA-16的EC50分别为0.067、0.039 mg/L;苯醚甲环唑效果次之,其对CA-13和CA-16的EC50均大于0.1 mg/L。
|
3 讨论
本研究采用组织分离法得到病原菌株,单孢纯化后根据形态学特征,并结合ITS、TUB2、GAPDH、CHS、ACT和GS进行多基因系统学分析,证明分离得到的菌株分别为果生炭疽菌C. fructicola、暹罗炭疽菌C. siamense和芭蕉生炭疽菌C. musicola。通过柯赫氏法则验证所有分离得到的菌株均可侵染叶片,引发叶片炭疽症状,故本研究结果应是准确可靠的,这是关于果生炭疽菌C. fructicola、暹罗炭疽菌C. siamense和芭蕉生炭疽菌C. musicola 3种炭疽病菌复合侵染引起广东地区引起咖啡叶片炭疽病的首次报道,该病原的确定为广东咖啡叶片炭疽病的诊断和防治提供了理论依据。该研究对炭疽病原菌的鉴定与Cao等对海南地区咖啡炭疽病病原菌研究结果基本一致[3]。另外,本研究亦首次从咖啡叶片中分离到芭蕉生炭疽菌C. musicola,但是该菌株致病力较弱,故不作为病原菌进行药效试验测定。但是,芭蕉生炭疽菌C. musicola能引起芋头小果野蕉Musa acuminata[17]、Colocasia esculenta[18]和棉豆Phaseolus lunatus[19]的炭疽病,亦应引起重视。
果生炭疽菌C. fructicola和暹罗炭疽菌C. siamense同属于胶孢炭疽菌复合种C. gloeosporioides complex,是重要的炭疽病菌种群[16]。关于炭疽病的化学防治,苯丙咪唑类杀菌剂多菌灵和甲基硫菌灵通过抑制病原菌细胞β- 微管蛋白合成而阻碍正常的有丝分裂达到抑菌的效果[20],腈菌唑和三唑酮为真菌甾醇生物合成抑制剂,导致真菌细胞裂解死亡[21],上述4种杀菌剂为常用的广谱型药剂。本研究结果证明咪鲜胺、吡唑醚菌酯和甲基硫菌灵对两种炭疽病菌的抑菌效果最佳,其EC50均小于0.1 mg/L,该结果与巩佳莉的研究结果基本一致[6]。苯醚甲环唑对炭疽病菌CA-13和CA-16的EC50均大于0.1 mg/L,表明炭疽病菌对苯醚甲环唑有一定的抗性,该结果与宋丹丹等用三唑酮处理杨树炭疽病菌得出的结论一致[22]。由于试验所选4种杀菌剂均为炭疽病防治的常规杀菌剂,长期使用导致病原菌抗药性的产生,且试验多选咖啡基地旁有大量的荔枝园,本研究鉴定得到的暹罗炭疽菌C. siamense亦是荔枝炭疽病的重要病原菌[23],所以在防治咖啡炭疽病的同时亦应对荔枝炭疽病进行预防,降低病原菌的侵染源。
4 结论结合致病性接种、形态特征观察和多基因(ITS、TUB2、GAPDH、CHS、ACT和GS)系统学分析,鉴定广东咖啡叶片炭疽病的优势病原菌为果生炭疽菌C. fructicola和暹罗炭疽菌C. siamense;咪鲜胺、吡唑醚菌酯和甲基硫菌灵对果生炭疽菌C. fructicola和暹罗炭疽菌C. siamense的抑制作用极强,对两株炭疽病菌菌株的EC50均小于0.1 mg/L,为田间防治咖啡炭疽病时选择更多轮换药剂提供了参考。
| [1] |
陈鸿志, 曾晓鹏. 中国咖啡产业现状及发展对策[J]. 热带农业工程, 2011, 35(6): 23-25. CHEN H Z, ZENG X P. Present status and development measures of coffee industry in China[J]. Tropical Agricultural Engineering, 2011, 35(6): 23-25. |
| [2] |
郑肖兰, 贺春萍, 高亚男, 张广宁, 习金根, 郑金龙, 梁艳琼, 李锐, 吴伟怀, 易克贤. 咖啡炭疽病菌生物学特性及其毒力测定[J]. 热带农业科学, 2015, 35(12): 94-98. ZHENG X L, HE C P, GAO Y N, ZHANG G N, XI J G, ZHENG J L, LIANG Y Q, LI R, WU W H, YI K X. Biological characteristics and toxicity determination of the Colletotrichum gloeosporioides penz from Coffee arabica Linn[J]. Chinese Journal of Tropical Agriculture, 2015, 35(12): 94-98. |
| [3] |
CAO X R, XU X M, CHE H Y, WEST J S, LUO D Q. Characteristics and distribution of Colletotrichum species in coffee plantations in Hainan, China[J]. Plant Pathology, 2019, 68(6): 1146-1156. DOI:10.1111/ppa.13028 |
| [4] |
CRISTóBAL-MARTíNEZ A L, DE JESúS YáÑEZ-MORALES M, SOLANO-VIDAL R, SEGURA-LEóN O, HERNáNDEZ-ANGUIANO A M. Diversity of Colletotrichum species in coffee (Coffea arabica)plantations in Mexico[J]. European Journal of Plant Pathology, 2017, 147(3): 605-614. DOI:10.1007/s10658-016-1029-0 |
| [5] |
FREITAS R L, MACIEL-ZAMBOLIM E, ZAMBOLIM L, LELIS D T, CAIXETA E T, LOPES U P, PEREIRA O L. Colletotrichum boninense causing anthracnose on coffee trees in Brazil[J]. Plant Disease, 2013, 97(9): 1255. DOI:10.1094/PDIS-03-13-0229-PDN |
| [6] |
巩佳莉, 陆英, 贺春萍, 吴伟怀, 梁艳琼, 黄兴, 郑金龙, 习金根, 易克贤. 15种杀菌剂对咖啡炭疽菌的室内毒力测定//中国植物保护学会2019年学术年会论文集[C]. 2019: 243. GONG J L, LU Y, HE C P, WU W H, LIANG Y Q, HUANG X, ZHENG J L, XI J G, YI K X. Toxicity of fifteen fungicides to coffee Colletotrichum pathogen in laboratory//Proceeding of the 2019 annual conference of China society of plant protection[C]. 2019: 243. |
| [7] |
CHECHI A, STAHLECKER J, DOWLING M E, SCHNABEL G. Diversity in species composition and fungicide resistance profiles in Colletotrichum isolates from apples[J]. Pesticide Biochemistry and Physiology, 2019, 158: 18-24. DOI:10.1016/j.pestbp.2019.04.002 |
| [8] |
PICCIRILLO G, CARRIERI R, POLIZZI G, AZZARO A, LAHOZ E, FERNáNDEZ-ORTUÑO D, VITALE A. In vitro and in vivo activity of QoI fungicides against Colletotrichum gloeosporioides causing fruit anthracnose in Citrus sinensis[J]. Scientia Horticulturae, 2018, 236: 90-95. DOI:10.1016/j.scienta.2018.03.044 |
| [9] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 122-125. FANG Z D. Plant pathology research protocols[M]. Beijing: China Agriculture Press, 1998: 122-125. |
| [10] |
WHITE T J, BRUNS T, LEE S, TAYLOR J. Amplification and direct seqencing of fungal ribosomal RNA genes for phylogenetics//PCR Protocols: A guide to methods and applications[C]. 1990: 315-322.
|
| [11] |
GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61(4): 1323-1330. DOI:10.1128/AEM.61.4.1323-1330.1995 |
| [12] |
TEMPLETON M D, RIKKERINK E H A, SOLON S L, CROWHURST R N. Cloning and molecular characterization of the glyceraldehyde- 3-phosphate dehydrogenase-encoding gene and cDNA from the plant pathogenic fungus Glomerella cingulata[J]. Gene, 1992, 122(1): 225-230. DOI:10.1016/0378-1119(92)90055-T |
| [13] |
CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91(3): 553-556. |
| [14] |
STEPHENSON S, GREEN J R, MANNERS J M, MACLEAN D J. Cloning and characterisation of glutamine synthetase from Colletotrichum gloeosporioides and demonstration of elevated expression during pathogenesis on Stylosanthes guianensis[J]. Current Genetics, 1997, 31(5): 447-454. DOI:10.1007/s002940050228 |
| [15] |
张曼, 钱芳, 徐锦华, 刘广, 姚协丰, 任润生, 赵庆, 侯茜, 朱凌丽, 羊杏平. 葫芦砧木萎蔫病病原镰刀菌鉴定及其防治药剂的筛选[J]. 植物保护, 2019, 45(5): 232-236. DOI:10.16688/j.zwbh.2018395 ZHANG M, QIAN F, XU J H, LIU G, YAO X F, REN R S, ZHAO Q, HOU Q, ZHU L L, YANG X P. Identification of causal agent of Fusarium wilt disease in bottle gourd rootstock and fungicide screening[J]. Plant Protection, 2019, 45(5): 232-236. DOI:10.16688/j.zwbh.2018395 |
| [16] |
WEIR B S, JOHNSTON P R, DAMM U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology, 2012, 73: 115-180. DOI:10.3114/sim0011 |
| [17] |
DAMM U, SATO T, ALIZADEH A, GROENEWALD J Z, CROUS P W. The Colletotrichum dracaenophilum, C. magnum and C. orchidearum species complexes[J]. Studies in Mycology, 2019, 92: 1-46. DOI:10.1016/j.simyco.2018.04.001 |
| [18] |
VáSQUEZ-LóPEZ A, PALACIOS-TORRES R E, CAMACHO-TAPIA M, GRANADOS-ECHEGOYEN C, LIMA N B, VERA-REYES I, TOVAR-PEDRAZA J M, LEYVA-MIR S G. Colletotrichum brevisporum and C. musicola causing leaf anthracnose of taro (Colocasia esculenta) in Mexico[J]. Plant Disease, 2019, 103(11): 2963. DOI:10.1094/PDIS-05-19-0967-PDN |
| [19] |
CAVALCANTE G, BARGUIL B M, VIEIR A W, LIMA W G, MICHEREFF S J, DOYLE V P, CAMARA M. Diversity, prevalence, and virulence of Colletotrichum species associated with lima bean in Brazil[J]. Plant Disease, 2019, 103(8): 1961-1966. DOI:10.1094/PDIS-11-18-2002-RE |
| [20] |
FUJIMURA M, KAMAKURA T, INOUE H, YAMAGUCHI I. Amino-acid alterations in the β-tubilin gene of Neurospora crassa that conferresistance to carbendazim and diethofencarb[J]. Current Genetics, 1994, 25(5): 418-422. DOI:10.1007/BF00351780 |
| [21] |
张晓勇, 李树江, 王亮, 杨友联. 山茶灰斑病病原菌鉴定及防治药剂初步筛选[J]. 植物保护, 2019, 45(4): 209-215. DOI:10.16688/j.zwbh.2018331 ZHANG X Y, LI S J, WANG L, YANG Y L. Pathogen identification of gray leaf spot on Camelia japonica and screening of fungicides[J]. Plant Protection, 2019, 45(4): 209-215. DOI:10.16688/j.zwbh.2018331 |
| [22] |
宋丹丹, 张伊莹, 张琳婧, 王毓, 李肖宇, 刘西莉, 陈磊, 田呈明. 杨树炭疽病菌对多菌灵及3种DMIs杀菌剂的敏感性[J]. 农药学学报, 2016, 18(5): 567-574. DOI:10.16801/j.issn.1008-7303.2016.0079 SONG D D, ZHANG Y Y, ZHANG L J, WANG Y, LI X Y, LIU X L, CHEN L, TIAN C M. Sensitivities of poplar anthracnose fungi isolates to carbendazim and three C-14α-demethylation inhibitors[J]. Chinese Journal of Pesticide Science, 2016, 18(5): 567-574. DOI:10.16801/j.issn.1008-7303.2016.0079 |
| [23] |
LING J F, SONG X B, XI P G, CHENG B P, CUI Y P, CHEN X, PENG A T, JIANG Z D, ZHANG L H. Identification of Colletotrichum siamense causing litchi pepper spot disease in mainland China[J]. Plant Pathology, 2019, 68(8): 1533-1542. DOI:10.1111/ppa.13075 |
 2021, Vol. 48
2021, Vol. 48