文章信息
基金项目
- 泉州市科技计划项目(2015Z72);泉州市高端海洋人才引进项目(QW201602)
作者简介
- 田力(1986—),男,助理实验师,研究方向为实验动物学,E-mail:rextian520@126.com.
通讯作者
- 温扬敏(1979—),男,博士,副教授,研究方向为细胞与遗传学,Email:ymwen4979@126.com.
文章历史
- 收稿日期:2020-09-18
【研究意义】小球藻(Chlorella pyrenoidosa)是广泛分布于淡水和海水环境中的单细胞微藻,生长快、易培养,富含多糖、蛋白质、叶绿素、多不饱和脂肪酸和微量元素等, 被国际粮农组织列为理想的健康食品[1]。早在19世纪70年代,小球藻作为保健食品和治疗某些疾病的辅助产品在日本得到广泛应用。但由于早期关于小球藻的保健和药理机制不明确,以及小球藻养殖和加工技术不成熟,当时并没有形成产业化。小球藻培养、采收、加工处理等技术的发展以及保健作用机制研究的深入,为小球藻食品和保健产品研发奠定了基础,小球藻已成为最重要的商业微藻之一[2]。小球藻不仅具有抗氧化、降血糖、降血脂、排毒作用等保健功能,还具有独特的海藻风味,其作为一种新资源食品原料越来越受到青睐,在功能食品领域得到广泛应用[3]。目前市面上可见以小球藻为原料的饼干、饮料、面条、糖果、冰淇淋等食品,包括全小球藻蛋白制剂、多糖制剂、胶囊、片剂等[4]。
【前人研究进展】正常人体肠道内有约1014个微生物,与人体形成共生的复杂生态系统。肠道菌群被称为体外器官,不仅在食物消化吸收中发挥重要作用,同时参与机体健康的维系,肠道菌群失调与疾病的发生密切相关[5]。小球藻等微藻不仅具有极高营养价值,还能调节微生物增殖功能。研究表明,小球藻能体外抑制溶壁微球菌(Micrococcus lysodeikticus)、解藻朊酸弧菌(Vibrio alginolyiicus)、表皮葡萄球菌(Staphylococcus epidermidis)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)等增殖[6],具有体外促进嗜热链球菌(Streptococcus thermophilus)、保加利亚乳酸杆菌(Lactobacillus bulgaricus)等益生菌增殖的功能[7]。小球藻富含大量膳食纤维,能加快肠道蠕动与新陈代谢,从小球藻中分离的小球藻活性生长因子(Chlorella Growth Factor,CGF)能促进人体肠道中双岐杆菌和乳酸菌等益生菌的繁殖,有望开发成益生元等功能食品和营养强化剂[8]。
【本研究切入点】目前关于小球藻对肠道菌群的研究主要集中在小球藻在体外对肠道菌的抑制或促进作用上,不能全面反映小球藻对体内肠道菌群的影响。【拟解决的关键问题】本研究采用高通量测序技术研究蛋白核小球藻对小鼠抗氧化和肠道细菌的影响,以期为基于改善肠道菌群研发新型小球藻功能性食品提供理论依据。
1 材料与方法 1.1 试验材料SPF级昆明小鼠购自北京华阜康生物公司。蛋白核小球藻粉由福建福清新大泽螺旋藻有限公司提供(每100 g提供能量1 532 kJ、蛋白质56.4 g、脂肪0.9 g、碳水化合物19.2 g),总抗氧化(Total Antioxidant Activity,T-AOC)能力、超氧化物歧化酶(Superoxide Dismutase,SOD)活性和蛋白质浓度检测试剂盒购自南京建成生物生物工程研究所公司,小鼠粪便DNA提取E.Z.N.A.® Stool DNA Kit购自普洛麦格(北京)生物技术有限公司。
主要仪器设备:高速冷冻离心机,上海卢湘仪离心机仪器有限公司;超纯水器,四川优普超纯科技有限公司;电泳仪,北京六一仪器厂;酶标仪,赛默飞技术(北京)有限公司;凝胶成像分析系统,北京六一生物科技有限公司;PCR仪,美国应用生物系统(ABI)公司。
1.2 试验方法1.2.1 动物试验 SPF级昆明小鼠于25(±1)℃下12 h昼夜交替适应性饲养1周。根据原卫生部有关蛋白核小球藻作为新资源食品食用量≤20 g/d的规定,确定小鼠蛋白核小球藻灌胃剂量。将小鼠随机分为5组,每组10只。正常对照(CK1):灌胃等体积生理盐水(N);VE对照(CK2):灌胃100 mg/kg VE;低剂量处理:灌胃100 mg/kg小球藻粉;中剂量处理:灌胃150 mg/kg小球藻粉;高剂量处理:灌胃200 mg/kg小球藻粉。每只小鼠每次灌胃0.2 mL,每天上午9:00给药,连续3周。试验开始和结束时称小鼠体重,试验于2019年10—12月在泉州医学高等专科学校SPF级动物实验室进行。
1.2.2 样品采集 末次给药24 h后,分别收集单只小鼠粪便,提取DNA,进行肠道菌群分析。麻醉后,心脏采血,取肝组织,测定血清和肝脏组织T-AOC、SOD活性。
1.2.3 小鼠肠道菌分析 每组小鼠粪便随机选择4个样品提取DNA,以小鼠粪便DNA为模板,采用文献[9]中的引物特异性扩增16S rDNA的V3~V4区,扩增体系与反应条件参照文献[10]。使用Invitrogen核酸/ 蛋白质定量荧光计Qubit 〔赛默飞技术(北京)有限公司〕对扩增文库进行定量。将扩增DNA浓度2 nmol/L以上样品置于Illumina NovaSeq平台上机测序(由杭州联川生物技术股份有限公司完成)。对测序原始读取数据进行质量过滤,获得高质量的clean data。使用扩增子序列变异体(Amplicon Sequence Variants,ASV)的概念构建类可操作分类单元(Operational Taxonomic Units,OTUs);基于OUTs结果,用QIIME2软件(http://qiime.org/)计算α多样性指数,并进行主成分分析(Principal Component Analysis,PCA)[11]。使用SILVA(Release 132,https://www.arb-silva.de/documentation/release-132/)数据库[12]开展物种分类及后续分析,使用R包云工具绘制相关图片。
试验数据采用独立样本t检验进行组间比较。
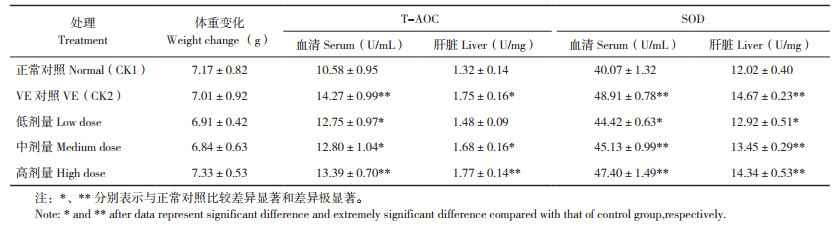
2 结果与分析 2.1 小球藻对小鼠体重及抗氧化酶活性的影响试验过程中小球藻各剂量处理小鼠皮毛光滑、行动饮食和粪便均正常,无死亡。从表 1可知,各处理小鼠体重变化差异不显著,表明小球藻对小鼠无不良影响。
|
细胞生命活动过程会不断生成超氧阴离子、羟自由基和过氧化氢等自由基,一定浓度的自由基是机体正常生命活动所必需的,但过多自由基引起的损伤与多种疾病的发生发展密切相关,抗氧化酶系统能有效清除细胞中的自由基,保护细胞免受损伤[13]。从表 1可知,小鼠T-AOC和SOD活性均随小球藻浓度增加而增大,且均高于正常对照。除肝脏T-AOC外,各处理小鼠抗氧化指标均显著高于正常对照,其中小球藻中剂量、高剂量处理小鼠T-AOC和SOD活性均比正常对照极显著提高,表明小球藻能提高小鼠抗氧化活性。
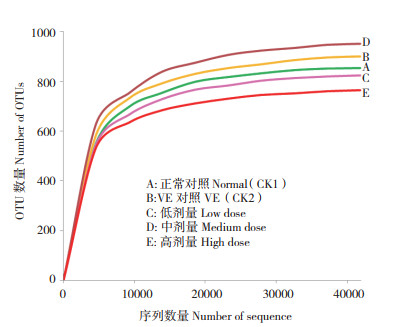
2.2 小球藻对小鼠肠道菌的影响2.2.1 小球藻对小鼠肠道菌多样性影响 稀释曲线能说明样本的测序数据量是否足以反映环境中的物种多样性。从各处理样品的稀释曲线(图 1)可以看出,随序列数量增加曲线趋于平缓,表明测序量趋于饱和, 继续增加测序量对物种多样性无影响,可以反映样本中绝大多数微生物多样性信息。
|
| 图 1 不同处理小鼠粪便菌群稀释曲线 Fig. 1 Rarefaction curve of mice faecal microflora under different treatments |
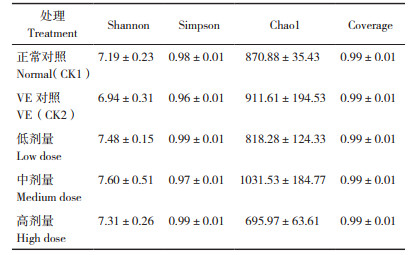
Alpha多样性可通过群落丰富度指数和群落多样性指数反映物种的丰富度和均匀度。从表 2可知,各处理Alpha多样性指数(Shannon、Simpson、Chao1和Coverage)与正常对照之间没有显著差异,表明小球藻对小鼠细菌的丰富度和均匀度无显著影响。
|
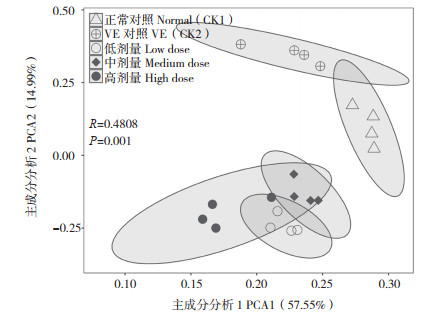
Beta多样性是指不同环境群落之间的物种差异性,可通过PCA等方法计算环境样品间的距离矩阵,样品在PCA图中的距离越接近表明物种组成越相似。本研究PCA分析结果(图 2)显示,5个处理小鼠肠道细菌相似性差异显著(P为0.01)。小球藻低剂量、中剂量、高剂量处理小鼠肠道细菌群落与正常对照相比差异显著(P分别为0.032、0.032、0.031),表明灌胃小球藻能影响小鼠肠道细菌群落结构。
|
| 图 2 不同处理的小鼠粪便菌群主成分分析 Fig. 2 Principal component analysis of mice faecal microflora under different treatments |
2.2.2 小球藻对小鼠肠道细菌门水平影响 微藻中的蛋白质、糖类、维生素和不饱和脂肪酸等是细菌生长的理想营养源,具有促进有益菌增殖的功能。拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)是小鼠肠道菌群的两大主导菌群,与未消化食物代谢有关[14]。从各处理小鼠肠道菌在门水平的分布(图 3)可知,肠道优势菌为拟杆菌门和厚壁菌门,两个门细菌数量均占各样品细菌总量的80% 以上。与正常对照比较,小球藻各剂量处理小鼠肠道菌的拟杆菌门和厚壁菌门占比均有所下降,而疣微菌门比例显著增加,其结果与服用螺旋藻对小鼠肠道菌群影响相似[15]。
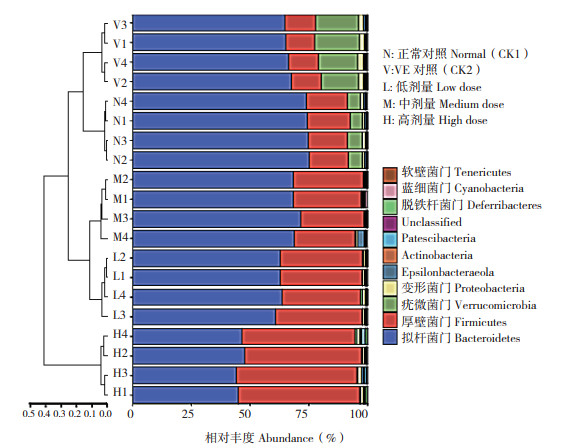
|
| 图 3 不同处理的小鼠粪便菌群门水平微生物种类分布 Fig. 3 Distribution of microbial species of mice faecal microflora at phylum level under different treatments |
2.2.3 小球藻对小鼠肠道细菌科水平影响 本研究中小鼠肠道细菌在科水平上丰度占优势的细菌为鼠杆菌科(Muribaculaceae)、毛螺菌科(Lachnospiraceae)、瘤胃菌科(Ruminococcaceae)、拟杆菌科(Bacteroidaceae)(图 4),占总细菌丰度的70% 以上。与正常对照比较,小球藻各剂量处理小鼠肠道细菌Muribaculaceae的相对丰度显著减少,而Lachnospiraceae和Ruminococcaceae相对丰度显著增加,表明服用小球藻后小鼠的肠道菌在科水平上发生显著改变。
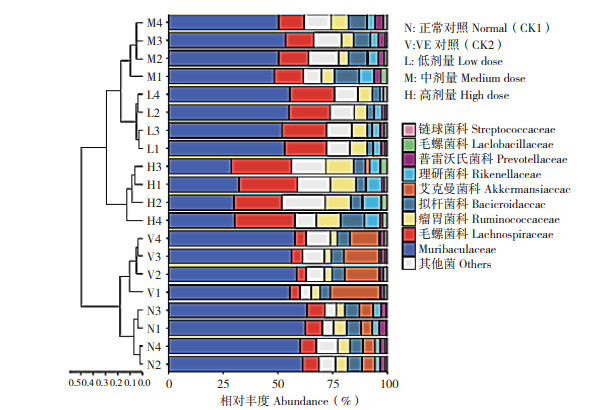
|
| 图 4 不同处理的小鼠粪便菌群科水平微生物种类分布 Fig. 4 Distribution of microbial species of mice faecal microflora at family level under different treatments |
2.2.4 差异菌分析 为分析小球藻对肠道菌的影响,对各剂量处理与正常对照之间小鼠肠道细菌进行两两比较,结果(图 5)显示,服用小球藻对小鼠肠道细菌影响较大的细菌包括艾克曼菌属(Akkermansia)、拟杆菌属(Bacteroides)、乳酸杆菌属(Lactobacillus)和Muribaculum等。与正常对照比较,小球藻各剂量处理拟杆菌和乳酸杆菌属相对丰度均比正常对照显著增加,而Akkermansia和Muribaculum相对丰度显著减少,表明服用小球藻对小鼠肠道细菌产生显著影响。VE是一种常见抗氧化剂,不仅能提高机体抗氧化活性,还能影响小鼠肠道乳酸菌属、梭菌属等细菌丰度,具有改善肠道菌群功能[16]。本研究结果显示,与正常对照比较,服用VE的小鼠肠道Akkermansia、Bacteroides等相对丰度显著增加,而另枝菌属(Alistipes)、Muribaculum等相对丰度显著减少,关于VE功能与肠道菌的关系有待进一步研究。
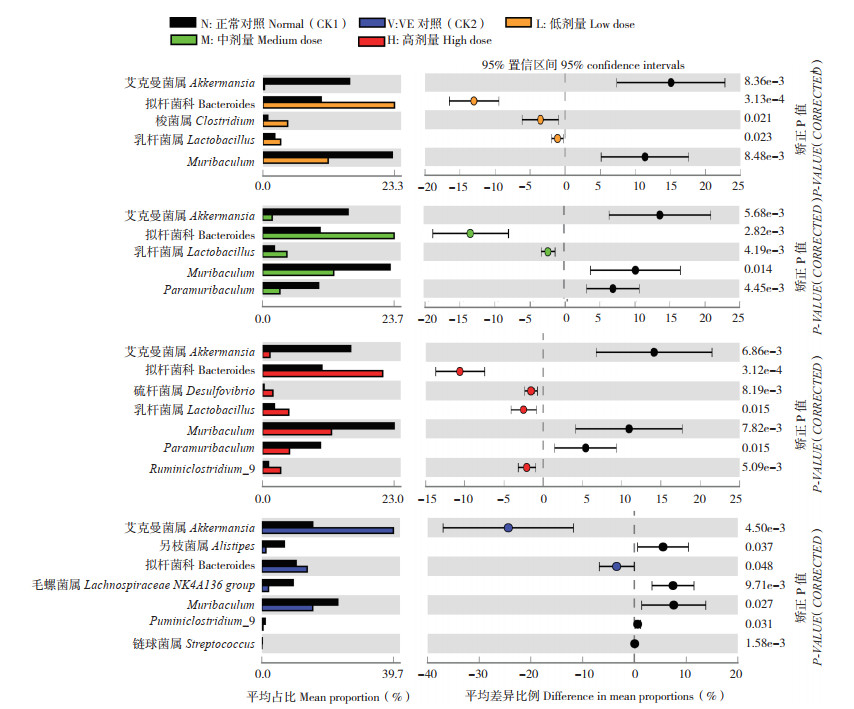
|
| 图 5 正常对照与各处理菌群差异分析 Fig. 5 Analysis of the microflora difference between normal group and experimental groups |
3 讨论
肠道菌群是维持机体健康不可或缺的重要因素,对宿主营养消化、能量转换、免疫调节等生理过程发挥重要作用。正常肠道菌群主要包括双歧杆菌、拟杆菌、乳酸菌、梭菌、肠杆菌、肠杆菌等[17-18]。研究显示,肠道菌群与肥胖症、糖尿病、心血管疾病等密切相关,而且肠道菌群能通过母体垂直传播遗传给下一代,维持肠道菌群平衡对保持人体的正常生理功能极其重要[19]。肠道菌群受到宿主基因、年龄、药物使用、环境、生活方式、饮食习惯等多重因素影响,其中通过合理膳食可促进肠道微生物定殖。调节肠道菌群促进宿主健康具有易于控制、操作性强等优势[20]。因此,研究不同食物对肠道菌群的影响,能为通过饮食改善肠道菌群、促进人体健康奠定理论基础。
小球藻有良好的微生态学效应,且细胞壁不含有纤维素而易于消化,是理想的益生元[1],但从肠道微生态的角度来研发小球藻类功能食品研究较少。本试验分析蛋白核小球藻对小鼠肠道细菌多样性及结构的影响,结果显示,小鼠灌胃小球藻后肠道乳酸杆菌属(Lactobacillus)和拟杆菌属(Bacteroides)相对丰度比正常对照显著增加。乳酸杆菌和拟杆菌是常见益生菌,其中乳酸菌能发酵产酸降低肠道pH值而防止有害菌定殖、改变肠道中短链脂肪酸的组成及数量和调节免疫功能等,对维护机体健康具有重要作用[21];拟杆菌属细菌能抑制一些有害菌群的黏附与侵袭,能迅速恢复宿主失衡的肠道微生态系统,维持肠道平衡以及改善宿主免疫力[22]。本试验结果表明,小球藻能提高小鼠肠道细菌有益菌的相对丰度,促进机体健康,这与程宇娇等[15]关于螺旋藻对腹泻模型小鼠肠道菌群的影响结果类似。Muribaculum与冠心病、糖尿病和应急焦虑等疾病相关。刘程鹏等[23]研究表明,糖尿病小鼠Muribaculum丰度增大,给小鼠灌胃功能食品后Muribaculum丰度减少。本试验结果显示,小鼠服用小球藻后Muribaculum丰度显著减少,表明服用小球藻除能增加肠道有益菌丰度外,还能减少Muribaculum等有害菌丰度。
生物细胞不断地产生自由基,过多自由基未能及时清除将对细胞产生损伤,进而导致疾病发生,及时清除过量自由基对维持个体健康至关重要[24]。抗氧化剂能清除自由基,保护细胞免受自由基损伤。由于合成抗氧化剂存在毒性甚至致癌风险等,目的,寻找天然、高效、低毒的天然抗氧化剂逐步取代合成抗氧化剂是必然趋势[25]。小球藻含有丰富的叶绿素、VC、VE、β- 胡萝卜素等抗氧化活性成分,是开发天然抗氧化剂的理想原料[26]。魏文志等[27]研究表明,从小球藻中提取的糖蛋白具有较强的体外清除羟自由基和超氧阴离子能力,且清除率随糖蛋白浓度增加而增大。本试验结果显示,小球藻能提高小鼠血液和肝脏总抗氧化和SOD活性,这与史瑞琴等[28]研究小球藻多糖口服液抗氧化活性结果相似,表明小球藻可显著提高小鼠的抗氧化能力。生物体的抗氧化能力受肠道菌群影响,肠道菌群中的兼性厌氧菌体内含有抗氧化酶类,如肠道乳酸杆菌分泌的胞外多糖能提高小鼠抗氧化酶活性,缓解衰老小鼠氧化应激,改善健康状况[29]。小球藻的抗氧化活性可能与改善肠道菌有关。
4 结论蛋白核小球藻能显著提高小鼠总抗氧化(T-AOC)能力和超氧化物歧化酶(SOD)活性,增强抗氧化能力。口服小球藻小鼠肠道细菌Alpha多样性指数与正常对照之间无显著差异,而Beta多样性与正常对照之间差异显著。通过菌群差异分析,在众多差异菌中发现口服小球藻小鼠乳酸杆菌、拟杆菌等有益菌丰度增加,而Muribaculum等有害菌丰度减少。小球藻能影响小鼠肠道菌群结构、改善肠道环境、促进机体健康,为基于改善肠道菌群研发新型小球藻功能性食品提供依据。可见,小球藻具有抗氧化活性,同时也能影响肠道细菌的构成,关于小球藻抗氧化活性与肠道菌群关系以及相关机制有待进一步研究。
| [1] |
PANAHI Y, DAR B V, JOWZI D, BEIRAGHDAR F, SAHEBKAR A. Chlorella vulgaris: a multifunctional dietary supplement with diverse medicinal properties[J]. Current Pharmaceutical Design, 2015, 22(2): 164-173. DOI:10.2174/1381612822666151112145226 |
| [2] |
SZABO N, MATULKA R, CHAN T, TERES C. Safety evaluation of whole algal in protein(wap)from chlorella protothecoides[J]. Food and Chemical Toxicology, 2013, 59(9): 34-45. DOI:10.1016/j.fct.2013.05.035 |
| [3] |
林丽云, 孙恢礼, 翁世兵, 吴园涛. 海洋生物新材料中益生元的开发与应用[J]. 现代食品科技, 2005, 21(4): 115-117. DOI:10.13982/j.mfst.1673-9078.2005.04.035 LIN L Y, SUN H L, WENG S B, WU Y T. Exploitation and application of prebiotics from marine organisms[J]. Guangzhou Food Science and Technology, 2005, 21(4): 115-117. DOI:10.13982/j.mfst.1673-9078.2005.04.035 |
| [4] |
张旗, 尚小玉, 王娜, 闫桂强, 史珅. 小球藻营养活性研究进展[J]. 食品研究与开发, 2015(13): 139-143. DOI:10.3969/j.issn.1005-6521.2015.13.037 ZHANG Q, SHANG X Y, WANG N, YAN G Q, SHI K. The research progress on nutrition activity of chlorella[J]. Food Research and Development, 2015(13): 139-143. DOI:10.3969/j.issn.1005-6521.2015.13.037 |
| [5] |
刘瑞雪, 李勇超, 张波. 肠道菌群微生态平衡与人体健康的研究进展[J]. 食品工业科技, 2016, 37(6): 383-387. DOI:10.13386/j.issn1002-0306.2016.06.068 LIU R X, LI Y C, ZHANG B. Research progress on gut microbiota homeostasis and human health[J]. Science and Technology of Food Indu stry, 2016, 37(6): 383-387. DOI:10.13386/j.issn1002-0306.2016.06.068 |
| [6] |
席波, 宋东辉, 孙晶, 刘凤路, 邸富荣. 十种微藻粗多糖的抑菌作用及海水小球藻粗多糖的抗氧化活性[J]. 天津科技大学学报, 2015, 30(5): 20-25. DOI:10.13364/j.issn.1672-6510.20140140 XI B, SONG D H, SUN J, LIU F L, DI F R. Anti-microbial activities of crude polysaccharide extracts from ten species of microalgae and the antioxidant activities of crude polysaccharide extracts from marine Chlorella vulgaris[J]. Journal of Tianjin University of Science and Technology, 2015, 30(5): 20-25. DOI:10.13364/j.issn.1672-6510.20140140 |
| [7] |
王晓晴, 王榆元, 周春宏, 杨新娟, 曾晓雄. 添加小球藻和几种低聚糖对益生菌增殖和酸奶品质的影响[J]. 食品科学, 2012, 33(7): 158-162. DOI: 10.1002-6630(2012)07-0158-05. WANG X Q, WANG Y Y, ZHOU C Y, YANG X J, ZHENG X. Effects of oligo saccharides and chlorella on the growth of probiotics and quality of chlorella yogurt[J]. Food Science, 2012, 2012, 33(7): 158-162. DOI: 10.1002-6630(2012)07-0158-05. |
| [8] |
薄香兰, 刘兴, 窦勇, 贾旭颖, 高金伟, 周文礼. 小球藻生长因子CGF的研究与应用进展[J]. 天津农学院学报, 2018, 25(1): 86-89. DOI:10.19640/j.cnki.jtau.2018.01.019 BO X L, LIU X, DOU Y, JIA X Y, GAO J W, ZHOU W L. Advances in research and application of Chlorella growth factor CGF[J]. Journal of Tianjin Agricultural University, 2018, 25(1): 86-89. DOI:10.19640/j.cnki.jtau.2018.01.019 |
| [9] |
WALTERS W, HYDE E R, BERGLYONS D, ACKERMANN G, HUMPHREY G, PARADA A, GILBERT J A, JANSSON J K, CAPORASO J, FUHRMAN J A, APPRILL A, KNIGHT R. Improved bacterial 16S rRNA gene(v4 and V4-5)and fungal internal transcribed spacer marker gene primers for microbial community surveys[J]. Msystems, 2017(1): 9-15. DOI:10.1128/mSystems.00009-15 |
| [10] |
ZHANG X, HERGER A G, REN Z, LI X X, CUI Z J. Resistance effect of flavonols and toxicology analysis of hexabromocyclododecane based on soil-microbe-plant system[J]. Chemosphere, 2020, 257(10): 127-136. DOI:10.1016/j.chemosphere.2020.127248 |
| [11] |
BOLYEN E, RIDEOUT J R, DILLON M R, NICHOLAS A, BOKULICH J, CAPORASO G. Author correction: reproducible, interactive, scalable and extensible microbiome data science using QⅡME2[J]. Nature Biotechnology, 2019, 37(8): 852-857. DOI:10.1038/s41587-019-0209-9 |
| [12] |
CHRISTIAN Q, ELMAR P, PELIN Y, JAN G, TIMMY S, PABLO Y, JÖRG P, FRANK G. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(1): 590-596. DOI:10.1093/nar/gks1219 |
| [13] |
PARAVISINI L, PETERSON D. Role of reactive carbonyl species in non-enzymatic browning of apple juice during storage[J]. Food Chemistry, 2018, 245(2): 1010-1017. DOI:10.1016/j.foodchem.2017.11.071 |
| [14] |
LEY R, TURNBAUGH P, KLEIN S, KLEIN S, GORDON J. Human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a |
| [15] |
程宇娇, 马浩天, 毛雪, 朱晓丽, 葛保胜, 李润植, 崔红利. 螺旋藻多糖对便秘小鼠肠道酶活性及微生物菌群的调节作用[J]. 激光生物学报, 2019, 28(6): 563-570. DOI:10.3969/j.issn.1007-7146.2019.06.013 CHENG Y J, MA H T, MAO X, ZHU X L, GE B S, LI R Z, CUI H L. Regulation of Spirulina polysaccharide on intestinal enzyme activity and microbial Flora in constipation mice[J]. Acta Laser Biology Sinica, 2019, 28(6): 563-570. DOI:10.3969/j.issn.1007-7146.2019.06.013 |
| [16] |
SCHAFFLE R H, HERLEMANN D P, KLINITZKE P, BERLIN P, KREIKEMEYER B, JASTER R, LAMPRECHT G. Vitamin D administration leads to a shift of the intestinal bacterial composition in Crohn's disease patients, but not in healthy controls[J]. Journal of Digestive Diseases, 2018, 19(4): 225-234. DOI:10.1111/1751-2980.12591 |
| [17] |
陈祚, 李苏宁, 王馨, 张林峰, 邵澜, 田野, 王增武. 我国中年人群高血压、超重和肥胖的发病率及其与心血管事件的关系[J]. 中华心血管病杂志, 2020, 48(1): 47-53. DOI:10.3760/cma.j.issn.0253-3758.2020.01.005 CHEN Z, LI S N, WANG X, ZHANG L F, SHAO L, TIAN Y, WANG Z W. The incidence of hypertension, overweight, and obesity and relationship with cardiovascular events among middle-aged Chinese: 6 years follow-up results[J]. Chinese Journal of Cardiology, 2020, 48(1): 47-53. DOI:10.3760/cma.j.issn.0253-3758.2020.01.005 |
| [18] |
ANDREW M H, TAICHI S A, MEGAN P R, MICHAEL N W. Transmission modes of the mammalian gut microbiota[J]. Science, 2018, 362(6413): 453-457. DOI:10.1126/science.aat7164 |
| [19] |
聂启兴, 胡婕伦, 钟亚东, 聂少平. 几类不同食物对肠道菌群调节作用的研究进展[J]. 食品科学, 2019, 40(11): 321-328. DOI:10.7506/spkx1002-6630-20180113-171 NIE Q X, HU J L, ZHONG Y D, NIE S P. Recent progress in understanding the regulation of gut microbiota by several different kinds of food[J]. Food Science, 2019, 40(11): 321-328. DOI:10.7506/spkx1002-6630-20180113-171 |
| [20] |
MARTEL C, GEORGES D, BRAY F, FERLAY J M, CLIFFORD J. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis[J]. The Lancet Global Health, 2020, 8(2): 1-18. DOI:10.1016/S2214-109X(19)30488-7 |
| [21] |
QI H, LI Y, YUN H, ZHANG T, HUANG Y, ZHOU J, YAN H, WEI J, LIU Y, ZHANG Z, GAO Y, CHE Y, SU X, ZHU D, ZHANG Y, ZHONG J, YANG R. Lactobacillus maintains healthy gut mucosa by producing L-Ornithine[J]. Communications Biology, 2019, 17(2): 12-23. |
| [22] |
李亚丹, 任宏伟, 吴彦彬, 边艳青. 拟杆菌与肠道微生态[J]. 微生物学通报, 2008, 35(2): 281-285. DOI:10.3969/j.issn.0253-2654.2008.02.023 LI Y D, REN H W, WU Y B, BIAN Y Q. Bacteroides and gut microbial ecology[J]. Microbiology, 2008, 35(2): 281-285. DOI:10.3969/j.issn.0253-2654.2008.02.023 |
| [23] |
刘程鹏, 刘丽坤, 周琪, 辛毅, 张炳强, 张利龙, 许尧, 吴大畅. 组方食品对2型糖尿病小鼠血糖及肠道菌群的影响[J]. 中国微生态学杂志, 2018, 30(7): 781-784. DOI:10.13381/j.cnki.cjm.201807008 LIU C P, LIU L K, ZHOU Q, XIN Y, ZHANG B Q, ZHANG L L, XU Y, WU D C. Effects of functional foods on blood glucose and intestinal microbiota in type 2 diabetes mice[J]. Chinese Journal of Microecology, 2018, 30(7): 781-784. DOI:10.13381/j.cnki.cjm.201807008 |
| [24] |
王宝贝, 李丽婷, 刘磊, 孙辉, 蔡舒琳, 戴聪杰. 烘焙处理对小球藻营养成分及其抗氧化活性的影响[J]. 食品与发酵工业, 2019, 45(4): 147-151. DOI:10.13995/j.cnki.11-1802/ts.017379 WANG B B, LI L T, LIU L, SUN H, CAI S L, DAI C J. Effects of roasting treatment on nutrient composition and antioxidant activities of Chlorella[J]. Food and Fermentation Industries, 2019, 45(4): 147-151. DOI:10.13995/j.cnki.11-1802/ts.017379 |
| [25] |
ZHAI Q, FENG S, AR JAN N, CHEN W. A next generation probiotic, Akkermansia muciniphila[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(19): 1517-1527. DOI:10.1080/10408398.2018.1517725 |
| [26] |
KHAN F, KUDDUS S A, SHOHAG M H, REZA H M, HOSSAIN M. Astaxanthin, the natural antioxidant, reduces reserpine induced depression in mice[J]. Current Bioactive Compounds, 2020, 2(16): 232-236. DOI:10.2174/1573407216666200203142722 |
| [27] |
魏文志, 夏文水, 吴玉娟. 小球藻糖蛋白的分离纯化与抗氧化活性评价[J]. 食品与机械, 2006, 22(5): 20-22. DOI:10.3969/j.issn.1003-5788.2006.05.005 WEI W Z, XIA W S, WU Y J. Isolation purification and anti-oxidation of the glycoprotein from chlorella pyrenoidosa[J]. Food and Machinery, 2006, 22(5): 20-22. DOI:10.3969/j.issn.1003-5788.2006.05.005 |
| [28] |
史瑞琴, 李大伟, 梁静静, 王颉, 郭书贤, 马艳莉. 小球藻多糖口服液的制备及其抗氧化活性[J]. 食品工业, 2019, 23(11): 82-87. DOI:10.13995/j.cnki.Article/CJFDTotal-SPGY201911021.htm SHI R Q, LI D W, LIANG J J, WANG J, GUO S X, MA Y L. The preparation and antioxidant activity of Chlorella polysaccharide drink[J]. The Food Industry, 2019, 23(11): 82-87. DOI:10.13995/j.cnki.Article/CJFDTotal-SPGY201911021.htm |
| [29] |
王融, 邵祎妍, 林佳佳, 郑柳杰, 杨欣, 傅正伟, 倪银华. 肠道菌群与益生菌在衰老及其调控中的研究与应用[J]. 生命科学, 2019, 31(1): 80-86. DOI:10.13376/j.cbls/2019012 WANG R, SHAO Y Y, LIN J J, ZHENG L J, YANG X, FU Z W, NI Y H. The involvement and application of gut microbiota and probiotics in aging[J]. Chinese Bulletin of Life Sciences, 2019, 31(1): 80-86. DOI:10.13376/j.cbls/2019012 |
 2021, Vol. 48
2021, Vol. 48




