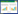文章信息
基金项目
- 潮州市科技计划项目-2019年广东省科技创新战略专项资金(2019ZX03);广东省现代农业产业技术体系创新团队项目(2020KJ108);广东省农业科学院科技创新战略专项资金(高水平农科院建设)-“十三五”学科团队建设项目(201604TD)
作者简介
- 邹波(1986—),男,博士,副研究员,研究方向为果蔬加工,E-mail:skzoubo@163.com.
通讯作者
- 徐玉娟(1974—),女,博士,研究员,研究方向为果蔬加工,E-mail:guoshuxuyujuan@163.com.
文章历史
- 收稿日期:2021-01-28
2. 华南农业大学食品学院,广东 广州 510642;
3. 广东展翠食品股份有限公司,广东 潮州 515634
2. College of Food Science, South China Agricultural University, Guangzhou 510642, China;
3. Guangdong Suntree Foodstuff Co., Ltd., Chaozhou 515634, China
【研究意义】佛手(Citrus medica L. var. sarcodactylis Swingle)为芸香科香橼属植物的果实,是我国传统中药材,同时也是药食两用的水果,富含精油、黄酮等活性成分,具有抗氧化、抗菌、抗炎、燥湿化痰等功效[1-3]。佛手鲜食口感不佳,通常将其加工成中药饮片或蜜饯、佛手膏、糖果等食品[4-5]。益生菌是一类能对宿主产生有益作用的微生物,可通过菌体本身及其代谢产物在胃肠道环境中发挥调节菌群平衡、抑制腐败菌和致病菌生长等作用,促进人体健康[6]。近年来,益生菌发酵果蔬在我国发展迅速。将佛手进行益生菌发酵,不仅可以丰富佛手的产品形式,还能分解佛手中的生物大分子,促进人体吸收,而乳酸杆菌、双歧杆菌等益生菌耐热性较差,在软糖等产品加工过程中易失活。枯草芽孢杆菌、地衣芽孢杆菌和凝结芽孢杆菌等芽孢杆菌安全性高且耐热性较好,在加工过程中不易失活,耐受胃酸能力强于乳酸菌[7-9]。将佛手进行芽孢杆菌发酵,可为开发富含活菌的发酵佛手糖果等产品提供科学指导。【前人研究进展】现有佛手的研究主要集中在佛手精油成分分析[10],微波干燥[11]、微波辅助热风干燥[12]、微波与真空冷冻联合干燥[13]等干燥技术对佛手加工品质的影响,低糖型佛手蜜饯的加工及产品开发[4]等方面,关于益生菌发酵佛手的研究鲜见报道。益生菌应用于果蔬发酵最早见于泡菜,乳酸菌是最早发现并应用于果蔬发酵的益生菌[6],随着人们对益生菌产品的认可,益生菌在荔枝、李、青梅等水果中的应用研究报道也在不断增加[14]。尽管如此,益生菌发酵作用对果蔬中多酚、黄酮和抗氧化能力的影响机理尚不明确。方晟等[1]研究表明,金佛手自然发酵过程中超氧阴离子自由基、羟基自由基、ABTS自由基等清除能力总体呈上升趋势,发酵过程中乳酸等有机酸含量逐渐升高;陈永芳等[15]研究表明,鼠李糖乳杆菌发酵可增加胡萝卜汁中游离态多酚含量,减少结合态多酚含量,提升抗氧化活性。植物乳杆菌发酵则可降低桑椹中花色苷含量,同时降低抗氧化活性[16]。近年来,耐热性、耐酸性较好的芽孢杆菌除应用于饲料研究外[7, 9],也逐渐应用到纳豆[17-18]、枸杞[8]、陈皮[19]等果蔬及中药材中。【本研究切入点】从食用安全性和保健作用功效考虑,佛手是益生菌发酵的优良植物资源,但现有研究仅见金佛手自然发酵的报道,接种益生菌(尤其是芽孢杆菌)发酵并研究其对佛手品质的影响还处于空白,以益生菌发酵的佛手为原料制备糖果的研究也未见报道。【拟解决的关键问题】为实现佛手加工产品的多元化,开发富含活菌的益生菌发酵佛手糖果,本研究以佛手浆为研究对象,分别接种耐热性较好的枯草芽孢杆菌、地衣芽孢杆菌和凝结芽孢杆菌,研究其发酵过程中芽孢杆菌的生长曲线,糖组分、总酚、总黄酮含量及抗氧化能力的变化,探明芽孢杆菌发酵对佛手浆品质的影响,明确糖果的制作工艺是否会造成芽孢杆菌的大量死亡,为佛手高值化利用奠定基础。
1 材料与方法 1.1 试验材料1.1.1 原料、菌种与试剂 佛手采摘于广东省潮州市,清洗并自然晾干,分装,密封,置于-20℃冻藏;枯草芽孢杆菌(BS168,模式菌株,BGSCID 1A1)、地衣芽孢杆菌(BL02,CCTCC M208065)和凝结芽孢杆菌(BC30,ATCC PTA-6086)均为实验室保存;Folin-Ciocalteu试剂,没食子酸和芦丁标准品,上海源叶生物科技有限公司;Trolox,Sigma-Aldrich公司;LB肉汤和固体培养基,广东环凯微生物科技有限公司;乙腈(HPLC),美国Tedia公司;其他试剂均为国产分析纯。
1.1.2 仪器设备 PBJ-G16K破壁料理机,德国贝尔斯顿公司;UV-1800型分光光度计,日本岛津公司;PB-10型pH计,赛多利斯公司;PX-250B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂;无菌操作台,苏净集团苏州安康空气技术有限公司;Biofuge Stratos Sorvall型台式高速冷冻离心机,Thermo Fisher Scientific公司;HWS24型电热恒温水浴锅,上海一恒科技有限公司;LC-20A高效液相色谱仪,日本岛津公司。
1.2 试验方法1.2.1 菌种活化与准备 将枯草芽孢杆菌、地衣芽孢杆菌和凝结芽孢杆菌分别接种至LB肉汤培养基中,37 ℃恒温摇床120 r/min培养至OD600=4,即可作为种子液,发酵前将种子液离心,沉淀用生理盐水重悬后使用。
1.2.2 发酵佛手浆制备与分组 冷冻佛手(0.5 kg)室温自然解冻,置于破壁料理机中,加入4倍质量纯水打浆,然后添加10 g/kg葡萄糖,100℃灭菌2 min后于超净工作台分装至三角瓶。待自然冷却后,加入1% 活化后的菌种重悬液,混匀,37℃摇床120 r/min发酵48 h,分别于0、12、24、36、48 h取样,用于各项指标测定。枯草芽孢杆菌168发酵佛手浆、地衣芽孢杆菌02发酵佛手浆和凝结芽孢杆菌30发酵佛手浆分别记为BS168、BL02和BC30。
1.2.3 发酵佛手浆软糖的制备 发酵佛手浆软糖配方为麦芽糖浆15%、蔗糖15%、浓度为30%(M/V)的明胶溶液50%、发酵佛手浆20%。凝胶软糖的制备:将等质量的麦芽糖浆和蔗糖加热溶解,降温至70℃,加入预热至70℃的明胶溶液搅拌均匀,再加入发酵后的佛手浆,混合均匀后倒入磨具中,冷却成型。取成型后的凝胶软糖,用于芽孢杆菌的测定。
1.3 测定项目及方法1.3.1 芽孢杆菌测定 将样品用生理盐水稀释至不同梯度,最高稀释倍数为10-7,取稀释后的样品1 mL,加入LB固体培养基,37℃倒置培养48 h,观察菌落形态,记录菌落数。
1.3.2 pH值测定 佛手浆的pH采用pH计直接测定。
1.3.3 糖组分测定 取不同发酵阶段的佛手浆10 g,加入10 mL水,在45℃水浴中加热1 h,补足挥发的水分,5 000 r/min离心5 min,收集上清液。糖组分含量的测定采用HPLC法[20]。
1.3.4 总酚、黄酮含量测定 取不同发酵阶段的佛手浆10 g,加入到20 mL提取液(甲醇∶盐酸=99 ∶ 1)30℃超声处理10 min,5 000 r/min离心5 min,收集上清液,沉淀继续提取2次,合并提取液,定容至50 mL,用于总酚和总黄酮含量的测定。其中,总酚含量采用Folin Ciocalteu法[21]测定,以没食子酸为标准对照品,绘制标准曲线,佛手浆总酚含量以每千克佛手浆中没食子酸当量(mg)表示;总黄酮含量采用铝离子法[22]测定,以芦丁为标准对照品,绘制标准曲线,佛手浆总黄酮含量以mg/L表示。
1.3.5 清除DPPH自由基能力测定 参照Zou等[23]方法,取稀释后的样品50 μL,加入150 μL DPPH溶液(0.2 mmol/L),混匀后在室温条件下避光反应20 min,用酶标仪测定517 nm处吸光度,以Trolox为标准对照品,以浓度为横坐标、DPPH自由基清除率为纵坐标,绘制标准曲线,设试剂空白对照(无水乙醇)、对照(以等体积甲醇代替样品)、样品空白对照(以等体积无水乙醇代替DPPH溶液),3次重复。DPPH自由基清除率按下式计算:

|
式中,A1为对照吸光度,A0为试剂空白对照吸光度,Ai为样品吸光度,Aj为样品空白对照吸光度。样品对DPPH自由基清除能力以每千克佛手浆中Trolox(mg)当量表示。
试验数据采用Excel、Origin 8.5、SPSS 17进行处理与分析。
2 结果与分析 2.1 佛手浆发酵过程中芽孢杆菌的生长规律取灭菌后的佛手浆,检测菌落总数、霉菌和酵母,培养基上未观察到菌落数,确认佛手浆接种前处于无菌状态。对灭菌后的佛手浆接入枯草芽孢杆菌(BS168)、地衣芽孢杆菌(BL02)和凝结芽孢杆菌(BC30),相应生长曲线如图 1所示,随着发酵时间的延长,3种芽孢杆菌数量均呈现上升趋势,12 h进入生长对数期,36 h生长速率减慢,进入稳定期。3种芽孢杆菌以BC30生长速度最快,发酵48 h后活菌数达8.35 log CFU/g;BS168和BL02的生长速率基本一致。由此可见,3株芽孢杆菌中,BC30对佛手浆的适应能力最强。

|
| 图 1 佛手浆发酵过程中芽孢杆菌的生长曲线 Fig. 1 Growth curve of Bacillus during the fermentation of fingered citron pulp BS168:枯草芽孢杆菌168发酵佛手浆;BL02:地衣芽孢杆菌02发酵佛手浆;BC30:凝结芽孢杆菌30发酵佛手浆BS168: Bacillus subtilis 168 fermented fingered citron pulp; BL02: Bacillus licheniformis 02 fermented fingered citron pulp; BC30: Bacillus coagulans 30 fermented fingered citron pulp |
2.2 佛手浆发酵过程中糖组分和pH值的变化
佛手浆中糖组分色谱图见图 2,除外源添加的葡萄糖外,佛手浆中的糖主要以果糖为主,其次是蔗糖,相较之下其他糖组分含量很少。佛手浆中接入芽孢杆菌后,随着发酵时间的延长,果糖、葡萄糖和蔗糖含量均呈现下降趋势,其中发酵0~36 h糖含量下降较缓慢,发酵36~48 h糖含量下降较快(图 3),发酵过程中糖含量与芽孢杆菌活菌数呈反比,这可能是芽孢杆菌在发酵过程中逐渐消耗糖所致。BC30对糖的消耗速率略快于其他两种芽孢杆菌,发酵48 h,BC30组果糖、葡萄糖和蔗糖含量分别下降21.6%、23.0%、23.1%。以上结果表明,与枯草芽孢杆菌和地衣芽孢杆菌相比,凝结芽孢杆菌能较好地利用佛手浆中的糖。
|
| 图 2 果糖、葡萄糖、蔗糖标准品(A)及佛手浆中糖组分(B)色谱图 Fig. 2 Chromatogram of standards of fructose, glucose and sucrose(A), and sugar composition of fingered citron pulp(B) |

|
| 图 3 佛手浆发酵过程中糖组分的变化 Fig. 3 Changes of sugar compositions during the fermentation of fingered citron pulp BS168:枯草芽孢杆菌168发酵佛手浆;BL02:地衣芽孢杆菌02发酵佛手浆;BC30:凝结芽孢杆菌30发酵佛手浆BS168: Bacillus subtilis 168 fermented fingered citron pulp; BL02: Bacillus licheniformis 02 fermented fingered citron pulp; BC30: Bacillus coagulans 30 fermented fingered citron pulp |
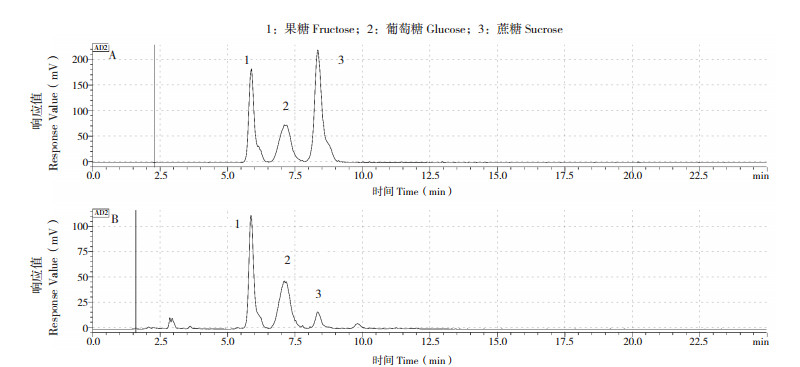
由图 4可知,佛手浆发酵过程中pH值呈逐渐下降趋势,但整体变化不大,其中BC30处理pH值下降略快,发酵48 h其pH值从初始的5.32下降至5.20。有研究报道称,凝结芽孢杆菌可分解糖类生成L- 乳酸,为同型乳酸发酵菌[8]。本研究发现佛手浆pH值与凝结芽孢杆菌活菌数呈负相关,与葡萄糖、果糖和蔗糖含量呈正相关,推测pH值的下降可能与凝结芽孢杆菌利用糖产生乳酸有关。
|
| 图 4 佛手浆发酵过程中pH值的变化 Fig. 4 Changes of pH value during the fermentation of fingered citron pulp BS168:枯草芽孢杆菌168发酵佛手浆;BL02:地衣芽孢杆菌02发酵佛手浆;BC30:凝结芽孢杆菌30发酵佛手浆BS168: Bacillus subtilis 168 fermented fingered citron pulp; BL02: Bacillus licheniformis 02 fermented fingered citron pulp; BC30: Bacillus coagulans 30 fermented fingered citron pulp |
2.3 佛手浆发酵过程中总酚和总黄酮含量的变化
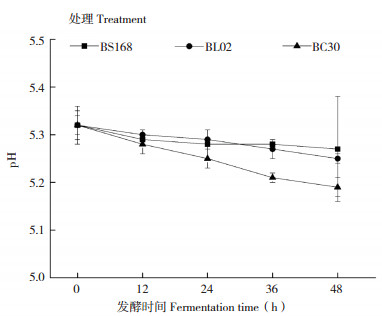
佛手浆发酵过程中总酚含量的变化如图 5所示,BC30发酵过程中,佛手浆总酚含量先轻微升高,随后逐渐下降;BS168和BL02发酵的佛手浆,总酚含量呈现先下降后上升的趋势。发酵48 h后,佛手浆总酚含量从大到小依次为BC30、BL20、BS168处理,与发酵前相比,总酚保留率分别为91.0%、87.4%、75.9%。
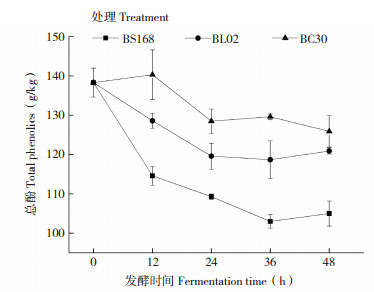
|
| 图 5 佛手浆发酵过程中总酚含量的变化 Fig. 5 Changes of total phenolics contents during the fermentation of fingered citron pulp BS168:枯草芽孢杆菌168发酵佛手浆;BL02:地衣芽孢杆菌02发酵佛手浆;BC30:凝结芽孢杆菌30发酵佛手浆BS168: Bacillus subtilis 168 fermented fingered citron pulp; BL02: Bacillus licheniformis 02 fermented fingered citron pulp; BC30: Bacillus coagulans 30 fermented Fingered Citron pulp |
从图 6可以看出,BC30发酵过程中,佛手浆总黄酮含量先迅速升高,然后逐渐下降,发酵36~48 h时保持平衡。BL02发酵过程中,佛手浆总黄酮含量呈现先下降后上升、再轻微下降的趋势;BS168发酵过程中,佛手浆总黄酮含量逐渐下降,发酵36 h时略微升高,随后又呈现下降趋势,但发酵24~48 h总黄酮含量变化幅度较小。发酵48 h后,佛手浆总黄酮含量从大到小依次为BC30、BL20、BS168处理,与发酵前佛手浆相比,BC30处理总黄酮含量升高4.4%。
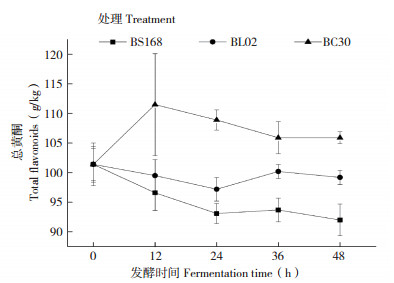
|
| 图 6 佛手浆发酵过程中总黄酮含量的变化 Fig. 6 Changes of total flavonoids content during the fermentation of fingered citron pulp BS168:枯草芽孢杆菌168发酵佛手浆;BL02:地衣芽孢杆菌02发酵佛手浆;BC30:凝结芽孢杆菌30发酵佛手浆BS168: Bacillus subtilis 168 fermented fingered citron pulp; BL02: Bacillus licheniformis 02 fermented fingered citron pulp; BC30: Bacillus coagulans 30 fermented fingered citron pulp |
BC30发酵12 h佛手浆总酚和总黄酮含量升高,可能与凝结芽孢杆菌的生命活动及黄酮、蛋白质、精油等化合物的结构变化有关。凝结芽孢杆菌在发酵过程中可产生蛋白酶、脂肪酶、糖苷酶等酶[8, 19],降解佛手中的蛋白质、果胶等,生成氨基酸等小分子化合物,并释放被包埋多酚、黄酮,导致总酚和总黄酮的含量升高[15]。多酚、黄酮自身并不稳定,随着发酵时间的延长会逐渐下降,当下降速度快于被释放速度时,表现为下降趋势。此外,还原糖含量的下降也会导致总酚含量下降。后续将进行佛手浆中多酚、黄酮等化合物单体的检测,以明确单一多酚、黄酮含量变化。
2.4 佛手浆发酵过程中抗氧化能力的变化本研究以清除DPPH自由基能力测定佛手浆发酵过程中抗氧化能力的变化,结果见图 7,BC30发酵的佛手浆抗氧化能力逐渐升高,发酵至36 h抗氧化能力最高;BS168和BL02发酵的佛手浆抗氧化能力在12 h最低,之后随着发酵时间的延长逐渐升高,发酵48 h达到最高。在整个发酵过程中,BC30发酵的佛手浆抗氧化能力最强,其次为BL02,BC30发酵48 h佛手浆的抗氧化能力是BS168的1.08倍。
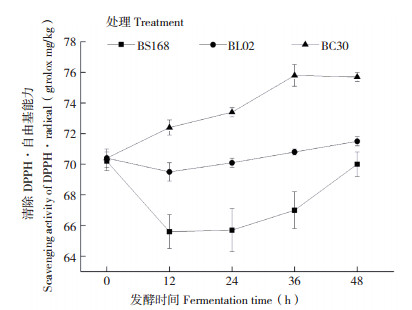
|
| 图 7 佛手浆发酵过程中清除DPPH自由基能力的变化 Fig. 7 Changes of scavenging ability of DPPH free radical during the fermentation of fingered citron pulp BS168:枯草芽孢杆菌168发酵佛手浆;BL02:地衣芽孢杆菌02发酵佛手浆;BC30:凝结芽孢杆菌30发酵佛手浆BS168: Bacillus subtilis 168 fermented fingered citron pulp; BL02: Bacillus licheniformis 02 fermented fingered citron pulp; BC30: Bacillus coagulans 30 fermented fingered citron pulp |
2.5 凝结芽孢杆菌发酵过程中佛手浆理化指标之间的相关性分析
从上述分析可以看出,3种芽孢杆菌以BC30最适宜在佛手浆中生长,且BC30发酵能提升佛手浆的抗氧化能力,因此本文对凝结芽孢杆菌发酵过程中佛手浆的抗氧化能力、活菌数、总酚含量、总黄酮含量、果糖含量、葡萄糖含量、蔗糖含量和pH值进行Pearson相关分析,结果见表 1。表 1显示,佛手浆清除DPPH自由基能力与活菌数呈极显著正相关,与pH值呈极显著负相关,与总酚、总黄酮含量无显著相关性;活菌数与总酚、果糖含量呈显著负相关,表明发酵过程中凝结芽孢杆菌可提升佛手浆清除DPPH自由基能力,同时也会造成部分酚类物质的损失。
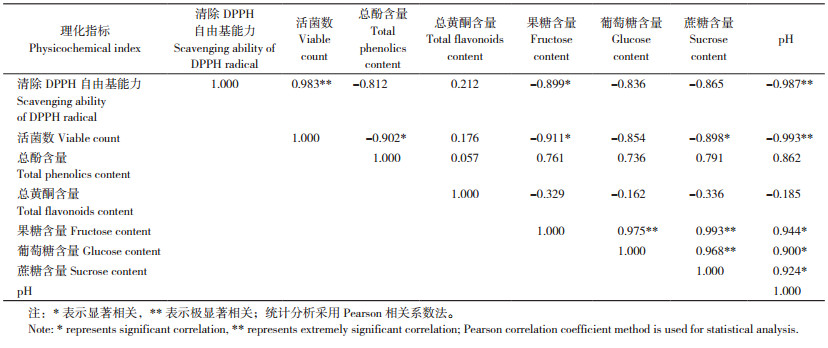
|
凝结芽孢杆菌发酵过程中,佛手浆清除DPPH自由基能力的变化与总酚、总黄酮含量的变化无显著相关性,这可能与佛手浆中黄酮类化合物的结构变化有关。研究显示,凝结芽孢杆菌发酵可提高陈皮发酵液中总酚、总黄酮含量和抗氧化能力,降低发酵残渣中总酚、总黄酮含量和抗氧化能力,表明发酵有利于抗氧化物质从陈皮释放到发酵液中[19]。本研究中,凝结芽孢杆菌发酵可能导致佛手中抗氧化物质的释放,将香叶木素糖苷类化合物、橙皮苷等化合物降解成香叶木素、橙皮素等抗氧化能力更强的化合物[3],导致发酵后的佛手浆抗氧化能力提高。后续将检测佛手浆中多酚、黄酮等化合物单体含量,进一步探明单一多酚和黄酮含量变化及其对佛手抗氧化能力的贡献。
2.6 凝结芽孢杆菌在软糖中的存活率以凝结芽孢杆菌发酵的佛手浆为原料,制备益生菌软糖,结果发现,软糖中BC30活菌数为7.5 log CFU/g,高于《食品安全国家标准发酵乳》(GB 19302-2010)规定的乳酸菌活菌数大于6.0 log CFU/g。该凝胶软糖有佛手的清香味,但也存在一定的苦味,开发出口感适宜且富含活菌的软糖还有待进一步研究。
3 讨论目前,枯草芽孢杆菌、地衣芽孢杆菌和凝结芽孢杆菌因其具有绿色无污染、无毒无害、可部分替代抗生素等优异生物学特性,广泛应用于饲料、食品及医药领域[9, 24]。现有研究主要集中于芽孢杆菌在发酵饲料中的应用,近年来研究发现,在我国传统白酒、泡菜、陈醋等酿造业中也有芽孢杆菌存在。Yang等[25]从四川泡菜中分离出一株枯草芽孢杆菌,将其接种至泡菜中进行发酵,发现其可加速泡菜pH的下降,促进乳酸杆菌和乳球菌等乳酸菌的生长,抑制致病菌生长,且芳樟醇、γ- 松油烯、乳酸、草酸和大部分氨基酸含量均显著高于自然发酵的泡菜。刘桂君等[26]从牛栏山酒厂生产用大曲中分离纯化得到地衣芽孢杆菌,将其添加到酒醅中可显著提高白酒乙酸乙酯含量,增加酒体协调感,提高白酒品质。杨帆等[27]从茅台酒生产用大曲中分离纯化得到2株地衣芽孢杆菌和1株枯草芽孢杆菌,在白酒发酵过程中可产生二甲基吡嗪、三甲基吡嗪、四甲基吡嗪、苯乙酸、呋喃扭尔、丁二醇、丁烯酸和异戊酸等酱香型酒类风味物质,对茅台酒风味的呈现有重要作用。
本研究首次将枯草芽孢杆菌、地衣芽孢杆菌和凝结芽孢杆菌应用到佛手浆发酵中,明确了不同芽孢杆菌单独发酵过程中活菌数的变化规律,发现3种芽孢杆菌均能较好生长,其中凝结芽孢杆菌BC30生长最好、活菌数最高,且能增加佛手浆的酸度。采用凝结芽孢杆菌对枸杞汁进行发酵[8],活菌数可达2.1×108 CFU/mL,口感和风味得到较大提升。将凝结芽孢杆菌与副干酪乳杆菌、植物乳杆菌和双歧杆菌等益生菌接种到红枣牛奶中进行发酵[28],4 ℃贮藏20 d后活菌数仍可达1.14×108 CFU/mL,这与本研究结果相似。
随着发酵时间的延长,凝结芽孢杆菌发酵的佛手浆清除DPPH自由基能力呈上升趋势,该变化可能与佛手浆中还原糖、总酚、总黄酮含量相关。然而,本研究相关性分析结果显示,凝结芽孢杆菌发酵过程中佛手浆抗氧化能力与总酚、总黄酮含量无显著相关性,但与活菌数呈极显著正相关,表明佛手浆清除自由基能力可能受凝结芽孢杆菌代谢产物的影响。在杨梅[29]、针叶樱桃和番石榴果实[30]益生菌发酵中也得到类似的研究结果。本研究发现,将发酵后的佛手浆应用到软糖中,益生菌数量仍可达7.5 log CFU/g,这为开发益生菌软糖提供了理论依据。后续将进一步研究佛手浆发酵过程中黄酮单体的结构变化及糖果制作工艺,以阐明芽孢杆菌对黄酮类化合物结构的影响,并开发出口感适宜的益生菌糖果。
4 结论枯草芽孢杆菌、地衣芽孢杆菌和凝结芽孢杆菌均能在佛手浆中存活,其中凝结芽孢杆菌BC30生长较好,发酵48 h活菌数可达8.35 log CFU/g。3种芽孢杆菌发酵的佛手浆总酚含量呈整体下降趋势,发酵48 h后BC30的总酚保留率最高(达91.0%)、总黄酮含量及清除DPPH自由基能力最高。相关性分析显示,BC30发酵过程中佛手浆的抗氧化能力与活菌数呈显著正相关,以其为原料开发的软糖活菌数可达7.5 log CFU/g。
| [1] |
方晟, 陈俊沲, 周瑾, 沙如意, 毛建卫. 金佛手酵素发酵过程中有机酸及其体外抗氧化性能分析[J]. 食品工业科技, 2020, 41(10): 68-74. DOI:10.13386/j.issn1002-0306.2020.10.012 FANG S, CHEN J D, ZHOU J, SHA R Y, MAO J W. Analysis of organic acids and antioxidant activity in vitro of Citrus medica Jiaosu during fermentation process[J]. Science and Technology of Food Industry, 2020, 41(10): 68-74. DOI:10.13386/j.issn1002-0306.2020.10.012 |
| [2] |
LIU W, LI Z H, YANG K, SUN P L, CAI M. Effect of nanoemulsion loading finger citron(Citrus medica L. var. sarcodactylis)essential oil on human gut microbiota[J]. Journal of Functional Foods, 2021, 77: 104336. DOI:10.1016/j.jff.2020.104336 |
| [3] |
LUO X G, WANG J, CHEN H Q, ZHOU A M, SONG M Y, ZHONG Q P, CHEN H M, CAO Y. Identification of flavoanoids from finger citron and evaluation on their antioxidative and antiaging activities[J]. Frontiers in Nutrition, 2020, 7: 584900. DOI:10.3389/fnut.2020.584900 |
| [4] |
黄丽, 高月明, 杨君, 袁利鹏, 刘后伟, 李东梅. 低糖佛手瓜蜜饯加工技术研究[J]. 食品工业, 2012, 33(4): 64-67. HUANG L, GAO Y M, YANG J, YUAN L P, LIU H W, LI D M. Study on processing technology of low-sugar-content candied chayote[J]. The Food Industry, 2012, 33(4): 64-67. |
| [5] |
朱鑫彤, 赵文, 周茜, 马丽丽, 张桂君, 付安珍, 王清, 高丽朴, 左进华, 郑淑芳. 佛手瓜采后保鲜及加工的研究进展[J]. 食品研究与开发, 2021, 42(2): 214-219. DOI:10.12161/j.issn.1005-6521.2021.02.034 ZHU X T, ZHAO W, ZHOU Q, MA L L, ZHANG G J, FU A Z, WANG Q, GAO L P, ZUO J H, ZHENG S F. Research progress on postharvest preservation and processing of chayote[J]. Food Research and Development, 2021, 42(2): 214-219. DOI:10.12161/j.issn.1005-6521.2021.02.034 |
| [6] |
谢明勇, 熊涛, 关倩倩. 益生菌发酵果蔬关键技术研究进展[J]. 中国食品学报, 2014, 14(10): 1-9. DOI:10.16429/j.1009-7848.2014.10.010 XIE M Y, XIONG T, GUAN Q Q. Research progress on the key techniques of the fruit and vegetable products fermented by probiotics[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(10): 1-9. DOI:10.16429/j.1009-7848.2014.10.010 |
| [7] |
李怡洁, 杨佐忠. 枯草芽孢杆菌主要作用机制与应用研究进展[J]. 四川林业科技, 2019, 40(4): 126-130. DOI:10.16779/j.cnki.1003-5508.2019.04.026 LI Y J, YANG Z Z. Advances in researches on main action mechanism and application of Bacillus subtilis[J]. Journal of Sichuan Forestry Science and Technology, 2019, 40(4): 126-130. DOI:10.16779/j.cnki.1003-5508.2019.04.026 |
| [8] |
马若霜, 方海田, 刘慧燕, 王茹, 刘予煊, 李金娜, 赵贝贝, 周婷, 胡晓磊. 凝结芽孢杆菌发酵枸杞汁的工艺优化及主要成分变化[J]. 中国酿造, 2018, 37(12): 169-174. DOI:10.11882/j.issn.0254-5071.2018.12.033 MA R S, FANG H T, LIU H Y, WANG R, LIU Y X, LI J N, ZHAO B B, ZHOU T, HU X L. Fermentation technology of goji juice by Bacillus coagulans and its major nutrients components changes[J]. China Brewing, 2018, 37(12): 169-174. DOI:10.11882/j.issn.0254-5071.2018.12.033 |
| [9] |
VIVIAN H, FELIX K K, GYAMFUA A, EMMANUEL D A, YISHAN L, SHUYAN C, MELODY A A. The use of Bacillus species in maintenance of water quality in aquaculture: A review[J]. Aquaculture Reports, 2020, 18: 100503. DOI:10.1016/j.aqrep.2020.100503 |
| [10] |
CHEN X A, CHEN H Q, XIAO J, LIU J Y, TANG N, ZHOU A M. Variations of volatile flavour compounds in finger citron(Citrus medica L. var. sarcodactylis)pickling process revealed by E-nose, HS-SPME-GC-MS and HS-GC-IMS[J]. Food Research International, 2020, 138(Part A): 109717. DOI:10.1016/j.foodres.2020.109717 |
| [11] |
黄凯信, 王楚茵, 许剑华, 陈树喜, 周爱梅. 微波杀菌技术在双华李和佛手加工中的应用[J]. 农产品加工, 2019(16): 32-34. DOI:10.16693/j.cnki.1671-9646(X).2019.08.045 HUANG K X, WANG C Y, XU J H, CHEN S X, ZHOU A M. Application of microwave sterilization in the process of Shuanghua Plum and Bergamot[J]. Farm Products Processing, 2019(16): 32-34. DOI:10.16693/j.cnki.1671-9646(X).2019.08.045 |
| [12] |
XU W X, ISLAM M N, CAO X H, TIAN J H, ZHU G Y. Effect of relative humidity on drying characteristics of microwave assisted hot air drying and qualities of dried finger citron slices[J]. LWT-Food Science and Technology, 2021, 137: 110413. DOI:10.1016/j.lwt.2020.110413 |
| [13] |
章斌, 侯小桢, 饶强, 王泽彬. 微波与真空冷冻组合干燥加工佛手的工艺研究[J]. 安徽农业科学, 2011, 39(30): 18739-18741. DOI:10.13989/j.cnki.0517-6611.2011.30.041 ZHANG B, HOU X Z, RAO Q, WANG Z B. Research on processing Bergamot by microwave combined with vacuum freeze-drying[J]. Journal of Anhui Agriculture, 2011, 39(30): 18739-18741. DOI:10.13989/j.cnki.0517-6611.2011.30.041 |
| [14] |
徐玉娟, 程丽娜, 卜智斌, 吴继军, 余元善, 邹波, 温靖, 彭健, 李璐. 岭南特色水果保鲜与加工研究进展[J]. 广东农业科学, 2020, 47(12): 144-157. DOI:10.16768/j.issn.1004-874X.2020.12.015 XU Y J, CHENG L N, BU Z B, WU J J, YU Y S, ZOU B, WEN J, PENG J, LI L. Research progress in preservation and processing of Lingnan characteristic fruits[J]. Guangdong Agricultural Sciences, 2020, 47(12): 144-157. DOI:10.16768/j.issn.1004-874X.2020.12.015 |
| [15] |
陈永芳, 胡荣康, 吴林秀, 巫梦婷, 钟思敏, 刘斌. 益生菌发酵胡萝卜汁活性成分与抗氧化活性研究[J]. 中国酿造, 2018, 37(5): 76-80. DOI:10.11882/j.issn.0254-5071.2018.05.015 CHEN Y F, HU R K, WU L X, WU M T, ZHONG S M, LIU B. Active constituents and antioxidant activity of fermented carrot juice by probiotics[J]. China Brewing, 2018, 37(5): 76-80. DOI:10.11882/j.issn.0254-5071.2018.05.015 |
| [16] |
李丰廷, 邹波, 肖更生, 徐玉娟, 唐道邦, 余元善, 吴继军. 植物乳杆菌在桑果浆中的发酵特性研究[J]. 蚕业科学, 2018, 44(5): 746-752. DOI:10.13441/j.cnki.cykx.2018.05.013 LI F T, ZOU B, XIAO G S, XU Y J, TANG D B, YU Y S, WU J. A study on fermentation characteristics of Lactobacillus plantarum in mulberry pulp[J]. Science of Sericulture, 2018, 44(5): 746-752. DOI:10.13441/j.cnki.cykx.2018.05.013 |
| [17] |
李秀凉, 李倩文, 朱玉, 韩晓云, 孙庆申, 宋永. 纳豆芽孢杆菌发酵菜用大豆中纳豆激酶的提取及其性质分析[J]. 中国酿造, 2020, 39(12): 106-112. DOI:10.11882/j.issn.0254-5071.2020.12.021 LI X L, LI Q W, ZHU Y, HAN X Y, SUN Q S, SONG Y. Extraction and properties of nattokinase from vegetable soybean fermented with Bacillus natto[J]. China Brewing, 2020, 39(12): 106-112. DOI:10.11882/j.issn.0254-5071.2020.12.021 |
| [18] |
许志平, 侯小琴, 孙力军, 邓旗, 房志家, 廖建萌. 纳豆芽孢杆菌nt-6酶解猪肉骨粉生产抗菌饲用肽的工艺优化[J]. 广东农业科学, 2020, 47(10): 149-157. DOI:10.16768/j.issn.1004-874X.2020.10.019 XU Z P, HOU X Q, SUN L J, DENG Q, FANG Z J, LIAO J M. Optimization of enzymolysis technology for meat and bone meal by Bacillus natto NT-6 to produce antimicrobial peptide[J]. Guangdong Agricultural Sciences, 2020, 47(10): 149-157. DOI:10.16768/j.issn.1004-874X.2020.10.019 |
| [19] |
黄翠华. 一种陈皮发酵饮料的制备工艺研究及品质分析[D]. 广州: 华南农业大学, 2016. HUANG C H. The research of the fermentation technology of Pericarpium citri reticulatae and the analysis of quality[D]. Guangzhou: South China Agricultural University, 2016. |
| [20] |
YU Y S, XIAO G S, XU Y J, WU J J, WEN J. Effects of dimethyl dicarbonate(DMDC)on the fermentation of litchi juice by Lactobacillus casei as an alternative of heat treatment[J]. Journal of Food Science, 2014, 79(5): 947-954. DOI:10.1111/1750-3841.12428 |
| [21] |
ZENG D, XIAO G S, XU Y J, ZOU B, WU J J, YU Y S. Protein and polyphenols involved in sediment formation in cloudy litchi juice[J]. Food Science and Biotechnology, 2019, 28(4): 945-953. DOI:10.1007/s10068-019-00567-y |
| [22] |
李汀, 邹波, 吴继军, 刘忠义, 肖更生, 徐玉娟, 余元善, 邹颖. 肠膜明串珠菌对蜜柚果醋酿造过程中品质变化影响[J]. 中国酿造, 2020, 39(1): 129-135. DOI:10.11882/j.issn.0254-5071.2020.01.025 LI T, ZOU B, WU J J, LIU Z Y, XIAO G S, XU Y J, YU Y S, ZOU Y. Effect of Leuconostoc mesenteroides on the quality change of pomelo vinegar during the brewing[J]. China Brewing, 2020, 39(1): 129-135. DOI:10.11882/j.issn.0254-5071.2020.01.025 |
| [23] |
ZOU B, XU Y J, WU J J, YU Y S, XIAO G S. Phenolic compounds participating in mulberry juice sediment formation during storage[J]. Journal of Zhejiang University-Science B, 2017, 18(10): 854-866. DOI:10.1631/jzus.B1600461 |
| [24] |
李锴骁, 杨婉秋, 庞煜, 闫海. 凝结芽孢杆菌的研究进展[J]. 化学与生物工程, 2019, 36(10): 1-6. DOI:10.3969/j.issn.1672-5425.2019.10.001 LI K X, YANG W Q, PANG Y, YAN H. Research progress of Bacillus coagulans[J]. Chemistry & Bioengineering, 2019, 36(10): 1-6. DOI:10.3969/j.issn.1672-5425.2019.10.001 |
| [25] |
YANG Z Y, LUO F P, ZHONG K, HUANG C, YU Z Y, PENG Z Y, WU Y P, BU Q, CAO H. Effect of Bacillus subtilis Y61 inoculation on bacterial community and metabolic profile of sichuan paocai fermentation[J]. LWT-Food Science and Technology, 2021, 137: 110393. DOI:10.1016/j.let.2020.110393 |
| [26] |
刘桂君, 刘红霞, 胡建华, 郝文军, 闻泽喜, 李兰英. 地衣芽孢杆菌在牛栏山二锅头基酒生产中的应用[J]. 酿酒科技, 2009(8): 83-84, 87. DOI:10.13746/j.njkj.2009.08.033 LIU G J, LIU H X, HU J H, HAO W J, WEN Z X, LI L Y. Application of Bacillus licheniformis in Niulanshan Erguotou base liquor production[J]. Liquor-Making Science & Technology, 2009(8): 83-84, 87. DOI:10.13746/j.njkj.2009.08.033 |
| [27] |
杨帆, 林琳, 王和玉, 王莉, 杨代永, 吕云怀, 季克良. 茅台大曲中3株芽孢杆菌代谢产物的比对分析[J]. 酿酒科技, 2011(8): 42-43, 46. DOI:10.13746/j.njkj.2011.08.030 YANG F, LIN L, WANG H Y, WANG L, YANG D Y, LU Y B, JI K L. Comparative analysis of the metabolites of three Bacillus strains in Maotai Daqu starter[J]. Liquor-Making Science & Technology, 2011(8): 42-43, 46. DOI:10.13746/j.njkj.2011.08.030 |
| [28] |
杨春雪. 红枣发酵工艺优化及常温酸奶的开发[D]. 哈尔滨: 黑龙江东方学院, 2019. YANG C X. Optimization of fermentation process of jujube and development of room temperature yogurt[D]. Harbin: East University of Heilongjiang, 2019. |
| [29] |
ZHU Y Y, JIANG J, YUE Y, FENG Z P, CHEN J C, YE X Q. Influence of mixed probiotics on the the bioactive composition, antioxidant activity and appearance of fermented red bayberry pomace[J]. LWT-Food Science and Technology, 2020, 133: 110076. DOI:10.1016/j.lwt.2020.110076 |
| [30] |
DE O S D, ARAÚJO C M, BORGES G D S C, LIMA M D S, VIERA V B, GARCIA E F, DE S E L, DE O M E G. Improvement in physicochemical characteristics, bioactive compounds and antioxidant activity of acerola (Malpighia emarginata D.C.)and guava(Psidium guajava L.) fruit by-products fermented with potentially probiotic Lactobacilli[J]. LWT-Food Science and Technology, 2020, 134: 110200. DOI:10.1016/j.lwt.2020.110200 |
 2021, Vol. 48
2021, Vol. 48