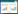文章信息
基金项目
- 甘肃省高等学校创新能力提升项目(2019B-203)
作者简介
- 张芬芬(1990—),女,硕士,讲师,研究方向为生物物理学,E-mail:1046767776@qq.com.
通讯作者
- 周晓伦(1987—),男,硕士,讲师,研究方向为土壤微生物,E-mail:610253095@qq.com.
文章历史
- 收稿日期:2020-12-17
【研究意义】粮食生产对人类生存至关重要,玉米(Zea mays L.)是世界重要的粮食作物之一,广泛应用于工业、养殖业以及畜牧业中[1]。氮、磷参与植物光合作用、营养吸收、细胞分裂和生物氧化等重要代谢途径,是植物生长发育所必需的大量营养元素[2]。为了满足农作物生存、生产所需的氮、磷等营养元素,几乎所有的土壤都需要化肥来补充无机磷支持作物生产,但反复使用化肥会导致土壤结构恶化[3],而且土壤中95% 的磷的存在形式难以被植物吸收利用[4]。因此,分离和利用土壤溶磷微生物,促进植物吸收磷元素,应用微生物肥料替代部分化肥逐渐成为现代农业技术的研究热点。植物根际促生菌(Plant growth-promoting rhizobacteria, PGPR)是指定殖于植物根际系统,并能促进植物生长和提高产量的一类细菌的总称[5]。PGPR在促进作物固氮能力、改善土壤环境以及提高植物抗病抗逆能力等方面有重要研究意义[6]。【前人研究进展】有研究报道关于植物根际促生菌的固氮、溶磷、产氨作用,溶磷菌可以释放有机酸、螯合和离子交换使土壤中的不溶性磷转化成可溶性磷,以提高土壤肥力[7-9]。溶磷剂对粮食和饲料作物也有部分相应的促进作用[10-12]。大量的文献主要说明了根际促生菌其自身的促生作用和菌株的生理特征,但促生菌对植株- 土壤- 微生物整个体系作用的研究相对很少[13]。【本研究切入点】陇东地区对PGPR菌株作为生物菌肥应用到农作物中以及促生效应的研究甚少。筛选一批促生作用显著的根际植物促生菌,可为进一步利用微生物- 植物促生相互作用促进农作物的增长,提供优质的菌种资源,提高粮食产量,减少化学肥料对土壤特征的影响。【拟解决的关键问题】为探索PGPR对土壤中无机磷的溶磷能力以及植物的促生作用机制,本试验以冬小麦根际土壤为研究材料筛选具有溶磷能力和产生促生效应物质的菌株,采用改良的Belimov方法获得一株显著促进玉米幼苗生长的菌株,通过16S rRNA基因序列及表型分析鉴定其为 Pseudomonas sp,其作为优质的菌种资源,可促进农作物产量的提高和改善局部土壤的理化特征,扩大了生物菌肥的资源。
1 材料与方法 1.1 试验材料供试土样采集自冬小麦根际土壤5~15 cm的土层。
试验使用的化学药品均为分析纯,均由西安姚北生物科技有限公司提供。
LB固体培养基:胰蛋白胨10.00 g,酵母膏5.00 g,NaCl 10.00 g,琼脂20.00 g,H2O 1 L,调节pH为7.0,用于观察溶磷菌的菌落特征。
改良SRSM培养基[14]:琼脂15 g,Glucose 10 g,Ca3(PO4)2 5 g,(NH4)2 SO4 0.5 g,KCl 0.2 g,MgSO4·7H2O 0.3 g,MnSO4 0.004 g,FeSO4 0.002 g,NaCl 20 g,Yeast extract 0.5 g,Bromocresol purple 0.1 g,加蒸馏水至1 L,调节pH为6.8~7.0,用于溶磷菌株的分离、纯化。
1.2 溶磷菌株筛选取采集的冬小麦根际土壤10 g,加入到100 mL (含有25~35个玻璃珠)的LB液体培养基的锥形瓶中,置振荡器上震荡15 min,得到10-1浓度的土壤稀释液,连续稀释至10-6,将10-1~10-6梯度的土壤稀释液均匀涂布于SRSM培养基中,培养温度为30(±2)℃,倒置、恒温培养3~5 d。菌落周围若出现溶磷圈即为溶磷菌,挑取具有明显溶磷圈的菌株进行纯化,重复3次,直至显微镜中观察出现形态、大小一致的细菌。将其保存4℃备用。
1.3 溶磷菌株鉴定1.3.1 菌株形态观察及生理生化试验 菌落形态特征及革兰氏染色特性参照《常见细菌系统鉴定手册》进行观察,菌株的各项生理生化指标参照《伯杰细菌鉴定手册》及相关文献鉴定[15]。
1.3.2 16S rDNA序列测定及系统发育树构建 分别提取菌株的总基因DNA,采用16S rDNA通用引物27f(5'-AGAGTTT-G-ATCCTGGCTCAG-3') 和1492r(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增,将PCR产物送西安擎科生物公司完成16S rDNA扩增及序列测定。提交菌株的16S rDNA序列到NCBI网站,与已知的序列比对分析其同源性。利用Blast将序列进行比对,MEGA5.05分子进化遗传分析软件分析碱基组成、GC含量,Kimura2参数计算遗传距离,采用NJ邻近法构建系统发育树。
1.4 溶磷菌株ACC脱氨酶酶活性和产IAA能力测定参照Penrose等[16]的方法,ACC脱氨酶的活性通过ACC脱氨酶分解ACC产生的α- 酮丁酸来测定。菌体蛋白含量根据Bradford[17]的方法测定。根据α- 酮丁酸和蛋白质的标准曲线即可测算ACC脱氨酶的活性。
参照Glickman等[18]的方法,将分离纯化的菌株分别接种于添加L- 色氨酸、终浓度为0.5 g/L的LB液体培养基中,37 ℃、180 r/min震荡培养2 d,离心后取50 μL上清液加入等体积Sackowcki’s显色剂,在白瓷板上避光显色30 min后观察,若显示粉红色即为阳性,表明该菌株能够分泌IAA。
定量测定:取阳性菌株的上清液与Sackowcki’s显色剂避光显色30 min后的混合液,测定在530 nm的吸光值,以空白培养基作对照,标准曲线以纯IAA的吸光值制作,计算各反应中的阳性菌株产IAA的量(μg/mL)[19]。
1.5 根际细菌溶磷能力测定1.5.1 定性测定 待测菌株在改良SRSM固体培养基上活化,然后用接种针点接菌株至改良的SRSM固体培养基,每菌株在一个皿上接4个重复,在30 ℃培养箱中培养8 d后观察菌株周围是否有透明圈产生。
1.5.2 定量测定 不加磷的改良SRSM液体培养基100 mL分装在250 mL三角瓶中,灭菌后精确加入0.5 g灭菌的Ca3(PO4)2粉、1 mL(1×108 CFU/mL)培养24 h菌液,28 ℃、120 r/min摇床培养,分别在48、72、96、120、144 h测定菌株溶解无机磷能力[14]。吸取2 mL混匀菌株培养液,10 000 r/min离心10 min,取上清液采用钼锑抗比色法测定其溶磷量[20],同时用酸度计测定培养液的pH值。每菌株3次重复,以基础培养基(不接种菌株)为对照。根据磷酸二氢钾标准曲线确定菌株的溶磷量。
1.6 溶磷菌株对玉米幼苗生长的影响于2019年5—6月进行盆栽试验,供试土壤来自平凉农田,供试作物为玉米。试验设接种ZX-10、ZX-3、ZX-40、ZX-7、ZX-701、ZX-2020、ZX-30、ZX-401及不接种任何菌剂对照9个处理,5次重复。供试菌株分别活化后置于LB培养基振荡培养24 h,用无菌水调节菌悬液浓度为1×108 CFU/mL,采用灌根方式进行接种,接种量10 mL/ 株。自然条件下室内培养,每隔5 d重复处理1次,整个试验期间保持土壤湿润,30 d后收获植株测定生物学数据。
试验数据采用SPSS13.0 one-way ANOVA进行分析,采用Fisher’s Student-Newman -Keulsa, b进行多重比较。
2 结果与分析 2.1 溶磷菌株的筛选将分离纯化的菌株以稀释涂布的方式接种于改良SRSM固体培养基5 d后,测定菌落直径和溶磷圈直径,根据溶磷圈大小筛选到8株具有溶磷能力的菌株,其对应平板上都观察到明显的溶磷圈。其中,ZX-2020菌落直径为2.3 mm,溶磷圈直径为4.8 mm(图 1中箭头所示),计算得SI=2.08,为8株菌株中最大,因此对ZX-2020平板上的溶磷菌株进行纯化和传代培养,表明菌株纯度和溶磷能力稳定。
|
| 图 1 菌株ZX-2020的溶磷圈 Fig. 1 Phosporous-solubilizing halos of strain ZX-2020 |
2.2 溶磷菌株的菌体形态特征和生理生化特性
菌株ZX-2020为乳白色或淡黄菌落,表面光滑,半透明,湿润粘稠,圆形,边缘规则,革兰氏染色阴性,具运动性。生化反应结果见表 1。另外,在SRSM液体培养基中,菌株ZX-2020在Pseudomonas aeruginosa strain P1(MK881024.1) pH 6.5~11.5之间均可生长,在37 ℃下生长状况最好。根据菌体形态特征和生理生化,菌株ZX-2020为Pseudomonas spp.

|
2.3 菌株ZX-2020 16S rDNA序列测定
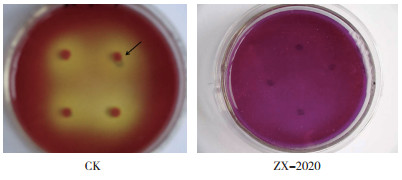
为了鉴定菌株的生理生化特性,以菌株ZX-2020的总DNA为模板,利用细菌16S rDNA引物进行PCR扩增,得到长度约为1.5 kb的扩增产物。将此序列提交至Genbank,获得的登录号为MT084758。根据Genbank序列同源性比较,利用NCBI数据库提供的Blast功能进行核苷酸比对,结果显示,菌株ZX-2020与Pseudomonas aeruginosa strain P1(MK881024.1)、Pseudomonas aeruginosa strain LCS1(MK430420.1) 及Pseudomonas aeruginosa strain BUYA-2 (MN490066.1)的16S rDNA基因序列一致性均高达100%。根据16S rDNA基因序列的相似性,利用MEGA5.0构建系统发育树(图 2),显示菌株ZX-2020在系统发育上最接近于铜绿假单胞菌属(Pseudomonas aeruginosa)。

|
| 图 2 基于菌株ZX-2020 16S rDNA基因序列构建的系统发育树 Fig. 2 Phylogenetic tree constructed based on the 16S rDNA gene sequence of strain ZX-2020 |
2.4 菌株ZX-2020 ACC脱氨酶活性和产IAA能力
植物促生菌可以定植在植物的根以及种子表面,菌株产生的1- 氨基环丙烷-1- 羧酸脱氨酶可降解乙烯的前体1- 氨基环丙烷-1- 羧酸,从而降低乙烯在植物体内的含量,促进植物的生长和发育。IAA也可通过直接刺激植物细胞的延伸和分裂,促进植物的生长并提高植物自身的防御系统。试验结果显示,Pseudomonas spp. ZX-2020 溶磷量为198.26(±10.04)μg/mL,ACC脱氨酶活性为152.62(±7.21)μmol/mg·h,产IAA量为6.71(±0.32)mg/L,具有较高的产IAA能力。
2.5 菌株ZX-2020溶磷能力难溶性磷在酸性土壤中会转化成磷酸铝和磷酸铁,在石灰性土壤中会转化为磷酸钙,而溶磷微生物能把此类难溶性磷转化成植物可以吸收利用的有效磷。为了分析测试菌株ZX-2020转化土壤中难溶性磷酸盐并且改善土壤的供磷能力,将菌液与供试土壤按照10% 的比例进行混合,3 d后,土壤中的有效磷含量从最初的8.63 mg/kg上升为12.66 mg/kg。起初的土壤有效磷含量比较少,属于低能力供磷水平,在施加菌株ZX-2020后,土壤有效磷含量明显增加,达到中等供磷水平,证明菌株ZX-2020可以改善土壤的供磷水平。
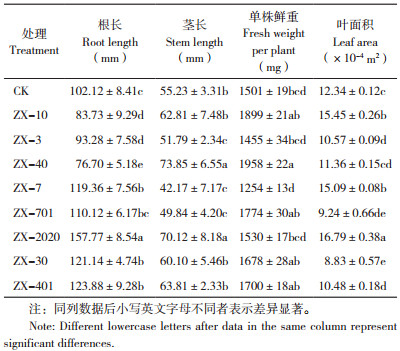
2.6 菌株ZX-2020对幼苗生长的影响通过不同溶磷菌株对幼苗进行灌根处理,30 d后测定植株的生理生长指标。盆栽试验显示,与对照相比,接种ZX-7、ZX-2020、ZX-30、ZX-401菌株的幼苗根长均显著增长,接种ZX-40、ZX-2020、ZX-30、ZX-401菌株的幼苗茎长均显著增长,接种ZX-40、ZX-701、ZX-30、ZX-401、ZX-2020的幼苗鲜重均显著增加,接种ZX-10、ZX-7、ZX-2020菌株的幼苗叶面积均显著增加(表 2)。表明接种8种菌株的玉米幼苗根长、茎长、鲜重、叶面积均有不同程度的增加,以ZX-2020菌株的促生效应更为突出,接种ZX-2020菌株的玉米幼苗根长增长54.49%,茎长增长26.96%,鲜重增加1.93%,叶面积增加36.06%。同时,接种溶磷菌株的幼苗植株与对照相比根部生长更为旺盛,根毛数更多,根须更长,根系更为发达。
|
3 讨论
土壤、根系及微生物三者相互作用的区域称为植物根际[21],植物根系可分泌大量的糖类、氨基酸、激素和维生素,根际细菌的定植在土壤养分转化和溶解等方面发挥着至关重要的作用[22]。大多数的解磷、溶磷菌都可以促进作物生长、提高作物产量、增强抗病力[23],假单胞菌属作为主要溶磷微生物之一,很多研究都表明假单胞杆菌属菌株对难溶性磷酸盐有较好的溶磷效果。郭莹等[24]研究表明铜绿假单胞菌JM1对磷酸钙和磷酸铝的溶磷量分别达到240.63和2.73mg/L。孙珊等[25]筛选的一株假单胞菌属菌株CJT-1对磷酸钙和宜昌磷矿粉的溶磷量分别达到224.51和120.59 mg/L,刘辉等[26]筛选的一株荧光假单胞菌JW-JS1对磷酸钙的溶磷量最高达708.34 mg/L。本研究筛选得到的ZX-2020菌株对磷酸钙溶的溶磷量为198.26 mg/L,该菌株对难溶性磷酸盐的溶解能力与上述报道的结果相近,甚至效果更优。溶磷菌的溶磷机理非常复杂,有的溶磷菌通过释放质子来降低土壤pH值而达到降磷效果,部分溶磷菌通过分泌有机酸而起到溶磷作用,也有溶磷菌通过分泌磷酸酶来溶磷,或者是多种机制并存起到的综合作用[27-28]。目前,大部分研究认为真菌溶磷的能力主要与其向培养基中分泌的小分子有机酸有关,分泌有机酸一方面可以降低培养基pH利于难溶性磷酸盐的溶解,另一方面可以通过结合铁镁钙铝等离子将磷酸盐释出来[29-30],因此造成不同浓度的溶磷菌株溶解能力的差异可能与金属离子的螯合能力不同或其分泌的有机酸含量有关。溶磷菌剂的使用,直接增加其在土壤中的数量,有利于植物对磷素的吸收利用[31]。万水霞等[32]通过盆栽试验,发现土壤根际筛选出的优良PGPR菌株(CH70)对苋菜的株高及地上部鲜重都有一定的促进作用,并且从根际土壤分离获得的溶磷菌株,其菌剂能有效促进苗期生长和增加产量[33]。陈佳怡等[34]对水稻根际土壤进行溶磷菌筛选纯化,分离得到的假单胞菌有高效的溶磷能力,可用来研制微生物菌肥。在陇东地区,过量使用化肥使农业生态环境遭到破坏,迫切需要绿色高效的生物菌肥代替化肥,因此,在今后的研究中,改善土壤微环境,溶磷微生物能够推动土壤中有效磷的释放,从而促进植物生长发育,增加作物产量,筛选更多优良PGPR菌株尤为重要。
4 结论本研究从平凉市化肥施用冬小麦土壤中初步筛选分离得到8株溶磷菌株,通过植物促生试验得到一株溶磷能力强(198.26 mg/L)、产吲哚乙酸(6.71 mg/L)、ACC脱氨酶活性强(152.62 μmol/mg·h)的铜绿假单胞菌属,可以作为生物菌肥应用到农耕活动中,不但可以增加农作物对磷元素的吸收,而且吲哚乙酸也可以促进植物的生长,ACC脱氨酶可以帮助植物抵抗非生物胁迫条件,如重金属、干旱、高盐等,增加植物的抗逆性。当ZX-2020菌株进入土壤中定殖于植物根系后,产生的吲哚乙酸、ACC脱氨酶和溶解无机磷的能力相互作用,促进植物生长,提高农作物的生物量,同时也为化肥土壤的生物修复提供了菌种资源。
| [1] |
AMI R A. Alleviating the adverse effects of NaCl stress in maize seedings by pretreating seeds with salicylic acid and 24-epibrassinolide[J]. South African Journal of Botany, 2013, 88: 171-177. DOI:10.1016/j.sajb.2013.07.019 |
| [2] |
ILLMER P, SCHINNER F. Solubilization of inorganic phosphates by microorganisms isolated from forest soil[J]. Soil Biology and Biochemistry, 1992, 24: 389-395. DOI:10.1016/0038-0717(92)90199-8 |
| [3] |
TEWARI S K, DAS B, MEHROTRA S. Cultivation of medicinal plants-tool for rural development[J]. Rural Technology, 2004, 3: 147-150. DOI:10.1007/1-4020-5449-1-3 |
| [4] |
赵素芬, 刘建新, 倪娒娣. 畜禽废弃物高温好氧堆肥过程中磷素的变化研究[J]. 农业环境科学学报, 2005, 24(2): 384-386. DOI:10.3321/j.issn:1672-2043.2005.02.039 ZHAO S F, LIU J X, NI M D. Dynamic phosphorus contents during aerobic and rmophilic composting of livestock wastes[J]. Journal of Agro-Environment Science, 2005, 24(2): 384-386. DOI:10.3321/j.issn:1672-2043.2005.02.039 |
| [5] |
AHMAD F, AHMAD I, KHAN M S. Screening of freeliving rhizospheric bacteria for their multiple plant growth promoting activities[J]. Microbiological Research, 2008, 163(2): 173-181. DOI:10.1016/j.micres.200604001 |
| [6] |
卢秉林, 李娟, 郭天文. 甘肃微生物肥料研发应用现状及其发展对策[J]. 甘肃农业科技, 2007, 8(8): 36-38. DOI:10.3969/j.issn.1001-1463.2007.08.016 LU B L, LI J, GUO T W. Application status and development strategies of microbic fertilizers in Gansu Province[J]. Gansu Agricultural Science and Technology, 2007, 8: 36-38. DOI:10.3969/j.issn.1001-1463.2007.08.016 |
| [7] |
OMAR S. The role of rock-phosphate-solubilizing fungi and vesicular- arbusular-mycorrhiza(VAM)in growth of wheat plants fertilized with rock phosphate[J]. World Journal of Microbiology and Biotechnology, 1997(14): 211-218. DOI:10.1023/A:1008830129262 |
| [8] |
NARULA N, KUMAR V, BEHL R K, DUEBEL A A, GRANSEE A, MERBACH W. Effect of P solubilizing Azotobacter chroococcum on N, P, K uptake in P responsive wheat genotypes grown under green house conditions[J]. Soil Science and Plant Nutrition, 2000, 163: 393-398. DOI:10.1002/1522-2624(200008)163:4<393::AID-JPLN393>3.0.CO;2-W |
| [9] |
WHITELAW M A. Growth promotion of plants inoculated with phosphate solubilizing fungi[J]. Advances in Agronomy, 2000, 69: 99-151. DOI:10.1016/S0065-2113(08)60948-7 |
| [10] |
DEY R, PAL K K, BHATT D M, CHAUHAN S M. Growth promotion and yield enhancement of peanut(Arachis hypogaea L.)by application of plant growth-promoting rhizobacteria[J]. Microbiological Research, 2004, 59: 371-394. DOI:10.1016/j.micres.2004.08.004 |
| [11] |
MITTAL V, SINGH O, NAYYAR H, KAUR J, TEWARI R. Stimulatory effect of phosphatesolubilizing fungal strains(Aspergillus awamori and Penicillium citrinum)on the yield of chickpea(Cicer arietinum L. cv. GPF2)[J]. Soil Biology and Biochemistry, 2008, 40: 718-727. DOI:10.1016/j.soilbio.2007.10.008 |
| [12] |
GULATI A, VYAS P, RAHI P, KASANA R C. Plant growth promoting and rhizosphere competent acinetobacter rhizosphere strain BIHB 723 from the cold desert of Himalayas[J]. Current Microbiology, 2009, 58: 371-377. DOI:10.1007/s00284-008-9339-x |
| [13] |
KOHLER J, CARAVACA F, ROLDAN A. Effect of drought on the stability of rhizosphere soil aggregates of Lactuca sativa grown in a degraded soil inoculated with PGPR and AM fungi[J]. Applied Soil Ecology, 2009, 42(2): 160-165. DOI:10.1016/j.apsoil.2009.03.007 |
| [14] |
VAZQUEZ P, HOLGUIN G, PUENTE M, LOPEZ-CORTES A, BASHAN Y. Phosphate-solubilizing microorganisms associated with the rhizosphere of mangroves in a semiarid coastal lagooni[J]. Biology and Fertility of Soils, 2000, 30: 460-468. DOI:10.1007/s003740050024 |
| [15] |
OLIVEIRA C A, ALVES V M C, MARRIEL I E, GOMES E A, SCOTTI M R, CARNEIRO N P, GUIMARAES C T, SCHAFFERT R E, Sá N M H. Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome[J]. Soil Biology and Biochemistry, 2009, 41: 1782-1787. DOI:10.1016/j.soilbio.2008.01.012 |
| [16] |
PENROSE D M, GLICK B R. Methods for isolating and characterizing ACC deaminase containing plant growth-promoting rhizobacteria[J]. Physiologia Plantarum, 2003, 118(1): 10-15. DOI:10.1034/j.1399-3054.2003.00086.x |
| [17] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254. DOI:10.1006/abio.1976.9999 |
| [18] |
GLICKMANN E, DESSAUX Y A. Critical examination of the specificity of the salkowski reagent for compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. DOI:10.1128/AEM.61.2.793-796.1995 |
| [19] |
张东艳, 刘晔, 吴越, 王国文, 万兵兵, 姜瑛. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学, 2016, 38(1): 104-110. DOI:10.7505/j.issn.1007-9084.2016.01.016 ZHANG D Y, LIU Y, WU Y, WANG G W, WAN B B, JIANG Y. Isolation and identification of IAA-producing strains from peanut rhizosphere and its promoting effects on peanut growth[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(1): 104-110. DOI:10.7505/j.issn.1007-9084.2016.01.016 |
| [20] |
许光辉, 郑洪元. 土壤微生物分析方法手册[M]. 北京: 农业出版社, 1986: 187-189. XU G H, ZHENG H Y. Manual of soil microbial analysis methods[M]. Beijing: Agricultural Press of China, 1986: 187-189. |
| [21] |
TRAVIS S W, HARSH P B, ERICH G, JORGE M V. Rootexudation and rhizosphere biology[J]. Plant Physiology, 2003, 132(1): 44-51. DOI:10.1104/pp.102.019661 |
| [22] |
SARKAR J, CHAKRABORTY B, CHAKRABORTY U. Plant growth promoting rhizobacteria protect wheat plants against temperature stress through antioxidant signalling and reducing chloroplast and membrane injury[J]. Journal of Plant Growth Regulation, 2018, 37(4): 1396-1412. DOI:10.1007/s00344-018-9789-8 |
| [23] |
马骢毓, 张英, 孙广正, 刘婷, 姚拓. 披碱草根际促生菌筛选及其接种剂的促生作用[J]. 植物营养与肥料学报, 2016, 22(4): 1039-1048. DOI:10.11674/zwyf.15449 MA C Y, ZHANG Y, SUN G Z, LIU T, YAO T. Identification of plant growth promoting rhizobacteria Elymus dahuricus and their effectives[J]. Plant Nutrition and Fertilizer Science, 2016, 22(4): 1039-1048. DOI:10.11674/zwyf.15449 |
| [24] |
郭莹, 鞠天琛, 秦玉莹, 冷粟, 吴迪, 李明堂. 一株铜绿假单胞菌的溶磷特征及其对底泥中Pb的固定化[J]. 吉林大学学报(理学版), 2016, 54(6): 276-282. DOI:10.13413/j.cnki.jdxblxb.2016.06.49.jdxblxb.2016.06.49 GUO Y, JU T C, QIN Y Y, LENG S, WU D, LI M T. Characteristics of phosphate solubilization of Pseudomonas aeruginosa and its immobilization of Pb in sediment[J]. Journal of Jilin University (Science Edition), 2016, 54(6): 276-282. DOI:10.13413/j.cnki.jdxblxb.2016.06.49.jdxblxb.2016.06.49 |
| [25] |
孙珊, 黄星, 范宁杰, 冯昭中, 李会会, 李顺鹏. 一株溶磷细菌的分离、鉴定及其溶磷特性研究[J]. 土壤学报, 2010, 42(1): 119-124. DOI:10.13758/j.cnki.tr.2010.01.004 SUN S, HUANG X, FAN N J, FENG Z Z, LI H H, LI S P. Studies on phosphorus solubilizing activity of a strain isolated from corp rhizosphere[J]. Acta Pedologica Sinica, 2010, 42(1): 119-124. DOI:10.13758/j.cnki.tr.2010.01.004 |
| [26] |
刘辉, 吴小芹, 任嘉红, 陈丹. 一株荧光假单胞菌的溶磷特性及其对杨树的促生效果[J]. 林业科学, 2013, 49(9): 112-118. DOI:10.11707/j.1001-7488.20130916 LIU H, WU X Q, REN J H, CHEN D. Phosphate-dissolving characteristics and growth promoting effect of Pseudomonads fluorescent JW-JSI on poplar seedlings[J]. Scientia Silvae Sinicae, 2013, 49(9): 112-118. DOI:10.11707/j.1001-7488.20130916 |
| [27] |
吴海燕, 金荣德, 范作伟, 胡会军, 孙甜田, 赵兰坡. 解磷巨大芽孢杆菌(Bacillus megaterium)的溶磷机理探讨[J]. 吉林农业大学学报, 2014(2): 171-175. DOI:10.13327/j.jjlau.2014.1713 WU H Y, JIN R D, FAN Z W, HU H J, SUN T T, ZHAO L P. Mechanism of solubilizing phosphate by Bacillus megaterium[J]. Journal of Jilin Agricultural University, 2014(2): 171-175. DOI:10.13327/j.jjlau.2014.1713 |
| [28] |
詹杨, 韩旭, 萧龙珍, 崔俊涛, 王呈玉. 溶磷放线菌研究进展[J]. 广州化工, 2016, 44(8): 8-9, 23. DOI:10.3969/j.issn1001-9677.2016.08.003 ZHAN Y, HAN X, XIAO L Z, CUI J T, WANG C Y. Research progress on phosphate-solubilizing actinomycetes[J]. Guangzhou Chemical, 2016, 44(8): 8-9, 23. DOI:10.3969/j.issn1001-9677.2016.08.003 |
| [29] |
王光华, 周德瑞, 杨谦, 周克琴, 赵英. 低分子量有机酸对磷矿粉的释磷效应[J]. 农业环境科学学报, 2004, 23(1): 80-84. DOI:10.3321/j.issn:1672-2043.2004.01.019 WANG G H, ZHOU D R, YANG Q, ZHOU K Q, ZHAO Y. Effects of low-molecular-weightorganic acids on release of phosphorus from rock phosphate[J]. Journal of Agro-Environment Science, 2004, 23(1): 80-84. DOI:10.3321/j.issn:1672-2043.2004.01.019 |
| [30] |
章爱群, 贺立源, 赵会娥, 郭再华, 崔雪梅. 有机酸对土壤无机态磷转化和速效磷的影响[J]. 生态学报, 2009, 29(8): 4061-4069. DOI:10.3321/j.issn:1000-0933.2009.08.006 ZHANG A Q, HE L Y, ZHAO H E, GUO Z H, CUI X M. Effect of organic acids on inorganic phosphorus transformation in soils and its readily available phosphate[J]. Acta Ecologica Sinica, 2009, 29(8): 4061-4069. DOI:10.3321/j.issn:1000-0933.2009.08.006 |
| [31] |
JIMENEZ B, REBOLEIRO RIVAS P, GONZALEZ L J, PESCIAROLI C. Immobilization of Delftia tsuruhatensis in macro-porous cellulose and biodegra-dation of phenolic compounds in repeated batch processe[J]. Journal of Biotechnology, 2012, 157(1): 148-153. DOI:10.1016/j.jbiotec.2011.09.026 |
| [32] |
万水霞, 王静, 李帆, 蒋光月, 徐文静, 刘祚军. 玉米根际高效溶磷菌的筛选、鉴定及促生效应研究[J]. 生物技术通报, 2020, 36(5): 98-103. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0678 WAN S X, WANG J, LI F, JIANG G Y, XU W J, LIU Z J. Screening and identification of phosphate solubilizing bacteria from maize rhizosphere soil and its growth promoting effect[J]. Biotechnology Bulletin, 2020, 36(5): 98-103. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0678 |
| [33] |
乔策策, 王甜甜, 王若斐, 刘超, 高琦, 李荣. 高效溶磷菌的筛选及其促生效应研究[J]. 南京农业大学学报, 2017, 40(4): 664-670. DOI:10.7685/jnau.201606030 QIAO C C, WANG T T, WANG R F, LIU C, GAO Q, LI R. Screening phosphate solubilizing bacterial strains from maize rhizosphere and research on their plant growth promotion effect[J]. Journal of Nanjing Agricultural University, 2017, 40(4): 664-670. DOI:10.7685/jnau.201606030 |
| [34] |
陈佳怡, 徐晶秀, 陈紫茵, 陈敏威, 徐迎傲, 方勇. 两株根际高效溶磷菌的筛选、鉴定和溶磷特性[J]. 草业科学, 2020, 37(10): 1979-1985. DOI:10.11829/j.issn.1001-0629.2020-0158 CHEN J Y, XU J X, CHEN Z Y, CHEN M W, XU Y A, FANG Y. Screening, identification, and characteristics of two phosphate-solubilizing bacteria in the rhizosphere[J]. Pratacultural Science, 2020, 37(10): 1979-1985. DOI:10.11829/j.issn.1001-0629.2020-0158 |
 2021, Vol. 48
2021, Vol. 48