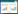文章信息
基金项目
- 海南省重大科技计划项目(ZDKJ201817)
作者简介
- 吴朝波(1988—),男,硕士,农艺师,研究方向为作物栽培管理技术,E-mail:wuchao_bo@126.com.
通讯作者
- 韩文素(1978—),女,博士,副研究员,研究方向为昆虫病虫害综合治理,E-mail:hwswill8@126.com.
文章历史
- 收稿日期:2021-01-18
2. 中国热带农业科学院环境与植物保护研究所,海南 海口 571101;
3. 海南省农业科学院植物保护研究所,海南 海口 571101;
4. 中国热带农业科学院椰子研究所,海南 文昌 571300
2. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China;
3. Institute of Plant Protection, Hainan Academy of Agricultural Sciences, Haikou 571101, China;
4. Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wenchang 571300, China
【研究意义】槟榔为棕榈科植物,海南省第二大经济作物,种植面积达15.58万hm2,年种植及初加工产值约287.3亿元,是海南230万农民的主要经济来源[1]。槟榔具有促消化、抗菌和抗氧化等重要药用价值,被称为四大南药之首[2]。钙是植物必需矿质元素之一,是植物生长发育的重要调节因子[3],也是植物结构组成元素[4],钙参与植物体内多个生理代谢过程[5],适宜浓度的钙能够调节植物对其他离子吸收,因此合理钙源有助于促进植物生长,而过多的钙则会对植物产生毒害,抑制植物生长,降低产量等[5-8]。目前尚未见不同钙浓度处理对槟榔生长、生理、养分吸收的研究报道,因此研究不同钙处理对槟榔生长、生理及养分吸收的影响,获得钙施用量的参考浓度,对生产具有指导意义。【前人研究进展】研究表明,钙在槟榔植株中占有重要地位,槟榔叶片中钙含量仅次于钾含量,较磷含量高,同时与槟榔产量具有极大关系,高产量槟榔叶片其钙含量高于低产槟榔[1]。海南岛是典型热带土壤分布区,是全国土壤最缺钙的地区之一,土壤交换性钙含量<14 cmol/kg对作物来说属于低钙含量,而海南岛土壤中钙含量较低,土壤交换性钙含量<4 cmol/kg的分布频率达100%,交换性钙含量<1 cmol/kg的分布频率高达74.5%[9]。【本研究切入点】槟榔为多年生木本植物,对钙需求旺盛,但生产中往往不注重补充钙元素。海南热带亚热带气候,雨热同期,槟榔属于浅根系,根系抓土作用较弱,表层土壤随着雨水冲刷而流失,留下较为贫瘠的砂砾土,严重影响了槟榔的健康生长。农户生产管理中以施用氮磷钾复合肥为主,而钙作为重要的中量元素被忽视,加剧了土壤缺钙状况。本研究组调查发现,槟榔缺钙时炭疽病、叶斑病、根腐等病害发生情况较钙充足时严重,且缺钙时槟榔果实多出现烂心现象,严重威胁着槟榔植株生长与果实品质。【拟解决的关键问题】研究钙对槟榔生长的影响,探索槟榔在不同钙浓度处理下,槟榔叶片膜脂过氧化产物丙二醛(MDA)、渗透调节物质(脯氨酸、可溶性糖)、抗氧化系统酶(SOD、POD、CAT)及养分(N、P、K)的变化,钙在根、茎、叶中的积累量,从槟榔形态、生理、养分3方面进行外源钙的响应研究,评价钙对槟榔的促生作用,为生产中钙的施用提供参考依据。
1 材料与方法 1.1 试验材料试验于2020年2月在澄迈海南博士威农用化学有限公司槟榔试验基地(19°49′N,109° 78′E)进行。槟榔品种为热研1号,外源钙为氢氧化钙水溶液。试验使用的营养液根据Hoagland营养液调整,具体组成为:硝酸钾607 mg/L、磷酸二氢铵115 mg/L、七水合硫酸镁493 mg/L、乙二胺四乙酸二钠铁30 mg/L、硼酸2.86 mg/L、四水合硫酸锰2.13 mg/L、七水合硫酸锌0.22 mg/L、五水合硫酸铜0.08 mg/L、四水合钼酸铵0.02 mg/L。
1.2 试验方法试验采用盆栽方式,每个育苗盆装土3 kg,盆栽土壤为当地红壤沙土,土壤有效钙66.54 mg/kg,碱解氮47.28 mg/kg,有效磷11.74 mg/kg,速效钾61.95 mg/kg,有机质11.02 g/kg,pH 5.6。试验设7个钙浓度处理(0、50、100、200、300、400、500 mg/kg),每个处理3盆,3次重复。
盆栽槟榔管理:2020年2月12日将长势一致、株高8 cm左右的槟榔实生苗,定植于不同钙浓度处理的育苗盆中。定植后立刻浇1次透水,使土壤含水量达到田间最大含水量的80%~90%。试验期间每隔20 d浇1次25%Hoagland营养液(V水∶ VHoagland营养液=3 ∶ 1)800 mL,当表层土壤1~2 cm发白时补浇纯净水,使土壤含水量保持在50%~60%。
1.3 测定指标及方法不同钙浓度处理210 d后,分别测定槟榔苗生长指标(株高、根长、根数、生物量)、生理指标(MDA、可溶性糖、脯氨酸含量以及SOD、POD、CAT活性)、养分指标(N、P、K、Ca含量)等。
生长指标:用直尺测量不同处理槟榔株高(cm)、根长(cm);每个处理选择3株槟榔,用去离子水冲洗干净,于茎基部将槟榔地上部与地下部分开,105 ℃杀青30 min,80 ℃烘干至恒重,用精度为1/1000的电子天平测定槟榔地下部和地上部干质量(g),3次重复。
生理指标:MDA含量参照郑炳松[10]的方法测定;脯氨酸含量采用茚三酮法[11]测定;可溶性糖含量采用蒽酮比色法[11]测定;SOD活性采用NBT光还原法测定,POD活性采用愈创木酚法测定,CAT活性采用紫外吸收法[12]测定。
养分指标:N、P、K、Ca含量参照鲁如坤的方法[13]测定。
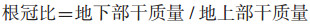
|
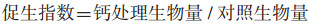
|
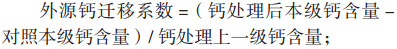
|

|
试验数据采用Excel 2003整理、绘制图表,用SPSS 13.0进行方差分析和多重比较。
2 结果与分析 2.1 外源钙对槟榔生长的影响外源钙处理对槟榔生长指标的影响结果见表 1。钙处理促进了槟榔株高,钙浓度为50 mg/kg时株高比空白对照显著增加15.78%,钙浓度300 mg/kg时株高最大达到38.85 cm、比对照增加57.22%,钙浓度≥ 400 mg/kg时株高不再增加。钙处理槟榔根长呈先增后减,钙浓度0~100 mg/kg根长无显著增加,钙浓度200 mg/kg时槟榔根长分别较钙浓度0、50、100 mg/kg显著增加,钙浓度300 mg/kg时根长达到最大,为25.99 cm。钙浓度为50 mg/kg时槟榔根数较对照显著增加,钙浓度400 mg/kg根数最多、为对照的2.12倍,钙浓度200~400 mg/kg根数无明显变化,钙浓度500 mg/kg根数较400 mg/kg处理明显减少。各钙处理槟榔地下部干重均显著高于对照,以钙浓度300 mg/kg时地下部干重达最大,为1.106 g。钙浓度0~100 mg/kg处理下槟榔地上部干重差异不显著,钙浓度300 mg/kg时达到最大、比对照增加85.10%。由表 1可知,槟榔生长指标在钙浓度200~300 mg/kg时达到最优且差异不显著,钙浓度≥ 400 mg/kg各指标出现不同增减变化。其中,根冠比、促生指数均呈先增后减趋势,钙浓度100 mg/kg时根冠比显著增加,钙浓度300 mg/kg时达到最大,钙浓度200~400 mg/kg的根冠比增加不显著,趋于稳定;促生指数均大于1,且在钙浓度300 mg/kg达到最大,钙浓度≥ 400 mg/kg则促生指数开始下降。整体来看,促生效果最佳钙浓度为200~300 mg/kg,钙浓度400~500 mg/kg虽然各生长指标优于对照,但部分指标开始低于或显著低于200~300 mg/kg钙处理。
2.2 外源钙对槟榔叶片膜脂过氧化产物积累的影响
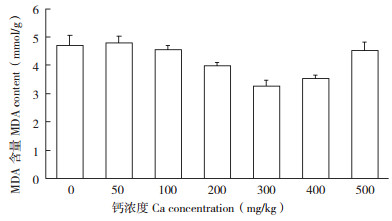
MDA作为生物膜氧化的产物,其含量高低反映植物细胞受伤害程度大小。由图 1可知,槟榔叶片MDA含量在钙浓度为0~100 mg/kg时各处理间差异不显著;当钙浓度为200 mg/kg时,叶片MDA含量显著减少;钙浓度为300 mg/kg时MDA含量最低,为对照的69.47%;钙浓度≥ 400 mg/kg时MDA含量呈增加趋势,钙浓度为500 mg/kg时MDA含量与对照相当。说明较低浓度钙(0~50 mg/kg)对槟榔叶片MDA的积累效果不显著,中浓度钙(200~400 mg/kg)可显著减少MDA积累量,高浓度钙(500 mg/kg)较中浓度钙下MDA出现增加。
|
| 图 1 外源钙对槟榔MDA含量的影响 Fig. 1 Effect of exogenous Ca on the MDA content in betel nut |
2.3 外源钙对槟榔渗透调节物质积累的影响
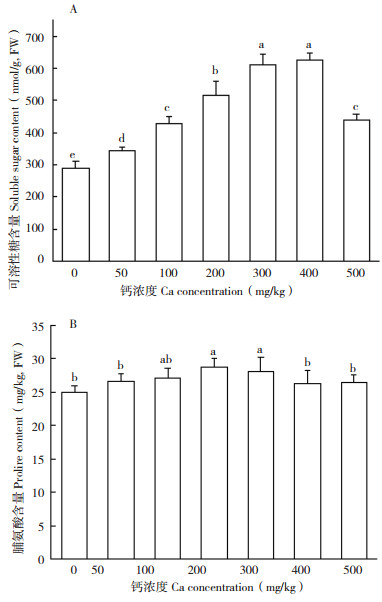
由图 2A可知,在未使用外源钙处理下,对照槟榔叶片可溶性糖含量为289.373 nmol/g;当钙浓度为50~400 mg/kg时,叶片中可溶性糖积累量随钙浓度增加而增加,以钙浓度400 mg/kg时槟榔叶片中可溶性糖含量最大、为对照的2.16倍;当钙浓度为500 mg/kg时,叶片中可溶性糖含量减少,与钙浓度100 mg/kg时相当。
|
| 图 2 外源钙对槟榔可溶性糖和脯氨酸含量的影响 Fig. 2 Effect of exogenous Ca on the soluble sugar and proline contents in betel nut A: 可溶性糖含量; B: 脯氨酸含量 A: Soluble sugar content; B: Proline content |
由图 2B可知,脯氨酸在槟榔叶片中的积累量呈先增后减,槟榔叶片脯氨酸含量在钙浓度为200~300 mg/kg时积累效果较显著,其中钙浓度为200 mg/kg时叶片中脯氨酸积累量最高、比对照增加15.31%,而在钙浓度0、50、100、400、500 mg/kg处理下两两处理间脯氨酸含量无显著变化。
2.4 外源钙肥对槟榔氧化酶系统影响槟榔抗氧化酶系统对外源钙响应如图 3所示,钙浓度≤ 400 mg/kg时槟榔叶片SOD活性随外源钙处理浓度的增加而提高,钙浓度400 mg /kg时达到最大值、为对照的3.69倍,钙浓度500 mg/kg时SOD活性较200~400 mg/kg钙处理显著下降。钙处理下槟榔叶片POD活性均较对照显著提高,以钙浓度300 mg/kg时POD活性最高、为对照的3.41倍,钙浓度≥ 400 mg/kg时POD活性较钙浓度200、300 mg/kg明显下降,而钙浓度200 mg/kg与300 mg/kg处理的POD活性差异不显著。钙浓度为50 mg/kg时叶片CAT活性无明显提高,钙浓度为100 mg/kg时CAT活性明显提高,以钙浓度300 mg/kg时CAT活性最高、为对照的4.32倍,钙浓度≥ 400 mg/kg时CAT活性较钙浓度200、300 mg/kg显著下降,且钙浓度为500 mg/kg时CAT活性与100 mg/kg钙浓度处理相当。可见,钙浓度≤ 300 mg/kg时,槟榔叶片SOD、POD、CAT活性均随钙浓度的增加而提高,说明SOD、POD、CAT具协同增效作用,能有效清除槟榔体内活性氧,维持持活性氧平衡。
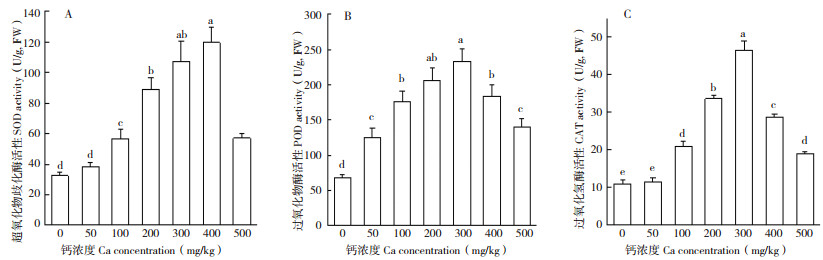
|
| 图 3 外源钙对槟榔抗氧化酶(SOD、POD、CAT)活性的影响 Fig. 3 Effect of exogenous Ca on the activity of antioxidant enzymes(SOD, POD, CAT)in betel nut A: 超氧化物歧化酶活性;B: 过氧化物酶活性;C: 过氧化氢酶活性 A: SOD activity; B: POD activity; C: CAT activity |
2.5 外源钙肥对槟榔植株氮磷钾积累的影响
由图 4可知,在各钙浓度处理下,槟榔植株N、P、K的积累量表现为N>K>P。其中,对照的槟榔植株N含量为27.75 mg/kg;钙浓度为0~300 mg/kg时,植株N含量随钙浓度增加而增加,且钙浓度0~100 mg/kg对N积累效果不显著;钙浓度≥ 400 mg/kg时,植株N含量较钙浓度200、300 mg/kg处理开始减少。未使用钙处理下,对照的槟榔植株P含量为0.76 mg/kg,钙浓度300 mg/kg时,植株P含量达到最大,为0.97 mg/kg,比对照显著增加27.75%;钙浓度≥ 400 mg/kg时,植株P含量较钙浓度300 mg/kg处理开始减少。未使用钙处理下,对照槟榔植株K含量为8.49 mg/kg;植株K含量随钙浓度增加表现先增加后减少,钙浓度200 mg/kg时达到最大11.94 mg/kg,为对照的1.41倍;而钙浓度300 mg/kg处理植株K含量与钙浓度200 mg/kg仅相差4.27%,钙浓度500 mg/kg的植株K含量与对照相当。
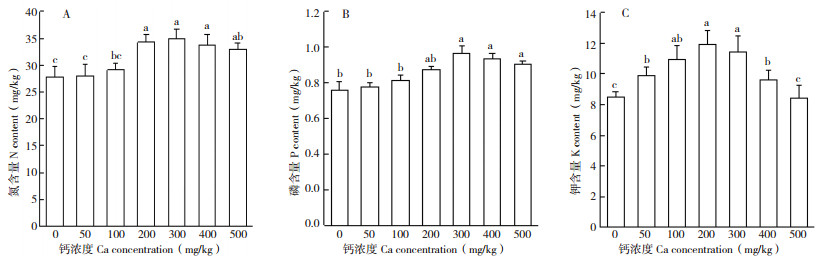
|
| 图 4 外源钙对槟榔氮磷钾含量的影响 Fig. 4 Effect of exogenous Ca on the contents of N, P and K in betel nut A: 氮含量;B: 磷含量;C: 钾含量 A: N content; B: P content; B: K content |
2.6 外源钙肥对槟榔钙积累的影响
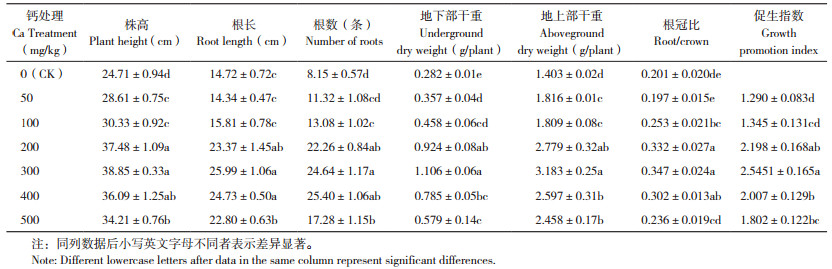
由表 2可知,钙在槟榔各组织中分布含量表现为叶>茎>根,钙浓度200 mg/kg处理时,根中钙含量显著高于对照;在钙浓度300 mg/kg处理时,根中钙含量达到最大,比对照显著增加97.22%;钙浓度≥ 400 mg/kg处理的根中钙含量较钙浓度300 mg/kg处理减少,钙浓度500 mg/kg处理时根中钙含量仅为对照的63.89%。钙浓度为100 mg/kg处理时茎中钙含量较对照显著增加;钙浓度≥ 400 mg/kg处理时茎中钙含量显著低于钙浓度200~300 mg/kg处理;钙浓度为500 mg/kg处理时茎中钙含量为对照的88.14%。当钙浓度为300 mg/kg时,叶中钙含量钙含量达到最大,比对照显著增加73.21%;钙浓度≥ 400 mg/kg时叶中钙含量显著减少。说明低浓度钙处理有助于增加槟榔根茎叶中的钙含量,且在钙浓度200~300 mg/kg时各组织钙含量相对较高,钙浓度≥ 500 mg/kg则抑制钙在各组织的积累。
分析外源钙吸收转移系数发现,钙处理浓度为0~100 mg/kg时,外源钙吸收转移系数表现为土壤- 根部>根部- 茎部>茎部- 叶部;钙处理浓度为200~300 mg/kg时,外源钙根部- 茎部、茎部- 叶部的转移系数较钙浓度0~100 mg/kg时增加,且土壤- 根部转移系数逐渐低于根部- 茎部和茎部- 叶部;钙处理浓度为400 mg/kg时,钙转移系数减小,各转移系数在0.37~0.45之间;当钙处理浓度为500 mg/kg时,各转移系数值为负。
3 讨论 3.1 槟榔生长对外源钙的响应钙是植物生长发育的必需营养元素,对于调控植物的生长发育有重要作用。大量研究结果标明,外源钙补充能够促进植物生长,甜椒幼苗喷施钙可以增加株高[14],黄瓜补充外源钙可以显著增加株高及植株干物质重量[15];高浓度钙会抑制植株生长,狭叶香蒲在1 500 mg/kg钙浓度胁迫下株高和生长受到明显抑制[16];宽叶海雀稗的株高、生物量随着钙浓度的增加呈先增后减的趋势[17]。本研究中,槟榔在钙处理下各生长指标变化呈现先增加后减少的趋势,与上述研究结论一致,钙处理浓度为200~300 mg/kg时,槟榔株高、根长、根数、生物量、根冠比、促生指数均表现为较优值,而钙浓度≥ 400 mg/kg对各项指标的促进效果开始下降。
3.2 槟榔叶片生理物质对外源钙的响应膜脂过氧化产物MDA是细胞膜受损伤的重要标志之一[18],MDA含量高低可以反映槟榔在外源钙处理下受到的伤害程度。细胞膜受到损伤,膜脂过氧化加剧,MDA大量生成[19],细胞液中渗透调节物质外流[20],质膜稳定性下降。本研究发现,槟榔MDA含量表现为先减后增的趋势,说明槟榔对一定浓度钙有极强的适应能力,而当钙浓度为500 m/kg时,槟榔叶片MDA含量增加,细胞膜受到损伤。
可溶性糖和脯氨酸是植物体内重要的渗透调节物质[21],脯氨酸能保持细胞中酶的稳定性,降低细胞损伤[22]。研究表明,外源钙处理能使植物可溶性糖含量保持在较高水平,降低细胞的渗透势[23]。本研究发现钙处理槟榔叶片可溶性糖、脯氨酸含量呈先增后减趋势。从含量增量看可溶性糖在渗透调节中起主要作用,脯氨酸起次要作用,降低细胞渗透势能,维持细胞的稳定性,使MDA含量维持在较低水平,促进槟榔的生长,这与冀乙萌等[24]对木薯的研究结果相一致,钙能够有效降低木薯MDA含量,增加可溶性糖、脯氨酸含量。本研究发现,钙浓度≥ 400 mg/kg时槟榔MDA含量呈增加趋势,可溶性糖含量、脯氨酸含量逐渐减少,这可能是由于钙浓度过高产生钙中毒现象[25],如钙与CaM结合使细胞内骨架微管蛋白去组装,导致细胞结构被破坏;钙与细胞内磷酸根形成沉淀,呼吸作用被抑制[26]。
细胞膜系统是植物感受外部环境的敏感部位,钙是许多重要酶和辅酶的活化剂,钙离子通常与细胞中的环状多肽结合形成钙调素,通过与钙调素结合的蛋白质进行信号传递,发挥钙信使作用[27]。有研究表明,抗氧化酶SOD、POD、CAT组成的抗氧化酶系统可以通过施加钙进行调控[28],SOD能使O2-歧化作用转化为H2O2,POD与CAT能清除H2O2,因此SOD、POD、CAT的平衡有助于清除植物体内活性氧,维持细胞功能[29]。本研究中,钙浓度≤ 300 mg/kg时,槟榔叶片SOD、POD、CAT活性均随钙浓度的增加而增加,表现出协同增效作用,有助于维持细胞活性氧平衡;钙浓度为400 mg/kg时,SOD活性继续增加,而POD、CAT活性开始降低;钙浓度达500 mg/kg时,SOD、POD、CAT活性均降低,表明钙浓度≥ 400 mg/kg时,对槟榔细胞中活性氧清除能力减弱,钙过高会致使植物抗氧化酶系统相关酶活性降低,这与李婷婷等[30]的研究结果一致。槟榔叶片渗透调节物质(可溶性糖、脯氨酸)和抗氧化酶(SOD、POD、CAT)对外源钙响应与生长指标变化相一致,表明钙浓度≤ 300 mg/kg时,随钙浓度增加渗透调节和抗氧化酶系统共同维持了细胞渗透压和活性氧平衡,有利于槟榔的生长,且最适钙浓度为300 mg/kg;而过高的钙浓度,使得渗透调节和抗氧化酶系统调节功能降低,抑制了槟榔生长。
3.3 槟榔植株氮、磷、钾含量和钙分布对外源钙的响应钙在生物膜中作为磷脂的磷酸根和蛋白质的羧基间联系的桥梁,可以维持膜结构的稳定性[31];大部分钙存在于液泡中,对液泡内阴阳离子的平衡有重要作用。例如,液泡中草酸钙的形成有助于维持液泡以及叶绿体中的游离钙离子浓度处于较低水平,由于草酸钙的溶解度很低,它的形成对细胞的渗透调节十分重要[32],因而钙对作物的生长及生理有重要影响。也有研究发现,钙能促进植物生长和养分吸收[33]。本研究槟榔在外源钙处理下,植株氮磷钾含量随钙浓度的增加呈先增后减趋势,以钙浓度200~300 mg/kg处理下植株氮磷钾积累量较大。槟榔中钙的积累主要在叶,在0~300 mg/kg钙处理下,茎、叶部钙转移系数增加,而根转移系数整体呈减小趋势,表明钙处理促进了钙从地下部转移至地上部,在地上部积累贮藏。钙处理促进了槟榔对氮磷钾钙的吸收,通常钾与钙具有拮抗作用,本研究中钙浓度≤ 200 mg/kg表现为协同增效作用,而钙浓度300~500 mg/kg处理表现为拮抗作用。施加外源钙浓度≤ 200 mg/kg时能促进钙向茎叶中转移,钙浓度≤ 300 mg/kg时能促进钙在根茎叶中的积累,而钙浓度≥ 400 mg/kg时钙转移系数和钙积累量均减少,并开始抑制氮、钾的吸收。养分积累量对外源钙的响应与生长指标相、渗透调节物质、抗氧化酶对外源钙的响应高度一致。
4 结论本研究结果表明,槟榔生长发育能对外源钙做出响应,且形态、生理、养分等指标对外源钙的响应相一致,中钙浓度(≤ 300 mg/kg)处理下,槟榔渗透调节物质(可溶性糖、脯氨酸含量),抗氧化酶(SOD、POD、CAT)能做出积极响应,有效调节槟榔各组织细胞的渗透压,清除活性氧,维持细胞的稳定性及活性氧平衡,细胞膜损伤减少,提高钙的积累量和转移系数,增加氮磷钾养分吸收,促进槟榔株高、根长、根数和干物质等形态指标。钙浓度≥ 400 mg/kg时,槟榔渗透调节功能下降,抗氧化酶活性降低,细胞渗透压和活性氧平衡失衡,膜脂过氧化产物MDA积累,生理功能降低,钙含量、钙转移系数和氮钾含量减少,槟榔养分吸收能力下降,槟榔生长受到抑制。因此槟榔生产中应该适当补充外源钙,最适土壤钙浓度范围为200~300 mg/kg。
| [1] |
李佳, 刘立云, 周焕起, 齐兰. 海南岛不同产量水平槟榔叶片营养元素丰缺状况调查[J]. 中国南方果树, 2019, 48(1): 13-15, 19. DOI:10.13938/j.issn.1007-1431.20180147 LI J, LIU L Y, ZHOU H Q, QI L. Investigation on the abundance and deficiency of nutrient elements in betel nut leaves at different yield levels in Hainan Island[J]. South China Fruit Tree, 2019, 48(1): 13-15, 19. DOI:10.13938/j.issn.1007-1431.20180147 |
| [2] |
车海彦, 曹学仁, 罗大全. 海南槟榔黄化病诊断及病原快速检测技术研究与示范应用//中国植物保护学会2019年学术年会论文集90[C]. 北京: 中国植物保护学会, 2019: 1. CHE H Y, CAO X R, LUO D Q. Hainan betel nut yellowing disease diagnosis and rapid pathogen detection technology research and demonstration application//Proceedings of the Chinese Society for Plant Protection 2019 Annual Conference[C]. Beijing: China Plant Protection Society, 2019 : 1. |
| [3] |
HEPLER P K. Ca: A central regulator of plantgrowth and developmen[J]. Plant Cell, 2005, 17(8): 2142-2155. DOI:10.1105/tpc.105.032508 |
| [4] |
李雪, 王胜男, 程江珂. 干旱胁迫对植物体内钙离子含量和分布的影响研究进展[J]. 种业导刊, 2019(12): 3-7. DOI:10.3969/j.issn.1003-4749.2019.12.001 LI X, WANG S N, CHENG J K. Advance of effects of drought stress on content and distribution of Ca2+ in plants[J]. Journal Of Seed Industry Guide, 2019(12): 3-7. DOI:10.3969/j.issn.1003-4749.2019.12.001 |
| [5] |
孙悦. 钙对油松幼苗生长及生理特征影响研究[D]. 沈阳: 沈阳农业大学, 2020. DOI: 10.27327/d.cnki.gshnu.2020.000503. SUN Y. Effects of calcium on growth and physiological characteristics of Pinus tabuliformis seedlings[D]. Shenyang: Shenyang Agricultural University, 2020. DOI: 10.27327/d.cnki.gshnu.2020.000503. |
| [6] |
檀龙颜, 马洪娜. 植物响应钙离子胁迫的研究进展[J]. 植物生理学报, 2017, 53(7): 1150-1158. DOI:10.13592/j.cnki.ppj.2017.0036 TAN L Y, MA H N. Advance in the research of plant in response to calcium ions stress[J]. Plant Physiology Communications, 2017, 53(7): 1150-1158. DOI:10.13592/j.cnki.ppj.2017.0036 |
| [7] |
韩志平, 张海霞, 李侠, 张红利. 硝酸钙胁迫对黄瓜幼苗生长和生理特性的影响[J]. 北方园艺, 2019, 32(1): 22-29. DOI:10.11937/bfyy.20181594 HAN Z P, ZHANG H X, LI X, ZHANG H L. Effects of Ca(NO3)2 stress on growth and physiological properties of cucumber seedlings[J]. Northern Horticulture, 2019, 32(1): 22-29. DOI:10.11937/bfyy.20181594 |
| [8] |
李华东, 白亭玉, 郑妍, 张贺, 林电. 土壤施钙对芒果果实钾、钙、镁含量及品质的影响[J]. 中国土壤与肥料, 2014, 50(6): 76-80. DOI:10.11838/sfsc.20140614 LI H D, BAI T Y, ZHENG Y, ZHANG H, LIN D. Effects of different lime nitrate application rates on potassium, calcium and magnesium content and quality in mango[J]. Soils and Fertilizers Sciences in China, 2014, 50(6): 76-80. DOI:10.11838/sfsc.20140614 |
| [9] |
龚子同, 张甘霖, 赵文君, 陈志诚, 欧阳洮. 海南岛土壤中铝钙的地球化学特征及其对生态环境的影响[J]. 地理科学, 2003, 23(2): 200-207. DOI:10.3969/j.issn.1000-0690.2003.02.012 GONG Z T, ZHANG G L, ZHAO W J, CHEN Z C, OU Y Z. Geochemical characteristics of aluminum and calcium of soils and their impact on ecological environment in Hainan Island[J]. Scientia Geographica Sinica, 2003, 23(2): 200-207. DOI:10.3969/j.issn.1000-0690.2003.02.012 |
| [10] |
郑炳松. 现代植物生理生化研究技术[M]. 北京: 气象出版社, 2006: 277. ZHENG B S. Modern plant physiology and biochemistry research technology[M]. Beijing: China Meteorological Press, 2006: 277. |
| [11] |
彭志英, 蒋黎. 紫外速率直接法测定过氧化氢酶活性[J]. 华西医学, 1995, 10(1): 4-8. PENG Z Y, JIANG L. Ultraviolet rate direct method for determination of catalase activity[J]. West China Medical Journal, 1995, 10(1): 4-8. |
| [12] |
李胜. 西葫芦耐热生理生化特性及其外源物质处理效应研究[D]. 杨凌: 西北农林科技大学, 2009. LI S. Study on heat-resistant physiological and biochemical characteristics of summer squash and the treatment effect of exogenous substances[D]. Yangling: Northwest A & F University, 2009. |
| [13] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 147-168, 193-197. LU R K. Soil agricultural chemical analysis method[M]. Beijing: China Agricultural Science and Technology Press, 2000: 147-168. |
| [14] |
孙克香, 杨莎, 郭峰, 刘翠敏, 孟静静, 胡春梅, 李新国. 高温强光胁迫下外源钙对甜椒(Capsicum fructescehs L.)幼苗光合生理特性的影响[J]. 植物生理学报, 2015, 51(3): 280-286. DOI:10.13592/ppj.2014.0448 SUN K X, YANG S, GUO F, LIU C M, MENG J J, HU C M, LI X G. Effects of exogenous calcium on photosynthetic chracteristics of sweet pepper(Capsicum fructescens L.)Seedlings[J]. Plant Physiology Communications, 2015, 51(3): 280-286. DOI:10.13592/ppj.2014.0448 |
| [15] |
翟江, 高原, 张晓伟, 韩鲁杰, 毕焕改, 李清明, 艾希珍. 硅钙对日光温室黄瓜光合作用及产量和品质的影响[J]. 园艺学报, 2019, 46(4): 701-713. DOI:10.16420/j.issn.0513-353x.2018-0687 ZHAI J, GAO Y, ZHANG X W, HAN L J, BI H G, LI Q M, AI X Z. Effects of silicon and calcium on photosynthesis, yield and quality of cucumber in solar-greenhouse[J]. Acta Horticulturae Sinica, 2019, 46(4): 701-713. DOI:10.16420/j.issn.0513-353x.2018-0687 |
| [16] |
彭博, 徐鸣洲, 王妍, 刘云根. 钙胁迫对狭叶香蒲的生长及逆境生理指标的影响[J]. 西部林业科学, 2020, 49(4): 163-170. DOI:10.16473/j.cnki.xblykx1972.2020.04.025 PENG B, XU M Z, WANG Y, LIU Y G. Effects of calcium stress on growth and physiological index of Typha angustifolia L. in Karst Wetland[J]. Journal of West China Forestry Science, 2020, 49(4): 163-170. DOI:10.16473/j.cnki.xblykx1972.2020.04.025 |
| [17] |
赵鑫, 王文娟, 王普昶, 黄莉娟, 赵丽丽. 不同钙浓度对宽叶雀稗幼苗的生长和抗性生理的影响[J]. 植物生态学报, 2019, 43(10): 909-920. DOI:10.17521/cjpe.2019.0235 ZHAO X, WANG W J, WANG P C, HUANG L J, ZHAO L L. Effects of different calcium concentrations on growth and physiology of Paspalum wettsteinii seedlings[J]. Chinese Journal of Plant Ecology, 2019, 43(10): 909-920. DOI:10.17521/cjpe.2019.0235 |
| [18] |
孙国荣, 关旸, 阎秀峰. 盐胁迫对星星草幼苗保护酶系统的影响[J]. 草地学报, 2001, 9(1): 34-38. DOI:10.11733/j.issn.1007-0435.2001.01.006 SUN G R, GUAN Y, YAN X F. Effect of Na2CO3 stress on defensive enzyme system of Puccinellia tenuif lora Seedlings[J]. Acta Agrestia Sinica, 2001, 9(1): 34-38. DOI:10.11733/j.issn.1007-0435.2001.01.006 |
| [19] |
成广雷, 张海娇, 赵久然, 刘春阁, 王元东, 王晓光, 王荣焕, 陈传永, 徐田军. 临界胁迫贮藏条件下不同基因型玉米种子活力及生理变化[J]. 中国农业科学, 2015, 48(1): 33-42. DOI:10.3864/j.issn.0578-1752.2015.01.04 CHENG G L, ZHANG H J, ZHAO J R, LIU C G, WANG Y D, WANG X G, WANG R H, CHEN C Y, XU T J. Vigor and physiological changes of different genotypes of maize seed(Zea mays L.)under critical stress storage conditions[J]. Scientia Agricultura Sinica, 2015, 48(1): 33-42. DOI:10.3864/j.issn.0578-1752.2015.01.04 |
| [20] |
杨发荣, 刘文瑜, 黄杰, 魏玉明, 金茜. 不同藜麦品种对盐胁迫的生理响应及耐盐性评价[J]. 草业学报, 2017, 26(12): 77-88. DOI:10.11686/cyxb2016412 YANG F R, LIU W Y, HUANG J, WEI Y M, JIN X. Physiological responses of different quinoa varieties to salt stress and evaluation of salt tolerance[J]. Acta Prataculturae Sinica, 2017, 26(12): 77-88. DOI:10.11686/cyxb2016412 |
| [21] |
ZAINAB M K, GHASEM K, MOZAFAR S. Cold-induced changes of proline, malondialdehyde and chlorophyll in spring canola cultivars[J]. Journal of Plant Physiology and Breeding, 2014, 4(1): 1-11. |
| [22] |
ESRA K, CEMIL İ A, SÜLÜN Ü. Effect of cold on protein, proline, phenolic compounds and chlorophyll content of two pepper(Capsicum annuum L.)varieties[J]. Gazi University Journal of Science, 2010, 23(1): 1-6. |
| [23] |
连佳, 刘芳, 张婷, 苏婷, 骆建霞, 史燕山. 氯化钙对盐胁迫下金叶过路黄生长及生理特性的影响[J]. 天津农学院学报, 2013, 20(1): 16-20. DOI:10.3969/j.issn.1008-5394.2013.01.004 LIAN J, LIU F, ZHANG T, SU T, LUO J X, SHI Y S. Effects of calcium chloride on growth and physiological properties of Lysimachia nummulari'Aurea'under salt-stress[J]. Journal of Tianjin Agricultural College, 2013, 20(1): 16-20. DOI:10.3969/j.issn.1008-5394.2013.01.004 |
| [24] |
冀乙萌, 惠杜娟, 李瑞梅, 郭建春. 钙对低温胁迫下木薯抗寒相关生理指标的影响[J]. 热带作物学报, 2012, 33(5): 894-898. DOI:10.3969/j.issn.1000-2561.2012.05.022 JI Y M, HUI D J, LI R M, GUO J C. Effects of Ca2+ on cold-resistance related physiological indexes in cassava under chilling stress[J]. Chinese Journal of Tropical Crops, 2012, 33(5): 894-898. DOI:10.3969/j.issn.1000-2561.2012.05.022 |
| [25] |
MINORSKY P V. A heuristic hypothesis of chilling injury in plants a role for Ca as the primary physiological transducer of injury[J]. Plant Cell & Environment, 1985, 8(2): 75-94. DOI:10.1111/j.1365-3040.1985.tb01226.x |
| [26] |
CHRISTOPH P, ULF-PETER H, HEATHER K, MARC R K. Temperature sensing by plants the primary characteristics of signal perception and Ca response[J]. The Plant Journal, 1999, 18(5): 491-497. DOI:10.1046/j.1365-313X.1999.00471.x |
| [27] |
彭淼, 钟晓红, 张玲, 杨塞. 钙对干旱胁迫下草莓SOD、CAT、PPO活性的影响[J]. 长江大学学报(自然科学版)农学卷, 2009, 6(1): 11-14, 110-111. DOI:10.3969/j.issn.1673-1409(S).2009.01.004 PENG M, ZHONG X H, ZHANG L, YANG S. Effects of calcium on activity of SOD, CAT, PPO of strawberry under drought stress[J]. Journal of Yangtze University(Natural Science Edition)Agricultural Science Volumn, 2009, 6(1): 11-14, 110-111. DOI:10.3969/j.issn.1673-1409(S).2009.01.004 |
| [28] |
李东霞, 符海泉, 杨伟波, 徐中亮. 不同钙处理对2份海南花生种质资源农艺性状和防御酶系统的影响[J]. 江苏农业科学, 2019, 47(10): 117-121. DOI:10.15889/j.issn.1002-1302.2019.10.025 LI D X, FU H Q, YANG W B, XU Z L. Effects of different calcium treatments on agronomic traits and active oxygen defense enzyme system of two peanut germplasm resources from Hainan Province[J]. Jiangsu Agricultural Sciences, 2019, 47(10): 117-121. DOI:10.15889/j.issn.1002-1302.2019.10.025 |
| [29] |
MORI I C, SCHROEDER J I. Reactive oxygen species activation of plant Ca2+ channels. A signaling mechanism in polar growth, hormone transduction, stress signaling, and hypothetically mechanotransduction[J]. Plant Physiology, 2004, 702-708. DOI:10.1104/pp.104.042069 |
| [30] |
李婷婷, 陈彦云, 沈文娟, 陈陆祺, 陈银花, 曹君迈. 钙对贮藏期马铃薯块茎渗透调节物质及SOD的影响[J]. 西南农业学报, 2019, 32(5): 1011-1015. DOI:10.16213/j.cnki.Scjas.2019.5.010 LI T T, CHENG Y Y, SHEN W J, CHEN L Q, CHEN Y H, CAO J M. Effects of calcium on osmotic adjustment substances and SOD in potato tubers during storage[J]. Southwest China Journal of Agricultural Sciences, 2019, 32(5): 1011-1015. DOI:10.16213/j.cnki.Scjas.2019.5.010 |
| [31] |
潘瑞炽. 植物生理学(第六版)[M]. 北京: 高等教育出版社, 2008: 31. PAN R C. Plant Physiology(Sixth Edition)[M]. Beijing: Higher Education Press, 2008: 31. |
| [32] |
张建平. 作物营养缺素诊断与科学施肥[M]. 北京: 中原农民出版社, 2014: 19. ZHANG J P. Crop nutrient deficiency diagnosis and scientific fertilization[M]. Beijing: Zhongyuan Farmers Publishing House, 2014. |
| [33] |
李冰, 王昌全, 冯长春, 李廷轩, 张锡洲. 喷施不同钙肥对莴笋产量及品质的影响[J]. 中国农学通报, 2004(2): 129-131. DOI:10.3969/j.issn.1000-6850.2004.02.047 LI B, WANG C Q, FENG C C, LI T X, ZHANG X Z. Effects on the yield and quality of lettuce by the different calcium fertilizers spraying[J]. Chinese Agricultural Science Bulletin, 2004(2): 129-131. DOI:10.3969/j.issn.1000-6850.2004.02.047 |
 2021, Vol. 48
2021, Vol. 48