文章信息
基金项目
- 广东省自然科学基金(2018A030313464);广州市农村科技特派员项目(GZKTP202038);广东省重点研发项目(2019B020214001)
作者简介
-
肖自添(1981—),女,硕士,副研究员,研究方向为食药用菌资源收集保藏、高效栽培与深加工,E-mail: xzt2006@163.com
肖自添,副研究员,任职于广东省农业科学院蔬菜研究所,广东省农业科技特派员,一直从事食药用菌资源收集鉴评、高效栽培及品质分析等科研工作。主持并参与省重大科研、省基金、省科技特派员、省乡村振兴等多项科研项目,获广东省科技进步奖二等奖1项(排名第2),广东省农业技术推广奖一等奖1项(排名第2);获国家发明专利2项;出版专著3部;发表科技论文15篇。作为广东省农村科技特派员,对口开展科技服务,为200多户贫困户提供了农业技术服务,帮助贫困户掌握灵芝、草菇、竹荪、大球盖菇、黑皮鸡枞等食用菌种植技术,取得良好的社会效益; 何焕清,研究员,中国食用菌协会常务理事、标准委员会专家委员,中国农业科技下乡团食用菌专家组副秘书长,广东省有机农业协会副会长,广东省农村科技特派员,广东省林下经济专家组成员。被全国第六届食用菌学术会议授予全国食用菌先进工作者、被中国食用菌协会授予全国小蘑菇新农村先进工作者。主要从事从事食药用菌资源收集、优良菌株筛选、高效栽培技术研究及深加工产品研发工作承担国家级、省科技厅等各级科研项目及横向联系科技项目30多项,收集保存灵芝、草菇、平菇等食药用菌菌株100多个,获广东省科学技术进步二等奖1项,三等奖1项、广东省农业技术推广奖一等奖1项,三等奖1项、市厅级科学技术奖3项,获国家授权发明专利5项、实用新型专利2项,发表科技论文40多篇,单独或参与编著的著作18部.
通讯作者
- 何焕清(1965—),男,研究员,研究方向为食药用菌资源收集、高效栽培与深加工,E-mail:hhq407@sina.com.
文章历史
- 收稿日期:2021-07-23
【研究意义】假芝〔Amauroderma rugosum(Blume & T. Nees)Torrend〕是灵芝科假芝属真菌,因子实体损伤后会分泌血红色物质,民间也称之为“血芝” [1]。我国假芝属真菌资源丰富,目前已鉴定的有22个种,分布于热带、亚热带地区,广东、广西、云南、福建、台湾、贵州、香港、海南等地均有发现[2]。假芝被认为是《神农本草经》记载的“六芝”中的“黑芝”,具有悠久的民间药用历史[3]。现代研究表明,假芝属真菌具有消炎[4]、抗肿瘤[5]、免疫调节[6]、抗氧化[7]等作用,且部分活性优于多种已被熟知的食药用菌,极具研究开发利用价值。【前人研究进展】对假芝属真菌子实体和菌丝体发酵菌液的成分分析表明,有机相提取物中的麦角甾醇、巴西红厚壳素、6- 脱氧巴西红厚壳素、乙醇提取物等成分具有抑制肿瘤细胞生长、抑制LPS诱导NO产生、促进消炎因子IL-10表达等作用[8-11];水提物,如多糖等也具有免疫调节和抑制肿瘤细胞生长等作用,其作用机理可能是通过促进细胞凋亡而抑制肿瘤生长[12-13]。通过急性和亚慢性毒理实验,表明皱盖假芝多糖对动物体无明显毒性,麦角甾醇组分对成纤细胞系(正常细胞)NIH3T3在0~150 μmol/L无明显细胞毒性,表明皱盖假芝自然提取物安全性高[14]。灵芝多糖具有“生物反应调节剂”的作用,是一种优良的抗氧化活性物质[15],不同灵芝品种多糖含量及其抗氧化活性各不相同[16-17],真菌多糖的活性与多糖的相对分子质量、单糖组成、糖苷键类型、一级结构和高级结构等相关[18]。目前对假芝属真菌多糖研究报道较少,潘鸿辉等[19]分离提取了皱盖假芝(Amauroderma rude)子实体多糖F212,对其单糖组成分析表明,该糖由葡萄糖、甘露糖、半乳糖、阿拉伯糖等7种单糖组成,多糖F212具有明显的免疫调节活性,可以增强免疫功效。伍燕等[20]对假芝菌丝体多糖纯化、结构及抗氧化活性做了相关研究,结果显示该多糖由半乳糖、鼠李糖和甘露糖组成,其中半乳糖含量最高,抗氧化试验表明假芝菌丝体粗多糖效果优于精制多糖。
【本研究切入点】本课题组从广州市白云山采集分离得到一株野生假芝(Amauroderma rugosum BYWZ),成功驯化栽培,其子实体水提液抗氧化活性比目前常规栽培的灵芝、紫芝强[21]。【拟解决的关键问题】在前期研究基础上开展驯化假芝子实体粗多糖组成、抗氧化活性等研究,以期促进假芝多糖的深入开发利用,为开发抗氧化功能产品提供理论依据。
1 材料与方法 1.1 试验材料驯化栽培的野生假芝(Amauroderma rugosum BYWZ)子实体,由广东省农业科学院蔬菜研究所白云试验基地2018年1—6月栽培获得(图 1)。子实体经烘箱60 ℃烘干,干燥阴凉处存放备用。

|
| 图 1 驯化栽培的假芝子实体 Fig. 1 Fruit body of cultivated Amauroderma rugosum |
羟基自由基试剂盒、总抗氧化能力(T-AOC)试剂盒购自南京建成生物工程研究所;HNY- 200D恒温摇床(天津欧诺);SANYO MLS-3750灭菌锅(日本);RE-2000A旋转蒸发仪(上海亚荣);恒温水浴锅HH-4(邦西仪器);SWCJ-1CU超净工作台(苏州安泰);全波长酶标仪Multiskan Spectrum(芬兰Thermo Scientific);紫外可见分光光度计Beckman Coulter DU 800(美国);18ND真空冷冻干燥机(宁波新芝)等。
1.2 多糖样品制备取假芝干品100 g,粉碎,按1 ∶ 20料液比加入蒸馏水,置100 ℃水浴3 h,室温冷却,抽滤,滤液旋转蒸发浓缩至适当体积,用胰蛋白酶法和Sevage法去蛋白,透析,旋转蒸发至适当体积,真空冷冻干燥,得假芝子实体粗多糖(图 2)。胰蛋白酶法和Sevage法去蛋白具体步骤:

|
| 图 2 提取的假芝子实体粗多糖 Fig. 2 Crude polysaccharides extracted from fruit body of Amauroderma rugosum |
将粗多糖溶液pH值调至8,2% 浓度胰蛋白酶酶液和粗多糖溶液分别同时放入37 ℃水浴锅中预热10 min,再把两者充分混合(酶液∶样液=1 ∶ 10),震荡30 min后放入100 ℃水浴锅中灭酶10 min,冷却至室温,加入1/4体积Sevage试剂,剧烈震荡20 min,分液漏斗分离,取上清,3次重复,得清液。将去蛋白的多糖清液倒入透析袋中(MD5000),用夹子夹紧避免漏液,置于去离子水容器中静置透析,每4~8 h更换超纯水一次,直至透析液清澈,约48 h。
1.3 多糖含量检测采用苯酚- 浓硫酸法测定假芝子实体粗多糖含量。
1.4 抗氧化活性测定1.4.1 子实体多糖溶液配制 称取假芝子实体粗多糖,用蒸馏水配成0.5、07、0.9、1.0、1.5 mg/mL不同浓度样液,进行总抗氧化能力、羟基自由基清除率测定,3次重复。
1.4.2 总抗氧化能力(T-AOC)测定 ABTS在适当的氧化剂作用下氧化成绿色的ABTS自由基,在抗氧化物存在时,ABTS自由基的产生会被抑制,在405 nm或734 nm测定ABTS自由基的吸光度即可计算出样品的总抗氧化能力。Trolox是一种Ve类似物,具有抗氧化能力,用作其他抗氧化物总抗氧化能力的参考。具体操作依照试剂盒具体要求进行。
ABTS自由基清除率计算公式如下:
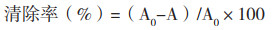
|
式中,A0为ABTS自由基溶液的吸光度,A为加药液后的吸光度。
1.4.3 羟基自由基(OH·-)清除率测定 具体操作依照试剂盒具体要求进行。按照试剂盒步骤配制好试剂,应用液先在37 ℃水浴中预热3 min,然后分别在空白管、标准管、对照管、测定管添加试剂,底物应用液、样本、试剂三应用液、混匀,37 ℃反应1 min,立即加入显色剂终止反应,混匀,室温放置20 min后550 nm测定吸光值。
羟基自由基清除率计算公式如下:
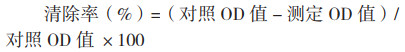
|
试验委托广州市欣源生物科技有限公司完成,RAW264.7小鼠单核巨噬细胞白血病细胞购自广州速业生物科技有限公司,采用MTS法检测细胞增殖。试验设5个不同浓度处理,分别为0、25、50、100、200 μg/mL假芝子实体粗多糖,3次重复。
1.6 多糖单糖组分及蛋白质含量测定试验委托北京中科光析化工技术研究所(食品实验室)完成,假芝子实体粗多糖分子量(GPC凝胶渗透色谱)、蛋白质(凯氏定氮)、氨基酸含量(HPLC)、单糖组成(HPLC)等。
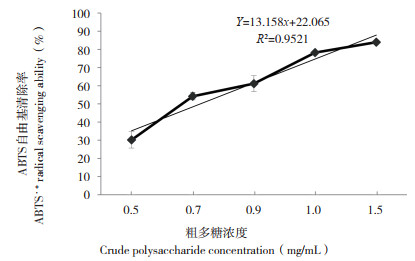
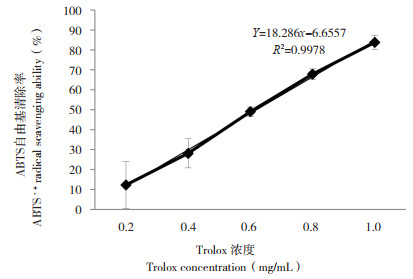
2 结果与分析 2.1 假芝子实体粗多糖总抗氧化能力ABTS自由基清除率用于评价抗氧化能力大小,清除率越大表明该物质抗氧化能力越强。假芝子实体粗多糖总抗氧化活性(ABTS法)如图 3所示。随着假芝子实体提取的粗多糖质量浓度增大,ABTS自由基清除率升高,清除率与质量浓度呈量效关系;当浓度为0.7 mg/mL时,清除率超过50%,当浓度为1.5 mg/mL时清除率达83.95%,与1.0 mg/mLTrolox标准物清除率(83.79%)相当(图 4)。假芝子实体粗多糖ABTS自由基清除率EC50值为0.74 mg/mL,Trolox标准物EC50为0.62 mg/mL,表明假芝子实体粗多糖总抗氧化活性较好。
|
| 图 3 不同浓度粗多糖总抗氧化活性 Fig. 3 Total anti-oxidant activity of crude polysaccharides with different concentrations |
|
| 图 4 Trolox总抗氧化活性标准曲线 Fig. 4 Standard curve of total anti-oxidant activity of the Trolox |
2.2 假芝子实体粗多糖羟基自由基清除能力
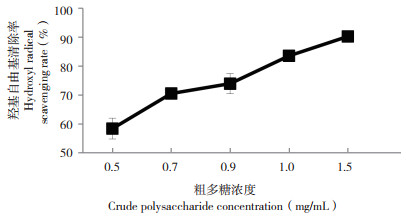
羟基自由基活性强、毒性大,可以与活细胞中任何分子发生反应造成损害,且反应速度极快,假芝子实体提取的粗多糖羟基自由基清除能力如图 5所示。随着粗多糖质量浓度增大,羟基自由基清除率逐渐增高,清除效果与质量浓度呈正相关;当浓度为0.5 mg/mL时,清除率为58.39%,优于0.03%H2O2标准物清除率(46.8%),当浓度为1.5 mg/mL时清除率达90.26%,表明假芝子实体粗多糖羟基自由基清除能力较好。
|
| 图 5 不同浓度粗多糖羟基自由基清除能力 Fig. 5 Hydroxyl radical scavenging capacityof the crude polysaccharides with different concentrations |
2.3 假芝子实体粗多糖对巨噬细胞RAW264.7增殖的影响
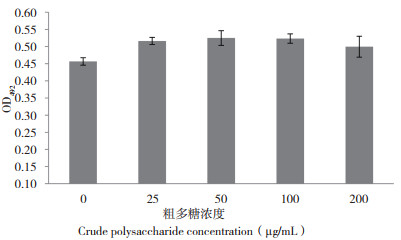
假芝子实体粗多糖对巨噬细胞RAW264.7增殖的影响见图 6。在25~200 μg/mL范围内,假芝子实体粗多糖能够显著促进RAW264.7巨噬细胞的增殖,增殖能力随多糖浓度增大呈先升高后降低趋势,多糖浓度为50 μg/mL时促进细胞增殖能力最强(图 6),与其他浓度没有显著差异,但均高于没有添加多糖的,表明假芝多糖具有潜在的免疫调节能力。
|
| 图 6 不同浓度粗多糖对巨噬细胞RAW264.7增殖的影响 Fig. 6 Effect of crude polysaccharide with different concentrations on the proliferation of macrophage RAW 264.7 |
2.4 假芝子实体粗多糖的单糖组分及含量
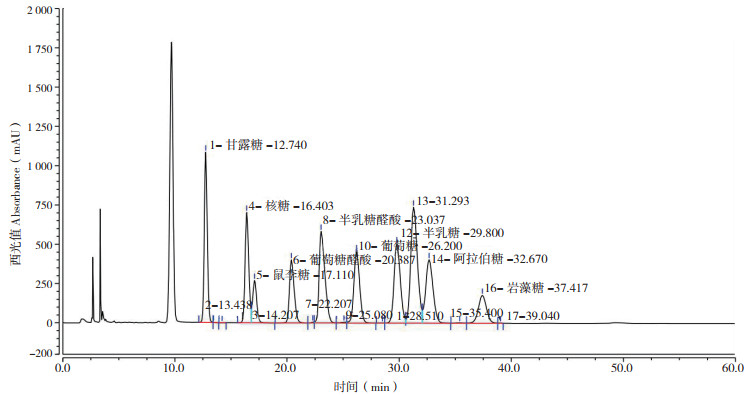
通过苯酚-硫酸法测得假芝子实体粗多糖含量为65.45%。由于粗多糖的单糖组成影响多糖的抗氧化活性,经HPLC测定,假芝子实体粗多糖是由多种单糖组成的杂多糖(图 7),由半乳糖、葡萄糖、甘露糖等10种单糖组成,没有检测到果糖,其中半乳糖含量最高、达1.995%,其次是葡萄糖(1.612%)、甘露糖(1.259%),3种单糖含量占总糖含量的67.87%,半乳糖醛酸(0.037%)、葡萄糖醛酸(0.074%)和木糖(0.13%)含量较低,岩藻糖(0.686%)、核糖(0.525%)、阿拉伯糖(0.474%)和鼠李糖(0.378%)含量居中。含量较高的半乳糖、甘露糖及葡萄糖可能是假芝子实体多糖具有较好抗氧化功效的原因之一。
|
| 图 7 假芝子实体粗多糖中单糖组成的HPLC Fig. 7 HPLC chromatograms for monosaccharides in crude polysaccharide from fruit body of Amauroderma rugosum |
2.5 假芝子实体粗多糖的蛋白质含量及氨基酸组成分析
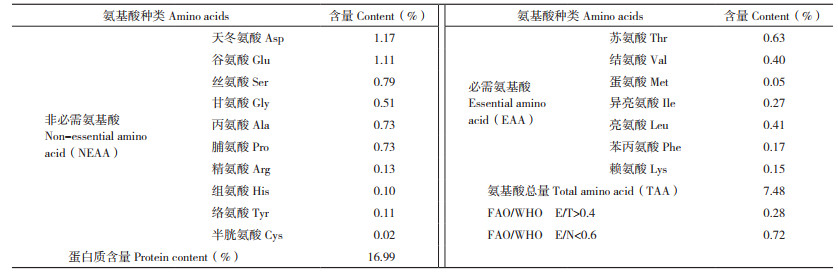
由表 1可知,假芝子实体粗多糖蛋白质含量为16.99%,含有17种氨基酸,总氨基酸含量为7.48%,其中必需氨基酸含量占总氨基酸的28%,天冬氨酸和谷氨酸含量最高,分别为1.17%、1.11%,二者占氨基酸总量30.48%;其次为丝氨酸、丙氨酸、脯氨酸,含量分别为0.79%、0.73% 和0.73%,三者占30.11%;半胱氨酸和蛋氨酸含量最低,分别仅为0.02% 和0.05%。天冬氨酸和谷氨酸被称为鲜味氨基酸,丝氨酸、丙氨酸、脯氨酸等被称为甜味氨基酸,两种氨基酸占比超过60%,使得假芝子实体粗多糖味道香浓,用作产品开发有一定优势。
|
2.6 假芝子实体粗多糖的分子量
一般认为分子量大小与多糖活性有关,大分子量多糖及其侧链的连接方式对多糖的生物活性有重要影响,可确保高级结构的空间构象。分子量分布指数用来表示分子量分布程度的指数,数值比1越大其分子量分布越宽,多分散性程度越大。多糖分子量分布系数α(Mw/Mn)越接近1,说明该多糖分子量分布较均一。假芝粗多糖数均分子量Wn为28.239 ku,重均分子量Mw为57.502 ku,平均分子量Mp为56.038 ku,更高的平均分子量Mz为95.331ku,Mz+1为130.852 ku,分子量分布Pd为2.03629,分子量分布系数α(Mw/Mn)为2.036,表明假芝粗多糖分子链长短分布不均,也可能纯度不够,需要进一步纯化分析。
3 讨论多糖的抗氧化及免疫活性与其单糖组成、分子量、空间结构等关系密切。伍燕等[20]对假芝菌丝体精制多糖进行分析,结果显示该多糖由半乳糖、鼠李糖和甘露糖组成,其中半乳糖含量最高,抗氧化试验表明假芝菌丝体粗多糖效果优于精制多糖。潘鸿辉等[19]对皱盖假芝子实体多糖F212单糖组成分析表明,该糖主要由葡萄糖、甘露糖、半乳糖、鼠李糖、木糖、阿拉伯糖、核糖等7种单糖组成,多糖F212具有明显的免疫调节活性。而本试验子实体粗多糖组分不仅含有菌丝体测得的3种单糖,还检测出其他7种,单糖组分中半乳糖、葡萄糖、甘露糖含量较高,未检测出果糖,对ABTS自由基、羟基自由基清除率高,一定范围内能够显著促进RAW264.7巨噬细胞的增殖。本试验中,假芝子实体多糖比菌丝体多糖单糖组分更丰富,抗氧化效果明显;与皱盖假芝子实体多糖相比,多检测出半乳糖醛酸、岩藻糖、葡萄糖醛酸等3种单糖组分。戚梦等[22]对大革耳子实体多糖组分分析显示,葡萄糖、甘露糖和木糖含量较高,对羟基自由基等清除能力较强。绣球菌子实体多糖则由葡萄糖、甘露糖、半乳糖木糖、果糖构成,分子量在215~393 ku,具有一定的还原能力和清除DPPH自由基的能力,能够促进巨噬细胞RAW264.7的增殖[23]。假芝子实体多糖相比菌丝体多糖组分更丰富,半乳糖、葡萄糖、甘露糖等含量较高,为重要单糖组分,可能与抗氧化及免疫活性有关。
糖蛋白(肽)复合物的功能与其结构特征密切相关。其中,相对分子质量、多糖和蛋白含量、单糖和氨基酸组成、糖基化形式等对其体内外抗肿瘤、免疫调节和细胞凝集等活性影响显著[24]。灵芝多糖也常常含有蛋白或多肽片段,形成糖蛋白或者蛋白聚糖结构,其分子质量、多糖和蛋白质含量、单糖和氨基酸组成、糖基化形式等对其生物活性有显著影响[24]。本试验假芝子实体多糖含蛋白质16.99%,由17种氨基酸组成,多糖数均分子量Mn为28.239 ku,重均分子量Mw为57.502 ku,与报道的大多数灵芝多糖分子质量Mw数量级相当,在104 u左右,水溶性较好,自由基清除效果较好。黄越等[25]也发现猴头菇粗多糖组分中含有的蛋白质是含有糖链和蛋白质残留的糖蛋白,具有较好的清除自由基能力。灵芝多糖也常含有蛋白或多肽片段,形成糖蛋白或者蛋白聚糖结构,其分子量、多糖和蛋白质含量、单糖和氨基酸组成、糖基化形式等对其生物活性有显著影响[24-27]。一般认为分子量大小与多糖活性有关,大分子量多糖及其侧链的连接方式对多糖的生物活性有重要影响,可确保高级结构的空间构象。多糖分子量分布系数Mw/Mn越接近1,说明该多糖分子量分布较均一,纯度较高[28-29]。
4 结论本研究首次对人工驯化栽培的假芝子实体多糖进行分析,假芝子实体粗多糖ARP为暗棕色粉末,对ABTS自由基、羟基自由基清除率高,抗氧化效果好,在一定范围内能够促进RAW264.7巨噬细胞的增殖。假芝子实体多糖是以半乳糖、葡萄糖、甘露糖等为主的蛋白质杂多糖,多糖数均分子量Mn为28.239 ku,重均分子量Mw为57.502 ku,分子量分布系数(Mw/Mn)为2.036。粗多糖蛋白质含量为16.99%,含有17种氨基酸,其中必需氨基酸占总氨基酸的28%,天冬氨酸和谷氨酸含量最高,使得假芝子实体粗多糖香味浓郁。
| [1] |
毕志树, 郑国扬, 李泰辉. 广东大型真菌志[M]. 广州: 广东科技出版社, 1994. BI Z S, ZHENG G Y, LI T H. Macrofungi of Guangdong Province[M]. Guangzhou: Guangdong Science and Technology Press, 1994. |
| [2] |
赵继鼎, 张小青. 中国真菌志[M]. 北京: 科学出版社, 2000. ZHAO J D, ZHANG X Q. Chinese mycology[M]. Beijing: Science Press, 2000. |
| [3] |
赵继鼎. 我国古籍中记载六芝的初步考证[J]. 微生物学通报, 1989(3): 180-181. DOI:10.13344/j.microbiol.china.1989.03.017 ZHAO J D. A preliminary textual research on the records of Liu Zhi in Chinese ancient books[J]. Microbiology China, 1989(3): 180-181. DOI:10.13344/j.microbiol.china.1989.03.017 |
| [4] |
CHAN P M, TAN Y S, CHUA K H, SABARATBAN V, KUPPUSAMY Y R. Attenuation of inflammatory mediators (TNF-αand nitric oxide) and up-regulation of IL-10 by wild and domesticated basidiocarps of Amauroderm rugosum(Blume & T.Nees) torrend in LPS-stimulated RAW264.7 Cells[J]. PLOS ONE, 2015, 10(10): 1-21. DOI:10.1371/journal.pone.0139593 |
| [5] |
JIAO C W, XIE Y Z, YANG X L, LI H R, LI X M, PAN H H, CAI M H, ZHONG H M, YANG B B. Anticancer Activity of Amauroderma rude[J]. PLOS ONE, 2013, 8(6): 1-13. DOI:10.1371/journal.pone.0066504 |
| [6] |
PAN H H, HAN Y Y, HUANG J G. Purification and identification of a polysaccharide from medicinal mushroom Amauroderma rude with immunomodulatory activity and inhibitory effect on tumor growth[J]. Oncotarget, 2015, 6(19): 17777-17791. DOI:10.18632/oncotarget.4397 |
| [7] |
CHAN P M, KANAGASABAPATHY G, TAN Y S. Amauroderma rugosum(Blume & T.Nees) Torrend: Nutritional composition and antioxidant and potential anti-inflammatory properties[J]. EvidenceBased Complementary and Alternative Medicine, 2013, 1-10. DOI:10.1155/2013/304713 |
| [8] |
LI X M, WU Q P, XIE Y Z, DING Y R, DU W W, SDIRI M, YANG B B. Ergosterol purified from medicinal mushroom Amauroderma rude inhibits cancer growth in vitro and in vivo by up-regulating multiple tumor suppressors[J]. Oncotarget, 2015, 6(19): 17832-17846. DOI:10.18632/oncotarget.4026 |
| [9] |
谌永蕾, 马青云, 黄圣卓, 戴好富, 华燕, 赵友兴. 皱盖假芝子实体的化学成分研究[J]. 中草药, 2016, 47(6): 881-885. DOI:10.7501/j.issn.0253-2670.2016.06.004 CHEN Y L, MA Q Y, HUANG S Z, DAI H F, HUA Y, ZHAO Y X. Chemical constituents from fruiting bodies of Amauroderma rude[J]. Chinese Traditional and Herbal Drugs, 2016, 47(6): 881-885. DOI:10.7501/j.issn.0253-2670.2016.06.004 |
| [10] |
黄纪国, 韩园园, 谢意珍, 潘鸿辉. 皱盖假芝化学成分分离及其结构鉴定[J]. 中国食用菌, 2016, 35(1): 42-45. DOI:10.13629/j.cnki.53-1054.2016.01.012 HUANG J G, HAN Y Y, XIE Y Z, PAN H H. Constituents extract from the fruit bodies of Amauroderma rude[J]. Edible Fungi of China, 2016, 35(1): 42-45. DOI:10.13629/j.cnki.53-1054.2016.01.012 |
| [11] |
伍燕, 吴德芳, 韦家美. 皱盖假芝乙醇提取物的LC-MS/MS分析及其体外抗肿瘤活性[J]. 贵州农业科学, 2021, 49(2): 122-127. DOI:10.3969/J.ISSN.1001-3601.2021.02.020 WU Y, WU D F, WEI J M. Antitumor activity in vitro and analysis of ethanol ectract from Amauroderma rude with Liquid Chromatography-tandem Mass Spectrometry (LC-MS/MS)[J]. Guizhou Agricultural Sciences, 2021, 49(2): 122-127. DOI:10.3969/J.ISSN.1001-3601.2021.02.020 |
| [12] |
余雄涛, 黄纪国, 韩园园, 谢意珍, 潘鸿辉. 皱盖假芝水提物抑制单纯疱疹病毒研究[J]. 食用菌学报, 2015, 22(3): 55-59. DOI:10.16488/j.cnki.1005-9873.2015.03.012 YU X T, HUANG J G, HAN Y Y, XIE Y Z, PAN H H. Effect of aqueous extracts of Amauroderma rudis fruit bodies on herpes simplex virus infection of vero cells in vitro[J]. Acta Edulis Fungi, 2015, 22(3): 55-59. DOI:10.16488/j.cnki.1005-9873.2015.03.012 |
| [13] |
PAN H H, ZHAO X J, LEI S W, CAI C, XIE Y Z, YANG X B. The immunomodulatory activity of polysaccharides from the medicinal mushroom Amauroderma rude(Agaricomycetes) is mediated via the iNOS and PLA2-AA pathways[J]. International Journal of Medicinal Mushrooms, 2019, 21(8): 793-804. DOI:10.1615/IntJMedMushrooms.2019031543 |
| [14] |
张一帆, 谢意珍, 杨小兵. 假芝功效研究进展[J]. 食用菌, 2018(2): 1-4. ZHANG Y F, XIE Y Z, YANG X B. Research progress on the efficacy of Amauroderma Murr[J]. Edible Fungi, 2018(2): 1-4. |
| [15] |
赵友兴, 吴兴亮, 黄圣卓. 中国药用菌物化学成分与生物活性研究进展[J]. 贵州科学, 2013, 31(1): 18-27. DOI:10.3969/j.issn.1003-6563.2013.01.002 AO Y X, W U X L, H UA NG S Z. Adva nce on chem ica l constituents and bioactivity of the medicinal fungi in China[J]. Guizhou Science, 2013, 31(1): 18-27. DOI:10.3969/j.issn.1003-6563.2013.01.002 |
| [16] |
滕李铭, 田雪梅, 吴芳, 戴玉成. 13种野生灵芝菌丝体中胞内三萜与多糖含量的比较[J]. 菌物学报, 2021, 40(7): 1-9. DOI:10.13346/j.mycosystema.210005 TENG L M, TIAN X M, WU F, DAI Y C. A comparison of triterpenoids and polysaccharides in 13 species of wild Ganoderma[J]. Mycosystema, 2021, 40(7): 1-9. DOI:10.13346/j.mycosystema.210005 |
| [17] |
张学新, 刘子宁, 王玉茜, 杨悦. 不同品种灵芝多糖得率及其体外抗氧化活性的差异研究[J]. 中国食用菌, 2021, 40(1): 79-83. DOI:10.13629/J.CNKI.53-1054.2021.01.015 ZHANG X X, LIU Z N, WANG Y X, YANG Y. Determination of t he yield of dif ferent va r ieties of Ganoder ma lucidum polysaccharidesand comparison of the antioxidant activities in vitro[J]. Edible Fungi of China, 2021, 40(1): 79-83. DOI:10.13629/J.CNKI.53-1054.2021.01.015 |
| [18] |
张冬雪, 王晓玲, 刘高强. 灵芝多糖的结构及构效关系[J]. 食品业, 2015, 36(11): 258-261. ZHANG D X, WANG X L, LIU G Q. The structure and the structureactivity relationships of Ganoderma lucidum polysaccharides[J]. The Food Industry, 2015, 36(11): 258-261. |
| [19] |
潘鸿辉, 吴清平, 谢意珍, 雷苏炜, 蔡超. 皱盖假芝多糖F212的制备方法和用于预防和/或治疗乳腺癌的应用: 广东, CN110078842A[P]. 2019-08-02. PAN H H, WU Q P, XIE Y Z, LEI S W, CAI C. Preparation of polysaccharides F212 From Amauroderma rude and its application in prevention and/or treatment of breast cancer: Guangdong Province, CN110078842A[P]. 2019-08-02. |
| [20] |
伍燕, 申利群, 朱华. 假芝菌丝体多糖ARP的纯化、结构及抗氧化活性[J]. 食品与发酵工业, 2019, 45(9): 214-219. DOI:10.13995/j.cnki.11-1802/ts.018120 WU Y, SHEN L Q, ZHU H. Purification, structural characteristics, and in vitro antioxidant activities of polysaccharides ARP from a wild Amauroderma rugosum mycelium[J]. Food And Fermentation Industries, 2019, 45(9): 214-219. DOI:10.13995/j.cnki.11-1802/ts.018120 |
| [21] |
肖自添, 刘明, 何焕清. 假芝驯化栽培及其抗氧化活性研究[J]. 菌物学报, 2017, 36(3): 358-366. DOI:10.13346/j.mycosystema.160029 XIAO Z T, LIU M, HE H Q. Domestication and antioxidant activities of Amauroderma rugosum[J]. Mycosystema, 2017, 36(3): 358-366. DOI:10.13346/j.mycosystema.160029 |
| [22] |
戚梦, 刘城移, 赵强, 张琪辉, 胡开辉, 傅俊生. 大革耳子实体多糖抗氧化活性[J]. 菌物学报, 2018, 37(12): 1707-1716. DOI:10.13346/j.mycosystema.180140 QI M, LIU C Y, ZHAO Q, ZHANG Q H, HU K H, FU J S. Polysaccharide antioxidant activities of Panus giganteus[J]. Mycosystema, 2018, 37(12): 1707-1716. DOI:10.13346/j.mycosystema.180140 |
| [23] |
王萌皓, 郝正祺, 常明昌, 孟俊龙, 刘靖宇, 冯翠萍. 绣球菌多糖表征及其抗氧化和免疫活性[J]. 菌物学报, 2019, 38(5): 707-716. DOI:10.13346/j.mycosystema.180317 WANG M H, HAO Z Q, CHANG M C, MENG J L, LIU J Y, FENG C P. Characterization, antioxidant and immunity activities of Sparassis latifolia polysaccharides[J]. Mycosystema, 2019, 38(5): 707-716. DOI:10.13346/j.mycosystema.180317 |
| [24] |
管国强, 李云虹, 杨焱, 崔凤杰, 田雅, 孙文敬, 谯琴, 吴迪. 食药用菌糖蛋白(肽)复合物的结构与功能[J]. 食用菌学报, 2015, 22(1): 79-86. DOI:10.16488/j.cnki.1005-9873.2015.01.015 GUAN G Q, LI Y H, YANG Y, CUI F J, TIAN Y, SUN W J, QIAO Q, WU D. Structure/function relationships of polysaccharideprotein (peptide) complexes from edible/medicinal fungi[J]. Acta Edulis Fungi, 2015, 22(1): 79-86. DOI:10.16488/j.cnki.1005-9873.2015.01.015 |
| [25] |
黄越, 周春晖, 黄惠华. 不同提取方法猴头菇粗多糖的表征及其抗氧化活性的比较[J]. 食品工业科技, 2017, 38(3): 80-86. DOI:10.13386/j.issn1002-0306.2017.03.007 HUANG Y, ZHOU C H, HUANG H H. Characterization and antioxidant activity analysis on the crude Hericium erinaceus polysaccharides extracted by different methods[J]. Science and Technology of Food Indstry, 2017, 38(3): 80-86. DOI:10.13386/j.issn1002-0306.2017.03.007 |
| [26] |
肖自添, 刘明, 何焕清. 一株野生乌芝的鉴定及其生物学特性研究[J]. 广东农业科学, 2016(3): 72-76. DOI:10.16768/j.issn.1004-874x.2016.03.015 XIAO Z T, LIU M, HE H Q. Research on identification and domestication of a wild Amauroderma rugosum[J]. Guangdong Agricultural Sciences, 2016(3): 72-76. DOI:10.16768/j.issn.1004-874x.2016.03.015 |
| [27] |
连瑞丽, 李宇伟, 李存法, 陈忠杰, 班新河, 李九英. 灵芝菌丝体多糖体外抗氧化活性研究[J]. 广东农业科学, 2012(19): 93-94, 101. DOI:10.16768/j.issn.1004-874X.2012.19.051 LIAN R L, LI Y W, LI C F, CHEN Z J, BAN X H, LI J Y. Study on anti-oxidation activity of polysaccharide extracted from myceli a of Ganoderma lucidum[J]. Guangdong Agricultural Sciences, 2012(19): 93-94, 101. DOI:10.16768/j.issn.1004-874X.2012.19.051 |
| [28] |
金鑫, 李文治, 何文江, 陈祖琴, 黄文丽. 不同灵芝菌株的农艺性状和药效成分特异性研究[J]. 广东农业科学, 2017, 44(4): 19-23. DOI:10.16768/j.issn.1004-874X.2017.04.004 JIN X, LI W Z, HE W J, CHEN Z Q, HUANG W L. Agronomic traits and bioactive compounds ofdifferent strains of Ganoderma lucidum[J]. GUangdong Agricultural Sciences, 2017, 44(4): 19-23. DOI:10.16768/j.issn.1004-874X.2017.04.004 |
| [29] |
张帅, 黄嘉玲, 林怡丽, 程昊. 紫外照射对灵芝菌丝体多糖的影响[J]. 广东农业科学, 2017, 44(8): 26-32. DOI:10.16768/j.issn.1004-874X.2017.08.005 ZHANG S, HUANG J L, LIN Y L, CHENG H. Effect of ultraviolet radiation on polysaccharides of Ganoderma lucidum mycelia[J]. Guangdong Agricultural Sciences, 2017, 44(8): 26-32. DOI:10.16768/j.issn.1004-874X.2017.08.005 |
(责任编辑 白雪娜)
 2021, Vol. 48
2021, Vol. 48