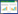文章信息
基金项目
- 广州市科技计划项目(202102020517,202206010058)
作者简介
- 许昌超(1990—),男,博士,工程师,研究方向为土壤与肥料以及植物与微生物互作,E-mail:xuchangchao12345@aliyun.com.
通讯作者
- 张俊涛(1981—),男,硕士,正高级工程师,研究方向为植物营养与肥料,E-mail:350965652@qq.com.
文章历史
- 收稿日期:2022-07-21
【研究意义】磷是植物生长的必需大量元素,土壤中有相当一部分的磷经过土壤化学途径被固定下来,无法被植物直接利用,限制了土壤磷素的有效性以及磷肥的肥效。在我国南方红壤区,土壤磷元素已经成为农林生产过程中的重要限制性因子[1-2]。研究发现,土壤中存在一类微生物,可将土壤中被固定下来的磷转化为有效磷,这类微生物被称作解磷微生物,该发现为提升土壤有效磷含量开辟了新的途径[3-4]。前期,从红壤中筛选出一株可提高土壤有效磷含量的解磷菌株Penicillium brocae(咖啡果小蠹青霉菌),对小白菜(Brassica chinensis L.)和矮牵牛(Petunia hybrida)具有显著的促生效果[5-6]。目前,国外已有解磷青霉菌进入商业化生产和应用,如以拜莱青霉菌为原料的解磷菌剂JumpStart®[7]。关于解磷菌的研究报道并不鲜见,主要集中在液体培养条件下的溶磷能力检测和小分子有机酸分泌相关的溶磷机理阐释,但要真正了解解磷菌在土壤环境中的作用效果,还需要加强其在土壤中定殖动态和解磷能力方面的研究,相关研究成果对推进解磷菌剂的实际应用具有积极意义。【前人研究进展】外源接种的解磷菌在土壤中能够定殖是发挥解磷作用的前提,土壤中复杂的微生物环境给研究特定解磷菌在数量上的动态变化带来困难[8]。张小兰等[8]和Nacoon等[9]利用平板计数法研究了解磷菌株在无菌土壤环境中的定殖情况,并发现土壤定殖能力强的菌株在溶磷效果方面表现更好,该方法对评估解磷菌的应用潜力具有参考意义,但尚不能反映出实际应用过程中土壤环境微生物对解磷菌定殖的影响。也有研究人员利用非灭菌土壤开展了解磷菌定殖方面的研究,如龚明波等[10]利用解磷菌筛选平板研究了解磷青霉菌P. aculeatum在自然土壤中的定殖动态,该方法要求能够准确判断P. aculeatum与其他土壤解磷菌在形态上的差异,通用程度上存在一定的局限性;王向英等[11]通过质粒将氨苄和四环素抗性基因导入到两株解磷细菌中,并利用含有相应抗生素的筛选平板对两株解磷菌在自然土壤中的定殖动态进行了研究,并发现解磷菌定殖数量和解磷效果存在一定关联。除平板计数法以外,Gómez-Muñoz等[12]利用qPCR对接种到土壤中的P. aculeatum群落丰度进行定量,qPCR是目前常用的土壤微生物群落丰度定量分析技术,但是要精确定量某一种功能菌则还需要保证设计引物的高度特异性,且qPCR用于土壤中微生物定量也存在一些异议,有研究人员认为利用qPCR会将微生物残体的DNA也扩增出来,进而对研究土壤中微生物的消长动态变化造成干扰[13]。因此,平板计数法仍然是当前菌落计数最直观和可靠的方法,该方法用于解磷菌定殖动态分析的关键在于如何提高平板的筛选特异性。【本研究切入点】获得具有筛选标记的P. brocea菌株,并利用筛选标记更为准确地对P. brocea在自然土壤中的存活数量进行计数,同时分析解磷菌定殖对土壤有效磷含量的影响。【拟解决的关键问题】本研究拟重点解决两个问题,即如何排除土壤环境中的杂菌对解磷菌P. brocea计数的干扰以及外源接种到土壤中的P. brocea在数量上是如何消长变化的。
1 材料与方法 1.1 试验材料1.1.1 菌株 解磷菌P. brocae为本实验室前期从土壤中筛选出来的解磷菌株,能够提升钙镁磷肥肥效和土壤有效磷含量,并促进小白菜和矮牵牛植株生长[5-6]。同时,利用农杆菌介导的丝状真菌转化体系将含有绿色荧光基因(gfp)、潮霉素抗性基因(hph)及β-葡萄糖苷酸酶基因(gus)的T-DNA片段插入到P. brocae基因组中,获得大量转化子并构建了文库[6]。P. brocae转化子Z3即挑选自文库并用于本研究,与野生型菌株在表观上无明显差异。
1.1.2 培养基 解磷菌培养和生长量监测采用马铃薯葡萄糖水(PDB)培养基,解磷能力测定和群落计数采用Pikovskaya(PVK)培养基[5, 14]。
1.1.3 供试土壤 解磷菌接种土壤采集自增城苗场苗木栽培地块,为南方地区常见红壤。土壤pH值为4.90±0.04,有机质含量为34.4 (±0.5) g/kg,全氮含量1.22 (±0.04) g/kg,全磷含量1.06 (±0.02) g/kg,全钾含量9.45 (±0.02) g/kg,水解氮含量120.6 (±0.2) mg/kg,有效磷含量10.4 (±0.1) mg/kg,速效钾含量53.3 (±0.6) mg/kg。
1.1.4 主要试剂和仪器 潮霉素B(罗氏)和链霉素购自广州研信生物,真菌DNA提取试剂盒(Omega HP Fungal DNA Kit)购自广州飞扬生物,Taq酶和dNTP购自天根生化科技(北京)有限公司,即用型GUS染色液购自飞净生物科技公司,利用Leica荧光显微镜观察菌体绿色荧光。
1.2 测定项目及方法1.2.1 gfp和hph基因片段检测 利用试剂盒提取解磷菌P. brocae野生型及转化子Z3基因组,并以此为模版分别用引物gfpF/gfpR(5'-ACTGGAGTTGTCCCAATTCTTG-3'/5'-CATCCATGCCATGTGTAATCCC-3')和hphF/hphR(5'-TACACAGCCATCGGTCCAGACG-3'/5'-CCGATTCCGGAAGTGCTTGACA-3')扩增gfp和hph基因片段。扩增程序如下:95 ℃ 2 min;95 ℃ 30 s,58 ℃ 20 s,72 ℃ 1 min(32 cycles);72 ℃ 3 min;4 ℃ forever。PCR产物经1.0%(W/V)琼脂糖凝胶电泳后,观察目的片段大小并切胶回收后送华大基因测序确认。
1.2.2 GUS染色和荧光观察 将GUS染色液稀释到工作浓度。用手术刀切取菌落边缘带有菌丝的固体培养基团块,放入1.5 mL离心管并添加0.5 mL GUS染色液。摇床振荡(往复140 r/min,37 ℃)30 min左右即可观察着色。用移液枪头挑取少量液体条件下培养获得的菌丝体,均匀涂布在载玻片上并利用荧光显微镜观察(激发波长488 nm)绿色荧光。
1.2.3 解磷菌生长量和解磷能力测定 将解磷菌接种到PDA平板上培养至产生孢子,收集孢子并稀释至106 CFU/mL。将50 mL PDB培养基分装到250 mL锥形瓶中,并接种0.5 mL上述孢子悬液(5个重复)。将锥形瓶置于摇床培养(160 r/min,28 ℃),分别于培养后2、4、6、8、10 d进行取样,抽滤收集菌体,并在60 ℃条件下烘干至恒重。
另外,将1×106 CFU/mL解磷菌孢子悬液接种到PVK液体培养基中(5个重复),置于温控摇床培养(160 r/min,28 ℃),分别于培养后2、4、6、8、10 d进行取样,用磷钼蓝比色法测定上清有效磷含量。
1.2.4 解磷菌在土壤中的定殖动态 于2021年8月在广州市林业和园林科学研究院3号实验楼楼顶大棚内开展解磷菌土壤接种试验。将供试土壤充分均质化后,向其中接种解磷菌孢子悬液至终浓度为1×106 CFU/g土壤,维持土壤湿度30%~50%(3个重复)。每隔7 d采集1次土壤样本,连续采集10次。取1 g土壤样本,用无菌水按102~105梯度稀释后涂布到PVK固体平板上(含200 mg/L潮霉素B和100 mg/L链霉素),28 ℃静置培养至平板上出现菌落,统计产生溶磷圈的真菌菌落数量,对存疑的菌落进行GUS染色或GFP观察确认,每个平板上的菌落计数在10~80 CFU的为有效计数结果[10]。
1.2.5 土壤有效磷含量测定 对接种解磷菌的土壤有效磷含量进行动态监测,每隔7 d采集1次土壤样本,连续采集10次。土壤经风干研磨后,过孔径2 mm筛,用NaHCO3浸提法测定有效磷含量。
试验数据统计分析和图表制作采用Microsoft Office Excel 2016和SPSS 22.0软件,采用最小显著性差异法(LSD)进行数据差异显著性分析。
2 结果与分析 2.1 转化子Z3携带的分子标记检测图 1为解磷菌P. brocae转化子Z3和野生型菌株Wt在PVK平板上生长7 d后菌落形态,表观上看转化子Z3和野生型菌株无太大差异(图 1A)。另外,转化子Z3可以在含有200 mg/L潮霉素B的PVK平板上正常生长,而野生型菌株则无法产生菌落,说明转化子Z3具有潮霉素抗性,可以作为接下来菌株的筛选标记(图 1A)。通过PCR从转化子Z3基因组上扩增出符合预期大小的hph和gfp基因片段,约分布在700 bp左右,并通过片段测序验证,表明转化子Z3中含有hph和gfp基因(图 1B)。最后,利用GUS染色剂和荧光显微镜分别在转化子Z3菌丝上检测到染料着色和绿色荧光,表明gfp和gus基因在转化子Z3中均可以正常表达(图 1C)。
|
| A:转化子Z3和野生型菌株Wt菌落形态比较及其潮霉素抗性检测;B:转化子Z3基因组中hph(上)和gfp(下)基因片段扩增产物电泳图谱,Wt为对照;C:转化子Z3菌丝的GUS染色和GFP检测,Wt为对照。图示为含菌丝的固体培养基团块在0 min、30 min和3 h的GUS着色情况以及菌丝GUS染色和GFP荧光的显微观察 A: The colonies formed by Z3 and wild type strain (Wt) and their hygromycin resistance test; B: The gel-electrophoresis map of hph (upper) and gfp (lower) gene fragments amplified with Z3 and Wt genome (control); C: The GUS staining and GFP detecting results of Z3 and Wt (control). The pictures showed the GUS staining process of solid culture media with colonies (at 0 min, 30 min and 3 h) and the microscopic views of GUS staining and GFP fluorescence of colonies 图 1 转化子Z3及其携带的分子标记检测 Fig. 1 Detection of transformant Z3 and its molecular markers |
2.2 转化子Z3和野生型菌株的生长速率和解磷能力比较
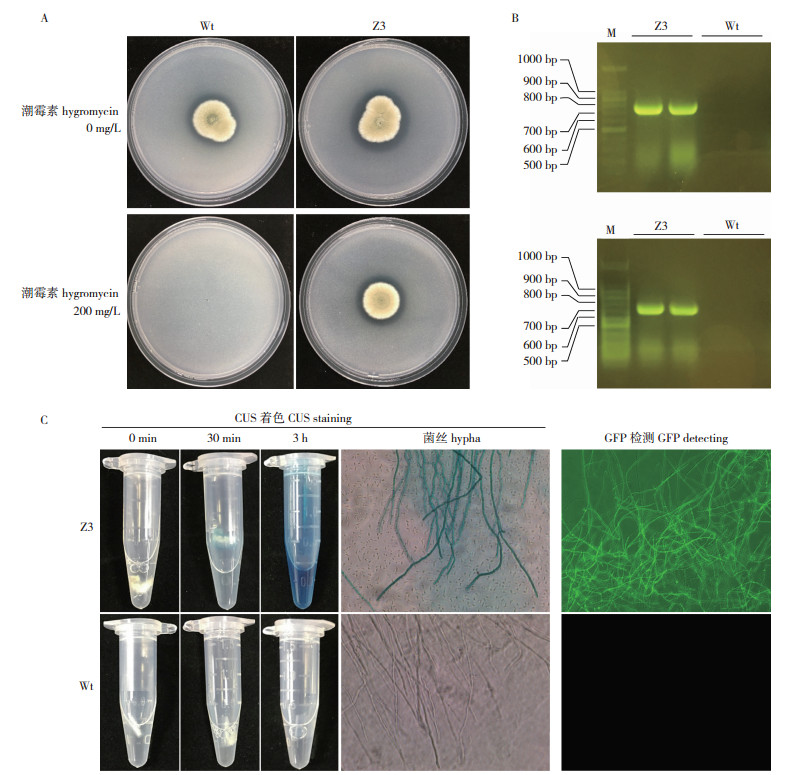
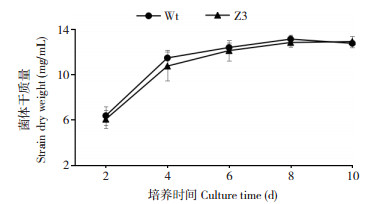
为进一步论证转化子Z3可以用于解磷菌P. brocae在土壤中的定殖动态和解磷效果分析,对转化子Z3和野生型菌株的生长速率和溶磷能力进行比较。连续10 d的菌丝体干质量监测数据表明,转化子Z3和野生型菌株具有趋势相近的生长曲线,并且二者在各监测时间节点上的菌丝体干质量均无显著差异,培养后10 d转化子Z3和野生型菌株的菌丝体干质量分别达到12.91 (±0.50)、12.76 (±0.17) mg/L(图 2)。另外,溶磷能力分析表明转化子Z3和野生型菌株培养10 d内具有相近的溶磷曲线,二者的溶磷量亦无显著差异,且转化子Z3和野生型菌株在培养10 d内的溶磷峰值分别可达到392.82 (±5.11)、395.38 (±19.94) mg/L(图 3)。
|
| 图 2 转化子Z3和野生型菌株Wt的生长曲线 Fig. 2 Growth curves of transformant Z3 and Wt |
|
| 图 3 转化子Z3和野生型菌株Wt的解磷曲线 Fig. 3 Phosphate solubilization curves of transformant Z3 and Wt |
上述研究结果表明,转化操作对转化子Z3的菌体生长速率和溶磷能力未产生显著影响,可替代野生型菌株用于P. brocae在土壤中的定殖动态和解磷效果分析。
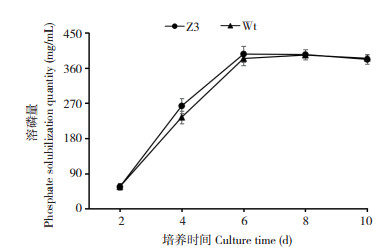
2.3 转化子Z3在土壤中的定殖动态和解磷效果对转化子Z3在土壤中的菌落数量进行为期70 d的监测,发现转化子Z3接种后的前两周土壤中存活的菌落数量呈下降趋势,由预先接种的1×106 CFU/g土壤分别下降到接种后1周的2.2×105 CFU/g土壤和接种后2周的1×105 CFU/g土壤(图 4)。接种后3周土壤中转化子Z3的数量大幅提升并达到峰值(4.3×106 CFU/g),接种后3周到接种后7周解磷菌在土壤中的定殖数量开始缓慢下降,并维持在1×105 CFU/g土壤数量级以上(图 4)。从接种后7周开始,转化子Z3在土壤中的定殖数量开始快速下降,从接种后7周的3.4×105 CFU/g土壤降至接种后10周的1.4×103 CFU/g土壤(图 4)。

|
| 图 4 转化子Z3在土壤中的定殖数量和土壤有效磷含量曲线 Fig. 4 Colony number of transformant Z3 in soil and soil available phosphate content curve |
同时,本研究对转化子Z3接种后土壤有效磷含量进行跟踪研究。数据分析结果表明,从接种后1周开始土壤有效磷含量从10.6 mg/L逐步提升,至接种后7周达到峰值14.7 mg/L,土壤有效磷较本底值增加41.3%。接种7周后土壤有效磷含量逐步下降,至接种后10周降至12.7 mg/L,较土壤本底值有效磷含量仍高出22.1%(图 4)。
通过转化子Z3定殖数量变化曲线和土壤有效磷含量变化曲线的综合比较分析发现,土壤有效磷含量上升阶段,转化子Z3在土壤中的检出数量均维持在1×105 CFU/g土壤数量级左右或以上,当土壤解磷菌数量呈下降趋势并明显低于1×105 CFU/g时,土壤有效磷含量也随之降低(图 4)。
3 讨论随着研究的深入,越来越多的高效解磷菌被筛选出来。刘春菊等[15]和李豆豆等[16]从土壤中获得的解磷真菌在液体培养条件下对磷酸钙的溶解量分别高达1 386.93、869.62 mg/L。另有报道,培养条件经过优化的解磷细菌在实验室条件下对磷酸钙的解磷能力也可达到424.14 mg/L[17]。然而,解磷菌施入到土壤环境后会因微生物间的拮抗、竞争作用或贫瘠的营养环境造成生长和解磷能力上的变化,往往达不到实验室条件下的理想状态[18]。因此,很有必要加强解磷菌在土壤中的定殖动态和解磷效果的研究,为实际生产应用提供参考[19]。
土壤中含有大量的杂菌,利用平板计数法对接种到土壤中的特定解磷菌进行定量时存在较多难点,一方面要尽量减少杂菌数量,另一方面要能准确甄别外观形态上类似的杂菌。利用无菌土壤进行解磷菌定殖动态方面的研究虽然可以避免杂菌干扰,但无法反映出土壤原生微生物对菌株定殖的影响,研究表明菌株在灭菌土壤中的定殖数量和续存时间要显著高于非灭菌土壤[11, 20]。本研究利用链霉素和潮霉素增强了解磷菌PVK筛选平板的特异性,链霉素可大大减少平板上细菌菌落的数量,潮霉素则可筛选掉大量解磷真菌。最后,利用转化子Z3携带的绿色荧光或GUS活性对存疑的菌落进一步甄别,提高了平板计数的效率和准确性。Xian等[21]通过类似方法实现了对土壤中生防菌棘孢木霉的定量,李颖等[22]也通过利福平标记实现了植物促生细菌在土壤中的定殖情况分析。此外,许昌超等[6]还利用菌株携带的GUS标记研究了该解磷菌在植物根部组织中的定殖情况。目前,通过T-DNA插入或质粒转化的方式将外源基因导入宿主菌是实现宿主菌株分子标记的两种便捷途径,但二者各有优缺点。相较后者,前者虽然更稳定(不易随着传代次数增加而丢失),但容易造成宿主基因发生插入突变[23]。另外,在宿主菌中引入外源基因很容易导致宿主菌的生长和代谢状态发生改变。因此,在利用这些方法时应确认相关操作不会对菌株的生长和相应功能产生显著影响。本研究结果表明,转化子Z3在生长速率和解磷能力上与野生型菌株并无显著差异,猜测T-DNA的插入位点位于基因组的非编码序列区域,未直接影响到基因的表达,在真核生物中非编码区域的占比可能超过基因组的98%[24]。
总体来看,外源微生物接种到土壤后的定殖动态变化情况还受到菌株自身遗传特性、土壤理化环境、土著微生物种类、地表植物类别及其根系分泌物情况等诸多因素影响,并且各因素之间的关联较为复杂,制约了当前功能菌株在土壤中定殖机制的研究进展。
另外,本研究结果表明,接种到土壤环境中的解磷菌转化子Z3在数量上呈先下降、后上升和再下降的总体趋势。菌种接种到土壤后数量上的先降后升,可能与菌株对土壤环境的适应性调整有关,在对一株生防木霉的土壤定殖动态研究过程中也发现了类似现象[25]。后期数量上的衰减则可能因种群数量扩大受到土著微生物的拮抗或相互间养分和空间的竞争有关。龚明波等[10]研究发现在30 ℃正常环境温度下,解磷菌P. aculeatum定殖数量在接种到土壤后14 d达到峰值,接种后49 d基本消亡。
本研究发现,解磷菌转化子Z3接种后能提高土壤有效磷含量。在监测时段内,土壤有效磷呈先升后降的趋势,即当解磷菌数量呈下降趋势并明显低于105 CFU/g土壤时,土壤有效磷含量也随之降低。该现象表明,转化子Z3的定殖数量对维持解磷效果可能具有重要作用,土壤中被解磷菌释放出来的有效磷可能会随着解磷菌数量的衰减而被重新固定下来。因此,优化解磷条件,提升解磷菌在土壤中的定殖数量以及定殖稳定性是解磷菌剂开发和应用的重点研究方向[19, 26]。
4 结论本研究利用潮霉素抗性基因和GUS基因等筛选标记的插入和表达,解决了从土壤环境中特异地分离和鉴定解磷菌P. brocae菌落的技术问题,并利用该技术研究解磷菌接种土壤后在数量上的动态变化过程。转化子Z3接种土壤后在数量上呈下降- 上升- 下降的总体趋势,定殖数量在接种后10周仍可维持在1.4×103 CFU/g土壤的水平,说明转化子Z3具有良好的土壤环境适应能力。转化子Z3接种可显著提高有效磷含量,最高可较接种前提升41.3%(接种后7周),至接种后10周较初始土壤有效磷含量仍高出22.1%。最后,转化子Z3土壤定殖数量维持在105 CFU/g土壤的水平或以上时,土壤有效磷含量总体呈增加趋势,且随着后期解磷菌土壤定殖数量上的衰减,有效磷含量也呈下降趋势,间接表明解磷菌在土壤中的解磷效果可能依赖解磷菌的定殖数量。
| [1] |
赵艳, 阮云泽, 张晓波. 王草砖红壤土壤根际解磷菌的分离鉴定及培养条件研究[J]. 广东农业科学, 2014, 41(19): 35-38. DOI:10.3969/j.issn.1004-874X.2014.19.009 ZHAO Y, RUAN Y Z, ZHANG X B. Study on isolation, identification and culture condition of rhizosphere phosphate-solubilizing microorganisms from red paddy soil of king grass[J]. Guangdong Agricultural Sciences, 2014, 41(19): 35-38. DOI:10.3969/j.issn.1004-874X.2014.19.009 |
| [2] |
陈利军, 蒋瑀霁, 王浩田, 赵其国, 孙波. 长期施用有机物料对旱地红壤磷组分及磷素有效性的影响[J]. 土壤, 2020, 52(3): 451-457. DOI:10.13758/j.cnki.tr.2020.03.004 CHEN L J, JIANG Y J, WANG H T, ZHAO Q G, SUN B. Effects of long-term application of organic materials on phosphorus fractions and availability in red soil[J]. Soils, 2020, 52(3): 451-457. DOI:10.13758/j.cnki.tr.2020.03.004 |
| [3] |
WHITELAW M, HARDEN T, HELYAR K. Phosphate solubilisation in solution culture by the soil fungus Penicillium radicum[J]. Soil Biology and Biochemistry, 1999, 31(5): 655-665. DOI:10.1016/S0038-0717(98)00130-8 |
| [4] |
ALAYLAR B, EGAMBERDIEVA D, GULLUCE M, KARADAYI M, ARORA N K. Integration of molecular tools in microbial phosphate solubilization research in agriculture perspective[J]. World Journal of Microbiology and Biotechnology, 2020, 36(7): 93. DOI:10.1007/s11274-020-02870-x |
| [5] |
许昌超, 张俊涛, 叶少萍, 郑富海. 土壤中一株溶磷青霉菌的分离鉴定及其应用效果研究[J]. 中国土壤与肥料, 2020(6): 272-278. DOI:10.11838/sfsc.1673-6257.19484 XU C C, ZHANG J T, YE S P, ZHENG F H. Isolation and the plant growth-promoting capacity characterization of a Penicillium strain derived from soil[J]. Soil and Fertilizer Sciences in China, 2020(6): 272-278. DOI:10.11838/sfsc.1673-6257.19484 |
| [6] |
许昌超, 张俊涛. 溶磷真菌ATMT转化条件优化及其对矮牵牛的促生效果评价[J]. 微生物学报, 2021, 61(2): 417-427. DOI:10.13343/j.cnki.wsxb.20200186 XU C C, ZHANG J T. Optimization of a phosphate-solubilizing fungus ATMT system and evaluation of its growth-promoting effect on Petunia hybrida[J]. Acta Microbiologica Sinica, 2021, 61(2): 417-427. DOI:10.13343/j.cnki.wsxb.20200186 |
| [7] |
O'CALLAGHAN M. Microbial inoculation of seed for improved crop performance: issues and opportunities[J]. Applied Microbiology and Biotechnology, 2016, 100(13): 5729-5746. DOI:10.1007/s00253-016-7590-9 |
| [8] |
张小兰, 韦中, 梅新兰, 徐阳春, 沈其荣. 一种基于根际定殖能力筛选溶磷菌的方法[J]. 南京农业大学学报, 2014, 37(2): 79-84. DOI:10.7685/j.issn.1000-2030.2014.02.013 ZHANG X L, WEI Z, MEI X L, XU Y C, SHEN Q R. A method for screening phosphate solubilizing bacteria based on the rhizosphere colonization ability of strains[J]. Journal of Nanjing Agricultural Universit y, 2014, 37(2): 79-84. DOI:10.7685/j.issn.1000-2030.2014.02.013 |
| [9] |
NACOON S, JOGLOY S, RIDDECH N, MONGKOL W, EKPRASERT J, COOPER J, BOONLUE S. Combination of arbuscular mycorrhizal fungi and phosphate solubilizing bacteria on growth and production of Helianthus tuberosus under field condition[J]. Scientific Report, 2021, 11(1): 6501. DOI:10.1038/s41598-021-86042-3 |
| [10] |
龚明波, 范丙全, 王洪媛. 一株新的溶磷棘孢青霉菌Z32的分离、鉴定及其土壤定殖与溶磷特性[J]. 微生物学报, 2010, 50(5): 580-585. DOI:10.13343/j.cnki.wsxb.2010.05.005 GONG M B, FAN B Q, WANG H Y. Isolation and identification of a novel phosphate-dissolving strain Penicillium aculeatum Z32 and its colonization and phosphate-dissolving characteristics in soil[J]. Acta Microbiologica Sinica, 2010, 50(5): 580-585. DOI:10.13343/j.cnki.wsxb.2010.05.005 |
| [11] |
王向英, 高建华, 孟会生, 张杰, 武欣, 洪坚平. 两株解磷菌的GFP标记及其在复垦土壤中的定殖[J]. 山西农业科学, 2021, 49(8): 976-982. DOI:10.3969/j.issn.1002-2481.2021.08.15 WANG X Y, GAO J H, MENG H S, ZHANG J, WU X, HONG J P. Two phosphate-solubilizing strains tagged by GFP and their colonization in reclaimed soil[J]. Journal of Shanxi Agricultural Sciences, 2021, 49(8): 976-982. DOI:10.3969/j.issn.1002-2481.2021.08.15 |
| [12] |
GÓMEZ-MUÑOZ B, EFTHYMIOU A, DUBEY M, SØLVE J, NICOLAISEN M, JENSEN D F, NYBROE O, LARSEN J. Cellulose amendment promotes P solubilization by Penicillium aculeatum in non-sterilized soil[J]. Fungal Biology, 2022, 126(5): 356-365. DOI:10.1016/j.funbio.2022.03.003 |
| [13] |
ZHANG Y, ZHENG N, WANG J, YAO H, CHAPMAN S. High turnover rate of free phospholipids in soil confirms the classic hypothesis of PLFA methodology[J]. Soil Biology and Biochemistry, 2019, 135: 323-330. DOI:10.1016/j.soilbio.2019.05.023 |
| [14] |
PIKOVSKAYA R I. Mobilization of phosphorus in soil in connection with vital activity of some microbial species[J]. Microbiologiya, 1948, 17: 362-370. |
| [15] |
刘春菊, 王彩霞, 张玉芹, 杜传印, 梁子敬, 于金凤. 一株高效解磷青霉菌株的筛选与鉴定[J]. 山东农业科学, 2017, 49(12): 50-53. DOI:10.14083/j.issn.1001-4942.2017.12.012 LIU C J, WANG C X, ZHANG Y Q, DU C Y, LIANG Z J, YU J F. Screening and identification of one efficient phosphate-solubilizing strain from Penicillium[J]. Shandong Agricultural Sciences, 2017, 49(12): 50-53. DOI:10.14083/j.issn.1001-4942.2017.12.012 |
| [16] |
李豆豆, 尚双华, 韩巍, 房娜娜, 依艳丽. 一株高效解磷真菌新菌株的筛选鉴定及解磷特性[J]. 应用生态学报, 2019, 30(7): 2384-2392. DOI:10.13287/j.1001-9332.201907.033 LI D D, SHANG S H, HAN W, FANG N N, YI Y L. Screening, identification, and phosphate solubilizing characteristics of a new efficient phos-phate solubilizing fungus[J]. Chinese Journal of Applied Ecology, 2019, 30(7): 2384-2392. DOI:10.13287/j.1001-9332.201907.033 |
| [17] |
于淼, 吴红艳, 冯健, 方新, 王智学. 解磷菌623-3的鉴定、培养条件优化及应用[J]. 四川农业大学学报, 2020, 38(5): 572-579. DOI:10.16036/j.issn.1000-2650.2020.05.010 YU M, WU H Y, FENG J, FANG X, WANG Z X. Identification, optimization of culture conditions and application of dephosphorizing bacteria 623-3[J]. Journal of Sichuan Agricultural University, 2020, 38(5): 572-579. DOI:10.16036/j.issn.1000-2650.2020.05.010 |
| [18] |
MANFREDINI A, MALUSA E, COSTA C, PALLOTTINO F, MOCALI S, PINZARI F, CANFORA L. Current methods, common practices, and perspectives in tracking and monitoring bioinoculants in soil[J]. Frontiers in Microbiology, 2021, 12: 698491. DOI:10.3389/fmicb.2021.698491 |
| [19] |
池景良, 郝敏, 王志学, 李杨. 解磷微生物研究及应用进展[J]. 微生物学杂志, 2021, 41(1): 1-7. DOI:10.3969/j.issn.1005-7021.2021.01.001 CHI J L, HAO M, WANG Z X, LI Y. Advances in research and application of phosphorus-solubilizing microorganism[J]. Journal of Microbiolog y, 2021, 41(1): 1-7. DOI:10.3969/j.issn.1005-7021.2021.01.001 |
| [20] |
徐瑞富, 陆宁海, 张定法, 吴利民. 土壤不同微生物量对木霉菌定殖的影响和木霉菌生态学习性研究[J]. 中国生态农业学报, 2007, 15(1): 207-208. DOI:10.3969/j.issn.0253-2654.2001.04.011 XU R F, LU N H, ZHANG D F, WU L M. Effects of different microorganisms on the colonization of Trichoderma spp. in the soil and studies on its biological characters[J]. Chinese Journal of Eco-Agriculture, 2007, 15(1): 2. DOI:10.3969/j.issn.0253-2654.2001.04.011 |
| [21] |
XIAN H Q, LIU L, LI Y H, YANG Y N, YANG S. Molecular tagging of biocontrol fungus Trichoderma asperellum and its colonization in soil[J]. Journal of Applied Microbiology, 2020, 128(1): 255-264. DOI:10.1111/jam.14457 |
| [22] |
李颖, 龙长梅, 蒋标, 韩丽珍. 两株PGPR菌株的花生定殖及对根际细菌群落结构的影响[J/OL]. 生物技术通报, 1-11[2022-07-04]. DOI: 10.13560/j.cnki.biotech.bull.1985.2021-1577. LI Y, LONG C M, JIANG B, HAN L Z. Colonization on the peanuts of two plant-growth promoting rhizobacteria strains and effects on the bacterial community structure of rhizosphere[J]. Biotechnology Bulletin, 1-11[2022- 07- 04]. DOI: 10.13560/j.cnki.biotech.bull.1985.2021-1577. |
| [23] |
HE L, FENG J, LU S, CHEN Z, CHEN C, HE Y, YI X, XI L. Genetic transformation of fungi[J]. International Journal of Developmental Biology, 2017, 61(6/7): 375-381. DOI:10.1387/ijdb.160026lh |
| [24] |
VAISHNAV E D, DE BOER C G, MOLINET J, YASSOUR M, FAN L, ADICONIS X, THOMPSON D A, LEVIN J Z, CUBILLOS F A, REGEV A. The evolution, evolvability and engineering of gene regulatory DNA[J]. Nature, 2022, 603: 455. DOI:10.1038/s41586-022-04506-6 |
| [25] |
古丽君, 徐秉良, 梁巧兰, 尹婷. 生防木霉对草坪土壤微生物区系的影响及定殖能力研究[J]. 草业学报, 2013, 22(3): 321-326. DOI:10.11686/cyxb20130341 GU L J, XU B L, LIANG Q L, YIN T. Impact and colonisation ability of Trichoderma biocontrol on lawn soil microflora[J]. Acta Prataculturae Sinica, 2013, 22(3): 6. DOI:10.11686/cyxb20130341 |
| [26] |
潘建刚, 常亚, 高国日, 时陪福, 张金艳, 张艾艾. 无机解磷菌的分离鉴定及解磷条件优化[J]. 广东农业科学, 2015, 42(6): 56-59. DOI:10.3969/j.issn.1004-874X.2015.06.011 PAN J G, CHANG Y, GAO G R, SHI P F, ZHANG J Y, ZHANG A A. Isolation, identification of phosphate-solubilizing microorganism (PSM) and optimization of solubilizing phosphate[J]. Guangdong Agricultural Sciences, 2015, 42(6): 56-59. DOI:10.3969/j.issn.1004-874X.2015.06.011 |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49