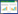文章信息
基金项目
- 国家自然科学基金(31972243);广西农业科学院基本科研业务专项(桂农科2021YT071)
作者简介
- 罗婉笛(1999—),女,在读硕士生,研究方向为植物病毒学,E-mail:2428621371@qq.com.
通讯作者
- 章松柏(1978—),男,博士,副教授,研究方向为病毒监测与分子病毒学,E-mail:yangtze2008@126.com.
文章历史
- 收稿日期:2022-07-22
2. 广西农业科学院植物保护研究所/农业农村部华南果蔬绿色防控重点实验室/广西作物病虫害生物学重点实验室,广西 南宁 530007
2. Plant Protection Research Institute/Guangxi Academy of Agricultural Sciences/Key Laboratory of Green Prevention and Control on Fruits and Vegetables in South China, Ministry of Agriculture and Rural Affairs/Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pests, Nanning 530007, China
【研究意义】双生病毒(Geminiviridae)是一类单链环状DNA病毒,病毒粒体为双联体结构,包裹1条或2条单链环状基因组DNA,长度为2.5~3.0 kb[1]。双生病毒主要侵染双子叶植物,可危害棉花、甘薯、番茄、烟草等多种经济作物[2]。杂草是其重要的中间寄主,在双生病毒的重组及进化过程中起着重要作用,同时,杂草寄主也为双生病毒的蔓延扩散提供重要中间过渡[3-4]。因此,监测杂草上的双生病毒对作物双生病毒的防控具有重要意义。【前人研究进展】双生病毒根据其基因组特征、寄主范围及传播媒介等特征被划分为14个属:分别为菜豆金色黄花叶病毒属(Begomovirus)、玉米线条病毒属(Mastrevirus)、曲项病毒属(Curtovirus)、番茄伪曲项病毒属(Topocuvirus)、甜菜曲项病毒属(Becurtovirus)、芜菁曲项病毒属(Turncurtovirus)、画眉草病毒属(Eragrovirus)、葡萄红斑病毒属(Grablovirus)、大戟小刺潜伏病毒属(Capulavirus)和5个新属:Citlodavirus、Maldovirus、Mulcrilevirus、Opunvirus和Topilevirus,其中,菜豆金色黄花叶病毒属(Begomovirus)是最具经济重要性的一个病毒属,据不完全统计该属病毒至少有445种[5-6]。甘薯双生病毒(sweepoviruses)是侵染甘薯的菜豆金色黄花叶病毒属的总称,已报道有14种可侵染甘薯,而侵染我国甘薯的至少有10种[7],甘薯曲叶病毒(Sweet Potato Leaf Curl Virus,SPLCV)是其中一个重要种[8]。由SPLCV引起的甘薯曲叶病是限制世界甘薯生产的主要病毒病害之一,该病20世纪80年代在中国台湾、日本等地区和国家甘薯上发现,目前已遍及美洲、非洲、欧洲和亚洲[9]。在我国,SPLCV已在辽宁[10]、广东[11]、福建、江苏[12]、云南[13]和湖南[14]等地甘[15]薯或牵牛花上得到鉴定。【本研究切入点】甘薯是湖北重要的粮食作物,病毒病的肆虐严重危害甘薯产业的健康发展。据报道,侵染湖北甘薯的双生病毒主要有甘薯羽状斑驳病毒(Sweet Potato Feathery Mottle Virus,SPFMV)、甘薯褪绿矮化病毒(Sweet Potato Chlorotic Stunt Virus,SPCSV)、黄瓜花叶病毒(Cucumber Mosaic Virus,CMV)和佐治亚甘薯曲叶病毒(SPLCGV)等4种[16],但这些病毒在湖北的发生流行规律仍不清楚。2021年9月,课题组在调查中发现,湖北荆州的圆叶牵牛表现黄脉、叶片卷曲等疑似双生病毒的典型症状,而明确其病原将为该病的防治提供理论支撑。【拟解决的关键问题】本研究拟通过分子生物学手段,对疑似双生病毒侵染的圆叶牵牛进行检测、鉴定,明确引发该类症状的病毒病原,并利用分段克隆、序列比对和遗传进化分析等方法获得相关病毒病原的全基因组序列和遗传进化规律,研究结果将为双生病毒的综合防控提供理论支撑。
1 材料与方法 1.1 试验材料2021年9月从湖北省荆州市市郊田间采集表现黄脉、叶片卷曲等疑似双生病毒典型症状的圆叶牵牛植株叶片,叶片样品经液氮速冻后-80 ℃保存备用。
1.2 植物叶片总DNA的提取采用CTAB法[17]提取圆叶牵牛总DNA:取100 mg叶片样品于液氮中研磨成粉末,加入65 ℃预热的CTAB缓冲液,然后分别加入氯仿- 异戊醇(24 ∶ 1)、异丙醇进行抽提,沉淀用75% 无水乙醇洗涤2次,最后将DNA沉淀溶解于50 μL的ddH2O中,于-20 ℃下保存备用。
1.3 PCR检测利用菜豆金色黄花叶病毒属病毒的通用引物PA:5'-TAATATTACCKGWKGVCCSC-3',PB:5'-TGGACYTTRCAWGGBCCTTCACA-3'[18],以圆叶牵牛叶片总DNA为模板进行PCR检测。反应体系为24μL:0.5μLDNA模板,上游和下游引物(10 μmol/L)各1.0 μL,12 μL 2×HiFi Taq PCR StarMiX,ddH2O补足至24 μL。反应程序如下:94 ℃预变性5 min;94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸30 s,循环36次;72 ℃延伸10 min,4 ℃保存。
菌落PCR反应体系为12 μL:上游和下游引物M13-47F/M13-47R(10 μmol/L)各0.5 μL,6 μL 2×HiFi Taq PCR StarMiX,ddH2O 5 μL,灭菌枪头挑取单菌落作为模板溶解于PCR反应体系中。扩增程序如下:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸30 s,循环36次;72 ℃延伸10 min。PCR产物经1% 的琼脂糖凝胶电泳检测。
1.4 圆叶牵牛中菜豆金色黄花叶病毒属病毒的全基因组序列克隆参考NCBI已经登录的甘薯曲叶病毒(SPLCV)全基因序列(登录号KY783941),设计可以扩增SPLCV基因序列的特异PCR引物SPLCV-1F:5'-TTCGCGGAGATTTCATCCCTATG-3',SPLCV-R:5'-GCAACAGTGCTTGGTATAACGTC-3';SPLCV-2F:5'-TACAGTTGGATTGCCAGTCCTTC-3',SPLCV-2R:5'-GTGGGTTCTGCAAAGGATCCCAC-3'。反应体系为24 μL:0.5 μL DNA模板,上游和下游引物(10 μmol/L)各1.0 μL,12 μL Taq酶(2×HiFi Taq PCR StarMiX),ddH2O补足至24 μL。PCR产物经1% 琼脂糖凝胶电泳检测后进行切胶纯化。
PCR产物经DNA凝胶回收试剂盒(OMEGA)回收,回收纯化后的PCR产物连接至pMD19-T克隆载体上,转化至大肠杆菌DH5α感受态细胞中,涂布于含氨苄青霉素的LB固体培养基上37 ℃培养12~16 h,挑取菌落,经菌落PCR鉴定后,选取阳性克隆送武汉华大基因有限公司进行测序。菌落PCR反应体系为12 μL:上游和下游引物M13-47F、M13-47R(10 μmol/L)各1.0 μL,6 μL 2×HiFi Taq PCR StarMiX,ddH2O 4 μL,灭菌枪头挑取单菌落作为模板溶解于PCR反应体系中。扩增程序如下:94 ℃预变性5 min;94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸90 s,循环36次;72 ℃延伸10 min。PCR产物经1% 琼脂糖凝胶电泳检测。
1.5 序列分析和进化树构建测序所得的序列采用DNASTAR Lasergene 7.1软件进行拼接,利用DNAMAN和DNASTAR Lasergene 7.1预测病毒基因组序列的开放阅读框(ORF),利用SDT软件对序列的核苷酸相似性进行分析,利用MEGA 7.0最大似然法(Maximum Likelihood Estimation, MLE)构建进化树,步值设置为1 000。
2 结果与分析 2.1 田间病株症状2021年9月在湖北省荆州市市郊田间发现表现为黄脉、叶片卷曲等疑似双生病毒典型症状的圆叶牵牛植株,其发病症状见图 1。

|
| A: SPLCV侵染的圆叶牵牛植株;B: SPLCV侵染的圆叶牵牛叶片 A: Plants infected by SPLCV; B: Leaves infected by SPLCV 图 1 SPLCV侵染的圆叶牵牛症状 Fig. 1 Symptoms of Ipomoea purpurea (L.) infected by SPLCV |
2.2 圆叶牵牛中菜豆金色黄花叶病毒属病毒的PCR检测结果
利用菜豆金色黄花叶病毒属病毒通用引物(PA、PB)对圆叶牵牛叶片总DNA进行扩增[19],结果(图 2)发现,从染病的圆叶牵牛总DNA中扩增出一条363 bp的目的DNA片段,健康圆叶牵牛总DNA未见特异扩增。将目的PCR条带回收、克隆并进行序列测定[20],所得序列在NCBI上使用BLASTn工具进行比对分析,结果发现所得序列与GenBank上已报道的甘薯曲叶病毒各分离物的相似性在94%~97% 之间,其中与甘薯曲叶病毒湖南分离物(GenBank登录号:KY783941)的部分核苷酸序列相似性最高,达到97.52%。表明检测阳性的圆叶牵牛叶片样品受到了双生病毒的侵染,其病原可能是甘薯曲叶病毒(SPLCV)。
|
| M:DL2000 DNA Marker;1:健康圆叶牵牛;2:感病圆叶牵牛 M: DL2000 DNA Marker; 1: Healthy Ipomoea purpurea (L.) leaf sample; 2:Diseased Ipomoea purpurea (L.) leaf sample 图 2 SPLCV侵染的圆叶牵牛叶片样品PCR检测结果 Fig. 2 PCR detection results of Ipomoea purpurea (L.) leaf samples infected by SPLCV |
2.3 湖北圆叶牵牛SPLCV基因组全序列克隆及分析
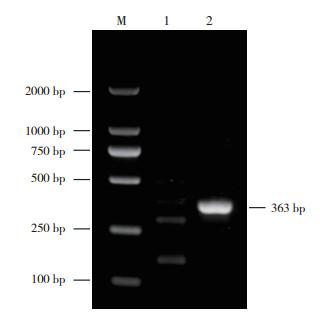
为了获得圆叶牵牛中菜豆金色黄花叶病毒属病毒的全长基因组,以圆叶牵牛叶片总DNA为模板,利用特异性引物SPLCV-1F/SPLCV-1R、SPLCV-2F/SPLCV-2R分别进行PCR扩增,所得的PCR产物经1% 的琼脂糖凝胶电泳进行分析[21],结果(图 3)显示,从圆叶牵牛叶片总DNA中获得两条大小分别为1 613 bp和1 260 bp的PCR产物条带,PCR产物经纯化后克隆至pMD19-T载体上,挑选阳性克隆子进行序列测定,所得序列经拼接后共获得2 827 bp的有效序列,使用DNAMAN对所得序列进行分析发现,所得序列含有AV1、AV2、AC1、AC2、AC3和AC4等6个开放阅读框,其中病毒链编码AV2(125~469 nt)和AV1(294~1058 nt)两个ORF,互补链编码AC1(1580~2674 nt)、AC2(1225~1671 nt)、AC3(1074~1508 nt)和AC4(2260~2517 nt)4个ORF。
|
| M:DL2000 DNA Marker;1:引物SPLCV-1F/SPLCV-1R扩增结果;2:引物SPLCV-2F/SPLCV-2R扩增结果 M: DL2000 DNA Marker; 1: Primer SPLCV-1F/SPLCV-1R amplification result; 2: Primer SPLCV-2F/SPLCV-2R amplification result 图 3 SPLCV基因序列PCR检测结果 Fig. 3 PCR detection electropherogram results of SPLCV gene sequence |
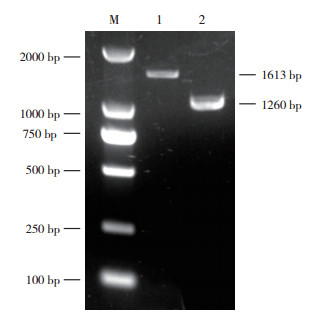
将本研究所得序列与GenBank中已报道的序列进行比对分析发现,本研究获得的序列与GenBank中SPLCV各分离物的核苷酸相似性均在91% 以上,其中与SPLCV湖南分离物(GenBank登录号:KY783941)、韩国分离物(GenBank登录号:HM754637)和韩国另一分离物(GenBank登录号:HM754641)的核苷酸序列相似性分别为97.52%、96.01% 和95.66%。根据国际病毒分类委员会对菜豆金色黄花叶病毒的分类标准[22],病毒DNA-A的核苷酸相似性 > 91% 则认为是同种病毒,因此,侵染湖北圆叶牵牛的双生病毒为SPLCV,命名为SPLCV-HB(GenBank登录号:OM287440)。选取SPLCV不同分离物进一步利用SDT软件进行核苷酸相似性比对分析发现,本研究所获得的SPLCV-HB分离物的核苷酸序列与用于分析的各SPLCV分离物的核苷酸相似性大部分在94%~99% 之间,但与SPLCV-spain分离的核苷酸相似性仅为91%,从图 4可以看出,所选取的SPLCV的分离物与SPLCV-spain分离物均具有较低的核苷酸相似性。

|
| 图 4 SPLCV湖北分离物与其他SPLCV分离物相似性比对结果 Fig. 4 Similarity comparison of SPLCV Hubei isolate and other SPLCV isolates |
2.4 SPLCV-HB分离物的进化树分析
为分析SPLCV-HB分离物与已报道的SPLCV各分离物的亲缘关系,利用MEGA 7.0将本研究获得的SPLCV-HB序列与20个SPLCV分离物序列采用最大似然法(MLE)对SPLCV构建进化树。从进化树图(图 5)可以看出,一共分为两个大支,本研究得到的SPLCV-HB分离物(GenBank登录号:OM287440)与国内和国外部分地区处于同一分支,其中与SPLCV湖南分离物(GenBank登录号:KY783941)聚在同一个小分支,表明与湖南分离物有较近亲缘关系,与之聚集在同一分支的还有SPLCV韩国各分离物和江苏分离物,这些分离物均来自东亚地区,而另一大的分支里有SPLCV西班牙分离物、SPLCV巴西分离物以及SPLCV秘鲁分离物等,也有SPLCV美国分离物与SPLCV韩国分离物,但绝大多数分离物来自南美地区。
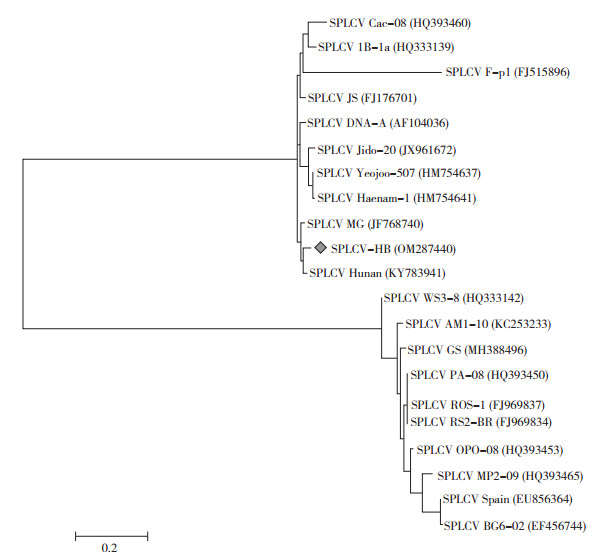
|
| 图 5 基于SPLCV湖北分离物与其他20个分离物的全基因序列构建的系统发育进化树 Fig. 5 Phylogenetic tree of SPLCV Hubei isolate and other 20 isolates based on complete gene sequence |
3 讨论
本研究对湖北省荆州市市郊表现典型黄脉症状的圆叶牵牛进行鉴定后证实,圆叶牵牛植株受到双生病毒的侵染,进一步利用分子克隆获得侵染圆叶牵牛的双生病毒的全基因组序列,该序列具备菜豆金色黄花叶病毒属的典型特征,且与GenBank已登录的SPLCV各分离物的核苷酸相似性均在91% 以上,其中与SPLCV-HuNan(GenBank登录号:KY783941)的相似性最高,达97.52%,根据国际病毒分类委员会对菜豆金色黄花叶病毒的分类标准[22],确定侵染湖北圆叶牵牛的双生病毒为SPLCV,本研究是SPLCV侵染湖北牵牛花的首次报道。
通过进化树进一步分析发现,SPLCV-HB分离物与国外和国内的部分地区处于同一分支,其中与SPLCV湖南分离物处于同一个小分支,说明它们之间有较近的亲缘关系,另外本研究分离物与SPLCV韩国各分离物和江苏分离物处于一个分支,分析发现与本研究分离物(GenBank登录号:OM287440)聚集在一个分支的SPLCV各分离物大多来自东亚地区,而没有与本研究聚集在一起的另一分支则大多来自南美地区,这些结果表明SPLCV的分布具有地域差异性。
SPLCV是限制世界甘薯生产的主要病毒病害之一,该病早在20世纪80年代就在中国台湾、日本等地区和国家甘薯上发生,目前已遍及美洲(美国、秘鲁、巴西和阿根廷)、非洲(肯尼亚)、欧洲(西班牙和意大利)和亚洲(日本、韩国、中国和印度)[23-25]。在我国,SPLCV已在辽宁、广东和福建的甘薯、江苏的圆叶矮牵牛、云南的锐叶牵牛和湖南的牵牛花等植物上分离鉴定到SPLCV[26]。可见SPLCV地理分布和寄主范围在不断扩展。2013年,Zhang等从湖北圆叶牵牛上分离鉴定到佐治亚甘薯曲叶病毒(SPLCGV)[27],该病毒分离物(GenBank登录号:KF769447)与河北分离物(GenBank登录号:JX448368)的序列相似性较高。而本研究又从圆叶牵牛中分离得到SPLCV,该结果证实,牵牛花可能是多种甘薯病毒的中间寄主,应该引起重视,采取有效的防治措施防范甘薯病毒通过圆叶牵牛进一步扩散蔓延。
4 结论本研究利用双生病毒简并引物证实湖北荆州表现黄脉症状的圆叶牵牛受到双生病毒侵染,通过分段克隆获得病毒分离物的全基因序列,在GenBank中进行Blast分析证实该病毒分离物为甘薯曲叶病毒的一个分离物,命名为SPLCV-HB;遗传进化分析发现,甘薯曲叶病毒湖北分离物与甘薯曲叶病毒湖南分离物处于同一分支,说明两者具有较近的亲缘关系。甘薯曲叶病毒主要通过烟粉虱和种苗带毒进行传播与扩散,而本研究的病毒分离物可能来自于湖南。本研究是甘薯曲叶病毒在湖北的首次报道,今后应加强对该类病毒监测。
| [1] |
KULSHRESTHA S, BHARDWAJ A, VANSHIKA. Geminiviruses: taxonomic structure and diversity in genomic organization[J]. Recent Patents on Biotechnology, 2020, 14(2): 86-98. DOI:10.2174/1872208313666191203100851 |
| [2] |
钟静, 赵丽玲, 李婷婷, 丁铭. 侵染青蒿的烟草曲茎病毒的分子鉴定及基因组结构特征分析[J]. 植物保护, 2021, 47(5): 126-133. DOI:10.16688/j.zwbh.2020297 ZHONG J, ZHAO L L, LI T T, DING M. Molecular identification and genomic structural characteristics analysis of tobacco curly shoot virus infecting Artemisia caruifolia[J]. Plant Protection, 2021, 47(5): 126-133. DOI:10.16688/j.zwbh.2020297 |
| [3] |
任江平. 赛葵黄脉病毒和云南赛葵黄脉病毒的群体遗传变异研究[D]. 重庆: 西南大学, 2017. REN J P. Genetic structure and population variability of malvastrum yellow vein virus and malvastrum yellow vein Yunnan virus[D]. Chongqing: Southwest University, 2017. |
| [4] |
孙少双, 王冬雪, 杨秀玲, 周雪平. 胜红蓟上一种与双生病毒伴随的重组β卫星分子的鉴定[J]. 植物保护, 2020, 46(4): 19-24, 32. DOI:10.16688/j.zwbh.2019253 SUN S S, WANG D X, YANG X L, ZHOU X P. Identification of a recombinant geminivirus-associated betasatellite from Ageratum conyzoides[J]. Plant Protection, 2020, 46(4): 19-24, 32. DOI:10.16688/j.zwbh.2019253 |
| [5] |
ROUMAGNAC P, LETT J, FIALLO O E, NAVASCASTILLO J, ZERBINI F, MARTIN D P, VARSANI A. Establishment of five new genera in the family Geminiviridae: Citlodavirus, Maldovirus, Mulcrilevirus, Opunvirus, and Topilevirus[J/OL]. Archives of Virology, 2021, 1-16. DOI: 10.1007/S00705-021-05309-2.
|
| [6] |
FIALLO O E, LETT J, MARTIN D, ROUMAGNAC P, VARSANI A, ZERBINI F, NAVAS C J. ICTV virus taxonomy profile: Geminiviridae 2021[J]. Journal of General Virology, 2021, 102(12): 1696. DOI:10.1099/JGV.0.001696 |
| [7] |
LIU Q, WANG Y, ZHANG Z, LV H, QIAO Q, QIN Y, ZHANG D, TIAN Y, WANG S, LI J. Diversity of sweepoviruses infecting sweet potato in China[J]. Plant Disease, 2017, 101(12): 2098-2103. DOI:10.1094/PDIS-04-17-0524-RE |
| [8] |
ZERBINI F M, BRIDDON R W, IDRIS A, MARTIN D P, MORIONES E, NAVAS C J, RIVERA B R, ROUMAGNAC P, VARSANI A. ICTV virus taxonomy profiles: Geminiviridae[J]. Journal of General Virology, 2017, 98(2): 131-133. DOI:10.1099/jgv.0.000738 |
| [9] |
ZHANG S C, LING K S. Genetic diversity of sweet potato begomoviruses in the United States and identification of a natural recombinant between sweet potato leaf curl virus and sweet potato leaf curl Georgia virus[J]. Archives of Virology, 2011, 156(6): 955-968. DOI:10.1007/s00705-011-0930-2 |
| [10] |
张娟. 侵染甘薯的双生病毒的研究[D]. 大连: 大连理工大学, 2006. ZHANG J. Study on geminiviruses infecting sweet potato[D]. Dalian: Dalian University of Technology, 2006 |
| [11] |
汤亚飞, 何自福, 韩利芳, 罗方芳. 侵染广东甘薯的甘薯曲叶病毒分子检测与鉴定[J]. 植物保护, 2013, 39(4): 25-28. TANG Y F, HE Z F, HAN L F, LUO F F. Molecular detection and identification of sweet potato curl virus infecting sweet potato in Guangdong Province[J]. Plant Protection, 2013, 39(4): 25-28. |
| [12] |
李华伟, 刘中华, 张鸿, 林志坚, 李国良, 林赵淼, 许泳清, 邱永祥, 罗文彬, 纪荣昌, 汤浩, 邱思鑫. 甘薯曲叶病毒福建省分离物的分子鉴定[J]. 福建农业学报, 2018, 33(6): 626-630. DOI: 10.19303/j.issn.1008-0384.2018.06.015. LI W H, LIU Z H, ZHANG H, LIN Z J, ZHAO L M, XU Y Q, QIU Y X, LUO W B, JI R C, TANG H, QIU S X. Molecular identification of sweet potato curl virus isolated in Fujian Province[J]. Fujian Journal of Agricultural Sciences, 2018, 33(6): 626-630. DOI: 10.19303/j.issn.1008-0384.2018.06.015. |
| [13] |
乔贞贞, 秦艳红, 乔奇, 张德胜, 田雨婷, 高洁, 张振臣. 甘薯卷叶病毒江苏分离物基因组全长序列测定及其外壳蛋白基因在大肠杆菌中的表达[J]. 河南农业科学, 2012, 41(4): 86-89. DOI:10.15933/j.cnki.1004-3268.2012.04.012 QIAO Z Z, QIN Y H, QIAO Q, ZHANG D S, TIAN Y T, GAO J, ZHANG Z C. Complete genome sequence of sweet potato leaf rolling virus isolated from Jiangsu Province and expression of coat protein gene in Escherichia coli[J]. Henan Agricultural Sciences, 2012, 41(4): 86-89. DOI:10.15933/j.cnki.1004-3268.2012.04.012 |
| [14] |
张水英, 赵丽玲, 李婷婷, 钟静, 陈越, 丁铭. 侵染云南雾水葛的菜豆金色花叶病毒属病毒的全基因组结构特征[J]. 植物病理学报, 2022, 52(2): 179-190. DOI:10.13926/j.cnki.apps.000575 ZHANG S Y, ZHAO L L, LI T T, ZHONG J, CHEN Y, DING M. Structural characteristics of the whole genome of the begomovirus infecting Kudzu, Yunnan[J]. Acta Phytopathologica Sinica, 2022, 52(2): 179-190. DOI:10.13926/j.cnki.apps.000575 |
| [15] |
班一云, 丁波, 周雪平. 湖南省番茄和牵牛花上双生病毒的分子鉴定[J]. 植物保护, 2017, 43(4): 134-138. BAN Y Y, DING B, ZHOU X P. Molecular identification of geminiviruses from tomato and ipomoea in Hunan Province[J]. Plant Protection, 2017, 43(4): 134-138. |
| [16] |
彭小琴, 王浩然, 张俊, 张玮华, 郭灵芳, 方守国, 章松柏. 湖北甘薯病毒病的检测与鉴定[J]. 中国植保导刊, 2017, 37(8): 20-23. PENG X Q, WANG H R, ZHANG J, ZHANG W H, GUO L F, FANG S G, ZHANG S B. Detection and identification of sweet potato virus disease in Hubei Province[J]. China Plant Protection Guide, 2017, 37(8): 20-23. |
| [17] |
JIU Y Y, CHANG Q M, CHANG B, XIANG G F, ZHENG L, YA Z Y, ZHENG Y Z. A modified CTAB method for genomic DNA extraction from apple fruit[J]. Molecular Plant Breeding, 2018, 9. DOI:10.5376/mpb.2018.09.0005 |
| [18] |
DENG D, MCGRATH P F, ROBINSON D J, HARRISON B D. Detection and differentiation of whitefly-transmitted geminiviruses in plants and vector insects by the polymerase chain- reaction with degenerate primers[J]. Annals of Applied Biology, 1994, 125(2): 327-336. DOI:10.1111/j.1744-7348.1994.tb04973.x |
| [19] |
唐远, 陆永跃. 广东地区引起扶桑黄化曲叶病的病毒种类确定[J]. 广东农业科学, 2013, 40(10): 80-82. DOI:10.16768/j.issn.1004-874X.2013.10.026 TANG Y, LU Y Y. Confirmation of the virus infecting and causing the Hibiscus rosa-sinensis yellow leaf curl disease in Guangdong[J]. Guangdong Agriculture Sciences, 2013, 40(10): 80-82. DOI:10.16768/j.issn.1004-874X.2013.10.026 |
| [20] |
魏永路, 任锐, 高洁, 刘伟平, 谢琦, 朱根发, 杨凤玺. 建兰花叶病毒广东分离物的全基因组序列分析[J]. 广东农业科学, 2022, 49(2): 109-117. DOI:10.16768/j.issn.1004-874X.2022.02.013 WEI Y L, REN R, GAO J, LIU W P, XIE Q, ZHU G F, YANG F X. Complete genome sequence analysis of Guangdong isolates of cymbidium mosaic virus[J]. Guangdong Agriculture Sciences, 2022, 49(2): 109-117. DOI:10.16768/j.issn.1004-874X.2022.02.013 |
| [21] |
钟礼义, 应正河, 刘新锐, 陈体强. 紫芝栽培新品种武芝2号基于rDNA-ITS和ITS2的分子鉴定与分析[J]. 广东农业科学, 2022, 49(2): 9-15. DOI:10.16768/j.issn.1004-874X.2022.02.002 ZHONG L Y, YING Z H, LIU X R, CHEN T Q. Molecular Identification and analysis of new cultivar Wuzhi No.2 based on ribosomal DNA ITS and ITS2 sequence[J]. Guangdong Agriculture Sciences, 2022, 49(2): 9-15. DOI:10.16768/j.issn.1004-874X.2022.02.002 |
| [22] |
BROWN J K, ZERBINI F M, NAVAS C J, MORIONRS E, RAMOS S R, SILVA J C F, FIALLO O E, BRIDDON R W, HERNANDEZ Z C, IDRIS A, MALATHI V G, MARTIN D P, RIVERA B R, SHIGENORI U S, VARSANI A. Revision of Begomovirus taxonomy based on pairwise sequence comparisons[J]. Archives of Virology, 2015, 160(6): 1593-1619. DOI:10.1007/s00705-015-2398-y |
| [23] |
KULSHRESHTHA A, ROSHAN P, SHARMA D, HALLAN V. Molecular characterization of a new begomovirus infecting Mirabilis jalapa in northern India[J]. Archives of Virology, 2017, 162(7): 2163-2167. DOI:10.1007/s00705-017-3330-4 |
| [24] |
KIM J, YANG J W, KWAK H R, KIM M K, SEO J K, CHUANG M N, LEE H U, LEE K B, NAM S S, KIM C S, LEE G S, KIM J S, LEE S, CHOI H S. Virus incidence of sweet potato in Korea from 2011 to 2014[J]. The Plant Pathology Journal, 2017, 33(5): 467-477. DOI:10.5423/PPJ.OA.08.2016.0167 |
| [25] |
MIANO D W, LABONTE D R, CLARK C A, VALVERDE R A, HOY M W, HURTT S, LI R. First report of a begomovirus infecting sweetpotato in Kenya[J]. Plant Disease, 2006, 90(6): 832. DOI:10.1094/PD-90-0832B |
| [26] |
杨彩霞, 张帅宗, 孙蓬蓬, 高雅, 汪绪花, 刘雨婷. 甘薯曲叶病毒的研究进展[J]. 中国农学通报, 2014, 30(1): 298-301. YANG C X, ZHANG S Z, SUN P P, GAO Y, WANG X H, LIU Y T. Research progress of Sweet potato leaf curl virus[J]. Chinese Agricultural Science Bulletin, 2014, 30(1): 298-301. |
| [27] |
ZHANG S B, DU Z G, WANG Z, TANG Y F, SHE X M, LAN G B, HE Z F. First report of sweet potato leaf curl georgia virus infecting tall round-leaved morning glory (Ipomoea purpurea) in China[J]. Plant Disease, 2014, 98(11): 1588. DOI:10.1094/PDIS-11-13-1161-PDN |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49