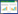文章信息
基金项目
- 广东省重点领域研发计划项目(2019B020217002,2020B0202080004);广东省现代农业产业技术体系生猪产业创新团队项目(2020KJ126);广东省科技基础条件建设领域项目(2021B1212050021)
作者简介
- 黄元(1980—),男,硕士,副研究员,研究方向为动物流行病学及相关生物制品研发,E-mail:huangyuan62@126.com.
通讯作者
- 向华(1971—),男,博士,研究员,研究方向为动物传染病学,E-mail:Xiangh898@163.com.
文章历史
- 收稿日期:2022-04-06
2. 东莞市动物疫病预防控制中心,广东 东莞 523128
2. Dongguan Animal Disease Prevention and Control Center, Dongguan 523128, China
【研究意义】猪链球菌(Streptococcus suis,SS)是影响断奶后仔猪最重要的细菌性猪病原体之一,主要引起脑膜炎、关节炎和猝死。在一些国家该菌仍然是一种重要的人畜共患病病原体[1]。该菌不仅会造成严重的经济损失,还会引起有关动物福利和抗菌素耐药性的担忧。根据荚膜多糖(Capsule polysacharides)抗原的差异,猪链球菌共分为多种血清型[2-3],其中猪链球菌2型(SS2)致病力最强,不但引起猪的急性败血症、脑膜炎、关节炎甚至死亡,也可导致人的感染和死亡。因此,对猪链球菌进行流行病学调查分析具有重大的公共卫生意义。
【前人研究进展】2005年我国四川省暴发人感染猪链球菌病疫情,报告204例,死亡38例,引起了公共卫生和科学研究领域的极大关注[4]。近几年来SS2感染人的病例也有报道,呈散发状态[5-8]。无防护措施下经常直接接触猪及其副产品是导致人感染猪链球菌病的主要感染方式。其中,屠宰场是最可能发生感染猪链球菌的场所[9-10]。
Vishva等[11]采集563头表面健康的屠宰猪的腭扁桃体,在分离的87个猪链球菌分离株中检测到6种血清型,显示SS7(24.13%)和SS5 (18.39%)为优势血清型,而在扁桃体DNA中检测到11种血清型,其中SS9(28.26%) 和SS7(14.13%)为主要血清型。近年来,我国有学者对江苏、河南、黑龙江、宁夏、广东等地[12-13] 屠宰场的猪链球菌携带状况进行调查。2007— 2009年东莞市各镇街屠宰场的屠宰猪经采样进行荧光定量PCR检测,结果显示,2007年未出现SS2感染猪,2008、2009年SS2检出率分别为37.4% 和74.85%[9]。2015年从东莞市各镇街屠宰场采集猪扁桃体样品共320份及环境样品252份,分离出溶血性链球菌276株,检出率为41.1%[10]。
【本研究切入点】2021年6月,佛山市某屠宰猪相关人员在东莞市某屠宰场从事屠宰活动后感染SS2死亡。屠宰场作为SS2病原的来源地,其公共卫生问题再次引起关注。目前东莞屠宰场的猪链球菌特别是SS2流行情况如何,需要更多的调查数据,以进一步评估人感染猪链球菌的风险。【拟解决的关键问题】2021年7月初,在东莞该屠宰场进行采样和猪链球菌分离鉴定,以期调查猪链球菌特别是SS2在屠宰场健康猪群中的携带情况和抗生素耐药情况,对该菌的传播风险进行评估,为其防控提供参考依据。
1 材料与方法 1.1 试验材料1.1.1 样品采集 2021年7月8日在东莞某屠宰场,用经灭菌的剪刀、镊子、注射器进行无菌操作,采集40头猪的关节液和扁桃体,共获得80份样品。40头猪分别来源于广东、广西、湖南和江西四省(区)九市的12个养殖场。
1.1.2 主要试剂 细菌基因组DNA提取试剂盒GeneJET Genomic DNA Purification Kit为Thermofisher产品,PCR相关酶和试剂为TaKaRa产品,血琼脂平板和TSB平板为广州环凯微生物科技有限公司产品。其他试剂和耗材等购自生工生物工程(上海)股份有限公司。
1.2 试验方法1.2.1 细菌分离 将样品分别接种于血琼脂平板上,37 ℃倒置培养约24 h后,观察菌落大小和形态,对典型单菌落在TSB平板上划线纯化。
1.2.2 样品的PCR检测 对关节液和扁桃体样品分别加适量PBS研磨,用试剂盒提取细菌基因组DNA,对SS的特异性基因recN[14]和SS2的特异性基因cps2J[15]分别进行PCR检测,SS2阳性样品用引物cpsK-F和cpsK-R2[16]进行PCR验证,扩增产物测序并进行序列分析。引物序列和扩增条件见表 1。
1.2.3 分离菌的PCR鉴定 (1) 16S rDNA的PCR鉴定。对划线分离的疑似链球菌用针对16S rDNA的引物[17]进行PCR扩增及测序鉴定。通过16S rDNA片段的序列比对,确定所分离细菌的种属,引物序列和扩增条件见表 1。(2)SS分型PCR鉴定。单菌落用TSB培养基振荡培养过夜后,用试剂盒提取细菌基因组DNA,分别用针对33种不同血清型的34对SS特异性基因片段进行PCR扩增,以确定SS的血清型,PCR引物和扩增条件按照文献[15, 18]进行,部分引物信息见表 1。
1.2.4 毒力基因的PCR鉴定 采用分离到的SS基因组DNA,针对不同毒力基因进行PCR扩增,以确定毒力基因在分离菌中的携带情况。PCR引物和扩增条件按照文献[18-19]进行,引物信息见表 1。
1.2.5 抗生素敏感性试验 采用纸片琼脂扩散法[20]检测分离菌株的敏感性,取恩诺沙星、环丙沙星、大观霉素、阿莫西林、青霉素G等16种药物的药敏片贴于涂布菌液的TSA培养基表面,37 ℃培养18 h,用游标卡尺测量抑菌圈直径,平行试验3次,计算平均值,根据美国临床实验室标准协会(Clinical and Laboratory Standards Institute,CLSI) 制定的抗生素药敏试验判定标准(2019版),评估受试菌的药物敏感性。质控菌株为变异链球菌(Streptococcus mutans, ATCC25175)和金黄色葡萄球菌(Staphylococcus aureus,CMCC26003)。
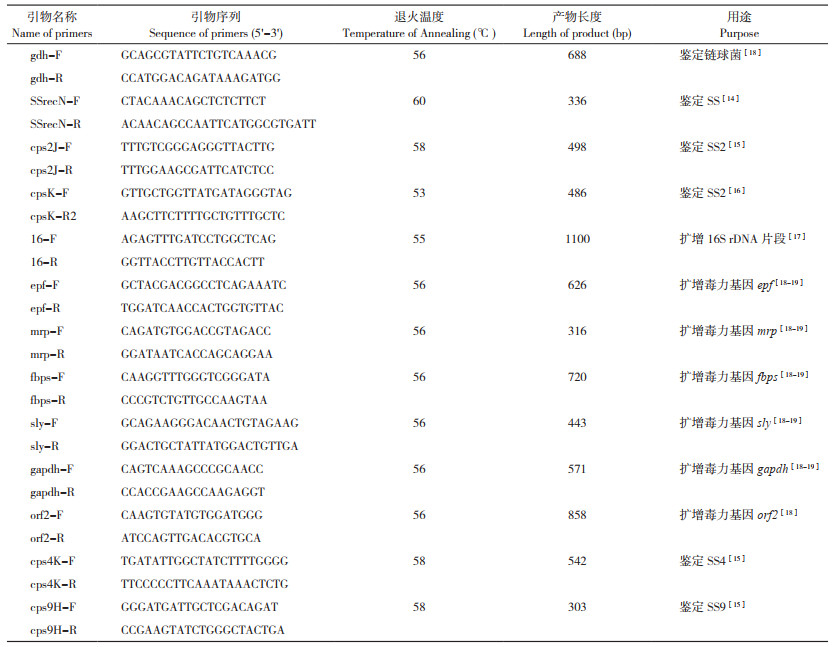
2 结果与分析 2.1 样品的PCR检测对采集的40份关节液和40份扁桃体样品提取细菌基因组DNA,对SS特异性基因recN和SS2特异性基因cps2J分别进行PCR检测,结果(表 2)表明,在40份关节液样品中,有9份呈SS阳性、阳性率为22.5%,未发现SS2阳性;在40份扁桃体样品中,有13份呈SS阳性、阳性率为32.5%,其中3份呈SS2阳性、阳性率为7.5%。
对3份SS2阳性样品的cps2J片段和cpsK片段扩增产物进行测序,cps2J片段核苷酸序列经比对可知,3株SS2之间相应序列同源性为100%;在NCBI进行在线BLAST分析可知,3株SS2的cps2J基因片段与荷兰报道SS2的cps2J基因(AF118389)相应片段的同源性最高(99.6%)。对所获得的cpsK片段核苷酸序列进行比对可知,3株SS2之间相应序列同源性为100%;产物长度为486 bp,在cpsK基因483 bp对应位置为SS2特征性的核苷酸G[16],产生Bst NI酶切位点,与预期相符。据此可以确定这3份样品中含有SS2。
对样品来源信息追查发现,3份SS2阳性样品均来自湖南同一养猪场。对照采样记录可知,3份样品对应的猪在关节处均有一定程度的肿胀。
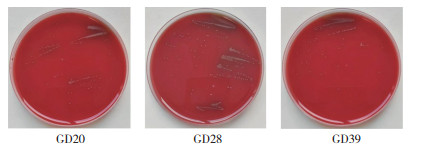
2.2 SS分离和PCR鉴定结果从供试40头猪的扁桃体和关节液得到6份形态疑似链球菌的菌落,菌落呈白色圆形,血平板上菌落周围形成溶血环(图 1),革兰氏染色呈阳性,在显微镜下均呈链状或双球状(图 2)。
|
| 图 1 血平板上分离菌的生长形态 Fig. 1 Colonial morphology of the isolated strains on blood plate |

|
| 图 2 血清肉汤培养分离菌的革兰氏染色形态(1 000×) Fig. 2 Colonial morphology of the isolated strains in serum broth stained with Gram (1 000× ) |
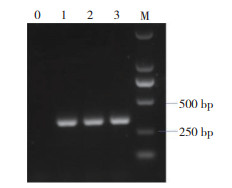
对这6份疑似链球菌的16S rDNA进行PCR扩增(图 3)和测序,经核苷酸序列在线BLAST比对分析表明,编号为20、28和39号的3株菌(分别命名为GD20、GD28和GD39) 的16S rDNA序列均与SS序列同源性最高。其中,与GD20和GD28测序序列同源性最高(均为99.47%) 的是日本分离的SS菌株MO869(GenBank登录号:LC377186);与GD39测序序列同源性最高(99.57%)的是日本分离的SS菌株DTK399 (GenBank登录号:LC316884)。对SS特异性基因recN的PCR扩增表明,GD20、GD28和GD39均为阳性。因此将菌株GD20、GD28和GD39认定为猪链球菌。
|
| M:DNA分子量标准TaKaRa®DL2000;0:空白对照;1:菌株GD20;2:菌株GD39;3:菌株GD28 M: DNA molecular marker TaKaRa® DL2000; 0: Blank control; 1: Strain GD20; 2: Strain GD28; 3: Strain GD28 图 3 SS特异性基因recN的PCR扩增 Fig. 3 PCR amplification to specific gene recN of SS |
2.3 猪链球菌分型鉴定结果
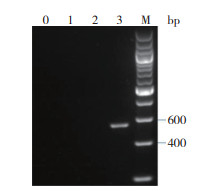
3株SS的分型鉴定结果表明,菌株GD28基因组DNA用针对SS4的cps4K基因引物扩增,可得到特异性片段(图 4),可确定为SS4;菌株GD20和DG39基因组DNA用针对SS9的cps9H基因引物扩增,可得到特异性片段(图 5),可确定为SS9。
|
| M:DNA分子量标准TaKaRa®200 bp Ladder;0:空白对照;1:菌株GD20;2:菌株GD39;3:菌株GD28 M: DNA molecular marker TaKaRa®200bp Ladder; 0: Blank control; 1: Strain GD20; 2: Strain GD28; 3: Strain GD28 图 4 SS4特异性基因cps4K的PCR扩增结果 Fig. 4 PCR amplification to specific gene cps4K of SS4 |

|
| M:DNA分子量标准TaKaRa®200bp Ladder;0:空白对照;1:菌株GD20;2:菌株GD28;3:菌株GD39 M: DNA molecular marker TaKaRa®200bp Ladder; 0: Blank control; 1: Strain GD20; 2: Strain GD28; 3: Strain GD39 图 5 SS9特异性基因cps9H的PCR扩增结果 Fig. 5 PCR amplification to specific gene cps9H of SS9 |
2.4 毒力基因鉴定结果
3株SS毒力基因的PCR鉴定结果如表 3所示。多个毒力基因检测为阳性,表明这3株SS具有一定的致病性。
2.5 药敏试验结果
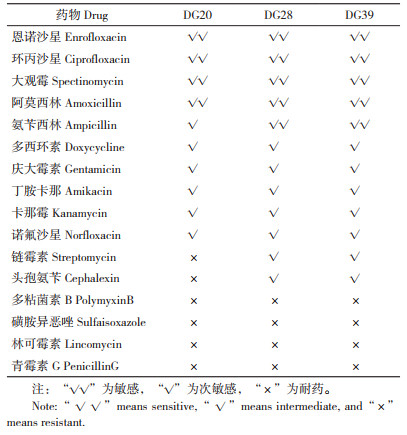
药敏试验结果(表 4)表明,3株SS分离株对青霉素G、林可霉素、多粘菌素B和磺胺异恶唑均表现耐药,对恩诺沙星、环丙沙星、大观霉素和阿莫西林均较敏感。质控菌株药敏试验结果符合预期。
3 讨论
近年来,屠宰场的卫生安全问题受到关注[21]。屠宰场是猪链球菌病防控的重要场所,无防护措施下屠宰、分割、洗切是高风险行为[9-10]。对广州市2016—2021年75例人感染猪链球菌病流行特征分析表明,来自屠宰场或从事猪肉零售相关工作的病例占24%,职业和生活上接触表面健康猪只、市售猪肉史且未采取防护措施的病例占56%,暴露时手部有伤口的病例占28.57%;SS的血清型以2型SS2为主[22]。
SS2在一年四季均可发生,但对人的感染在夏季发生较多。研究表明,夏秋季表面健康猪SS2检出率高于冬春季节,SS2感染人的病例在夏季多发,原因可能与本季节猪携带SS的优势致病血清2型菌高于冬春季有关[13]。本研究于2021年夏季在发生人感染SS2的屠宰场进行SS流行病学调查,具有很强的针对性。
本研究采样的屠宰猪,除了少量猪只关节处有轻微肿胀外,其余均呈外观健康。对40头猪的关节炎和扁桃体进行PCR检测,结果显示关节液中SS阳性率为22.5%,SS2阳性率为0%;扁桃体样品中SS阳性率为32.5%,SS2阳性率为7.5%。多份扁桃体中检测出SS2核酸,提示存在SS2感染人的风险。近几年我国学者对屠宰场生猪进行一系列流行病学调查,扁桃体SS核酸检测阳性率为9.27%~65% 不等[13, 23-25]。2017年对在广东地区养殖场采集的发病猪群样品及健康猪群样品进行SS携带情况调查,结果表明,发病猪群SS的阳性率为82.02%(187/228),健康猪群的SS阳性率为42.20%(192/455),其中屠宰场屠宰猪群的SS阳性率为32.10%(78/243) [24]。2021年于重庆屠宰场共采集表观健康猪扁桃体154份,检出SS阳性样本80份(51.95%),从中分离到菌株87株;主要血清型分别为SS16(16.09%)、SS9(9.20%)、SS4(8.05%),而SS2占比4.60%[25]。与2010年和2015年在东莞屠宰场的SS调查[9-10]相比,本研究对SS的核酸检出率和菌株分离率均相对较低,可能与该屠宰场在发生人感染SS2后加强消毒和检疫有关。扁桃体是SS入侵猪体内首先定植的部位[26],健康猪可在扁桃体中携带SS,成为该菌在猪群中传播的传染源,从正常屠宰猪扁桃体中可分离到致病性SS。Vishva等[11]对表面健康的屠宰猪腭扁桃体检测表明,SS抗原免疫检测的组织病理学变化证实其在无症状携带者中持续存在,部分菌株对小鼠表现显著致病性。本研究中SS在扁桃体中的阳性率远大于关节液中的阳性率,其中SS2在扁桃体中阳性率为7.5%,而在对应的关节液中均未检出阳性,提示SS在猪体内处于所谓的携带状态,即在扁桃体中存在,未表现症状而不容易发现感染,这对SS防控造成一定困难。本研究检出的3份SS2阳性样品均来自扁桃体组织,且均来自于同一养殖场,提示SS2在该养殖场的猪群中已有一定程度传播,尚未在屠宰场造成传播。本研究在采样过程中采取无菌操作,然而由于扁桃体是开放器官,因此也不能排除外界环境SS造成扁桃体污染的可能性。
根据荚膜多糖抗原的差异,SS可分为29种传统血清型和Chz血清型。此外,根据荚膜基因簇的差异,近年来发现27种新的荚膜基因簇菌株[3]。目前发现可感染人的血清型已达10种。本研究对关节液和扁桃体进行SS分离,从关节液中分离出3株SS,其中1株鉴定为SS4,另两株为SS9。SS9和SS4均曾造成人的感染[27-28],在防疫中不可忽视。
目前一般根据毒力标志基因的分布判断SS毒力。溶菌酶释放蛋白MRP又称为M蛋白,一般认为与SS的吸附能力有关;mrp和epf被认为编码SS的2种重要毒力因子,与SS的致病性密切相关[2]。甘油醛-3-磷酸脱氢酶GADPH一般存在于细胞浆中,研究表明,随着gadph基因表达量的增加,SS毒力也随之增加[29]。orf2基因作为一种毒力因子在猪源链球菌中普遍存在。gdh基因是链球菌的保守的毒力因子,可作为链球菌的定属鉴定[30],但不能用于鉴定SS[18]。一般认为epf+mrp+sly+ 的SS2菌株是强毒株[29],但对其他血清型的强毒株认定尚无定论。对印度健康屠宰猪的调查中,arcA+sly+epf+mrp-为普遍的基因型。对广州周边地区健康猪群SS携带情况的调查中,68株健康猪分离的SS中,有61株全为epf-mrp-sly-,1株为epf-mrp+sly-,6株为epf-mrp-sly+[31-34]。本研究对SS毒力基因的PCR鉴定表明,分离的SS4菌株基因型为epf-mrp+gdh+gapdh+fbps-orf2+sly-,分离的2株SS9菌株基因型分别为epf-mrp+gdh+gapdh+fbpsorf2+sly-和epf-mrp-gdh+gapdh+fbps-orf2+sly+。这提示3株SS可能具有一定的致病性。在采样时对20、28和39号猪的观察中发现,猪下肢关节均有一定程度肿胀,提示这3株SS均已经造成了关节炎症,其致病性不容忽视。
药敏试验结果提示,分离的3株SS对多种抗生素耐药。在对猪SS的防控方面,养殖场应当控制抗生素使用,根据药敏试验结果有针对性地选择抗生素,不可采取长期使用广谱抗生素的办法。
4 结论对东莞某屠宰场外表健康屠宰猪样品进行猪链球菌PCR检测,关节液中猪链球菌阳性率为22.5%(9/40);扁桃体样品中,猪链球菌阳性率为32.5%(13/40),其中SS2阳性率为7.5%(3/40)。对样品进行猪链球菌分离、形态鉴定和PCR鉴定,获得1株SS4和2株SS9。对毒力基因的PCR鉴定提示,这3株猪链球菌具有一定的致病性。药敏试验表明,3株猪链球菌对青霉素G、林可霉素、多粘菌素B和磺胺异恶唑耐药,对恩诺沙星、环丙沙星、大观霉素和阿莫西林敏感。研究表明,该屠宰场猪群中存在猪链球菌的隐性感染,也提示存在SS2感染人的风险。
| [1] |
OBRADOVIC M R, SEGURA M, SEGALES J, GOTTSCHALK M. Review of the speculative role of co-infections in Streptococcus suisassociated diseases in pigs[J]. Veterinary Research, 2021, 52(1): 49. DOI:10.1186/s13567-021-00918-w |
| [2] |
SEGURA M, FITTIPALDI N, CALZAS C, GOTTSCHALK M. Critical Streptococcus suis virulence factors: Are they all really critical?[J]. Trends in Microbiol, 2017, 25(7): 585-599. DOI:10.1016/j.tim.2017.02.005 |
| [3] |
刘召颖, 朱夏雨, 牛洪颖, 万欣, 吴宗福. 浙江某市屠宰场猪链球菌血清型、耐药及致病特征[J]. 微生物学报, 2022, 62(8): 3236-3250. DOI: 10.13343/j.cnki.wsxb.20210788. LIU Z Y, ZHU X Y, NIU H Y, WAN X, WU Z F. Serotypes, antimicrobial resistance, and pathogenic characteristics of Streptococcus suis isolated from a slaughterhouse in an area of Zhejiang Province[J/OL]. Acta Microbiologica Sinica. [2022-07-25]. DOI: 10.13343/j.cnki.wsxb.20210788. |
| [4] |
吕强, 吴建林, 袁珩, 罗隆泽, 刘学成. 四川省人感染猪链球菌病流行病学调查分析[J]. 预防医学情报杂志, 2005(4): 379-383. DOI:10.3969/j.issn.1006-4028.2005.04.001 LYU Q, WU J L, YUAN H, LUO L Z, LIU X C. Epidemiological analysis of Human infection with swine Streptococcus in Sichuan Province[J]. Journal of Preventive Medicine Information, 2005(4): 379-383. DOI:10.3969/j.issn.1006-4028.2005.04.001 |
| [5] |
周伟忠, 谈忠鸣, 刘文东, 张楠, 朱永坚. 2010—2019年江苏省人感染猪链球菌病流行病学, 病原学及临床特征[J]. 江苏预防医学, 2021, 32(2): 178-179. DOI:10.13668/j.issn.1006-9070.2021.02.016 ZHOU W Z, TAN Z M, LIU W D, ZHANG N, ZHU Y J. Epidemiology, etiology and clinical characteristics of human infection with Streptococcus suis in Jiangsu Province from 2010 to 2019[J]. Jiangsu Journal of Preventive Medicine, 2021, 32(2): 178-179. DOI:10.13668/j.issn.1006-9070.2021.02.016 |
| [6] |
常开锋, 赵利江, 韩军, 杨宇田, 王彦辉. 2016—2019年临沂市人感染猪链球菌病流行病学特征分析[J]. 预防医学论坛, 2020, 26(5): 379-381. DOI:10.16406/j.pmt.issn.1672-9153.2020.05.018 CHANG K F, ZHAO L J, HAN J, YANG Y T, WANG Y H. Analysis on epidemiological characteristics of human infection with Streptococcus suis, Linyi city, 2016-2019[J]. Preventive Medicine Tribune, 2020, 26(5): 379-381. DOI:10.16406/j.pmt.issn.1672-9153.2020.05.018 |
| [7] |
ZHANG B, KU X, YU X, SUN Q, WU H, CHEN F, ZHANG X, GUO L, TANG X, HE Q. Prevalence and antimicrobial susceptibilities of bacterial pathogens in Chinese pig farms from 2013 to 2017[J]. Scientific Reports, 2019, 9(1): 9908. DOI:10.1038/s41598-019-45482-8 |
| [8] |
毛云霞, 王曼, 罗乐, 曹东晖, 陈雪琴, 李雷, 郑悦康. 2006—2017年中山市人感染猪链球菌病流行病学和临床特征分析[J]. 热带医学杂志, 2019, 19(8): 1056-1058. DOI:10.3969/j.issn.1672-3619.2019.08.029 MAO Y X, WANG M, LUO L, CAO D H, CHEN X Q, LI L, ZHENG Y K. Epidemiological and clinical characteristics of human Streptococcus suis in Zhongshan, 2006-2017[J]. Journal of Tropical Medicine, 2019, 19(8): 1056-1058. DOI:10.3969/j.issn.1672-3619.2019.08.029 |
| [9] |
洪伟彬, 张险朋, 黄炳炽. 2007—2009年东莞市屠宰猪体内猪链球菌2型带菌情况调查及分析[J]. 中国动物检疫, 2010, 27(11): 48-49. DOI:10.3969/j.issn.1005-944X.2010.11.026 HONG W B, ZHANG X P, HUANG B C. Investigation and analysis of slaughtering pigs carrying Streptococcus suis type 2 in Dongguan City, Guangdong Province between 2007 and 2009[J]. China Animal Health Inspection, 2010, 27(11): 48-49. DOI:10.3969/j.issn.1005-944X.2010.11.026 |
| [10] |
洪伟彬, 李永福, 杨振波, 张险朋, 温贤诚. 东莞市屠宰场环境及屠宰猪体内溶血性链球菌的分离与鉴定[J]. 黑龙江畜牧兽医, 2015(6): 65-66. DOI:10.13881/j.cnki.hljxmsy.2015.0354 HONG W B, LI Y F, YANG Z B, ZHANG X P, WEN X C. Isolation and identification of hemolytic streptococcus in slaughterhouse environment and slaughtered pigs in Dongguan[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(6): 65-66. DOI:10.13881/j.cnki.hljxmsy.2015.0354 |
| [11] |
VISHVA K V, GANGWAR P, CHATURJI T J, DINESH M, SAHOO M, SINGH R, MAHAJAN S, QURESHI S, LADDIKA L, RANJAN S N, UJJAWAL K D. Carrier status of Streptococcus suis in the palatine tonsils of apparently healthy slaughtered pigs of India[J]. Journal of Immunoassay and Immunochemistry, 2022, 43(5): 1-22. DOI:10.1080/15321819.2022.2048011 |
| [12] |
高雪萍. 江苏某市屠宰场猪链球菌流行病学调查及NCLs菌株病原特性分析[D]. 南京: 南京农业大学, 2018. DOI: 10.27244/d.cnki.gnjnu.2018.000509. GAO X P. Epidemiological investigation of Streptococcus suis and analysis of pathogenic characteristics of NCLs strains in a slaughterhouse in Jiangsu Province[D]. Nanjing: Nanjing Agricultural University, 2018. DOI: 10.27244/d.cnki.gnjnu.2018.000509. |
| [13] |
王长珍, 刘文宇, 祝瑶, 栾天, 于淼, 杨亲, 刘思国, 张万江. 2017年我国4个省份屠宰场猪链球菌的分离鉴定及耐药性分析[J]. 中国预防兽医学报, 2019, 41(12): 1210-1214. DOI:10.3969/j.issn.1008-0589.201903017 WANG C Z, LIU W Y, ZHU Y, LUAN T, YU M, YANG Q, LIU S G, ZHANG W J. Identification and antimicrobial resistance of Streptococcus suis in slaughterhouses from four different provinces of China[J]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(12): 1210-1214. DOI:10.3969/j.issn.1008-0589.201903017 |
| [14] |
ISHIDA S, TIEN LHT, OSAWA R, TOHYA M, NOMOTO R, KAWAMURA Y, TAKAHASHI T, KIKUCHI N, KIKUCHI K, SEKIZAKI T. Development of an appropriate PCR system for the reclassification of Streptococcus suis[J]. Journal of Microbiological Methods, 2014, 107: 66-70. DOI:10.1016/j.mimet.2014.09.003 |
| [15] |
LIU Z, ZHENG H, GOTTSCHALK M, BAI X, LAN R, JI S, LIU H, XU J. Development of multiplex PCR assays for the identification of the 33 serotypes of Streptococcus suis[J]. PloS One, 2013, 8(8): e72070. DOI:10.1371/journal.pone.0072070 |
| [16] |
MATIASOVIC J, ZOUHAROVA M, NEDBALCOVA K, KRALOVA N, MATIASKOVA K, SIMEK B, KUCHAROVICOVA I, GOTTSCHALK M. Resolution of Streptococcus suis serotypes 1/2 versus 2 and 1 versus 14 by PCR-restriction fragment length polymorphism method[J]. Journal of Clinical Microbiology, 2020, 58(7): e00480-e00420. DOI:10.1128/JCM.00480-20 |
| [17] |
张芬芬, 周晓伦, 贺洋洋. 一株溶磷促生菌的分离、鉴定及其对玉米幼苗生长的影响[J]. 广东农业科学, 2021, 48(5): 76-82. DOI:10.16768/j.issn.1004-874X.2021.05.010 ZHANG F F, ZHOU X L, HE Y Y. Isolation and identification of a phosphorus-solubilizing growth-promoting bacterium and its effect on the growth of Zea mays L. seedlings[J]. Guangdong Agricultural Sciences, 2021, 48(5): 76-82. DOI:10.16768/j.issn.1004-874X.2021.05.010 |
| [18] |
李丽, 黄良宗, 谢博, 张海龙, 顾万军. 猪链球菌9型广东株的分离鉴定和基因序列分析[J]. 中国畜牧兽医, 2018, 45(4): 1016-1026. DOI:10.16431/j.cnki.1671-7236.2018.04.023 LI L, HUANG L Z, XIE B, ZHANG H L, GU W J. Isolation, identification and gene sequence analysis of Streptococcus suis serotype 9 strain from Guangdong[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(4): 1016-1026. DOI:10.16431/j.cnki.1671-7236.2018.04.023 |
| [19] |
SILVA L M, BAUMS C G, REHM T, WISSELINK H J, GOETHE R, VALENTIN-WEIGAND P. Virulence-associated gene profiling of Streptococcus suis isolates by PCR[J]. Veterinary Microbiology, 2006, 115(1-3): 117-127. DOI:10.1016/j.vetmic.2005.12.013 |
| [20] |
刘泽文, 袁芳艳, 刘威, 高婷, 周丹娜, 杨克礼, 段正赢, 郭锐, 梁婉, 田永祥. 湖北省猪2型链球菌的分布及耐药性分析[J]. 动物医学进展, 2021, 42(1): 125-129. DOI:10.3969/j.issn.1007-5038.2021.01.022 LIU Z W, YANG F Y, LIU W, GAO T, ZHOU D N, YANG K L, DUAN Z Y, GUO R, LIANG W, TIAN Y X. Distribution and drug resistance of Streptococcus suis Type 2 in Hubei Province[J]. Progress in Veterinary Medicine, 2021, 42(1): 125-129. DOI:10.3969/j.issn.1007-5038.2021.01.022 |
| [21] |
康桦华, 移兰丽, 王片片, 陈兴勃, 彭新宇, 向蓉, 梅盈洁, 徐志宏. 广东屠宰行业现状及非洲猪瘟后的发展对策[J]. 广东农业科学, 2019, 46(7): 130-137. DOI:10.16768/j.issn.1004-874X.2019.07.019 KANG H H, YI L L, WANG P P, CHEN X B, PENG X Y, XIANG R, MEI Y J, XU Z H. Current situation of slaughtering industry in Guangdong and development countermeasures in the Post African Swine Fever Era[J]. Guangdong Agricultural Sciences, 2019, 46(7): 130-137. DOI:10.16768/j.issn.1004-874X.2019.07.019 |
| [22] |
苏碧慧, 侯水平, 王志萍, 甄若楠, 廖鑫龙, 许建雄, 谢朝军. 广州市2006—2021年人感染链球菌病流行特征分析[J]. 现代预防医学, 2022, 49(15): 2704-2707, 2729. DOI:10.20043/j.cnki.MPM.202203116 SU B H, HOU S P, WANG Z P, ZHEN R N, LIAO X L, XU J X, XIE C J. Surveillance and epidemiological analysis of human Streptococcus suis infection in Guangzhou, 2006—2021[J]. Modern Preventive Medicine, 2022, 49(15): 2704-2707, 2729. DOI:10.20043/j.cnki.MPM.202203116 |
| [23] |
魏丹. 江苏省某屠宰场猪链球菌携带情况调查及猪链球菌培养基选择性机制的探索[D]. 南京: 南京农业大学, 2019. DOI: 10.27244/d.cnki.gnjnu.2019.000575. WEI D. Investigation on the carrying status of Streptococcus suis in a slaughterhouse in Jiangsu Province and exploration on the selective mechanism of Streptococcus suis culture medium[D]. Nanjing: Nanjing Agricultural University, 2019. DOI: 10.27244/d.cnki.gnjnu.2019.000575. |
| [24] |
都玉, 刘召颖, 彭泽仁, 吴宗福. 重庆屠宰场猪链球菌感染的调查[J]. 畜牧与兽医, 2022, 54(6): 58-65. DU Y, LIU Z Y, PENG Z R, WU Z F. Investigation on Streptococcus suis infection in some slaughter houses of Chongqing[J]. Animal Husbandry & Veterinary Medicine, 2022, 54(6): 58-65. |
| [25] |
刘琪, 王娟, 周如月, 贾爱卿, 王贵平. 广东地区健康猪群和发病猪群猪链球菌流行病学调查分析[J]. 中国畜牧兽医, 2017, 44(6): 1825-1831. DOI:10.16431/j.cnki.1671-7236.2017.06.035 LIU Q, WANG J, ZHOU R Y, JIA A Q, WANG G P. The streptoccus suis epidemicl analysis of healthy and infencted swine in Guangdong Province[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(6): 1825-1831. DOI:10.16431/j.cnki.1671-7236.2017.06.035 |
| [26] |
OKURA M, OSAKI M, NOMOTO R, ARAI S, OSAWA R, SEKIZAKI T, TAKAMATSU D. Current taxonomical situation of Streptococcus suis[J]. Pathogens, 2016, 5(3). DOI:10.3390/pathogens5030045 |
| [27] |
DUTKIEWICZ J, ZAJAC V, SROKA J, WASINSKI B, CISAK E, SAWCZYN A, KLOC A, WOJCIK-FATLA A. Streptococcus suis: a re-emerging pathogen associated with occupational exposure to pigs or pork products. Part Ⅱ-Pathogenesis[J]. Annals of Agricultural and Environmental Medicine, 2018, 25(1): 186-203. DOI:10.26444/aaem/85651 |
| [28] |
HUONG V T, HA N, HUY N T, HORBY P, NGHIA H D, THIEM V D, ZHU X, HOA N T, HIEN T T, ZAMORA J, SCHULTSZ C, WERTHEIM H F, HIRAYAMA K. Epidemiology, clinical manifestations, and outcomes of Streptococcus suis infection in humans[J]. Emerging Infectious Diseases, 2014, 20(7): 1105-1114. DOI:10.3201/eid2007.131594 |
| [29] |
QUESSY S, BUSQUE P, HIGGINS R, JACQUES M, DUBREUIL J D. Description of an albumin binding activity for Streptococcus suis serotype 2[J]. FEMS Microbiology Letters, 1997, 147(2): 245-250. DOI:10.1111/j.1574-6968.1997.tb10249.x |
| [30] |
李小军, 李旭金, 郭丽芬, 周柱辉, 陈贵珍, 吴寿军, 钟文超. 猪链球菌分子生物学检测研究进展[J]. 广东农业科学, 2009(7): 208-211. DOI:10.16768/j.issn.1004-874X.2009.07.070 LI X J, LI X J, GUO L F, ZHOU Z H, CHEN G Z, WU S J, ZHONG W T. Research advances in molecular biology detection of Streptococcus suis[J]. Guangdong Agricultural Sciences, 2009(7): 208-211. DOI:10.16768/j.issn.1004-874X.2009.07.070 |
| [31] |
王娟, 贾爱卿, 张炜, 王贵平, 刘琪, 周如月. 广州周边地区健康猪群猪链球菌携带情况调查[J]. 中国兽医学报, 2017, 37(6): 1092-1097. DOI:10.16303/j.cnki.1005-4545.2017.06.21 WANG J, JIA A Q, ZHANG W, WANG G P, LIU Q, ZHOU R Y. Analysis and epidemiological investigation of Streptococcus suis in Guangzhou surrounding area[J]. Chinese Journal of Veterinary Science, 2017, 37(6): 1092-1097. DOI:10.16303/j.cnki.1005-4545.2017.06.21 |
| [32] |
周昌敏, 白翠华, 罗东林, 朱陆伟, 王伟, 谢耀如, 姚丽贤. 施用高金属含量猪粪对荔枝果品质量的影响[J]. 广东农业科学, 2019, 46(10): 69-75. DOI:10.16768/j.issn.1004-874X.2019.10.011 ZHOU C M, BAI C H, LUO D L, ZHU L W, WANG W, XIE Y R, YAO L X. Effect of application of pig manure with high contents of metals on the quality of Litchi fruit[J]. Guangdong Agricultural Sciences, 2019, 46(10): 69-75. DOI:10.16768/j.issn.1004-874X.2019.10.011 |
| [33] |
王妍斐, 梁桂超, 吕航, 王众, 郑业鲁. 福利水平对母猪繁殖性能的影响[J]. 广东农业科学, 2018, 45(5): 91-97. DOI:10.16768/j.issn.1004-874X.2018.05.016 WANG Y F, LIANG G C, LYU H, WANG Z, ZHENG Y L. Effects of welfare on the reproductive performance of sows[J]. Guangdong Agricultural Sciences, 2018, 45(5): 91-97. DOI:10.16768/j.issn.1004-874X.2018.05.016 |
| [34] |
李段, 王磊, 梁鹏帅, 张乐宜, 刘燕玲, 徐峥, 宋长绪. 猪伪狂犬病排毒情况与gE、gB抗体之间的关系研究[J]. 广东农业科学, 2018, 45(6): 103-109. DOI:10.16768/j.issn.1004-874X.2018.06.017 LI D, WANG L, LIANG P S, ZHANG L Y, LIU Y L, XU Z, SONG C X. Relationship between the PRV release of porcine pseudorabies and the level of gE, gB antibody[J]. Guangdong Agricultural Sciences, 2018, 45(6): 103-109. DOI:10.16768/j.issn.1004-874X.2018.06.017 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49