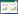文章信息
基金项目
- 国家自然科学基金面上项目(41877288);区域(四川)创新发展联合基金重点项目(U21A2016)
作者简介
- 利勇(1998—),男,在读硕士生,研究方向为微生物修复生态污染研究,E-mail:L_1998y@163.com.
通讯作者
- 代群威(1978—),男,博士,教授,研究方向为环境污染调控与生态修复,E-mail:qw_dai@163.com.
文章历史
- 收稿日期:2022-10-03
2. 西南科技大学核废物与环境安全国防重点学科实验室,四川 绵阳 621010;
3. 西南科技大学生命科学与工程学院,四川 绵阳 621010
2. National Defense Key Discipline Laboratory of Nuclear Waste and Environmental Safety, Southwest University of Science and Technology, Mianyang 621010, China;
3. School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China
【研究意义】随着我国居民生活水平的提升,居民对肉类产品需求增加,促进畜禽业发展。畜禽养殖业集约化发展的同时,也产生大量养殖废水[1],我国养猪场每年产生1.6亿t的养猪废水[2]。养猪废水成分复杂,一般含有丰富的有机物、高浓度NH4+-N、悬浮固体等成分,养猪废水中的大量含氮污染物直接排放会造成严重的水体污染和富营养化,威胁周边居民的用水安全[3-4]。因此,为满足废水排放标准,会采用一些生物、物理或化学方法来降低污染物浓度,其中生物法通过好氧或厌氧微生物构建工艺,具有操作简单、脱氮高效、环境友好等优点[5]。【前人研究进展】传统的生物脱氮技术通过自养硝化菌和厌氧反硝化菌将含氮有机物-氨化-硝化-反硝化成N2达到去除氮的目的[6]。传统工艺分为好氧和厌氧两段,且自养硝化菌的生长速度缓慢,需要较长的启动时间,从而无法广泛应用[7]。近年来,异养硝化细菌因其生长速度快、适应能力强而受到越来越多的关注,异养硝化细菌可以在高浓度NH4+-N和有机物下生长,并利用废水中的有机物作为能源进行异养硝化的同时降低有机物和氨氮浓度[8]。与自养型硝化细菌比较,异养硝化细菌生长速率更快且适应能力更强[9],关于异养硝化菌的研究已经逐渐成为研究热点。目前发现的异养硝化菌主要包括假单胞菌属(Pseudomonas sp.)、不动杆菌属(Acinetobacter sp.)、芽孢杆菌属(Bacillus sp.)等[10]。【本研究切入点】关于异养硝化细菌的应用研究主要集中于低浓度NH4+-N废水,因此有必要寻找高效的异养硝化细菌来处理高浓度NH4+-N的废水,如其在养殖废水中的实际应用,此外异养硝化菌在未灭菌处理的实际废水中的研究也较少[11]。【拟解决的关键问题】本研究从某湖泊底泥中富集、分离鉴定出能有效去除NH4+-N的异养硝化菌,研究其异养硝化和好氧反硝化能力,以及在不同接种比例、碳源、pH、温度、C/N、初始氨氮浓度条件下对菌株脱氮特性的影响,再以农村养殖户污水池中的养猪废水为试验对象,将该异养硝化菌用于养猪废水处理,探究其在高浓度氨氮废水中的异养硝化能力与处理养猪废水的可行性。
1 材料与方法 1.1 试验材料筛选样品于2021年12月采自某浅水湖泊的底泥,取样后马上进行菌株筛选;养猪废水于2022年5月采自绵阳市某农村小型养殖户的污水池,保存于聚乙烯瓶中,取样后第2天用于试验。后续试验于2022年在西南科技大学实验室内进行。
异养硝化培养基:硫酸铵0.47 g/L、二水合柠檬酸钠4.08 g/L、50 mL维氏盐溶液,pH值为7.0~7.2。硝酸盐培养基:硝酸钾0.722 g/L、二水合柠檬酸钠4.08 g/L、50 mL维氏盐溶液,pH值为7.0~7.2。亚硝酸盐培养基:亚硝酸钠0.49 g/L、二水合柠檬酸钠4.08 g/L、50 mL维氏盐溶液,pH值为7.0~7.2。维氏盐溶液:磷酸氢二钾5.0 g/L、七水合硫酸镁2.5 g/L、氯化钠2.5 g/L、四水合硫酸锰0.05 g/L、七水合硫酸亚铁0.05 g/L。固体培养基需加入2% 的琼脂粉,培养基均高温高压灭菌(121 ℃、30 min)。
1.2 试验方法1.2.1 菌株的分离与鉴定 取3份适量样品分别置于20 mL 0.9% 生理盐水中,混匀后静置,取2 mL上清液接种到异养硝化液体培养基,富集3 d,选择变浑浊的培养基进行后续研究。
取富集菌液进行梯度稀释,选择10-5、10-6、10-7梯度进行平板涂布,置于30℃恒温培养箱内培养。待长出菌落,挑选不同形态菌落进行平板划线纯化2~3次。将纯化后的不同菌株接种至异养硝化液体培养基中,在30 ℃、120 r/min摇床中培养48 h后将培养液在8 000 r/min、3 min条件下离心,取上清液检测NH4+-N浓度,对比不同菌株的氨氮去除率,选择效果最好的菌株进行后续研究。
观察菌株在平板上菌落的特征,并进行革兰氏染色,委托天津诺禾致源生物信息科技有限公司测序。测序结果同Blast数据库中细菌的16SrDNA进行同源性分析,用MEGA7.0构建系统发育树。
1.2.2 菌株的异养硝化性能 将活化的菌液以2% 接种比接种于异养硝化培养基中,设空白对照,在30 ℃、130 r/min条件下恒温培养。每隔4 h取样,测定培养基中菌体的细胞密度OD600的数值,同时取样离心,测定上清液NH4+-N、NO3--N、NO2--N的浓度变化。
1.2.3 菌株的好氧反硝化性能 将活化的菌液以2% 接种比分别接种于硝酸盐培养基和亚硝酸盐培养基中,设置空白对照,在30 ℃、120 r/min条件下培养。每隔4 h取样,测定OD600和离心测定上清液NO3--N、NO2--N浓度。
1.2.4 菌株的脱氮特性 测定菌液接种量、碳源、pH、温度、C/N、初始NH4+-N浓度等单因素对菌株的脱氮特性的影响。菌液接种量为0%、2%、4%、7%、10% 的不同接种比例;碳源包括丁二酸钠、乙酸钠、柠檬酸钠、葡萄糖;pH为6、7、8、9、10;温度为15、20、25、30、35 ℃;C/N为2、6、10、15、20;初始NH4+-N浓度为50、100、200、400、800 mg/L。固定单一因素,其余条件保持不变,将活化的菌液接种于100 mL异养硝化培养基中,设置空白对照,在摇床中培养48 h后,测定NH4+-N浓度和OD600。
1.2.5 菌株在农村养殖废水中的应用 在锥形瓶中进行简单振荡试验,研究菌株在实际养猪废水中的异养硝化能力。从绵阳农村某养殖户的污水池中采集养猪废水,用棉网过滤水中浮渣,不做灭菌处理,其初始NH4+-N浓度为1 048 mg/L,用自来水稀释废水得到不同浓度NH4+-N废水(500、1 000 mg/L)用于试验。柠檬酸钠用于将废水C/N比率调整为约10,将3 mL活化的菌液接种至150 mL养猪废水中(试验组),然后在30 ℃、130 r/min下培养。以相同条件下不加异养硝化细菌的养猪废水作为空白对照,每隔12 h取样测试其NH4+-N、TN、NO3--N、NO2--N的浓度。
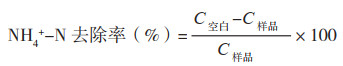
|
式中,C空白为空白对照中NH4+-N浓度,C样品为试验组中不同时间的NH4+-N浓度,NH3--N去除率、NH2--N去除率计算方法与上式相同。
1.3 测定指标及方法样品在测定前经离心处理,取上清液测定。NH4+-N采用纳氏试剂分光光度法(HJ 535-2009);NH3--N采用紫外分光光度法(HJ/T 346-2007);NH2--N采用盐酸萘乙二胺检测法(GB 7493-87);TN采用碱性过硫酸钾消解紫外分光光度法(GB 11894—89);菌体生长量以在波长600 nm的吸光度表征,采用可见分光光度计(WFJ-2100型,尤尼柯仪器有限公司)进行测定。
试验数据采用Excel 2021进行计算,使用Origin 2018绘制数据图进行分析。
2 结果与分析 2.1 菌株的筛选与鉴定供试湖底泥经分离筛选得到11株细菌,其中1株NH4+-N去除率最大、为91.8%,命名为L-1,菌株L-1属于革兰氏阴性菌,菌落呈乳白色、不透明、表面光滑。细胞呈短杆状,大小为0.7~0.9 μm×0.4~0.5 μm,电镜扫描图像见图 1。L-1的16SrDNA序列(1 415 bp)在Blast数据库中检索,发现L-1与多株Acinetobacter sp. 同源性在99% 以上。通过MEGA7.0构建系统发育树,如图 2所示,菌株L-1与Acinetobacter_sp._bB11(2011) 聚为一支,鉴定菌株L-1为不动杆菌属(Acinetobacter sp.)。
|
| 图 1 菌株L-1的电镜扫描图像 Fig. 1 Scanning electron micrographs of strain L-1 |

|
| 图 2 菌株L-1的系统发育树 Fig. 2 Phylogenetic tree of strain L-1 |
2.2 菌株L-1的异养硝化性能
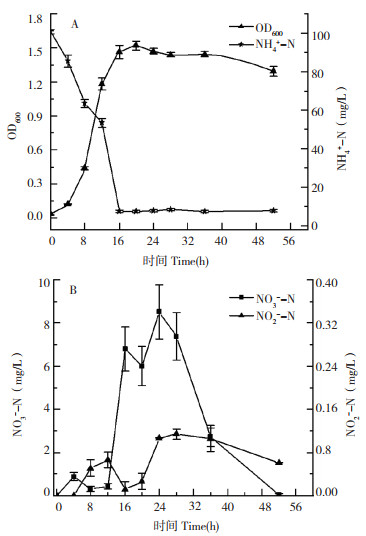
以NH4+-N为唯一氮源,菌株生长情况与氮素变化如图 3所示,菌株L-1在4 h进入对数生长期,20 h到达稳定期,OD600达到最高值1.523,其中NH4+-N的去除过程主要处于对数生长期,NH4+-N浓度由100.75 mg/L降至7.54 mg/L,NH4+-N去除率达到92.52%,说明菌株能有效以NH4+-N为唯一氮源进行异养硝化。在NH4+-N硝化过程中有少量NO3--N和微量NO2--N累积,在52 h时NO3--N只有0.04 mg/L,这与蒙小俊[12]、雷强等[13]研究相似,在硝化过程中产生NO3--N,随后浓度逐渐降低,可能与L-1的脱氮途径相关。
|
| A:OD600和NH4+-N浓度变化;B:NO3--N和NO2--N浓度变化 A: Variation in OD600 and NH4+-N concentrations; B: Variation of NO3--N and NO2--N concentrations 图 3 NH4+-N为氮源时菌株L-1的生长曲线和脱氮特性 Fig. 3 Growth curve and denitrification characteristics of strain L-1 with NH4+-N as nitrogen source |
2.3 菌株L-1的好氧反硝化性能
由图 4A可知,菌株L-1以NO3--N作为唯一氮源时,在前24 h,菌株生长快速,OD 600达到0.75,同时NO3--N浓度快速降低,去除率达到75.61%,平均去除速率为3.13 mg/(L·h),反硝化过程中有少量NO2--N累积,其浓度先升后降,累积量不超过0.9 mg/L。由图 4B可知,以NO2-作为唯一氮源时,与NO3--N为氮源时不同,其达到稳定期时间延长,生物量最大为0.49,说明高浓度NO2-会抑制了微生物的生长,但菌株仍能利用NO2-,最终NO2-去除率为83.23%。
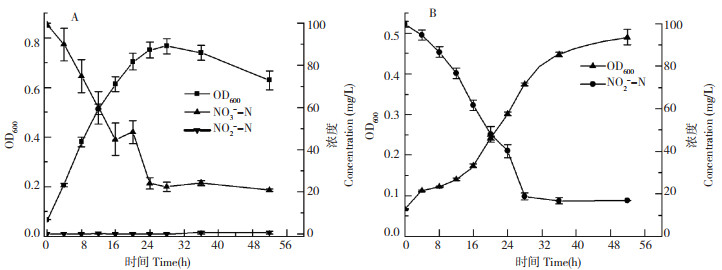
|
| A:以KNO3为唯一氮源;B:以NaNO2为唯一氮源 A: KNO3 as the sole source of nitrogen; B: NaNO2 as the sole source of nitrogen 图 4 以NO3--N、NO2--N为氮源时菌株L-1的生长曲线和脱氮特性 Fig. 4 Growth curve and denitrification characteristics of strain L-1 with NO3--N and NO2--N as nitrogen sources |
2.4 环境因素对菌株L-1脱氮的影响
由于培养基中的营养物质有限,不同的接种量影响微生物的生长速度,进而影响微生物的硝化性能。从图 5A可以看出,不同的接种量下各处理OD600和NH4+-N浓度均发生不同变化,其中,2% 的接种比的培养基中菌株生长状况最好,在48 h后,OD600达到1.056,NH4+-N去除率达到86.68%,具体为OD600-2% > OD600-4% ≈ OD600-7% > OD600-10%。
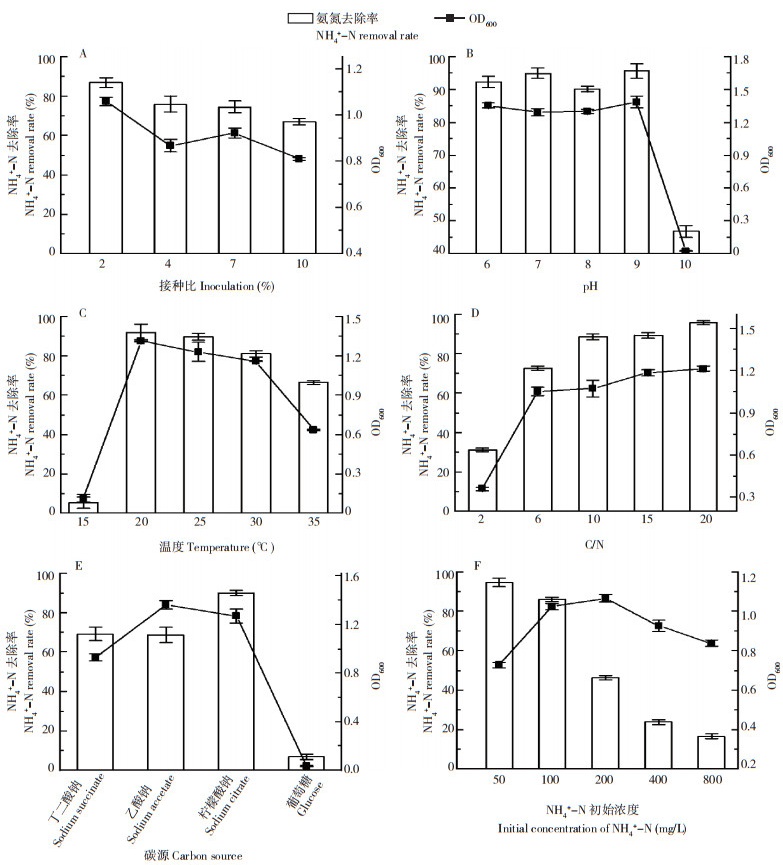
|
| A:接种比;B:pH;C:温度;D:C/N比;E:碳源;F:NH4+-N初始浓度 A: Inoculation rate; B: pH; C: Temperature; D: C/N ratios; E: Carbon source; F: Initial concentration of NH4+-N 图 5 不同环境条件对菌株L-1异养硝化的影响 Fig. 5 Effects of different environmental conditions on heterotrophic nitrification of strain L-1 |
环境中pH或温度的变化,微生物的酶活性都会受到影响,当pH和温度过高或过低,硝化细菌生长都会受到抑制[14]。如图 5B所示,当pH为6、7、8、9时,NH4+-N去除率均在90% 以上,OD600均在1.3以上,说明弱酸、中性、弱碱条件下,L-1均能正常生长并进行异养硝化。其中pH为9时,菌株生长量最好,NH4+-N去除率达到95.68%,而pH升高到10时,OD600没有增长,说明L-1在过碱性条件下生长完全受到抑制[15]。如图 5C所示,在15 ℃条件下,菌株生长速度缓慢,几乎停滞,NH4+-N去除率仅为5.36%,20、25、30 ℃下菌株L-1生长迅速,48 h后OD600分别达到1.313、1.230和1.161,其中20 ℃下NH4+-N去除率最高、达到91.99%;但当温度继续升高至35 ℃时,OD600降低至0.634,脱氮效果降到66.49%,说明L-1的适宜温度为20~30 ℃。
C/N比直接影响硝化细菌生长,如图 5D所示,C/N为10、15、20时,OD600均大于1.0,NH4+-N去除率均在88% 以上,最高达到95.78%;C/N降低为6时,NH4+-N去除率和OD600分别为72.46%、1.052;当C/N为2时,L-1生长缓慢,NH4+-N去除率仅有31.03%,说明低C/N条件下菌株的生长和硝化作用受到抑制[16]。菌株L-1的适宜C/N范围为10~20。
菌株对不同碳源的利用能力如图 5E所示,L-1以柠檬酸钠作为碳源时,NH4+-N去除率和生长情况最好,去除率达到90.16%,OD600达到最大1.269;以丁二酸钠、乙酸钠为碳源时NH4+-N去除率分别为69.09% 和68.79%;而以葡萄糖为碳源时,L-1生长情况最差,相应地除氨效果也较差,去除率仅为6.77%。
菌株L-1在不同初始NH4+-N浓度中的生长与硝化效率如图 5F所示,初始NH4+-N浓度在50~800 mg/L时,L-1均能生长。因为NH4+-N既是污染物又是营养物质,故NH4+-N浓度在50 mg/L时,NH4+-N去除率最高为94.59%,OD600为0.727;当NH4+-N浓度上升到为100、200 mg/L时,NH4+-N去除率开始下降,分别为86.18%、46.34%;NH4+-N浓度继续上升到400、800 mg/L时,此时NH4+-N去除率大幅下降,分别为23.71%、16.53%。
2.5 菌株L-1在农村养猪废水中的脱氮效果如图 6A所示,在空白对照中,NH4+-N浓度有缓慢下降趋势,可能是养猪废水未做灭菌处理,其中存在脱氮菌,但其效果一般。加入菌液后,NH4+-N去除效果显著提升,在NH4+-N浓度为1 000 mg/L、处理96 h后,NH4+-N浓度降至298.46 mg/L,去除率为70.15%,比未添加菌液的空白对照高45.78%。如图 6B所示,在1 000 mg/L废水中,加入菌液后不仅去除大量NH4+-N,同时去除80.21% 的NO3--N和60.53% 的NO2--N,说明在废液中菌株L-1进行了异养硝化和好氧反硝化。
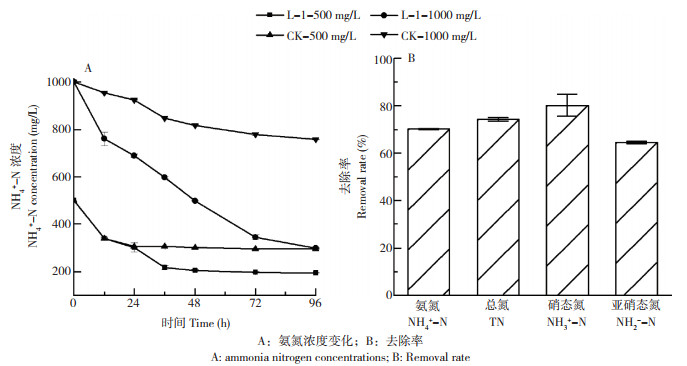
|
| A:氨氮浓度变化;B:去除率 A: ammonia nitrogen concentrations; B: Removal rate 图 6 菌株L-1对养猪废水的处理效果 Fig. 6 Effect of strain L-1 on the treatment of pig wastewater |
3 讨论 3.1 菌株L-1的异养硝化和好氧反硝化性能
本试验筛选出一株异养硝化-好氧反硝化细菌L-1,鉴定为不动杆菌。菌株L-1能利用NO3--N和NO2--N作为氮源进行生长,说明L-1能进行反硝化作用,这与Acinetobacter pittii SY9[17]、Pseudomonas HNM-4[18]等异养硝化-好氧反硝化菌结果相似。研究菌株L-1异养硝化和好氧反硝化性能发现,去除氮素与菌株生长量呈正相关,但不同氮源中的菌株生长量不同,其中NH4+-N > NO3--N > NO2--N,这与AHP123[19]在不同氮源中的生长情况相似。由上推测菌株L-1的反硝化途径属于传统反硝化途径。
3.2 菌株L-1不同条件下的脱氮特性异养硝化细菌的硝化性能受多个环境因素影响,本试验主要研究了接种比、pH、温度、C/N比、碳源、初始NH4+-N浓度6个因素对L-1的生长与硝化性能的影响。微生物生长需要适宜的pH,过高过低都会影响到酶活性,pH对微生物絮团的NH4+-N转化效率和絮团细菌活性均有影响[14]。试验得出菌株L-1的适应pH范围在6~9,与梁贤等[20]研究结果相似。温度也是影响细菌生长的因素之一,温度从20 ℃上升到35 ℃时,L-1的OD600逐渐下降,硝化性能减弱,因此在实际应用时,应考虑pH和温度对硝化细菌的影响。
郑冰冰等[21]研究不同C/N对处理养殖废水的影响时,发现低C/N下,碳源不足会影响微生物生长,导致脱氮效果较差,选择适宜的C/N有利于微生物快速生长。本试验结果与郭少鹏等[22]得出的最佳C/N为12、孙将等[23]研究的最佳C/N为15的结果相似。废水中C/N比普遍较低,而菌株L-1适宜更高的C/N比,在后续L-1处理低C/N比的废水时需要考虑调节C/N。
碳源是微生物生物量累积和生命活动的能量来源,不同碳源对其硝化能力有直接影响[24]。L-1在以葡萄糖为碳源时,硝化性能较差,与Acinetobacter sp. ND7的结果[25]一致,相较于葡萄糖,柠檬酸钠等无机碳源结构简单更容易被微生物吸收利用[19, 26]。本研究中最佳碳源为柠檬酸钠,这与朱晓明等[27]分离的菌株XK51、谭俊杰等[28]分离的菌株ADM-42、郑建龙等[29]分离的菌株DG-3的最佳碳源均为柠檬酸钠相同。在处理废水或调节废水C/N时,应选择能被高效利用的碳源。逐步提高初始NH4+-N浓度,当NH4+-N浓度在800 mg/L时,L-1的异养硝化能力明显下降,但其仍然可以生长且NH4+-N浓度下降,说明L-1能够耐受高浓度NH4+-N脱氮,NH4+-N去除率较低的原因可能是处理时间不足[30-31]。故后续可研究其在含高浓度NH4+-N的养殖废水中脱氮能力。
3.3 菌株L-1在农村养殖废水中的应用养猪废水含有高浓度的NH4+-N,直接排放会严重破坏水体环境,所以必须降低氮素浓度。本试验采集发酵中的养猪废水,将菌株L-1投加到未灭菌的废水,经处理96 h后,对氮素去除效果明显。与CAO等[11]处理配制的废水和Klebsiella oxytoca YZ-12[13]处理灭菌后的废水不同,采集的废水来自发酵池且未做灭菌处理,其成分更加复杂,菌株L-1可能会受到其他微生物的影响,L-1对NH4+-N去除不彻底,后续可以驯化L-1在实际养猪废水中的适应能力以及串联曝气装置[32-33],提高对氮素的去除效果。
4 结论从湖泊底泥中筛选出一株异养硝化-好氧反硝化菌株,经分子生物学鉴定初步确定为不动杆菌(Acinetobactersp),命名为L-1,菌株L-1不仅能去除NH4+-N,还能进行好氧反硝化去除NO3--N、NO2--N。通过单因素研究菌株L-1的脱氮特性结果显示接种比例为2%、碳源为柠檬酸钠、pH为6~9、温度20~30 ℃、C/N为10~20、初始NH4+-N浓度为50 mg/L时氨氮去除率最高;在实际养猪废水中投加L-1进行脱氮,1 000 mg/L NH4+-N废水中氨氮去除率为70.15%,与空白组对比NH4+-N去除率提高45.78%,且废水中的NO3--N、NO2--N浓度分别降低了80.21% 和60.53%,表明L-1在实际废水中具有一定异养硝化-好氧反硝化能力。
| [1] |
王振兴, 许振成, 谌建宇, 庞志华, 丘锦荣, 骆其金. 畜禽养殖业氨氮总量控制减排技术特征与评估方法研究[J]. 广东农业科学, 2014, 41(4): 185-192. DOI:10.16768/j.issn.1004-874X.2014.04.010 WANG Z X, XU Z C, CHEN J Y, PANG Z H, QIU J R, LUO Q J. Research on characteristics and assessment method of ammonia emissions reduction technology for livestock and poultry industry[J]. Guangdong Agricultural Sciences, 2014, 41(4): 185-192. DOI:10.16768/j.issn.1004-874X.2014.04.010 |
| [2] |
ZHAO G P, WANG X Y, HONG Y, LIU X Y, WANG Q, ZHAI Q Y, ZHANG H K. Attached cultivation of microalgae on rational carriers for swine wastewater treatment and biomass harvesting[J]. Bioresource Technology, 2022, 351: 127014. DOI:10.1016/j.biortech.2022.127014 |
| [3] |
阮明君, 钟梓杰, 余发杰, 姚宇泰, 朱剑锋, 胡文锋, 胡斌. 一株异养硝化细菌的分离鉴定及其在垃圾渗滤液中的应用[J]. 广东农业科学, 2022, 49(3): 68-76. DOI:10.16768/j.issn.1004-874X.2022.03.008 RUAN M J, ZHONG Z J, YU F J, YAO Y T, ZHU J F, HU W F, HU B. Isolation and identification of a heterotrophic nitrifying bacterium and its application in landfill leachate[J]. Guangdong Agricultural Sciences, 2022, 49(3): 68-76. DOI:10.16768/j.issn.1004-874X.2022.03.008 |
| [4] |
CAI Y Y, YANG H N, LIU J X, ZUO D D, DENG L W. Sequencing batch reactor (SBR) and anoxic and oxic process (A/O) display opposite performance for pollutant removal in treating digested effluent of swine wastewater with low and high COD/N ratios[J]. Journal of Cleaner Production, 2022, 372: 133643. DOI:10.1016/J.JCLEPRO.2022.133643 |
| [5] |
YU J J, HU H C, WU X D, ZHOU T, LIU Y H, RUAN R G, ZHENG H L. Coupling of biochar-mediated absorption and algal-bacterial system to enhance nutrients recovery from swine wastewater[J]. Science of the Total Environment, 2020, 701: 134935. DOI:10.1016/j.scitotenv.2019.134935 |
| [6] |
JOO H S, HIRAI M, SHODA M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4[J]. Journal of Bioscience & Bioengineering, 2005, 100(2): 184-191. DOI:10.1263/jbb.100.184 |
| [7] |
CHEN J L, XU J, ZHANG S N, LIU F, PENG J W, PENG Y X, WU J S. Nitrogen removal characteristics of a novel heterotrophic nitrification and aerobic denitrification bacteria, Alcaligenes faecalis strain WT14[J]. Journal of Environmental Management, 2021, 282(5): 111961. DOI:10.1016/j.jenvman.2021.111961 |
| [8] |
LIU X Y, DANG Y, SUN D Z, HOLMES D E. Identification of optimal parameters for treatment of high-strength ammonium leachate by mixed communities of heterotrophic. nitrifying/aerobicdenitrifyingbacteria[J]. Bioresource Technology, 2021, 336: 125415. DOI:10.1016/j.biortech.2021.125415 |
| [9] |
赵思琪, 任勇翔, 杨垒, 肖倩, 汪旭辉. 异养硝化复合菌强化处理含氮废水脱氮性能研究[J]. 工业微生物, 2018, 48(1): 22-29. DOI:10.3969/j.j.issn.1001-6678.2018.01.004 ZHAO S Q, REN Y X, YANG L, XIAO Q, WANG X H. Nitrogen removal characteristics of heterotrophic nitrifying compound bacteria by bioaugmentation for treatment of nitrogenous wastewater[J]. Industrial Microbiology, 2018, 48(1): 22-29. DOI:10.3969/j.j.issn.1001-6678.2018.01.004 |
| [10] |
HUANG F, PAN L Q, LV N, TANG X M. Characterization of novel bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification–aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 2017, 124(5): 564-571. DOI:10.1016/j.jbiosc.2017.06.008 |
| [11] |
CAO X H, ZHAO B H, WU Y M, HUANG J, WANG H Z, SUN X Y, LI S J. Characterization of alcaligenes aquatilis as a novel member of heterotrophic nitrifier-aerobic denitrifier and its performance in treating piggery wastewater[J]. Bioresource Technology, 2022, 354: 127176. DOI:10.1016/j.biortech.2022.127176 |
| [12] |
蒙小俊, 祖德彪, 张玉秀, 刘可欣. 异养硝化-好氧反硝化菌HNAD4的脱氮性能分析[J]. 中国给水排水, 2022, 38(15): 29-36. DOI:10.19853/j.zgjsps.1000-4602.2022.15.005 MENG X J, ZU D B, ZHANG Y X, LIU K X. Denitrification performance of heterotrophic nitrification-aerobic denitrification bacteria HNAD4[J]. China Water & Wastewater, 2022, 38(15): 29-36. DOI:10.19853/j.zgjsps.1000-4602.2022.15.005 |
| [13] |
雷强, 张燕, 孙燕, 刘啟明. 异养硝化-好氧反硝化菌YZ-12的脱氮性能及其对养殖废水的处理效果[J]. 环境工程学报, 2022, 16(1): 301-310. DOI:10.12030/j.cjee.202109042 LEI Q, ZHANG Y, SUN Y, LIU Q M. Denitrification performance and aquaculture wastewater treating effects of heterotrophic nitrifying aerobic denitrifying bacteria Yz-12[J]. Chinese Journal of Environmental Engineering, 2022, 16(1): 301-310. DOI:10.12030/j.cjee.202109042 |
| [14] |
李莉, 李文清, 谭洪新, 罗国芝. pH对微生物絮团氨氮转化效率及细菌活性的影响[J]. 上海海洋大学学报, 2019, 28(5): 671-679. DOI:10.12024/jsou.20180702359 LI L, LI W Q, TAN H X, LUO G Z. Effects of pH on ammonium nitrogen conversion efficiency and bacteria activity of microbial flocs[J]. Journal of Shanghai Ocean University, 2019, 28(5): 671-679. DOI:10.12024/jsou.20180702359 |
| [15] |
LEI Y, WANG Y Q, LIU H J, XI C W, SONG L Y. A novel heterotrophic nitrifying and aerobic denitrifying bacterium, Zobellella taiwanensis DN-7, can remove high-strength ammonium[J]. Applied Microbiology and Biotechnology, 2016, 100(9): 4219-4229. DOI:10.1007/s00253-016-7290-5 |
| [16] |
赵丙辰, 丁笑寒, 兰杰, 陈栋, 毕学军, 刘长青. 不同C/N进水对微生物群落结构及雌激素去除的影响[J]. 环境科学与技术, 2020, 43(9): 14-20. DOI:10.19672/j.cnki.1003-6504.2020.09.003 ZHAO B C, DING X H, LAN J, CHEN D, BI X J, LIU C Q. Effects of different influent C/N ratios on microbial community structure and estrogens removal[J]. Environmental Science & Technology, 2020, 43(9): 14-20. DOI:10.19672/j.cnki.1003-6504.2020.09.003 |
| [17] |
SHI Y Q, HU Y Y, LIANG D H, WANG G B, XIE J Y, ZHU X Q. Enhanced denitrification of sewage via bio-microcapsules embedding heterotrophic nitrification-aerobic denitrification bacteria Acinetobacter pittii SY9 and corn cob[J]. Bioresource Technology, 2022, 358: 127260. DOI:10.1016/J.BIORTECH.2022.127260 |
| [18] |
唐伟, 张远, 刘缨, 王书平, 刘志培, 丁森. 北运河底泥中异养硝化菌的筛选及其脱氮特性[J]. 环境工程, 2019, 37(10): 126-132. DOI:10.13205/j.hijc.201910021 TANG W, ZHANG Y, LIU Y, WANG S P, LIU Z P, DING S. Screening of heterotrophic nitrifying bacteria in the sediment of the Beiyun river and its nitrogen removal characteristics[J]. Environmental Engineering, 2019, 37(10): 126-132. DOI:10.13205/j.hijc.201910021 |
| [19] |
周香群, 徐嘉璐, 张琴, 李艳宾, 王远丽. 1株好氧反硝化菌筛选及处理猪场厌氧消化废水[J]. 环境科学与技术, 2022, 45(8): 53-60. DOI:10.19672/j.cnki.1003-6504.0443.22.338 ZHOU X Q, XU J L, ZHANG Q, LI Y B, WANG Y L. Screening of an aerobic denitrifying bacteria and treatment of anaerobic digestion piggery effluent[J]. Environmental Science & Technology, 2022, 45(8): 53-60. DOI:10.19672/j.cnki.1003-6504.0443.22.338 |
| [20] |
梁贤, 任勇翔, 杨垒, 夏志红. 异养硝化-好氧反硝化菌YL的脱氮特性[J]. 环境科学, 2015(5): 1749-1756. DOI:10.13227/hjkx.2015.05.033 LIANG X, REN Y X, YANG L, XIA Z H. Characteristics of nitrogen removal by a heterotrophic nitrification-aerobic denitrification bacterium YL[J]. Environmental Science, 2015(5): 1749-1756. DOI:10.13227/hjkx.2015.05.033 |
| [21] |
郑冰冰, 吴怡伟, 李云辉, 周弋铃, 王欣雨, 赵阳国. 不同碳氮比对海水养殖废水脱氮效果的影响[J]. 环境科学研究, 2020, 33(8): 1848-1856. DOI:10.13198/j.issn.1001-6929.2020.03.02 ZHENG B B, WU Y W, LI Y H, ZHOU Y L, WANG X Y, ZHAO Y G. Effects of different C/N ratios on nitrogen removal of mariculture wastewater[J]. Research of Environmental Sciences, 2020, 33(8): 1848-1856. DOI:10.13198/j.issn.1001-6929.2020.03.02 |
| [22] |
郭少鹏, 江兴龙, 王泽旭, 魏金生. 高效硝化与反硝化功能菌株的分离筛选及其性能研究[J]. 海洋与湖沼, 2020, 51(6): 1520-1529. DOI:10.11693/hyhz20200400106 GUO S P, JIANG X L, WANG Z X, WEI J S. Isolation and screening of high-efficiency nitrification and denitrification functional strains and effect evaluation[J]. Oceanologia et Limnologia Sinica, 2020, 51(6): 1520-1529. DOI:10.11693/hyhz20200400106 |
| [23] |
孙将, 李建章, 袁月祥, 闫志英, 廖银章. 高效除氨氮异养硝化细菌的分离鉴定及其脱氮条件优化[J]. 农业工程学报, 2018, 34(S1): 35-41. DOI:10.11975/j.issn.1002-6819.2018.z.006 SUN J, LI J Z, YUAN Y X, YAN Z Y, LIAO Y Z. Study on isolation and identification of heterotrophic nitrifying bacteria and optimal denitrification conditions[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(S1): 35-41. DOI:10.11975/j.issn.1002-6819.2018.z.006 |
| [24] |
潘永亮, 黑亮, 黄徐, 刘雯, 蔡名旋. 农业氮污染治理技术中脱氮菌的研究进展[J]. 广东农业科学, 2020, 47(2): 92-101. DOI:10.16768/issn.1004-874X.2020.02.013 PAN Y L, HEI L, HUANG X, LIU W, CAI M X. Progress in the research on denitrifying bacteria in agricultural nitrogen pollution control technology[J]. Guangdong Agricultural Sciences, 2020, 47(2): 92-101. DOI:10.16768/issn.1004-874X.2020.02.013 |
| [25] |
XIA L, LI X M, FAN W H, WANG J L. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. ND7 isolated from municipal activated sludge[J]. Bioresource Technology, 200020, 301: 122749. DOI:10.1016/j.biortech.2020.122749 |
| [26] |
LIU X N, WANG L, PANG L N. Application of a novel strain corynebacterium pollutisoli SPH6 to improve nitrogen removal in an anaerobic/aerobic-moving bed biofilm reactor (A/O-MBBR)[J]. Bioresource Technology, 2018, 269: 113-120. DOI:10.1016/j.biortech.2018.08.076 |
| [27] |
朱晓明, 赵东华, 阮晓红. 含水层介质中1株异养硝化-好氧反硝化菌的分离鉴定与脱氮性能[J]. 环境工程, 2020, 38(5): 43-48. DOI:10.13205/j.hjgc.202005008 ZHU X M, ZHAO D H, RUAN X H. Identification and nitrogen removal characteristics of a heterotrophic nitrification aerobic denitrifying strain isolated from unconfined aquifer porous media[J]. Environmental Engineering, 2020, 38(5): 43-48. DOI:10.13205/j.hjgc.202005008 |
| [28] |
谭俊杰, 李立君, 李雪洁, 韩天放, 胡筱敏, 赵鑫. 异养硝化-好氧反硝化菌株GNR选育及对猪场废水脱氮实验[J]. 环境工程, 2021, 39(2): 21-26. DOI:10.13205/j.j.hjgc.202102004 TAN J J, LI L J, LI X J, HAN T F, HU X M, ZHAO X. Isolation of a heterotrophic nitrification-aerobic denitrifying strain gnr and its application of ammonia removal of swine wastewater[J]. Environmental Engineering, 2021, 39(2): 21-26. DOI:10.13205/j.j.hjgc.202102004 |
| [29] |
郑建龙, 时书宁, 雍燕, 方炳虎. 一株好氧反硝化细菌的脱氮特性研究[J]. 广东农业科学, 2015, 42(10): 153-159. DOI:10.16768/j.issn.1004-874X.2015.10.003 ZHENG J L, SHI S N, YONG Y, FANG B H. Study on the denitrification characteristics of an aerobic denitrifying bacteria[J]. Guangdong Agricultural Sciences, 2015, 42(10): 153-159. DOI:10.16768/j.issn.1004-874X.2015.10.003 |
| [30] |
刘志云, 刘国华, 蔡辉益, 张姝, 常文环, 谢庆, 司彦培. 鸡粪中氨氮降解菌的分离鉴定及除氨适宜条件研究[J]. 中国农业科学, 2016, 49(6): 1187-1195. DOI:10.3864/j.issn.0578-1752.2016.06.014 LIU Z Y, LIU G H, CAI H Y, ZHANG S, CHANG W H, XIE Q, SI Y P. lsolation and characterization of ammonia nitrogen-degrading microbe from chicken manure[J]. Scientia Agricultura Sinica, 2016, 49(6): 1187-1195. DOI:10.3864/j.issn.0578-1752.2016.06.014 |
| [31] |
刘春花, 梁慧丽, 孙承文, 陶家发, 巩华, 石存斌, 吴淑勤. 区域微型生物养护剂对池塘环境改善作用研究[J]. 广东农业科学, 2019, 46(10): 104-113. DOI:10.16768/j.issn.1004-874X.2019.10.017 LIU C H, LIANG H L, SUN C W, TAO J F, GONG H, SHI C B, WU S Q. Study on the effect of regional micro-biological curing agent on the improvement of pond environment[J]. Guangdong Agricultural Sciences, 2019, 46(10): 104-113. DOI:10.16768/j.issn.1004-874X.2019.10.017 |
| [32] |
陈均利, 张树楠, 戴桂金, 张苗苗, 吴金水, 刘锋. 同步硝化反硝化菌(Alcaligenes faecalis WT14) 养殖污水脱氮效果研究[J]. 农业环境科学学报, 2020, 39(8): 1811-1817. DOI:10.11654/jaes.2020-0325 CHEN J L, ZHANG S N, DAI G J, ZHANG M M, WU J S, LIU F. Nitrogen removal capacity of simultaneously nitrifying and denitrifying bacteria(Alcaligenes faecalis WT14)in breeding wastewater[J]. Journal of Agro-Environment Science, 2020, 39(8): 1811-1817. DOI:10.11654/jaes.2020-0325 |
| [33] |
田野, 程红艳, 王効挙, 闫双堆, 曹艳篆, 郝千萍, 李丹洋. 不同生物质炭对污灌区土壤铜形态及玉米吸收转运富集的影响[J]. 广东农业科学, 2020, 47(4): 61-67. DOI:10.16768/j.issn.1004-874X.2020.04.009 TIAN Y, CHENG H Y, WANG X Q, YAN S D, CAO Y Z, HAO Q P, LI D Y. Effects of different biochar on copper forms in soil and absorption and transfer enrichment of corn in sewage irrigation area[J]. Guangdong Agricultural Sciences, 2020, 47(4): 61-67. DOI:10.16768/j.issn.1004-874X.2020.04.009 |
(责任编辑 白雪娜)
 2022, Vol. 49
2022, Vol. 49