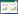文章信息
基金项目
- 广东省现代农业产业技术体系创新团队项目(2022KJ108);广州市农村科技特派员项目(GZKTP202039)
作者简介
- 崔一平(1984—),女,博士,助理研究员,研究方向为果树病害及其防控,E-mail:kktracy@163.com.
通讯作者
- 彭埃天(1962—),男,研究员,研究方向为果树病害及其防控,E-mail:pengait@163.com.
文章历史
- 收稿日期:2022-08-25
2. 广州市白云区沙田柠檬农产品专业合作社,广东 广州 510550
2. Shatian Lemon Agricultural Products Cooperative of Baiyun District, Guangzhou 510640, China
【研究意义】沙田柠檬〔Citrus limon(L.)Burm. f., Shatian lemon〕又称香水柠檬、香橼柠檬,是芸香科柑橘属常绿小乔木,因主要种植于广东省广州市白云区沙田村而得名。由于沙田村独特的气候条件,该地及所产柠檬已于2009年通过无公害的产地认证及产品认证,属于无公害食品、有机食品和国家地理标志保护产品[1]。柠檬炭疽病是影响柠檬产量和品质的主要病害之一,多发生在高温多雨地区,而广州气候常年高温多雨,极易引起该病的发生;炭疽病主要危害柑橘类植物的叶片、树梢、花和果实等部位,潜伏在果实中的病原菌也可在储运期继续对果实造成危害[2]。研究表明,不同的炭疽病病原菌对同一化学药剂的敏感性也不同,因此明确引起沙田柠檬炭疽病的病原菌种类对精准防控该病害具有重要的现实意义[3-5]。【前人研究进展】柑橘炭疽病主要由炭疽菌属(Colletotrichum sp.)真菌引起。目前已报道的引起柑橘炭疽病的病原菌主要有炭疽菌属的胶孢炭疽菌(C. gloeosporioides)、尖孢炭疽菌(C. acutatum)、喀斯特炭疽菌(C. karstii)、果生刺盘孢菌(C. fructicola)和暹罗刺盘孢菌(C. siamense)等[4-6]。本课题组调查发现,沙田村柠檬种植园沙田柠檬上的主要病害有炭疽病、疮痂病、黄龙病等,主要害虫有红蜘蛛、蓟马、叶螨等,除蓟马和炭疽病对沙田柠檬的产量和品质造成一定危害外,其他病虫害危害程度均较轻[7]。【本研究切入点】目前,对引起沙田柠檬炭疽病的病原菌种类缺乏系统研究,而不同种类炭疽病对药剂敏感性存在差异,明确其病原菌种类对于精准防控沙田柠檬炭疽病具有至关重要的作用。【拟解决的关键问题】为了研究引起广州市沙田村沙田柠檬炭疽病的病原菌种类,2019—2021年期间我们采集了具有炭疽病典型症状的沙田柠檬叶片和果实,开展病原菌的组织分离、致病性测定及其分子生物学鉴定,以期明确引起该地区柠檬炭疽病的病原菌种类,为沙田柠檬炭疽病的防治提供理论基础和方向。
1 材料与方法 1.1 试验材料供试病样:2019—2021年期间采集自广东省广州市白云区沙田村沙田柠檬上具有炭疽病典型症状的叶片和果实;健康沙田柠檬植株的叶片和果实也采自沙田村。
马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、去离子水定容至1 000 mL。
试剂及仪器:植物DNA提取试剂盒,爱思进生物技术(杭州)有限公司;PCR扩增试剂盒2×EasyTaq PCR SuperMix(-dye),北京全式金生物技术有限公司。美国贝克曼Microfuge 20微量离心机(美国,Beckman Coulter, Inc.)、T100TM PCR仪及美国伯乐1704487小型水平电泳槽(美国,BIO-RAD company)。
1.2 试验方法1.2.1 病原菌的分离与形态特征观察 每年选取具炭疽病症状的沙田柠檬叶15片和有白斑的柠檬果实3个,用剪刀在病健交界处剪出0.2 cm左右的正方形小块,依次用70% 酒精浸泡30 s、2%NaClO浸泡90 s、无菌水冲洗4次,而后置于无菌滤纸上晾干,最后放置于PDA培养基上于25 ℃培养箱中进行暗培养。3~5 d后,通过挑取单孢子接种在新的PDA平板上继续进行纯化培养。7~10 d后,在显微镜下对分离出菌株的菌丝和孢子进行镜检,每个菌株观察视野超过10个,约能看到100多个孢子,并统计其中50个孢子的大小。
1.2.2 致病性测定 对仅从柠檬病果上分离获得的真菌菌株命名为ST2,其代表菌株ST2-1、ST2-2和ST2-3采用针刺接种菌丝块的方法分别接种3个健康的沙田柠檬果实(每个果实上3个接种点),以接种PDA空白培养基作为阴性对照;同时在液体PD培养基中对菌株ST3-1、ST3-2、ST3-3以及ST4-1、ST4-2、ST4-3进行培养,制成1×106 CFU/mL的孢子悬浮液,分别喷洒接种在3株3月龄的健康沙田柠檬苗的叶片和枝干上;以喷洒无菌水作为阴性对照。然后将这些柠檬果实和植株放置于温度28 ℃、湿度75% 的温室中进行正常培养,光照/黑暗时间为12 h/12 h;每天对柠檬叶片和果实上的病害症状进行观察,并拍照记录。
1.2.3 真菌的分子生物学鉴定 将培养7 d的菌株ST2-1、ST2-2、ST2-3、ST3-1、ST3-2和ST3-3以及ST4-1、ST4-2和ST4-3的菌丝分别从PDA平板上刮下来,迅速用液氮研磨。然后依据Axygen动植物基因组DNA制备试剂盒的说明书进行真菌全基因组DNA的提取,研究中用到的引物合成及PCR产物测序服务均购自上海生工生物工程有限公司。选取核糖体转录间隔区(ITS)、微管蛋白(β-Tubulin)、延伸因子1α基因(EF-1α)、肌动蛋白Actin(ACT)、钙调节蛋白(CAL)、甘油醛-3-磷酸脱氢酶glyceraldehyde-3-phosphate dehydrogenase(GAPDH)、大亚基基因large subunit(LSU)genes和几丁质合成酶Chitin synthase(CHS1)的检测引物为ITS1/ITS4、Bt2a/Bt2b、EF-2/EF-1、ACT-783R/ACT-512F、CL1/CL2、gpd1/gpd2、LR5/LR0R和CHS79-F/CHS354-R(表 1),以提取的菌株全基因组DNA为模板进行PCR扩增[8-16]。PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸60 s,34个循环;72 ℃延伸7 min;然后对PCR产物进行电泳检测,将阳性PCR产物送去测序。在NCBI的BLAST中对获得的片段信息进行对比并将部分基因片段提交到NCBI数据库,同时利用MegAlign 7.1.0(44)软件以最大自然法分别建立ST2-1、ST3-1和ST4-1的进化树,根据菌株之间的聚和程度确定病原菌的分类地位。
2 结果与分析 2.1 沙田柠檬炭疽病的危害及田间症状
沙田柠檬炭疽病可发生在柠檬的叶片、枝梢和果实上。炭疽病危害叶片时,初期多从叶尖或叶缘进行侵入,而后逐渐扩展成黄褐色云纹状病斑,多呈“V”字型,严重时可造成大量落叶;炭疽病危害枝梢时多发生在梢顶,初为淡褐色椭圆形病斑,最后整个梢顶枯死;炭疽病危害果实时,最初为白色小点,在环境适宜时病斑逐渐扩大至整个果实,但这些白色片状斑点不深入果皮,仅在果实表面造成危害,严重影响柠檬的外观和经济价值(图 1)。

|
| A:炭疽病的田间症状;B:炭疽病在叶片和枝梢上的危害症状(正面);C:炭疽病在叶片和枝梢上的危害症状(反面);D:炭疽病在果实上的危害症状 A: Symptoms of anthracnose in field; B: Symptoms of anthracnose on leaves and sheet (front); C: Symptoms of anthracnose on leaves and sheet (back); D: Symptoms of anthracnose on fruit 图 1 沙田柠檬炭疽病的田间症状 Fig. 1 Symptoms of anthracnose disease on Shatian lemon in field |
2.2 病原菌的培养特征及形态特征
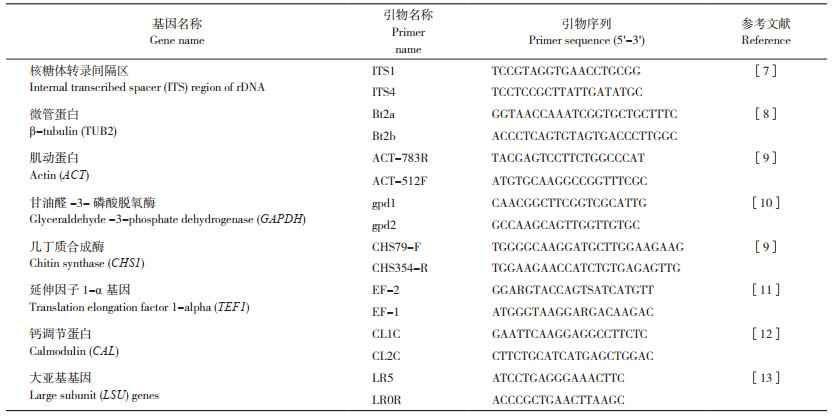
通过对沙田柠檬炭疽病样的组织分离和培养,共获得30株真菌菌株。经过单胞分离,在25 ℃培养箱中培养7 d后,通过菌株的菌落颜色、菌落形态和菌丝孢子形态观察,可将分离所得的30株真菌菌株分为3类。第一类仅从柠檬病果上分离获得,命名为ST2,该类真菌的分离率为30%(该分离率仅指占在沙田柠檬上分离所得的炭疽菌属Colletotrichum sp. 真菌中的比例);ST2菌落圆形,淡灰色,菌丝浓密,从平板背面可看到菌落上附有大量黑色孢子堆;菌丝无色,有分隔和分叉;孢子单胞、透明,梭形,两端钝圆,大小为14.0~19.8 μm × 4.4~6.1 μm(n = 50)(图 2A~ 图 2C)。选取其中3株(ST2-1、ST2-2、ST2-3)作为代表菌株进行后续研究。第二类仅从柠檬病叶上分离获得,命名为ST3,该类真菌的分离率为10%;ST3在PDA培养基上的菌落边缘均整齐,最初为白色,而后逐渐变为灰褐色,菌丝稀疏至浓密,无或少刚毛,菌落上附有黑色分生孢子粘孢团;菌丝为白色或棕褐色,有间隔和分支,孢子为卵圆形或圆柱形,透明,无分隔,内含1~3个油球,大小为14.8~26.3 μm × 3.1~4.5 μm(n = 50)(图 2D~ 图 2F)。选取其中3株(ST3-1、ST3-2、ST3-3)作为代表菌株进行后续研究。第三类命名为ST4,该类真菌仅从柠檬病叶上分离获得、分离率为60%,在PDA培养基上的菌落边缘均整齐,最初为白色,之后仅菌落中间变为浅灰色和白色相间,菌丝稀疏,无或少刚毛,菌落上附有橘红色和黑色分生孢子粘孢团;菌丝为透明、有分枝和分隔,分生孢子单胞、椭圆形、透明且无隔膜,两端圆形,内含1个油球,大小为14.5~18.9 μm × 3.7~5.9 μm(n = 50)(图 2G~ 图 2I)。从中选取3株(ST4-1、ST4-2、ST4-3)作为代表菌株进行后续研究。由于每类真菌的生物学特性几乎一致,因此文中仅显示ST2-1、ST3-1和ST4-1在PDA平板上的菌落形态及在显微镜下的孢子和菌丝形态(图 2)。
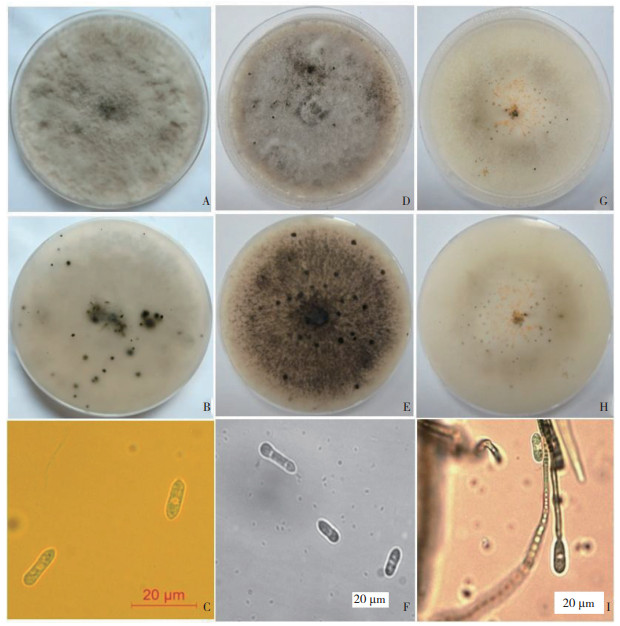
|
| A、B:ST2-1菌落形态;C:ST2-1分生孢子形态;D、E:ST3-1菌落形态;F:ST3-1分生孢子形态;G、H:ST4-1菌落形态;I:ST4-1分生孢子形态 A, B: Colonial morphology of ST2-1; C: Conidial morphology of ST2-1; D, E: Colonial morphology of ST3-1; F: Conidial morphology of ST3-1; G, H: Colonial morphology of ST4-1; I: Conidial morphology of ST4-1 图 2 炭疽病菌属病原菌ST2-1、ST3-1和ST4-1在PDA培养基上培养7 d后的菌落形态和分生孢子形态 Fig. 2 Colonial and conidial morphology characteristics of Colletotrichum sp. strains ST2-1, ST3-1 and ST4-1 cultured on PDA for 7 days |
2.3 病原菌的致病性及分子鉴定
在健康的沙田柠檬果实上分别针刺接种菌株ST2(ST2-1、ST2-2和ST2-3)的菌丝块,PDA空白培养基作为阴性对照接种于柠檬果实上;将ST3(ST3-1、ST3-2、ST3-3)和ST4(ST4-1、ST4-2、ST4-3)浓度为1×106 CFU/mL的孢子悬浮液分别喷洒于3月龄的健康柠檬叶片上(整株喷洒),无菌水作为阴性对照。7 d后,接种的柠檬果实和叶片均出现与田间相似的炭疽病症状;而后从发病的沙田柠檬果实和叶片上可再分离获得单一的、与原接种菌株的培养性状和形态特征相一致的病原菌,从而进一步确定菌株ST2(ST2-1、ST2-2和ST2-3)、ST3(ST3-1、ST3-2和ST3-3)以及ST4(ST4-1、ST4-2和ST4-3)均为沙田柠檬炭疽病的病原菌,图 3中仅显示ST2-1、ST3-1及ST4-1的致病性测定结果,其他菌株的接种结果与此相类似

|
| A、B:果实针刺接种ST2-1;C:植株喷洒接种无菌水;D:果实喷洒接种ST3-1;E:植株喷洒接种ST4-1 A, B: Fruit inoculated with ST2-1 by puncturing; C: Plant inoculated with sterile water by spraying; D: Plant inoculated with ST3-1 by spraying; E: Plant inoculated with ST4-1 by spraying 图 3 沙田柠檬炭疽病菌的致病力 Fig. 3 Pathogenicity of the pathogen causing anthracnose on Shatian lemon |
为了对病原菌ST2、ST3和ST4进行分子生物学鉴定,本研究采用引物ITS1/ITS4、Bt2a/Bt2b、ACT-512F/ACT-783R、CL1C/CL2C和CHS79-F/CHS354-R,以ST2(ST2-1、ST2-2和ST2-3)全基因组为模板进行PCR扩增,分别得到540、749、241、265 bp的ITS、CAL、ACT和CHS1;以ST3(ST3-1、ST3-2和ST3-3)全基因组为模板进行PCR扩增,分别得到549、464、233、278 bp的ITS、TUB2、ACT和CHS1片段(图 4)。通过胶回收和测序比对后发现,分别以ST2-1、ST2-2和ST2-3为模板扩增的同一基因片段相似性达到100%,而以ST3-1、ST3-2和ST3-3为模板扩增的同一基因片段相似性达到99% 以上。将得到的序列在GenBank中进行BLAST比对,发现菌株ST2(ITS:OM698365;ACT:OM746167;CAL:OM746165;CHS1:OM746166,此处的基因序列登陆号是以ST2-1为模板扩增获得的片段信息)与暹罗刺盘孢C. siamense MSO(ITS:MK673873.1;ACT:MK674786;CAL:MK674788;CHS1:MK674790)具有99% 以上的同源性;而ST3(ITS:MZ646051;ACT:OK086976;TUB:OK086977;CHS1:OK086977,此处的基因序列登陆号是以ST3-1为模板扩增获得的片段信息)则与兰花刺盘孢C. cliviicola LJ2-1(ITS:MT351121;CHS1:MT396799;TUB:MT396863;ACT:MT396767)具有较高的同源性,达到99% 以上。同时我们也以LR5/LR0R和EF-2/EF-1为引物,对ST3基因组进行分子鉴定,扩增获得904 bp的LSU和568 bp的TEF1基因,通过NCBI BLAST发现ST3也属于Colletotrichum sp.(LSU:DQ286216.1,TEF1:GU994315.1)。但由于这2个基因在炭疽菌属内小种的分类研究中应用较少且鉴定效果不稳定,因此在后续建立进化树时未予采用[17]。综上所述,初步判断ST2属于暹罗刺盘孢(C. siamense),ST3属于兰花刺盘孢菌(C. cliviicola)。
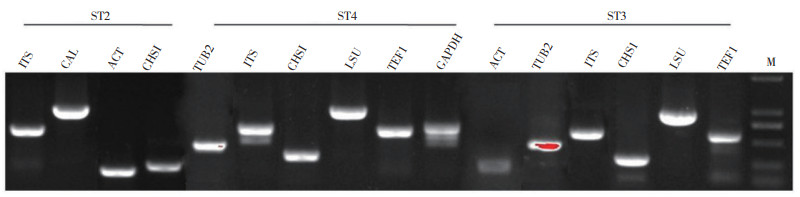
|
| M:DL2000 DNA标准分子量;ST2、ST3和ST4:基因组分别为PCR的模板 M: DL2000 DNA marker; ST2、ST3 and ST4: Its genome is the template for PCR 图 4 ITS及其他相关基因的PCR扩增产物电泳图谱 Fig. 4 Electrophoregram of the PCR product of ITS and other related genes |
同时,选用ITS1/ITS4、Bt2a/Bt2b、EF-2/EF-1、LR5/LR0R、gpd1/gpd2和CHS79-F/CHS354-R为引物,以ST4(ST4-1、ST4-2和ST4-3)全基因组为模板进行PCR扩增,分别获得552、443、565、903、638、299 bp的ITS、TUB2、TEF1、LSU、GAPDH、CHS1序列片段(图 4);经过测序和在NCBI BLAST后发现,ST4(ITS:MZ645939)与果生刺盘孢菌(C. fructicola)MSCJ06的同源性最高,初步确定ST4属于果生刺盘孢菌(C. fructicola)。
2.4 病原菌ST2的进化树建立在对ST2-1、ST2-2和ST2-3进行分子生物学鉴定时发现,同一个基因在3个菌株中扩增得到序列相似性均达到99% 以上。因此,我们仅上传基于ST2-1获得的ITS(OM698365)、ACT(OM746167)、CHS1(OM746166)和CAL(OM746165)序列。然后基于ACT和CHS1基因序列并采用最大自然法构建ST2-1的系统发育树,结果(表 2、图 5)表明:ST2-1与暹罗刺盘孢菌(C. siamense)的遗传距离最近,聚为一类;与隐秘刺盘孢(C. aenigma)和山茶刺盘孢(C. camelliae)的遗传距离最远。结合形态学特征及分子鉴定结果,确定引起沙田柠檬炭疽病的病原菌ST2-1为暹罗刺盘孢菌(C. siamense)。

|

|
| 图 5 基于ACT和CHS1序列以最大自然法建立ST2-1和ST3-1及其近缘属种的系统发育树 Fig. 5 Phylogenetic tree of the ST2-1, ST3-1 and their relative strains based on ACT and CHS1 sequences with the maximum natural method |
2.5 病原菌ST3的进化树建立
在对ST3-1、ST3-2和ST3-3进行分子生物学鉴定时发现,同一个基因在3个菌株中扩增得到序列相似性均达到100%。因此,我们仅上传基于ST3-1获得的ITS(MZ646051)、ACT(OK086976)、CHS1(OK086977)和TUB(OK086977)序列。然后基于ACT和CHS1序列并采用最大自然法构建ST3-1的系统发育树,结果表明:ST3-1与兰花刺盘孢(C. cliviicola)的遗传距离最近,聚为一类;与果生刺盘孢菌(C. fructicola)和暹罗刺盘孢菌(C. siamense)的遗传距离最远。结合形态学特征及分子鉴定结果,确定引起沙田柠檬炭疽病的病原菌ST3-1为兰花刺盘孢菌(C. cliviicola)(表 2、图 5)。
2.6 病原菌ST4的进化树建立在对ST4-1、ST4-2和ST4-3进行分子生物学鉴定时发现,同一个基因在3个菌株中扩增得到序列相似性均达到99%。因此我们仅上传基于ST4-1获得的ITS(MZ645939)、LSU(OK638977)、CHS1(OK667073)、GAPDH(OK667072)和TUB2(OK667071)序列。然后基于GAPDH和CHS1序列并采用最大自然法构建ST4-1的系统发育树,结果(图 6)表明:ST4-1与果生刺盘孢菌(C. fructicola)的遗传距离最近,聚为一类;与喀斯特炭疽菌(C. karsti)的遗传距离最远。结合形态学特征及分子鉴定结果,确定引起沙田柠檬炭疽病的病原菌ST4-1为果生刺盘孢菌(C. fructicola)。
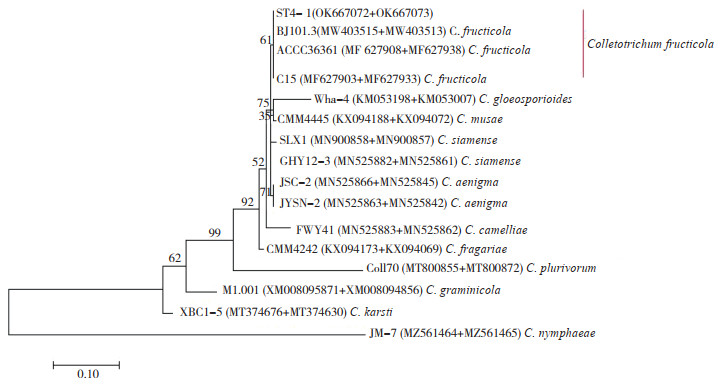
|
| 图 6 基于GAPDH和CHS1序列以最大自然法建立ST4-1及其近缘属种的系统发育树 Fig. 6 Phylogenetic tree of the ST4-1 and its relative strains based on GAPDH and CHS1 sequences with the maximum natural method |
3 讨论
炭疽病在柑橘类水果的生长期和采后期均能够造成严重的经济损失。研究表明,引起广东省各柑橘产地炭疽病的病原菌主要为盘长孢状刺盘孢(Colletotrichum gloeosporioides Penz.)。2007年,盘长孢状刺盘孢曾在广东省德庆官圩镇和马圩镇贡柑上引起大面积的炭疽病,仅当年的果园损失就高达2 000多万元[18];而后关于不同炭疽菌小种引起炭疽病的研究也逐渐有报道,如暹罗刺盘孢菌(C. siamense)和毛豆炭疽病菌(C. truncatum)能够分别在肇庆十月桔和龙门市年橘上引起柑橘炭疽病[19-20]。目前在广东还没有果生刺盘孢菌(C. fructicola)在柑橘上引起病害的报道,而果生刺盘孢菌能够在湖南常德石门甜橙上引起炭疽病。与盘长孢状刺盘孢相似,该病原菌侵染柑橘果实,最初可在果实上造成小而褐色的病斑,随后病斑会发展为各种形状的大病斑,最后造成果实腐烂和脱落[4]。
本文从发病柠檬果实上分离得到的暹罗刺盘孢菌引起的病症与以往报道的炭疽病在柑橘类果实上引起的病症截然不同,仅为白色片状斑点不深入果皮;该病害仅影响沙田柠檬果实的外观,不透过果皮,对柠檬的品质没有明显影响;但在室内接种试验中发现,暹罗刺盘孢菌仅可通过伤口在果实上产生危害,由此推断该病害的侵入有可能与物理伤口或昆虫的危害有关;对该类病原菌引起的炭疽病的防治应结合控虫,从而达到最优的防治效果。而果生刺盘孢菌能够在柑橘上引起病害,为广东省首次报道。在我国,除柑橘外,果生刺盘孢菌还可对核桃、樱桃、蛋黄果等的果实和叶片造成危害[21-23]。此外,有研究表明,兰花刺盘孢仅可在我国的烟草和杂交狼尾草上引起叶斑病和炭疽病[24-27],而本研究发现兰花刺盘孢能够在沙田柠檬上引起炭疽病为国际上首次报道。目前对于炭疽病的防控,主要采用生物防治和化学防治的方法,不同小种对同一种药剂的敏感性也不同[28-29]。因此,明确引起炭疽病的炭疽菌种类对该病的防治至关重要。
4 结论对沙田柠檬炭疽病病原菌的研究发现,引起该病害的病原菌为果生刺盘孢菌(C.fructicola)、暹罗刺盘孢菌(C. siamense)和兰花刺盘孢(C. cliviicola)。通过致病性测定发现,果生刺盘孢菌和兰花刺盘孢均能够在沙田柠檬叶片上引起炭疽病,而暹罗刺盘孢菌则可以在柠檬的果实和叶片上引起病害;但从田间沙田柠檬病叶片上仅能够分离获得果生刺盘孢菌和兰花刺盘孢,而果实上也仅能够获得暹罗刺盘孢菌。通过对3个不同炭疽属病原菌的分子生物学鉴定和进化树建立表明,除ITS外,钙调蛋白(CAL)、肌动蛋白(ACT)和几丁质合成酶(CHS1)可以稳定应用于炭疽菌属真菌不同小种之间的鉴定。在对沙田柠檬炭疽病的防治上,要科学用药,兼顾到不同的病原菌。但是关于果生刺盘孢菌、暹罗刺盘孢菌和兰花刺盘孢菌在沙田柠檬上的致病机理及侵染途径仍需进一步深入研究。
| [1] |
姜波, 彭成绩, 邓其海, 曾继吾, 钟云, 周碧容. 尤力克柠檬在广东的引种研究[J]. 广东农业科学, 2011, 38(5): 58-59. DOI:10.3969/j.issn.1004-874X.2011.05.021 JIANG B, PENG C J, DENG Q H, ZENG J W, ZHONG Y, ZHOU B R. Performances of eureka lemon introduction in Guangdong[J]. Guangdong Agricultural Sciences, 2011, 38(5): 58-59. DOI:10.3969/j.issn.1004-874X.2011.05.021 |
| [2] |
TIMMER L W, AGOSTINI J P, ZITKO S E, ZULFIQAR M. Postbloom fruit drop, an increasingly prevalent disease of citrus in the America[J]. Plant Disease, 1994, 78(4): 329-334. DOI:10.1094/PD-78-0329 |
| [3] |
DEAN R, KAN J A L V, PRETORIUS Z A, HAMMOND-KOSACK KIM E, PIETRO A D, SPANU P D, RUDD J J, DICKMAN M, KAHMANN R, ELLIS J. The top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(4): 414-430. DOI:10.1111/j.1364-3703.2012.00822.x |
| [4] |
HU W L, MA Y Z, CHEN J Z. First report of citrus sinensis anthracnose caused by Colletotrichum fructicola in China[J]. Plant Disease, 2019, 103(5). DOI:10.1094/PDIS-08-18-1466-PDN |
| [5] |
CHENG B P, HUANG Y H, SONG X B, PENG A T, LING J F, CHEN X. First report of Colletotrichum siamense causing leaf drop and fruit spot of Citrus reticulata Blanco cv. Shiyue Ju in China[J]. Plant Disease, 2013, 97(11): 1508. DOI:10.1094/PDIS-04-13-0352-PDN |
| [6] |
王冬, 田卉, 贾勇, 王亮, 王宣伍. 四川省柠檬主要病虫害防控技术[J]. 四川农业科技, 2021(2): 56-58. DOI:10.3969/issn.1004-1028.2021.12.017 WANG D, WANG H, JIA Y, WANG L, WANG X W. Main pest and disease control techniques on lemon in Sichuan province[J]. Sichuan Agricultural Science and Technology, 2021(12): 56-58. DOI:10.3969/issn.1004-1028.2021.12.017 |
| [7] |
宋晓兵, 王晓宇, 彭埃天, 冯冠杰, 黄峰, 崔一平, 陈霞. 柠檬蓟马的危害及其防控技术研究[J]. 中国热带农业, 2021(4): 66-69. DOI:10.3969/j.issn.1673-0658.2021.04.013 SONG X B, WANG X Y, PENG A T, FENG G J, HUANG F, CUI Y P, CHEN X. Research of damage of citrus limon thrips and control technology[J]. China Tropical Agriculture, 2021(4): 66-69. DOI:10.3969/j.issn.1673-0658.2021.04.013 |
| [8] |
WHITE T J, BRUNS T, LEE S, TAYLOR J. Amplification and direct sequencing of fungal ribosomal RNA for phylogenetices // INNIS M A, GELFAND D H, SNINSKY J J, WHITE T J. PCR protocol: A guide to methods and applications[C]. San Diego: Aeademic Press, 1990: 315-322. DOI: 10.0000/PMID1793.
|
| [9] |
GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61: 1323-1330. DOI:10.1128/aem.61.4.1323-1330 |
| [10] |
CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91: 553-556. DOI:10.2307/3761358 |
| [11] |
GUERBER J C, LIU B, CORRELL J C, CORRELL J C, JOHNSTON P R. Characterization of diversity in Colletotrichum acutatum sensu lato by sequence analysis of two gene introns, mtDNA and intron RFLPs, and mating compatibility[J]. Mycologia, 2003, 95: 872-895. DOI:10.1080/15572536.2004.11833047 |
| [12] |
GEISER D M, DEL MAR JIM NEZ-GASCO M, KANG S, MAKALOWSKA I, VEERARAGHAVAN, N, WARD T J, ZHANG N, KULDAU G A, O'DONNELL K. FUSARIUM-ID v. 1. 0: A DNA sequence database for identifying Fusarium[J]. European Journal of Plant Pathology, 2004, 110(473): 479. DOI:10.1007/978-1-4020-2285-22 |
| [13] |
WEIR B S, JOHNSTON P R, DAMM U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology, 2012, 73: 115-180. DOI:10.3114/sim0011 |
| [14] |
VILGALYS R, HESTER M. Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species[J]. Journal of Bacteriology, 1990, 172: 4238-4246. DOI:10.1128/jb.172.8.4238-4246.1990 |
| [15] |
GARGAS A, TAYLOR J W. Phylogeny of discomycetes and early radiations of the apothecial Ascomycotina inferred from SSU rDNA sequence data[J]. Experimental Mycology, 1995, 19(1): 7-15. DOI:10.1006/emyc.1995.1002 |
| [16] |
崔一平, 李一方, 彭埃天, 宋晓兵, 凌金锋, 黄峰, 陈霞. 广东怀集青心菊炭疽病病原菌的分子鉴定[J]. 广东农业科学, 2022, 49(1): 87-93. DOI:10.16768/j.issn.1004-874X.2022.01.010 CUI Y P, LI Y F, PENG A T, SONG X B, LING J F, HUANG F, CHEN X. Molecular identification of anthracnose pathogen of Chrysanthemum in Huaiji, Guangdong Province[J]. Guangdong Agricultural Sciences, 2022, 49(1): 87-93. DOI:10.16768/j.issn.1004-874X.2022.01.010 |
| [17] |
CAO X R, XU X M, CHE H Y, WEST J S, LUO D Q. Three Colletotrichum species, including a new species, are associated to leaf anthracnose of rubber tree in Hainan, China[J]. Plant Disease, 2019, 103: 117-124. DOI:10.1094/PDIS-02-18-0374-RE |
| [18] |
彭埃天, 陈玉托, 宋晓兵, 姚燕球, 吴咏梅. 德庆贡柑炭疽病的发生和防治初探[J]. 广东农业科学, 2008(2): 58-60. DOI:10.16768/issn.1004-874X.2008.02.024 PENG A T, CHEN Y T, SONG X B, YAO Y Q, WU Y M. Anthracnose occurrence and control of deqing citrus gongan[J]. Guangdong Agricultural Sciences, 2008(2): 58-60. DOI:10.16768/issn.1004-874X.2008.02.024 |
| [19] |
王震, 杨媚, 杨迎青, 彭正凯, 周而勋. 广东省柑橘炭疽病病原菌的形态与分子鉴定[J]. 菌物学报, 2010, 29(4): 488-493. DOI:10.13346/j.mycosystema.2010.04.018 WANG Z, YANG M, YANG Y Q, PENG Z K, ZHOU E X. Morphological and molecular identification of citrus anthracnose pathogen from Guangdong Province[J]. Mycosystema, 2010, 29(4): 488-493. DOI:10.13346/j.mycosystema.2010.04.018 |
| [20] |
CHENG B P, HUANG Y H, PENG A T, LING J F, SONG X B, CHEN X. First report of leaf and fruit spot of Citrus reticulata Blanco cv. Nian Ju caused by Colletotrichum truncatum in China[J]. Plant Disease, 2014, 98(3): 422. DOI:10.1094/PDIS-07-13-0712-PDN |
| [21] |
WANG Q H, LI D W, DUAN C H, LIU X H, NIU S G, HOU L Q, WU X Q. First report of walnut anthracnose caused by Colletotrichum fructicola in China[J]. Plant Disease, 2017, 102(1). DOI:10.1094/PDIS-06-17-0921-PDN |
| [22] |
TANG Z Y, LOU J, HE L Q, WANG Q D, CHEN L H, ZHONG X T, WU C F, ZHANG L Q, WANG Z Q. First report of Colletotrichum fructicola causing anthracnose on cherry (Prunus avium) in China[J]. Plant Disease, 2021. DOI:10.1094/PDIS-03-21-0544-PDN |
| [23] |
YANG Z N, MO J Y, GUO T X, LI Q L, TANG L H, HUANG S P, WEI J G, HSIANG T. First report of Colletotrichum fructicola causing anthracnose on Pouteria campechiana in China[J]. Plant Disease, 2021, 105(3). DOI:10.1094/PDIS-02-20-0253-PDN |
| [24] |
WANG Y R, HU Z, ZHONG J, CHEN Y, ZHU J Z. First Report of Colletotrichum cliviicola causing leaf spot on Tobacco (Nicotiana tabacum) in Hunan province of China[J]. Plant Disease, 2021, 106(1). DOI:10.1094/PDIS-02-21-0409-PDN |
| [25] |
HAN Y Z, FAN Z W, WU C F, WANG J H, ZHAO J J. First report of leaf anthracnose caused by Colletotrichum cliviicola on Hybrid Pennisetum in China[J]. Plant Disease, 2019, 103(9): 2472. DOI:10.1094/PDIS-02-19-0386-PDN |
| [26] |
李文豪, 刘明, 康林芝, 肖自添, 何焕清, 徐江, 胡婷婷, 刘主. 一株疑似野生大白口蘑的鉴定及菌丝培养基筛选[J]. 广东农业科学, 2019, 46(3): 37-44, 173. DOI:10.16768/j.issn.1004-874X.2019.03.006 LI W H, LIU M, KANG L Z, XIAO Z T, HE H Q, XU J, HU T T, LIU Z. Identification of a strain of suspected wild Tricholoma giganteum and screening of mycelium culture medium[J]. Guangdong Agricultural Sciences, 2019, 46(3): 37-44, 173. DOI:10.16768/j.issn.1004-874X.2019.03.006 |
| [27] |
崔杰, 洪文君, 刘俊, 陈伟玉, 何书奋, 罗金环. 极小种群野生植物海南假韶子结构解剖特征研究[J]. 广东农业科学, 2019, 46(11): 31-36. DOI:10.16768/j.issn.1004-874X.2019.11.005 CUI J, HONG W J, LIU J, CHEN W Y, HE S F, LUO J H. Anatomical structure characteristics of a wild plant of extremely small population Paranephelium hainanensis[J]. Guangdong Agricultural Sciences, 2019, 46(11): 31-36. DOI:10.16768/j.issn.1004-874X.2019.11.005 |
| [28] |
徐丹丹, 石力允, 张羽, 林泽勉, 姜子德, 乔方. 广东咖啡炭疽病病原菌初步鉴定及防治药剂筛选[J]. 广东农业科学, 2021, 48(2): 100-107. DOI:10.16768/j.issn.1004-874X.2021.02.013 XU D D, SHI L Y, ZHANG Y, LIN Z M, JIANG Z D, QIAO F. Pathogen identification of anthracnose disease on coffeaarabica in Guangdong province and screening of fungicides[J]. Guangdong Agricultural Sciences, 2021, 48(2): 100-107. DOI:10.16768/j.issn.1004-874X.2021.02.013 |
| [29] |
刘连金, 李正令, 李雪理, 李兴田, 侯青, 杨友联, 廖旺姣, 严凯, 张晓勇. 八角炭疽病生防菌株筛选及发酵条件研究[J]. 植物保护, 2022, 48(5): 204-211. DOI:10.16688/j.zwbh.2021512 LIU L J, LI Z L, LI X L, LI X T, HOU Q, YANG Y L, LIAO W J, YAN K, ZHANG X Y. Screening and fermentation conditions of biocontrol bacteria for anthracnose of star anise[J]. Plant Protection, 2022, 48(5): 204-211. DOI:10.16688/j.zwbh.2021512 |
(责任编辑 张辉玲)
 2022, Vol. 49
2022, Vol. 49