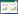文章信息
基金项目
- 云南省重大科技专项计划项目(202002AE32005,202102AE090021)
作者简介
- 兰珊珊(1982—),女,硕士,副研究员,研究方向为食品安全与风险评估,E-mail:cindy_lss@163.com.
通讯作者
- 刘宏程(1975—),男,博士,研究员,研究方向为食品安全与分析,E-mail:liuorg@163.com.
文章历史
- 收稿日期:2022-09-13
2. 祥云县农业科学技术推广所,云南 祥云 672100
2. Xiangyun Agricultural Science and Technology Extension Institute, Xiangyun 672100, China
【研究意义】甲醛,无色,有刺激性气味,易溶于水,其水溶液具有防腐杀菌性能[1-2]。甲醛毒性来源于醛的亲电性,在此过程中,副产物的形成会损害DNA、RNA、蛋白质和脂质等生物大分子的活性,从而抑制细胞正常生理功能[3-4]。急性暴露于甲醛会刺激五官和皮肤黏膜,导致炎症反应,上呼吸道疾病增加,呼吸短促和喘息等[5-6]。长期接触甲醛对人体神经系统、肺、肝脏、免疫系统及生殖细胞均有损害[7-9],可导致基因突变和癌症的发生[10]。基于甲醛的严重危害,2006年世界卫生组织下属的国际癌症研究局(IARC)正式公布甲醛是人类致癌物(A1类)[11]。在人国有毒化学物品控制名单中,甲醛居第二位[12]。《中华人民共和国食品安全法》已将其明确列为禁用添加剂,卫生部办公厅关于GB 2760-2011《食品添加剂使用标准》有关问题的复函中也明确指出,甲醛不得作为食品用加工助剂生产经营和使用[13]。但近年来,在蔬菜运输过程中喷洒甲醛溶液保鲜的新闻屡见不鲜[13],同时蔬菜在贮运过程中使用的包装材料也会造成甲醛溶出,对人体健康造成潜在威胁[14]。蔬菜中甲醛的残留问题已成为人们密切关注的食品安全问题之一。【前人研究进展】有关植源性食品中甲醛含量检测的方法标准主要有农业行业标准《NY/T 3292-2018蔬菜中甲醛含量的测定高效液相色谱法》《NY/T 1283-2007香菇中甲醛含量的测定》,出入境检验检疫行业标准《SN/T 1547-2011进出口食品中甲醛的测定液相色谱法》及地方标准《DB12/T 883-2019食用菌中甲醛的测定高效液相色谱法》等。目前蔬菜中甲醛含量测定最常用的方法为高效液相色谱(High Performance Liquid Chromatography,HPLC)法,分析检测普遍采用的是农业行业标准NY/T 3292-2018,使用的也是HPLC法。除HPLC法外,植源性食品中甲醛检测的方法还有乙酰丙酮法、酚试剂衍生法和催化光度法等[1, 13, 15-16]。【本研究切入点】HPLC法存在检测成本高、样品前处理繁琐、比色液不稳定等问题。蔬菜流通中人为不当使用而产生的外源性甲醛,是造成蔬菜中甲醛污染的主要原因,另外蔬菜在代谢过程中也会生成少量内源性甲醛[17]。本研究通过超声提取蔬菜中的甲醛,对提取和分析条件进行优化,分析常见及甲醛残留高关注度蔬菜中的甲醛残留量,并利用数学模型结合膳食数据对甲醛的残留风险进行评估。【拟解决的关键问题】建立适应基层实验室应用的蔬菜中甲醛含量测定的快速方法,掌握常见及甲醛残留高关注度蔬菜中甲醛含量的残留情况,分析蔬菜中甲醛含量对人群的膳食暴露风险。
1 材料与方法 1.1 试验材料蔬菜样品取样参照NY/T 789-2004《农药残留分析样本的采样方法》和NY/T 2103-2011《蔬菜抽样技术规范》规定执行。抽样品种包括大白菜、上海青、生菜、芹菜、菠菜、西兰花、黄瓜、西葫芦、豇豆、山药、秋葵和芦笋12种常见蔬菜,样品抽自云南昆明、曲靖、玉溪、红河、临沧、大理、楚雄等种植基地、农贸市场、蔬菜批发市场和商超等。每种蔬菜的样品数不少于10个,总计抽取383个样品,产地包括云南、海南、山东、湖南或湖北等。
乙酸铵、乙酰丙酮、氢氧化钠、硫酸、硫代硫酸钠、可溶性淀粉(分析纯,国药集团化学试剂有限公司),冰乙酸(分析纯,重庆川东化工有限公司),碘化钾(分析纯,成都市科隆化学用品有限公司),壳聚糖(分析纯,上海泰坦化学有限公司),实验用水由PURELAB flex纯水机系统制得(英国埃尔格ELGALab Water公司)。溶液配制、甲醛标准贮备溶液的标定参照农业行业标准NY/T 1283-2007《香菇中甲醛含量的测定》。
SPECORD 210 Plus型紫外分光光度计(德国Analytik Jena AG公司),AE 100电子分析天平(瑞士Mettler Toledo公司),KQ500-E型超声清洗器(江苏省昆山市超声仪器有限公司),TGL-15B高速台式离心机(上海安亭科学仪器厂),HWS26型电热恒温水浴锅(上海一恒科技有限公司)。
1.2 试验方法1.2.1 确定最大吸收波长 将5 mL甲醛标准溶液(10 μg/mL)加入25 mL比色管中,加水定容至25 mL,加入2.5 mL乙酰丙酮溶液,混匀后60 ℃水浴加热15 min,冷却后进行350~800 nm全波段扫描,测定最大吸收波长。
1.2.2 标准曲线绘制 依次吸取0.50、1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00 mL 10.0 μg/L的甲醛标准溶液于25 mL具塞比色管中,加水至25 mL,加入2.5 mL乙酰丙酮溶液,混匀后置于60 ℃水浴中15 min,冷却至室温,以空白液为参比,于波长413 nm处用1 cm比色皿测定吸光度值,绘制标准曲线。
1.2.3 测定条件优化 将大白菜样品切成碎片(5 mm×5 mm左右)后混匀,称取10.0 g于100 mL离心管中(若样品为深色蔬菜,可加入2.0 g壳聚糖进行脱色[15]),加入纯水至100 mL,分别超声提取10、15、20、25、30、35、40 min,5 000 r/min离心5 min。吸取10 mL上清液于25 mL具塞比色皿中,加水至25 mL,加入2.5 mL乙酰丙酮溶液,混匀后置于60 ℃水浴中15 min,冷却至室温,立即以空白液为参比,于波长413 nm处用1 cm比色皿进行比色,记录吸光度值,重复6次。
将2.5 mL甲醛标准溶液(10 μg/mL)加入25 mL比色管中,加水定容至25 mL,研究显色剂添加量、水浴温度、水浴时间对测定结果的影响,显色剂添加量为1.0、2.0、3.0、4.0、5.0 mL;水浴温度为50、60、70、80、90、100 ℃;水浴时间为5、10、15、20、25、30 min,进行单因素实验,进行测定条件优化,6次重复。
1.2.4 样品测定 将蔬菜样品可食部分切成碎片(5 mm×5 mm左右)后混匀,称取10.0 g样品于100 mL离心管中(深色蔬菜中加入2.0 g壳聚糖),加入纯水至100 mL,加塞超声提取20 min,5 000 r/min离心5 min。准确吸取10 mL样品上清液于25 mL具塞比色皿中,加水至25 mL,加入2.5 mL乙酰丙酮溶液,混匀后置于60 ℃水浴中15 min,冷却至室温,立即以空白液为参比,于波长413 nm处用1 cm比色皿进行比色,记录吸光度值。每个样品平行测定两次,取平均值。
1.2.5 回收率和精密度试验 选择大白菜、上海青、黄瓜、豇豆、山药5种蔬菜,切碎混匀后按1.5、7.5、15 mg/kg的水平添加甲醛,按照1.2.4的方法测定甲醛含量,6次重复。
1.2.6 暴露评估 采用点评估方法,根据蔬菜中甲醛每日膳食暴露水平(mg/kg bw)=蔬菜日消费重量(kg/kg bw)×蔬菜中甲醛残留量(mg/kg)[18-19],用公式(1)计算。急性膳食暴露是指一次性或短期内大量摄入某种危害物,用公式(2)计算;慢性膳食暴露风险评估是估算人们在长时间可能的暴露程度(范围),用公式(3)计算。

|
公式(1) |

|
公式(2) |

|
公式(3) |
式(1)中,y为个体通过蔬菜摄入甲醛的每日暴露量,x为蔬菜的每日消费量(g),c为蔬菜甲醛的含量(平均值或最高值,mg/kg),w为个体平均体重(kg),蔬菜整体消费量参照中国营养学会推荐的不同个体人群每日蔬菜摄入量[20-22],每种蔬菜的消费量参照WHO给出的可涵盖97.5% 食用者每天消耗的该类食品的量[23],个体平均体重按58. 2 kg计[24],不同年龄段个体平均体重依据金水高[25]编写的《中国居民营养与健康状况调查报告之十》。
式(2)、(3)中,MOS为安全限值,aPAD为甲醛急性人群校正剂量,其中美国环境保护局研究确定甲醛急性参考剂量(ARfD)为15 mg/kg bw,而国际上通常再除以一个安全系数10,从而得出甲醛的aPAD为1. 5 mg/kg bw[19]。ADI为甲醛每日允许摄入量,美国国家环境保护局(EPA)建议甲醛的ADI值为0.2 mg/kg bw[26]。一般地,如果MOS>1,暴露水平为“安全”,通常认为该危害物对人体的健康风险是可接受的;而如果MOS ≤ 1,则认为该危害物对人体的健康风险超过可接受限值,应采取适当的风险管控措施,MOS越大,风险越小,MOS越小,风险越大[18]。
1.2.7 数据处理 应用Microsoft Excel 2021处理原始数据与作图,采用SPSS 17.0软件进行统计学分析。
2 结果与分析 2.1 最大吸收波长甲醛标准溶液与乙酰丙酮溶液加热反应,反应液冷却后进行350~800 nm全波段扫描,测定最大吸收波长,结果如图 1所示,最大吸收波长为413 nm。

|
| 图 1 甲醛与乙酰丙酮反应液的最大吸收波长 Fig. 1 Maximum absorption wavelength of reaction solution of formaldehyde and acetylacetone |
2.2 标准曲线和方法检出限
如图 2所示,甲醛浓度在5~80 μg/25 mL,即0.2~3.2 mg/kg范围内与吸光度值呈良好线性关系,回归方程为y=0.0205x+0.0259,相关系数r=0.9996,检出限为0.45 mg/kg,定量限为1.5 mg/kg。

|
| 图 2 甲醛测定的标准曲线 Fig. 2 Standard curve for determination of formaldehyde |
2.3 单因素条件的确定
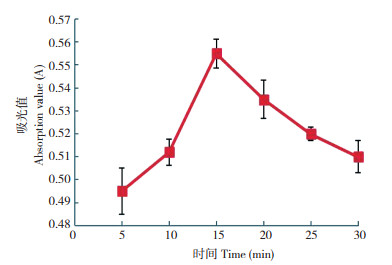
用超声水提蔬菜中的甲醛,结果如图 3所示。当超声提取20 min时,甲醛含量最高,随着超声提取时间的延长,甲醛含量逐渐降低,因此将前处理试样制备的超声提取时间确定为20 min。
|
| 图 3 超声提取时间对甲醛含量的影响 Fig. 3 Effect of ultrasonic extraction time on determination of formaldehyde content |
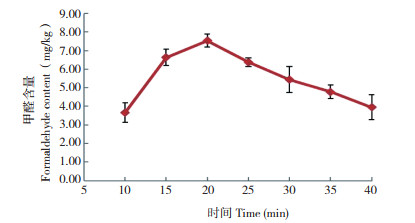
在甲醛标准溶液中加入不同体积的乙酰丙酮溶液,确定显色反应液乙酰丙酮的用量。结果如图 4所示,当乙酰丙酮溶液的体积小于2.0 mL时,吸光度值偏小,这是由于显色剂用量过少,反应不完全;当乙酰丙酮溶液的体积在2.0~3.0 mL时,吸光度值保持基本不变,说明此时已基本反应完全;当乙酰丙酮溶液的体积大于3.0 mL,吸光度值减小。因此确定显色剂乙酰丙酮溶液的用量为2.5 mL。
|
| 图 4 乙酰丙酮用量对吸光值的影响 Fig. 4 Effect of acetylacetone consumption on the absorbance value |
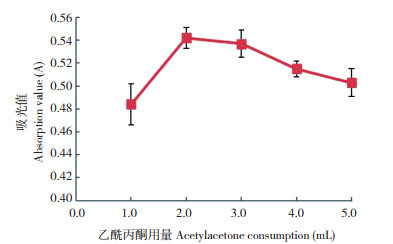
在甲醛标准溶液中加入2.5 mL乙酰丙酮溶液,混匀后分别于50、60、70、80、90、100 ℃下水浴加热15 min,结果(图 5)表明,当水浴加热温度为60 ℃时反应的吸光度值最大。当水浴温度在70~100 ℃时,随着温度升高,吸光值逐渐下降,说明温度过高会破坏反应液的稳定性,影响显色反应,因此将水浴加热的温度确定为60 ℃。而将甲醛溶液与乙酰丙酮溶液的反应液在60 ℃水浴中分别加热,结果(图 6)显示,当水浴时间在5~10 min之间时,吸光度值较低;当水浴时间为15 min时,吸光度值最大;当水浴时间长于15 min后,吸光度值随水浴时间的延长而逐渐降低,说明水浴时间过长会破坏反应液的稳定性,影响显色反应,因此将水浴加热的时间确定为15 min。

|
| 图 5 水浴温度对吸光值的影响 Fig. 5 Effect of water bath temperature on the absorbance value |
|
| 图 6 水浴时间对吸光值的影响 Fig. 6 Effect of water bath time on the absorbance value |
2.4 回收率和精密度
以定量限的1倍、5倍和10倍作为添加量进行加标回收实验,每种添加水平重复测定6次,计算平均回收率,并求得相对标准偏差,结果如表 1所示。当样品中甲醛的添加水平为1.5 mg/kg时,回收率为87.23%~92.40%,相对标准偏差为2.23%~4.21%;当添加水平为7.5 mg/kg时,回收率为86.33%~92.12%,相对标准偏差为2.83%~3.61%;添加水平为15.0 mg/kg时,回收率在86.38%~91.60% 之间,相对标准偏差为2.41%~3.59%。在3种添加水平下,甲醛在不同蔬菜中的平均回收率为86.33%~92.40%,相对标准偏差在2.23%~4.21%,准确度和精密度均满足甲醛含量分析的要求。

|
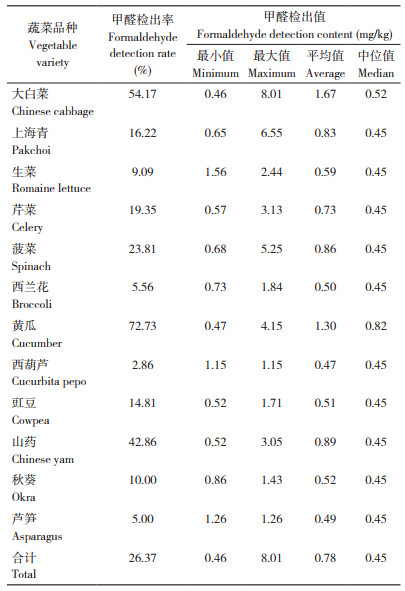
2.5 主要蔬菜产品中甲醛含量
用上述方法对12个蔬菜品种、383个蔬菜样品中的甲醛含量进行测定,所有蔬菜种类均有未检出样品,在计算平均值和中位值时,所有未检出样品中甲醛含量均按检出限0.45 mg/kg计算。结果(表 2)显示,蔬菜中甲醛的检出率为26.37%,不同蔬菜的检出率在5.00%~72.73% 之间,检出值为ND 8.01 mg/kg,检出平均值为0.47~1.67 mg/kg,其中黄瓜的最高、芦笋的最低,大白菜的最大、西葫芦的最小;大白菜、黄瓜和山药3种蔬菜中甲醛的检出率相对较高,均在40% 以上。
|
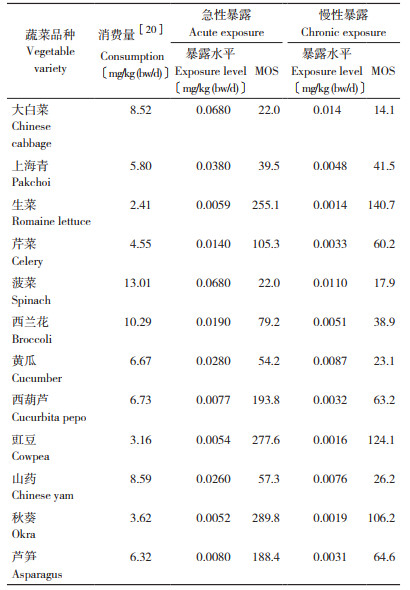
2.6 膳食暴露评估
用点评估的方法分析不同蔬菜中甲醛含量的膳食暴露水平及风险。计算急性膳食暴露水平采用每种蔬菜中甲醛检出的最大值,计算慢性暴露水平采用每种蔬菜甲醛检出的平均值。每种蔬菜的消费量参照GEMS/FOOD全球环境监测规划/食品污染监测与评估规划的消费量数据库,以各成员国调查结果的P97.5为基础统计获得;该数据库中未统计山药的日摄入量,故山药的日摄入量用中国营养学会推荐的人群每日蔬菜摄入量最大值500 g[20]除以人群平均体重58.2 kg[24]获得。结果如表 3所示,各种蔬菜中甲醛含量的急性膳食暴露量为0.0052~0.068 mg/kg (bw/d),慢性暴露水平为0.0019~0.014 mg/kg (bw/d),其中大白菜的暴露水平最高,急性暴露MOS为22.0,慢性暴露MOS为14.1,秋葵的暴露水平最低,急性暴露和慢性暴露MOS分别为289.8、106.2。虽然不同蔬菜中甲醛含量的膳食暴露水平差异较大,但无论是急性还是慢性暴露水平均较低,MOS值均远大于1,说明不同蔬菜中甲醛的暴露风险水平均很低。
|
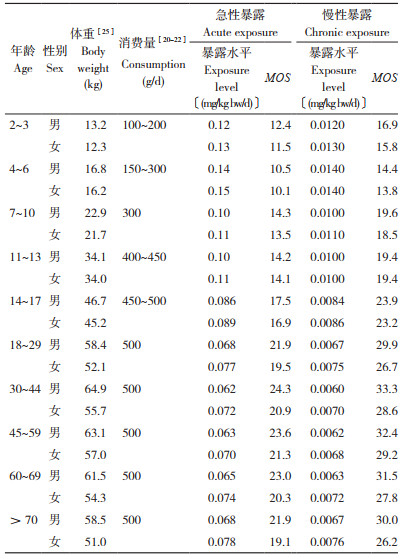
依据中国营养学会推荐的学龄前儿童、学龄儿童和普通人群等不同个体人群每日蔬菜摄入量,计算蔬菜中甲醛含量的膳食暴露量和评估膳食风险。本着最大风险原则,本文在计算蔬菜中甲醛暴露水平时均采用各年龄人群推荐蔬菜消费量的最大值,计算急性膳食暴露水平采用所有蔬菜中甲醛检出的最大值(8.01 mg/kg),计算慢性暴露水平采用所有蔬菜甲醛检出的平均值(0.78 mg/kg)。结果表明,甲醛在蔬菜中的残留对我国不同人群的急性膳食暴露水平为0.062~0.15 mg/kg (bw/d),MOS为10.1~24.3;慢性暴露水平在0.0060~0.014 〔mg/kg (bw/d)〕,MOS在13.8~33.3。不同年龄不同性别人群的暴露水平和暴露风险有差异,整体来说未成年人(<18岁)蔬菜中甲醛含量的膳食暴露风险大于成年人和老年人,其中4~6岁年龄段的暴露风险最大,但MOS值均大于1,表明急性暴露和慢性暴露风险均在可接受范围内,各类人群暴露水平和暴露风险详见表 4。
|
3 讨论
目前蔬菜中甲醛含量测定的常用标准是农业行业标准NY/T 3292-2018《蔬菜中甲醛含量的测定高效液相色谱法》,用高效液相色谱测定蔬菜中的甲醛含量,方法定量限为2.0 mg/kg,HPLC法能够消除样品基体对检测带来的影响,但存在检测成本高、样品前处理繁琐、反应时间长、比色液不稳定等问题。而传统的乙酰丙酮分光光度法采样蒸馏的方式提取甲醛,不仅操作繁琐耗时长,提取率也较低。本方法采用超声提取,优化各实验条件后,定量限为1.5 mg/kg,回收率在86.33%~92.40% 之间,满足蔬菜中甲醛含量测定的要求,且操作简便,可作为蔬菜中甲醛含量测定的快速检测方法。用上述方法分析的12个蔬菜品种、383个蔬菜样品中,甲醛检出率为26.37%,检出值在ND~8.01 mg/kg之间,与近年来国内的相关分析结论基本一致[1, 12-13, 15]。但WHO曾有报告公布蔬菜和水果中甲醛含量为3.3~17.3 mg/kg[27],与我们的结果有一定差异,可能与样本来源、样本品种、成熟度、样本量、测定方法及贮藏时间等因素有关。
在食品危害因子的风险评估研究中,点评估的方法操作简单,已被用于食用菌、水产品等中甲醛的暴露评估,但该法未考虑污染物含量和消费量的变异性以及抽样的不确定性,易高估暴露量,使评估结果过于保守[28-29]。本着最大风险原则,本研究在评估时,甲醛含量和蔬菜消费量均是取高值进行分析,是基于极保守假设的暴露估计,评估结果远高于实际暴露水平,但这种极端保守的评估结果仍显示蔬菜中甲醛含量的膳食暴露风险较低,MOS值最小的都为10.1,是安全限值1的10倍,说明蔬菜中甲醛残留量的膳食摄入风险水平较低。但由于各类农产品中均可能含有少量内源性甲醛[27],消费者在实际膳食摄入过程中,甲醛的暴露途径并不是单一的,仅对蔬菜产品中的甲醛残留量进行评估并不足以全面描述甲醛的膳食摄入暴露风险。另一方面,部分评估参数还不够全面,目前我国基础膳食数据统计尚不完全。本研究中各种蔬菜的日摄入量是参照GEMS/Food提供的大份餐数据,但东西方饮食习惯有一定差异,以及特殊人群的消费习惯等数据也还较为缺乏,因此现有的评估结果存在一定的局限性,还需要不断完善暴露评估的各项基础数据。
4 结论本试验通过超声提取,研究了提取时间、显色剂用量、水浴温度和时间对甲醛含量测定的影响,建立了蔬菜中甲醛测定的乙酰丙酮分光光度法,方法精确度和灵敏度符合GB/T 27404—2008 《实验室质量控制规范食品理化检测》的要求,能够满足蔬菜中甲醛测定的需求,适应于蔬菜中甲醛的快速测定和基础实验室应用;对12个蔬菜品种的383个样品中的甲醛含量进行分析发现,不同蔬菜中甲醛的检出率为5.00%~72.73%,总检出率为26.37%,不同蔬菜的检出平均值在0.47~1.67 mg/kg;不同蔬菜中甲醛含量对一般人群的膳食暴露水平为0.0019~0.068 mg/kg (bw/d),MOS为14.1~289.8,蔬菜中甲醛含量对不同人群的膳食暴露水平为0.0060~0.15 mg/kg (bw/d),MOS在10.1~33.3,所有评估的MOS均大于1,不同蔬菜中的甲醛膳食摄入水平和风险以及蔬菜中甲醛残留对我国不同人群的摄入风险都有差异,但整体来说,基于现有的风险评估模型和膳食数据的评估结果,蔬菜中甲醛残留量的膳食摄入风险较低,在可接受范围内。
| [1] |
符文杰, 陈晓红. 酚试剂衍生法测定白菜中的甲醛[J]. 中国卫生检验杂志, 2021, 31(12): 1412-1414. FU W J, CHEN X H. Determination of formaldehyde in cabbage by phenol reagent derivatization[J]. Chinese Journal of Health Laboratory Technology, 2021, 31(12): 1412-1414. |
| [2] |
周松英, 万军伟, 朱铭立, 张卫锋, 朱孟丽. 超高速液相色谱法测定白菜中的甲醛[J]. 广东农业科学, 2012, 39(19): 102-103. DOI:10.16768/j.issn.1004-874X.2012.19.004 ZHOU S Y, WAN J W, ZHU M L, ZHANG W F, ZHU M L. Determination of formaldehyde in cabbage by ultra high performance liquid chromatography[J]. Guangdong Agricultural Sciences, 2012, 39(19): 102-103. DOI:10.16768/j.issn.1004-874X.2012.19.004 |
| [3] |
赵云鹏. 香菇加工过程中甲醛风险识别、迁移及转化规律研究[D]. 广州: 华南理工大学, 2021. ZHAO Y P. Study on the risk identification, migration and conversion of formaldehyde during shiitake mushroom processing[D]. Guangzhou: South China University of Technology, 2021. |
| [4] |
DINGLER F A, WANG M, MU A, MILLINGTON C L, OBERBECK N, WATCHAM S, PONTEL L B, KAMIMAE-LANNING A N, LANGEVIN F, NADLER C, CORDELL R L, MONKS P S, YU R, WILSON N K, HIRA A, YOSHIDA K, MORI M, OKAMOTO Y, OKUNO Y, MURAMATSU H, SHIRAISHI Y, KOBAYASHI M, MORIGUCHI T, OSUMI T, KATO M, MIYANO S, ITO E, KOJIMA S, YABE H, YABE M, MATSUO K, OGAWA S, GÖTTGENS B, HODSKINSON M R G, TAKATA M, PATE K J. Two aldehyde clearance systems are essential to prevent lethal formaldehyde accumulation in mice and humans[J]. Molecular Cell, 2020, 80(6): 996-1012. DOI:10.1016/j.molcel.2020.10.012 |
| [5] |
DUAN J F, XIE J, DENG T, XIE X M, LIU H, LI B Z, CHEN M Q. Exposure to both formaldehyde and high relative humidity exacerbates allergic asthma by activating the TRPV4-p38 MAPK pathway in Balb/c mice[J]. Environmental Pollution, 2020, 256: 113371-113375. DOI:10.1016/j.envpol.2019.113375 |
| [6] |
LÓPEZ-SÁNCHEZ L, MIRALLES P, SALVADOR A, MERINOSANJUÁN M, MERINO V. In vitro skin penetration of bronidox, bronopol and formaldehyde from cosmetics[J]. Regulatory Toxicology and Pharmacology, 2021, 122: 104888. DOI:10.1016/j.yrtph.2021.104888 |
| [7] |
LI X N, YANG S Q, LI M, LI X S, TIAN Q, XIAO F, TANG Y Y, KANG X, WANG C Y, ZOU W, ZHANG P, TANG X Q. Formaldehyde induces ferroptosis in hippocampal neuronal cells by upregulation of the Warburg effect[J]. Toxicology, 2021, 448. DOI:10.1016/j.tox.2020.152650 |
| [8] |
MOHANTY B P, AHANTY A, MITRA T, MOHANTY S, NAIK A K, PARIJA S C. Proteomic and transcriptomic changes in rat liver following oral feeding of formaldehyde[J]. Chemosphere, 2020, 245: 125591-125599. DOI:10.1016/j.chemosphere.2019.125599 |
| [9] |
GE J, YANG H L, LU X X, WANG S Q. Combined exposure to formaldehyde and PM2.5: Hematopoietic toxicity and molecular mechanism in mice[J]. Environment International, 2020, 144: 1-14. DOI:10.1016/j.envint.2020.106050 |
| [10] |
ANDERSEN M E, GENTRY P R, SWENBERG J A, MUNDT K A, WHITE K W, THOMPSON C, BUS J, SHERMAN H, GREIM H, BOLT H. Considerations for refining the risk assessment process for formaldehyde: Results from an interdisciplinary workshop[J]. Regulatory Toxicology and Pharmacology, 2019, 106: 210-223. DOI:10.1016/j.yrtph.2019.04.015 |
| [11] |
IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Formaldehyde, 2-butoxyethanol and 1-ter-butoxypropan-2-ol[J]. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans Supplement, 2006, 88: 1-478. |
| [12] |
刘焕, 黄卓权, 周雄, 杨娇, 柳春红. 广州地区蔬菜甲醛含量及人群甲醛暴露的初步风险评估[J]. 保鲜与加工, 2020, 20(2): 195-199. LIU H, HUANG Z Q, ZHOU X, YANG J, LIU C H. Determination of formaldehyde content in vegetables and preliminary risk assessment of formaldehyde exposure in population in Guangzhou[J]. Storage and Process, 2020, 20(2): 195-199. |
| [13] |
李叶青, 皮小弟, 谢秋让, 许静文. 乙酰丙酮分光光度法测定白菜中甲醛含量的方法优化及其在快检结果验证中的应用[J]. 食品安全质量检测学报, 2018, 9(16): 4246-4251. DOI:10.3969/j.issn.2095-0381.2018.16.011 LI Y Q, PI X D, XIE Q R, XU J W. Optimization of determination method for formaldehyde content in Chinese cabbage by acetylacetone spectrophotometry and its application in verification of quick test results[J]. Journal of Food Safety & Quality, 2018, 9(16): 4246-4251. DOI:10.3969/j.issn.2095-0381.2018.16.011 |
| [14] |
俞其林, 励建荣. 食品中甲醛的来源与控制[J]. 现代食品科技, 2007, 23(10): 76-78. YU Q L, LI J R. Origin and control of formaldehyde in foods[J]. Modern Food Science and Technology, 2007, 23(10): 76-78. |
| [15] |
李俊, 刘辉, 刘嘉, 陈中爱, 王辉, 吕都, 唐健波, 刘永翔. 乙酰丙酮分光光度法检测果蔬中甲醛含量的改进研究[J]. 食品科技, 2016, 41(9): 289-294. DOI:10.13684/j.cnki.spkj.2016.09.057 LI J, LIU H, LIU J, CHEN Z A, WANG H, LYU D, TANG J B, LIU Y X., et al. Improvement on acetylacetone spectrophotometry for formaldehyde detection in fruits and vegetables[J]. Food Science and Technology, 2016, 41(9): 289-294. DOI:10.13684/j.cnki.spkj.2016.09.057 |
| [16] |
刘细祥, 兰翠玲, 覃艳艳, 何柳媚. 铬天青S-溴酸钾体系催化光度法测定水发食品中甲醛[J]. 广东农业科学, 2013, 40(20): 116-118. DOI:10.16768/j.issn.1004-874X.2013.20.008 LIU X X, LAN C L, QIN Y Y, HE L M. Determination of formaldehyde in water-soaked foodstuffs by catalytic spectrophotometry with chromazurol S-KBrO3 system[J]. Guangdong Agricultural Sciences, 2013, 40(20): 116-118. DOI:10.16768/j.issn.1004-874X.2013.20.008 |
| [17] |
励建荣, 朱军莉. 食品中内源性甲醛的研究进展[J]. 中国食品学报, 2011, 11(9): 247-256. DOI:10.3969/j.issn.1009-7848.2011.09.027 LI J R, ZHU J L. Research advance in endogenous formaldehyde in foods[J]. Journal of Chinese Institute of Food Science and Technology, 2011, 11(9): 247-256. DOI:10.3969/j.issn.1009-7848.2011.09.027 |
| [18] |
郑智溢, 黄娇, 李珏, 陈琳, 徐衡, 陈湖丰. 乐清市主要鲜活水产品甲醛残留量调查及膳食暴露风险评估[J]. 渔业研究, 2018, 40(3): 217-222. DOI:10.14012/j.cnki.fjsc.2018.03.007 ZHENG Z Y, HUANG J, LI J, CHEN L, XU H, CHEN H F. Investigation on formaldehyde residues of major fresh aquatic products consumed in Yueqing City and health assessment on dietary exposure[J]. Journal of Fisheries Research, 2018, 40(3): 217-222. DOI:10.14012/j.cnki.fjsc.2018.03.007 |
| [19] |
刘海燕, 黄柳娟, 冯博, 周昌艳, 邵毅. 上海市食用菌中的甲醛含量及风险评估[J]. 上海农业学报, 2022, 38(1): 85-89. DOI:10.15955/j.issn.1000-3924.2022.01.17 LIU H Y, HUANG L J, FENG B, ZHOU C Y, SHAO Y. Formaldehyde contents and risk assessment of edible fungi sampled in Shanghai[J]. Acta Agriculturae Shanghai, 2022, 38(1): 85-89. DOI:10.15955/j.issn.1000-3924.2022.01.17 |
| [20] |
中国营养学会. 《中国居民膳食指南(2022)》[M]. 北京: 人民卫生出版社, 2022. Chinese Nutrition Society. Dietary guidelines for Chinese residents (2022)[M]//Beijing: People's Medical Publishing House, 2022. |
| [21] |
中国营养学会. 《中国学龄儿童膳食指南(2022)》[M]. 北京: 人民卫生出版社, 2022. Chinese Nutrition Society. Dietary guidelines for school age children in China (2022)[M]//Beijing: People's Medical Publishing House, 2022. |
| [22] |
中国营养学会. 《中国学龄前儿童膳食指南(2022)》[R]. 北京: 人民卫生出版社, 2022. Chinese Nutrition Society. Dietary guidelines for preschool children in China (2022)[R]. Beijing: People's Medical Publishing House, 2022. |
| [23] |
GEMS/food. Highest reported 97.5th percentile consumption figures (eaters only) for various commodities by the general population and children ages 6 and under[EB/OL](2008-04)[2016-12-20]. http://www.who.int/foodsafety/chem/en/acute_hazard_db1.pdf.
|
| [24] |
YANG X L, ZHAO Z Y, TAN Y L, CHEN B, WU A. Risk profiling of exposures to multiclass contaminants through cereals and cereal-based products consumption: a case study for the inhabitants in Shanghai, China[J]. Food Control, 2020, 109: 106964. DOI:10.1016/j.foodcont.2019.106964 |
| [25] |
金水高. 中国居民营养与健康状况调查报告之十: 2002年营养与健康状况数据集[R]. 北京: 人民卫生出版社, 2008. JIN S G. The tenth report of nutrition and health status for China residents: nutrition and health status of annual 2002[R]. Beijing: People's Medical Publishing House, 2008. |
| [26] |
TONG Z Q, HAN C S, MIAO J Y, LU J, HE R Q. Excess endogenous for m a ldehyde i nduc e s memor y de cl i ne[J]. Progress in Biochemistry and Biophysics, 2011, 38(6): 575-579. DOI:10.3724/SP.J.1206.2011.00241 |
| [27] |
WHO. Formaldehyhe, environmental health criteria[M]. Geneva: WHO, 1989.
|
| [28] |
陈碧珊, 蔡月炎, 叶林海, 陈洁茹, 周舒柔, 英晓芹. 湛江市蔬菜地土壤重金属含量特征及生态风险评价[J]. 广东农业科学, 2022, 49(4): 46-53. DOI:10.16768/j.issn.1004-874X.2022.04.006 CHEN B S, CAI Y Y, YE L H, CHEN J R, ZHOU S R, YING X Q. Characteristics of heavy metal content and ecological risk assessment of vegetable soil in Zhanjiang city[J]. Guangdong Agricultural Sciences, 2022, 49(4): 46-53. DOI:10.16768/j.issn.1004-874X.2022.04.006 |
| [29] |
蔡云梅, 张艳林, 任露陆, 李彩霞, 王固宁, 黄涵书. 广州城区菜地土壤重金属污染特征及生态风险评价[J]. 广东农业科学, 2019, 46(2): 73-78. DOI:10.16768/j.issn.1004-874X.2019.02.011 CAI Y M, ZHANG Y L, REN L L, LI C X, WANG G N, HUANG H S. Characteristics and ecological risk assessment of heavy metal pollution in vegetable soils of Guangzhou urban districts[J]. Guangdong Agricultural Sciences, 2019, 46(2): 73-78. DOI:10.16768/j.issn.1004-874X.2019.02.011 |
(责任编辑 白雪娜)
 2022, Vol. 49
2022, Vol. 49