文章信息
基金项目
- 国家自然科学基金(31970154)
作者简介
- 张舒(1996—),女,在读硕士生,研究方向为兽医公共卫生,E-mail:zhangshu19@mails.jlu.edu.cn.
通讯作者
- 段铭(1975—),男,博士,教授,研究方向为兽医公共卫生,E-mail:duan_ming@jlu.edu.cn.
文章历史
- 收稿日期:2021-12-06
【研究意义】1976年Kolakofasky[1]在植物病毒中首次发现环状RNA(circular RNA,circRNA)。circRNA是一类内源性非编码RNA[2],由前体mRNA反向剪接产生,具有不同于传统线性RNA的共价闭合环状结构,无5′帽子结构和3′poly(A)尾,是一类功能强大的调控型非编码RNA[3]。circRNA在真核生物中广泛存在,并且大部分进化保守,结构稳定,能够避免因核酸扩增或外切酶导致的降解,因此在细胞质中存在时间比线性RNA更持久[4]。甲型流感病毒(Influenza A Virus,IAV)是单股负链RNA包膜病毒,属于正黏病毒科(Orthomyxoviridae),由于其传播和变异速度极快,且致病率和致死率高,严重威胁人类和动物的健康及生命安全[5-6]。然而,宿主编码的circRNA在IAV感染过程中的作用及其机制相关研究尚处于起步阶段。本研究探讨IAV感染过程中宿主hsa_circ_004389的表达及其表达对IAV复制的影响,研究结果丰富了我们对circRNA在IAV和宿主中互作、功能的认识。
【前人研究进展】近年来在哺乳动物中已发现数千种circRNA。circRNA在不同种类的细胞中数量不同,尤其在脑细胞中极其丰富[7-11]。circRNA是由mRNA外显子或内含子反向剪接构成的共价闭合环状RNA[12],具有复杂的生物学作用机制。作为一种新型的非编码RNA,circRNA在许多致病过程中都发挥重要功能[13],参与宿主的免疫应答[14-17]。例如,在汉坦病毒(Hantaan Virus,HTNV)的复制中,宿主circ_0000479通过间接调节RIG-I的表达阻碍病毒复制[18]。病毒编码的circRNA在疾病发展中同样也产生非常重要的影响[19];疱疹病毒(Epstein Barr Virus,EBV)编码的circLMP2A在SNU- 4th细胞系中表达增加,并通过靶向miR-3908/TRIM59/p53轴在诱导和维持干细胞表型中发挥关键作用。此外,在卡西波肉瘤相关疱疹病毒、乳头瘤病毒、脑心肌炎病毒、人巨细胞病毒等的感染中发现,circRNA对病毒的复制也起着一定作用[20]。IAV传染是一种相当复杂的过程,现有的研究成果指出IAV在传播至肺部后,会促进肺部释放大量的促炎细胞激素和趋化因子,从而导致机体的免疫反应[21]。
【本研究切入点】宿主编码的circRNA在IAV感染复制过程中功能及机理目前尚不明确。本实验室前期基于基因芯片技术检测了IAV感染的A549细胞中差异表达的circRNA,其中hsa_circ_004389的表达显著上调。【拟解决的问题】为进一步探究circ_004389在流感病毒复制中的功能,本研究在IAV病毒感染后不同时间点和不同感染复数条件下,采用荧光定量PCR等方法对hsa circ 004389的表达水平进行检测,探索circ_004389和IAV感染之间的关系。经Poly I∶C和LPS处理A549细胞后,采用荧光定量PCR等方法检测circ_004389的表达情况,探索在IAV感染中诱导circ_004389表达变化的诱因。然后用IFNβ和JAK的抑制剂处理细胞后用qPCR检测circ_004389的表达情况,探索circ_004389的表达变化和JAK-STAT信号通路之间的关联。circ_004389过表达和敲低后,用qPCR和Western blot在mRNA和蛋白水平上检测该环状RNA对IAV复制的影响。
1 材料与方法 1.1 试验材料供试IAV毒株、11日龄无特定病原体(Specific Pathogen Free,SPF)鸡胚由吉林大学动物医学学院动物传染病实验室提供,A549、THP-1、A172、Caco-2和SY5Y细胞由人兽共患病研究教育部重点实验室冻存。
pHB-circBasic载体购自汉恒生物科技有限公司Trizol(TaKaRa)和反转录试剂(MonScriptTMRTlll All-in-one Mix with dsDNase)购自武汉Monad生物科技有限公司;qPCR反应试剂(PowerUPTM SYBRTM Green Master Mix)购自美国Thermo公司;聚肌苷酸胞苷酸(Polyinosinic: polycytidylic acid,poly I∶C)、脂多糖(大肠杆菌O55∶B5来源)和TPCK胰蛋白酶购自美国Sigma-Aldrich公司;Lipofectamine LTX & PLUSTM Reagent、Lipofectamine RNAiMAX试剂、超纯琼脂糖凝胶购自美国Invitrogen公司;抗IAV-M1抗体购自美国Abcam有限公司;抗β-actin抗体购自美国Cell Signaling有限公司;辣根酶标志山羊抗小鼠IgG(H+L)购自美国Santa有限公司。
1.2 细胞培养用含100 mg/L青霉素、100 U/mL链霉素和10%(V/V)胎牛血清(Hyclone)的RPMI-1640培养基(Corning)培育A549细胞和THP-1细胞;用含10%胎牛血清的DMEM培养基(Corning)培育A172、Caco-2和SY5Y细胞,并且将细胞置于4% CO2、37 ℃的细胞培养箱中。
1.3 病毒感染将IAV毒株于11日龄SPF鸡胚中培育,在生长48、72 h后,将鸡胚置于4 ℃过夜并采集尿囊液。细胞密度达到60%~80%后,用PBS溶液洗涤细胞,用含有1 mg/L TPCK胰蛋白酶的培养基和感染复数(Multiplicity of Infection,MOI)=2的病毒混匀后感作,吸附1 h后换成正常细胞培养液继续培养。
1.4 细胞处理用Poly I∶C和LPS分别处理A549细胞:以24孔板为例,将A549细胞铺板,次日细胞密度达到60%~80%时,分别加入poly I∶C和LPS。设置poly I∶C终浓度分别为0.1、1、10 μg/mL,LPS终浓度为1μg/mL,24 h后提取总RNA。
IFNβ和信号通路抑制剂Ruxolitinib处理细胞:以24孔板为例,将A549细胞铺板,次日细胞密度达到60%~80%。分别加入FNβ和Ruxolitinib。设置IFNβ终浓度分别为1、1、100 ng/mL,Ruxolitinib终浓度分别为5、10 μmol/L。分别处理2 h后感染IAV,方法同1.3。病毒感染24 h后提取总RNA。
1.5 质粒、siRNA和poly I∶ C转染利用pHB-circBasic载体构建hsa_circ_004389的真核表达质粒。抑制hsa_circ_004389表达的siRNA序列为5'-CAGGAUUCGAUGAGAUUGA-3',由上海吉玛公司制备合成。按照Lipofectamine LTX & PLUSTM Reagent和Lipofectamine RNAiMAX试剂说明书分别进行质粒、siRNA和poly I∶C转染。
1.6 RNA提取、实时定量聚合酶链反应(qPCR)和半定量PCR检测将经poly I∶C、LPS、IFNβ和Ruxolitinib不同处理后的A549细胞使用Trizol试剂按照说明书提取细胞总RNA。提取的RNA按照反转录试剂盒说明书进行反转录,反转录前在PCR仪中于37 ℃下反应2 min,去除基因组DNA。RNA反转录的反应条件如下:85 ℃ 15 min,42 ℃ 5 min。取5 μL反转录产物使用StepOne PlusTM进行实时荧光定量PCR。对于半定量PCR,反应条件为:94 ℃ 5 min;94 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,35个循环。qPCR和半定量PCR检测均利用管家基因GAPDH为内参基因。引物序列如表 1所示。用1.5%琼脂糖凝胶电泳检测PCR产物,电压120 V,电泳15 min,在凝胶成像仪(UVP EC3 Imaging System)上观察结果。
1.7 蛋白免疫印迹(Western blot)
A549细胞感染IAV36 h后,裂解细胞并获得总蛋白质,采用10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)进行电泳,每孔加入等量的蛋白质样品,PVDF膜转膜,用5%脱脂牛奶溶液室温下封闭2 h。加入一抗β-actin(1︰4 000倍稀释)和IAV-M1(1︰1 000倍稀释),4 ℃孵育过夜。辣根酶标志山羊抗小鼠IgG(H+L)和辣根酶标志山羊抗兔IgG 1︰2 000稀释后,在室温下孵育2 h后,用ECL显影液在凝胶成像系统显影,并利用ImageJ软件对电泳图进行灰度值解析。
试验数据应用GraphPad软件进行分析,通过t检验进行差异显著性检验。
2 结果与分析 2.1 IAV感染后宿主的hsa_circ_004389表达显著上调前期circRNA组学数据提示宿主hsa_circ_004389的表达与IAV感染相关。采用qPCR方法检测IAV感染A549细胞不同时间点后hsa_circ_004389的表达,结果(图 1A)显示,hsa_circ_004389的表达随感染进程逐渐增加,并且在感染后24 h表达量最高。同时,Ifnb1与IAV M基因的表达变化趋势和hsa_circ_004389基本一致,不仅说明IAV感染细胞模型的成功,而且提示hsa_circ_004389的表达上调可能与病毒复制及宿主抗病毒天然免疫应答存在潜在联系。不同MOI的IAV感染试验表明,hsa_circ_004389的表达与病毒感染剂量呈显著正相关(图 1B)。IAV感染来源于不同器官(肺、肠、脑和血液)或组织的人源细胞系,应用半定量RT-PCR检测hsa_circ_004389的表达水平,结果(图 1C)显示,hsa_circ_004389在5种人源细胞系中均有表达,但是只在病毒适应并易感的A549细胞中,其表达量高低与IAV感染呈正相关。以上结果表明,hsa_circ_004389的表达呈现出细胞类型的广泛性,也兼具特异性,且其表达与IAV的感染复制密切相关。
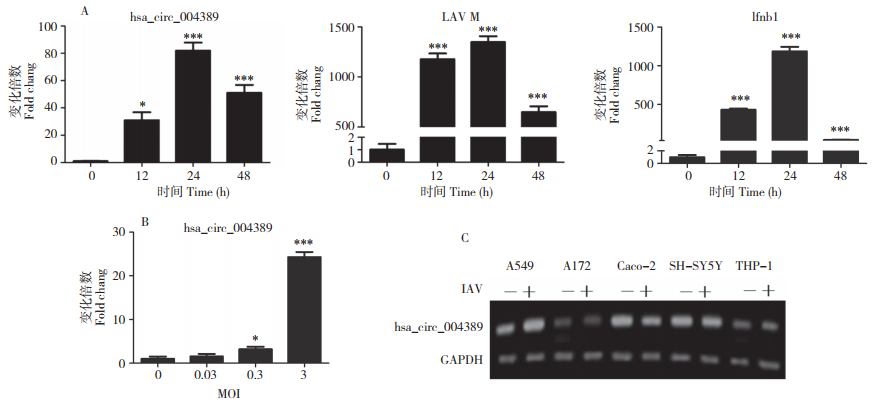
|
| A:不同时间点IAV感染A549细胞对hsa_circ_004389、IAV M和Ifnb1表达的影响;B:不同MOI的IAV感染A549细胞24 h后hsa_circ_004389的表达;C:IAV感染不同细胞系24 h后hsa_circ_004389的表达。*表示P < 0.05,**表示P < 0.01,***表示P < 0.001 A: Expression of hsa_circ_004389, IAV M and Ifnb1 genes in A549 cells infected with IAV strain (PR8) at different time courses; B: Hsa_circ_004389 expression level in A549 cells infected with IAV at different MOIs for 24h; C: Expression of hsa_circ_004389 after IAV infection of different cell lines for 24h. *P<0.05; **P <0.01; ***P< 0.001 图 1 IAV感染诱导hsa_circ_004389的表达情况 Fig. 1 Expression of hsa_circ_004389 induced by IAV infection |
2.2 poly I∶C有效诱导hsa_circ_004389表达
为了研究hsa_circ_004389表达的诱因,分别使用poly I∶C和LPS处理A549细胞。qPCR检测结果显示,poly I∶C处理A549细胞后,hsa_circ_004389和Ifnb1的表达均与poly I∶C剂量成正相关(图 2A)。与对照相比,处理后6 h时hsa_circ_004389和Ifnb1的表达已被显著诱导(图 2B),说明poly I∶C有效激活下游的信号通路且能够诱导hsa_circ_004389表达。LPS处理细胞后,hsa_circ_0043891表达未见显著改变(图 2C),说明hsa_circ_004389的表达上调与Toll样受体4(Toll Like Receptor 4,TLR4)或细菌感染无关。研究结果提示,hsa_circ_004389的表达是细胞特异性应答RNA病毒感染的结果,并且在IAV复制过程中产生的大量病毒RNA可能是hsa_circ_004389表达的主要诱因之一。
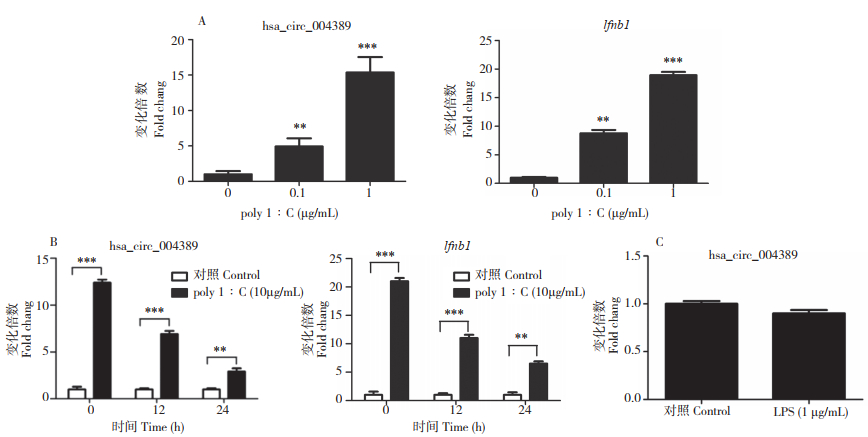
|
| A:不同浓度poly I∶C转染A549细胞24 h后hsa_circ_004389和Ifnb1的表达;B:10 μg/mL poly I∶C转染A549细胞后hsa_circ_004389和Ifnb1不同时间的表达;C:LPS(1 μg/mL)处理A549细胞12 h后对hsa_circ_004389表达的影响 A: Expression of hsa_circ_004389 and Ifnb1 genes in A549 cells transfected with different concentrations of poly I∶C for 24 h; B: Expression of hsa_circ_004389 and Ifnb1 genes in A549 cells transfected with poly I∶C at a dose of 10 μg/mL at different time courses; C: A549 cells treated with LPS (1 μg/mL) for 12 h 图 2 poly I∶C诱导hsa_circ_004389表达情况 Fig. 2 Expression of hsa_circ_004389 induced by poly I∶ C |
2.3 JAK-STAT信号通路参与调控hsa_circ_004389的表达
病毒感染宿主后,宿主细胞通过体内广泛表达的模式识别受体监测病原相关分子模式的存在,模式识别受体被激活后触发一系列磷酸化或泛素化介导的信号级联反应。为了确定JAKSTAT信号通路是否参与hsa_circ_004389的表达调控,采用干扰素β(Interferon β,IIFNβ)处理A549细胞,qPCR检测结果显示,hsa_circ_004389的表达和IFNβ的剂量呈现正相关(图 3A),说明hsa_circ_004389可能是I型IFN相关JAK-STAT信号通路调控表达的产物。进一步应用JAK抑制剂(Ruxolitinib)有效抑制JAK-STAT信号通路后,IAV诱导的hsa_circ_004389的表达也显著受到抑制(图 3B)。上述结果表明JAKSTAT信号通路参与调控hsa_circ_004389的转录表达。
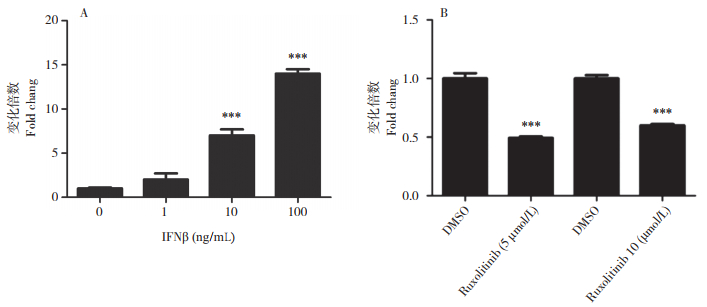
|
| A:不同剂量IFNβ处理A549细胞12 h后hsa_circ_004389的表达;B:不同剂量Ruxolitinib处理对IAV(PR8)诱导A549细胞内hsa_circ_004389表达的影响 A: Expression of hsa_circ_004389 after treating A549 cells with different concentrations of IFNβ for 12 h; B: Expression of hsa_circ_004389 in IAV infection induced A549 cells after treatment with different concentrations of Ruxolitinib 图 3 JAK-STAT信号通路参与hsa_circ_004389表达的转录调控 Fig. 3 JAK-STAT signaling pathway participating in hsa_circ_004389 expression regulation |
2.4 hsa_circ_004389抑制IAV复制
为了探究hsa_circ_004389对IAV复制的影响,应用hsa_circ_004389的真核表达质粒和siRNA分别进行过表达和敲低实验,用qPCR和Western blot在病毒mRNA和蛋白水平上检测hsa_circ_004389对IAV复制的影响。结果(图 4)显示,hsa_circ_004389的过表达明显抑制IAV M基因和M1蛋白的表达;反之,应用siRNA抑制内源性hsa_circ_004389的表达则有利于病毒复制。研究结果表明,hsa_circ_004389具有抑制IAV复制的功能。
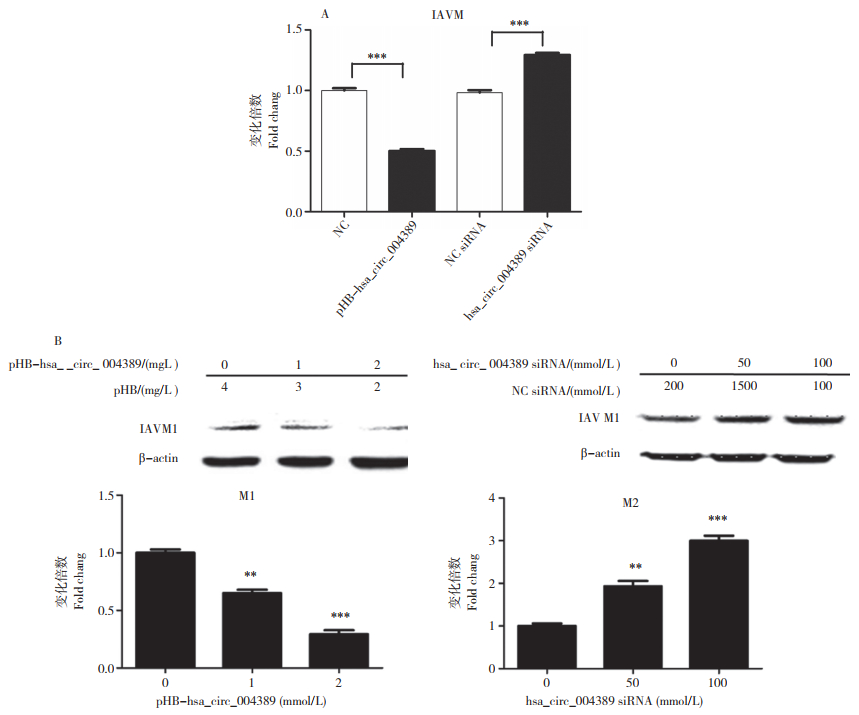
|
| :hsa_circ_004389在mRNA水平对IAV复制的影响;B:hsa_circ_004389在蛋白水平对IAV复制的影响 A: Effect of hsa_circ_004389 on IAV replication at the mRNA level; B: Effect of hsa_circ_004389 on IAV replication at the protein level 图 4 hsa_circ_004389抑制IAV复制 Fig. 4 IAV replication inhibited by hsa_circ_004389 |
3 讨论
circRNA开始被认为是错误剪接或剪接过程中形成的副产物[22],随着先进生物技术的应用,我们对circRNA也有了比较全面系统的研究。近年来,circRNA复杂的生物结构及其生物学功能被人们熟知[23]。circRNA可以吸附微小RNA,例如,在新生小鼠中circ_000203表达上调,可以在NMVCs中特异性吸附miR-26b-5p和miR-140- 3p[24]。circRNA能够竞争性影响RNA线性剪接。例如,circMBNL1可降低MBNL1 pre-mRNA的剪接[25]。circRNA还可以作为蛋白质翻译的模板,也可以通过结合蛋白质发挥功能。
近几年,研究人员对宿主编码circRNA在病毒感染宿主细胞过程中的作用也展开了相关研究,如恒河猴淋巴滤泡病毒、艾滋病毒、马立克病毒、乙肝病毒、丙型肝炎病毒等[26-28]。转移性鼻咽癌组织中的疱疹病毒(Epstein-Barr virus,EBV)编码的环状RNA circRPMS1的表达显著增加。敲低circRPMS1的表达可以诱导EBV阳性鼻咽癌的细胞凋亡,对抗细胞侵袭和抑制细胞增殖。circRPMS1功能的发挥可能是通过吸附miR- 203、miR-31和miR-451来实现[29]。卡锡波肉瘤相关疱疹病毒(Kaposi’s sarcoma herpesvirus,KSHV)和EBV编码的circRNA,在这两种病毒相关的肿瘤中均有高表达,说明这些circRNA促进这两种肿瘤病毒的致病作用,但其功能及作用机制仍有待进一步研究[30]。已有的研究表明,circRNA既可以参与宿主抗病毒天然免疫反应,也可以参与病毒复制[31-32]。hsa_circ _004389是一个新发现的circRNA,在甲型流感病毒中的表达和作用机制尚不明确。上述差异表达circRNA在病毒感染致病或宿主抗病毒应答中的功能及其分子机制的研究尚未广泛展,亟待探究。
这些组学数据不仅证实病毒感染能改变宿主circRNA的表达模式,而且说明circRNA在病毒与宿主的相互作用中扮演重要角色,既有可能是宿主抗病毒染的工具,也有可能成为病毒重塑有利于自身复制的细胞内微环境的利器。实验室基于IAV感染A549细胞的芯片分析筛选到众多差异表达的circRNA, hsa_circ_004389是明显差异表达的circRNAs之一。在本部分研究中,我们拟充分验证表达hsa_circ_004389与IAV感染之间的关联,研究其表达的诱因,探究其表达与转录因子信号通路之间的关系。hsa_circ_004389与IAV感染剂量和感染时间呈正相关,在5种细胞系中检测了hsa_circ_004389的表达,发现hsa_circ_004389表达量增加具有细胞特异性。用poly I∶C和LPS处理A549细胞,验证了hsa_circ_004389表达量的改变是机体特异性应答IAV感染的反应。用JAK抑制剂Ruxolitinib和IFNβ处理细胞,hsa_circ_004389被进一步鉴定为宿主抗IAV因子,其表达受JAK/STAT信号调节。功能学试验显示hsa_circ_004389能够抑制IAV复制和增殖,更好地佐证了其参与宿主天然抗病毒免疫应答,但其抗病毒的作用机制还需进一步研究。
4 结论在IAV感染A549细胞中circ_004389的表达显著上调。RT-qPCR检测在IAV诱导的A549细胞中circ_004389的表达显著增加并且其表达水平和poly I∶C呈现显著剂量依赖性;LPS处理细胞后circ_004389的表达没有明显变化,证明circ_004389水平的增加与复制过程中病毒RNA的积累有关,是细胞特异性应答IAV感染的产物。IFNβ和Ruxolitinib处理的A549细胞中,circ_0050463的表达降低,证明JAK-STAT信号通路参与其表达。应用siRNA抑制内源性circ_004389的表达能促进IAV的感染;反之,circ_004389的过表达明显抑制IAV M基因和M1蛋白的表达。研究结果表明,circ_004389具有抑制IAV复制的功能。本研究结果表明,hsa_circ_004389是宿主应答IAV感染的产物,为潜在的细胞Ⅰ型IFN应答IAV的拮抗因子,研究结果丰富了对circRNA功能的理解,为探究IAV与宿主相互作用提供了新视角。
| [1] |
KOLAKOFSKY D. Solation and characterization of Sendai virus DI-RNAs[J]. Cell, 1976, 8(4): 547-555. DOI:10.1016/0092-8674(76)90223-3 |
| [2] |
CHEN Y H, LI C, TAN C L, LIU X. Circular RNAs: a new frontier in the study of human diseases[J]. Oncotarget, 2016, 53(6): 359-65. DOI:10.1136/jemdgenet-2016-103758 |
| [3] |
WANG J F, ZHAO X H, WANG Y B, REN F H, SUN D W, YAN Y B, KONG X L, BU J L, LIU M F, XU S D. circRNA-002178 act as a ceRNA to promote PDL1/PD1 expression in lung adenocarcinoma[J]. Cell Death and Disease, 2020, 11(1): 32. DOI:10.1038/s41419-020-2230-9 |
| [4] |
YANG Y, WANG Y J, WANG F, YUAN L H, GUO Z Q, WEI Z C, WANG Z R, WANG S W. The roles of miRNA, lncRNA and circRNA in the development of osteoporosis[J]. Biology Research, 2020, 53(1): 40. DOI:10.1186/s40659-020-00309-z |
| [5] |
LAMICHHANE P P, SAMARASINGHE A E. The role of innate leukocytes during influenza virus infection[J]. Journal of Immunology Research, 2019, 2019: 8028725. DOI:10.1155/2019/8028725 |
| [6] |
WANG R F, ZHU Y X, ZHAO J C, REN C W, LI P, CHEN H C, JIN M L, ZHOU H B. Autophagy promotes replication of influenza A Virus in vitro[J]. Journal of Virology, 2019, 93(4): e01984-18. DOI:10.1128/JVI.01984-18 |
| [7] |
DI T G, DATTILO D, CENTRON B A, COLANTONI A, GUARNACCI M, ROSSI F, INCARNATO D, OLIVIERO S, FATICA A, MORLANDO M, BOZZONI I. Modulation of circRNA metabolism by m(6)A modification[J]. Cell Report, 2020, 31(6): 107641. DOI:10.1016/j.celrep.2020.107641 |
| [8] |
LI X J, DING J Y, WANG X Y, CHENG Z N, ZHU Q B. NUDT21 regulates circRNA cyclization and ceRNA crosstalk in hepatocellular carcinoma[J]. Oncogene, 2020, 39(4): 891-904. DOI:10.1038/s41388-019-1030-0 |
| [9] |
XU X L, ZHANG J W, TIAN Y, GAO Y H, DONG X, CHEN W B, YUAN X N, YIN W N, XU J J, CHEN K, HE C J, WEI L. CircRNA inhibits DNA damage repair by interacting with host gene[J]. Molecular Cancer, 2020, 19(1): 128. DOI:10.1186/s12943-020-01246-x |
| [10] |
Liu Y, CHEN S, ZONG Z H, GUAN X, ZHAO Y. CircRNA WHSC1 targets the miR-646/M1M1 pathway to promote the development of endometrial cancer[J]. Journal of Cellular and Molecular Medicine, 2020, 24(12): 6898-6907. DOI:10.1111/jcmm.15346 |
| [11] |
LIU Y, YANG Y Y, WANG Z B, FU X X, CHU X M, LI Y H, WANG Q, HE X Q, LI M, WANG K, WANG J X, LI P F, YU T. Insights into the regulatory role of circRNA in angiogenesis and clinical implications[J]. Atherosclerosis, 2020, 298: 14-26. DOI:10.1016/j.atherosclerosis.2020.02.017 |
| [12] |
ZANG J, LU D, XU A. The interaction of circRNAs and RNA binding proteins: An important part of circRNA maintenance and function[J]. Journal of Neuroscience Research, 2020, 98(1): 87-97. DOI:10.1002/jnr.24356 |
| [13] |
马博涵, 姚丹, 焦苏淇, 鲁中爽, 李泽远, 张爱晶, 何浩博, 张家野. 非编码RNA在植物中的研究进展[J]. 广东农业科学, 2019, 46(7): 8-16. DOI:10.16768/j.issn.1004-874X.2019.07.002 MA B H, YAO D, JIAO S Q, LU Z S, LI Z Y, ZHANG A J, HE H B, ZHANG J Y. Research progress of non-coding RNA in plants[J]. Guangdong Agricultural Sciences, 2019, 46(7): 8-16. DOI:10.16768/j.issn.1004-874X.2019.07.002 |
| [14] |
MEMCZAK S, JENS M, ELEFSINIOTI A, TORTI F, KRUEGER J, RYBAK A, MAIER L, MACKOWIAK S D, GREGERSEN L H, MUNSCHAUER M, LOEWER A, ZIEBOLD U, LANDTHALER M, KOCKS C, LE N F, RAJEWSKY N. Circular RNAs are a large class of animal RNAs with regulatory potency[J]. Nature, 2013, 495(7441): 333-338. DOI:10.1038/nature11928 |
| [15] |
HANSEN T B, JENSEN T I, CLAUSEN BH, BRAMSEN J B, FINSEN B, DAMGARRD C K, KJEMS J. Natural RNA circles function as efficient microRNA sponges[J]. Nature, 2013, 495(7441): 384-388. DOI:10.1038/nature11993 |
| [16] |
SHI Y, JIA X, XU J. The new function of circRNA: translation[J]. Clinical and Translitional Oncology, 2020, 22(12): 2162-2169. DOI:10.1007/s12094-020-02371-1 |
| [17] |
LI H, XU J D, FANG X H, ZHU J N, YANG J, PAN R, YUAN S J, ZENG N, YANG Z Z, YANG H, WANG X P, DUAN J Z, WANG S, LUO J F, WU S L, SHAN Z X. Circular RNA circRNA_000203 aggravates cardiac hypertrophy via suppressing miR-26b-5p and miR-140-3p binding to Gata4[J]. Cardiovascular Research, 2020, 116(7): 1323-1334. DOI:10.1093/cvr/cvz215 |
| [18] |
LU S, ZHU N, GUO W W, WANG X, LI K J, YAN J, JIANG C P, HAN S Y, XIANG H M, WU X H, LIU Y Y, XIONG H R, CHEN L J, GONG Z J, LUO F, HOU W. RNA-Seq revealed a circular RNA-microRNAmRNA regulatory network in hantaan virus infection[J]. Frontiers in Cellularand Infection Microbiology, 2020, 10: 52-67. DOI:10.3389/fcimb.2020.00097 |
| [19] |
JANICE M N, KATHLEEN R C, ERIC R F, SCOTT E K, MICHAEL J R, JONATHAN D O, KENNETH W K, BERT V. Scrambled exons[J]. Cell, 1991, 64: 607-613. DOI:10.1016/0092-8674(91)90244-s |
| [20] |
GONG L P, CHEN J N, DONG M, XIAO Z D, FENG Z Y, PAN Y H, ZHANG Y, DU Y, ZHANG J Y, BI Y H, HUANG J T, LIANG J, SHO C K. Epstein-Barr virus-derived circular RNA LMP2A induces stemness in EBV-associated gastric cancer[J]. EMBO Reports, 2020, 21(10): e49689. DOI:10.15252/embr.201949689 |
| [21] |
ZHANG J, LIU J, YUAN Y, HUANG F, MA R, LUO B, XI Z, PAN T, LIU B, ZHANG Y, ZHANG X, LUO Y, WANG J, ZHAO M, LU G, DENG K, ZHANG H. Two waves of pro-inflammatory factors are released during the influenza A virus(IAV)-driven pulmonary immunopathogenesis[J]. PLOS Pathogens, 2020, 16(2): 2031-2044. DOI:10.1371/journal.ppat.1008334 |
| [22] |
HUANG G Q, LIANG M, LIU H Y, HUANG J H, LI P Q, WANG C, ZHANG Y D, LIN Y, JIANG X H. CircRNA hsa_circRNA_104348 promotes hepatocellular carcinoma progression through modulating miR-187-3p/RTKN2 axis and activating Wnt/beta-catenin pathway[J]. Cell Death and Disease, 2020, 11(12): 2419-2434. DOI:10.1038/s41419-020-03276-1 |
| [23] |
WEI C Y, ZHU M X, LU N H, LIU J Q, YANG Y W, ZHANG Y, SHI Y D, FENG Z H, LI J X, QI F Z, GU J Y. Circular RNA circ_0020710 drives tumor progression and immune evasion by regulating the miR-370-3p/CXCL12 axis in melanoma[J]. Molecular Cancer, 2020, 19(1): 2984-2985. DOI:10.1186/s12943-020-01191-9 |
| [24] |
PATOP I L, WUST S, KADENER S. Past, present, and future of circRNAs[J]. The EMBO Journal, 2019, 38(16): e100836. DOI:10.15252/embj.2018100836 |
| [25] |
LODDE V, MURGIA G, SIMULA E R, STERI M, FLORIS M, IDDA M L. Long noncoding RNAs and circular RNAs in autoimmune diseases[J]. Biomolecules, 2020, 10(7): 3089-3096. DOI:10.3390/biom10071044 |
| [26] |
PETKOVIC S, MULLER S. RNA circularization strategies in vivo and in vitro[J]. Nucleic Acids Research, 2015, 43(4): 2454-2465. DOI:10.1093/nar/gkv045 |
| [27] |
SALZMAN J. Circular RNA expression: Its potential regulation and function[J]. Trends Genet, 2016, 32(5): 309-316. DOI:10.1016/j.tig.2016.03.002 |
| [28] |
HAN Y N, XIA S Q, ZHANG Y Y, ZHENG J H, LI W. Circular RNAs_ A novel type of biomarker and genetic tools in cancer[J]. Oncotarget, 2017, 8(38): 64551-64563. DOI:10.18632/Oncotarget.18350 |
| [29] |
LIU Q, SHUAI M, XIA Y. Knockdown of EBV-encoded circRNA circRPMS1 suppresses nasopharyngeal carcinoma cell proliferation and metastasis through sponging multiple miRNAs[J]. Cancer Management and Research, 2019, 11: 8023-8031. DOI:10.2147/CMAR.S218967 |
| [30] |
ABERE B, LI J, ZHOU H Z, TUNA T, PATRICK M, CHANG Y A. Kaposi's sarcoma-associated herpesvirus-encoded circRNAs are expressed in infected tumor tissues and are incorporated into virions[J]. Microbiology, 2020, 11(1): 2043-2053. DOI:10.1128/mBio.03027-19 |
| [31] |
李润峰, 何蓉蓉, 栗原博, 陈建新. 苹果多酚体内外抗甲型流感病毒作用[J]. 广东农业科学, 2011, 38(14): 6-9. DOI:10.16768/j.issn.1004-874X.2011.14.018 LI R F, HE R R, LI Y B, CHEN J X. Study on anti-influenza virus activity of apple polyphenols in vivo and in vitro[J]. Guangdong Agricultural Sciences, 2011, 38(14): 6-9. DOI:10.16768/j.issn.1004-874X.2011.14.018 |
| [32] |
崔建勋, 杜红丽, 凌飞. H1N1亚型流感的公共卫生意义与防疫检疫措施[J]. 广东农业科学, 2009(7): 152-155. DOI:10.16768/j.issn.1004-874X.2009.07.076 CUI J X, DU H L, LING F. Public health significance and epidemic prevention and quarantine measures of H1N1 Subtype Influenza[J]. Guangdong Agricultural Sciences, 2009(7): 152-155. DOI:10.16768/j.issn.1004-874X.2009.07.076 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49





