文章信息
基金项目
- 广东省自然科学基金(2018A030307012);国家重点研发计划项目(2019YFD1000900);中央级公益性科研院所基本科研业务专项(1630062021010);国家荔枝龙眼产业技术体系专项(CARS-32-20)
作者简介
- 董晨(1981—),女,硕士,副研究员,研究方向为热带果树分子生物学研究,E-mail:nysdongchen@sina.com.
通讯作者
- 李伟才(1975—),男,研究员,研究方向为果树栽培与生理,E-mail:lwc-619@163.com.
文章历史
- 收稿日期:2022-01-08
【研究意义】荔枝(Litchi chinensis Sonn.)是岭南名贵水果,有“岭南果王”之美誉。荔枝是典型的糖直接积累型果实,含糖量是优质荔枝品种的重要指标之一。不同荔枝品种积累的主要糖分不同,如妃子笑和黑叶荔枝以积累还原糖为主,无核荔和糯米糍荔枝则以积累蔗糖为主[1]。不同品种荔枝的糖分构成不同,其实质是不同酶系统调控的结果,而酶系统及其活性与基因表达相关[2]。蔗糖代谢相关酶活性与蔗糖积累密切相关,而转化酶是调节蔗糖代谢的关键酶之一,转化酶将蔗糖分解为还原糖和果糖,在蔗糖的转运、贮藏和分配中起重要作用[3]。根据最适pH值,转化酶可分酸性转化酶(AI)和碱性转化酶(NI);根据定位,酸性转化酶又分为可溶性酸性转化酶(SAI)和细胞壁酸性转化酶(CWAI)[4]。可溶性酸性转化酶是一种液泡酶,能调控液泡的库活力,对外界胁迫、激素和细胞伸长等都有一定作用[5-9];细胞壁酸性转化酶主要参与韧皮部质外体卸载时蔗糖的分解,以保持库- 源之间蔗糖的浓度梯度,在调控植物衰老及果实发育中起重要作用[10]。
【前人研究进展】酸性转化酶能显著调控果实成熟期的糖组分。如在香蕉果实成熟过程中酸性转化酶能显著调节蔗糖与还原糖的比值[11];菠萝蜜果实发育过程中,随着转化酶活性增强,蔗糖含量随之减少,且不同品种中转化酶活性存在差异[12-13]。在葡萄、荔枝、甘蔗等作物中,转化酶基因表达量越高,转化酶活性越高,伴随着蔗糖含量越少且还原糖含量升高,反之亦然[14-15]。研究表明,以积累蔗糖为主的糯米糍等荔枝在果实成熟过程中几乎检测不到酸性转化酶活性,而积累还原糖为主的妃子笑等则保持较高的酸性转化酶活性[16]。还原糖积累型果实酸性转化酶基因的表达量显著上调,而在蔗糖积累型果实中该基因表达量很低。【本研究切入点】基因表达由上游调控因子调节,启动子决定特定基因的表达。因此,克隆并分析酸性转化酶基因的启动子,对深入了解荔枝不同糖积累类型的调控机理具有重要意义。但目前尚未见有关荔枝酸性转化酶基因LcSAI启动子的相关报道。【拟解决的关键问题】本研究通过克隆荔枝LcSAI启动子,利用生物信息学分析工具对LcSAI启动子中可能的转录起始位点、顺式作用元件、CpG岛等进行分析,以期为今后深入研究荔枝生产中的品质调控提供理论基础。
1 材料与方法 1.1 试验材料供试荔枝品种为妃子笑,2021年5月下旬采自中国热带农业科学院南亚热带作物研究所荔枝种植园,取成熟妃子笑果肉作为基因组DNA的提取材料。
DNA提取试剂盒Easypure Plant Genomic DNA Kit、pEASY-T1载体和大肠杆菌Trans1-T1感受态细胞购于北京全式金生物技术有限公司。所用仪器主要有Eppendorf离心机、Germany超微量分光光度计、Thermo Fisher Scientific PCR仪。
1.2 试验方法1.2.1 基因组DNA提取 按照DNA提取试剂盒说明书的方法提取荔枝基因组DNA。取2μL得到的DNA检测质量和浓度,样品符合要求后放于-20 ℃保存备用。
1.2.2 引物设计 基于荔枝基因组数据库,查找LcSAI基因上游2000bp的片段,设计上、下游引物,引物序列LcSAI pFw:5′TCTTCAACCTTGAACCATGACCT3′,LcSAI pRe:5′CCGGCAAGGGAGTGTAGTAT3′,引物委托广州艾基生物有限公司合成。
1.2.3 LcSAI启动子克隆 以妃子笑DNA为模板,PCR扩增LcSAI启动子序列。PCR反应体系:2×PCR buffer25μL,dNTP(2mmol/L)10 μL,上下游引物各2μL,DNA模板1 μL,KOD酶1 μL,用ddH2O补足50μL。PCR反应程序:94 ℃2min,98 ℃ 10 s、68 ℃ 2.5 min、68 ℃ 7 min,35个循环。经0.5%TBE琼脂凝胶电泳,获得特异性目的条带,进行切胶回收,将回收产物连接至pEASY-T1载体,转入大肠杆菌Trans1-T1感受态细胞,于37 ℃培养箱过夜培养,随机挑取15个单菌落进行菌落PCR鉴定,挑取3个阳性克隆菌液送至广州艾基生物技术有限公司测序。
1.2.4 LcSAI启动子生物信息学分析 利用在线软件BDGP(http://www.fruitfly.org/seq_tools/promoter.html)预测LcSAI启动子转录起始位点及可能的核心启动子区域;启动子顺式作用元件利用在线分析工具PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测;启动子CpG岛利用在线软件CpG Island Searcher(http://www.cpgislands.com)预测,预测时用1个长度为200 bp的窗口移过序列,每次移1个碱基对,计算Y值(实际值/ 期望值),CpG岛定义为Y>0.6且GC含量>50% 的200 bp序列区域。
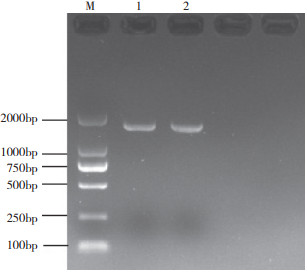
2 结果与分析 2.1 LcSAI基因启动子的PCR扩增以妃子笑基因组DNA为模板,LcSAI pFw、LcSAI pRe为引物,扩增出长约1 000~2 000 bp的单一条带,与预测目的条带大小吻合(图 1)。将PCR产物纯化回收后连接至pEASY-T1载体,转入大肠杆菌Trans1-T1感受态细胞,经培养后进行菌液PCR鉴定(图 2),阳性克隆菌液经测序,结果显示获得1 514 bp LcSAI基因启动子序列。
|
| M: DL2000 Marker;1、2:PCR扩增产物 M: DL2000 Marker; 1, 2: PCR amplification product 图 1 LcSAI基因启动子克隆结果 Fig. 1 Cloning of LcSAI gene promoter |

|
| M: Marker DL2000;1~15:菌液PCR结果 M: Marker DL2000; 1-15: PCR result of bacterial liquid 图 2 菌液PCR检测结果 Fig. 2 PCR detection of bacterial liquid |
2.2 LcSAI基因启动子转录起始位点预测结果
利用在线软件BDGP对LcSAI基因启动子的转录起始位点进行预测,LcSAI可能存在3处核心启动子区域,分别位于276~326、458~508、1 183~1 233 bp,分值分别为0.94、0.82和0.83,可能的转录起始位点分别为C、A、A(表 1)。根据结果可推测位于276~326 bp的序列很可能就是该基因真正的核心启动子区域,转录起始位点为位于第316 bp的C。
2.3 LcSAI基因启动子顺式作用元件预测结果
利用在线软件PlantCARE对LcSAI基因启动子顺式作用元件进行预测,结果(图 3)显示,LcSAI启动子序列除了存在大量的启动子核心元件如TATA-box和增强元件CAAT-box外,还存在多种特殊顺式元件,如光响应顺式元件、植物激素应答元件、MYB结合位点、MYC结合位点及一些未知功能元件。

|
| 图 3 LcSAI基因启动子序列及其关键元件 Fig. 3 Promoter sequence of LcSAI gene and its key elements |
由表 2可知,LcSAI启动子中含有35个TATA-box核心启动元件、38个CAAT-box增强元件,多种光响应元件和植物激素应答元件。光响应元件有5种,分别为3-AF1 binding site、ATCT-motif、Box 4、G-box和TCT-motif,其中G-box数量最多、有8个,ATCT-motif有4个,Box 4有2个,3-AF1 binding site和TCT-motif各1个。在植物激素响应元件中,LcSAI启动子含有茉莉酸甲酯响应元件CGTCA-motif和TGACGmotif各2个,赤霉素响应元件TATC-box和水杨酸响应元件TCA-element各1个,脱落酸响应元件ABRE有5个。
2.4 LcSAI基因启动子CpG岛预测结果
CpG岛作为表观调控的重要组成部分,在基因调控方面起重要作用。通过在线CpG岛预测软件CpG Island Searcher对LcSAI启动子序列进行CpG岛预测。预测结果显示,在LcSAI基因启动子区没有符合限定条件的CpG岛,这可能与获得的序列长度有关。
3 讨论可溶性酸性转化酶定位在植物体液泡中,催化蔗糖水解为己糖,在植物生长发育过程中发挥重要作用。以积累己糖为主的葡萄果实中,在果实发育全过程中酸性转化酶活力均维持较高水平[17]。基因表达水平是由基因上游的启动子顺式作用元件及转录因子共同调控。启动子中包括多种顺式作用元件,如上游启动子元件、核心启动子元件、特殊启动子元件、远端上游元件等。其中在植物逆境胁迫诱导基因表达起关键作用为特殊启动子元件[18]。本研究通过克隆妃子笑酸性转化酶LcSAI启动子,采用生物信息学方法对LcSAI启动子的转录起始位点、顺式作用元件及CpG岛进行在线预测,分析结果表明LcSAI启动子片段转录起始位点为在核心启动子区域第316 bp的C。LcSAI启动子区没有预测到符合限定条件的CpG岛,可能与获得序列长度不同有关。
对启动子结构和顺式元件的探索不仅有助于更好地调节单个或多个异源基因响应化学、生物以及环境因素刺激,而且为研究者改良作物提供了新思路,从而开启了设计启动子的新领域[19]。牛俊奇等[20]对甘蔗可溶性酸性转化酶基因及部分启动子进行克隆和序列分析发现,SoSAI1基因启动子在甘蔗生长发育和蔗糖积累并在应对环境胁迫中发挥作用。本研究表明,荔枝LcSAI启动子序列包含核心启动元件TATA-box 35个和CAAT-box 38个。其中核心启动元件TATA-box有介导基因转录的作用,普遍存在于真核生物启动子上,含有TATA-box的基因对转录调控比较敏感[21]。核心启动元件CAAT-box可增强启动子的强度,原因是因为CAAT-box对转录起始的频率具有一定影响。此外,妃子笑LcSAI的启动子中还包含多种特殊启动子元件,如光响应元件(3-AF1 binding site、ATCT-motif、Box 4、G-box、TCT-motif)和植物激素响应元件(ABRE脱落酸响应元件、CGTCA-motif、TGACG-motif茉莉酸甲酯响应元件、TATC-box赤霉素响应元件、TCAelement水杨酸响应元件)。后续将对植物激素应答元件与转录因子结合调控LcSAI基因的表达进行深入研究。
4 结论本研究以妃子笑荔枝为材料,克隆得到1 514 bp LcSAI启动子片段,LcSAI启动子片段转录起始位点可能存在3处核心启动子区域。根据得分,位于276~326 bp的序列很可能为LcSAI启动子真正的核心启动子区域,转录起始位点为位于第316 bp的C。LcSAI基因的启动子序列包括35个TATA-box、38个CAAT-box核心启动元件以及多种特殊启动子元件,如多种光响应元件和植物激素响应元件。LcSAI基因启动子共含有近30种顺式作用元件,意味着LcSAI具有复杂的表达调控机制,顺式作用元件与相应的反式作用因子相互作用发挥生物学功能。
| [1] |
YANG Z Y, WANG T D, WANG H C, HUANG X M, QIN Y H, HU G B. Patterns of enzyme activities and gene expressions in sucrose metabolism in relation to sugar accumulation and composition in the aril of Litchi chinensis Sonn[J]. Journal of Plant Physiology, 2013, 170(8): 731-740. DOI:10.1016/j.jplph.2012.12.021 |
| [2] |
陈杰忠. 常绿果树生殖生理及调控技术[M]. 北京: 中国农业出版社, 2011. CHEN J Z. Reproductive physiology and regulation of evergreen fruit trees[M]. Beijing: China agriculture Press, 2011. |
| [3] |
潘秋红, 张大鹏. 植物转化酶的种类, 特性与功能[J]. 植物生理学通讯, 2004, 40(3): 275-280. PAN Q H, ZHANG D P. Isoforms, characteristics and roles of plant invertase[J]. Plant Physiology Communications, 2004, 40(3): 275-280. |
| [4] |
STURM A. Invertases primary structures, functions, and roles in plant development and sucrose partitioning[J]. Plant Physiology, 1999, 121(1): 1-7. DOI:10.1104/pp.121.1.1 |
| [5] |
CHIKOV V I, AKHTYAMOVA G A, BATASHEVA S N, MIKHAILOV A L, Khamidullinaa L A, Timofeeva O A. Effect of silencing of the apoplastic invertase gene on photosynthesis in tomato[J]. Russian Journal of Plant Physiology, 2015, 62(1): 39-44. DOI:10.1134/s1021443715010045 |
| [6] |
ZHANG L, PAN Y, LV W, XIONG Z T. Physiological responses of biomass allocation, root architecture, and invertase activity to copper stress in young seedlings from two populations of Kummerowia stipulacea (Maxim.) Makino[J]. Ecotoxicology and Environmental Safety, 2014, 104: 278-284. DOI:10.1016/j.ecoenv.2014.03.013 |
| [7] |
KULSHRESTHA S, TYAGI P, SINDHI V, YADAVILLI K S. Invertase and its applications–a brief review[J]. Journal of Pharmacy Research, 2013, 7(9): 792-797. DOI:10.1016/j.jopr.2013.07.014 |
| [8] |
MISHRA B S, SINGH M, AGGRAWAL P, LAXM A. Glucose and auxin signaling interaction in controlling Arabidopsis thaliana seedlings root growth and development[J]. PloS One, 2009, 4(2): e4502.. DOI:10.1371/journal.pone.0004502 |
| [9] |
LU L, LIANG J, CHANG X, YANG H, LI T, HU J. Enhanced vacuolar invertase activity and capability for carbohydrate import in GA-treated inflorescence correlate with increased fruit set in grapevine[J]. Tree Genetics & Genomes, 2017, 13(1): 21. DOI:10.1007/s11295-017-1109-0 |
| [10] |
JIANG Y M, JIANG Q Y, HAO C Y, HOU J, WANG L F, ZHANG H N, ZHANG S N, CHEN X H, ZHANG X Y. A yield-associated gene TaCWI, in wheat: its function, selection and evolution in global breeding revealed by haplotype analysis[J]. Theoretical and Applied Genetics, 2015, 128(1): 131-143. DOI:10.1007/s00122-014-2417-5 |
| [11] |
FILS-LYCAON B, JULIANUS P, CHILLET M, GALAS C, HUBERT O, RINALDO D, Mbeguie-A-Mbeguie D. Acid invertase as a serious candidate to control the balance sucrose versus (glucose+ fructose) of banana fruit during ripening[J]. Scientia horticulturae, 2011, 129(2): 197-206. DOI:10.1016/j.scienta.2011.03.029 |
| [12] |
胡丽松, 吴刚, 郝朝运, 伍宝朵, 谭乐和. 菠萝蜜果实中糖分积累特征及相关代谢酶活性分析[J]. 果树学报, 2017, 34(2): 224-230. DOI:10.13925/j.cnki.gsxb.20160256 HU L S, WU G, HAO C Y, WU B D, TAN L H. Characterization of sugar accumulation and enzyme activities in jackfruit[J]. Journal of Fruit Science, 2017, 34(2): 224-230. DOI:10.13925/j.cnki.gsxb.20160256 |
| [13] |
段小强. 菠萝蜜果实糖代谢相关酶活性及其基因表达分析[D]. 湛江: 广东海洋大学, 2016. Duan X Q. Activity and gene expression analysis of sugar metabolismrelated enzymes in jackfruit fruit[D]. Zhangjiang: Guangdong Ocean University, 2016. |
| [14] |
NIU J Q, WANG A Q, HUANG J L, YANG L T, LI Y R. Isolation, characterization and promoter analysis of cell wall invertase gene SoCIN1 from sugarcane (Saccharum spp.)[J]. Sugar Tech, 2015, 17(1): 65-76. DOI:10.1007/s12355-014-0348-8 |
| [15] |
WANG H C, HUANG H B, HUANG X M, HU Z Q. Sugar and acid compositions in the arils of Litchi chinensis Sonn : cultivar differences and evidence for the absence of succinic acid[J]. The Journal of Horticultural Science and Biotechnology, 2006, 81(1): 57-62. DOI:10.1080/14620316.2006.11512029 |
| [16] |
王惠聪, 黄辉白, 黄旭明. 荔枝果实的糖积累与相关酶活性[J]. 园艺学报, 2003, 30(1): 1-5. DOI:10.16420/j.issn.0513-353x.2003.01.001 WANG H C, HUANG H B, HUANG X M. Sugar accumulation and related enzyme activities in the litchi fruit of 'Nuomici'and'Feizixiao'[J]. Acta Horticulturae Sinica, 2003, 30(1): 1-5. DOI:10.16420/j.issn.0513-353x.2003.01.001 |
| [17] |
DAVIES C, ROBINSON S P. Suger accumulation in grape berries: cloning of two putative vacuolar invertase cDNA and their expression in grapevine tissues[J]. Plant Physiology, 1996, 111: 275-283. DOI:10.1104/pp.111.1.275 |
| [18] |
张龙, 黄真池, 欧阳乐军, 朱苗, 陈信波, 曾富华. 植物人工启动子研究进展[J]. 广东农业科学, 2014, 41(6): 150-153. DOI:10.16768/j.issn.1004-874X.2014.06.004 ZHANG L, HUANG Z C, OUYANG L J, ZHU M, CHEN X B, ZENG F H.. Research progress of artificial promoter in plant[J]. Guangdong Agricultural Sciences, 2014, 41(6): 150-153. DOI:10.16768/j.issn.1004-874X.2014.06.004 |
| [19] |
郑晓瑜, 郭晋艳, 张毅, 李秋莉. 植物非生物胁迫诱导启动子顺式作用元件的研究方法[J]. 植物生理学报, 2011, 47(2): 129-135. DOI:10.13592/j.cnki.ppj.2011.02.003 ZHENG X Y, GUO J Y, ZHANG Y, LI Q L. Research methods of cisacting elements in plant abiotic stress inducible promoters[J]. Journal of Plant Physiology, 2011, 47(2): 129-135. DOI:10.13592/j.cnki.ppj.2011.02.003 |
| [20] |
牛俊奇, 王爱勤, 黄静丽, 朱惠, 李阳瑞, 杨丽涛. 甘蔗可溶性酸性转化酶(SoSAI1)基因的克隆及表达分析[J]. 中国农业科学, 2013, 46(24): 5248-5260. DOI:10.3864/j.issn.0578-1752.2013.24.019 NIU J Q, WANG A Q, HUANG J L, ZHU H, LI Y R, YANG L T. Cloning and expression analysis of a soluble acid invertase gene (SoSAI1) of sugarcane[J]. Scientia Agricultura Sinica, 2013, 46(24): 5248-5260. DOI:10.3864/j.issn.0578-1752.2013.24.019 |
| [21] |
王婧, 李冰, 刘翠翠, 朱阵, 张继瑜. 启动子结构和功能研究进展[J]. 生物技术通报, 2014, 4(8): 40-45. DOI:10.13560/j.cnki.biotech.bull.1985.2014.08.005 Wang J, Li B, Liu C C, Zhu Z, Zhang J Y.. dvances of the studies on structure and function of promoter[J]. Biotechnology Bulletin, 2014, 4(8): 40-45. DOI:10.13560/j.cnki.biotech.bull.1985.2014.08.005 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49